| |
| Med Sci (Paris). 35(6-7): 571–574. doi: 10.1051/medsci/2019111.Le microbiote intestinal, un modulateur clé de la
physiologie immunitaire Valentine Boutherin,1 Florence Piastra-Facon,1 and Emma Risson1 1École normale supérieure de Lyon, département de biologie,
Master biologie, Lyon, France |

Équipe pédagogique
Chloé Journo (maître de conférences, ENS de Lyon). Co-responsable de
l’UE microbiologie moléculaire et structurale. Équipe oncogenèse rétrovirale,
Centre international de recherche en infectiologie, Inserm U1111 - CNRS UMR5308,
École normale supérieure de Lyon, Lyon, France
Théodore Grenier (doctorant moniteur, ENS de Lyon). Équipe génomique
fonctionnelle des interactions hôte/bactéries, Institut de Génomique
Fonctionnelle de Lyon, Université de Lyon, École Normale Supérieure de Lyon,
CNRS UMR 5242, Université Claude Bernard Lyon 1, Lyon, France
Renaud Mahieux (professeur, ENS de Lyon). Co-responsable de l’UE
microbiologie moléculaire et structurale. Équipe oncogenèse rétrovirale, Centre
international de recherche en infectiologie, Inserm U1111 - CNRS UMR5308, École
normale supérieure de Lyon, Lyon, France
chloe.journo@ens-lyon.fr
L’existence des microbes, responsables des maladies et épidémies, a été démontrée au
cours du XIXe siècle par Louis Pasteur. Les microorganismes ont alors été
considérés comme pathogènes. Pourtant, on sait aujourd’hui que chaque être humain
cohabite avec près de 1014 bactéries [1]. Le microbiote, cet ensemble de bactéries, champignons, virus et
autres microorganismes, peuple les surfaces du corps en contact avec le milieu extérieur
telles que l’intestin, la peau ou le vagin. La majorité des bactéries constituant le microbiote est acquise à la naissance, lorsque
le nouveau-né entre en contact avec le microbiote vaginal de sa mère. Des études ont
toutefois suggéré que des bactéries pourraient être acquises plus tôt, au cours du
développement embryonnaire [2,
3]. Ces études ont en effet
montré que le placenta n’est pas stérile : il existerait un microbiote placentaire,
proche du microbiote oral maternel. La communauté scientifique est cependant encore
divisée quant à la signification biologique de ce microbiote placentaire, qui serait
important pour le maintien de la grossesse jusqu’à son terme. La composition du microbiote évolue ensuite tout au long de la vie, de manière tant
quantitative que qualitative, sous l’influence de nombreux facteurs tels que
l’alimentation, le mode de vie, l’hygiène et l’environnement. Le microbiote bactérien est très important au cours des premiers mois de la vie. L’effet
de la prise d’antibiotiques par la mère au cours de la grossesse ou de l’allaitement sur
la santé du nourrisson en est une indication. Une étude réalisée sur des souris a par
exemple démontré que lorsque l’on administre des antibiotiques à des souris au cours de
la gestation et de la lactation, les nouveau-nés présentent une réponse immunitaire
antivirale moins efficace [4]. La
diversité du microbiote bactérien maternel, et donc du microbiote bactérien acquis à la
naissance, impacte ainsi la physiologie immunitaire. Nous nous concentrerons dans cette introduction sur l’exemple de la muqueuse intestinale,
à laquelle est associé le microbiote le plus diversifié et le mieux étudié à ce jour. Si
le rôle essentiel du microbiote bactérien intestinal au cours de la digestion n’est plus
à démontrer, on découvre en effet depuis une dizaine d’années son importance dans la
régulation de l’immunité mucosale. Nous décrirons ici les principaux mécanismes de
l’immunité de la muqueuse intestinale avant de présenter les interactions qu’elle
entretient avec différentes composantes du microbiote [7] (→).
(→) Voir la Synthèse de V. Gaboriau-Routhiau et N. Cerf-Bensussan,
m/s n° 11, novembre 2016, page 961
|
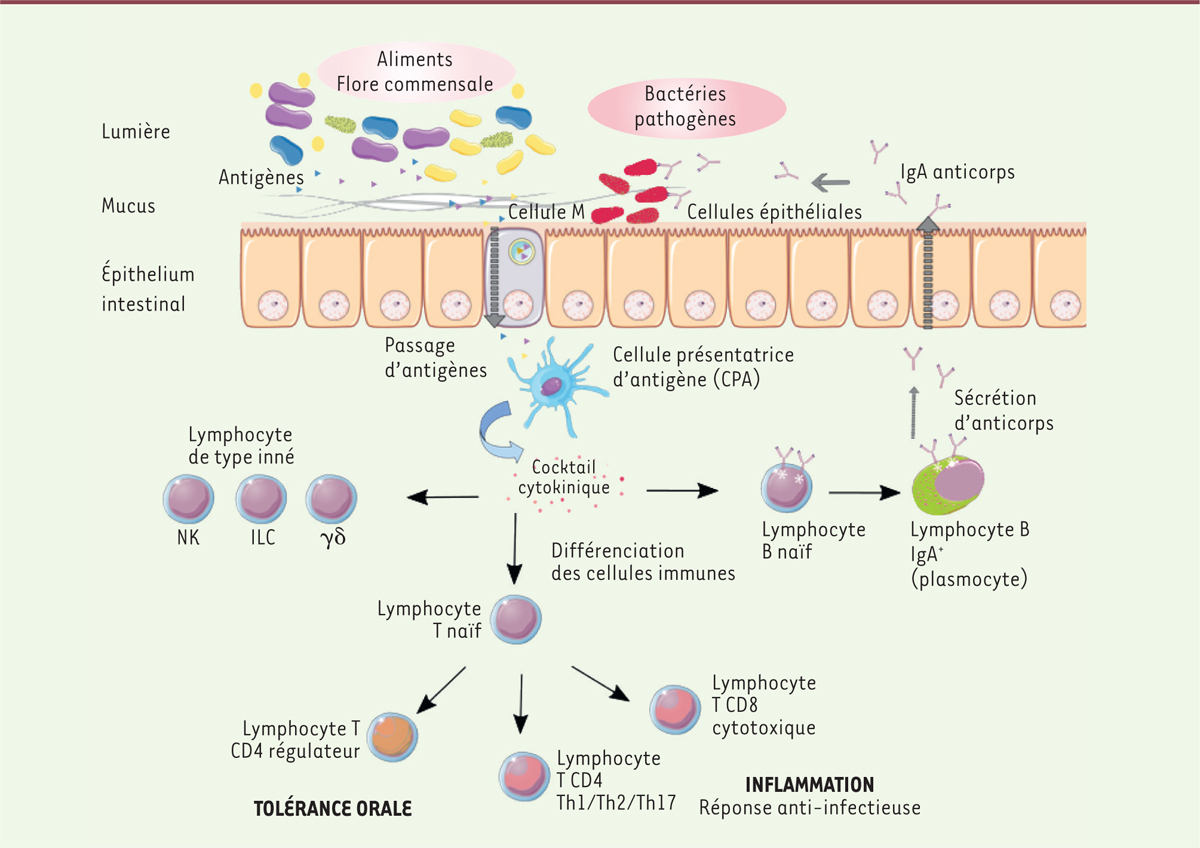
L’immunité mucosale de l’intestin met en jeu différents acteurs cellulaires
permettant le maintien de l’homéostasie Comme l’illustre la Nouvelle de ce dossier intitulée « Les bactériophages,
alliés de l’épithélium intestinal contre les bactéries pathogènes »
(→), le mucus produit par l’épithélium intestinal représente une
barrière physique contre les pathogènes. Il recouvre l’épithélium intestinal,
composé principalement de cellules épithéliales permettant l’absorption des
nutriments. Ces dernières reconnaissent des motifs particuliers propres aux
microorganismes via leurs différents récepteurs PRR de l’immunité
innée (pattern recognition receptors). L’épithélium comprend
également des cellules particulières, les cellules M, capables de collecter les
antigènes présents dans le lumen et de les transporter vers les cellules
présentatrices d’antigènes (cellules dendritiques, macrophages et lymphocytes B)
présentes dans la lamina propria (c’est-à-dire le tissu conjonctif
sous-jacent à l’épithélium intestinal). Ces cellules présentatrices d’antigènes sont
responsables de l’activation des lymphocytes T au cours de la réponse adaptative
(Figure 1). Des
lymphocytes de type inné, regroupant les cellules lymphoïdes de type inné
(innate lymphoid cells, ILC), les lymphocytes T natural
killer (NKT) et les lymphocytes T γδ s’activent également.
>(→) Voir page 581 de ce numéro
 | Figure 1. L’immunité mucosale intestinale, un fin équilibre entre tolérance et
inflammation. |
En réponse aux signaux des cellules de l’immunité innée, la réponse adaptative
s’active ensuite. La différenciation des cellules du système adaptatif en cellules
effectrices est conditionnée par un cocktail de cytokines et de molécules de
surface. Le mode d’infection ainsi que la nature du pathogène déterminent les
sous-populations de lymphocytes T et B qui sont mises en jeu. Les lymphocytes B se
différencient en plasmocytes, sécrétant des anticorps. Dans les muqueuses, c’est
principalement une réponse anticorps de type IgA qui se met en place. Les anticorps
IgA passent en effet la barrière épithéliale et peuvent se lier à des
microorganismes présents dans le lumen, ce qui limite la colonisation de
l’épithélium intestinal et facilite leur élimination. Parmi les lymphocytes T effecteurs, on distingue les lymphocytes T CD4+
auxiliaires, qui recrutent et activent d’autres leucocytes, des lymphocytes T
CD8+ cytotoxiques, qui éliminent les cellules infectées. Les
lymphocytes T auxiliaires sont eux-mêmes classés en plusieurs sous-populations dont
les lymphocytes Th17, qui protègent contre les pathogènes extracellulaires et qui
jouent un rôle central dans l’immunité mucosale en stimulant la réponse
inflammatoire. Le système immunitaire joue un rôle ambivalent dans l’intestin : il protège
l’organisme des pathogènes ingérés par voie orale, tout en tolérant les nutriments
issus de l’alimentation ainsi que l’ensemble de microorganismes constituant le
microbiote intestinal. Selon le type de bactérie détectée et sa localisation, le
système immunitaire n’est pas activé de la même manière. Ainsi, les bactéries
commensales sont généralement cantonnées à la lumière intestinale, alors que la
plupart des bactéries pathogènes traversent le mucus et adhèrent à l’épithélium
intestinal, voire envahissent le tissu, générant des signaux distincts perçus par le
système immunitaire. Les bactéries commensales ne sont toutefois pas invisibles pour
le système immunitaire : elles participent de façon active à la stimulation de
l’immunité mucosale. |
Les bactéries du microbiote intestinal induisent une inflammation constitutive à
bas bruit qui stimule l’immunité des muqueuses Par rapport aux souris conventionnelles, les souris traitées aux antibiotiques et les
souris axéniques (c’est-à-dire dépourvues de microbiote bactérien) présentent des
anomalies de l’architecture intestinale et de la composition en cellules
immunitaires de la lamina propria et des ganglions mésentériques :
villosités plus fines et cryptes plus étroites, population de lymphocytes T réduite
(à la fois CD4+ et CD8+) et population de cellules lymphoïdes
innées de type 2 (ILC2) accrue, entre autres. Les bactéries commensales de
l’intestin participent en effet à l’éducation du système immunitaire : elles
permettent la différenciation de certaines populations immunitaires et l’activation
d’un programme inflammatoire et antimicrobien permettant de résister aux pathogènes
intestinaux [5]. Bien que
séparées par le mucus et l’épithélium intestinal, les bactéries commensales et les
cellules du système immunitaire communiquent. La plupart des bactéries commensales
sécrètent des métabolites tels que des acides gras à chaîne courte, qui diffusent
dans le mucus. Ces métabolites sont transmis, via les cellules M,
aux cellules immunitaires sous-jacentes, et orchestrent leur différenciation. En
outre, certaines bactéries commensales adhèrent aux cellules épithéliales de manière
physiologique. C’est le cas des bactéries filamenteuses segmentées (BFS) qui
déclenchent une réponse Th17 physiologique permettant l’éducation du système
immunitaire. La Nouvelle de ce dossier intitulée « L’adhérence de
microorganismes aux cellules intestinales induit une réponse immunitaire de type
Th17» (→) illustre ce lien entre adhérence bactérienne et
immunité.
(→) Voir page 575 de ce numéro
|
Les animaux axéniques et gnotobiotiques
L’élevage d’animaux axéniques et gnotobiotiques représente une innovation
majeure dans l’étude des microbiotes bactériens. À la différence d’un animal
conventionnel qui acquiert son microbiote bactérien naturellement, sans que
les chercheurs puissent contrôler cette acquisition, un animal gnotobiotique
est un animal dont le microbiote est connu et contrôlé. Un animal axénique
est, lui, dépourvu de microbiote. Maintenir un animal axénique en
laboratoire exige deux conditions. L’animal doit tout d’abord commencer sa
vie en condition axénique, c’est-à-dire être dépourvu de tout microorganisme
à la naissance. Les souris axéniques, par exemple, sont obtenues en
prélevant les jeunes dans l’utérus (afin d’éviter une contamination par le
microbiote de leur mère à la naissance) et en les transférant stérilement
dans des incubateurs. Ensuite, l’animal ne doit jamais être exposé à des
sources de contamination microbienne. Les souris axéniques sont élevées dans
des incubateurs stériles et nourries avec des aliments pasteurisés. Les animaux axéniques sont utiles pour observer les conséquences d’une
absence de microbiote. On peut, par ailleurs, obtenir des animaux
gnotobiotiques en associant des animaux axéniques avec la communauté
microbienne que l’on souhaite étudier. Il peut s’agir d’une unique souche
microbienne (on parle alors de mono-association) ou d’une communauté plus
complexe (on parle alors de poly-association). La souris est le modèle animal gnotobiotique le plus utilisé, mais de
nombreux laboratoires travaillent sur d’autres modèles gnotobiotiques comme
le rat, la drosophile, le moustique ou encore le cochon.
|
|
À la découverte de la flore intestinale virale Si les recherches sur le microbiote se sont jusqu’à présent essentiellement
concentrées sur sa composante bactérienne, de nouvelles études explorent la
diversité et les fonctions du virobiote, c’est-à-dire l’ensemble des virus présents
dans l’organisme. L’identification des séquences virales associées au virobiote,
regroupées sous le terme de virome, a longtemps constitué un défi technique du fait
de la petite taille des génomes viraux et de leur incroyable diversité (génomes à
ADN ou à ARN, simple ou double brin). De plus, les génomes viraux ne partagent pas
de séquences nucléiques consensus permettant de séquencer les virus encore non
recensés, comme c’est, par exemple, le cas des gènes codant les ARN ribosomaux
bactériens. Le perfectionnement des nouvelles techniques de séquençage à haut débit
(NGS, next generation sequencing) a répondu à ce défi : on peut en
effet aujourd’hui séquencer les métagénomes sans avoir de connaissances a
priori sur la nature des génomes amplifiés. Ces avancées ont été
déterminantes dans l’identification de la composante virale du microbiote, en
particulier dans l’intestin. Celle-ci comprend les virus pouvant infecter les
cellules de l’hôte, ainsi que les bactériophages (aussi appelés phages) infectant
les bactéries commensales. La Nouvelle intitulée « Les bactériophages,
alliés de l’épithélium intestinal contre les bactéries pathogènes »
(→) traite de l’importance de ces bactériophages dans la
physiologie de l’épithélium intestinal.
(→) Voir page 581 de ce numéro
Plusieurs études ont mis en évidence le fait que le virobiote serait contrôlé par le
système immunitaire, comme c’est le cas pour le microbiote bactérien. Par exemple,
une expansion anormale du virobiote intestinal est observée chez des singes atteints
d’une immunodéficience acquise [6]. Existe-t-il en retour, de façon analogue au microbiote bactérien, un
effet bénéfique du virobiote sur l’immunité de l’hôte ? Cette question est explorée
dans les Nouvelles « Le virobiote intestinal, nouvelle composante des
interactions entre le microbiote et le système immunitaire »
(→) et « Les bactériophages, alliés de l’épithélium
intestinal contre les bactéries pathogènes » de ce dossier au travers
d’exemples de virus intestinaux (→).
(→) Voir page 578 de ce numéro
(→) Voir page 581 de ce numéro
Enfin, comme l’illustrent les deux Nouvelles « La bactérie Wolbachia bloque
l’infection des moustiques par différents pathogènes humains »
(→) et « Une plante, une chenille, une guêpe et des
microorganismes symbiotiques : des interactions multitrophiques emboîtées
» (→) dans ce dossier, l’impact du microbiote sur la
physiologie de l’hôte n’est pas restreinte aux seuls mammifères mais s’applique
également aux insectes.
(→) Voir page 586 de ce numéro
(→) Voir page 584 de ce numéro
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
1. Sender
R,
Fuchs
S,
Milo
R. Revised estimates
for the number of human and bacteria cells in the body .
PLoS Biol.
2016; ; 14 :
:e1002533.. 2. Fardini
Y,
Chung
P,
Dumm
R, et al.
Transmission of diverse oral bacteria to murine placenta:
evidence for the oral microbiome as a potential source of intrauterine
infection . Infect Immun.
2010; ; 78 :
:1789.–1796. 3. Stout
MJ,
Conlon
B,
Landeau
M, et al.
Identification of intracellular bacteria in the basal plate
of the human placenta in term and preterm gestations .
Am J Obstet Gynecol.
2013;; 208 : :226.e1-7..
4. Gonzalez-Perez
G,
Hicks
AL,
Tekieli
TM, et al.
Maternal antibiotic treatment impacts development of the neonatal
intestinal microbiome and antiviral immunity . J
Immunol.
2016; ; 196 :
:3768.–3779. 5. Pedicord
VA,
Mucida
D. A sledgehammer
breaks glass but forges steel: bacteria adhesion shapes gut
immunity . Cell.
2015; ; 163 :
:273.–274. 6. Handley
SA,
Thackray
LB,
Zhao
G, et al.
Pathogenic simian immunodeficiency virus infection is associated
with expansion of the enteric virome . Cell.
2012; ; 151 :
:253.–266. 7. Gaboriau-Routhiau
V,
Cerf-Bensussan
N. Microbiote
intestinal et développement du système immunitaire .
Med Sci (Paris).
2016; ; 32 :
:961.–967. |