Les bactéries filamenteuses segmentées (BFS) sont des bactéries commensales qui adhèrent à l’épithélium intestinal et qui sont particulièrement étudiées pour leur rôle dans le développement et l’éducation du système immunitaire. En effet, elles déclenchent une réponse immune de type Th17 qui confère une résistance de l’intestin à la colonisation par des entéropathogènes tels que certaines souches d’Escherichia coli ou de Salmonella enterica [1]. La réponse Th17 intestinale ainsi induite a également des effets systémiques : elle permet de limiter la colonisation de l’épithélium pulmonaire par des bactéries pathogènes et diminue les risques d’auto-immunité (diabète, arthrite et encéphalomyélite) [1]. D’autre part, les BFS participent à l’homéostasie du microbiote intestinal en induisant un remodelage du glycocalyx épithélial, ce qui stimule le métabolisme de certaines espèces commensales comme les Bacteroides, composantes majeures du microbiote humain [1].
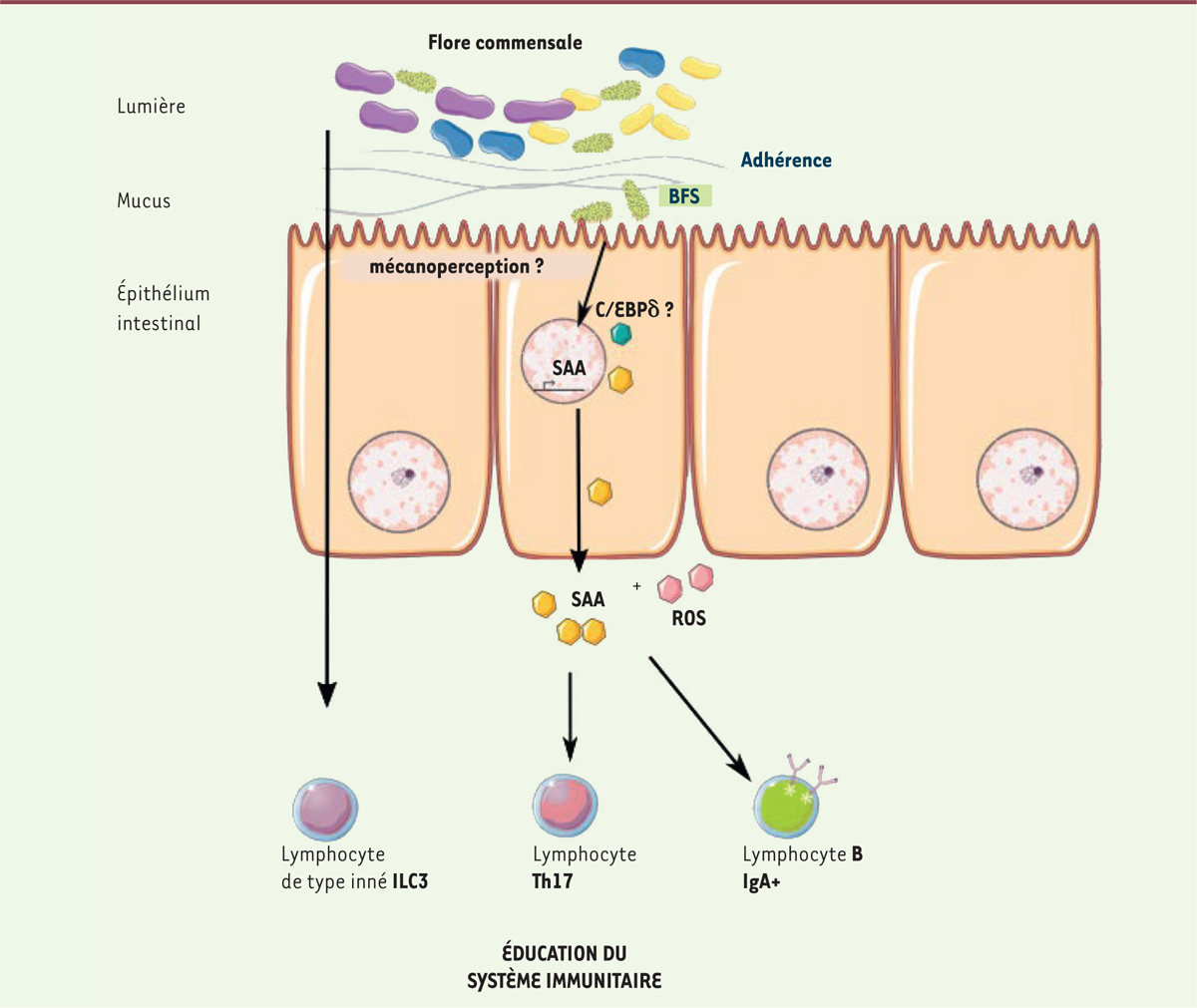
Le passage d’antigènes de BFS à travers l’épithélium intestinal ne suffit pas à déclencher la réponse Th17 décrite plus haut. En 2009, Ivanov et al. ont montré que l’adhérence des BFS aux cellules épithéliales contribuait à induire cette réponse [2]. Plus récemment, les travaux d’Atarashi et al. ont permis de mieux comprendre les mécanismes moléculaires faisant le lien entre l’adhérence bactérienne et l’induction de l’immunité intestinale [3]. Pour cela, les auteurs ont exploité le fait que l’adhérence des BFS à l’épithélium intestinal est spécifique de l’hôte. En effet, des BFS issues de souris (M-BFS) adhèrent à l’épithélium intestinal de souris mais non de rat, et inversement pour les BFS issues de rat (R-BFS). Les auteurs ont donc colonisé des souris axéniques, dépourvues de microbiote bactérien et caractérisées par une population de lymphocytes Th17 très réduite dans la muqueuse intestinale, par des M-BFS ou des R-BFS. Les auteurs ont constaté que seules les M-BFS restaurent une population de lymphocytes Th17 normale. De plus, des immunoglobulines d’isotype A (IgA) sont détectées en quantité plus importante dans les matières fécales des souris colonisées par des M-BFS. Ainsi, l’adhérence des BFS est nécessaire pour l’induction de la réponse Th17 mais aussi pour la mise en place de la réponse IgA.
Pour tester la spécificité antigénique des lymphocytes Th17 différenciés lors de la colonisation bactérienne par les BFS adhérentes ou non, les auteurs ont isolé les lymphocytes de souris colonisées à la fois par des M-BFS et des R-BFS. Les auteurs ont ensuite stimulé ex vivo les cellules isolées de la lamina propria du petit intestin des souris colonisées, incluant des lymphocytes T et des cellules présentatrices d’antigènes (CPA), avec des fragments antigéniques de M-BFS ou de R-BFS. Seuls les antigènes issus des M-BFS induisent une réactivation d’une sous-population de lymphocytes Th17 différenciés lors de la colonisation. Une réponse spécifique des lymphocytes Th17 aux antigènes issus des R-BFS n’a pas été détectée dans ces expériences. Ces résultats suggèrent que les antigènes issus des M-BFS adhérentes sont plus efficacement pris en charge et présentés par les CPA au cours de la colonisation que les antigènes issus des R-BFS non adhérentes.
Pour comprendre les mécanismes sous-jacents à la mise en place d’une réponse Th17, les auteurs ont ensuite étudié l’effet direct de l’adhérence bactérienne sur les cellules épithéliales. Par analyse transcriptomique (RNA-seq), ils ont observé qu’un certain nombre de gènes étaient différentiellement exprimés dans les cellules épithéliales auxquelles les M-BFS avaient adhéré, en comparaison de celles issues de souris colonisées avec R-BFS ou de souris axéniques. Ils se sont intéressés aux gènes plus fortement exprimés lors de la colonisation par les M-BFS. Parmi ceux-ci, les auteurs ont identifié le gène codant la protéine sérum amyloïde A (SAA). In vitro, en présence de CPA et des cytokines IL(interleukine)-6 et TGF(transforming growth factor)-β, SAA induit la différenciation de lymphocytes T CD4+ naïfs issus de la rate en lymphocytes Th17. Ainsi, SAA pourrait être un facteur sécrété par les cellules épithéliales en réponse à l’adhérence des BFS, participant à la mise en place de la réponse Th17. L’analyse du transcriptome a également permis d’observer l’augmentation de l’expression du gène codant le facteur de transcription C/EBPδ, régulateur de l’expression de SAA, lors de l’adhérence des M-BFS aux cellules épithéliales. Ainsi, l’adhérence des BFS à l’épithélium intestinal provoque une augmentation de l’expression du facteur C/EBPδ, ce dernier activant ensuite la transcription de SAA. L’augmentation de l’expression de SAA et de C/EBPδ induite in vitro dans une lignée de cellules épithéliales du petit intestin suite à l’adhérence de M-BFS est augmentée en présence de latrunculine, une drogue induisant une dépolymérisation des filaments d’actine. Ceci suggère que l’adhérence bactérienne induit probablement une désorganisation du réseau d’actine qui, par l’intermédiaire d’une signalisation activant des facteurs de transcription tels que C/EBPδ, active la transcription de SAA.
Parmi les gènes plus fortement exprimés dans les cellules épithéliales auxquelles les M-BFS ont adhéré, les auteurs ont également identifié le gène codant Duox2, responsable de la génération de dérivés réactifs de l’oxygène (ROS). Des souris colonisées par des M-BFS et traitées par un inhibiteur de la production de ROS ont significativement moins de lymphocytes Th17 que les souris témoins. Ce résultat indique que la production de ROS par les cellules épithéliales participe à l’activation de la réponse Th17.
On aurait ainsi un exemple de mécano-perception de l’adhérence bactérienne par les cellules épithéliales permettant, par le remodelage du cytosquelette d’actine et la production de SAA et de ROS, l’activation du système immunitaire vers la voie Th17 (Figure 1).
Après avoir mieux caractérisé l’induction de la réponse Th17 par l’adhérence des BFS à l’épithélium intestinal, les auteurs ont cherché à étendre ces observations à des bactéries et champignons pathogènes. Tout d’abord, des souris axéniques ont été inoculées avec Citrobacter rodentium, une bactérie entéropathogène connue pour induire des réponses Th17 délétères chez la souris. Deux souches de C. rodentium ont été utilisées : une souche sauvage et une souche mutée n’exprimant pas le gène eae codant l’intimine, une protéine bactérienne essentielle à l’adhérence aux cellules épithéliales. La souche mutée induit une réponse Th17 beaucoup plus faible que la souche sauvage. Ainsi, c’est aussi via l’adhérence aux cellules épithéliales que ce pathogène induit une réponse Th17 exacerbée. Des résultats équivalents ont été obtenus avec une souche entérohémorragique d’Escherichia coli ainsi qu’avec la levure Candida albicans, montrant que ce mécanisme d’induction d’une réponse Th17 par adhérence aux cellules épithéliales n’est pas uniquement propre aux bactéries commensales, mais existe également chez des bactéries pathogènes et des levures.
Les cellules lymphoïdes innées de type 3 (ILC3) sont fonctionnellement proches des lymphocytes Th17, mais possèdent des caractéristiques propres au système immunitaire inné (activation plus rapide, absence de récepteurs spécifiques d’un antigène). À la différence des lymphocytes Th17, les ILC3 sont activées lors de la colonisation de souris axéniques par des M-BFS mais également par des R-BFS. Des résultats similaires ont été obtenus avec C. rodentium. L’activation des ILC3 ne nécessite donc pas l’adhérence des bactéries aux cellules épithéliales. Ainsi, toutes les composantes de la réponse immunitaire de type inflammatoire ne sont pas nécessairement induites par l’adhérence des microorganismes à l’épithélium.
Les auteurs ont enfin cherché à savoir si ces résultats s’appliquaient également à des souches bactériennes commensales de l’espèce humaine. L’inoculation d’échantillons de matière fécale humaine à des souris axéniques, qui permet de reproduire un microbiote humain au sein de l’intestin des souris, induit une réponse Th17. Vingt souches bactériennes appartenant à divers taxons tels que Clostridium, Bifidobacterium, Rhuminococcus et Bacteroides, sont associées à l’induction d’une forte réponse Th17. Les auteurs ont observé par microscopie électronique à balayage que les bactéries du microbiote humain induisant une réponse Th17 adhèrent, comme les BFS, aux cellules épithéliales.
Cette activation du système immunitaire repose ainsi sur un contact physique entre les microorganismes et les cellules épithéliales de l’intestin et le passage d’antigènes microbiens à travers l’épithélium. Les protéines de surface de ces bactéries interagissent avec celles de la surface des cellules épithéliales, par une interaction de type ligand-récepteur spécifique [4]. À titre d’exemple, la protéine transmembranaire invasine de la bactérie Yersinia se lie aux récepteurs intégrines β1 de la cellule ciblée.
Ainsi, les cellules épithéliales intestinales sont à la fois une barrière à l’invasion bactérienne et une interface à l’origine d’un signal transmis au système immunitaire. Cette interaction physique entre certaines souches bactériennes du microbiote et leur hôte, qui se met en place de façon spécifique, pourrait illustrer le processus de coévolution qui façonne les relations symbiotiques entre le microbiote et son hôte.