| |
| Med Sci (Paris). 35(6-7): 578–580. doi: 10.1051/medsci/2019113.Le virobiote intestinal, nouvelle composante des
interactions entre le microbiote et le système immunitaire Caroline Henrot1 and Maria Kuksin1 1École normale supérieure de Lyon, département de biologie,
Master biologie, Lyon, France MeSH keywords: Animaux, Antibactériens, Tumeurs colorectales, Entérite, Transplantation de microbiote fécal, Microbiome gastro-intestinal, Humains, Système immunitaire, Intestins, Souris, Norovirus, Probiotiques, administration et posologie, étiologie, virologie, induit chimiquement, immunologie, effets des médicaments et substances chimiques, pathogénicité |
Si les effets bénéfiques des bactéries du microbiote intestinal sur l’hôte ont été bien
démontrés, ceux du microbiote viral, ou virobiote, commencent tout juste à être étudiés.
La souris peut constituer un bon modèle pour l’étude fonctionnelle du virobiote. En
effet, les virus entériques murins partagent des similarités avec les virus humains. En
particulier, le norovirus murin (MNV, murine norovirus) est souvent
retrouvé dans le virobiote intestinal de la souris. Les norovirus sont des virus
intestinaux à ARN positif simple brin, de la famille des Caliciviridae,
et sont la principale cause des gastro-entérites virales chez l’homme. Chez les souris
immunocompétentes, le MNV n’est pas pathogène. Cependant, dans certaines lignées de
souris portant une mutation dans un gène de susceptibilité aux maladies inflammatoires
chroniques de l’intestin (MICI), ce virus commensal peut déclencher la maladie de Crohn
[1]. Ce comportement
ambivalent a déjà été décrit pour certaines bactéries du microbiote, associées au
développement de MICI sous l’influence de facteurs génétiques [2]. Ces données posent la question de
caractéristiques partagées entre le MNV et certaines bactéries du microbiote intestinal,
notamment en termes d’effets sur le système immunitaire de l’hôte. |
L’infection par le MNV restaure la structure intestinale et l’activité
immuno-physiologique des souris privées de microbiote bactérien L’équipe de Ken Cadwell, de la New York University School of
Medicine, s’est intéressée au rôle du MNV dans l’intestin en absence de
microbiote bactérien [3].
Pour cela, les chercheurs ont utilisé des souris axéniques et des souris traitées
aux antibiotiques, qui présentent des anomalies dans la structure de la muqueuse
intestinale, avec des villosités fines et cryptes étroites, ainsi que des
différences de certaines populations de cellules immunitaires (→).
(→) Voir page 572 de ce numéro
Ces souris ont été colonisées de façon artificielle par la souche MNV.CR6 : des
couples parentaux ont été infectés oralement, permettant au virus de coloniser
l’intestin et de se transmettre verticalement à la génération suivante, comme c’est
le cas pour la transmission du microbiote bactérien. Étonnamment, l’architecture
intestinale, ainsi que les populations de lymphocytes T et de cellules innées
lymphoïdes (ILC pour innate lymphoid cells) de type 2 ont été
restaurées par cette infection. Ainsi, un virus intestinal semble suffisant pour
modifier l’architecture tissulaire et les populations immunitaires, indiquant que le
virobiote pourrait avoir un effet bénéfique sur l’homéostasie intestinale, de façon
similaire au microbiote bactérien. Il est particulièrement intéressant de remarquer
qu’ici, l’infection par une unique souche virale compense certaines anomalies
causées par l’absence de très nombreuses espèces de bactéries. Les auteurs ont alors réalisé des expériences de séquençage des ARN issus de cellules
intestinales. Ils ont montré que le transcriptome des cellules intestinales est
similaire pour les souris avec un microbiote bactérien et celles infectées par la
souche virale MNV.CR6. Le même profil d’expression de gènes a été observé, en
particulier pour des gènes régulant le développement du système immunitaire. Ceci
corrobore l’idée que le virobiote et les bactéries commensales intestinales exercent
des effets similaires sur le système immunitaire de l’hôte. Le MNV.CR6 induit
également l’expression de gènes impliqués dans la réponse antivirale et en
particulier dans la réponse interféron de type I (IFN-I), tels que
IFIG-1. Il faut de plus souligner que la compensation des
anomalies intestinales induite par le MNV n’est pas observée chez des souris
déficientes pour le récepteur des IFN-I (souris Ifnar1-/-
), indiquant que les effets observés en présence du MNV.CR6 sont dépendants
de cette réponse antivirale IFN-I. |
L’infection par le MNV protège des inflammations intestinales Suite à une inflammation intestinale induite chimiquement par l’équipe de Ken
Cadwell, les souris traitées par des antibiotiques présentent un taux de survie plus
faible que les souris témoins. Ainsi, la détérioration du microbiote intestinal
bactérien, causée par le traitement antibiotique, rend les souris plus vulnérables à
l’inflammation. Les auteurs ont observé que l’infection par le MNV.CR6 réduit les
effets délétères du traitement antibiotique, indiquant que le MNV.CR6 pourrait avoir
un rôle protecteur vis-à-vis de l’inflammation chez ces souris. En outre, chez des
souris préalablement soumises à des antibiotiques, l’infection par MNV.CR6 diminue
les conséquences de l’infection par la bactérie entéropathogène Citrobacter
rodentium, sans pour autant réduire la charge bactérienne. L’infection
par MNV.CR6 réduit également la production de facteurs de virulence par C.
rodentium, probablement en induisant la stimulation d’une réponse
immunitaire antibactérienne. Ces résultats montrent qu’un virus peut avoir un effet
protecteur contre des agents inflammatoires chimiques ou bactériens, chez des souris
traitées par des antibiotiques et possédant une flore bactérienne diminuée. Ainsi, ces travaux suggèrent que de façon similaire au microbiote bactérien, le
virobiote intestinal pourrait stimuler le système immunitaire de l’hôte, lui
permettant de mieux se défendre contre des agents infectieux ou non-infectieux
(Figure 1). Le
virobiote et le microbiote bactériens pourraient donc agir de façon étroitement liée
et avoir des effets en partie redondants. Cela souligne la nécessité d’étudier plus
en profondeur le rôle du virobiote sur la physiologie de l’hôte et ses interactions
avec le microbiote bactérien.
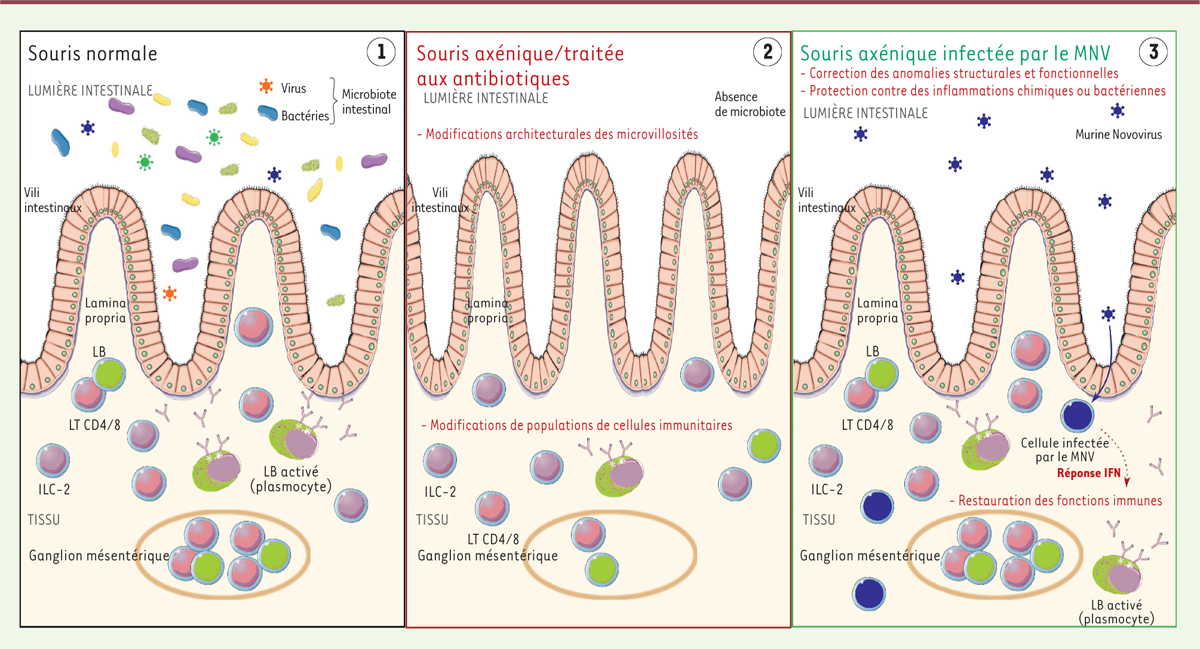
 | Figure 1. L’infection par le MNV corrige les anomalies intestinales des souris
dépourvues de microbiote bactérien. 1.
Intestin de souris saines, présentant un microbiote composé de bactéries
et de virus. 2. Intestin de souris
dépourvues de microbiote. On observe des vili anormalement fins, ainsi
qu’une déplétion des lymphocytes T et un taux anormalement élevé de
cellules lymphoïdes ILC-2, au niveau de la lamina
propria et des ganglions mésentériques. Ces souris sont
également plus vulnérables à l’inflammation.
3. L’infection par le MNV permet de
restaurer la structure normale de la muqueuse ainsi que les fonctions
immunes. La réponse antivirale de l’hôte (réponse interféron de type I,
IFN), stimulée par le virus, serait un médiateur important de cet effet.
L’infection par le MNV permet également de protéger les souris de
l’inflammation induite par des agents chimiques ou bactériens. |
|
Vers la manipulation du virobiote en santé humaine ? Ces observations ouvrent de nouvelles perspectives en santé humaine. La redondance
entre les microbiotes bactérien et viral pourrait être particulièrement intéressante
dans le contexte de la prise d’antibiotiques : les antibiotiques ont des effets
délétères sur les populations bactériennes du microbiote, ce qui représente un effet
secondaire néfaste important de ces traitements. Afin de restaurer la flore
bactérienne, il est courant d’avoir alors recours à des probiotiques (des bactéries
ou levures, aux effets bénéfiques pour la santé, notamment en cas de dysbiose) ou à
des prébiotiques (des fibres alimentaires indigestes qui vont stimuler la croissance
de certaines bactéries intestinales de types probiotiques). Certains virus
pourraient-ils également permettre de compenser cette dysbiose bactérienne induite
suite à un traitement antibiotique ? Il serait donc pertinent de déterminer s’il est
possible de transposer à l’homme les résultats obtenus chez la souris avec le MNV.
Cependant, l’étude du virome humain est très complexe, de par la grande diversité de
ses populations virales, et du fait que la plupart des séquences virales trouvées
dans le corps humain n’ont pas d’homologues dans les bases de données. Ce champ de
recherche est en plein développement, grâce aux nouvelles techniques de séquençage
et aux progrès de la bioinformatique pour l’analyse des métagénomes [4]. Par ailleurs, la transplantation de microbiote fécal est déjà utilisée en santé
humaine pour soigner certaines inflammations intestinales dues à l’infection par
Clostridium difficile et sont à l’étude pour d’autres
pathologies [5]. Les travaux
de Kernbauer et al. indiquent qu’il est possible qu’une partie des
effets bénéfiques de la transplantation soit due aux virus transplantés, et pas
seulement aux bactéries. À l’inverse, certains virus introduits au cours de la
transplantation pourraient avoir des effets négatifs sur la physiologie des
patients. Une meilleure compréhension de la composition du virobiote et de ses
propriétés fonctionnelles est donc primordiale pour optimiser cette stratégie
thérapeutique. Une altération particulière du virome intestinal a récemment été identifiée dans le
cas de cancers colorectaux [6, 7]. Ces travaux
suggèrent que le virobiote intestinal, et en particulier les populations de
bactériophages, pourraient indirectement contribuer au développement de la
pathologie, en modulant les populations bactériennes résidant dans l’intestin.
L’analyse du virome pourrait donc être intéressante dans le diagnostic et le
pronostic de de ces cancers. De la même manière que l’on parle de dysbiose
bactérienne, on peut alors introduire la notion de « dysbiose virale », qui pourrait
être un marqueur de certaines pathologies de la muqueuse intestinale [8]. Les effets du virobiote
intestinal pourraient d’ailleurs s’élargir au-delà de l’intestin. En effet, une
étude récente montre par exemple que des modifications de la composition du virome
intestinal précédent le déclenchement du diabète de type I, dans une cohorte
d’enfants susceptibles de développer la maladie [9]. L’ensemble de ces observations suggère donc
que le virobiote intestinal pourrait contribuer à l’homéostasie de l’intestin et de
l’organisme entier. La compréhension du virobiote reste donc à approfondir et
pourrait permettre d’apporter des pistes pour l’élaboration de nouvelles stratégies
préventives ou thérapeutiques en santé humaine. |
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
1. Cadwell
K,
Patel
KK,
Maloney
NS, et al.
Virus-plus-susceptibility gene interaction determines Crohn’s
disease gene Atg16L1 phenotypes in intestine .
Cell.
2010; ; 141 :
:1135.–1145. 2. Matsuoka
K,
Kanai
T. The gut
microbiota and inflammatory bowel disease . Semin
Immunopathol.
2015; ; 37 :
:47.–55. 3. Kernbauer
E,
Ding
Y,
Cadwell
K. An enteric virus
can replace the beneficial function of commensal bacteria .
Nature.
2014; ; 16 :
:94.–98. 4. Abeles
SR,
Pride
DT. Molecular bases
and role of viruses in the human microbiome . J Mol
Biol.
2014; ; 426 :
:3892.–3906. 5. Pamer
EG. Fecal microbiota
transplantation: effectiveness, complexities, and lingering
concerns . Mucosal Immunol.
2014; ; 7 :
:210.–214. 6. Nakatsu
G,
Zhou
H,
Wu
WKK, et al.
Alterations in enteric virome are associated with colorectal
cancer and survival outcomes .
Gastroenterology.
2018; ; 155 : (529–41)
:e5.. 7. Hannigan
GD,
Duhaime
MB,
Ruffin
MT, et al.
Diagnostic potential and interactive dynamics of the
colorectal cancer virome . MBio.
2018; :9.. pii: e02248–18..
8. Cadwell
K.. The virome in
host health and disease . Immunity.
2015; ; 42 :
:805.–813. 9. Zhao
G,
Vatanen
T,
Droit
L, et al.
Intestinal virome changes precede autoimmunity in type I
diabetes-susceptible children . Proc Natl Acad Sci
USA.
2017; ; 114 :
:E6166.–E6175. |