| |
| Med Sci (Paris). 35(6-7): 586–588. doi: 10.1051/medsci/2019116.Une plante, une chenille, une guêpe et des
microorganismes symbiotiques Des interactions multitrophiques emboîtées Paul Clémençon,1 Diane Letourneur,1 Pélagie Ratchinski,1 and Sozerko Yandiev1 1École normale supérieure de Lyon, département de biologie,
Master biologie, Lyon, France MeSH keywords: Animaux, Catechol oxidase, Glucose oxidase, Interactions hôte-microbes, Peroxyde d'hydrogène, Lycopersicon esculentum, Oviposition, Feuilles de plante, Phénomènes physiologiques des plantes, Polydnaviridae, Symbiose, Inhibiteurs trypsiques, Guêpes, biosynthèse, physiologie, métabolisme, virologie |
Au cours de son cycle de reproduction, la guêpe parasitoïde Microplitis
croceipes pond ses œufs dans le corps de son hôte, la chenille
Helicoverpa zea. Le développement de la guêpe parasitoïde repose
sur l’intervention d’un virus endogène peu connu, le polydnavirus. Ce virus à ADN
circulaire double brin a un cycle viral atypique [1, 2]. Le
virus est intégré dans le génome des cellules germinales de la guêpe et se transmet donc
de façon verticale au sein de cette population hôte. La guêpe produit également des
particules virales qui sont injectées dans la chenille au moment de la ponte, en même
temps que les œufs. Ces particules virales permettent l’expression de facteurs de
virulence qui altèrent la physiologie de la chenille, mais elles ne contiennent pas les
gènes nécessaires à la réplication virale : le virus ne peut donc pas se répliquer dans
la chenille. Le polydnavirus a ainsi un hôte primaire, la guêpe, dans lequel le virus se
transmet verticalement et dans lequel des particules virales se forment, et un hôte
secondaire, la chenille parasitée par la guêpe, dans lequel le virus ne se multiplie
pas. La multiplication virale dépend ainsi entièrement du succès reproducteur de la
guêpe. Les facteurs de virulence codés par le virus et exprimés dans la chenille
induisent une immunosuppression locale et perturbent le développement de la chenille, en
altérant son métabolisme et en modifiant ses taux hormonaux. Cela permet aux larves de
guêpes de se développer en consommant les tissus de la chenille tout en la maintenant
vivante, et ainsi au virus de persister dans cette nouvelle génération de guêpes. Ce système de poupées russes est parfois encore plus complexe et peut impliquer un
quatrième acteur, la plante consommée par la chenille parasitée. La chenille
Helicoverpa zea broute des feuilles de tomate, et le glucose de la
plante est oxydé par l’enzyme glucose-oxydase (GOX) présente dans la salive de la
chenille. Un produit de cette réaction, le peroxyde d’hydrogène
(H2O2), est perçu par la plante qui synthétise alors des
molécules de défense qui repoussent la chenille, telles que la polyphénoloxydase (PPO)
et la protéine inhibitrice de trypsine (TI). L’étude menée par l’équipe de Gary W.
Felton s’est intéressée à l’influence du polydnavirus sur le processus de prise
alimentaire de son hôte secondaire, la chenille, et en particulier sur les mécanismes de
défense de la plante consommée [2]. |
Influence du polydnavirus sur la physiologie de la plante consommée Les auteurs ont d’abord infecté des chenilles par des guêpes parasitoïdes porteuses
ou non du polydnavirus, et mesuré la production de molécules de défense par les
feuilles broutées par ces chenilles. Ils ont ainsi montré que les feuilles broutées
par les chenilles parasitées par des guêpes porteuses du polydnavirus produisent
moins de molécules de défense telles que la PPO. Ce phénomène s’explique par la
diminution d’expression de l’enzyme GOX salivaire de la chenille, qui limiterait
ainsi la production de H2O2 à l’origine de l’activation des
défenses de la plante. Afin de démontrer l’effet direct du polydnavirus sur la production de l’enzyme GOX de
la chenille et des protéines de défense de la plante broutée, le virus seul a été
injecté directement dans les chenilles. Les auteurs ont observé que la salive de ces
chenilles contenait alors moins d’enzyme GOX, et les plantes en contact produisaient
moins de molécules de défense. Le polydnavirus est ainsi suffisant pour faciliter la
prise alimentaire de son hôte secondaire en limitant indirectement les réactions de
défense de la plante consommée. Enfin, des feuilles de tomate ont été traitées par de la salive de chenilles non
parasitées ou par celle de chenilles parasitées par des guêpes porteuses du virus.
Ces feuilles traitées ont ensuite été broutées par d’autres chenilles parasitées.
Les chenilles broutant des feuilles traitées par de la salive de chenilles
parasitées ont une prise de poids plus élevée, ce qui suggère une meilleure
croissance de ces chenilles due à l’inhibition des mécanismes de défense de la
plante consommée. Les chercheurs ont conclu en proposant le scénario suivant : en l'absence du virus,
l’enzyme GOX salivaire de la chenille provoque, lors de la prise alimentaire, la
production d’espèces réactives de l’oxygène telles que le
H2O2, qui à leur tour induisent la synthèse de molécules de
défense par la plante : la PPO et la TI. Grâce à ces substances, la plante repousse
la chenille qui alors se nourrit moins. Mais en présence du virus, la sécrétion de
la GOX est diminuée. Le virus diminue ainsi la réaction de défense de la plante et
favorise la prise de nourriture de son hôte secondaire, favorisant ainsi le
développement de son hôte primaire et donc sa propre multiplication virale
(Figure 1).
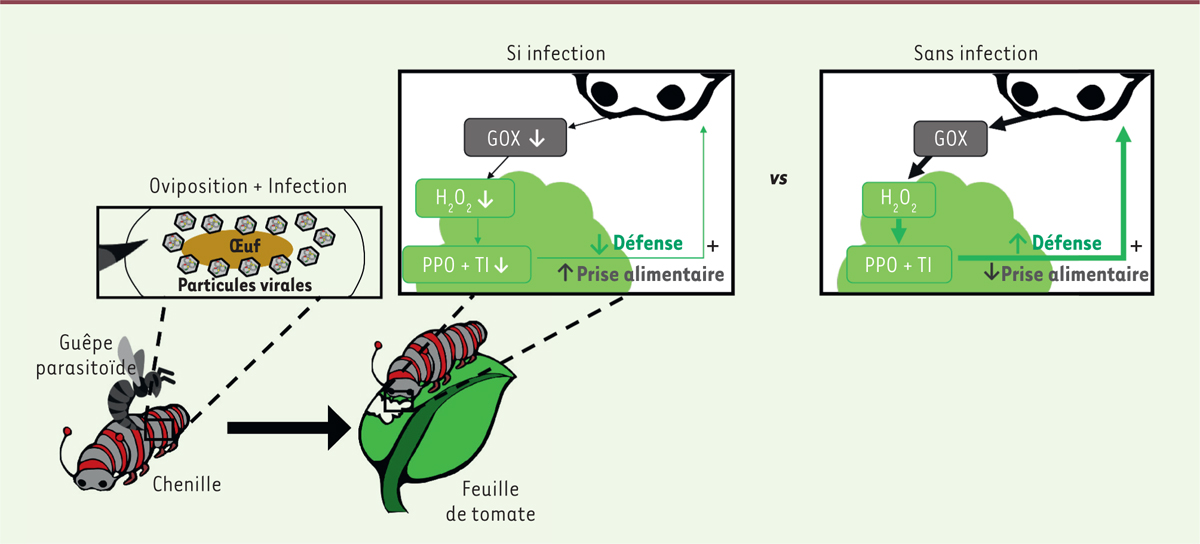
 | Figure 1. Le parasitisme par une guêpe porteuse de polydnavirus symbiotique
favorise la prise alimentaire de la chenille parasitée en réduisant les
défenses de la plante broutée. L’œuf de la guêpe (hôte primaire du
virus) entouré de particules virales est injecté dans le corps de la
chenille (hôte secondaire du virus) lors de l’oviposition. Le virus
infecte les cellules de la chenille et réduit la production de l’enzyme
salivaire glucose-oxydase (GOX). En absence d’infection, cette enzyme
provoque la production de peroxyde d’hydrogène
(H2O2) par la plante qui est perçu par les
cellules végétales et induit la synthèse de polyphénoloxydase (PPO) et
de la protéine inhibitrice de trypsine (TI), qui repoussent la chenille.
En diminuant la sécrétion de la GOX, le virus diminue la production de
la PPO et la TI par la plante et favorise la prise de nourriture de son
hôte secondaire. |
Les auteurs ont ainsi mis en évidence un nouvel aspect des interactions
hôte-parasitoïde. Le parasitoïde perturbe non seulement la physiologie de son hôte
secondaire, mais également celle de la plante consommée par cet hôte herbivore.
Néanmoins, le mécanisme exact permettant cet effet du virus sur la production de GOX
n’est pas encore connu. Plusieurs scénarios sont envisageables. L’expression des
facteurs de virulence viraux pourrait indirectement générer des signaux réduisant à
distance la synthèse de la GOX dans les glandes salivaires. Le virus pourrait
également infecter les glandes salivaires de la chenille et impacter directement la
production de la GOX, bien que l’infection des glandes salivaires n’ait pas été
documentée à ce jour. |
Les microorganismes symbiotiques façonnent les chaînes trophiques Un acteur supplémentaire peut venir s’ajouter à cette chaîne trophique complexe. Les
parasitoïdes peuvent en effet être eux-mêmes sujets aux attaques
d’hyperparasitoïdes, des parasitoïdes de parasitoïdes. Un exemple de cette situation
emboîtée est le suivant : une plante (Brassica oleracea) est
consommée par une chenille (Pieris brassicae), qui est parasitée
par une guêpe parasitoïde (Cotesia glomerata), dont la larve est
elle-même parasitée par une guêpe hyperparasitoïde (Lysibia nana).
Les chercheurs de l’équipe du professeur Feng Zhu ont mis en évidence qu’un virus
endosymbiotique de la guêpe parasitoïde Cotesia glomerata modifiait
indirectement les composés volatils émis par la plante lorsqu’elle est consommée par
la chenille parasitée [3].
Ces signaux chimiques attirent alors les guêpes hyperparasitoïdes telles que
Lysibia nana. Dans ce cas précis, le virus de la guêpe
parasitoïde Cotesia glomerata diminue la valeur sélective de son
hôte, en augmentant indirectement la probabilité de rencontre et d’infestation par
les guêpes hyperparasitoïdes. Un autre exemple de l’importance des microorganismes endogènes dans la modulation des
relations interspécifiques est celui de l’interaction complexe décrite entre (1) la
guêpe parasitoïde Aphidius ervi, (2) son hôte, le puceron du pois,
(3) la bactérie Hamiltonella defensa, un endosymbionte du puceron,
et (4) des phages endogènes de la bactérie H. defensa. La bactérie
H. defensa confère au puceron une résistance vis-à-vis de la
guêpe parasitoïde, et ce de façon strictement dépendante de la présence des phages
[4]. En effet, les
génomes viraux comportent des séquences codant des toxines qui, libérées par la
bactérie H. defensa, inhiberaient le développement du parasitoïde
sans affecter celui du puceron. Dans cet exemple, ce sont les virus associés à
l’hôte parasité et non plus au parasite qui jouent un rôle primordial dans la
régulation de cette relation étroite. La plante, dernier acteur de la chaîne trophique étudiée, est également associée à
une grande diversité de microorganismes épiphytes (qui vivent à sa surface) ou
endophytes (qui vivent à l’intérieur), constituant son microbiote. Une partie de ce
microbiote, dit rhizosphérique, est associé aux racines et joue un rôle essentiel
dans la nutrition végétale, mais également dans la sensibilité à l’herbivorie. Des
chercheurs de l’université du Wyoming ont analysé des plants de Boechera
stricta, une crucifère, cultivés dans des sols inoculés avec différents
ensembles de bactéries présentes dans des sols naturels [5]. Les résultats montrent que les différences
en termes de sensibilité à l’herbivorie par des pucerons sont plus fortement liées à
la composition de la rhizosphère qu’au fond génétique des plants. Ainsi, dans ce
cas, c’est le phénotype étendu de l’association plante-microorganismes qui se
manifeste. |
Ainsi, dans l’interaction complexe entre une plante, un herbivore et un parasitoïde,
les microorganismes associés aux trois acteurs jouent un rôle clé dans la régulation
des différentes relations interspécifiques. Ces microorganismes agissent au niveau
du phénotype étendu de leur hôte, mais leur action s’étend en réalité bien au-delà
de leur hôte et a des conséquences sur la physiologie des individus interagissant
avec cet hôte. L’identification de ces relations complexes permet de revisiter l’utilisation des
parasitoïdes comme agents de lutte biologique. En effet, en raison de l’effet
ravageur de certains insectes herbivores sur les cultures, l’introduction de guêpes
parasitoïdes a été proposée comme une alternative aux pesticides pour protéger les
cultures. Cependant, comme discuté dans cette nouvelle, la guêpe parasitoïde
Microplitis croceipes, loin de réduire le broutage de feuilles
de tomate par sa chenille hôte, l’augmente au contraire en trompant les défenses
immunitaires de la plante. Des chercheurs de l’université de Leyde avaient déjà
formalisé cette idée en postulant l’existence d’un conflit d’intérêt entre plantes
et guêpes parasitoïdes [6].
Dans ces conditions, l’introduction de guêpes parasitoïdes pourrait donc conduire à
un effet encore plus néfaste des herbivores sur les cultures agricoles. Une
compréhension fine et complète des réseaux de relations interspécifiques est donc
nécessaire pour optimiser les stratégies de lutte biologique. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
1. Strand
MR,
Burke
GR. Polydnaviruses:
From discovery to current insights .
Virology.
2015; ; 479–80 :
:393.–402. 2. Tan
CW,
Peiffer
M,
Hoover
K, et al.
Symbiotic polydnavirus of a parasite manipulates caterpillar and
plant immunity . Proc Natl Acad Sci USA.
2018; ; 115 :
:5199.–5204. 3. Zhu
F,
Cusumano
A,
Bloem
J, et al.
Symbiotic polydnavirus and venom reveal parasitoid to its
hyperparasitoids . Proc Natl Acad Sci USA.
2018; ; 115 :
:5205.–5210. 4. Oliver
KM,
Degnan
PH,
Hunter
MS,
Moran
NA. Bacteriophages
encode factors required for protection in a symbiotic
mutualism . Science.
2009; ; 325 :
:992.–994. 5. Hubbard
CJ,
Li
B,
McMinn
R, et al.
The effect of rhizosphere microbes outweighs host plant genetics
in reducing insect herbivory . Mol Ecol.
2019; ; 28 :
:1801.–1811. 6. Meïjden
EVD,
Klinkhamer
PGL. Conflicting
interests of plants and the natural enemies of herbivores .
Oikos.
2000;; 89 : :202.–8.
7. Shikano
I,
Rosa
C,
Tan
CW,
Felton
GW. Tritrophic
interactions: microbe-mediated plant effects on insect
herbivores . Annu Rev Phytopathol.
2017; ; 55 :
:313.–331. |