| |
| Med Sci (Paris). 35(8-9): 608–610. doi: 10.1051/medsci/2019121.Canaux ioniques et mécanismes de transmission de
maladies héréditaires à l’origine de la migraine Perrine Royal1,2 and Guillaume Sandoz1,2* 1Université Côte d’Azur, CNRS, Inserm, iBV, Campus
Valrose, 28, avenue de
Valrose, 06108Nice,
France. 2Laboratories of excellence, ion channel science and
therapeutics, 06108Nice,
France. MeSH keywords: Peptide relié au gène de la calcitonine, Dimérisation, Conception de médicament, Mutation avec décalage du cadre de lecture, Humains, Canaux ioniques, Transport des ions, Migraines, Potassium, Canaux potassiques, Canaux potassiques à pores à domaines en tandem, Biosynthèse des protéines, Cellules réceptrices sensorielles, Nerf trijumeau, Vasodilatation, physiologie, génétique, métabolisme, traitement médicamenteux, physiopathologie, agonistes |
Il est difficile de comprendre pourquoi des mutations délétères d’un même gène se
trouvent être ou ne pas être associées à une maladie. La migraine est une affection
neurologique handicapante qui affecte 15% de la population. Une attaque migraineuse se
traduit par des maux de tête d’une durée de 4 à 72h accompagnés d’une hypersensibilité à
de nombreux stimulus, tels que la lumière ou le son, pouvant mener à des nausées, voire
des vomissements. La migraine est une maladie complexe liée, entre autres, à
l’hyperexcitabilité électrique des neurones sensoriels de la face, appelés neurones
trigéminaux. Cette excitabilité électrique est sous le contrôle de canaux ioniques
[1] (→).
(→) Voir la Nouvelle de F. Rugiero, m/s n°12 décembre 2010,
page1015
Les canaux «potassiques à deux-domaines pore» ou K2P sont inhibiteurs et
servent de frein à l’excitabilité neuronale. Lorsque ces protéines dysfonctionnent, une
hyperexcitabilité des neurones survient (Figure
1).
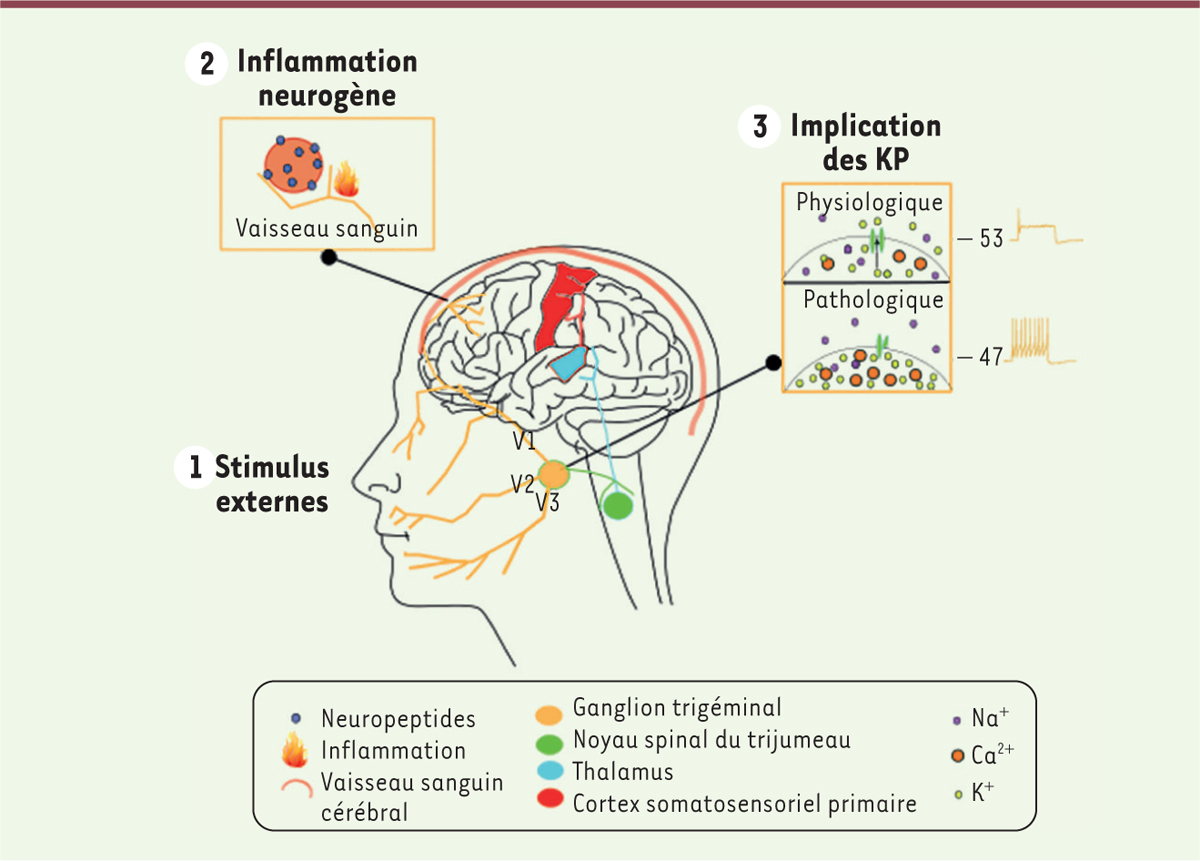
 | Figure 1. La migraine étape par étape. Représentation
schématique montrant les mécanismes qui contribuent à la pathogenèse de la
migraine. 1. La migraine est déclenchée par une vague
électrique initiée par des stimulus endogènes et exogènes, qui perturbent le
système de modulation sensorielle dans le cerveau pour finalement activer
les premières divisions du système nerveux trigéminé (V1/2/3). 2. Cela stimule la libération de neuropeptides,
comme le CGRP (calcitonin gene-related peptide), qui
provoque une dilatation vasculaire et une inflammation. Cette dernière est à
l’origine d’une activation exagérée des neurones sensoriels trigéminaux
induisant la transmission d’un signal douloureux aux centres supérieurs
pouvant alors déclencher la migraine. 3. Des mutations dans le gène
kcnk18 (potassium two pore domain channel
subfamily K member 18) conduisant à la production de protéines
inhibant les canaux potassiques TREK1 et TREK2 vont entraîner une
dérégulation de l’homéostasie potassique à l’origine d’une hyperexcitabilité
et induire la transmission d’un signal douloureux. |
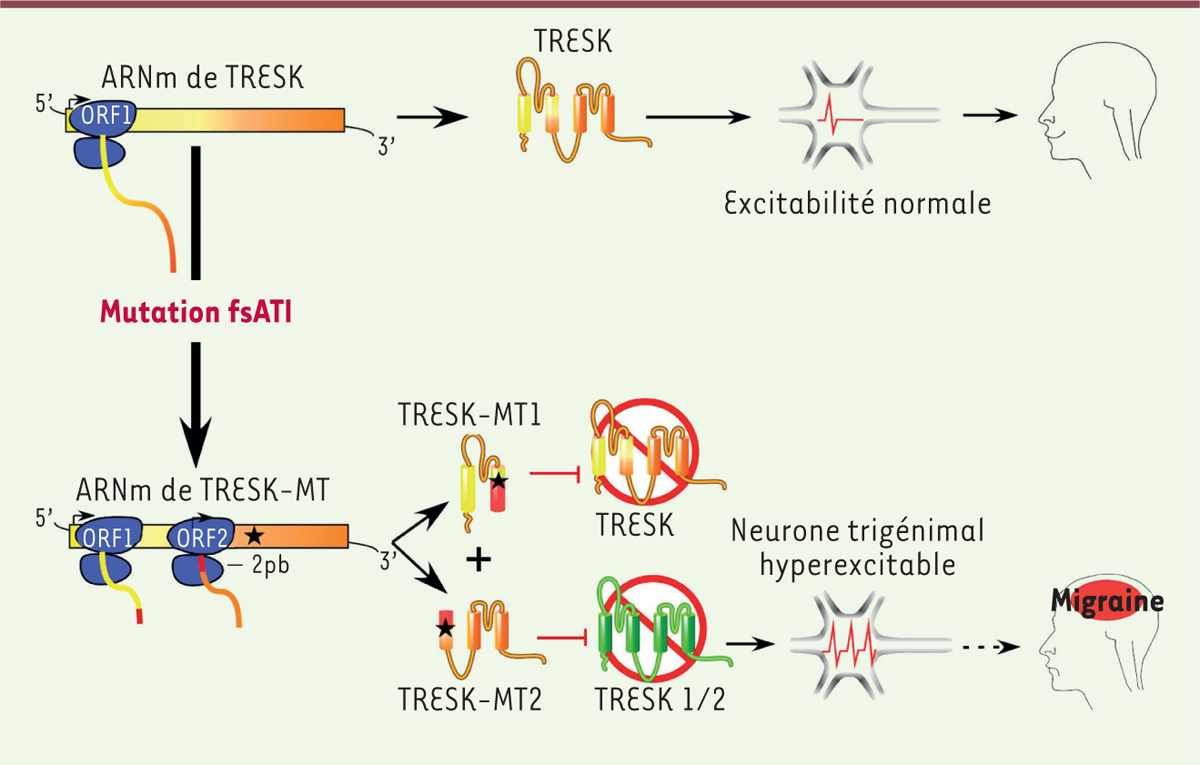
 | Figure 2. La mutation TRESK-MT provoque une migraine via l’inhibition de
TREK1 et TREK2 induite par TRESK-MT2. Dans la partie
supérieure est représentée l’excitabilité des neurones trigéminaux en
présence de la version sauvage de TRESK. Dans la partie inférieure, les
personnes portant la version mutée du canal TRESK (symbolisée par une étoile
noire) présentent une allodynie liée à la migraine. Ce gène muté, par un
mécanisme appelé fsATI (frameshift mutation-induced alternative
translation initiation), est traduit en deux protéines,
TRESK-MT1 et TRESK-MT2. TRESK-MT1 inhibe le canal TRESK alors que TRESK-MT2
cible TREK1 et TREK2. L’inhibition de TREK1 et TREK2 conduit à une
hyperexcitabilité neuronale et à un phénotype migraineux. |
Une version mutée du canal TRESK (TWIK-related spinal cord potassium
channel)1, un membre de la famille des
canaux K2P, présentant une délétion de 2 paires de bases entraînant un
décalage du cadre de lecture (frameshift: F139WfsX24), dénommée
TRESK-MT, a récemment été incriminée dans la migraine [2]. Cette mutation induit la formation d’un canal
tronqué qui, en plus d’être non fonctionnel, agit comme dominant négatif du canal TRESK
sauvage (TRESK-MT abolit le courant généré par TRESK). Les neurones trigéminaux qui
expriment TRESK-MT voient leur excitabilité augmentée, ce qui explique l’induction de la
migraine [3]. Les études qui ont
suivi ont décrit une autre mutation du gène codant TRESK, TRESK-C110R2 qui, comme TRESK-MT, conduit à la formation d’un canal non
fonctionnel qui agit comme dominant négatif sur le canal sauvage [4]. Bien que TRESK-C110R et TRESK-MT semblent avoir
une fonction similaire, seule la mutation TRESK-MT est associée à une augmentation de
l’excitabilité neuronale et à un phénotype migraineux [5]. Comment deux mutations génétiques délétères du
même gène TRESK se trouvent être ou ne pas être associées à la
migraine? |
Le canal TRESK peut s’hétérodimériser La famille des K2P est composée de 15 membres qui sont actifs lorsqu’ils
sont sous forme de dimère. Nous avons montré récemment que certains membres de la
famille pouvaient s’hétérodimériser entre eux [6]. Nous avons émis l’hypothèse que la
différence d’activité observée entre les deux mutants (TRESK-MT et TRESK-C110R)
pouvait reposer sur leur capacité à moduler différemment les autres canaux
K2P avec lesquels TRESK s’hétéromérise. L’utilisation de la technique de précipitation en molécule unique, le
SiMPull (single-molecule pull-down)3 [7] nous a permis de montrer que TRESK était capable de
s’hétérodimériser avec d‘autres canaux K2P, les canaux TREK1 et TREK2.
Les études fonctionnelles réalisées ont ensuite révélé que seul TRESK-MT, et pas
TRESK-C110R, inhibait l’activité des canaux TREK1 et TREK2. L’analyse de souris dont
les canaux TREK1 et TREK2 ont été génétiquement inactivés, a quant à elle, permis de
montrer que TRESK-MT augmentait l’excitabilité des neurones en inhibant ces deux
canaux. Ainsi, la différence entre le mutant impliqué dans la migraine (TRESK-MT) et celui
qui ne l’est pas (TRESK-C110R), repose sur la capacité à inhiber TREK1 et TREK2.
TREK1 et TREK2 ayant un rôle de frein de l’excitabilité, il en résulte une
augmentation de l’excitabilité des neurones trigéminaux, à l’origine de la migraine.
Nous avons également confirmé l’importance de TREK1 et TREK2 dans la survenue de la
migraine en montrant que l’absence d’expression de TREK1 et
TREK2 par invalidation génétique chez la souris, induisait un
phénotype migraineux chronique pouvant être inversé par des médicaments utilisés
pour traiter les migraines. C’est donc l’inhibition de TREK1 et TREK2, mais pas
celle de TRESK, qui conduit à la migraine. TREK1 et TREK2 représentent donc de
nouvelles cibles potentielles pour le traitement de cette maladie. |
L’initiation alternative de la traduction La mutation TRESK-MT est supposée engendrer un canal, appelé TRESK-MT1, non
fonctionnel car amputé de son extrémité carboxy-terminale. Nous avons examiné la
capacité de ce canal tronqué à interagir avec TREK1 et TREK2 mais aucune interaction
n’a été observée. Si l’inhibition du courant formé par TREK1/2 que l’on observe
lorsque le mutant TRESK-MT est co-exprimé ne peut être attribuée à la protéine qu’il
produit, TRESK-MT1, un processus différent est nécessairement impliqué. En général,
l’ARN messager (ARNm) transcrit à partir du gène permet la traduction d’une protéine
unique. Dans certains cas, cette loi n’est cependant pas respectée [8]. Un site alternatif d’initiation de
la traduction peut, en effet, être reconnu sur l’ARNm par les ribosomes et induire
la synthèse d’une deuxième protéine à partir du même ARNm. La délétion des 2 paires
de base de la mutation TRESK-MT du gène TRESK est à l’origine d’un
tel site d’initiation alternatif sur l’ARNm produit, ce qui conduit à la traduction
d’une deuxième protéine, TRESK-MT2, dont l’expression a pu être mise en évidence par
une série d’expériences de biologie cellulaire et de biochimie. Cette nouvelle
protéine correspond à un canal TRESK qui est, lui, amputé de son extrémité
N-terminale [9]. Nous avons
appelé fsATI (pour frameshift mutation-induced alternative translation
initiation) ce nouveau mécanisme d’insertion d’un site alternatif de
traduction par déplacement du cadre de lecture. L’activité de la protéine mutante
TRESK-MT2 a été testée, et nous avons montré que contrairement à TRESK-MT1, elle est
capable d’interagir et d’inhiber TREK1 et TREK2, augmentant ainsi l’excitabilité des
neurones trigéminaux (Figure
2). Afin de démontrer que seule TRESK-MT2, par sa capacité d’inhiber TREK1 et TREK2, est
suffisante pour induire un phénotype migraineux, comme celui observé chez les
patients portant la mutation TRESK-MT, nous avons utilisé un modèle développé chez
le rat chez lequel une surexpression de TRESK-MT2 dans les neurones trigéminaux a
été induite par vectorisation adénovirale. La migraine s’accompagne d’une
hypersensibilité de la face, directement reliée à la sensibilité des nerfs
trijumeaux qui l’innervent et qui peut être mesurée. Nous avons donc testé la
sensibilité faciale des animaux surexprimant TRESK-MT2. Après une semaine de repos,
temps nécessaire à l’expression du vecteur viral, nous avons observé que les rats
exprimant la protéine TRESK-MT2 présentaient une hypersensibilité faciale similaire
à celle observée chez les rats rendus migraineux par injection de monoxyde d’azote
(NO) (la migraine peut être provoquée en utilisant des molécules donneuses de NO).
Cette expérience confirme que la protéine TRESK-MT2, en inhibant TREK1 et TREK2,
est, à elle seule, suffisante pour induire le phénotype migraineux observé chez les
patients. |
TRESK-MT est-il le seul mutant de type fsATI? En examinant les bases de données publiques, nous avons trouvé une autre mutation du
canal TRESK capable, comme la mutation TRESK-MT, de créer un site alternatif
d’initiation de la traduction. Les données de biologie cellulaire et de biochimie
que nous avons obtenues confirment que ce variant, Y121LfsX444, est aussi à l’origine de la traduction de deux protéines
(MT1 et MT2) et de l’inhibition des canaux TREK1 et TREK2. Afin de savoir si cette
mutation était associée à la migraine, nous avons alors confronté sa séquence aux
bases de données cliniques (Clinvar) et avons trouvé qu’elle avait également été
associée à un phénotype migraineux dans des cohortes de populations asiatiques. En
système d’expression hétérologue, cette mutation conduit également à la production
d’une seconde protéine qui inhibe les canaux TREK1 et TREK2. La traduction
alternative du canal TRESK n’est donc pas unique. |
Vers un nouveau médicament Nos études moléculaires, cellulaires et chez l’animal, montrent que TREK1 et
TREK2 sont les canaux qui régulent l’excitabilité des neurones trigéminaux
impliqués dans le phénotype migraineux. Nos résultats récents utilisant des
agonistes de TREK1 et TREK2 chez l’animal se révèlent encourageants et ouvrent
de nombreuses perspectives en clinique humaine dans le traitement de la
migraine. Une nouvelle forme de mutation induisant une maladie Nous avons démontré qu’une mutation du canal TRESK peut induire un déplacement du
cadre de lecture et générer ainsi un site d’initiation de la traduction
alternatif qui, dans certain cas, peut être reconnu par les ribosomes et
conduire, à partir d’un même ARNm, à la synthèse d’une protéine tronquée qui
présente la fonction « poison» responsable de la maladie! Nous
avons étendu notre étude à un autre canal TRESK mutant également impliqué dans
le déclenchement de la migraine, démontrant ainsi que ce phénomène n’est pas
isolé. Il faudra à l’avenir considérer ce type de mutations alternatives dans la
détermination des causes de certaines maladies et ne pas négliger leur
dépistage. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1.
Rugiero
F.
Les canalopathies de la douleur chez l’homme .
Med Sci (Paris).
2010; ; 26 :
:1015.–1017. 2.
Lafrenière
RG
,
Cader
MZ
,
Poulin
JF
, et al.
A dominant-negative mutation in the TRESK potassium channel is
linked to familial migraine with aura . Nat
Med.
2010; ; 16 :
:1157.–1160. 3.
Liu
P
,
Xiao
Z
,
Ren
F
, et al.
Functional analysis of a migraine-associated TRESK K+
channel mutation . J Neurosci.
2013; ; 33 :
:12810.–12824. 4.
Andres-Enguix
I,
Shang
L,
Stansfeld
PJ, et al.
Functional analysis of missense variants in the TRESK (KCNK18) K
channel . Sci Rep.
2012;; 2 : :237.. 5.
Guo
Z
,
Liu
P
,
Ren
F
,
Cao
YQ
. Nonmigraine-associated TRESK K+
channel variant C110R does not increase the excitability of trigeminal
ganglion neurons . J Neurophysiol.
2014; ; 112 :
:568.–579. 6.
Levitz
J
,
Royal
P
,
Comoglio
Y
, et al.
Heterodimerization within the TREK channel subfamily produces a
diverse family of highly regulated potassium channels .
Proc Natl Acad Sci USA.
2016; ; 113 :
:4194.–4199. 7.
Jain
A
,
Liu
R
,
Xiang
YK
,
Ha
T
. Single-molecule pull-down for studying protein
interactions . Nat Protoc.
2012; ; 7 :
:445.–442. 8.
Kozak
M. Initiation of
translation in prokaryotes and eukaryotes .
Gene.
1999;; 234, :
:187.–208. 9.
Royal
P
,
Andres-Bilbe
A
,
Prado
PÁ
, et al.
Migraine-associated TRESK mutations increase neuronal
excitability through alternative translation initiation and inhibition of
TREK . Neuron.
2019; ; 101 : :232.–45.
e6.. |