La myxomatose est une maladie virale hautement infectieuse, virulente et contagieuse du lapin de garenne (Oryctolagus cuniculus). Son agent étiologique, MYXV (virus de la myxomatose), est un Leporipoxvirus de la famille des Poxviridae. Il circule naturellement chez les lapins américains du genre Sylvilagus chez lesquels il cause des fibromes cutanés localisés. Son important pouvoir pathogène vis-à-vis du lapin de garenne est à l’origine de son introduction légale en Australie en 1950 puis illégale en France en 1952 pour réguler les populations de lapins responsables de dégâts écologiques et économiques majeurs. Suite à ces introductions, il a rapidement diffusé à travers le continent australien et à travers l’Europe causant de fortes mortalités dans les populations de lapins, estimées à l’époque à 90-99% [1, 2].
Il a rapidement été constaté une diminution de l’impact de la maladie et une progressive reconstitution des populations de lapins sous l’effet conjoint de la baisse de virulence des souches virales et du développement de résistance dans ces populations. Le système lapin/myxomatose est ainsi devenu la référence en matière de coévolution entre un hôte et son pathogène [3, 4]. Des études récentes ont montré que le système continuait d’évoluer, le virus développant de nouvelles stratégies pour contourner le système immunitaire du lapin [5, 6].
En dépit de nombreuses études, les bases de la résistance génétique à la myxomatose restent mal connues et le rôle joué par la composante génétique dans la résistance à la maladie a fait l’objet de controverses [7].
Pour décrypter les bases génétiques de la résistance à la myxomatose, nous avons comparé des lapins modernes avec des spécimens conservés dans des muséums et collectés avant ou juste après l’introduction de la myxomatose, l’un de ces échantillons anciens ayant même été collecté par Charles Darwin, en 1869. Dans ce travail publié dans Science [8], nous nous sommes focalisés sur trois pays où la résistance à la myxomatose s’est développée indépendamment et dans lesquels le lapin a une histoire différente: l’Australie, la France et le Royaume-Uni. En effet, l’aire de distribution d’origine du lapin de garenne comprend la Péninsule Ibérique et le sud de la France. Il a été introduit au Royaume-Uni depuis la France au XIIIesiècle. Il a ensuite été importé en Australie au XIXesiècle: la majorité des populations australiennes seraient dérivées d’une introduction depuis le Royaume-Uni en 1859.
Pour obtenir des données de polymorphisme à l’échelle du génome, un séquençage haut-débit de l’exome, du génome mitochondrial et de trois régions génomiques codant le CMH (complexe majeur d’histocompatibilité) a été conduit sur 152 lapins et a permis d’identifier 757 333 SNP (single nucleotide polymorphism).
Une première étape a montré que les échantillons modernes et anciens d’un même pays présentaient une diversité et une structure génétique similaires. Les évolutions de fréquences alléliques observées ne sont donc pas artéfactuelles et peuvent être interprétées comme un résultat de la sélection naturelle.
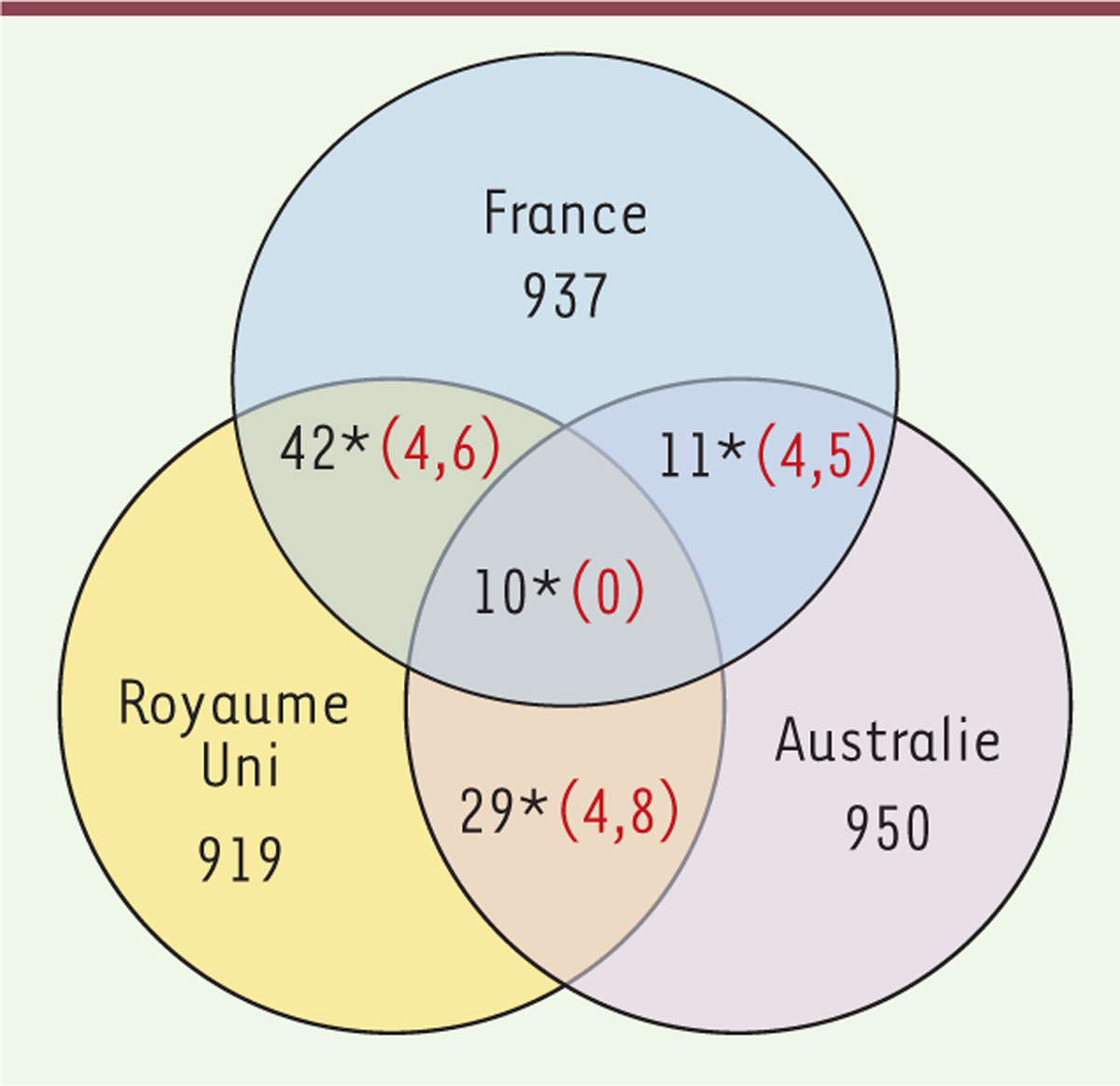
Notre étude montre une évolution parallèle des fréquences alléliques dans les trois pays. Parmi les 757 333 SNP identifiés, nous avons sélectionné les 1 000 polymorphismes affichant la plus forte variation de fréquence allélique entre échantillons modernes et anciens dans chaque pays. On constate que les allèles ayant changé de fréquence simultanément dans deux ou trois pays sont plus nombreux qu’attendu sous le seul effet du hasard (Figure 1). Nous avons ainsi identifié 92 SNP dont la fréquence a changé dans deux ou trois pays simultanément. Parmi eux, on constate que dans 87 cas c’est la fréquence du même allèle qui augmente.
| Figure 1. Changements parallèles de fréquence allélique en Australie, en
France et au Royaume-Uni. Diagramme montrant le
chevauchement des 1 000 SNP (single nucleotide
polymorphism) avec les changements les plus importants de
fréquences alléliques entre les échantillons modernes et historiques dans
chaque pays. Les nombres en noir indiquent le nombre observé de SNP et les
nombres en rouge le chevauchement attendu après 1000 permutations aléatoires
d’échantillons modernes et historiques dans chaque pays. *p<0,001 (figure
adaptée de [8]). |
En complément de cette évolution parallèle, on observe une évolution spécifique à chaque population dont les causes possibles sont diverses: conditions environnementales, structure génétique initiale des populations (sous l’effet de bottlenecks 1, certains allèles peuvent être rares ou manquants dans des populations) ou processus indépendants de coévolution.
De nombreux changements de fréquence allélique concernent des gènes liés à l’immunité. Ainsi, l’un des SNP sélectionnés joue un rôle dans l’activité antivirale du gène IFN-a21A (codant l’interféron–α21A). Nous avons montré expérimentalement que l’allèle sélectionné réduit significativement la réplication d’une souche atténuée de MYXV (mutant M029). La sélection naturelle a donc augmenté l’expression de la réponse interféron chez les populations modernes de lapins. Cet allèle sélectionné a aussi un effet antiviral sur le VSV (vesicular stomatitis virus), ce qui suggère un accroissement général de l’activité antivirale de l’IFN-α21A [9] (→).
(→) Voir la Synthèse de J. Manry et L. Quintana-Murci, m/s n°12, décembre2012, page1095
La sélection qui s’est opérée sous l’effet du MYXV pourrait ainsi contribuer à augmenter la résistance des lapins à d’autres virus, notamment au RHDV (rabbit haemorrhagic disease virus).
D’autres évolutions concernent des gènes proviraux qui commandent la synthèse de protéines que le virus détourne à son profit. Outre l’augmentation de la défense antivirale, la résistance aux virus peut en effet se développer par une diminution de l’activité de ces gènes proviraux. Un changement significatif de fréquence allélique a été détecté sur le gène VPS4. Nous avons montré que la protéine VPS4 (vacuolar protein sorting 4-A) est provirale et intervient dans les premières étapes de la réplication de MYXV. Il semble que la sélection opérée sous l’effet de la myxomatose ait altéré l’expression de cette protéine VPS4 chez les populations modernes de lapins.
La sélection parallèle d’allèles ayant un effet antiviral a été rendue possible par l’existence d’une variabilité génétique héritée de plusieurs millénaires d’évolution en Europe et qui a été introduite avec les lapins au Royaume-Uni puis en Australie. Cette variabilité génétique explique le développement rapide de la résistance à la myxomatose après les premières épidémies. En effet, cinq ans après l’introduction du virus en Australie, l’existence d’une résistance génétique à la maladie a été établie [10]. En complément, nous avons constaté que l’effondrement des populations causé par la myxomatose n’a pas eu d’incidence sur la diversité génétique qui est restée similaire entre populations historiques et modernes. Nous avions observé un résultat similaire lors de l’émergence de la RHD (rabbit haemorragic disease). En effet, à l’échelle d’une population de lapins qui avait subi une épidémie de RHD causant des mortalités estimées à 90%, nous n’avions enregistré aucune perte de diversité génétique [11]. Ainsi, même après avoir été soumise à des effondrements de populations causés par deux maladies virales, l’espèce a conservé le même potentiel d’évolution pour faire face à des pathogènes émergents auxquels elle pourrait être exposée dans le futur.
L’ensemble de nos résultats suggèrent donc que la résistance à la myxomatose est polygénique et résulte d’une accumulation de changements de fréquence allélique sur l’ensemble du génome plutôt qu’à quelques évolutions ayant un effet majeur sur la réponse immunitaire. Ce processus plaide pour une évolution graduelle de la résistance au cours du temps.
Lorsque la résistance se développe au travers d’une réduction de la réplication du virus plutôt qu’à un évitement de l’infection, on doit s’attendre, en réponse, à une augmentation de la virulence du virus. C’est ce qui a été observé sur une période récente avec l’émergence de souches virales très immunosuppressives [6]. Il semble donc que le virus ait trouvé la parade pour contourner les mécanismes de défense développés jusqu’à présent par le lapin sous l’effet de la sélection génétique.