| |
| Med Sci (Paris). 35(8-9): 616–618. doi: 10.1051/medsci/2019120.Maturation extracellulaire du virus de l’hépatite
C Une cape d’invisibilité plasmatique Marion Chanut,1 Christelle Granier,1 François-Loïc Cosset,1* and Solène Denolly1 1CIRI- Centre International de Recherche en Infectiologie,
Université Lyon, Université Claude Bernard Lyon 1, Inserm, U1111, CNRS,
UMR5308, ENS Lyon, 46,
allée d’Italie, F-69007, Lyon, France. MeSH keywords: Anticorps neutralisants, Hepacivirus, Hépatite C, Anticorps de l'hépatite C, Antigènes de l'hépatite C, Interactions hôte-pathogène, Humains, Lipoprotéines, Propriétés de surface, Protéines de l'enveloppe virale, Virémie, Virion, immunologie, métabolisme, génétique, physiologie, ultrastructure, sang, virologie |
Le virus de l’hépatite C (VHC) est un virus à tropisme hépatique responsable
d’infections aiguës ou chroniques. Ces infections ont un impact important en santé
publique dû au nombre de décès causés, estimé à environ 399 000 en 2015, qui ont
majoritairement pour origine une cirrhose, mais également un carcinome
hépatocellulaire [1]. Le VHC est un petit virus enveloppé de 80 à 120 nanomètres de diamètre, de la famille
des Flaviviridae et du genre des Hepacivirus. Il
présente une nucléocapside composée de la protéine core et du génome viral à ARN,
protégés par une enveloppe membranaire où sont ancrées deux glycoprotéines, E1 et E2
(Figure 1). Lors du
cycle viral, une unique polyprotéine, obtenue par traduction du génome viral, permet
la production après clivage des protéines structurales et non structurales du virus.
Parmi les protéines structurales, les protéines core, E1 et E2, sont présentes dans
les particules virales. Les protéines p7, NS2, NS3, NS4A, NS4B, NS5A et NS5B sont,
elles, non structurales, et ont un rôle dans la réplication, la morphogenèse, et la
régulation des facteurs cellulaires modulant la propagation du virus [2]. Le génome viral présente
une variabilité très importante qui, au sein d’un même virus et de ses protéines,
n’est pas distribuée de manière équivalente. C’est le cas de la glycoprotéine E2 et
notamment des 27 acides aminés les plus divergents, qui constituent sa partie
N-terminale et forment la région hypervariable 1 (HVR1) de la protéine.
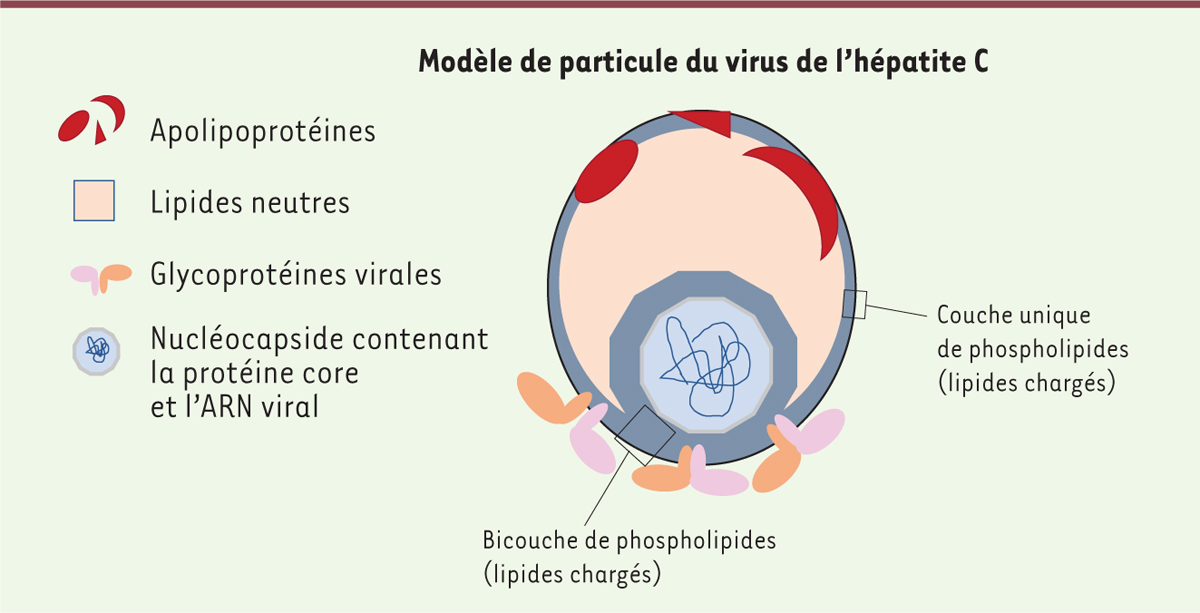
 | Figure 1. Modèle de particule du virus de l’hépatite
C. Les particules du VHC sont associées aux
lipoprotéines, présentant à leur surface, d’une part des
apolipoprotéines comme apoB, apoE, apoC et, d’autre part, des lipides
neutres comme des esters de cholestérol et des triglycérides. Les
glycoprotéines virales, imbriquées à la surface des particules virales,
permettent l’interaction avec la cellule via des
récepteurs spécifiques. La nucléocapside, composée de la protéine core
et du génome à ARN, est ainsi protégée par ces structures externes. |
La découverte de nouvelles molécules antivirales a permis des avancées considérables
dans le traitement du VHC. La perspective d’un vaccin reste néanmoins pertinente
afin de pouvoir éradiquer ce virus [2, 3] (→).
(→) Voir la Nouvelle de N. Hamdane et al.,
m/s n°5, mai2018, page391
Sa conception reste cependant difficile à cause de la variabilité génétique du virus,
comme le reflète sa classification en 7 génotypes différents, en de nombreux
sous-types et en une quasi-espèce extrêmement abondante chez les individus infectés.
Le virus a également développé différents mécanismes permettant son échappement à la
réponse immunitaire. Notamment, la région hypervariable HVR1 de la glycoprotéine E2
joue un rôle important pour sa protection contre le système immunitaire [4]. De plus, le virion du VHC
présente une caractéristique unique: il s’associe et incorpore des lipides neutres
(triglycérides et esters de cholestérol) issus de son hôte, qui pourraient modifier
sa conformation spatiale [5].
La source de ces lipides est constituée par les lipoprotéines présentes dans le
sérum des patients et dont le rôle est le transport des lipides dans l’organisme.
Cette lipidation du virus est à l’origine de l’acquisition de la très faible densité
de ses virions, entre 1,00 et 1,08. Cela lui permet d’échapper aux anticorps
capables de neutraliser ces particules virales, notamment en raison d’un accès plus
difficile aux épitopes cibles d’anticorps neutralisants et/ou d’une entrée plus
rapide dans la cellule [6]. |
VHCcc produites en présence de sérum humain: nouveau modèle de particules Un enjeu majeur pour progresser dans la connaissance des mécanismes d’infection par
le virus est la mise au point d’un modèle de particules virales produites in
vitro et capables de mimer celles retrouvées chez le patient. Ces
particules sont de très faible densité [5],
selon leur association avec les lipides de l’hôte [7]. Plusieurs modèles in vitro
ont permis l’étude du cycle du virus, mais les particules produites dans ces
modèles, appelées VHCcc (cell-culture-derived hepatitis C virus),
se retrouvent à des hauts niveaux de densité [8]. Les particules virales produites dans des hépatocytes
primaires humains [9] ou dans
des modèles de souris humanisées [10] présentent des densités intermédiaires entre celles des patients
infectés et celles du VHCcc. Des travaux de notre laboratoire, publiés récemment, ont permis de mettre en évidence
l’importance du sérum humain pour la production de VHCcc se rapprochant davantage
des caractéristiques des particules virales dérivées des patients [11]. La production in
vitro de ces particules, ou encore leur incubation pendant quelques
heures en présence de sérum humain, provoquent un changement de densité des virions.
Ils sont alors distribués dans les niveaux de faible densité, probablement en raison
de leur lipidation, alors que l’absence de sérum, ou l’utilisation de sérum de veau
fœtal maintiennent ou confèrent à ces particules une densité plus élevée [11]. Comme cela a été observé pour le VHC
dérivé de patients infectés, les particules produites ou incubées avec du sérum
humain sont associées à l’apolipoprotéine B, une protéine structurale majeure des
lipoprotéines de faible densité. |
Mécanisme de lipidation du virus Alors que d’autres études suggéraient que l’association des virions aux lipoprotéines
se réalisait très précocement, lors de leur assemblage ou au moment de la phase de
sécrétion des virions par la cellule, nos résultats montrent que la lipidation
pourrait également, voire principalement, se produire dans le milieu
extracellulaire, après la production des particules par les hépatocytes infectés
[11]. En effet, l’incubation de
particules virales, initialement produites sans sérum, avec du sérum humain permet
de produire des particules de faible densité, indiquant que la maturation des
virions par lipidation se produit après leur sécrétion dans la circulation. Nous avons montré également que les différentes classes de lipoprotéines sériques
(les lipoprotéines de très basse densité [very-low density
lipoprotein ou VLDL], les lipoprotéines de basse densité [low
density lipoprotein ou LDL] et les lipoprotéines de haute densité
[high density lipoprotein ou HDL]) constituaient la source de
lipides pour la formation des lipo-viro-particules. Pourtant, si chacune d’entre
elles peut être à l’origine de la fourniture de lipides, la lipidation complète des
particules virales est induite par leur association avec une combinaison de ces
trois classes de lipoprotéines. Ce mécanisme nécessite également des facteurs
sériques non lipidiques qui ne sont pas encore totalement identifiés. Néanmoins, le
rôle de l’albumine sérique pour l’acquisition de la faible densité en présence de
LDL ou de VLDL a pu être mis en évidence (Figure 2).
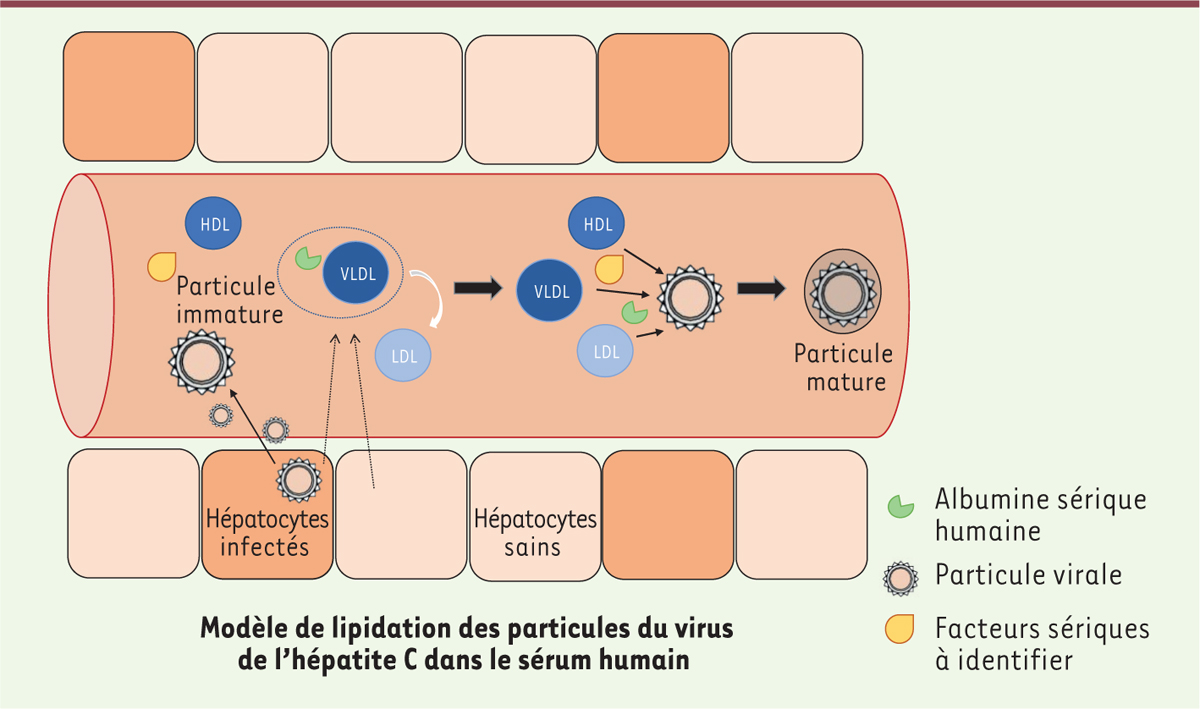
 | Figure 2. Modèle de lipidation des particules du virus de l’hépatite
C dans le sérum humain. Les hépatocytes infectés
permettent la libération des particules immatures dans la circulation
sanguine. Dans ce compartiment, le virus trouve les facteurs qui vont
aider à la formation des particules lipidées. Pour cela, les différentes
lipoprotéines circulantes du sérum vont entrer en jeu, ainsi que
d’autres facteurs sériques dont l’albumine sérique. Ces particules vont
alors être capables d’aller infecter d’autres hépatocytes. |
En accord avec des études précédentes qui soulignaient son rôle dans l’interaction du
virus avec les lipoprotéines [4], la région
HVR1 apparaît comme essentielle dans le mécanisme de lipidation des virions.
Notamment, des échanges génétiques de cette région HVR1 entre deux souches du VHC
présentant des distributions différentes de densités en présence de sérum humain ont
permis de montrer que la région HVR1 déterminait le niveau de lipidation de la
souche virale [11]. Cette région semble donc
être spécifiquement impliquée dans la lipidation des particules virales, dictant
leur niveau de lipidation et ainsi, l’acquisition de la faible densité. |
Anticorps et neutralisation Hormis l’apport de ce modèle de lipidation in vitro permettant une
meilleure compréhension fondamentale des propriétés du VHC, plusieurs perspectives
importantes de cette observation sont à souligner. L’association des virions aux
lipides est un élément clé pour l’échappement du virus à la réponse immunitaire.
L’élimination spontanée du virus a été associée à une réponse immunitaire importante
et précoce, pouvant être maintenue durant plusieurs années. Des anticorps
neutralisants sont produits à la suite d’une infection aiguë. Ils sont notamment
dirigés contre différents épitopes, dont certains sont capables d’engendrer des
réactions de neutralisation croisée [12]. Ces anticorps semblent avoir un rôle dans le contrôle de
l’infection. Ils pourraient contribuer au développement d’une immunité protective
[13], même si des
mécanismes d’échappement mis en place par le virus limitent fortement leur capacité
de neutralisation [4]. Les approches utilisant des particules produites in vitro permettent
d’étudier précisément la réponse humorale, et cela de manière d’autant plus
pertinente que les modèles développés produisent des particules virales telles
qu’elles sont observées chez les patients. Il est probable que l’association du
virus aux lipides permette d’échapper à ces anticorps. L’association aux composants
des lipides et/ou lipopoprotéines pourrait en effet modifier la structure de la
particule, ce qui pourrait conduire à une utilisation différente par le virus de ses
récepteurs d’entrée dans la cellule, rendant sa pénétration plus rapide et plus
efficace [6] en évitant que les particules ne
soient ciblées par les anticorps [14]. Il est également possible que l’association avec les lipoprotéines,
ou avec les lipides, masque les épitopes cibles de ces anticorps neutralisants [4,
8, 11, 12, 14]. Nos travaux ont confirmé que les anticorps ciblant la glycoprotéine E2 ont une
capacité de neutralisation des particules incubées avec du sérum humain inférieures
à celles des particules produites sans sérum [11]. Ceci renforce donc l’hypothèse du rôle de l’association des virions
aux lipoprotéines dans la protection des particules contre la neutralisation par les
anticorps [4], suggérant le masquage par des
composants du sérum, d’épitopes importants dans l’activité neutralisante des
anticorps. |
La mise au point d’un outil d’étude du virus de l’hépatite C se rapprochant davantage
de ce qui est observé in vivo a permis de préciser le mécanisme de
lipidation du virus. Cela pourrait permettre aussi des avancées dans l’étude
structurale et fonctionnelle du virus, pouvant aider à concevoir des candidats pour
un vaccin. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Notre laboratoire est financé par l’agence nationale de la recherche sur le SIDA et
les hépatites virales (ANRS) et par le LabEx Ecofect (ANR-11-LABX-0048) de
l’Université de Lyon dans le cadre du programme d’investissements d’avenir
(ANR-11-IDEX-0007) de l’agence nationale pour la recherche (ANR).
|
1.
Organisation Mondiale de la Santé . Global hepatitis
report . Genève: :
OMS; , 2017 2.
Hamdane
N
,
Baumert
T
,
Zeisel
MB
. Carcinome hépatocellulaire après éradication du
virus de l‘hépatite C par des antiviraux à action directe .
Med Sci (Paris).
2018; ; 34 :
:391.–394. 3.
Bartenschlager
R
,
Baumert
TF
,
Bukh
J
, et al.
Critical challenges and emerging opportunities in hepatitis C
virus research in an era of potent antiviral therapy: considerations for
scientists and funding agencies . Virus Res.
2018; ; 248 :
:53.–62. 4.
Bartosch
B
,
Verney
G
,
Dreux
M
, et al.
An interplay between the hyper-variable region 1 of the HCV E2
glycoprotein, the scavenger receptor BI and HDL promotes both enhancement of
infection and protection against neutralizing antibodies .
J Virol.
2005; ; 79 :
:8217.–8229. 5.
André
P
,
Komurian-Pradel
F
,
Deforges
S
, et al.
Characterization of low- and very-low-density hepatitis C virus
RNA-containing particles . J Virol.
2002; ; 76 :
:6919.–6928. 6.
Dreux
M
,
Pietschmann
T
,
Granier
C
, et al.
High density lipoprotein inhibits hepatitis C virus-neutralizing
antibodies by stimulating cell entry via activation of the scavenger
receptor BI . J Biol Chem.
2006; ; 281 :
:18285.–18295. 7.
Merz
A
,
Long
G
,
Hiet
MS
, et al.
Biochemical and morphological properties of HCV particles and
determination of their lipidome . J Biol
Chem.
2011; ; 286 :
:3018.–3032. 8.
Dao Thi
VL
,
Granier
C
,
Zeisel
MB
,
Guérin
M
, et al.
Characterization of hepatitis C virus particle subpopulations
reveals multiple usage of SRBI for entry steps . J
Biol Chem.
2012; ; 287 :
:31242.–31257. 9.
Podevin
P
,
Carpentier
A
,
Pene
V
, et al.
Production of infectious hepatitis C virus in primary cultures of
human adult hepatocytes . Gastroenterology.
2010; ; 139 :
:1355.–1364. 10.
Calattini
S
,
Fusil
F
,
Mancip
J
, et al.
Functional and biochemical characterization of Hepatitis C virus
(HCV) particles produced in a humanized liver mouse model .
J Biol Chem.
2015; ; 290 :
:23173.–23187. 11.
Denolly,
Granier
C,
Fontaine
N, et al.
A serum protein factor mediates maturation and apoB-association
of HCV particles . J Hepatol.
2019;; 70 :
:626.–38. 12.
Lavillette
D
,
Morice
Y
,
Germanidis
G
, et al.
Human serum facilitates hepatitis C virus infection, and
neutralizing responses inversely correlate with viral replication kinetics
at the acute phase of hepatitis C virus infection . J
Virol.
2005; ; 79 :
:6023.–6034. 13.
Fafi-Kremer
S
,
Fauvelle
C
,
Felmlee
DJ
, et al.
Neutralizing antibodies and pathogenesis of hepatitis C virus
infection . Viruses.
2012; ; 4 :
:2016.–2030. 14.
Prentoe
J
,
Serre
SB
,
Ramirez
S
, et al.
HVR1 deletion and required adaptive envelope mutations confer
decreased dependancy on SRBI and LDLr for HCV . J
Virol.
2014; ; 88 :
:1725.–1739. |