La capacité du système immunitaire à reconnaître les cellules tumorales et à les éradiquer est suspectée depuis plus de cent ans. En 1909, Paul Ehrlich formule l’hypothèse que les défenses immunitaires de l’hôte peuvent prévenir le développement de cancers dans certaines situations [1], une hypothèse que les moyens techniques de l’époque ne permettaient pas de démontrer. La première démonstration expérimentale que le cancer peut induire une réponse immunitaire est apportée en 1953 par Gross et Foley, qui montrent, chez la souris, l’efficacité contre des sarcomes d’une vaccination avec des extraits de tumeurs [2]. Plus tard, Frank Macfarlane Burnet émet l’hypothèse que les néo-antigènes synthétisés par les cellules cancéreuses induisent une réaction immunitaire contre la tumeur, et formule ainsi la théorie de la surveillance immunitaire [3, 4]. Ce n’est pourtant qu’assez récemment que l’équipe de Robert Schreiber a pu démontrer de manière expérimentale la réalité du principe d’immunosurveillance dans le cancer. En effet, dans un modèle de sarcome induit par un carcinogène, le méthylcholanthrène, les tumeurs apparaissent beaucoup plus fréquemment chez des souris immunodéficientes que chez des souris immunocompétentes. Des études complémentaires ont également révélé le rôle essentiel des lymphocytes T CD8+ et des cellules NK (natural killer), ainsi que de l’interféron gamma (IFNγ) et de molécules cytotoxiques comme la perforine ou le granzyme, dans le contrôle de cette croissance tumorale [5].
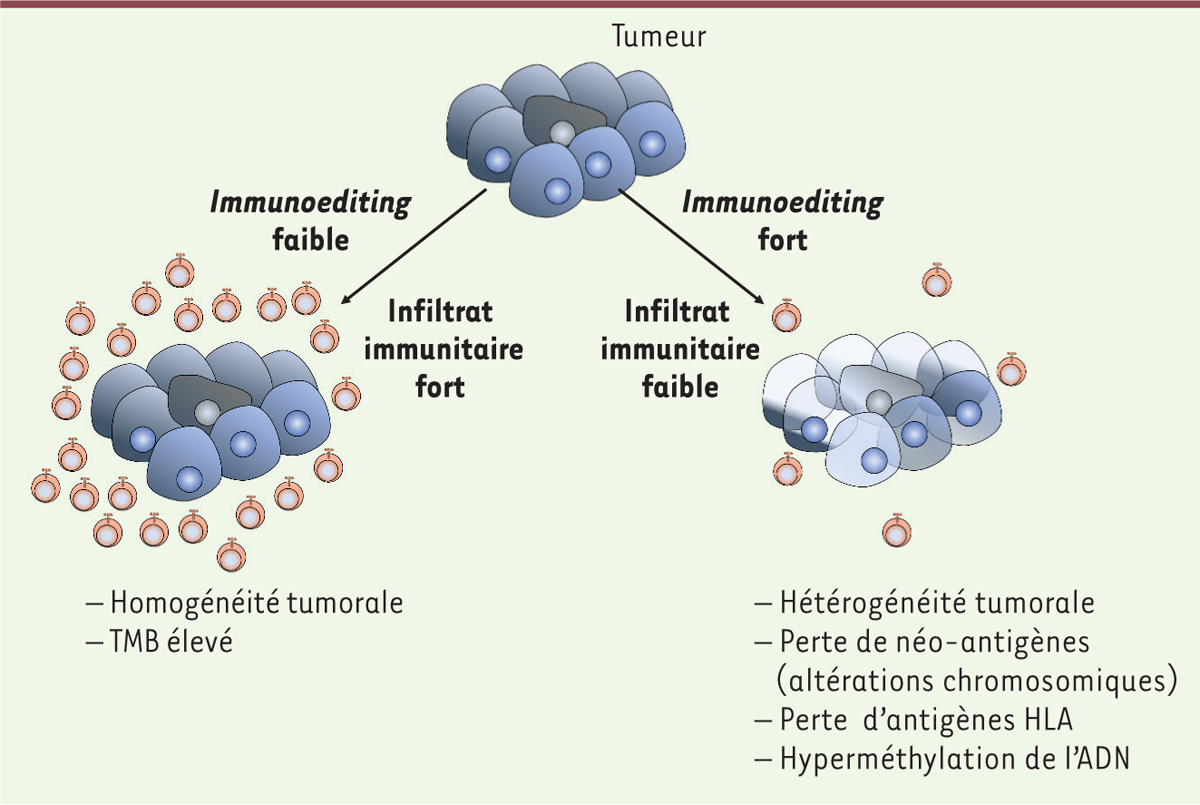
Dunn et al., de la même équipe, ont complété ces travaux. Ils ont suggéré que l’immunosurveillance était composée de trois phases [6]. Dans la première phase, la phase d’élimination, les cellules tumorales sont tuées par les cellules NK et les lymphocytes T CD4+ et CD8+. Ceci permet l’éradication de certaines tumeurs avant même qu’elles deviennent détectables [7]. La deuxième phase correspond à un état d’équilibre entre cellules immunitaires et cellules tumorales. Elle s’accompagne d’une sélection de clones tumoraux résistants au système immunitaire: c’est la phase d’immunoediting. Enfin, lorsque le système immunitaire devient incapable de détruire les cellules tumorales, la troisième phase est celle de l’échappement, qui s’achève par l’apparition d’une tumeur cliniquement détectable. Ainsi, le concept d’immunoediting conduit à envisager la possibilité que le système immunitaire exerce un contrôle sur le génome et le transcriptome des cellules tumorales dès les premiers stades de la croissance tumorale. La réponse immunitaire pourrait donc induire l’élimination des clones tumoraux les plus antigéniques, favorisant l’apparition d’une hétérogénéité tumorale et une perte d’expression des néo-antigènes à l’origine de la réponse immunitaire.
Des analyses génomiques de tumeurs induites par le méthylcholanthrène ont permis leur caractérisation moléculaire chez des souris immunodéficientes ou immunocompétentes. Chez les souris immunodéficientes, on observe le développement de tumeurs ayant une forte immunogénicité, due à la présence de protéines mutantes très antigéniques. Ces tumeurs sont spontanément rejetées lorsqu’elles sont transplantées chez un animal immunocompétent. Chez les souris immunocompétentes, un processus d’immunosélection, dépendant des lymphocytes T, conduit à la sélection de tumeurs dépourvues d’antigènes fortement immunogéniques et qui résistent à la transplantation chez des souris immunocompétentes syngéniques.
La démonstration du phénomène d’immunoediting chez l’homme restait à apporter, mais l’équipe de Charles Swanton vient de publier, dans la revue Nature, les résultats d’une étude qui porte sur l’analyse génomique et transcriptomique de plusieurs échantillons tumoraux d’une tumeur bronchique non-à-petites-cellules localisée, traitée par chirurgie sans aucun traitement médical néoadjuvant (étude TRACERX) [8]. Les données issues de 64 tumeurs et de 164 zones tumorales ont été analysées par séquençage d’exome et séquençage du transcriptome (ARNseq).
L’analyse de l’exome a permis d’estimer le nombre de mutations par échantillon tumoral (ou TMB pour tumor mutation burden). Il s’agit d’un marqueur prédictif de la réponse à l’immunothérapie [9]. Cette analyse a aussi permis de déterminer le typage HLA (human leucocyte antigen) et de rechercher une perte d’antigènes du complexe HLA (consécutive à une perte d’hétérozygotie, que l’analyse de l’exome tumoral permet d’identifier) ou une inactivation de gènes impliqués dans la stimulation antigénique du système immunitaire. L’analyse du transcriptome a, quant à elle, permis d’estimer l’infiltration immunitaire de la tumeur. Cette analyse révèle un lien entre l’existence d’un nombre élevé de mutations dans les cellules tumorales et l’importance de l’infiltration immunitaire, indiquant, comme chez la souris, qu’une forte immunogénicité pourrait induire une meilleure réponse immunitaire. Les résultats suggèrent également que le microenvironnement immunitaire varie considérablement entre les prélèvements réalisés chez les différents patients, mais aussi, dans de nombreux cas, entre différentes régions de la même tumeur. Étonnamment, l’hétérogénéité tumorale, caractérisée par un grand nombre de sous-clones tumoraux, est associée à un faible infiltrat de cellules immunitaires. Ceci suggère un défaut de l’immunosélection permettant l’élimination des sous-clones exprimant certains néo-antigènes, ce qui favorise la production de ces nombreux sous-clones résistants.
Des modifications du transcriptome des cellules tumorales ont été observées dans des tumeurs pour lesquelles il existe une sélection négative de certains néo-antigènes. Certaines tumeurs expriment en effet moins de transcrits codant des néo-antigènes susceptibles d’être présentés au système immunitaire par le complexe HLA que de transcrits codant des néo-antigènes qui échapperont au système immunitaire. Il semble donc exister une immunosélection des néo-antigènes dès l’étape de transcription des gènes correspondants.
Sur le plan génomique, l’immunosélection repose sur l’accumulation d’anomalies chromosomiques. Dans les tumeurs avec une faible infiltration immunitaire, on observe une augmentation des délétions chromosomiques dans des zones codant des néo-antigènes susceptibles d’être présentés au système immunitaire par le complexe HLA. Ces tumeurs se caractérisent également par des pertes d’hétérozygotie touchant des gènes codant des protéines du complexe HLA, ou d’autres protéines impliquées dans la présentation antigénique, ce qui diminue la capacité de présentation des néo-antigènes aux cellules immunocompétentes. Ces mécanismes jouent donc un rôle majeur dans l’immunoediting.
L’hyper-méthylation des promoteurs des gènes codant les néo-antigènes inhibe également la transcription de ces gènes, donc la synthèse des néo-antigènes, notamment ceux présentés par le complexe HLA. Les modifications épigénétiques contribuent donc aussi à l’immunoediting.
L’immunoediting, par des mécanismes génétiques et épigénétiques, conditionne donc l’évolution des cellules constitutives d’une tumeur. Il constitue un marqueur de mauvais pronostic indépendant de l’infiltration immunitaire, et pourrait devenir un nouveau biomarqueur prédictif du pronostic, notamment dans le cancer bronchique. Les résultats obtenus par l’équipe de Charles Swanton montrent que le système immunitaire joue un rôle majeur dans tous les cancers bronchiques, quel que soit leur degré d’infiltration par les cellules immunitaires. En cas de tumeur «peu immunogénique», présentant une faible charge mutationnelle et un faible infiltrat immunitaire, la réponse immunitaire induit une sélection clonale qui est à l’origine d’une faible immunogénicité de la tumeur. Une analyse génomique et transcriptomique des cellules tumorales pourrait donc permettre d’affiner l’utilisation thérapeutique d’anticorps ciblant les inhibiteurs de points de contrôle immunitaire. Des stratégies alternatives pourraient aussi utiliser des vaccins thérapeutiques ou des lymphocytes T génétiquement modifiés ciblant ces néo-antigènes clonaux nécessaires à la survie de la cellule tumorale. Des molécules empêchant l’évasion immunitaire reposant sur des modifications épigénétiques pourraient aussi faire partie de l’arsenal thérapeutique. Le potentiel thérapeutique de telles molécules, en association avec une immunothérapie, est actuellement testé. Les résultats préliminaires suggèrent que cette association restaure l’immunogénicité des tumeurs. Une des hypothèses est que la répression, par un mécanisme épigénétique, d’un néo-antigène préalablement exprimé dans un cancer pourrait induire une immunosuppression. Le rôle de l’épigénétique dans l’immunoediting pourrait alors expliquer les observations récentes sur la résistance acquise de tumeurs aux inhibiteurs de points de contrôle immunitaire, et le fait que ces tumeurs redeviennent répondeuses à un second traitement similaire après administration d’un médicament affectant les modifications épigénétiques.
Le cancer bronchique est donc un cancer propice à l’immunothérapie. Dès les stades précoces, des mécanismes immunologiques influent sur ses caractéristiques génétiques et son pronostic. Ces découvertes ouvrent un champ immense de recherche de biomarqueurs et de thérapies immunologiques ciblées pour contrecarrer les mécanismes d’immunosubversion qui grèvent le pronostic.