| |
| Med Sci (Paris). 35(8-9): 659–666. doi: 10.1051/medsci/2019128.Syndrome néphrotique idiopathique et facteurs
circulants Une Arlésienne ? Hans-Kristian Lorenzo1,2,3 and Jean-Jacques Candelier1,2* 1Inserm U1197, Interactions cellules
souches-niches-physiologie, tumeurs et réparations tissulaires, Hôpital Paul
Brousse, Bâtiment Lavoisier, 14, avenue Paul-Vaillant Couturier,
94800Villejuif,
France. 2Université Paris-Saclay, Campus universitaire
d’Orsay, 91
405Orsay,
France. 3Service de néphrologie, CHU Bicêtre,
94270Le Kremlin Bicêtre,
France. |
Les reins représentent 1 % du poids du corps mais 10 % de la consommation totale
d’oxygène. C’est un organe complexe, tant des points de vue de son développement, de sa
structure, de sa physiologie que de sa pathologie. L’une des pathologies qui le touche,
le syndrome néphrotique, a été décrite pour la première fois par Hippocrate comme un
œdème généralisé. Il faudra attendre 1722 et Théodore Zwinger pour que le rein fasse son
entrée dans cette pathologie. On s’aperçut ensuite que les urines des patients atteints
de cette maladie pouvaient coaguler, et c’est Richard Bright, en 1827, qui, pour la
première fois, a pu rassembler la triade : œdème généralisé, protéinurie et maladie
rénale. |
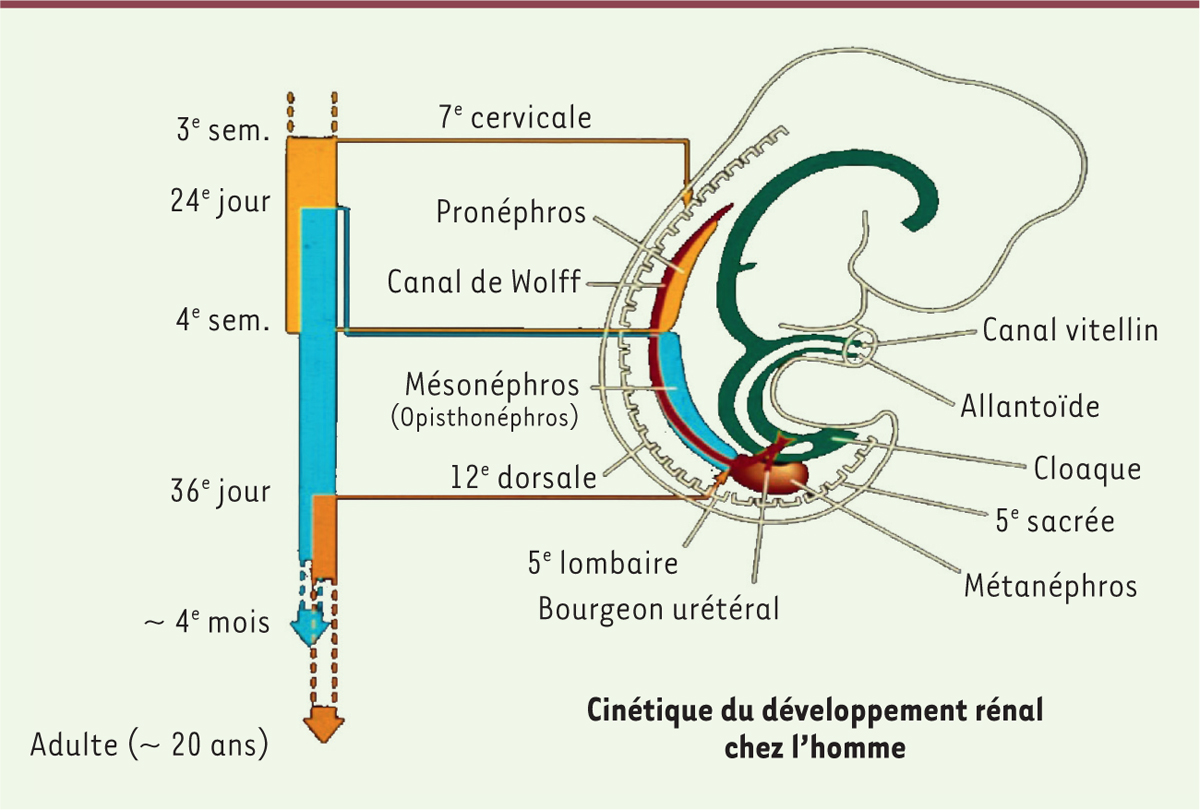
C’est chez les mammifères que le développement rénal prend toute son ampleur
(Figure 1). On observe
initialement, selon une organisation spatio-temporelle précise, un rein céphalique,
nommé pronéphros. Ce rein est à l’origine de la formation du canal de Wolff qui
induira, le long de son parcours dans le mésoderme intermédiaire, le développement
du rein thoracique encore nommé mésonéphros. Le canal de Wolff continue sa
progression vers la partie postérieure du fœtus humain. Il émettra au cours de la
cinquième semaine de gestation, un bourgeon inducteur (bourgeon urétéral) qui
induira dans le blastème métanéphrogène la formation du rein définitif des
mammifères : le métanéphros. C’est dans ce rein que se différencient les unités
filtrantes que l’on appelle néphrons. Il y a environ 900 000 néphrons par rein, mais
ce nombre varie en fonction du développement intra-utérin, de l’environnement du
fœtus et de son poids à la naissance. Un faible poids de naissance est en effet
associé à une réduction du nombre de néphrons par rein, qui devient alors plus
sensible aux maladies rénales aux cours de sa vie [1].
 | Figure 1.
Cinétique du développement rénal chez l’homme.
|
Des mutations, impliquant actuellement plus de 50 gènes, peuvent perturber le
développement et la différenciation du rein, en particulier au niveau de la barrière
de filtration et des podocytes. Certains des allèles mutés sont à l’origine d’une
protéinurie in utero ou/et de la formation d’un rein plus petit que
la normale [2]. Avec l’âge, un déclin de la taille totale des néphrons et de leur nombre apparaît.
Des changements tubulo-interstitiels, un épaississement de la membrane basale
glomérulaire et une augmentation de la glomérulosclérose sont aussi observés [3]. On note ainsi une
« certaine ressemblance » entre population âgée en bonne santé et population qui
présente une maladie rénale chronique. |
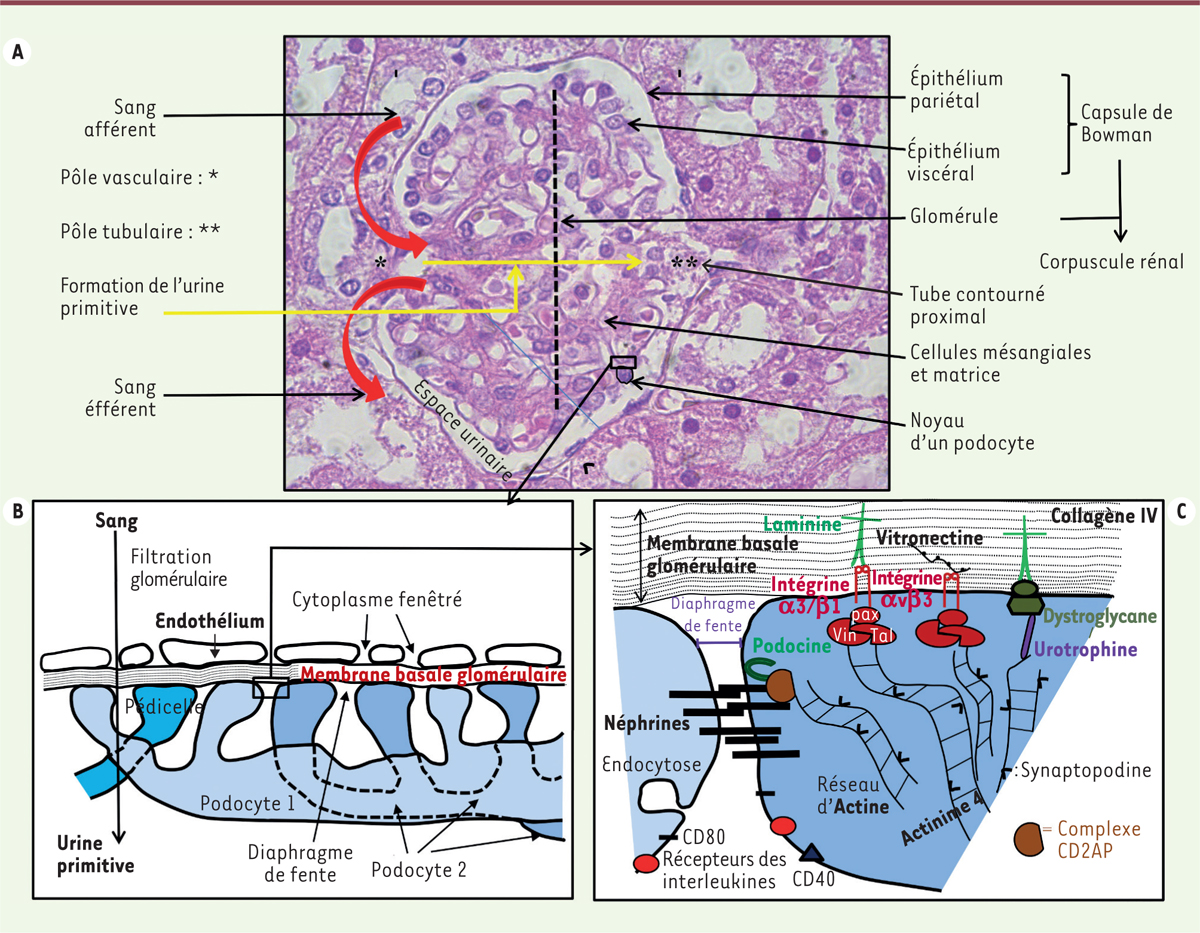
Chaque néphron reçoit le sang par une artériole afférente (subdivision terminale de
l’artère rénale), qui forme un peloton vasculaire appelé glomérule. Le sang repart
ensuite par une artériole efférente (Figure
2A). Les cellules endothéliales de ce glomérule présentent
un cytoplasme fenestré et l’endothélium est recouvert d’un glycocalyx dense. Il
filtre sélectivement le sang. Le glomérule est enveloppé par la capsule de
Bowman1, l’ensemble constituant le
corpuscule rénal. Le versant externe de cette capsule est constitué d’un épithélium
pariétal qui fait face à un épithélium viscéral, composé de cellules originales -
les podocytes - qui déterminent en grande partie la capacité de filtration de cet
organe. Chez l’adulte, on compte entre 500 et 600 podocytes par corpuscule. Ils
possèdent des pédicelles enchevêtrés les uns dans les autres, ne laissant qu’un
espace de 40 nm entre eux, et sont recouverts de molécules spécialisées dans
l’adhérence cellulaire (podocine, néphrine, etc.). Cet espace constitue ce que l’on
nomme le diaphragme de fente (Figures
2B, C et 3). Ces podocytes sont doués de très nombreuses
propriétés. Ils ont en effet des propriétés de cellules présentatrices d’antigènes,
d’endocytose, de contraction (via l’actine du cytosquelette),
d’adhérence à la membrane basale glomérulaire (en particulier par les intégrines
a3b1 et avb3), de filtration sélective des molécules au niveau du diaphragme de
fente, selon leur charge et leur taille (les protéines de masses moléculaires
supérieures à 65-68 000 daltons - comme l’albumine – sont en effet arrêtées).
 | Figure 2. A. Histologie d’un glomérule (Gl) sain chez
l’homme (coloration hémalun/éosine x630). Le
sang arrive au Gl par l’artériole afférente, il est distribué aux
capillaires glomérulaires soutenus par les cellules mésangiales et la
matrice qu’elles produisent. Le cytoplasme fenestré des cellules
endothéliales des capillaires est orienté vers la membrane basale
glomérulaire (MBG) localisée directement à leur contact. Les podocytes
reposent sur cette MBG. L’ultrafiltration du sang à travers ces
différentes barrières donne naissance à l’urine primitive déversée dans
l’espace urinaire et recueillie au pôle tubulaire à l’opposé du pôle
vasculaire. L’ultrafiltat sera évacué par le tube contourné proximal. Le
sang quitte le Gl par l’artériole efférente. B. Les
pédicelles enchevêtrés des podocytes de l’épithélium viscéral de
la capsule de Bowman sont en contact avec la MBG et délimitent
entre eux l’espace de filtration ou diaphragme de
fente. L’autre versant de la MBG est tapissé par
l’endothélium du Gl qui limite l’interface sanguine.
C. Représentation de quelques molécules qui
interviennent au niveau du diaphragme de fente et de la surface
basale des podocytes. Le composant majeur du
diaphragme est la néphrine. Ces molécules présentent des interactions
entre elles et une molécule en forme de harpon: la podocine. Ce complexe
moléculaire est lié au cytosquelette d’actine par un complexe
intracytoplasmique (non détaillé) déterminé par la protéine associée à
CD2 (CD2AP). Le réseau d’actine est régulé en particulier par
l’a-actinine-4 mais aussi par la synaptopodine. Au niveau de la surface
basale, les molécules d’adhérence telles que l’intégrine a3b1 et
l’a-dystroglycane sont liées à la laminine tandis que l’intégrine avb3
est associée à la vitronectine dans la MBG. C’est la sous-unité b des
intégrines qui intervient. Ces intégrines sont couplées au réseau
d’actine par le complexe taline/vinculine/paxilline tandis que
l’a/b-dystroglycane est liée à l’actine par la molécule d’urotrophine.
Les podocytes expriment à leur surface des récepteurs d’interleukines et
les molécules CD40 et CD80. Ils sont aussi capables d’endocytose. |
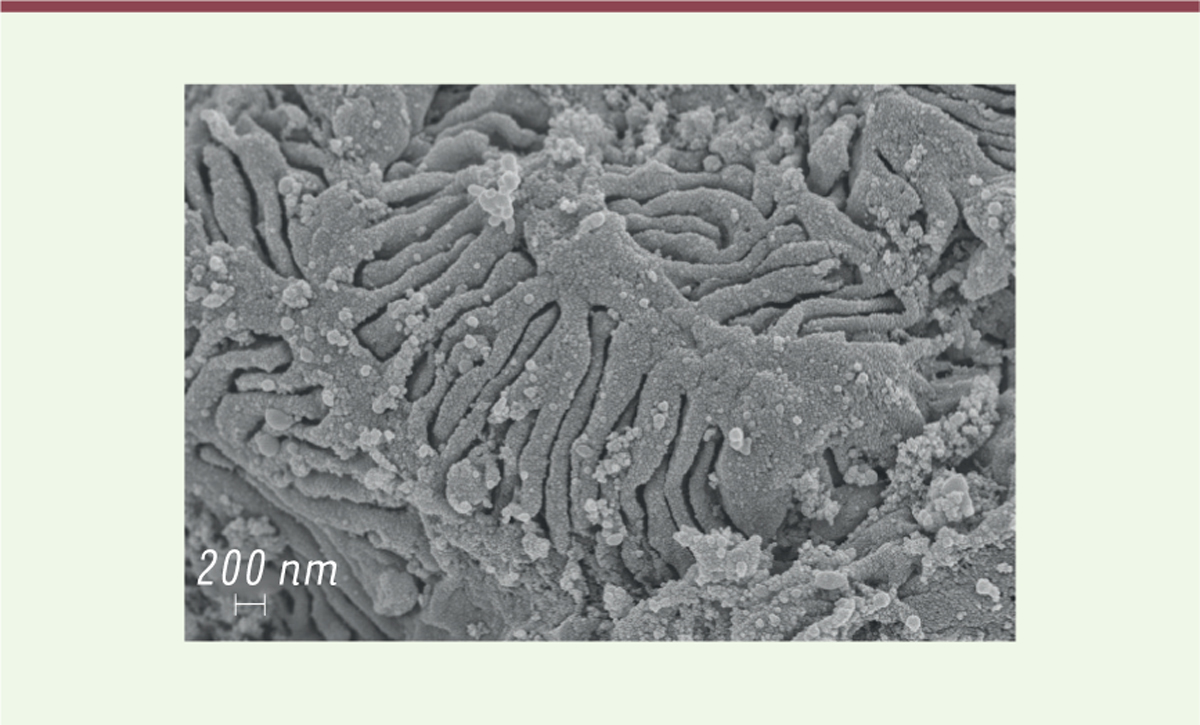
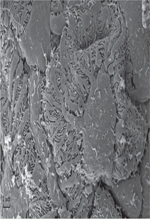
 | Figure 3.Microscopie électronique à balayage d’un rein normal
montrant les podocytes avec leurs pédicelles enchevêtrés et les
diaphragmes de fente. Comparer avec la
Figure
2B. |
Les podocytes sont ancrés, via leurs pédicelles, dans la membrane
basale des glomérules, synthétisée par les podocytes eux-mêmes (collagène IV
sous-unités a3,4,5 disposé au centre de cette membrane) et par les cellules
endothéliales (collagène IV sous-unités a1,2 disposé du côté endothélial de la
basale). Cette structure est associée à d’autres molécules, comme les
protéoglycanes, qui lui confèrent des propriétés anioniques responsables de la
sélectivité de charge lors de la filtration rénale. Le filtrat glomérulaire passe
ainsi, à partir du sang artériel, au travers de l’ensemble de ces tissus, et atteint
la chambre urinaire, délimitée par la capsule de Bowman. On parle alors d’urine
primitive (Figure 2A, B). Un tissu de soutien, appelé
mésangium, constitué de cellules mésangiales, tapisse l’intérieur des glomérules.
Ces cellules sont capables de se contracter. Elles produisent de la matrice
extracellulaire et sont douées de phagocytose. |
Deux activités caractérisent la physiologie rénale. L’une contrôle, par les
mécanismes de filtration glomérulaire et de réabsorption/sécrétion au niveau de
différentes régions des néphrons, la concentration minérale du sang, l’équilibre
acido/basique, l’excrétion des déchets solubles et le volume sanguin. L’autre repose
sur la capacité du rein à fonctionner comme une glande hormonale. Le rein produit en
effet l’érythropoïétine, qui est nécessaire à la synthèse des globules rouges, la
1-25 (OH)2 vitamine D, qui contrôle la concentration sanguine de calcium, et la
rénine, impliquée dans la régulation de la pression artérielle. Ce petit organe de
12 cm joue donc de très nombreux rôles dans la physiologie générale et les 14 (au
moins) types cellulaires différents constitutifs d’un néphron sont sollicités afin
d’établir l’homéostasie nécessaire à la vie de l’organisme, quelles que soient les
variations d’environnement auxquelles il est confronté. |
Les pathologies touchant le rein sont classées selon les différentes structures
histologiques qu’elles altèrent : glomérule/corpuscule, tubules, tissu interstitiel,
vaisseaux. C’est environ 10 % de la population qui est affectée par une maladie
rénale chronique et, pour les individus de 65 ans et plus, la prévalence est de 20 %
[4]. Le risque d’évoluer
vers la phase terminale reste inférieur à 1 % chez les patients de moins de 40 ans
mais supérieur ou égal à 8 % chez les patients âgés de 65 ans et plus. Nous nous
attacherons ici à développer les atteintes glomérulaires et plus particulièrement le
syndrome néphrotique idiopathique (SNI) qui comporte essentiellement deux entités,
les lésions glomérulaires minimes (LGM ou minimal change disease)
et la hyalinose (ou glomérulosclérose) segmentaire et focale (HSF ou FSGS). En dépit
de l’identification de nombreux facteurs (hypertension artérielle, hyperlipidémie,
obésité, infections, médicaments, mutations géniques) qui peuvent conduire à la HSF,
c’est approximativement 80 % des cas qui sont d’origine idiopathique [4]. Ces SNI représentent 15 à 30 % des
glomérulopathies de l’adulte [5] et 85 à 90 % de celles de l’enfant [6] (→).
(→) Voir la Synthèse de V. Audard et al.,
m/s n° 10, octobre 2008, page 853, et la Nouvelle de S.Y.
Zhang et al., m/s n° 6-7, juin-juillet 2010,
page 592
Chez les enfants, l’incidence du syndrome néphrotique varie beaucoup selon le pays
d’origine ou l’ethnie, de 1,15 à 16,9 pour 100 000 enfants [7]. |
Les lésions glomérulaires minimes Les lésions glomérulaires minimes (LGM) représentent la cause la plus fréquente du
syndrome néphrotique chez l’enfant (70 à 90 % des cas chez les moins de 10 ans et
50 % pour les plus âgés [8]),
avec un pic de fréquence situé entre 2 et 6 ans. Mais les LGM sont aussi la cause de
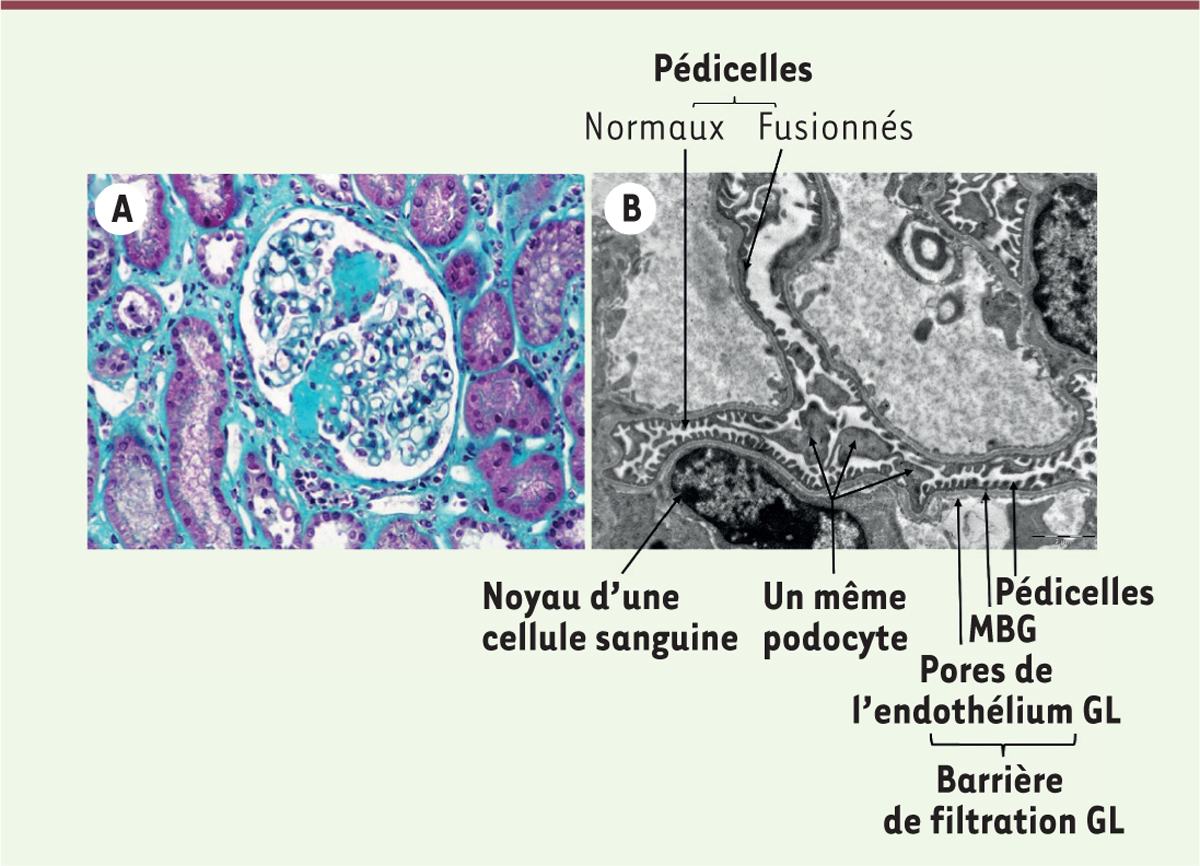
syndrome néphrotique chez les adultes pour 10 à 20 % des cas [9]. Elles sont caractérisées par une fusion
et/ou l’effacement des pédicelles des podocytes, avec une hyperplasie des
microvillosités, que l’on ne repère pas en microscopie optique, où les corpuscules
rénaux paraissent normaux. Les anomalies ne sont observables qu’en microscopie
électronique (Figure 4B). Ces
lésions sont responsables principalement d’une protéinurie massive (plus de
3,5 g/jour chez l’adulte), en particulier d’une fuite de lipoprotéines, d’où l’autre
appellation de cette affection, « néphrose lipoïdique », et d’un œdème interstitiel.
La fonction rénale est préservée, on n’observe ni hypertension ni hématurie. Ces LGM
répondent aux corticothérapies de façon spectaculaire (pour plus de 90 % des cas).
Ainsi, en dépit des rechutes possibles, l’avenir de ces enfants est bon : le risque
de progression vers une maladie rénale chronique, 10 ans après le diagnostic, est en
effet estimé à moins de 5 % [10].
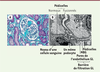 | Figure 4. A. Microscopie optique d’un rein présentant une HSF où l’on
peut voir un glomérule abîmé par la fibrose
(coloration au trichrome de Masson x10). B. Microscopie
électronique d’une coupe de rein à LGM montrant l’aspect des
pédicelles des podocytes. Dans différentes
zones, ces pédicelles sont fusionnés. Cette photo montre aussi l’aspect
de la MBG et de l’endothélium à cytoplasme fenestré des capillaires
glomérulaires. GL : glomérulaire ; MBG : membrane basale
glomérulaire. |
|
La hyalinose segmentaire et focale Dans la hyalinose segmentaire et focale (HSF), la sclérose n’affecte qu’un secteur du
glomérule, d’où le terme de « segmentaire », et seulement certains glomérules, ce
qui explique le terme de « focal ». Ce syndrome néphrotique est directement
observable en microscopie optique (Figure
4A). La classification de Columbia a établi 5 sous-types
morphologiques de HSF selon la présentation histologique de l’anomalie glomérulaire
[11]. Dans les
glomérules atteints, les cellules mésangiales prolifèrent et le dépôt de matrice
extracellulaire est plus ou moins important [12]. Les podocytes ont une structure altérée (leur réseau
d’actine est modifié), leur nombre diminue - par mort cellulaire par
apoptose/nécrose, ou migration par dissociation des complexes d’adhérence focaux et
phosphorylation de VASP (vasodilator-stimulated-phosphoprotein).
Les podocytes restants deviennent hypertrophiques, ce qui favorise le recouvrement
de la surface des capillaires glomérulaires. Les corpuscules rénaux, moins nombreux,
présentent, par adaptation, un plus grand diamètre associé à une adhérence plus ou
moins importante du glomérule à la pariétale de la capsule (synéchie) aux niveaux
laissés vacants après disparition des podocytes. Cette situation semble activer les
cellules épithéliales pariétales de la capsule, qui peuvent se substituer aux
podocytes perdus (rôle bénéfique), ou envahir le glomérule et sécréter de la matrice
extracellulaire (rôle délétère) [13]. Un phénomène de fusion et/ou d’effacement des pédicelles des
podocytes est aussi observé. Du point de vue clinique, ce syndrome néphrotique est
caractérisé par une protéinurie abondante (supérieure à 3,5 g/24 h), un syndrome
œdémateux et peut être associé à une hypoalbuminémie, une hyperlipidémie et une
lipidurie. Le syndrome œdémateux correspond à un œdème interstitiel ; il est présent
chez tous les individus atteints d’un syndrome néphrotique. Parmi les nombreuses
protéines retrouvées dans les urines des patients, on observe des protéases dont
certaines peuvent modifier les canaux sodium des épithéliums des tubes distaux et
collecteurs. Ces canaux deviennent actifs, ce qui déclenche une forte réabsorption
de sodium à ces niveaux. Chez le patient néphrotique, ce processus est l’une des
explications à l’origine de la rétention importante de sodium responsable d’une
augmentation du volume des fluides et d’une fuite du liquide en excès vers les
tissus interstitiels (œdème). L’incidence de ce syndrome néphrotique, chez l’adulte,
semble augmenter depuis les dernières décennies : elle oscillerait aujourd’hui entre
15 et 25 % [14]. Les HSF
sont résistantes aux corticoïdes pour environ 70 % d’entre elles [15]. De manière générale, les syndromes
néphrotiques idiopathiques résistants aux stéroïdes sont plus susceptibles de
progresser vers une HSF et une insuffisance rénale terminale que les syndromes qui y
sont sensibles [15]. C’est en particulier le
cas chez les enfants, dont environ 50 % d’entre eux ont un risque de progresser vers
une insuffisance rénale terminale [16]. |
Lésions glomérulaires minimes versus hyalinose segmentaire et focale La perméabilité glomérulaire chez les patients atteints de hyalinose segmentaire et
focale (HSF) est supérieure à celle des patients atteints de lésions glomérulaires
minimes (LGM) et augmente avec la fréquence des rechutes [17]. Avec l’avènement de la biopsie, au milieu
du XXe siècle, le développement de l’immunofluorescence et de la
microscopie électronique, le diagnostic du syndrome néphrotique a été révolutionné.
Des biopsies réalisées de façon répétée au cours de la maladie révèlent ainsi que
les altérations des podocytes peuvent progresser des LGM jusqu’aux HSF récurrentes
[18]. Tejani et
al. [19] ont
suivi des LGM avec de fréquentes rechutes en utilisant des biopsies réalisées chez
des enfants, 1,5 an après le début de la maladie, puis 4,5 ans plus tard chez ceux
qui souffrent de récidives. Les analyses histologiques de ces biopsies montrent que
55 % d’entre elles correspondent alors à des HSF. Un tel chevauchement entre LGM et
HSF est également observé dans les modèles animaux. La sévérité des lésions est liée
au degré de perte des podocytes : quand il est supérieur à 20 %, une protéinurie
soutenue se développe, tandis qu’elle est transitoire si ce pourcentage est
inférieur [12]. Les HSF seraient ainsi une
conséquence de la diminution du nombre des podocytes, quand celle-ci dépasse un
seuil critique. La cinétique d’évolution est donc la suivante : protéinurie,
effacement des pédicelles, diminution du nombre de podocytes, adhérence du glomérule
à la capsule de Bowman et, finalement, sclérose. Comme RJ Maas, on peut ainsi
admettre que « minimal change disease and idiopathic HSF are manifestations
of the same disease » [20]. Les deux syndromes avaient été distingués dans les années
1970, mais les travaux que nous venons de présenter suggèrent que LGM et HSF
idiopathiques sont en fait des phénotypes différents d’une même maladie. Dans la
suite de cet article, nous considérerons donc ces deux syndromes comme une
progression dans le temps de la pathologie glomérulaire avec des lésions extensives
des podocytes. |
L’hypothèse des facteurs circulants Historique La responsabilité des facteurs circulants extrarénaux dans l’apparition des
syndromes néphrotiques idiopathiques a été proposée pour la première fois par
Gentili et al. en 1954. Une expérience particulièrement
audacieuse, mais éthiquement discutable, a été réalisée par ces auteurs. En
administrant du plasma d’enfants présentant une LGM à des enfants exempts de
syndrome néphrotique, ils ont pu observer l’induction d’une légère protéinurie
chez ces derniers ! [ 21]. Dans les années 1970, de nombreuses études cliniques font état de
HSF récurrentes après des transplantations rénales. Hoyer et
al., en 1972 [ 22], décrivent deux enfants et une femme présentant un syndrome
néphrotique idiopathique résistant aux stéroïdes, qui, après deux à six ans,
sont en insuffisance rénale terminale. Après transplantations, ces patients ont
récidivé. Les auteurs remarquèrent que les altérations glomérulaires présentées
par ces patients correspondaient à des HSF et commençaient à apparaître dans la
zone de contact entre le cortex rénal et la médullaire, mais sans évidence, sur
les biopsies, de signe de rejet. Cette cinétique médullo-corticale avait déjà
été remarquée par Rich et al. en 1957 [ 23]. Ces résultats ont été le point de
départ d’une réflexion sur l’implication de facteurs circulants à l’origine du
syndrome néphrotique idiopathique [ 24]. Couser et Shankland font en effet remarquer que deux
des trois patients suivis par Hoyer n’ont pas de sclérose initiale, et que les
trois présentent une LGM sur les biopsies des transplants initiaux, au début de
l’apparition du syndrome [ 24]. Il s’agit
là d’un argument indiscutable indiquant que les facteurs circulants peuvent
induire une LGM aussi bien qu’une HSF, et donc que ces deux lésions sont
probablement liées pathogénétiquement. Cet argument a été renforcé par un cas de
rémission de la protéinurie, après transplantation de reins d’un donneur
présentant une LGM prouvée par biopsie, chez un patient exempt de LGM et
HSF. D’autres observations confirment la présence de facteurs circulants responsables
des lésions glomérulaires et/ou podocytaires :
-
La rémission de la protéinurie par plasmaphérèse [25], ou
immunoadsorption sur protéine A2 [26], ou sur anticorps anti-immunoglobulines humaines, ce
qui suggère un lien entre facteurs circulants et cellules
immunitaires [27].
-
Le sérum, le plasma ou des fractions de plasma de patients atteints
de HSF récurrentes injectés dans l’aorte de rats induisent une
protéinurie [28] et une augmentation de la perméabilité à l’albumine
sur des glomérules isolés [29].
-
Les mères HSF peuvent transmettre la maladie à leurs enfants, et la
protéinurie de ces enfants guérit spontanément en quelques semaines
après l’accouchement [30].
• Chez un patient HSF qui a reçu un transplant rénal, une protéinurie massive
s’est déclarée et n’a pas pu être soignée. Le greffon a alors été re-transplanté
à un patient diabétique et cette nouvelle greffe a été un succès [31]. Le rôle des lymphocytes Shalhoub et al. montrent en 1974 [ 32] pour la première fois que ces facteurs
circulants peuvent être associés aux lymphocytes T (LT). Ces résultats découlent
d’observations cliniques : (1) l’induction par le virus de la rougeole (à
l’origine d’une déplétion des LT) d’une rémission spectaculaire du syndrome
néphrotique - des patients qui présentaient des cas difficiles de syndrome ont
ainsi été délibérément infectés par ce virus [ 33] ! ; (2) la thérapie utilisée contre
certains lymphomes résout le syndrome néphrotique que présentent parfois ces
patients ; (3) les rémissions du syndrome induites par les stéroïdes qui
entraînent une déplétion préférentielle des LT. En 1975, Lagrue et al. [34] montrèrent que les lymphocytes T produisent une
cytokine qui agit comme un facteur de perméabilité des vaisseaux (VPF), et avec
Shalhoub et al., furent les premiers à suggérer la présence de
ces facteurs de perméabilité dans les LGM. Enfin, la cyclosporine A, qui est
utilisée dans le traitement de la protéinurie, agit, pour partie, en induisant
une immunosuppression via la calcineurine et son action sur les
lymphocytes T. Le rôle des lymphocytes B a été découvert fortuitement chez un patient traité par
le rituximab (un anticorps anti-CD20) pour un purpura thrombocytopénique
idiopathique, et chez qui une rémission de la protéinurie a été observée [35]. Le rituximab a
également une action directe sur les podocytes : il réduit en effet la
diminution de l’activité de la SMPDL3b (sphingomyelinase-like
phosphodiesterase 3b) observée chez les patients présentant une
hyalinose segmentaire et focale, ce qui stabilise le cytosquelette d’actine et
la morphologie des podocytes, ceux-ci restant alors associés à la membrane
basale glomérulaire et ne subissant plus l’apoptose [36]. Dans le cas du lymphome de Hodgkin, lorsqu’il est associé à un syndrome
néphrotique idiopathique, une expression du gène c-mip
(c-maf inducing protein) est observée dans les cellules
tumorales mais aussi dans les podocytes. Cette double expression n’est pas
observée en l’absence de syndrome néphrotique. Or, des souris transgéniques qui
surexpriment le gène c-mip dans les podocytes développent une
protéinurie massive sans lésions inflammatoire ni infiltration cellulaire. La
protéine codée par c-mip interfère avec la signalisation du
podocyte en inactivant la protéine tyrosine kinase Fyn qui ne phosphoryle plus
la néphrine, ce qui conduit à une désorganisation du cytosquelette, un
effacement des pédicelles et à une fuite importante de protéines [37]. Les récepteurs membranaires CD40 et CD80 (B7-1) présents sur les lymphocytes mais
aussi sur les podocytes, ont été impliqués dans le syndrome néphrotique
idiopathique. Les anticorps anti-CD40, présents dans le sérum des patients HSF
et dans les biopsies glomérulaires, altèrent le cytosquelette des podocytes de
ces patients et augmentent leur perméabilité glomérulaire [38]. L’expression de CD80 est plus
élevée au cours des rechutes de LGM ; elle se normalise après rémission [39]. CD80, exprimé par
les podocytes dans les biopsies de reins des patients LGM et HSF, favorise leur
migration en inhibant leur adhérence résultant de la liaison de la taline à
l’intégrine b1 (Figure
2C). L’abatacept, une protéine de fusion composée du domaine
extracellulaire de CTLA-4 (cytotoxic T-lymphocyte antigen 4)
fusionné à une région Fc d'IgG1 humaine, peut induire, en se liant à CD80, une
rémission partielle ou totale de la HSF [40]. D’autres molécules ont été proposées pour être des
facteurs circulants, comme l’interleukine 13 (IL-13) qui provoque chez le rat la
fusion de 80 % des pédicelles et la diminution de l’expression par les podocytes
des gènes codant la néphrine, la podocine, et le dystroglycane [41] ; la CLCF-1
(cardiotrophine-like cytokine-1), un membre de la famille
des IL-6, qui diminue l’expression de la néphrine dans les glomérules [42] ; le TNF-a
(tumor necrosis alpha) qui est en concentration élévée dans
le sang des patients présentant un syndrome néphrotique et dont le taux se
normalise après rémission [43] ; l’hémopexine (Hx), une protéine à activité sérine-protéase
produite par le foie découverte dans les années 1980-1990 [44], qui modifie la composition de
la membrane basale glomérulaire et l’organisation des filaments d’actine,
dépendant de la néphrine, dans les podocytes. Jusqu’à présent, la présence
d’hémopexine n’a été révélée que chez les patients LGM. Les autres facteurs circulants Nous avons découvert dans le sérum des patients HSF, la protéine CASK (ou kinase
sérine/thréonine dépendante régulée par le complexe calcium/calmoduline)
sécrétée par une catégorie de cellules sanguines (probablement les macrophages)
et dont la présence, à partir d’une certaine concentration, modifie le réseau
d’actine des podocytes, provoque une fusion de leurs pédicelles et une
protéinurie [ 54].
Actuellement, la molécule réceptrice de l’urokinase (uPAR) suscite un grand
intérêt. Il s’agit d’une glycoprotéine ancrée dans la membrane cellulaire des
leucocytes (rarement les lymphocytes), des cellules endothéliales et des
podocytes, par une structure glycosylphosphatidylinositol (GPI). Différentes
enzymes peuvent cliver l’ancrage GPI de uPAR produisant la forme soluble de la
protéine - suPAR- qui est alors libérée dans le sang [ 45]. suPAR induit un effacement des
pédicelles, un détachement des podocytes de la membrane basale glomérulaire et
une protéinurie via l’activation de l’intégrine avb3 associée à
la vitronectine de la membrane basale glomérulaire [ 46] (Figure 2C). Un autre facteur a également été proposé :
l’angiopoïétine-like 4. Elle est sécrétée par les podocytes sous une forme
hyposialylée dont la surexpression a un effet protéinurique chez les LGM [ 47]. |
Les facteurs circulants : trésor ou méprise Les différents facteurs proposés ne sont pas spécifiques des syndromes néphrotiques
idiopathiques. suPAR peut être associée à de nombreuses maladies du foie, des
infections, au lupus érythémateux disséminé, l’athérosclérose, etc., maladies qui ne
comportent pas ou peu de protéinurie mais dans lesquelles sa concentration sérique
est augmentée. Certains patients développent une HSF récurrente en l’absence de taux
circulants de suPAR élévés. Il n’y a ainsi pas de corrélation directe entre le
niveau circulant de ce facteur et l’intensité de la protéinurie [48]. On ne sait pas non plus si
l’action de ces différents facteurs circulants dépend du type de HSF [49]. Autre difficulté, la
plasmaphérèse réalisée chez les patients souffrant de HSF idiopathiques afin
d’épurer leur sang, présente un taux de réussite variable [50]. Les facteurs circulants ne distinguent pas
entre promoteurs et inhibiteurs de la perméabilité glomérulaire. Les facteurs
inhibiteurs présents dans le sérum d’individus sains, peuvent être retrouvés dans
l’urine de patients néphrotiques [51]. Ils pourraient se lier aux facteurs de perméabilité ou les dégrader
par voie enzymatique. Par exemple, la fuite dans l’urine des inhibiteurs de
l’activation de l’hémopexine, favoriserait l’apparition de sa forme active et le
développement de la pathologie. Le rôle de ces facteurs circulants serait en partie
secondaire à la protéinurie. Les concentrations, en tenant compte de la valeur de la filtration glomérulaire, des
facteurs circulants (comme suPAR ou l’hémopexine) ne sont pas significativement
différentes chez les patients LGM et chez les patients HSF, voire même chez les
individus sains [52]. Les
rôles pathologiques de ces facteurs pourraient être associés à leur état de
glycosylation à l’origine de caractéristiques fonctionnelles différentes (par
exemple, la formation de dimères pour suPAR). Ces facteurs pourraient également
favoriser l’influx de calcium au niveau des canaux TRPC-6 (transient
receptor potential channel-6) des podocytes et ainsi provoquer
l’activation de la calcineurine podocytaire responsable d’une déphosphorylation de
la synaptopodine. Sous cette forme, la synaptopodine qui n’est plus protégée de
l’action protéolytique de la cathepsine-L, sera dégradée. L’association entre
synaptopodine et actine, nécessaire à la stabilité du réseau d’actine (Figure 2C), n’étant plus assurée,
une protéinurie apparaît [53]. En conditions physiologiques, la protéinurie peut être ajustée
afin, par exemple, d’augmenter la clairance d’antigènes délétères lors d’une
infection ou d’épisodes allergiques. Cette réponse repose sur les lymphocytes T
régulateurs, mais aussi sur les podocytes par l’intermédiaire des interleukines
qu’ils produisent. L’ensemble de ces facteurs qui présentent chacun des
caractéristiques originales, pourrait participer à un « ballet » moléculaire, dont
chaque intervenant entrerait « dans la danse » avec une cinétique temporelle et
spatiale particulières. Dans ce « ballet », se formeraient des complexes
moléculaires transitoires, dont la localisation, la concentration, la durée de
présence et le moment de leur sécrétion, conduiraient aux différents profils
histo-pathologiques que l’on observe, amplifieraient leurs manifestations, voire
rendraient les podocytes plus sensibles aux modifications de leur environnement
(infections, médicaments, etc.). Une équipe allemande [55]
vient de publier un travail élégant fondé sur la construction d’une continuité de la
circulation sanguine entre deux larves de poissons zebrafish
(parabiose). Chez l’un des zebrafish, le gène de la néphronectine
(un composant de la membrane basale glomérulaire) a été invalidé, ce qui induit une
protéinurie. Chez l’autre poisson (normal) se développe une protéinurie par
effacement des pédicelles des podocytes. La protéinurie induit donc la production de
facteurs circulants qui sont passés dans le zebrafish non traité ou
bien l’absence de facteurs indispensables perdus sous l’effet de cette protéinurie.
Conclusion : « la protéinurie déclenche la protéinurie » par un phénomène de
feedback positif et pourrait exacerber d’autres maladies
rénales. L’origine de ces pathologies rénales, suivant les formes différentes que prennent le
syndrome néphrotique idiopathique et les multiples facteurs circulants responsables
de son apparition, reste difficile à comprendre. Si les facteurs circulants peuvent
modifier la structure des podocytes et ainsi conduire à des anomalies fonctionnelles
responsables d’un syndrome néphrotique idiopathique, la cause initiale de ce
syndrome pourrait être reliée à une réponse anormale des podocytes à des évènements
déclencheurs communs, tels que des infections ou des inflammations. Il existe sans
doute des caractéristiques intrinsèques aux podocytes qui favoriseraient leur
vulnérabilité. Désormais, il semble que le mécanisme ait une origine
multifactorielle et ne soit pas associé à une seule molécule circulant dans le
plasma des patients. Ces facteurs circulants, dont on parle depuis plus de 40 ans,
ressemblent de plus en plus à l’Arlésienne de Bizet, toujours attendue, jamais
trouvée… |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Nous sommes redevables au Docteur Michaël Trichet (Institut de Biologie, Paris-Seine)
pour son expertise et son amicale attention en microscopie électronique, à la Région
Île-de-France, Sorbonne-Université et au CNRS, ainsi qu’au Professeur Djillali
Sahali (Hôpital Henri Mondor, Créteil) pour sa relecture critique du manuscrit, et
au Docteur Sophie Ferlicot (CHU Bicêtre, Anatomie-Pathologique) pour sa
participation à l’iconographie de l’HSF. Nous remercions Madame Véronique Mamessier
pour son aide en histologie.
Ce travail est supporté par la Fondation du rein sous égide de la Fondation pour la
recherche médicale. Grant numéro R16099LL de H.K. Lorenzo.
|
Footnotes |
1.
Puelles
VG
,
Hoy
WE
,
Hughson
MD
, et al.
Glomerular number and size variability and risk for kidney
disease . Curr Opin Nephrol Hypertens.
2011; ; 20 :
:7.–15. 2.
Cil
O
,
Perwad
F
. Monogenic causes of proteinuria in
children . Front Med.
2018; ; 5 : :55.. 3.
O’Sullivan
ED
,
Hughes
J
,
Ferenbach
DA
. Renal aging: causes and
consequences . J Am Soc Nephrol.
2017; ; 28 :
:407.–420. 4.
D’Agati
VD
,
Kaskel
FJ
,
Falk
RJ
. Focal segmental
glomerulosclerosis . N Engl J Med.
2011; ; 365 :
:2398.–2411. 5.
Audard
V
,
Lang
P
,
Sahali
D
. Pathogénie du syndrome néphrotique à lesions
glomérulaires minimes . Med Sci (Paris).
2008; ; 24 :
:853.–858. 6.
Zhang
SY
,
Audard
V
,
Lang
P
,
Sahali
D
. Mécanismes moléculaires du syndrome néphrotique
idiopathique à rechutes: rôle de c-mip dans les dysfonctions
podocytaires . Med Sci (Paris).
2010; ; 26 :
:592.–596. 7.
Banh
TH
,
Hussain-Shamsy
N
,
Patel
V
, et al.
Ethnic differences in incidence and outcomes of childhood
nephrotic syndrome . Clin J Am Soc Nephrol.
2016; ; 11 :
:1760.–1768. 8.
Meyrier
A
,
Niaudet
P
. Acute kidney injury complicating nephrotic
syndrome of minimal change disease . Kidney
Int.
2018; ; 94 :
:861.–869. 9.
Uezono
S
,
Hara
S
,
Sato
Y
, et al.
Renal biopsy in elderly patients: a clinicopathological
analysis . Renal Failure.
2006; ; 28 :
:549.–555. 10.
Mendonca
AC
,
Oliveira
EA
,
Froes
BP
, et al.
A predictive model of progressive chronic kidney disease in
idiopathic nephrotic syndrome . Pediatr
Nephrol.
2015; ; 30 :
:2011.–2020. 11.
Han
MH
,
Kim
YJ
. Practical application of Columbia classification
for focal segmental glomerulosclerosis . BioMed Res
Int.
2016; ; 2016 :
:9375753.. 12.
Wharram
BL
,
Goyal
M
,
Wiggins
JE
, et al.
Podocyte depletion causes glomerulosclerosis: diphtheria
toxin-induced podocyte depletion in rats expressing human diphtheria toxin
receptor transgene . J Am Soc Nephrol.
2005; ; 16 :
:2941.–2952. 13.
Smeets
B
,
Kuppe
C
,
Sicking
EM
, et al.
Parietal epithelial cells participate in the formation of
sclerotic lesions in focal segmental glomerulosclerosis .
J Am Soc Nephrol.
2011; ; 22 :
:1262.–1274. 14.
O’Shaughnessy
MM
,
Hogan
SL
,
Poulton
CJ
, et al.
Temporal and demographic trends in glomerular disease
epidemiology in the southeastern United States, 1986–2015 .
Clin J Am Soc Nephrol.
2017; ; 12 :
:614.–623. 15.
Savin
VJ
,
Sharma
M
,
Zhou
J
, et al.
Multiple targets for novel therapy of FSGS associated with
circulating permeability factor . BioMed Res
Int.
2017; ; 2017 :
:6232616.. 16.
Ehrich
JH
,
Geerlings
C
,
Zivicnjak
M
, et al.
Steroid-resistant idiopathic childhood nephrosis: overdiagnosed
and undertreated . Nephrol Dial Transplant.
2007; ; 22 :
:2183.–2193. 17.
Sharma
M
,
Zhou
J
,
Gauchat
JF
, et al.
Janus kinase 2/signal transducer and activator of transcription 3
inhibitors attenuate the effect of cardiotrophin-like cytokine factor 1 and
human focal segmental glomerulosclerosis serum on glomerular filtration
barrier . Transl Res.
2015; ; 166 :
:384.–398. 18.
Fogo
AB
. Causes and pathogenesis of focal segmental
glomerulosclerosis . Nat Rev Nephrol.
2015; ; 11 :
:76.–87. 19.
Tejani
A
,
Phadke
K
,
Nicastri
A
, et al.
Efficacy of cyclophosphamide in steroid-sensitive childhood
nephrotic syndrome with different morphological lesions .
Nephron.
1985; ; 41 :
:170.–173. 20.
Maas
RJ
,
Deegens
JK
,
Smeets
B
, et al.
Minimal change disease and idiopathic FSGS: manifestations of the
same disease . Nat Rev Nephrol.
2016; ; 12 :
:768.–776. 21.
Gentili
A
,
Tangheroni
W
,
Gelli
G
. Proteinuria caused by transfusion of blood from
nephrotic to non-nephrotic individuals . Minerva
Medica.
1954; ; 45 :
:603.–608. 22.
Hoyer
JR
,
Vernier
RL
,
Najarian
JS
, et al.
Recurrence of idiopathic nephrotic syndrome after renal
transplantation . Lancet.
1972; ; 2 :
:343.–348. 23.
Rich
AR
. A hitherto undescribed vulnerability of the
juxtamedullary glomeruli in lipoid nephrosis . Bull
Johns Hopkins Hosp.
1957; ; 100 :
:173.–186. 24.
Hoyer
JR
,
Vernier
RL
,
Najarian
JS
, et al.
Recurrence of idiopathic nephrotic syndrome after renal
transplantation. 1972 . J Am Soc Nephrol.
2001; ; 12 :
:1994.–2002. 25.
Dantal
J
,
Testa
A
,
Bigot
E
,
Soulillou
JP
. Effects of plasma-protein A immunoadsorption on
idiopathic nephrotic syndrome recurring after renal
transplantation . Ann Med Interne (Paris).
1992; ; 143 : (suppl 1)
:48.–51. 26.
Artero
ML
,
Sharma
R
,
Savin
VJ
,
Vincenti
F
. Plasmapheresis reduces proteinuria and serum
capacity to injure glomeruli in patients with recurrent focal
glomerulosclerosis . Am J Kidney Dis.
1994; ; 23 :
:574.–581. 27.
Dantal
J
,
Godfrin
Y
,
Koll
R
, et al.
Antihuman immunoglobulin affinity immunoadsorption strongly
decreases proteinuria in patients with relapsing nephrotic
syndrome . J Am Soc Nephrol.
1998; ; 9 :
:1709.–1715. 28.
Zimmerman
SW
. Increased urinary protein excretion in the rat
produced by serum from a patient with recurrent focal glomerular sclerosis
after renal transplantation . Clin Nephrol.
1984; ; 22 :
:32.–38. 29.
Savin
VJ
,
Sharma
R
,
Sharma
M
, et al.
Circulating factor associated with increased glomerular
permeability to albumin in recurrent focal segmental
glomerulosclerosis . N Engl J Med.
1996; ; 334 :
:878.–883. 30.
Lagrue
G
,
Branellec
A
,
Niaudet
P
, et al.
Transmission of nephrotic syndrome to two
neonates . Spontaneous regression. Presse
Med.
1991; ; 20 :
:255.–257. 31.
Gallon
L
,
Leventhal
J
,
Skaro
A
, et al.
Resolution of recurrent focal segmental glomerulosclerosis after
retransplantation . N Engl J Med.
2012; ; 366 :
:1648.–1649. 32.
Shalhoub
RJ
. Pathogenesis of lipoid nephrosis: a disorder of
T-cell function . Lancet.
1974; ; 2 :
:556.–560. 33.
Janeway
CA
. The management of nephrosis .
Pediatrics.
1948; ; 2 : :705.. 34.
Lagrue
G
,
Xheneumont
S
,
Branellec
A
, et al.
A vascular permeability factor elaborated from lymphocytes. I.
Demonstration in patients with nephrotic syndrome .
Biomedicine.
1975; ; 23 :
:37.–40. 35.
Benz
K
,
Dotsch
J
,
Rascher
W
,
Stachel
D
. Change of the course of steroid-dependent
nephrotic syndrome after rituximab therapy . Pediatr
Nephrol.
2004; ; 19 :
:794.–797. 36.
Yoo
TH
,
Pedigo
CE
,
Guzman
J
, et al.
Sphingomyelinase-like phosphodiesterase 3b expression levels
determine podocyte injury phenotypes in glomerular disease .
J Am Soc Nephrol.
2015; ; 26 :
:133.–147. 37.
Ollero
M
,
Sahali
D
. Inhibition of the VEGF signalling pathway and
glomerular disorders . Nephrol Dial
Transplant.
2015; ; 30 :
:1449.–1455. 38.
Delville
M,
Sigdel
TK,
Wei
C, et al.
A circulating antibody panel for pretransplant prediction of FSGS
recurrence after kidney transplantation . Sci Transl
Med.
2014;; 6 :
:256ra136.. 39.
Garin
EH
,
Mu
W
,
Arthur
JM
, et al.
Urinary CD80 is elevated in minimal change disease but not in
focal segmental glomerulosclerosis . Kidney
Int.
2010; ; 78 :
:296.–302. 40.
Yu
CC
,
Fornoni
A
,
Weins
A
, et al.
Abatacept in B7-1-positive proteinuric kidney
disease . N Engl J Med.
2013; ; 369 :
:2416.–2423. 41.
Lai
KW
,
Wei
CL
,
Tan
LK
, et al.
Overexpression of interleukin-13 induces minimal-change-like
nephropathy in rats . J Am Soc Nephrol.
2007; ; 18 :
:1476.–1485. 42.
McCarthy
ET
,
Sharma
M
,
Savin
VJ
. Circulating permeability factors in idiopathic
nephrotic syndrome and focal segmental glomerulosclerosis .
Clin J Am Soc Nephrol.
2010; ; 5 :
:2115.–2121. 43.
Raveh
D
,
Shemesh
O
,
Ashkenazi
YJ
, et al.
Tumor necrosis factor-alpha blocking agent as a treatment for
nephrotic syndrome . Pediatr Nephrol.
2004; ; 19 :
:1281.–1284. 44.
Bakker
WW,
Baller
JF, van
Luijk
WH. A
kallikrein-like molecule and plasma vasoactivity in minimal change disease.
Increased turnover in relapse versus remission .
Contrib Nephrol.
1988;; 67 :
:31.–6. 45.
Wei
C
,
Moller
CC
,
Altintas
MM
, et al.
Modification of kidney barrier function by the urokinase
receptor . Nat Med.
2008; ; 14 :
:55.–63. 46.
Kemeny
E
,
Mihatsch
MJ
,
Durmuller
U
,
Gudat
F
. Podocytes loose their adhesive phenotype in focal
segmental glomerulosclerosis . Clin Nephrol.
1995; ; 43 :
:71.–83. 47.
Clement
LC
,
Avila-Casado
C
,
Mace
C
, et al.
Podocyte-secreted angiopoietin-like-4 mediates proteinuria in
glucocorticoid-sensitive nephrotic syndrome . Nat
Med.
2011; ; 17 :
:117.–122. 48.
Sever
S
,
Trachtman
H
,
Wei
C
,
Reiser
J
. Is there clinical value in measuring suPAR levels
in FSGS? . Clin J Am Soc Nephrol.
2013; ; 8 :
:1273.–1275. 49.
Schwartz
MM
,
Evans
J
,
Bain
R
,
Korbet
SM
. Focal segmental glomerulosclerosis: prognostic
implications of the cellular lesion . J Am Soc
Nephrol.
1999; ; 10 :
:1900.–1907. 50.
Campbell
KN
,
Tumlin
JA
. Protecting podocytes: a key target for therapy of
focal segmental glomerulosclerosis . Am J
Nephrol.
2018; ; 47 : (suppl 1)
:14.–29. 51.
Sharma
R
,
Sharma
M
,
McCarthy
ET
, et al.
Components of normal serum block the focal segmental
glomerulosclerosis factor activity in vitro . Kidney
Int.
2000; ; 58 :
:1973.–1979. 52.
Harita
Y
,
Ishizuka
K
,
Tanego
A
, et al.
Decreased glomerular filtration as the primary factor of elevated
circulating suPAR levels in focal segmental
glomerulosclerosis . Pediatr Nephrol.
2014; ; 29 :
:1553.–1560. 53.
Faul
C
,
Donnelly
M
,
Merscher-Gomez
S
, et al.
The actin cytoskeleton of kidney podocytes is a direct target of
the antiproteinuric effect of cyclosporine A . Nat
Med.
2008; ; 14 :
:931.–938. 54.
Beaudreuil
S,
Zhang
X,
Florence
H, et al.
Circulating CASK is associated with recurrent focal segmental
glomerulosclerosis after transplantation . PLoS
One.
2019 ( sous presse.). 55.
Müller-Deile
J,
Schenk
H,
Schroder
P, et al.
Circulating factors cause proteinuria in parabiotic
zebrafish . Kidney Int.
2019
Mar 8. pii: S0085–2538(19)30232–7. doi: 10.1016/j.kint.2019.02.013.. |