| |
| Med Sci (Paris). 35(8-9): 699–702. doi: 10.1051/medsci/2019139.Traiter la dermatite atopique par les
probiotiques Induction de cellules dendritiques tolérogènes Noémie Lopez-Ramirez1* and Ingrid Masse2** 1Master Biologie Moléculaire et Cellulaire-M2 Parcours
Biologie de la Peau, Université Claude Bernard Lyon 1, Université de
Lyon, France. 2Centre de Recherche en Cancérologie de Lyon, CNRS UMR5286,
Inserm U1052, Université Lyon 1, Université de Lyon,
France. |

Équipe pédagogique
Beatrice Horard (Maître de Conférence, Université Lyon1)
beatrice.horard@univ-lyon1.fr
Ludivine Walter (Maître de Conférence, Université Lyon1)
ludivine.walter@univ-lyon1.fr
Edmund Derrington (Professeur, Université Lyon1)
Armelle Corpet (Maître de Conférence, Université Lyon1)
Fabien Chevalier (Maître de Conférence, Université Lyon1)
Aurore Rozière (Maître de Conférence, Université Lyon1)
Jérôme Lamartine (Professeur, Université Lyon1)
Benjamin Gibert (CR CNRS)
La dermatite atopique (DA) est une maladie allergique fréquente, avec une prévalence
d’environ 20%, caractérisée par une inflammation chronique de la peau [1]. Les symptômes de la DA sont
contraignants, pouvant inclure démangeaisons, rougeurs et lésions eczémateuses [1]. L’inflammation cutanée à l’origine des lésions
est une réponse impliquant principalement les lymphocytes Th2 (T helper
2) qui sécrètent des cytokines pro-inflammatoires telles que l’IL-4 (interleukine 4),
l’IL-5 ou l’IL-13 (Figure 1)
[1].
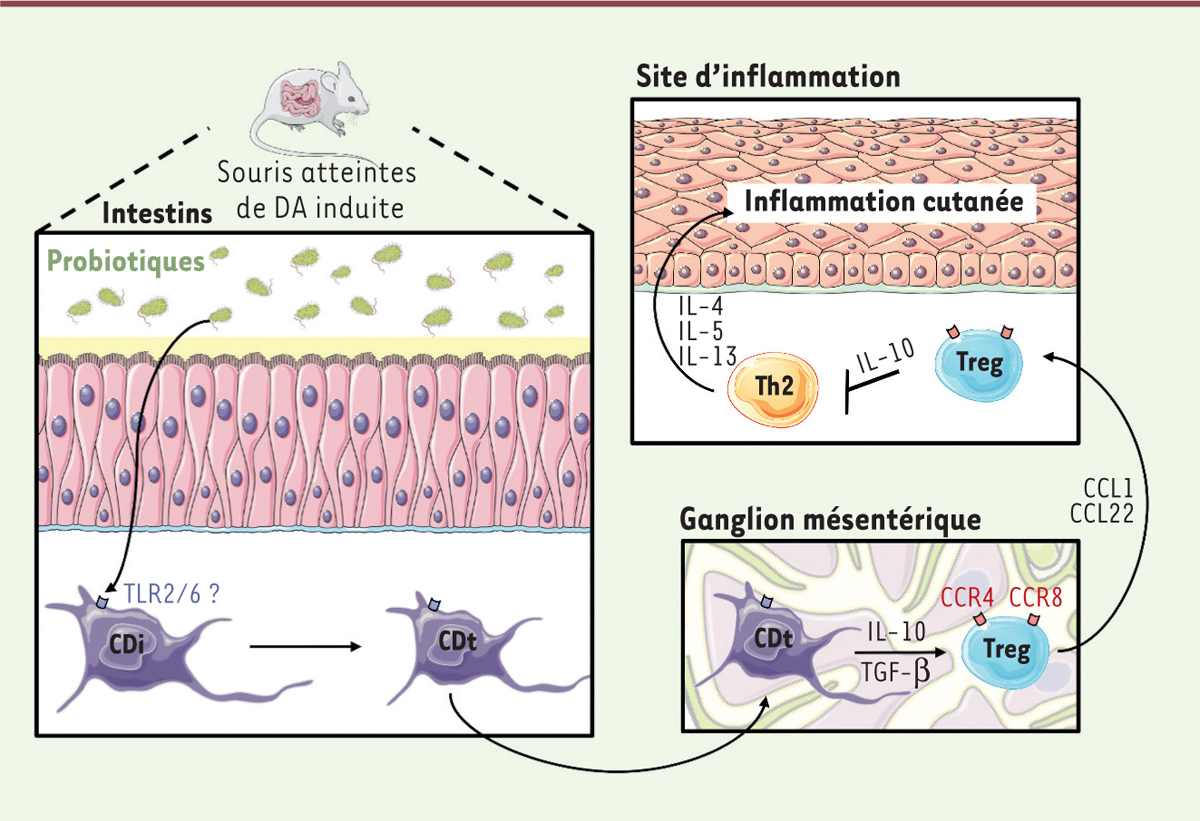
 | Figure 1. Résolution de l’inflammation cutanée par les cellules
dendritiques tolérogènes dans la dermatite atopique.
Les probiotiques administrés aux souris atteintes de dermatite atopique (DA)
sont reconnus grâce aux récepteurs Toll-like receptors
(TLR) des cellules dendritiques (CD). Ils induisent la différenciation, dans
les intestins, de CD immatures (CDi) en CD tolérogènes (CDt) qui migrent
jusqu’aux ganglions mésentériques. Elles activent la différenciation des
lymphocytes T CD4+ en T régulateurs (Treg) par la production
d’IL-10 (interleukine 10) et de TGF-β (transforming growth
factor β). Les Treg migrent jusqu’au site de l’inflammation
grâce à l’expression de CCR4 (C-C motif chemokine receptor
4) et CCR8, les récepteurs des chimiokines CCL1 (C-C
motif chemokine ligand 1) et CCL22, respectivement. Ils
inhibent alors l’activité des lymphocytes Th2 (T helper 2)
par la sécrétion d’IL-10, permettant ainsi la résolution de l’inflammation
cutanée à l’origine des symptômes de la DA. |
Si les effecteurs de la DA sont de mieux en mieux décrits, les évènements à l’origine de
cette pathologie cutanée restent à ce jour assez mal compris, même si un
dysfonctionnement de la barrière cutanée a été mis en cause. Des mutations dans le gène
codant la filagrine, qui participe au maintien de l’intégrité de la couche cornée, ou
dans celui codant la lymphopoïétine stromale thymique (TSLP pour thymic stromal
lymphopoietin) qui joue un rôle dans la différenciation des lymphocytes T
naïfs en lymphocytes Th2, peuvent notamment induire des perturbations de la barrière
cutanée [1]. Une implication du microbiote cutané
est également évoquée. Le microbiote cutané correspond à l’ensemble des bactéries
commensales qui colonisent la surface de la peau. Lorsque l’équilibre de la composition
bactérienne est respecté, il assure une défense efficace contre les microorganismes
pathogènes. Cependant, un déséquilibre du microbiote (appelé dysbiose) peut altérer ses
capacités de protection et mener à une altération de la barrière cutanée. Ainsi, il a
été suggéré, par exemple, que la colonisation du microbiote cutané par
Staphylococcus aureus pourrait participer au développement de la DA
en entraînant la mise en place d’une dysbiose cutanée [1]. En plus de ces facteurs cutanés connus, l’évolution des technologies de séquençage de ces
15 dernières années a permis de réaliser des études approfondies du microbiote
intestinal [2]
(→).
(→) Voir la Synthèse de H.M. Blottière et J. Doré, m/s n°11,
novembre2016, page944
Ces études ont notamment permis de confirmer l’implication du microbiote intestinal dans
le développement de la DA et son potentiel prometteur comme cible thérapeutique. |
Le microbiote intestinal, un système complexe impliqué dans de nombreuses
pathologies Le microbiote intestinal représente l’ensemble des microorganismes qui colonisent
l’intestin. Il se met en place dès la naissance et évolue jusqu’à l’âge de 3 ans
environ, où il est considéré comme mature. Le microbiote intestinal participe
principalement à la digestion mais est aussi connu pour son rôle de barrière de
protection des muqueuses contre la colonisation par des bactéries pathogènes [3] (→).
(→) Voir la Synthèse de V. Gaboriau-Routhiau et N. Cerf-Bensussan,
m/s n°11, novembre2016, page961
Le microbiote intestinal est également capable d’éduquer le système immunitaire
[3]. La composition complexe de la flore
intestinale, mise en évidence par des études de séquençage, rend la balance entre
équilibre du microbiote intestinal et dysbiose intestinale d’autant plus instable
[2]. Or, une dysbiose du microbiote
intestinal chez l’homme pourrait être à l’origine de nombreuses pathologies
associées ou non à l’intestin (maladies intestinales chroniques, diabète, obésité,
certains cancers ou certaines maladies allergiques dont la DA) [2, 4]. Chez les patients atteints de DA, une dysbiose du microbiote intestinal est associée
à une diversité réduite de la population bactérienne commensale intestinale [4]. Récemment, une étude de Zachariassen
et al. a pu mettre en évidence que le transfert de la flore
microbienne intestinale issue de souris présentant une DA sévère dans des souris
axéniques, induit, chez les descendants des souris ayant reçu la transplantation, le
développement de la pathologie. Ces résultats soulignent l’importance du microbiote
intestinal dans l’établissement de la pathologie et suggèrent que restaurer
l’équilibre de ce microbiote serait une potentielle stratégie thérapeutique pour
soigner la DA [4]. |
Restaurer l’équilibre du microbiote intestinal pour atténuer les symptômes de la
dermatite atopique Dans l’optique de restaurer l’équilibre du microbiote intestinal de patients
souffrant de DA, Kwon et al. [5] se sont intéressés aux propriétés des
probiotiques, des bactéries vivantes non pathogènes ajoutées à certains produits
alimentaires pour leurs effets bénéfiques sur la santé. En effet, les probiotiques
permettent de conserver la diversité bactérienne intestinale et de limiter la
colonisation du tube digestif par des microorganismes pathogènes. Ainsi, cette
équipe de recherche a administré, à des souris atteintes de DA, l’une de ces
bactéries probiotiques, la souche Lactobacillus sakei WIKIM30
[5]. À l’issue de la phase de traitement,
une atténuation significative des symptômes de la DA a été observée, avec notamment
une réduction de la réponse immunitaire Th2. D’autres travaux ont également démontré
la capacité des probiotiques à atténuer la sévérité de la DA, par l’administration
d’une [6] ou de plusieurs
[7,8] souches bactériennes. Ces études ont
également mis en évidence une réduction de la production des cytokines
pro-inflammatoires IL-4, IL-5 et IL-13 [6,
8]. Pour mieux comprendre le lien entre le microbiote intestinal et le développement de
la DA, Kwon et al. ont analysé par séquençage la composition exacte
du microbiote intestinal des souris atteintes de DA sévère à partir d’échantillons
de fèces. Ils ont observé une diminution de la diversité microbienne chez les souris
atteintes de DA par rapport à des souris saines, associée à une augmentation du taux
des bactéries de genre Ralstonia ou Arthromitus.
De précédentes études ont montré que ces deux genres bactériens étaient associés à
la différenciation des lymphocytes T CD4+ en lymphocytes Th17 (pour le
genre Ralstonia) [9] et à une réponse Th2 dans les allergies alimentaires (pour le genre
Arthromitus) [10]. L’abondance de ces bactéries dans le microbiote intestinal serait
donc corrélée à une réponse inflammatoire. À l’issue du traitement par L.
sakei WIKIM30, le taux de Ralstonia et Arthromitus est
diminué et la diversité bactérienne restaurée. Ces travaux ont donc permis de
souligner la capacité de ce lactobacille à restaurer l’équilibre de la flore
intestinale, contribuant ainsi à l’atténuation des symptômes de la DA. |
L’induction de cellules dendritiques tolérogènes par les probiotiques Les mécanismes permettant l’atténuation des symptômes de la DA ont été étudiés par
ces mêmes équipes de recherche et l’implication de cellules dendritiques (CD)
tolérogènes a été mise en évidence [5–8]. En effet, lorsque des CD de souris atteintes
de DA sont traitées par des probiotiques, une augmentation des marqueurs spécifiques
des CD tolérogènes est observée [5–8]. Les CD tolérogènes sont en effet
caractérisées par l’expression de certains marqueurs tels que PD-L1
(programmed death-ligand 1), ICOS (inducible T-cell
costimulator), iDO (indoléamine 2-3 dioxygénase 1), et par la
production de cytokines anti-inflammatoires comme l’IL-10 et le TGF-β
(transforming growth factor-beta) [5–8]. De plus, in
vitro, la co-culture de ces CD tolérogènes induites par les
probiotiques avec des lymphocytes T CD4+ entraine leur différenciation en
lymphocytes T régulateurs (Treg) [5–8]. Ainsi, c’est par l’induction de Treg dans
les ganglions mésentériques bordant les intestins que les CD tolérogènes participent
à la résolution de l’inflammation et au rétablissement de l’homéostasie cutanée
(Figure 1). Les Treg
induits quittent les ganglions mésentériques grâce à l’expression membranaire de
CCR4 (C-C motif chemokine receptor 4) et CCR8, les récepteurs des
chimiokines CCL1 (C-C motif chemokine ligand 1) et CCL22,
respectivement. L’expression de ces chimiokines est augmentée au niveau des sites
d’inflammation cutanée ce qui entraine la migration des Treg jusqu’aux lésions de DA
[5, 8]. En effet, chez les souris atteintes de DA et traitées par les
différentes bactéries probiotiques, une augmentation du nombre de Treg est observée
dans les ganglions mésentériques et aux sites d’inflammation cutanée [5–8]. Ils
bloquent l’action des lymphocytes Th2 par la sécrétion d’IL-10 et permettent ainsi
la résolution de cette inflammation [8]. Les mécanismes d’activation des CD tolérogènes par les probiotiques sont encore à
l’étude, mais l’implication des récepteurs Toll-like receptors
(TLR) est probable [5]. La stimulation de
certains de ces récepteurs de l’immunité innée à la surface des CD immatures serait
à l’origine de leur différenciation en CD tolérogènes. L.sakei
WIKIM30 entraîne la production d’IL-10 par les CD tolérogènes et un résultat
similaire est obtenu avec des protéines bactériennes connues pour stimuler les TLR2
et TLR6 [5]. De plus, Ren et
al. ont mis en évidence, par l’utilisation d’anticorps bloquants, le
fait que l’induction des Treg par les probiotiques était dépendante des TLR2 et TLR6
[11]. Cependant, chaque
bactérie probiotique semble avoir un profil de signalisation TLR unique et
spécifique [11]. Ainsi, choisir les souches
bactériennes selon les TLR qu’elles activent, et par conséquent les voies de
différenciation qu’elles induisent, est une stratégie prometteuse pour sélectionner
les probiotiques en fonction des mécanismes immunitaires de la pathologie
traitée. |
Traiter la dermatite atopique en modulant le microbiote intestinal L’utilisation de probiotiques pour soigner la DA est une stratégie de traitement
prometteuse. Des études complémentaires avec d’autres modèles animaux de DA seront
cependant nécessaires pour confirmer les résultats obtenus puisque que les modèles
de souris utilisés constituent surtout des modèles d’eczéma allergique de contact.
Le développement de modèles animaux de DA plus proches de la physiopathologie
humaine (comme certains modèles canins) devrait donc permettre de mieux évaluer le
rôle bénéfique des probiotiques, et de caractériser précisément les mécanismes de
l’induction de CD tolérogènes et l’implication des TLR. De plus, la mise en place de
protocoles standardisés pour l’analyse des bactéries du microbiote intestinal
devrait permettre de caractériser l’évolution de la dysbiose intestinale en fonction
des probiotiques administrés. Ainsi, la mise en évidence des rôles directs et
indirects des probiotiques dans le traitement de la DA, via la
régulation de la dysbiose intestinale et l’activation de CD tolérogènes, confirmera
leur potentiel comme thérapies innovantes. |
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
1.
Kennedy
K
,
Heimall
J
,
Spergel
JM
. Advances in atopic dermatitis in
2017 . J Allergy Clin Immunol.
2018; ; 142 :
:1740.–1747. 2.
Blottière
HM
,
Doré
J
. Impact des nouveaux outils de métagénomique sur
notre connaissance du microbiote intestinal et de son rôle en santé humaine
: enjeux diagnostiques et thérapeutiques . Med Sci
(Paris).
2016; ; 32 :
:944.–951. 3.
Gaboriau-Routhiau
V
,
Cerf-Bensussan
N
. Microbiote intestinal et développement du système
immunitaire . Med Sci (Paris).
2016; ; 32 :
:961.–967. 4.
Zachariassen
LF
,
Krych
L
,
Engkilde
K
, et al.
Sensitivity to oxazolone induced dermatitis is transferable with
gut microbiota in mice . Sci Rep.
2017; ; 7 :
:1.–11. 5.
Kwon
MS
,
Lim
SK
,
Jang
JY
, et al.
Lactobacillus sakei WIKIM30 ameliorates atopic dermatitis-like
skin lesions by inducing regulatory T cells and altering gut microbiota
structure in mice . Front Immunol.
2018; ; 9 :
:1.–11. 6.
Lim
SK
,
Kwon
MS
,
Lee
J
, et al.
Weissella cibaria WIKIM28 ameliorates atopic dermatitis-like skin
lesions by inducing tolerogenic dendritic cells and regulatory T cells in
BALB/c mice . Sci Rep.
2017; ; 7 :
:1.–9. 7.
Kim
HW
,
Hong
R
,
Choi
EY
, et al.
A probiotic mixture regulates T cell balance and reduces atopic
dermatitis symptoms in mice . Front
Microbiol.
2018; ; 9 :
:1.–13. 8.
Kwon
HK
,
Lee
CG
,
So
JS
, et al.
Generation of regulatory dendritic cells and CD4+Foxp3+T cells by
probiotics administration suppresses immune disorders .
Prot Natl Acad Sci USA.
2010; ; 107 :
:2159.–2164. 9.
Lee
YK
,
Menezes
JS
,
Umesaki
Y
, et al.
Proinflammatory T-cell responses to gut microbiota promote
experimental autoimmune encephalomyelitis . Proc Natl
Acad Sci USA.
2011; ; 108 : (suppl 1)
:4615.–4622. 10.
Savage
JH
,
Lee-Sarwar
KA
,
Sordillo
J
, et al.
A prospective microbiome-wide association study of food
sensitization and food allergy in early childhood .
Allergy.
2018; ; 73 :
:145.–152. 11.
Ren
C
,
Zhang
Q
,
de Haan
BJ
, et al.
Identification of TLR2/6 signalling lactic bacteria for
supporting immune regulation . Sci Rep.
2016; ; 6 :
:1.–12. |