| |
| Med Sci (Paris). 35(8-9): 705–708. doi: 10.1051/medsci/2019140.Cellules souches leucémiques Cibler leur quiescence afin d’optimiser les
thérapies Mélanie Bellina1* 1Master Biologie Moléculaire et Cellulaire-M2 Parcours
Génopath, Université Claude Bernard Lyon 1, Université de
Lyon, France. MeSH keywords: Antinéoplasiques, Cycle cellulaire, Conception de médicament, Protéines de fusion bcr-abl, Glycogen Synthase Kinase 3, Cellules souches hématopoïétiques, Humains, Leucémies, Leucémie aigüe myéloïde, Thérapie moléculaire ciblée, Progéniteurs myéloïdes, Protéines tumorales, Cellules souches tumorales, Phosphatidylinositol 3-kinases, Maturation post-transcriptionnelle des ARN, ARN messager, ARN tumoral, Transduction du signal, Microenvironnement tumoral, pharmacologie, usage thérapeutique, toxicité, effets des médicaments et substances chimiques, physiologie, antagonistes et inhibiteurs, anatomopathologie, thérapie, métabolisme |
Les CSL (cellules souches leucémiques) ont été identifiées pour la première fois en 1997
dans la LMA (leucémie myéloïde aiguë) [1]. Elles forment une petite population hétérogène de cellules leucémiques,
provenant de la transformation de CSH (cellules souches hématopoïétiques) ou de cellules
myéloïdes progénitrices [2]. Les
CSL possèdent des propriétés d’autorenouvellement, de quiescence cellulaire et de
chimiorésistance [2, 3]. L’hétérogénéité de cette population est marquée
par l’expression différentielle de certains marqueurs à la surface des cellules qui la
constituent. Cette hétérogénéité rend leur ciblage thérapeutique particulièrement
difficile [2]. Les traitements standards
cytotoxiques, qui visent les cellules fortement prolifératrices, ne sont pas efficaces
contre les CSL quiescentes. Ainsi, les CSL peuvent persister dans l’organisme alors
qu’un patient est en rémission, puis sortir de leur état de quiescence et se mettre à
proliférer, ce qui peut mener à une rechute [3,
4]. Il est essentiel
d’élucider les caractéristiques fonctionnelles des CSL, ainsi que leurs altérations
intracellulaires, afin d’optimiser les approches thérapeutiques qui doivent avoir une
toxicité minimale pour les cellules hématopoïétiques saines [5]. Les CSL sont essentiellement régulées par leur microenvironnement, des voies de
signalisation intrinsèques et des ARN non codants [2]. Il a été observé que des voies de signalisation associées à la
progression dans le cycle cellulaire, la survie et le métabolisme des cellules, comme,
par exemple, la voie mTOR, étaient inhibées dans les CSL en comparaison avec les CSH
saines [6, 7, 8]. L’inhibition de ces voies participe au maintien de la quiescence et
ainsi à la résistance des CSL à la chimiothérapie. Deux molécules ont récemment été
identifiées comme ayant un rôle important dans le maintien dans cet état des CSL: miR126
et GSK3. |
Les régulateurs de la quiescence cellulaire miR126 Les micro-ARN (ou miARN) sont de courts acides ribonucléiques simples brins
synthétisés sous forme de pré-miARN dans le noyau, puis exportés dans le cytosol
où ils sont clivés en miARN. Les miARN matures sont des régulateurs de
l’expression des gènes: ils induisent une répression traductionnelle ou une
dégradation des ARN messagers cible. En 2014, l’équipe de de Leeuw a mis en évidence des différences d’expression de
miARN entre CSL et CSH [7]. Les miARN
concernés par ces différences sont, pour une partie d’entre eux, potentiellement
oncogéniques, car surexprimés dans les CSL par rapport aux CSH. Les auteurs ont
également identifié le miARN126 comme étant sous-exprimé dans les CSL par
rapport aux CSH, mais avec une expression plus forte dans les CSL par rapport à
des cellules progénitrices leucémiques [7]. Ces observations suggèrent que l’expression de ce miARN peut être
associée à un phénotype «cellule souche». Les auteurs ont donc mené des études
supplémentaires pour caractériser les fonctions et les cibles de miR126 [7]. L’inhibition de miR126 grâce à
l’infection par un lentivirus KD (knock-down) de miR126
entraîne une réduction du taux de croissance et une apoptose des CSL et des
cellules progénitrices leucémiques [7].
Les CSH saines transduites montrent, quant à elles, une légère réduction de
prolifération cellulaire, mais pas d’augmentation de leur apoptose. Enfin, la
greffe de CSL transduites dans des souris immunodéficientes induit une
augmentation du temps de survie et un risque diminué de rechute des souris ayant
développé une LMA par rapport à la greffe de CSL non transduites [7]. Ainsi, miR126 apparaît comme un miARN essentiel pour la survie cellulaire,
quantitativement moins abondant dans les CSL que les CSH. Son ciblage dans la
LMA devrait permettre d’induire une mort cellulaire des CSL, tout en épargnant
les CSH saines. Deux ans plus tard, Lechman et ses collaborateurs ont mis en évidence une
signature de miARN exprimés dans les CSL associée à l’évolution clinique de la
LMA. Ils ont observé que miR126 présente une activité plus forte dans les CSL
que dans les CSH [6]. De plus, cette
activité est associée à une atténuation de l’expression de CDK3, Sin1 et de
composants de la voie PI3K/AKT/mTOR. La diminution de l’expression de CDK3
induit un blocage du cycle cellulaire, piégeant ainsi les CSL en phase G0, qui
deviennent alors quiescentes. La voie PI3K/AKT/mTOR, activée par la
phosphorylation de AKT de façon dépendante du complexe MTORC2, induit une
signalisation intracellulaire essentielle à la prolifération et la
différenciation des cellules. Sin1 est essentielle à la formation du complexe
MTORC2. Ainsi, en induisant une diminution de l’expression de Sin1 dans les CSL,
miR126 inhibe la voie PI3K/AKT/mTOR, ce qui participe également au maintien de
la quiescence de ces cellules [6]
(Figure 1).
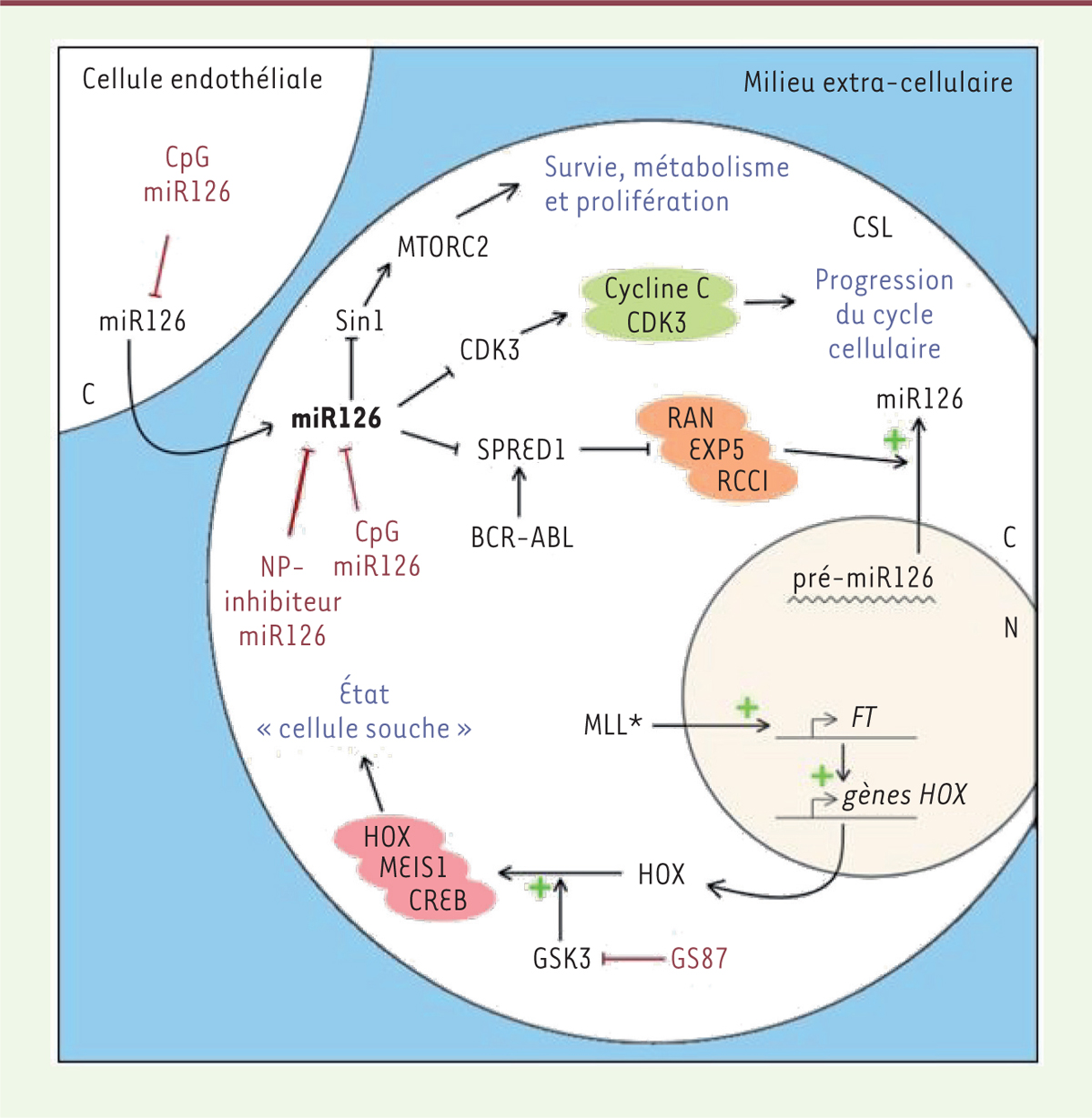
 | Figure 1. Représentation schématique des effets de miR126 et GSK3
dans les cellules souches leucémiques et leur
microenvironnement. miR126 peut être aussi
bien généré intrinsèquement par les cellules souches leucémiques
(CSL) qu’apporté par transport vésiculaire à partir de cellules
endothéliales environnantes. Le miR126 inhibe l’expression de Sin1,
CDK3, et SPRED1, ce qui aboutit au maintien de la quiescence des
CSL, et permet un rétrocontrôle positif sur l’expression et la
maturation de miR126. De plus, GSK3, constitutivement activé dans
les CSL, promeut, en partenariat avec les translocations
chromosomiques impliquant le gène MLL, le maintien
de l’état «cellule souche» par la formation de complexes
HOX-MEIS1-CREB. En rouge sont indiqués les inhibiteurs de miR126 et
de GSK3, capables d’induire une sortie de quiescence des CSL (CpG
miR126, NP-inhibiteur miR126 et GS87). N: noyau; C: cytoplasme;
MLL*: protéine de fusion MLL; NP: nanoparticule; FT: facteur de
transcription. |
D’autres travaux se sont également intéressés à la régulation de l’expression et
de la maturation de miR126. La leucémique myéloïde chronique (LMC) est
caractérisée par l’expression d’un gène de fusion, BCR-ABL, qui
code une tyrosine kinase constitutivement active, induisant la transformation
des CSH en CSL. L’équipe de Zhang a récemment constaté que l’expression la
protéine de fusion BCR-ABL est associée à une réduction de l’expression de
miR126 mature endogène [8]. En effet,
lorsque BCR-ABL active, par phosphorylation, la kinase SPRED1, cette dernière
empêche la formation du complexe assurant le transport de miR126 du noyau au
cytosol. Ainsi, SPRED1, activé par BCR-ABL, inhibe la formation de miR126
mature. Cependant, ces auteurs ont également observé que miR126 avait un
potentiel de rétrocontrôle positif sur sa propre maturation en inhibant SPRED1.
De plus, ces chercheurs ont remarqué un taux élevé de miR126 dans les cellules
endothéliales proches des CSL, suggérant un apport possible de miR126 exogène
provenant des cellules endothéliales du microenvironnement vers les CSL
via un transport vésiculaire (Figure 1). GSK3 Initialement identifiée comme régulateur du métabolisme du glycogène, GSK3
(glycogène synthase kinase 3) est impliquée dans l’inflammation, le maintien de
l’état «cellule souche», la prolifération cellulaire et la régulation de
l’hématopoïèse [ 9]. Une surexpression et/ou activation constitutive de GSK3, observée dans de
nombreux types de cancers, est généralement synonyme de résistance thérapeutique
et associée à un mauvais pronostic pour les patients [9]. Dans les leucémies aiguës impliquant des translocations
chromosomiques du gène MLL, l’expression des gènes
HOX (homéobox) au sein des CSL est augmentée. GSK3 induit
la formation du complexe HOX-MEIS1-CREB, impliqué dans la transcription de gènes
responsables de l’état «cellule souche» et la prolifération des CSL [10] (Figure 1). Plusieurs études montrent que l’inhibition pharmacologique de GSK3 permet
l’induction de la différentiation cellulaire et l’arrêt de croissance des
cellules leucémiques dans des modèles murins de LMA [9]. De même, en 2010, l’équipe de Birch a constaté que
l’inhibition de GSK3 est associée à une augmentation de l’expression de p27Kip1,
un inhibiteur de kinases dépendantes des cyclines, importantes pour la
progression du cycle cellulaire [10]. |
Optimisation thérapeutique Les traitements anti-leucémiques développés jusqu’à présent sont à base d’agents
cytotoxiques visant principalement les cellules en train de proliférer activement
[9]. Cependant, la quiescence des CSL les
rendent résistantes à ces traitements. Par conséquent, des stratégies thérapeutiques
visant à induire une différenciation et une prolifération des CSL pour les rendre
sensibles à ces agents cytotoxiques sont à l’étude [9]. C’est dans ce contexte que des inhibiteurs de miR126 et GSK3 ont été
identifiés et testés. Des nanoparticules à base de lipopolyplex anionique comportant des antagonistes de
miR126 ont été mises au point en 2015 [3]. Ces
nanoparticules sont recouvertes d’un antigène ou d’un anticorps particulier qui
assure le ciblage des cellules dans lesquelles elles vont être internalisées. Ainsi,
les nanoparticules permettent l’absorption d’un inhibiteur de miR126 par les
cellules hématopoïétiques, tout en contournant l’absorption hépatique et la
dégradation [3]. Plus récemment, en 2018,
Zhang et ses collaborateurs ont généré un oligodéoxynucléotide inhibiteur,
CpG-miR126, pouvant être internalisé aussi bien par les cellules endothéliales de la
niche des CSL que par les CSL elles-mêmes. L’efficacité et la spécificité de ce
traitement sont rendues possibles grâce à une modification chimique de l’inhibiteur
afin qu’il ne soit pas dégradé par les nucléases du sérum et lors de son couplage
aux nanoparticules citées ci-dessus [8]. Son
administration en combinaison avec un traitement standard par inhibiteur de
tyrosines kinases induit une sortie de quiescence et une réduction du nombre de CSL
[3,8]. Les inhibiteurs de GSK3, ont quant à eux une activité sub-optimale, notamment à cause
de leur manque de spécificité. En 2016, Hu et son équipe ont néanmoins identifié
GS87, un inhibiteur hautement spécifique de GSK3 [9]. Dans un modèle de souris atteintes de LMA, GS87 induit la
différenciation des CSL sans affecter la prolifération des CSH saines [9]. L’émergence des combinaisons thérapeutiques a été un tournant dans l’optimisation des
thérapies anti-cancéreuses. Dans le cas des leucémies, des combinaisons
thérapeutiques ciblant les cellules leucémiques prolifératrices ainsi que les CSL
permettraient une amélioration de la prise en charge des patients. Dorrance et Zhang
ont ainsi tous les deux suggéré la combinaison de leurs inhibiteurs de miR126 et de
thérapies standards ciblant les acteurs du cycle cellulaire [3, 8]. Une combinaison
thérapeutique étant d’autant plus intéressante lorsqu’elle cible des voies de
signalisation différentes, combiner l’inhibition de GSK3 à celle de miR126 ou des
inhibiteurs de tyrosines kinases serait également une voie envisageable. |
Caractérisées entre autre par leur quiescence, les CSL constituent une population
cellulaire responsable de résistances thérapeutiques et de rechutes de la maladie
chez les patients atteints de leucémie. C’est la raison pour laquelle elles sont
devenues la cible de nouvelles thérapies visant à favoriser leur différenciation
[1–5]. Suite aux observations que miR126 et GSK3 sont deux facteurs participant à la
régulation du cycle cellulaire dans les CSL, des recherches se sont concentrées sur
l’identification et le développement d’inhibiteurs de ces molécules [2, 6–8, 10].
Comme nous l’avons évoqué ci-dessus, des nanoparticules de lipopolyplex anioniques
conjugués à un inhibiteur du miR126 (le CpG-miR126) ont été développées. Combinée à
des traitements standards, cette stratégie thérapeutique induit une réduction de la
croissance des cellules leucémiques dans un modèle de souris [3, 8, 9]. De même, l’identification de la molécule
inhibitrice, GS87, hautement spécifique de GSK3 a ouvert des perspectives
thérapeutiques. Dans l’optique d’optimiser les stratégies thérapeutiques utilisées dans le traitement
des leucémies, le développement de combinaisons ciblant à la fois les CSL
quiescentes et les cellules leucémiques fortement prolifératrices semble très
prometteur [3, 8, 9]. |
L’auteure déclare n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
1.
Bonnet
D
,
Dick
JE
. Human acute myeloid leukemia is organized as a
hierarchy that originates from a primitive hematopoietic
cell . Nat Med.
1997; ; 3 :
:730.–737. 2.
Wang
X
,
Huang
S
,
Chen
JL
. Understanding of leukemic stem cells and their
clinical implications . Mol Cancer.
2017; ; 16 : :2.. 3.
Dorrance
AM
,
Neviani
P
,
Ferenchak
GJ
, et al.
Targeting leukemia stem cells in vivo with antagomiR-126
nanoparticles in acute myeloid leukemia .
Leukemia.
2015; ; 29 :
:2143.–2153. 4.
Löwenberg
B.
Introduction to the review series on leukemic stem
cells . Blood.
2017; ; 129 : :1567.. 5.
Hanekamp
D
,
Jacqueline
C
,
Gerrit
JS
. Leukemic stem cells: identification and clinical
application . Int J Hematol.
2017; ; 105 :
:549.–557. 6.
Lechman
ER
,
Gentner
B
,
Ng
SW
, et al.
MiR-126 regulates distinct self-renewal outcomes in normal and
malignant hematopoietic stem cell . Cancer
Cell.
2016; ; 29 :
:214.–228. 7.
De Leeuw
DC
,
Denkers
F
,
Olthof
MC
, et al.
Attenuation of microRNA-126 expression that drives
CD34+38+ stem/progenitor cells in acute myeloid
leukemia leads to tumor eradication . Cancer
Res.
2014; ; 74 :
:2094.–2105. 8.
Zhang
B
,
Nguyen
LXT
,
Li
L
, et al.
Bone marrow niche trafficking of MiR-126 controls the
self-renewal of leukemia stem cells in chronic myelogenous
leukemia . Nat Med.
2018; ; 24 :
:450.–462. 9.
Hu
S
,
Ueda
M
,
Stetson
L
, et al.
A novel glycogen synthase kinase-3 inhibitor optimized for acute
myeloid leukemia differentiation activity . Mol
Cancer Ther.
2016; ; 15 :
:1485.–1494. 10.
Birch
NW
,
Zeleznik-Le
NJ
. Glycogen synthase kinase-3 and leukemia:
restoring the balance . Cancer cell.
2010; ; 17 :
:529.–531. |