Les défauts des voies de réparation de l’ADN sont un élément caractéristique des cellules cancéreuses ; ils participent au développement tumoral en favorisant l’instabilité génomique. Depuis plus de 50 ans, cette caractéristique est exploitée comme opportunité thérapeutique pour le traitement du cancer, avec l’utilisation de chimiothérapies cytotoxiques conventionnelles, qui détruisent en particulier les cellules porteuses de défauts de réparation de l’ADN. Plus récemment, la découverte d’une interaction de létalité synthétique entre les dommages à l’ADN induits par les inhibiteurs de la poly(ADP-ribose) polymérase (PARPi, poly[ADP-ribose] polymerase inhibitors) et les défauts des gènes suppresseurs de tumeur BRCA1 et BRCA2 (breast cancer type 1/2 susceptibility genes) a permis le développement de nouvelles approches thérapeutiques ciblées destinées à des populations sélectionnées de patients présentant ces défauts, notamment dans le cadre de cancers du sein, de l’ovaire, ou de la prostate [1]. Suite à un développement clinique rapide, les PARPi olaparib, rucaparib, et niraparib ont obtenu une autorisation de mise sur le marché pour le traitement des cancers de l’ovaire associés à une mutation de BRCA (« BRCA-mutés ») ; l’olaparib et le talazoparib ont été approuvés pour le traitement des cancers du sein BRCA-mutés. Plusieurs études précliniques ont par ailleurs démontré que le défaut d’autres gènes suppresseurs de tumeur impliqués dans la réparation de l’ADN, tels que ERCC1 (excision repair cross-complementation group 1), déficient dans 30 % des cancers bronchiques non-à-petites cellules (CBNPC), entraîne également une sensibilité accrue aux PARPi [2]. Ces résultats ont permis le développement d’essais cliniques de phase II (par exemple, l’essai PIPSeN développé à l’Institut Gustave Roussy, NCT02679963) évaluant l’efficacité des PARPi dans le CBNPC.
Parallèlement à ces avancées, l’avènement de l’immunothérapie dans la dernière décennie a révolutionné le traitement du cancer. En particulier, le développement des anticorps ciblant les points de contrôle immunitaires PD-1/PD-L1 (programmed cell death-1/programmed cell death-ligand 1) a permis d’améliorer significativement la survie des patients dans de nombreux cancers agressifs, notamment le CBNPC. Malgré ces progrès, les patients bénéficiant de ces thérapies sont encore minoritaires ; en effet, seulement 20 % des patients atteints de CBNPC présentent une réponse favorable aux anticorps anti-PD-1/PD-L1, et ces immunothérapies s’avèrent même délétères chez près de 15 % des patients, pour lesquels le traitement entraîne une accélération violente de la maladie, appelée « hyper-progression » [3]. Aussi, l’identification de combinaisons thérapeutiques rationnelles permettant d’augmenter la proportion des patients susceptibles de répondre favorablement aux anti-PD-1/PD-L1 constitue actuellement un domaine de recherche très actif. De récentes découvertes établissant un lien entre l’instabilité génomique tumorale, la présence de certains défauts de réparation de l’ADN, et la réponse aux anti-PD-1/PD-L1, ont conduit à la mise en place d’essais cliniques évaluant ce type d’immunothérapie en combinaison avec la chimiothérapie. Les résultats de ces essais ont démontré l’efficacité remarquable de ce type d’approche dans le CBNPC métastatique [4], dont le standard thérapeutique en première ligne comporte maintenant l’ajout d’un anti-PD-1 à la chimiothérapie à base de sels de platine. De manière similaire, de plus en plus d’essais cliniques évaluent l’efficacité des anti-PD-1/PD-L1 en combinaison avec des thérapies ciblées exploitant les défauts de réparation de l’ADN, telles que les PARPi.
Dans ce contexte, il est essentiel : (1) de comprendre comment les thérapies ciblant la réparation de l’ADN modulent l’immunité anti-tumorale, afin de permettre le développement rationnel de combinaisons thérapeutiques avec l’immunothérapie ; (2) d’identifier les contextes moléculaires et histologiques dans lesquels ces approches pourront apporter un bénéfice médical. Jusqu’à récemment, peu d’études précliniques avaient exploré le potentiel immunomodulateur des PARPi. Cependant, des données récentes démontrent la présence d’un lien fonctionnel entre la réponse aux dommages à l’ADN (DDR, DNA damage response) et l’immunité anti-cancéreuse [5]. Ce lien relève de trois aspects essentiels de l’immunogénicité tumorale : (1) l’impact de l’instabilité génomique et de la charge mutationnelle tumorale sur la production de néo-antigènes tumoraux ; (2) la mort cellulaire immunogène induite par les dommages à l’ADN ; (3) l’activation des voies de signalisation de « l’immunité innée cytosolique » en réponse aux dommages à l’ADN. Ce dernier aspect a notamment été révélé par deux études récentes ayant mis en évidence la capacité de certains défauts de réparation de l’ADN, présents dans la tumeur, à stimuler une réponse immunitaire anti-tumorale par activation de la voie cGAS/STING (cyclic GMP-AMP synthase/stimulator of interferon genes) [6, 7, 13] (→).
(→) Voir la Synthèse de R. Chanut et V. Petrilli, m/s n° 6-7, juin-juillet 2019, page 527
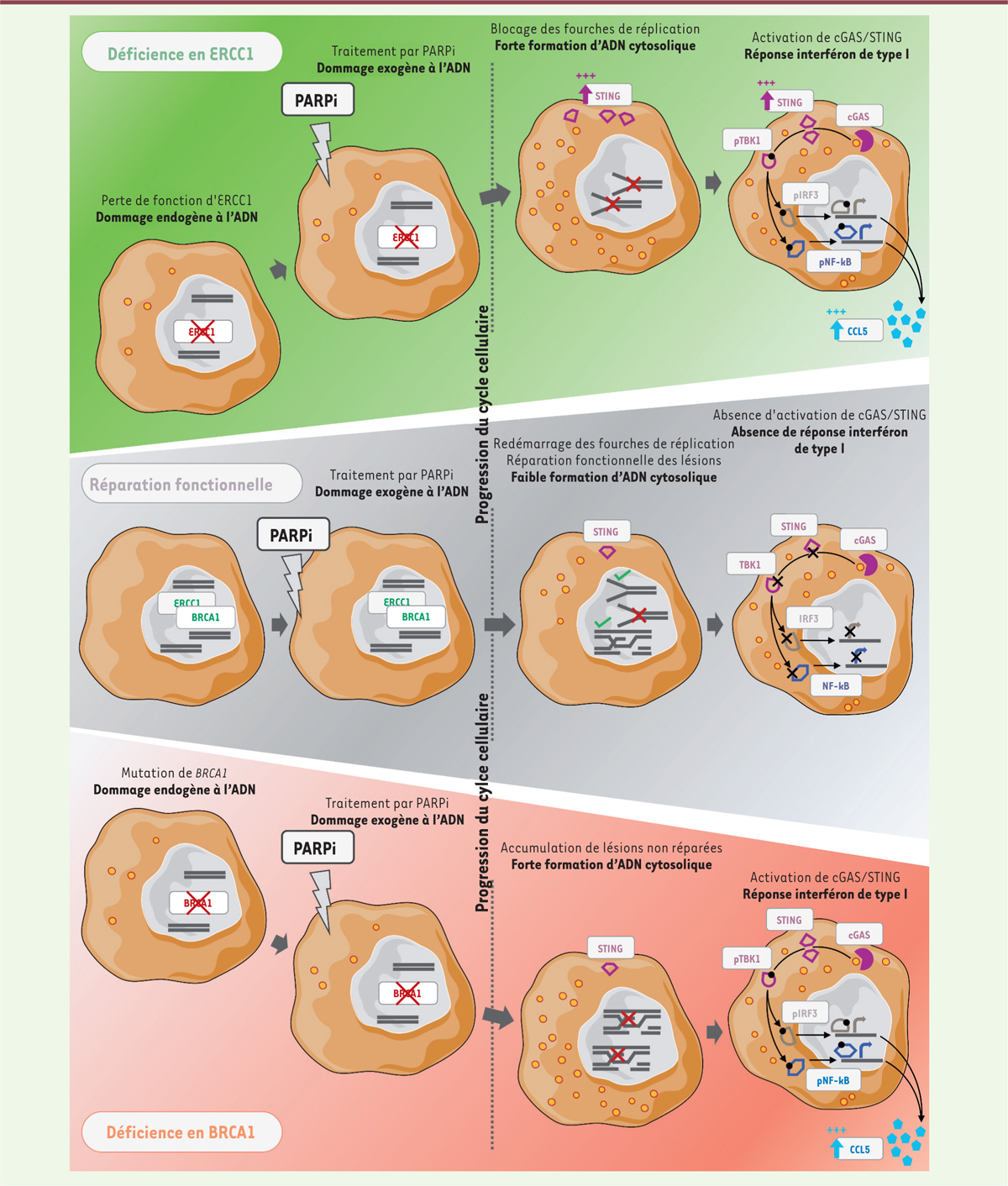
Initialement identifiée comme un mécanisme physiologique de défense cellulaire contre les infections suite à la reconnaissance d’ADN étranger, la voie cGAS/STING est connue pour son rôle essentiel dans la détection des PAMP (pathogen-associated molecular patterns) – tels que l’ADN viral – et l’activation de réponses immunitaires innées en réaction à ces « signaux de danger » par la stimulation de l’expression des gènes de la famille des interférons. Plus récemment, un rôle supplémentaire de la voie cGAS/STING a été montré dans la détection d’ADN cytosolique endogène accumulé à la suite de dommages de l’ADN génomique ou mitochondrial – un type de signal de danger alors appelé DAMP (damage-associated molecular pattern). Par exemple, l’exposition de cellules tumorales à des agents génotoxiques ou cytotoxiques comme l’irradiation ou certaines chimiothérapies a été associée à l’activation de la voie cGAS/STING et à la stimulation de l’immunité innée anti-tumorale [8]. Dans notre étude [7], nous avons fait l’hypothèse que les dommages à l’ADN induits par les PARPi pourraient activer la voie cGAS/STING de manière sélective dans les cellules cancéreuses déjà porteuses de défauts des voies de réparation de l’ADN (et par conséquent sensibles aux PARPi), telles que les cellules de CBNPC déficientes en ERCC1 et les cellules de cancer du sein triple-négatif1 (CSTN) BRCA1-mutées.
Afin de tester cette hypothèse, nous avons exploité plusieurs modèles de CBNPC isogéniques pour la déficience en ERCC1 – lignées ERCC1-WT (wild-type, lignée parentale sauvage), ERCC1-HZ (heterozygous, lignée rendue hétérozygote pour ERCC1), ERCC1-KO (knockout, lignée invalidée pour ERCC1), et ERCC1-R (rescue, lignée ERCC1-KO dans laquelle l’expression d’ERCC1 a été restaurée). Nous avons également utilisé un modèle de CSTN isogénique pour la déficience en BRCA1 – lignées BRCA1-MUT (mutant, lignée parentale BRCA1-mutée), BRCA1-REV (revertant, lignée BRCA1-MUT dans laquelle l’expression de BRCA1 a été restaurée), et PARP1-KO (lignée rendue résistante aux PARPi par invalidation du gène PARP1). Nous avons établi, par une analyse du transcriptome par RNA sequencing, que les lignées ERCC1-HZ et ERCC1-KO présentent une augmentation significative des transcrits de nombreux gènes de l’immunité par rapport à la lignée ERCC1-WT, notamment des gènes impliqués dans la voie de l’interféron de type I, et dans la signalisation par les cytokines. Cette analyse transcriptomique, combinée à des données d’expression protéique générées par western blot, a également indiqué que les cellules ERCC1-KO ré-expriment spontanément STING, et sur-expriment les gènes codant plusieurs cytokines chimiotactiques, dont CCL5 (C-C motif chemokine ligand 5) et CXCL10 (C-X-C motif chemokine ligand 10) – ce phénotype étant abrogé par la réintroduction d’ERCC1 dans les cellules ERCC1-R. Cela suggère une activation conditionnelle de la voie cGAS/STING en l’absence d’ERCC1. Par ailleurs, en effectuant une analyse immuno-histochimique sur les tumeurs de 55 patients atteints de CBNPC, nous avons mis en évidence une augmentation significative du nombre de lymphocytes T infiltrants (tumour-infiltrating lymphocytes ou TIL) dans les tumeurs présentant une faible expression d’ERCC1, suggérant un effet du « statut ERCC1 » sur l’infiltrat lymphocytaire dans le CBNPC.
Nous avons ensuite cherché à évaluer les effets des PARPi sur divers phénotypes immunologiques associés à l’activation de la voie cGAS/STING dans les cellules cancéreuses déficientes en ERCC1 ou BRCA1. Nos expériences ont montré que l’exposition des cellules de CBNPC ou de CSTN à plusieurs PARPi actuellement utilisés en pratique clinique augmentait la formation d’ADN cytosolique de manière dose-dépendante, et que l’amplitude de cet effet dépendait du statut ERCC1 ou BRCA1 des cellules tumorales. En effet, alors que la formation de fragments d’ADN cytosolique restait limitée dans les lignées ERCC1-WT et BRCA1-REV, nous avons observé une forte accumulation d’ADN sous la forme de fragments « libres » ou de micronoyaux dans le cytoplasme des cellules déficientes en ERCC1 ou BRCA1. De plus, nous avons observé une co-localisation de ces fragments avec cGAS – le senseur d’ADN cytosolique nécessaire à l’activation de la voie cGAS/STING – suite au traitement par PARPi. Nous avons ensuite montré que cette accumulation d’ADN cytosolique était associée à une activation de la signalisation STING et de ses marqueurs, notamment la phosphorylation de TBK1 (TANK-binding kinase 1) et celle des facteurs de transcription IRF3/7 (interferon regulatory factors 3/7) et NF-κB (nuclear factor-kappa B). Cette activation entraînait une réponse interféron de type I caractérisée par le relargage de cytokines chimiotactiques, telles que CCL5 (Figure 1). Nous avons par ailleurs montré que ce phénotype était restreint aux cellules déficientes en ERCC1 et BRCA1, les effets observés étant totalement abrogés dans les lignées ERCC1-R et BRCA1-REV. Cela suggère que la présence de défauts des voies de réparation de l’ADN est nécessaire à l’induction de phénotypes immunologiques en réponse aux PARPi dans les cellules cancéreuses de CBNPC et CSTN. De manière similaire, l’absence d’activation de cGAS/STING observée dans la lignée de CSTN PARP1-KO a permis de confirmer que cet effet immunomodulateur des PARPi était dépendant de la présence de PARP1, et résultait donc d’un effet spécifique du médicament sur sa cible (on-target effect).
| Figure 1. Mécanisme de stimulation de l’immunité anti-cancéreuse par les
inhibiteurs de PARP dans les cellules tumorales comportant des
défauts des voies de réparation de l’ADN. Les
cellules cancéreuses ayant un système fonctionnel de réparation de leur ADN
(telles que les cellules ERCC1-WT et
BRCA1-REV) réparent efficacement les lésions créées à la
suite de dommages à l’ADN. Lorsque l’exposition à un PARPi crée une lésion
(par exemple une cassure double-brin consécutive au blocage d’une fourche de
réplication), la portion d’ADN lésée est excisée par ERCC1, puis réparée par
la recombinaison homologue qui fait intervenir BRCA1 : la réplication de
l’ADN peut alors reprendre. Les lésions résiduelles non réparées sont
associées à un taux minimal d’ADN cytosolique, insuffisant pour déclencher
la cascade de signalisation de la voie cGAS/STING. A l’inverse, les cellules
comportant des défauts des voies de réparation de l’ADN (telles que les
cellules ERCC1-KO et BRCA1-MUT) sont
incapables de réparer correctement les lésions créées à la suite de dommages
à l’ADN. Dans les cellules déficientes en ERCC1, l’exposition aux PARPi crée
des lésions de l’ADN qui ne peuvent pas être correctement excisées, ce qui
empêche l’action des protéines de la recombinaison homologue. Dans les
cellules déficientes en BRCA1, ce sont plusieurs étapes de la recombinaison
homologue qui sont invalidées. Dans les deux cas, le nombre accru de
fourches de réplication bloquées cause une accumulation de cassures
double-brins de l’ADN non réparées, qui finissent par provoquer la formation
de micronoyaux et de fragments d’ADN cytosoliques en grande quantité. Ces
fragments sont détectés par cGAS, ce qui active la cascade de signalisation
STING/pTBK1/pIRF3/pNF-κB, et induit une réponse interféron de type I
associée à la sécrétion de cytokines chimiotactiques, comme CCL5. BRCA1,
breast cancer 1 ; CCL5, C-C motif chemokine
ligand 5 ; cGAS, cyclic GMP-AMP synthase ;
ERCC1, excision repair cross-complementation group 1 ;
PARPi, poly(ADP-ribose) polymerase inhibitors ; pTBK1,
phosphorylated TANK-binding kinase 1 ; pIRF3,
phosphorylated interferon regulatory factor 3 ; pNF-κB,
phosphorylated nuclear factor-kappa B ; STING,
stimulator of interferon genes. |
Au total, les résultats de notre étude [7] suggèrent que les PARPi ont des propriétés immunomodulatrices intrinsèques qui participent à la stimulation de l’immunité anti-tumorale. Ils complètent ceux d’autres études très récentes, indiquant une stimulation de l’immunité anti-tumorale dépendante de cGAS/STING en réponse aux PARPi dans divers modèles tumoraux [9-12]. Ces résultats ouvrent la voie à un développement clinique des PARPi en combinaison avec les anti-PD-1/PD-L1 chez des patients sélectionnés selon les caractéristiques moléculaires de leur tumeur. Alors que plusieurs essais cliniques évaluent actuellement cette combinaison dans les cancers du sein et de l’ovaire BRCA1/2-mutés, d’autres types histologiques tumoraux, comme le CBNPC – dans lequel au moins 30 % des tumeurs présentent une déficience en ERCC1, et les anti-PD-1/PD-L1 ont déjà démontré leur efficacité anti-tumorale –, pourraient bénéficier de cette stratégie thérapeutique. Un essai clinique de type « panier »2 vient d’être mis en place à l’institut Gustave Roussy pour évaluer cette stratégie (essai ARIANE, EudraCT 2018-001744-62).