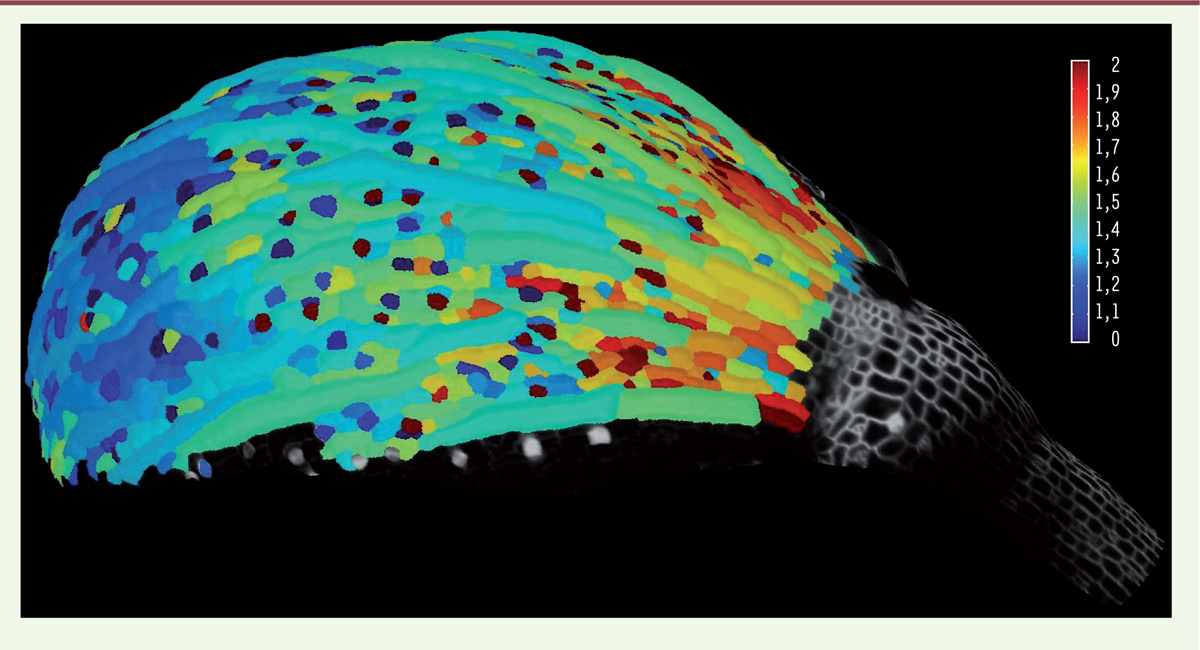
La majorité des animaux, dont les humains, ont une symétrie bilatérale. Ainsi, en général, nos deux mains se superposent quasi parfaitement, et si nous étendons nos bras, nous trouvons que leurs longueurs sont quasiment identiques. De même, un plant de pétunia présente des fleurs dont les formes et tailles sont quasi identiques. Il peut sembler banal que deux organes qui résultent d’un même processus de développement soient identiques comme le sont deux pièces usinées sortant d’une même chaîne de production, mais c’est faire abstraction du fait que chaque organe est composé d’une myriade de cellules qui croissent, se divisent… et se comportent individuellement de manière aléatoire, comme le montre une carte de croissance cellulaire (Figure 1). Se pose ainsi la question de savoir comment des organes ou des organismes atteignent une taille et une forme bien précises au terme de leur développement, alors que la croissance des cellules qui les composent fluctue dans le temps et dans l’espace.
Répondre à cette question nécessite de considérer les effets statistiques liés au grand nombre de cellules qui constituent un organe. Au fur et à mesure que l’organe croît et que ses cellules prolifèrent, les fluctuations individuelles des cellules ont de moins en moins d’impact sur celle de l’organe et, par conséquence, l’incertitude sur la taille de l’organe décroît (ou la précision de la taille augmente). De manière comparable, dans une école, la proportion de filles et de garçons dans des groupes pris au hasard fluctue entre les groupes, mais les fluctuations décroissent avec la taille du groupe, de sorte que le rapport garçons/filles se rapproche de 1,06 à l’échelle de l’école. C’est la loi des grands nombres. Si les cellules d’un organe grandissaient de manière aléatoire et indépendante, la croissance de l’organe, qui intègre la croissance de toutes les cellules, deviendrait de moins en moins variable quand le nombre de cellules augmente [1]. Cependant, un tel scénario ne rend pas vraiment compte de la réalité, car les cellules communiquent entre elles et ne sont donc pas toutes indépendantes les unes des autres. C’est ainsi que nous nous sommes intéressés aux propriétés statistiques émergentes des tissus pour comprendre comment les organes peuvent se développer avec une forme et une taille reproductibles [2].
Outre ces effets statistiques, il convient d’identifier et de prendre en compte les mécanismes à l’œuvre pour que des organes atteignent des formes reproductibles. Si les cellules d’un tissu ont une croissance partiellement aléatoire, les cellules qui grandissent le plus vite ont tendance à pousser leurs voisines. En résultent des forces au sein du tissu. De manière générale, la croissance non uniforme des cellules suscite des forces (contrainte mécanique interne) dans le tissu. De telles forces pourraient être perçues et utilisées par la cellule [3]. La situation ressemble à celle d’une ronde dont les danseurs ont les yeux bandés : chaque danseur a son propre rythme et le rythme fluctue d’un danseur à l’autre ; chaque danseur perçoit donc des forces transmises de main à main par les danseurs voisins. Les danseurs pourraient-ils utiliser ces forces pour adapter leur rythme ?
De nombreux travaux de recherche ont montré que les cellules ont la capacité de percevoir les forces mécaniques et d’y répondre activement de différentes manières. Il a été proposé que le taux de prolifération cellulaire augmente ou diminue lorsque les cellules sont soumises respectivement à des forces de tension ou de compression [3], et cette hypothèse s’est révélée pertinente pour le développement de la mouche du vinaigre (drosophile) et du poisson-zèbre [4–6]. La réponse aux forces mécaniques peut aussi se traduire par une rigidification du tissu, car les multiples fibres qui lui donnent sa rigidité sont affectées par les forces mécaniques. Ainsi, le cytosquelette pourrait être renforcé par une tension mécanique, comme cela a été observé dans le disque imaginal de l’aile de la drosophile [7, 8]. La synthèse de la matrice extracellulaire pourrait également être affectée par les contraintes mécaniques. Chez les plantes, l’équivalent de la matrice extracellulaire est la paroi qui entoure et contient les cellules, et dont les éléments les plus rigides sont les fibres de cellulose. Or, il a été montré que les cellules végétales orientent leur cytosquelette de microtubules en fonction des forces exercées sur leur paroi [9], ce qui conduit vraisemblablement à une synthèse de fibres de cellulose renforçant la paroi dans la direction où la tension est la plus forte. De manière générale, les tissus ne se comportent pas de la même manière si les forces qui leur sont appliquées le sont de manière isotrope (identique dans toutes les directions) ou anisotrope (directionnelle). Les réponses à une contrainte mécanique isotrope (par exemple, le changement du taux de prolifération cellulaire) diffèrent des réponses à une contrainte mécanique anisotrope (par exemple, l’alignement du cytosquelette d’actine).
Notre objectif était de comprendre comment ces différents mécanismes de réponse influent sur la précision de la croissance et de la taille des organes. Nous avons décrit les tissus cellulaires en utilisant un modèle mathématique générique, applicable à une variété de systèmes et de types de réponses. Le modèle ne prend pas en compte les détails de l’arrangement des cellules, décrit les principaux processus à l’œuvre dans les tissus, et se focalise sur les échelles de temps longues pour lesquelles le tissu se réorganise. Les processus pris en compte sont l’équilibre des forces mécaniques et la synthèse de nouveau tissu. L’anisotropie du tissu est également considérée, et peut prendre en compte l’allongement des cellules ou le co-alignement des fibres du cytosquelette, de la matrice extracellulaire ou de la paroi cellulaire. Les réponses à la contrainte mécanique sont un élément essentiel du modèle : la synthèse de tissu varie en réponse à une contrainte mécanique isotrope ou anisotrope, dans le sens positif ou négatif selon qu’un excès de tension du tissu respectivement défavorise ou favorise sa croissance. Une réponse positive à la contrainte isotrope correspond par exemple à un épaississement de la paroi cellulaire ou à une augmentation de la densité de matrice extracellulaire lorsque le tissu est soumis à une tension, alors qu’une réponse négative correspond à une augmentation du taux de division des cellules lorsque le tissu est soumis à une telle contrainte mécanique. Une réponse positive à la contrainte mécanique anisotrope correspond à la synthèse de fibres (cytosquelette, matrice, paroi) dans la direction de la force maximale, alors qu’une réponse négative à la contrainte mécanique anisotrope correspond à l’intercalation de cellules quand le tissu est étiré (l’intercalation correspond à un échange de voisines entre des cellules, facilitant l’allongement du tissu).
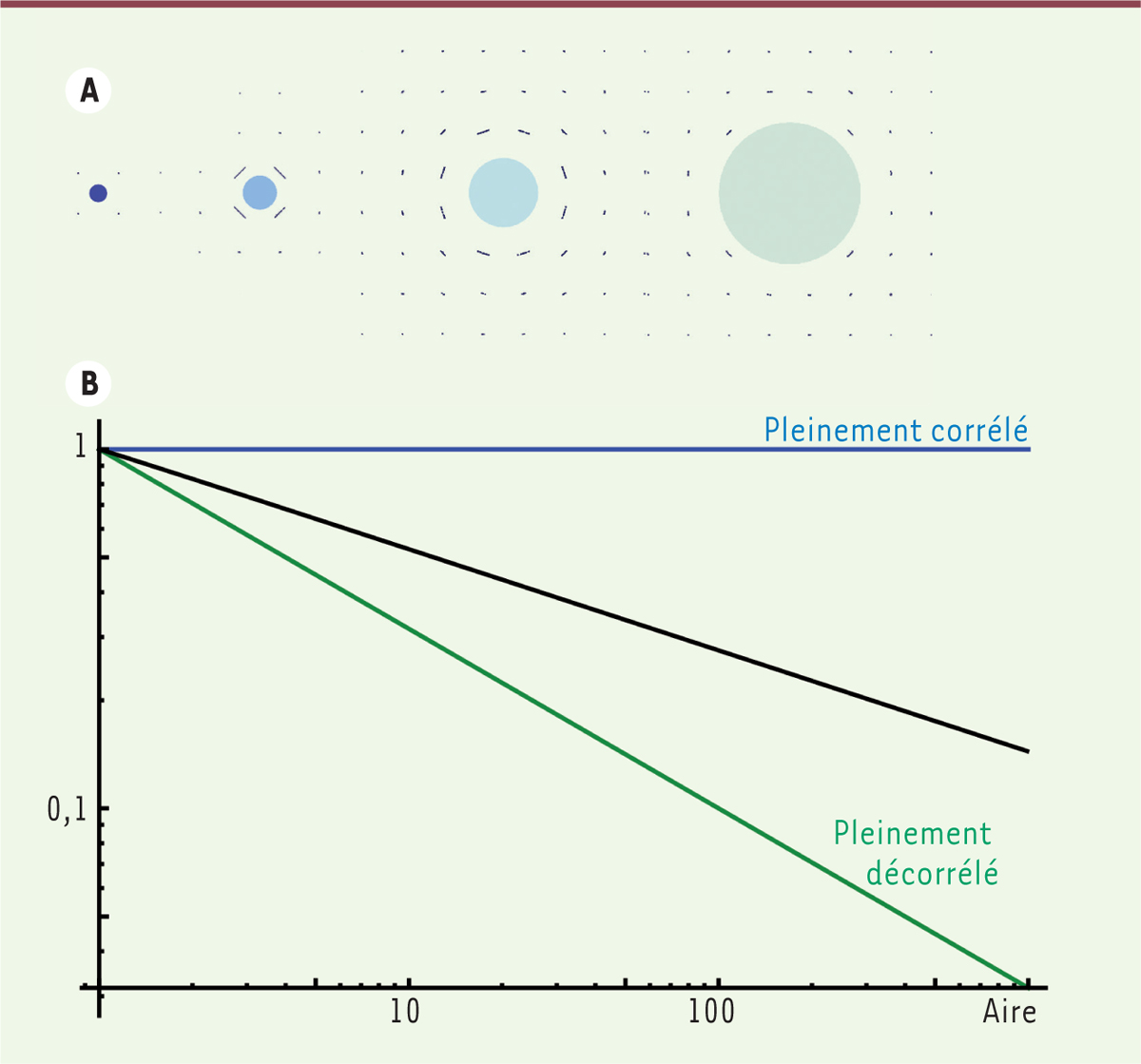
Nous avons appliqué notre modèle à des tissus à deux dimensions, ce qui correspond à des épithéliums, même si nos conclusions sont généralisables à des tissus en trois dimensions. Nous avons d’abord étudié la façon dont les tissus répondent à une perturbation localisée (Figure 2A), par exemple quand le cytosquelette est transitoirement dépolymérisé ou quand la synthèse de la matrice extracellulaire est momentanément réduite dans une région en forme de disque. Le modèle prédit que la région affectée par la perturbation s’étend à la même vitesse que la croissance du tissu entier, alors que l’amplitude de la perturbation est atténuée sous les effets conjugués de la croissance et de la réponse mécanique. Un effet de la réponse mécanique est que le tissu devient anisotrope et s’oriente autour de la perturbation, comme le fait le cytosquelette lors de la cicatrisation d’un épithélium. Nous avons ensuite considéré l’impact de fluctuations aléatoires de la synthèse d’un tissu sur sa dynamique d’expansion. Le modèle prédit que deux régions du tissu, qui correspondraient par exemple à deux cellules distantes, ne croissent pas indépendamment ; les fluctuations de croissance d’une cellule restent donc corrélées avec celles de cellules éloignées. Ces corrélations « à longue portée » sont caractérisées par un exposant, reliant les fluctuations de croissance de surfaces avec la taille de ces dernières (Figure 2B). Une cellule individuelle a donc un plus fort impact sur la taille finale de l’organe que si sa croissance était totalement indépendante de celle des autres cellules de l’organe.
| Figure 2. A. Réponse à une perturbation locale. Profils
instantanés de l’évolution d’une perturbation dans le tissu. La densité
initiale du tissu, qui peut être interprétée comme la densité de cellules ou
la densité de matériau composant le tissu, est initialement réduite dans un
disque. Cette perturbation en densité est représentée par un code couleur
(la densité moyenne étant représentée en blanc, et une densité inférieure à
la moyenne en bleu). L’anisotropie du tissu est représentée par des segments
: le tissu est plus rigide le long de ces traits. B.
Corrélations « de longue portée ». Ce graphique
montre les fluctuations relatives de la croissance surfacique d’un tissu
(écart-type normalisé du taux de croissance) en fonction de son aire. Si les
cellules croissaient de manière complètement corrélée, les fluctuations de
croissance ne dépendraient pas de la taille (exposant nul, courbe bleue) et
si les cellules étaient complètement non corrélées, leurs fluctuations de
croissance diminueraient avec la taille (exposant -0,5, courbe verte). En
général, le modèle prédit un comportement intermédiaire (avec un exposant
compris entre -0,5 et 0, courbe noire), qui est la signature des
corrélations à longue portée. |
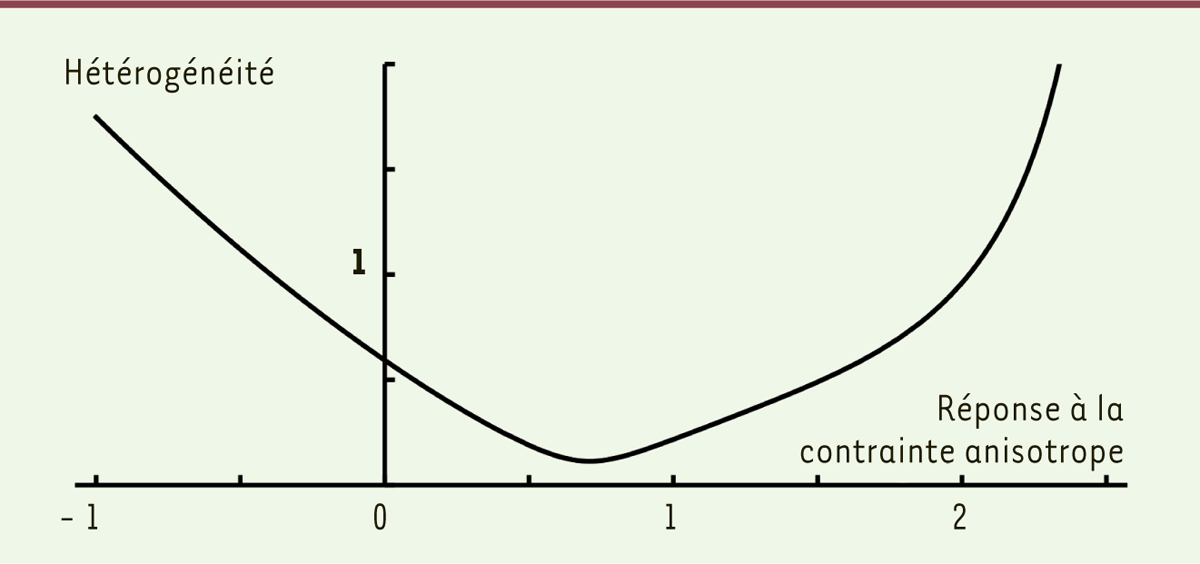
Nous avons finalement considéré la variabilité des formes et tailles d’organes. Le modèle prédit que des tissus dont la réponse à une contrainte mécanique isotrope est positive (les tissus devenant plus rigides sous l’effet d’une tension mécanique) se développent de manière plus hétérogène que des tissus dont la réponse à la contrainte mécanique isotrope est négative (les tissus devenant moins rigides sous l’effet d’une tension mécanique). L’effet de la réponse aux contraintes anisotropes est plus complexe, mais un résultat remarquable est la mise en évidence d’une réponse « optimale » à la contrainte anisotrope : celle qui minimise l’hétérogénéité des formes et tailles d’organes (Figure 3). Pour reprendre la métaphore de la ronde de danseurs, ce dernier résultat peut être qualitativement compris : la ronde peut être rompue si les danseurs répondent trop fortement ou trop faiblement aux forces qu’ils perçoivent ; une réponse « intermédiaire » à ces forces, que l’on peut qualifier d’optimale, assure l’harmonie de la danse.
Les corrélations à longue portée des fluctuations de croissance dans les tissus sont une prédiction importante de notre modèle, car elles déterminent comment les fluctuations de prolifération ou de croissance d’une cellule influencent la taille d’un organe. Pour cette raison, nous pensons qu’il est important que ces corrélations soient mesurées à diverses échelles et dans différents systèmes biologiques. Cela pourrait permettre de comprendre quels processus parmi la division cellulaire, les dynamiques du cytosquelette, de la paroi cellulaire ou de la matrice extracellulaire, contribuent réellement à réguler l’hétérogénéité des tissus. Enfin, nous avons concentré notre recherche sur la reproductibilité de la morphogenèse, prenant pour exemple la symétrie bilatérale chez les animaux ou l’invariabilité des fleurs d’une plante, mais une telle reproductibilité n’est pas toujours de règle. Les feuilles et racines des plantes sont par exemple très fortement plastiques : elles s’adaptent aux conditions environnementales. La progression des tumeurs est susceptible d’être favorisée par une hétérogénéité phénotypique (sans hétérogénéité génétique). En somme, notre travail met en lumière l’importance de l’étude des fluctuations pour comprendre le développement et le fonctionnement des organismes. Enfin, signalons qu’une étude parallèle, par une autre équipe de chercheurs, sur un modèle d’épithélium plan en croissance isotrope ou anisotrope, a obtenu des résultats similaires et complémentaires aux nôtres [10].