| |
| Med Sci (Paris). 35(10): 749–752. doi: 10.1051/medsci/2019143.Nanotaxi® pour les vaccins ARN et
ADN Bruno Pitard1* 1CRCINA, CNRS, Inserm, Université d’Angers, Université de
Nantes, 22 boulevard
Bénoni Goullin, 44200Nantes,
France MeSH keywords: Techniques de transfert de gènes, Nanotechnologie, ARN, Vaccins, Vaccins à ADN, administration et posologie |
La vaccination utilisant des acides nucléiques s’est développée au cours des dernières
décennies. Elle représente une méthode prometteuse et particulièrement attractive pour
prévenir ou guérir des maladies infectieuses ou cancéreuses. Cette approche a suscité un
regain d’intérêt mondial au cours de ces dernières années, suite aux progrès réalisés
dans la compréhension du système immunitaire humain. Les vaccins à base d’acides
nucléiques reposent essentiellement sur deux types de molécules, ADN et ARN messager
(ARNm), qui, lorsqu’elles sont injectées chez un individu, permettent la synthèse de la
protéine immunogénique. La principale différence entre les vaccins à ADN et à ARNm
réside dans le compartiment cellulaire où ces molécules doivent parvenir pour être
actives : le noyau pour l’ADN, et le cytoplasme pour l’ARNm. Les difficultés communes
rencontrées afin de rendre ces vaccins efficaces sont le franchissement de la barrière
cellulaire par les acides nucléiques pour pénétrer à l’intérieur de la cellule, et la
nécessité d’augmenter leur immunogénicité. |
Les vaccins à ADN sont composés d’une simple molécule d’ADN plasmidique circulaire
fermée, contenant un gène codant la protéine immunogénique, et dont l’expression est
contrôlée par un puissant promoteur. Cette technique d’ADN plasmidique est peu
coûteuse, robuste, simple d’utilisation, et possède un excellent profil d’innocuité
lors des différents essais cliniques. Depuis les travaux pionniers de Jon Wolff
[1], ce mode
d’administration de l’immunogène in vivo, par l’intermédiaire d’une
molécule d’ADN injectée, a fait l’objet de nombreuses études précliniques contre des
cibles variées dans le domaine des maladies infectieuses et de l’oncologie.
Cependant, les résultats prometteurs obtenus chez les petits animaux n’ont pas été
reproduits chez l’homme. Dans un premier temps, cela a été attribué à une expression
insuffisante de l’immunogène codé par l’ADN chez l’individu vacciné, même si des
doses de plusieurs milligrammes d’ADN étaient utilisées dans les essais cliniques :
typiquement de 1 à 5 mg d’ADN par injection, ce qui correspond à des doses allant de
0,014 à 0,07 mg d’ADN/kg pour un adulte de 70 kg et représente 100 fois moins d’ADN
que la dose efficace chez la souris (1-4 mg d’ADN/kg). Les travaux de plusieurs
groupes de recherche ont permis d’augmenter la quantité d’immunogène produite, et
ainsi d’accroître progressivement l’immunogénicité des vaccins à ADN : stratégies
d’optimisation du squelette de l’ADN plasmidique, mais aussi mise au point de
nouvelles méthodes d’administration de ces vaccins telles que l’électroporation du
tissu d’injection [2].
Cependant, ces améliorations n’ont pas permis d’atteindre le niveau d’immunogénicité
souhaité chez l’homme, ce qui a motivé la mise au point de méthodes plus appropriées
pour renforcer la réponse immunitaire induite par les vaccins à ADN. |
Les vaccins à ARNm utilisent des molécules linéaires comportant une extrémité 5’
pourvue d’une coiffe protégeant l’ARNm et recrutant le ribosome, la séquence codant
l’immunogène, et une extrémité 3’ constituée d’une séquence de polyadénosine
augmentant la stabilité des molécules. Les molécules d’ARNm sont produites par
transcription enzymatique in vitro à partir d’ADN plasmidique. Le
procédé de production des vaccins à ARNm comporte donc une étape supplémentaire par
rapport à la production de vaccins à ADN, qui utilisent directement les molécules
d’ADN plasmidique produites. Les molécules d’ARNm sont environ 5 fois plus petites
que les molécules d’ADN utilisées pour la vaccination. Néanmoins, le développement de cette nouvelle génération de vaccins à ARNm ou à ADN
nécessite encore de nouvelles méthodes pour augmenter l’expression et
l’immunogénicité de la protéine produite. A ce jour, aucun vaccin à base d’ADN ou
d’ARNm n’a entraîné une protection suffisante dans des essais cliniques de phase III
chez l’homme. En revanche, quatre vaccins à ADN ont reçu les autorisations
règlementaires nécessaires à leur exploitation commerciale pour protéger les saumons
d’élevage contre la nécrose hématopoïétique infectieuse et contre une maladie du
pancréas due à un sous-type d’alphavirus, les poulets contre la grippe aviaire, et
pour traiter des chiens atteints d’un mélanome buccal. |
Obtenir une grande quantité d’immunogène à partir de l’ADN ou de l’ARNm injecté ne
constitue malheureusement qu’une partie de la solution pour améliorer
l’immunogénicité des vaccins à base d’acides nucléiques. De façon comparable à ce
qui se passe au cours d’une infection bactérienne ou virale, l’activation de
récepteurs de l’immunité innée, qui déclenche un « signal de danger », constituerait
une condition préalable à une forte réponse immunitaire adaptative. Cet « effet inné
» est une étape essentielle pour créer un environnement local contenant des
cytokines et des interférons pro-inflammatoires, propice au recrutement et à
l’activation adéquate des cellules immunitaires contre un agent pathogène ou une
tumeur. Un vaccin à acides nucléiques idéal ne devrait donc pas seulement délivrer
l’acide nucléique codant l’antigène cible à tout type de cellules susceptibles de
contribuer à l’expression et/ou à la présentation de l’antigène au système
immunitaire, mais également activer suffisamment les capteurs de danger exprimés par
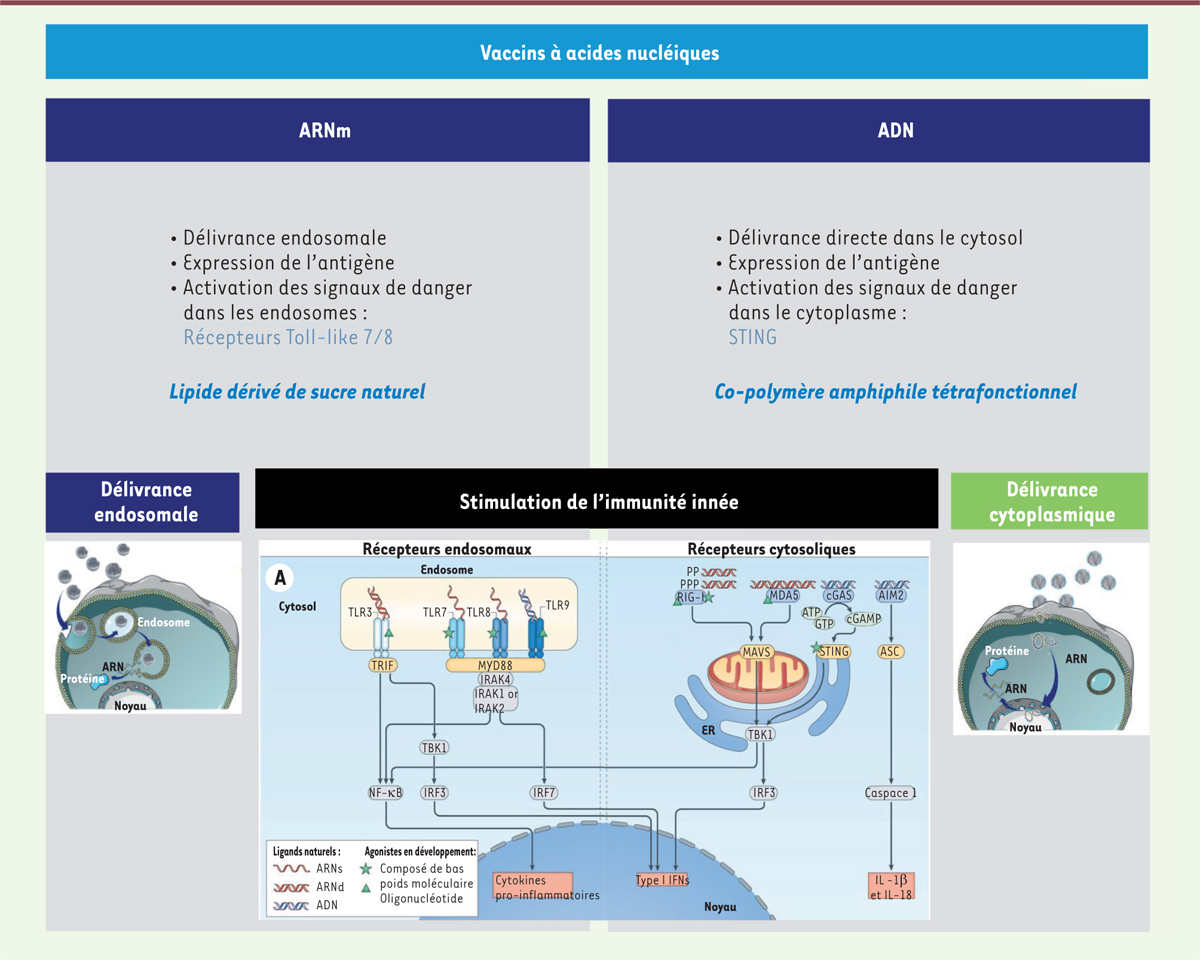
ces cellules. Les « capteurs de danger » pour l’ADN et l’ARNm ne sont pas les mêmes et sont
localisés à des endroits différents de la cellule [3]. En situation physiologique, les molécules
d’ADN constituant le génome sont localisées dans le noyau des cellules, et les
capteurs en charge de la détection de molécules d’ADN étrangères sont donc localisés
en dehors du noyau, majoritairement dans le cytoplasme: cGAS-STING (cyclic
GMP-AMP synthase-stimulator of interferon genes), DHX (DEAH box
nucleic acid helicase), AIM2 (absent in melanoma 2)…
Inversement, les molécules d’ARNm mature assurant la synthèse des protéines sont
localisées dans le cytoplasme, et les capteurs de danger pour la détection d’ARNm
exogènes sont situés majoritairement dans les endosomes (TLR7/8, Toll-like
receptors 7 et 8) afin d’éviter des réactions inflammatoires
chroniques. Cette différence nous a conduits à définir de nouvelles classes de
vecteurs synthétiques capables de maximiser l’activation des signaux de danger en
fonction de l’acide nucléique utilisé pour produire l’antigène. C’est ainsi que les
molécules d’ADN constituant les vaccins devront être délivrées aux cellules
directement dans le cytoplasme, tandis que les molécules d’ARNm devront être ciblés
dans les endosomes. Bien entendu, les molécules d’ADN devront ensuite parvenir au
noyau pour y être transcrites en ARNm et traduites en protéine immunogénique dans le
cytoplasme, alors que les molécules d’ARNm devront sortir des endosomes pour être
traduites en protéine immunogénique dans le cytoplasme. Quelles que soient les
molécules d’acide nucléique utilisées, elles devront donc franchir deux membranes :
les membranes plasmique et nucléaire pour l’ADN, la membranes plasmique et celle des
endosomes pour l’ARNm. |
Le transport d’ADN ou d’ARNm par nanovecteurs Pour accomplir le transport direct dans le cytoplasme des molécules d’ADN et dans les
endosomes pour les molécules d’ARNm, deux systèmes de vectorisation différents ont
été inventés. L’ADN plasmidique est vectorisé avec un copolymère amphiphile tétra-fonctionnel (en
forme d’étoile), constitué de quatre blocs polymériques hydrophobes-hydrophiles
centrés sur un cœur ionisable que nous avons nommé Nanotaxi®. Dans les
modèles précliniques, cette formulation a démontré une augmentation de la production
de protéines codées par l’ADN, et s’est avérée suivre un mécanisme de délivrance
intracellulaire directe, ce qui optimise l’accès du vaccin aux capteurs de danger de
l’ADN cytoplasmique. Nous avons démontré sa capacité à améliorer l’immunogénicité
des vaccins à ADN dans de nombreux modèles comme ceux du carcinome hépatocellulaire
[4], d’asthme allergique
[5], de cancer colorectal
[6], de l’infection à
Mycobacterium abscessus dans la mucoviscidose [7], ainsi que contre la protéine dérivée
de la transposase codée par des néogènes humains [8], et contre le virus Zika [9]. Ce vaccin à base de copolymère
amphiphile tétra-fonctionnel et d’ADN est actuellement en phase d’essai clinique
dans le contexte de l’hépatocarcinome cellulaire, avec le gène codant l’antigène
embryonnaire a-fœtoprotéine, qui est surexprimé chez 70 % des individus atteints de
ce cancer. Les résultats de l’étude réglementaire d’innocuité ont démontré que le
copolymère amphiphile tétra-fonctionnel seul ou en association avec l’ADN est très
bien toléré, n’induisant ni mortalité ni toxicité. L’ARNm est formulé avec une classe différente de molécules chimiques, certes toujours
amphiphiles, mais de nature lipidique et non-polymérique. Dans une publication
récente [10], grâce à une
méthode originale non invasive chez le macaque par tomographie d’émission de
positrons et imagerie infrarouge (Figure
1), nous avons montré que le nanovecteur lipidique CHOLK
(cholestérol-kanamycine), dérivé d’un sucre naturel, permet la délivrance d’ARNm
dans les cellules présentatrices d’antigènes au niveau du site d’injection et des
ganglions lymphatiques drainant ce site. Ce nanovecteur lipidique, constitué d’une
molécule unique et non pas d’un mélange complexe d’adjuvants, conduit donc, par ses
propriétés physicochimiques, à la biodistribution idéale dans les ganglions
lymphatiques et à la délivrance des molécules d’ARNm aux cellules clefs du système
immunitaire, dans lesquelles a également été démontrée l’activation des signaux de
danger spécifiques des ARNm et la synthèse de l’immunogène.
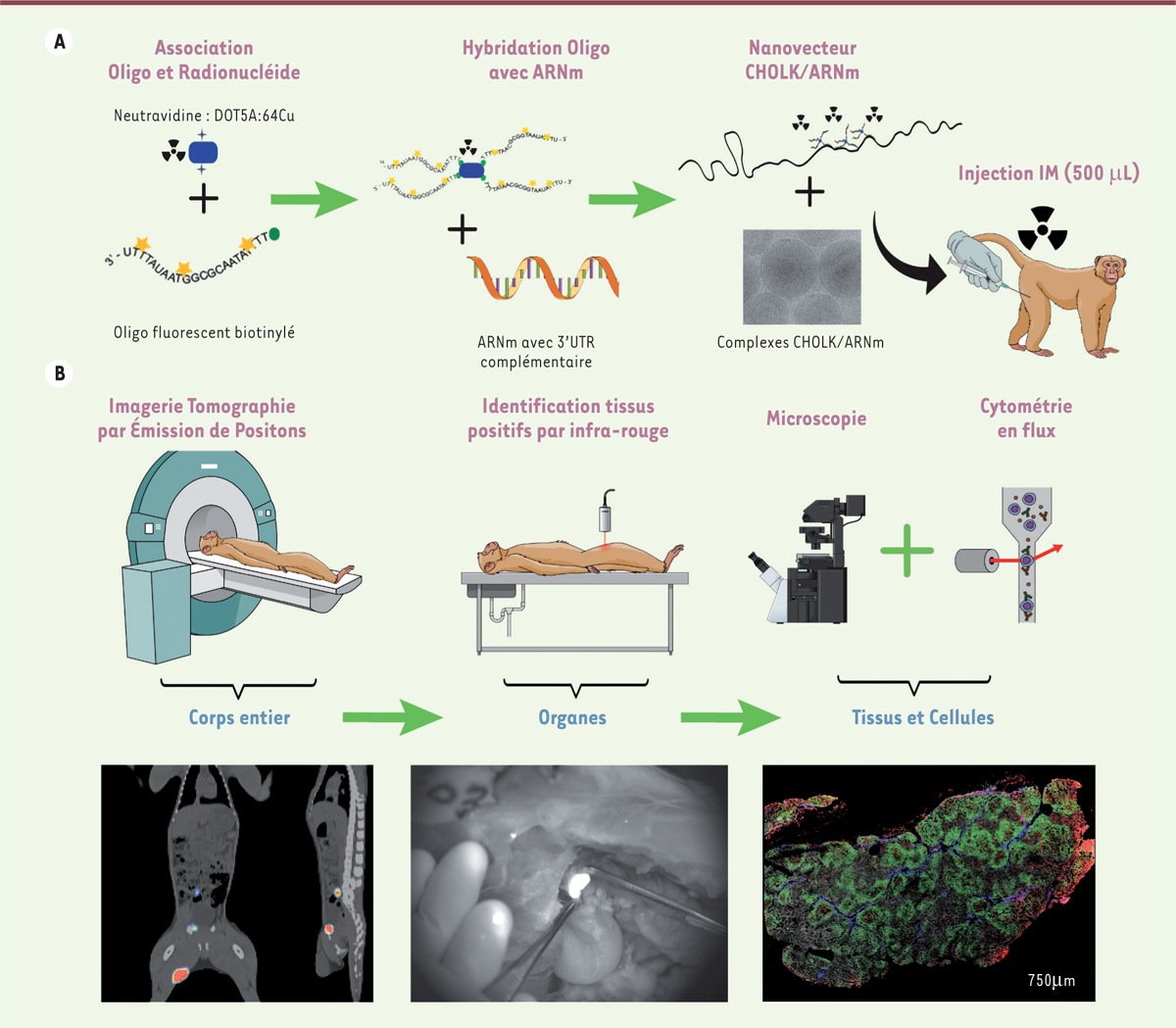
 | Figure 1. Méthode originale non-invasive chez le macaque cynomolgus
pour le suivi spatio-temporel d’un nanovecteur transportant des
molécules d’ARNm marquées par une sonde multidimensionnelle.
A. Représentation schématique du marquage des
molécules d’ARNm avec une sonde radioactive/proche infrarouge
(64Cu/dylight680) et association au nanovecteur CHOLK.
B. Représentation schématique du
suivi en imagerie par tomographie d’émission de positrons corps entier,
puis identification des tissus ayant incorporé les molécules d’ARNm avec
une caméra portative proche infrarouge et enfin extraction des tissus
pour analyse cellulaire par microscopie et cytométrie en flux. Les
images en bas de la figure illustrent les données collectées à chaque
étape, et montrent la dynamique du transport des ARNm avec CHOLK : ces
ARNm ont parcouru environ 9 cm par rapport au site d’injection, et ont
atteint les ganglions lymphatiques para-aortiques. |
|
La vaccination à base d’acides nucléiques repose sur un processus complexe, où deux
éléments doivent être pris en compte pour optimiser à la fois la production de
l’immunogène et la stimulation de l’immunité innée créant un environnement propice à
l’activation d’une réponse immune spécifique de l’immunogène. Les molécules d’ADN
plasmidique et d’ARNm doivent respectivement transiter directement par le cytoplasme
et par les endosomes des cellules cibles. Compte tenu de ces contraintes spatiales
et des propriétés physico-chimiques différentes de l’ADN et des ARNm, deux systèmes
synthétiques de délivrance différents ont été inventés, reposant respectivement sur
des polymères amphiphiles en forme d’étoile et sur des lipides dérivés de sucres
naturels (Figure 2).
 | Figure 2.
Les deux types de vaccins à base d’acides nucléiques
nécessitent des systèmes de vectorisation synthétiques
différents en fonction de la nature de l’acide nucléique codant
l’antigène et de la localisation cellulaire des capteurs
biologiques de danger correspondants, afin d’activer au mieux
ces capteurs, et optimiser ainsi la réponse
immunitaire.
|
Cette activité scientifique multidisciplinaire dédiée à la vaccination à base
d’acides nucléiques devra être validée chez l’homme par des essais cliniques pour le
futur développement de vaccins prophylactiques ou thérapeutiques utilisant une
séquence informative instruisant le système immunitaire de l’individu vacciné. |
L’auteur déclare être à l’origine de brevets et demandes de brevets
revendiquant l’utilisation de molécules amphiphiles dérivées de sucres naturels
et de copolymères amphiphiles pour la formulation d’acides nucléiques. L’auteur
déclare également être co-fondateur d’In-Cell-Art.
|
1. Wolff
JA,
Malone
RW,
Williams
P, et al. Direct
gene transfer into mouse muscle in vivo .
Science.
1990; ;247
::1465.–1468. 2. Mir
LM,
Bureau
MF,
Gehl
J, et al.
High-efficiency gene transfer into skeletal muscle mediated
by electric pulses . Proc Natl Acad Sci
USA.
1999; ;96
::4262.–4267. 3. Wu
J,
Chen
JZ. Innate immune
sensing and signaling of cytosolic nucleic acids .
Annu Rev Immunol.
2014; ;32
::461.–468. 4. Cany
J,
Barteau
B,
Tran
L, et al.
AFP-specific immunotherapy impairs growth of autochthonous
hepatocellular carcinoma in mice . J
Hepatol.
2011; ;54
::115.–121. 5. Beilvert
F,
Tissot
A,
Langelot
M, et al.
DNA/amphiphilic block copolymer nanospheres reduce asthmatic
response in a mouse model of allergic asthma .
Hum Gene Ther.
2012; ;23
::597.–608. 6. Cambien
B,
Richard-Fiardo
P,
Karimdjee
BF, et al.
CCL5 neutralization restricts cancer growth and potentiates the
targeting of PDGFRbeta in colorectal carcinoma .
PLoS One.
2011; ;6 ::e28842.. 7. Le Moigne
V,
Rottman
M,
Goulard
C, et al.
Bacterial phospholipases C as vaccine candidate antigens against
cystic fibrosis respiratory pathogens: the Mycobacterium
abscessus model . Vaccine.
2015; ;33
::2118.–2124. 8. Arnaoty
A,
Gouilleux-Gruart
V,
Casteret
S, et al.
Reliability of the nanopheres-DNA immunization technology to
produce polyclonal antibodies directed against human neogenic
proteins . Mol Genet
Genomics.
2013; ;288
::347.–363. 9. Hraber
P,
Bradfute
S,
Clarke
E, et al.
Amphiphilic block copolymer delivery of a DNA vaccine against
Zika virus . Vaccine.
2018; ;36
::6911.–6917. 10. Lindsay
KE,
Bhosle
SM,
Zurla
C, et al.
Visualization of early events in mRNA vaccine delivery in
non-human primates via PET-CT and near-infrared imaging .
Nat Biomed Eng.
2019; ;5
::371.–380. |