| |
| Med Sci (Paris). 35(10): 771–778. doi: 10.1051/medsci/2019155.Les cellules souches pluripotentes dans le traitement
de l’insuffisance cardiaque Statut actuel, problèmes et perspectives Manon Desgres1 and Philippe Menasché1,2* 1Université de Paris, PARCC, Inserm,
F-75015Paris,
France 2Département de chirurgie cardio-vasculaire, Hôpital Européen
Georges Pompidou, 20 rue
Leblanc, 75015Paris,
France |
Vignette (Photo © Inserm - Belmadani, Souâd). Alors que pendant longtemps, le traitement de la plupart des maladies a reposé sur deux
piliers principaux, à savoir les médicaments et les procédures interventionnelles, les
biothérapies ont émergé au cours des deux dernières décennies comme une troisième option
thérapeutique potentielle. Parmi elles, l’utilisation de cellules continue de susciter
un intérêt majeur parce qu’au contraire des thérapeutiques conventionnelles, elle ne
cible pas la rémission des symptômes mais s’adresse aux racines même de la maladie en
visant la réparation ou, encore mieux, la régénération du tissu pathologique.
Historiquement, les cellules de tissu adulte ont été les plus fréquemment utilisées dans
de nombreux essais cliniques, mais la reconnaissance de leurs limites, principalement un
potentiel de différenciation et de prolifération limité, a progressivement conduit à
considérer des cellules plus immatures et, en particulier, les cellules souches
pluripotentes (CSP), comme des alternatives attractives. Classiquement définies par la
double propriété d’auto-renouvellement indéfini et de différenciation vers tous les
types cellulaires (hormis les annexes embryonnaires), ces cellules offrent sur le plan
thérapeutique l’intérêt d’un contrôle précis du processus de différenciation qui peut
ainsi être « gelé » au stade souhaité (progéniteurs précoces ou cellules plus matures) –
toutes propriétés dont sont dépourvues les cellules adultes. Aussi les remarques qui
suivent déborderont-elles occasionnellement le strict cadre des applications cardiaques
pour souligner la communauté trans-disciplinaire des problèmes que pose l’utilisation
des CSP à des fins thérapeutiques et des solutions possibles. |
Les premières CSP qui ont été utilisées en clinique ont ciblé les paraplégies
traumatiques. Un essai de phase I utilisant des progéniteurs d’oligodendrocytes
dérivés de cellules souches embryonnaires (CSE) a été initié en octobre 2010 puis
rapidement arrêté, lorsque la société a décidé de se recentrer sur des indications
oncologiques. Il a depuis été repris et, en janvier 2019, les résultats à un an
concernant 25 patients ont été rapportés montrant l’absence de complication
spécifique et des améliorations encourageantes de la motricité des membres
supérieurs. Le deuxième organe ciblé par les dérivés différenciés des CSE a été l’œil pour le
traitement de la dégénérescence maculaire liée à l’âge et la maladie de
Stargardt1 comme indications prioritaires.
L’essai pionnier [1] a inclus
18 patients suivis pendant 22 mois après une transplantation sous-rétinienne de
nombres croissants de progéniteurs de l’épithélium rétinien. Les seules
complications rapportées ont été celles en rapport avec la chirurgie ou le
traitement immuno-suppresseur, mais une amélioration de l’acuité visuelle a été
observée dans plus de la moitié des yeux traités. Plus récemment, une amélioration
identique de l’acuité visuelle a été rapportée dans deux essais effectués sur des
cohortes de petite taille où les injections de suspensions cellulaires ont été
remplacées par une transplantation des progéniteurs rétiniens déposés sur une
matrice visant à reproduire la membrane de Bruch2 [2]. Le cerveau des patients parkinsoniens est une autre indication potentielle des CSP
qu’il est possible de différencier en neurones dopaminergiques. Après
transplantation intra-cérébrale, ces neurones sont capables d’améliorer les déficits
moteurs dans des modèles pré-cliniques de la maladie y compris chez le primate non
humain [3]. Ces données
expérimentales ont ouvert la voie à un essai clinique en cours en Chine. La meilleure connaissance des voies de signalisation modulant les différentes étapes
conduisant les cellules de l’endoderme vers la génération d’îlots pancréatiques a
permis de reproduire in vitro ces étapes et ainsi générer des
cellules β-like à partir de CSP destinées au traitement du diabète
[4]. Pour éviter le rejet
de ces cellules et réduire ou, encore mieux, éliminer la nécessité de médicaments
immuno-suppresseurs, les cellules ont en général été encapsulées dans des
microparticules d’alginate avec l’idée que la membrane de la capsule les protégerait
d’une destruction par le système immunitaire du receveur tout en permettant à la
fois un influx d’oxygène et de facteurs nutritifs et la libération de l’insuline
produite par les cellules encapsulées. Une limite majeure de cette stratégie
d’encapsulation a été la survenue de réactions à des corps étrangers et le
développement secondaire d’une fibrose péri-capsulaire limitant le fonctionnement à
long terme du greffon. Aussi plusieurs technologies visent-elles actuellement à
optimiser la formulation de ces particules d’alginate [5] et à favoriser la vascularisation des îlots
greffés. Dans le cas de l’insuffisance cardiaque, les premières cellules qui ont été
implantées cliniquement dans le myocarde ont été les myoblastes squelettiques et les
cellules mononucléées issues de la moelle osseuse. Les résultats décevants de ces
essais ont secondairement conduit à privilégier plutôt les cellules mésenchymateuses
de diverses origines (moelle osseuse, tissu adipeux, cordon ombilical) et qui, bien
que le qualificatif « souches » leur soit habituellement accolé, n’en ont pas les
attributs. Actuellement, plus d’une vingtaine d’essais cliniques testant ces
cellules sont en cours. En parallèle, la reconnaissance que de meilleurs résultats
pourraient sans doute être obtenus avec des cellules de phénotype proche de celui
des cellules de l’organe cible a été à l’origine d’une seconde génération d’essais
cliniques utilisant des cellules engagées vers un lignage cardiaque : cellules
mésenchymateuses autologues de moelle dites « cardiopoïétiques » car traitées
préalablement in vitro pour surexprimer des facteurs de
transcription cardiaques [6]
; cardiosphères qui sont des agglomérats de plusieurs types cellulaires prélevés par
biopsie endomyocardique du ventricule droit [7] ; « cellules souches cardiaques » c-kit
positives, cultivées à partir d’une biopsie per-opératoire de l’oreillette droite
[8]. Néanmoins, les
résultats de ces essais cliniques se sont révélés être neutres (avec les cellules
médullaires cardiopoïétiques et les cardiosphères), quand ils n’ont pas été
franchement remis en cause au nom de l’honnêteté scientifique (pour les cellules
c-kit positives), ce qui a constitué l’incitation la plus forte
à explorer aujourd’hui la piste alternative des CSP pour générer des cellules
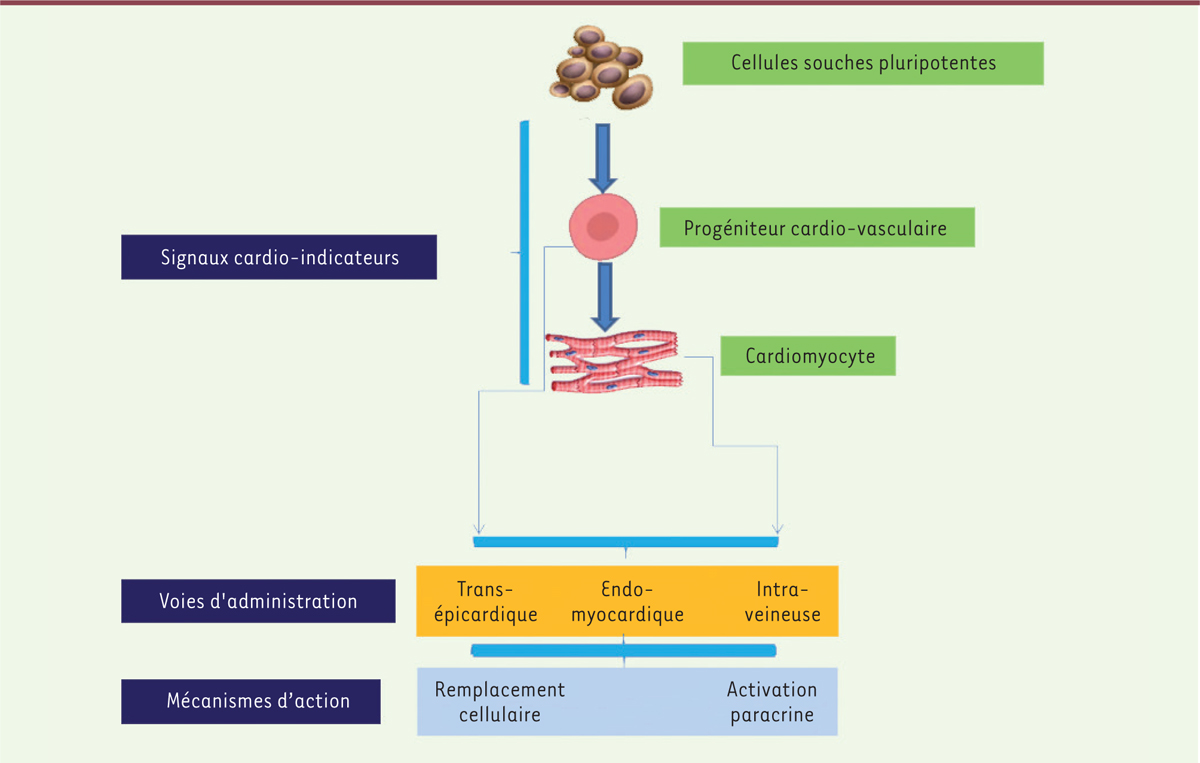
cardiaques. Le contrôle des signaux cardio-instructeurs (leur nature, la durée d’exposition
nécessaire) permet, comme indiqué plus haut, de sélectionner le stade de
différenciation souhaité pour la transplantation : progéniteurs cardio-vasculaires
ou cardiomyocytes différenciés. C’est la première option que nous avons retenue pour
notre essai clinique (ESCORT) qui a utilisé des progéniteurs précoces
Isl-1+ incorporés dans un gel de fibrine déposé sur
l’épicarde de la zone infarcie au cours d’un pontage coronaire réalisé chez 6
patients présentant une dysfonction ventriculaire gauche sévère [9]. Au-delà de la démonstration qu’un
tel produit de l’ingénierie tissulaire pouvait être fabriqué selon les normes
réglementaires en vigueur, notre essai a atteint avec succès son objectif premier
qui était la sécurité, dans la mesure où, avec un recul aujourd’hui maximal de 4 ans
et 5 mois (en mars 2019), aucun des patients n’a présenté de complications pouvant
être spécifiquement attribuées aux cellules greffées (troubles du rythme, tumeurs,
allo-immunisation cliniquement pertinente). Cependant, en raison de son protocole,
l’essai ne peut naturellement pas répondre à la question de l’efficacité, et
l’amélioration de l’épaississement systolique des segments myocardiques traités par
le patch cellularisé et non revascularisés, telle qu’elle a été observée chez
certains patients, ne peut au mieux qu’être considérée comme un signal
encourageant. Alors que les cellules souches embryonnaires ont été les premières cellules
pluripotentes à être testées cliniquement, elles sont maintenant relayées par les
cellules souches induites à la pluripotence (iPSC). Le premier essai initié au Japon
a utilisé des progéniteurs de l’épithélium rétinien dérivés d’iPSC pour traiter la
dégénérescence maculaire. L’étude a néanmoins été arrêtée après le premier patient
en raison d’altérations génétiques des cellules qui avaient été préparées pour le
traitement du second [10].
Cette observation a conduit les investigateurs à modifier le protocole et à utiliser
des iPSC allogéniques, qui, elles, ont franchi avec succès tous les contrôles de
qualité. À ce jour, un patient a été transplanté et quatre autres sont en attente de
traitement. D’autres essais utilisant ces iPSC sont en préparation pour le
traitement de différentes pathologies : maladie de Parkinson, paraplégies
traumatiques, maladies cornéennes et insuffisance cardiaque, dans ce dernier cas en
Chine où l’étude a débuté, ainsi qu’au Japon et en Allemagne. Contrairement à notre
choix pour l’essai ESCORT, celui des investigateurs est de transplanter
préférentiellement des cardiomyocytes déjà différenciés. Tous ces essais de thérapie cellulaire utilisant des CSP ont ainsi avant tout
démontré la sécurité de ce type de traitement (5 patients de la première étude
portant sur les paraplégies traumatiques sont maintenant à 8 années de leur greffe
sans aucun effet secondaire rapporté) mais peu de ces études ont été conçues pour
réellement démontrer son efficacité. Néanmoins, quelques signaux encourageants ont
déjà émergé. Ils rendent crédible l’hypothèse que les cellules différenciées à
partir de CSP ou leurs produits de sécrétion peuvent trouver une place dans
l’arsenal des traitements contre de nombreuses maladies mettant en jeu le pronostic
vital du patient ou fonctionnellement invalidantes. Naturellement, les résultats des
essais actuels et futurs devront être analysés à la lumière de ceux obtenus avec des
traitements alternatifs qui font également l’objet d’investigations extensives pour
traiter les mêmes pathologies, comme la thérapie génique pour les maladies oculaires
[11], les pompes à
insuline dans le diabète [12] ou l’administration intra-cérébrale directe de facteurs de
croissance dans la maladie de Parkinson [13]. |
Historiquement, le premier objectif de la thérapie cellulaire a été de remplacer le
tissu pathologique par de nouvelles cellules visant à créer un néo-tissu
fonctionnel. Cet objectif a été atteint avec succès dans des modèles de cardiopathie
ischémique après transplantation intra-myocardique de cardiomyocytes dérivés d’iPSC
[14], cellules qui se
sont d’ailleurs révélées supérieures à celles d’autres sources somatiques [15]. Toutefois, la
translation clinique de cette approche pose des défis majeurs. Le premier est la
nécessité de transplanter des quantités très importantes de cardiomyocytes, de
l’ordre du milliard, compte tenu de l’étendue habituelle des dommages myocardiques
qui peuvent justifier ce type de procédure. Conserver un tel nombre de cellules
vivantes et viables sur une longue période de temps, de sorte qu’elles puissent
efficacement contribuer à la génération d’une force contractile, est un autre défi
qui a motivé l’évaluation expérimentale de multiples stratégies destinées à
améliorer la survie du greffon et souvent fondées sur l’ingénierie génétique ou le
pré-conditionnement des cellules [16]. Toutefois, ces approches n’ont pas, à ce jour, été traduites en
clinique à cause de la complexité technique réglementaire et économique qui leur est
liée. Idéalement, enfin, les cardiomyocytes injectés doivent se coupler avec ceux du
myocarde receveur de façon homogène afin d’éviter les troubles du rythme, un risque
qui a été documenté chez le primate non humain [14] et chez le porc [17] où la présence initiale de cardiomyocytes dérivés d’iPSC ou de CSE
est obtenue au prix d’arythmies ventriculaires précoces. La discordance observée constamment entre la perte rapide des cellules greffées et la
persistance d’un effet fonctionnel bénéfique a conduit à l’hypothèse d’une
signalisation paracrine [18] par laquelle des molécules bioactives sécrétées par les cellules du
greffon activent des mécanismes endogènes de réparation tissulaire. Ceux-ci se
manifestent notamment par une stimulation de l’angiogénèse et une diminution de
l’inflammation, de la fibrose et peut-être de l’apoptose, alors qu’une prolifération
des cardiomyocytes de l’hôte paraît plus incertaine. Ce sécrétome cellulaire
responsable de l’effet paracrine est constitué principalement de facteurs solubles
(facteurs de croissance, cytokines) et de vésicules extra-cellulaires,
nanoparticules qui regroupent exosomes et microparticules (que l’on distingue en
fonction de leur taille, biogenèse et contenu). Ces vésicules jouent un rôle majeur
dans la communication inter-cellulaire grâce à leur capacité à transférer dans les
cellules « receveuses » un contenu riche en protéines, lipides et acides nucléiques
et à ainsi modifier leurs fonctions. Cette hypothèse paracrine est renforcée par
l’observation que le sécrétome cellulaire peut reproduire les effets protecteurs des
cellules mères dans de multiples modèles pré-cliniques, notamment de pathologie
cardiaque [19]. Cette
hypothèse a deux conséquences directes sur le choix des cellules à implanter : elles
doivent présenter un fort potentiel sécrétoire, ce qui est le cas des cellules
encore peu différenciées, et un phénotype aussi proche que possible de celui des
cellules du tissu ciblé [20], ce qui qualifie particulièrement des cellules engagées vers un lignage
cardiaque [21]. Le fait que
les effets cardio-protecteurs des cellules transplantées peuvent être obtenus en
utilisant leur sécrétome conduit actuellement à l’idée de n’administrer que ce
dernier et non les cellules elles-mêmes. Ceci pourrait représenter des avantages en
clinique avec, en particulier, un procédé de fabrication se rapprochant davantage de
celui d’un médicament, l’absence d’immunogénicité (en fonction de la source
cellulaire) et une stabilité sous cryopréservation permettant une disponibilité
immédiate. Quel que soit le mécanisme d’action impliqué (direct ou paracrine), une difficulté
majeure reste d’assurer une prise de greffe effective. Dans le cas spécifique des
CSP, qui sont par définition allogèniques (seules les iPSC peuvent être d’origine
autologue mais, pour des raisons logistiques et financières, la tendance est de les
utiliser également dans des situations allogéniques lorsque l’objectif est la
réparation tissulaire), la prévention du rejet est très dépendante du mécanisme
d’action présumé des cellules greffées. Dans l’hypothèse paracrine, il est assumé
que les cellules vont inévitablement mourir et n’ont besoin d’être présentes que
transitoirement, le temps de libérer les biomolécules sous-tendant leurs effets.
Dans ce cas, l’immunosuppression peut n’être prescrite que pendant une courte
période (1 mois dans notre essai), ce qui est habituellement bien toléré. À
l’opposé, si l’objectif est une permanence des cellules à long terme,
l’immunosuppression (induite par la ciclosporine, le FK506-tacrolimus, ou les
corticoïdes) devrait théoriquement être également induite à vie, mais on en connaît
les effets secondaires indésirables et les protocoles des essais en préparation
divergent encore sur le type de molécules le plus approprié, leur dosage optimal et
la durée nécessaire du traitement. Compte tenu des limites de cette classique
immunosuppression médicamenteuse, des options alternatives sont en cours de
développement : la compatibilité immunologique entre donneur et receveur, par
l’utilisation de cellules provenant de lignées haplotypées en ce qui concerne les
molécules du système HLA (human leukocyte antigen) [22] ; l’ingénierie génétique
des CSP pour éliminer les gènes codant les molécules HLA de classes I et II [23] ; ou l’induction d’une
tolérance immunologique par le conditionnement de l’hôte par une activation ou un
transfert adoptif de lymphocytes T régulateurs [24]. À l’exception de la compatibilité des
molécules du système HLA, actuellement testée dans la maladie de Parkinson, aucune
de ces approches n’a encore été utilisée cliniquement. L’objectif de repeupler le cœur avec de nouveaux cardiomyocytes pourrait aussi être
atteint par des approches alternatives fondées sur la stimulation de la division des
cardiomyocytes endogènes obtenue en levant les points de contrôle du cycle
cellulaire [25]. Mais ceci
semble nécessiter de modifier le métabolisme des cellules afin de favoriser la
glycolyse aux dépens de la phosphorylation oxydative qui a été identifiée comme un
frein majeur à la prolifération des cardiomyocytes [26]. Les applications cliniques de ces
approches restent donc sans doute encore lointaines. |
Le transfert des cellules Les cellules sont habituellement injectées directement dans l’organe cible. Cette
procédure peut néanmoins altérer à la fois le tissu hôte et les cellules elles-mêmes
en raison de l’augmentation très importante des contraintes de cisaillement auxquels
elles sont soumises lorsqu’elles passent de la seringue à une aiguille de petit
calibre [27]. Dans la
seringue, les cellules en suspension tendent également à sédimenter, ce qui peut
induire un gradient de densité à l’origine d’une dispersion inégale des cellules et
donc à une quantité délivrée variable lorsque des injections multiples sont
réalisées, les densités cellulaires les plus élevées correspondant à la première
injection. Des améliorations sont envisagées afin d’augmenter la précision du
transfert tout en minimisant son caractère invasif. Dans le cœur, les principales voies d’administration des cellules ont été
trans-épicardiques, trans-endocardiques ou intra-coronaires. Bien que l’approche
intra-myocardique directe semble la plus efficiente [28], elle reste grevée d’un faible taux de
rétention des cellules greffées qui contribue vraisemblablement à nombre d’échecs
thérapeutiques. Même si cette rétention peut être améliorée par des cathéters dédiés
ou une association à des biomatériaux (comme discuté plus loin), les voies
d’administration mentionnées plus haut ont en commun plusieurs limites : elles
nécessitent des environnements spécifiques et des équipes hautement entraînées ;
elles sont coûteuses ; et, surtout, elles ont un caractère invasif qui empêche leur
répétition aisée. L’échec de nombreux essais cliniques pourrait être ainsi dû au
fait que les cellules n’ont été administrées qu’une seule fois alors qu’il a été
montré que des injections répétées sont préférables à une injection unique pour une
dose cumulée équivalente [29]. Afin de remédier à ce problème, la voie intraveineuse fait
aujourd’hui l’objet d’un intérêt croissant. Cette approche peut paraître paradoxale,
les études de bio-distribution de cellules injectées par voie intraveineuse ayant
montré que la plupart d’entre elles n’atteignent pas le cœur mais s’accumulent dans
le foie, les poumons et la rate [30]. Néanmoins, cette distribution n’empêche pas une amélioration de la
fonction cardiaque après injection des cellules [31] ou de leur sécrétome [32], ce qui suggère que les
biomolécules libérées par les cellules séquestrées (ou leur sécrétome) pourraient
agir à distance sur un mode endocrine [30]
et/ou induire des modifications touchant les cellules immuno-inflammatoires les
orientant vers un phénotype anti-inflammatoire et réparateur [33]. À ce jour, très peu d’études ont
été consacrées aux injections par voie intraveineuse de CSP [34] ; l’utilisation exclusive de leur sécrétome
pourrait améliorer encore la sécurité de cette approche systémique sans compromettre
son efficacité surtout si les cellules sont préalablement stimulées par des ligands
spécifiques de récepteurs qui sont exprimés par le tissu cible [35]. |
La maturation des cellules cardiaques dérivées des CSP Si la réplication in vitro des voies de signalisation qui
déterminent le destin cellulaire au cours de l’embryogénèse permet de produire des
cellules différenciées spécifiques d’un lignage, se pose néanmoins la question du
stade optimal de différenciation auquel ces cellules doivent être transplantées.
Dans un modèle murin de maladie de Parkinson, des neurones dopaminergiques immatures
post-mitotiques ont ainsi été identifiés comme étant les plus efficaces, comparés à
des cellules à des stades plus précoces ou plus tardifs de différenciation [36]. Dans le diabète, les
données sont plus contradictoires. Certains investigateurs ont choisi de
transplanter des progéniteurs pancréatiques, avec pour hypothèse que ces cellules
résisteraient mieux à l’hypoxie et qu’elles pourront poursuivre leur maturation
in vivo [37]. D’autres font valoir que ce processus de maturation est long (de
l’ordre de 4 mois) et préfèrent greffer des cellules β déjà différenciées, supposées
être rapidement fonctionnelles après transplantation [38].
 | Figure 1.
Les cellules souches pluripotentes dans le traitement de
l’insuffisance cardiaque.
|
Dans le cas du cœur, l’une des approches est de transplanter des cardiomyocytes
dérivés de CSP présentant un phénotype ventriculaire aussi proche que possible de
celui des cellules natives avec le pari qu’ils pourront générer une plus grande
force contractile, être moins arythmogènes, puisqu’un processus prolongé de
différenciation devrait permettre d’éliminer les cellules douées d’automaticité, et
enfin présenter un risque moindre en raison de l’absence présumée au sein de cette
population de cellules immatures à fort potentiel prolifératif. Cet objectif
ambitieux a été ciblé par une variété de stratégies, dont la prolongation de la
durée de culture, l’exposition à une stimulation électrique, l’application d’une
contrainte mécanique, la croissance dans un environnement tridimensionnel,
l’addition de types cellulaires non cardiaques co-cultivés, l’utilisation d’hormones
et de petites molécules et enfin un ajustement de l’environnement extra-cellulaire
[39]. Une approche
alternative consiste à transplanter des progéniteurs précoces. Ce choix est étayé,
d’une part par leur métabolisme glycolytique qui pourrait aider les cellules à mieux
tolérer l’environnement hypoxique dans lequel elles sont transplantées et donc à
former de plus larges greffons, d’autre part par une plus grande plasticité,
facilitant une différenciation vers des cellules cardiaques et vasculaires et,
finalement, un plus grand potentiel sécrétoire permettant d’optimiser la
signalisation paracrine [21]. Ces arguments
ont rationalisé notre utilisation clinique de progéniteurs cardiaques
Isl-1+ [9]
mais force est de constater que le débat n’est pas tranché. |
Le problème sécuritaire majeur posé par l’utilisation clinique des CSP est la
survenue d’une tumeur favorisée par des mutations génétiques apparues pendant la
période de culture [40],
avec d’ailleurs un risque qui semble plus élevé avec les iPSC qu’avec les CSE [41]. Dans une perspective
clinique, il est donc essentiel de contrôler régulièrement les CSP en culture afin
de détecter des mutations oncogéniques par une approche multifactorielle (caryotype,
hybridation in situ en fluorescence, hybridation génomique
comparative) tout en gardant à l’esprit que ces techniques de criblage à haut débit
peuvent méconnaître des altérations uniquement présentes dans une population
cellulaire minoritaire. Même si les cellules sont restées génétiquement stables pendant la culture, un risque
persiste toutefois. Celui du développement d’un tératome à partir de cellules
pluripotentes qui n’ont pas répondu aux signaux instructeurs spécifiques d’un
lignage et « contaminent » la population de cellules destinées au patient. Ces
tératomes sont des tumeurs bénignes composées en proportions diverses de tissus
issus de trois couches germinales (mésoderme, endoderme et ectoderme). Elles sont
néanmoins potentiellement graves en raison des phénomènes compressifs qu’elles
peuvent exercer sur les tissus, et d’un risque de transformation maligne des
cellules qui les constituent. Ce risque est d’autant plus important que les cellules
sont encore à un stade de progéniteurs, rendant alors essentiel l’élimination de
celles qui ont conservé un caractère pluripotent. La purification du produit de
thérapie cellulaire final peut être obtenue par une variété de techniques comme
l’utilisation d’agents génotoxiques auxquels les cellules encore indifférenciées
sont très sensibles [42],
ou une culture sans glucose et enrichie en lactate qui favorise la survie exclusive
des cardiomyocytes différenciés [43]. En clinique, cependant, la sélection d’une population pure de
progéniteurs se fonde préférentiellement sur le ciblage des cellules par des
anticorps reconnaissant des marqueurs de surface spécifiques du phénotype retenu
(SSEA-1 [stage-specific embryonic antigen-1] pour les progéniteurs
cardiovasculaires, par exemple) suivi d’un tri sur billes magnétiques. Au terme de cette étape, le produit supposé purifié et génétiquement stable nécessite
cependant d’être testé in vitro, par des analyses visant à détecter
des marqueurs associés à la pluripotence, et in vivo, par les
études de tumorigénicité et de bio-distribution [44]. Pour ces études, il est important de
déterminer le pourcentage de cellules pluripotentes au-dessus duquel une tumeur
apparaît en faisant varier les rapports entre ces cellules et les cellules
différenciées afin de définir un seuil de pureté compatible avec la libération d’un
lot clinique (95 % dans notre essai ESCORT). Toutefois, ces données expérimentales
doivent être interprétées avec prudence en raison de leurs limites, principalement
un contexte habituellement xénogénique (les cellules humaines étant transplantées
chez des rongeurs). Une dernière mesure sécuritaire peut consister à transfecter des
lignées de cellules souches avec des gènes-suicides pharmacologiquement inductibles
[45, 46] mais dont l’utilisation en clinique
introduit toutefois un degré supplémentaire de complexité technique, économique et
réglementaire. |
L’utilisation de biomatériaux Le faible taux de rétention initiale des cellules injectées et leur forte mortalité
secondaire ont conduit à développer des stratégies visant à optimiser leur maintien
dans le tissu greffé. Les biomatériaux sont ainsi apparus comme une approche
attractive de par leur capacité à agir comme des lubrifiants protecteurs au cours
des injections, et à fournir aux cellules une matrice tridimensionnelle porteuse de
signaux qui peuvent favoriser leurs viabilité, prolifération et différenciation. Les
biomatériaux peuvent également servir de réservoirs contrôlant la libération des
facteurs paracrines sécrétés par les cellules. Les exemples les plus typiques de
matériaux qui ont évolué vers des applications cliniques concernent le diabète (avec
les capsules d’alginate [47]), la dégénérescence maculaire (avec un polymère comme support des
progéniteurs épithélio-rétiniens [2]) et le
cœur (avec une matrice de fibrine incorporant des progéniteurs cardiovasculaires
dérivés de CSE [9]). De nombreuses revues ont
été consacrées à ces biomatériaux [48] et nous nous limiterons à décrire quelques-unes de leurs
caractéristiques qui sont essentielles pour une application clinique. Les caractéristiques spécifiques du matériau Les caractéristiques spécifiques du matériau (rigidité, porosité) doivent être
adaptées à son objectif précis : renforcement mécanique de la paroi, plateforme
passive pour libérer des cellules ou des biomolécules ou matrice visant à
l’activation de mécanismes endogènes de réparation. Si le biomatériau est conçu
comme un patch cardiaque destiné à persister longtemps et à s’intégrer dans le
myocarde du patient receveur, une ingénierie plus complexe peut être nécessaire
pour lui donner des propriétés angiogéniques (par optimisation de sa porosité ou
génération de réseaux capillaires avant l’implantation [ 49]) et électro-conductrices. Un
ordonnancement géométrique précis des cellules selon des motifs pré-déterminés
peut aussi contribuer à améliorer leur capacité de réparation et leurs
interactions avec la matrice extra-cellulaire de l’hôte. Les techniques
d’électro-filage et de bio-impression rendent désormais possible ce contrôle
architectural précis. Mode d’administration Le second facteur qui influence le choix du biomatériau est son mode
d’administration. Si un cathéter est utilisé, le matériau devra posséder des
propriétés rhéo-fluidifiantes afin qu’il puisse s’écouler sous forme liquide
dans la lumière du dispositif avant de se gélifier une fois le tissu cible
atteint. Si le matériau est conçu pour être un patch épicardique, ses
caractéristiques mécaniques devront concilier biocompatibilité et possibilité de
le manipuler pendant l’intervention, y compris même de le suturer. Sécurité et rapport coût/efficacité Au regard des applications cliniques, deux impératifs doivent être également
considérés. Le premier est naturellement la sécurité. Cela implique
l’utilisation de biomatériaux ne causant que peu ou pas de réponses
inflammatoire et immune. Le second concerne la fabrication qui doit répondre à
un rapport coût-efficacité favorable par l’utilisation de matériaux sources
facilement disponibles à prix raisonnable, fabricables à grande échelle,
stérilisables et stables après stockage. Chaque fois que l’objectif ultime est
d’aller vers la clinique, il est capital de conserver à l’esprit dès la
conception du programme que c’est un gaspillage de temps et de ressources que de
développer un produit d’ingénierie tissulaire dont la complexité est telle qu’il
est peu probable qu’il soit jamais approuvé par les autorités réglementaires
et/ou remboursé par les parties prenantes. |
L’expérience accumulée en thérapie cellulaire dans une large gamme de pathologies
permet maintenant d’envisager plus clairement les directions à explorer pour rendre
l’usage des cellules ou de leurs produits de sécrétion efficaces sur le plan
thérapeutique, pour faciliter leur administration et développer des thérapies
économiquement viables. Les limites reconnues des cellules adultes à la plasticité
limitée soulignent l’intérêt des recherches consacrées aux CSP. Les problèmes
restant à résoudre étant souvent similaires quel que soit l’organe considéré, on ne
saurait trop insister sur l’intérêt de s’inspirer de l’expérience d’investigateurs
impliqués dans des domaines extérieurs à sa propre discipline, tant la fertilisation
croisée peut être productive. En définitive, et quelles que soient les propriétés
attractives des CSP, leur succès thérapeutique ne dépend pas seulement de leur
nature, de leur voie d’administration ou d’une incorporation dans des matrices
tri-dimensionnelles. Il nécessite également un meilleur ciblage des patients
susceptibles de bénéficier au mieux de ces traitements ; dans ce contexte, on peut
espérer que l’exploitation des méta-données par des techniques dérivées de
l’intelligence artificielle aide à discriminer les répondeurs des non répondeurs et
permette ainsi de plus précisément cibler les patients chez lesquels on peut espérer
un bénéfice thérapeutique [50]. En parallèle, le schéma des essais nécessite aussi sans doute
d’être repensé et les modèles de type bayésien (prévisionnistes) pourraient s’avérer
mieux adaptés que les approches fréquentistes (observationnelles). Enfin, compte tenu du caractère de plus en plus exigeant des contraintes
réglementaires, la translation clinique de ces thérapies fondées sur des cellules ou
leur sécrétome impose que tout plan de développement soit conçu depuis le tout début
de façon à optimiser l’automatisation des procédés de production, la
reproductibilité des lots et la fiabilité des contrôles-qualité, toutes conditions
nécessaires pour orienter le rapport coût/bénéfice dans une direction favorable, ce
qui reste le pré-requis à de larges applications cliniques. |
Philippe Menasché est consultant pour Fujifilm-Cellular Dynamics, Inc. ;
Manon Desgres n’a aucun lien d’intérêt.
|
Footnotes |
1. Schwartz
SD,
Regillo
CD,
Lam
BL, et al.
Human embryonic stem cell-derived retinal pigment epithelium in
patients with age-related macular degeneration and Stargardt’s macular
dystrophy: follow-up of two open-label phase 1/2 studies .
Lancet.
2015; ; 385 :
:509.–16. 2. Kashani
AH,
Lebkowski
JS,
Rahhal
FM, et al.
A bioengineered retinal pigment epithelial monolayer for
advanced, dry age-related macular degeneration .
Sci Transl Med.
2018; ; 10. 3. Kikuchi
T,
Morizane
A,
Doi
D, et al.
Human iPS cell-derived dopaminergic neurons function in a primate
Parkinson’s disease model .
Nature.
2017; ; 548 :
:592-6.. 4. Sneddon
JB,
Tang
Q,
Stock
P, et al.
Stem cell therapies for treating diabetes: progress and remaining
challenges . Cell Stem Cell.
2018; ; 22 :
:810.–23. 5. Strand
BL,
Coron
AE,
Skjak-Braek
G. Current and
future perspectives on alginate encapsulated pancreatic
islet . Stem Cells Transl
Med.
2017; ; 6 :
:1053.–8. 6. Bartunek
J,
Terzic
A,
Davison
BA, et al.
Cardiopoietic cell therapy for advanced ischaemic heart failure:
results at 39 weeks of the prospective, randomized, double blind,
sham-controlled CHART-1 clinical trial . Eur
Heart J.
2017; ; 38 :
:648.–60. 7. Smith
RR,
Barile
L,
Cho
HC, et al.
Regenerative potential of cardiosphere-derived cells expanded
from percutaneous endomyocardial biopsy specimens .
Circulation.
2007; ; 115 :
:896.–908. 8. Bolli
R,
Chugh
AR,
D’Amario
D, et al.
Cardiac stem cells in patients with ischaemic cardiomyopathy
(SCIPIO): initial results of a randomised phase 1 trial .
Lancet.
2011; ; 378 :
:1847.–57. 9. Menasché
P,
Vanneaux
V,
Hagège
A, et al.
Transplantation of human embryonic stem cell-derived
cardiovascular progenitors for severe ischemic left ventricular
dysfunction . J Am Coll
Cardiol.
2018; ; 71 :
:429.–38. 10. Mandai
M,
Watanabe
A,
Kurimoto
Y, et al.
Autologous induced stem-cell-derived retinal cells for macular
degeneration . N Engl J Med.
2017; ; 376 :
:1038.–46. 11. Ramlogan-Steel
CA,
Murali
A,
Andrzejewski
S, et al.
Gene therapy and the adeno-associated virus in the treatment of
genetic and acquired ophthalmic diseases in humans: trials, future
directions and safety considerations . Clin
Exp Ophthalmol.
2019; ; 47 :
:521.–36. 12. Latres
E,
Finan
DA,
Greenstein
JL, et al.
Navigating two roads to glucose normalization in diabetes:
automated insulin delivery devices and cell therapy .
Cell Metab.
2019; ; 29 :
:545.–63. 13. Whone
A,
Luz
M,
Boca
M, et al.
Randomized trial of intermittent intraputamenal glial cell
line-derived neurotrophic factor in Parkinson’s disease .
Brain.
2019; ; 142 :
:512.–25. 14. Shiba
Y,
Gomibuchi
T,
Seto
T, et al.
Allogeneic transplantation of iPS cell-derived cardiomyocytes
regenerates primate hearts .
Nature.
2016; ; 538 :
:388.–91. 15. Ishida
M,
Miyagawa
S,
Saito
A, et al.
Transplantation of human-induced pluripotent stem cell-derived
cardiomyocytes is superior to somatic stem cell therapy for restoring
cardiac function and oxygen consumption in a porcine model of myocardial
infarction . Transplantation.
2019; ; 103 :
:291.–8. 16. Mohsin
S,
Siddiqi
S,
Collins
B, et al.
Empowering adult stem cells for myocardial
regeneration . Circ Res.
2011; ; 109 :
:1415.–28. 17. Romagnuolo
R,
Masoudpour
H,
Porta-Sánchez
A, et al.
Human embryonic stem cell-derived cardiomyocytes regenerate the
infarcted pig heart but induce ventricular tachyarrhythmias .
Stem Cell Reports.
2019; ; 12 :
:967.–81. 18. Garbern
JC,
Lee
RT. Cardiac stem
cell therapy and the promise of heart regeneration .
Cell Stem Cell.
2013; ; 12 :
:689.–98. 19. Kervadec
A,
Bellamy
V, El
Harane
N, et al.
Cardiovascular progenitor-derived extracellular vesicles
recapitulate the beneficial effects of their parent cells in the treatment
of chronic heart failure . J Heart Lung
Transplant.
2016; ; 35 :
:795.–807. 20. Barile
L,
Cervio
E,
Lionetti
V, et al.
Cardioprotection by cardiac progenitor cell-secreted exosomes:
role of pregnancy-associated plasma protein-A .
Cardiovasc Res.
2018; ; 114 :
:992.–1005. 21. El Harane
N,
Kervadec
A,
Bellamy
V, et al.
Acellular therapeutic approach for heart failure: in vitro
production of extracellular vesicles from human cardiovascular
progenitors . Eur Heart J.
2018; ; 39 :
:1835.–47. 22. Neofytou
E,
O’Brien
CG,
Couture
LA, et al.
Hurdles to clinical translation of human induced pluripotent stem
cells . J Clin Inves.
2015; ; 125 :
:2551.–7. 23. Deuse
T,
Hu
X,
Gravina
A, et al.
Hypoimmunogenic derivatives of induced pluripotent stem cells
evade immune rejection in fully immunocompetent allogeneic
recipients . Nat Biotechnol.
2019; ; 37 :
:252.–8. 24. Pan
Y,
Leveson-Gower
DB, de
Almeida
PE, et al.
Engraftment of embryonic stem cells and differentiated progeny
following host conditioning with total lymphoid irradiation and regulatory T
cells . Cell Rep.
2015; ; 10 :
:1793.–802. 25. Mohamed
TMA,
Stone
NR,
Berry
EC, et al.
Chemical enhancement of in vitro and in vivo direct cardiac
reprogramming clinical perspective .
Circulation.
2017; ; 135 :
:978.–95. 26. Mills
RJ,
Titmarsh
DM,
Koenig
X, et al.
Functional screening in human cardiac organoids reveals a
metabolic mechanism for cardiomyocyte cell cycle arrest .
Proc Natl Acad Sci USA.
2017; ; 114 :
:E8372.–81. 27. Aguado
BA,
Mulyasasmita
W,
Su
J, et al.
Improving viability of stem cells during syringe needle flow
through the design of hydrogel cell carriers .
Tissue Eng Part A.
2012; ; 18 :
:806.–15. 28. Hou
D,
Youssef
EA-S,
Brinton
TJ, et al.
Radiolabeled cell distribution after intramyocardial,
intracoronary, and interstitial retrograde coronary venous delivery:
implications for current clinical trials .
Circulation.
2005; ; 112 :
:I150.–6. 29. Tang
X-L,
Nakamura
S,
Li
Q, et al.
Repeated administrations of cardiac progenitor cells are superior
to a single administration of an equivalent cumulative dose .
J Am Heart Assoc.
2018; ; 7((4)). 30. Lee
RH,
Pulin
AA,
Seo
MJ, et al.
Intravenous hMSCs improve myocardial infarction in mice because
cells embolized in lung are activated to secrete the anti-inflammatory
protein TSG-6 . Cell Stem
Cell.
2009; ; 5 :
:54.–63. 31. Bartolucci
J,
Verdugo
FJ,
González
PL, et al.
Safety and efficacy of the intravenous infusion of umbilical cord
mesenchymal stem cells in patients with heart failure: a phase 1/2
randomized controlled trial (RIMECARD trial [randomized clinical trial of
intravenous infusion umbilical cord mesenchymal stem cells on
cardiopathy]) . Circ Res.
2017; ; 121 :
:1192.–204. 32. Sun
X,
Shan
A,
Wei
Z, et al.
Intravenous mesenchymal stem cell-derived exosomes ameliorate
myocardial inflammation in the dilated cardiomyopathy .
Biochem Biophys Res Commun.
2018; ; 503 :
:2611.–8. 33. Wysoczynski
M,
Khan
A,
Bolli
R. New paradigms in
cell therapy: repeated dosing, intravenous delivery, immunomodulatory
actions, and new cell types . Circ
Res.
2018; ; 123 :
:138.–58. 34. Nizzardo
M,
Simone
C,
Rizzo
F, et al.
Minimally invasive transplantation of iPSC-derived
ALDHhiSSCloVLA4+ neural stem cells effectively improves the phenotype of an
amyotrophic lateral sclerosis model . Hum Mol
Genet.
2014; ; 23 :
:342.–54. 35. Ciullo
A,
Biemmi
V,
Milano
G, et al.
Exosomal expression of CXCR35 targets cardioprotective vesicles
to myocardial infarction and improves outcome after systemic
administration . Int J Mol
Sci.
2019 ; :20(3).. 36. Qiu
L,
Liao
MC,
Chen
AK, et al.
Immature midbrain dopaminergic neurons derived from floor-plate
method improve cell transplantation therapy efficacy for Parkinson’s
disease . Stem Cells Transl
Med.
2017; ; 6 :
:1803.–14. 37. Schulz
Thomas C
Concise review: Manufacturing of pancreatic endoderm cells for
clinical trials in type 1 diabetes: manufacturing of pancreatic endoderm
cells . Stem Cells Transl
Med.
2015; ; 4 :
:927.–31. 38. Pagliuca
FW,
Millman
JR,
Gürtler
M, et al.
Generation of functional human pancreatic β cells in
vitro . Cell.
2014; ; 159 :
:428.–39. 39. Veerman
CC,
Kosmidis
G,
Mummery
CL, et al.
Immaturity of human stem-cell-derived cardiomyocytes in culture:
fatal flaw or soluble problem?
Stem Cells Dev.
2015; ; 24 :
:1035.–52. 40. Werbowetski-Ogilvie
TE,
Bossé
M,
Stewart
M, et al.
Characterization of human embryonic stem cells with features of
neoplastic progression . Nat
Biotechnol.
2009; ; 27 :
:91.–7. 41. Ben-David
U,
Benvenisty
N
The tumorigenicity of human embryonic and induced pluripotent
stem cells . Nat Rev Cancer.
2011; ; 11 :
:268.–77. 42. Secreto
FJ,
Li
X,
Smith
AJ, et al.
Quantification of etoposide hypersensitivity: a sensitive,
functional method for assessing pluripotent stem cell
quality . Stem Cells Transl
Med.
2017; ; 6 :
:1829.–39. 43. Tohyama
S,
Hattori
F,
Sano
M, et al.
Distinct metabolic flow enables large-scale purification of mouse
and human pluripotent stem cell-derived cardiomyocytes .
Cell Stem Cell.
2013; ; 12 :
:127.–37. 44. Garitaonandia
I,
Gonzalez
R,
Christiansen-Weber
T, et al.
Neural stem cell tumorigenicity and biodistribution assessment
for phase I clinical trial in Parkinson’s disease .
Sci Rep.
2016; ; 6 : :34478.. 45. Itakura
G,
Kawabata
S,
Ando
M, et al.
Fail-safe system against potential tumorigenicity after
transplantation of iPSC derivatives . Stem
Cell Rep.
2017; ; 8 :
:673.–84. 46. Liang
Q,
Monetti
C,
Shutova
MV, et al.
Linking a cell-division gene and a suicide gene to define and
improve cell therapy safety .
Nature.
2018; ; 563 :
:701.–4. 47. Vegas
AJ,
Veiseh
O,
Gürtler
M, et al.
Long-term glycemic control using polymer-encapsulated human stem
cell-derived beta cells in immune-competent mice .
Nat Med.
2016; ; 22 :
:306.–11. 48. O’Neill
HS,
Gallagher
LB,
O’Sullivan
J, et al.
Biomaterial-enhanced cell and drug delivery: lessons learned in
the cardiac field and future perspectives .
Adv Mater Weinheim.
2016; ; 28 :
:5648.–61. 49. Redd
MA,
Zeinstra
N,
Qin
W, et al.
Patterned human microvascular grafts enable rapid vascularization
and increase perfusion in infarcted rat hearts .
Nat Commun.
2019; ; 10 : :584.. 50. Steinhoff
G,
Nesteruk
J,
Wolfien
M, et al.
Cardiac function improvement and bone marrow response: Outcome
analysis of the randomized PERFECT phase III clinical trial of
intramyocardial CD133+ application after myocardial
infarction . EBioMedicine.
2017; ; 22 :
:208.–24. |