| |
| Med Sci (Paris). 35(10): 779–786. doi: 10.1051/medsci/2019156.Anomalies de la β-oxydation mitochondriale des acides
gras Maladies rares et maladies communes Jean Bastin1* and Fatima Djouadi1 1Centre de Recherche des Cordeliers, Inserm U1138, Sorbonne
Université, USPC, Université Paris Descartes, Université Paris
Diderot, 15 rue de
l’École de Médecine, 75006Paris,
France |
Vignette (Photo © Inserm - Barelli, Hélène). La β-oxydation mitochondriale des acides gras (β-OAG) joue un rôle majeur dans la
fourniture d’ATP dans de nombreux organes ou tissus à forts besoins en énergie, tels que
le cœur, les muscles squelettiques, le foie ou les reins. Le principe de base de cette
voie métabolique (Figure 1) repose
sur une séquence récurrente de quatre réactions enzymatiques (appelée hélice de Lynen)
(Figure 2) permettant de
convertir les acides gras en acétyl-CoA. Celui-ci sera ensuite incorporé dans le cycle
de Krebs pour compléter l’oxydation. L’ensemble de ce processus générera de grandes
quantités de NADH (nicotinamide adénine dinucléotide réduit) et de FADH2
(flavine adénine dinucléotide réduite) qui permettront, en alimentant en électrons la
chaîne respiratoire mitochondriale, la production d’ATP avec un rendement énergétique
élevé. Chez l’homme comme chez le rongeur, la β-OAG utilise principalement les acides
gras à chaîne longue (de 16 et 18 carbones) présents en abondance dans l’alimentation de
l’adulte, ou stockés dans les réserves du tissu adipeux [1]. Dans de nombreux tissus (cœur, muscle, foie,
etc.), il existe en permanence un équilibre subtil entre l’utilisation des acides gras
et celle du glucose comme source d’énergie métabolique. Selon l’organe considéré, cet
équilibre peut être plus ou moins déplacé en réponse à des modifications physiologiques
ou physiopathologiques : on parle ainsi de flexibilité métabolique [2, 3]. D’une façon générale, on admet que l’utilisation des acides gras
joue un rôle prépondérant dans toutes les situations imposant une restriction de
l’utilisation du glucose, tels que le jeûne ou l’exercice physique. Dans ces conditions,
la lipolyse du tissu adipeux permet d’augmenter fortement les taux circulant d’acides
gras à chaîne longue et, ainsi leur β-oxydation mitochondriale dans de nombreux tissus.
Ces fonctions énergétiques de la β-OAG sont modulées par un ensemble de facteurs
nutritionnels et hormonaux qui agissent par différents mécanismes moléculaires,
allostériques, transcriptionnels, et post-traductionnels via un réseau
de signalisation cellulaire et nucléaire complexe, qui permet d’ajuster l’activité de
cette voie métabolique en réponse à différents contextes physiologiques ou
physiopathologiques [4–7]. Les déficits génétiques
touchant la β-OAG, avec leur panel complexe de manifestations cliniques, révèlent
l’importance de cette voie métabolique dans la physiologie de nombreux organes. D’autres
dysfonctionnements de la β-OAG interviennent dans la pathogenèse de différentes maladies
communes, dont le diabète [8],
l’obésité [9], et les maladies
cardiaques [10].
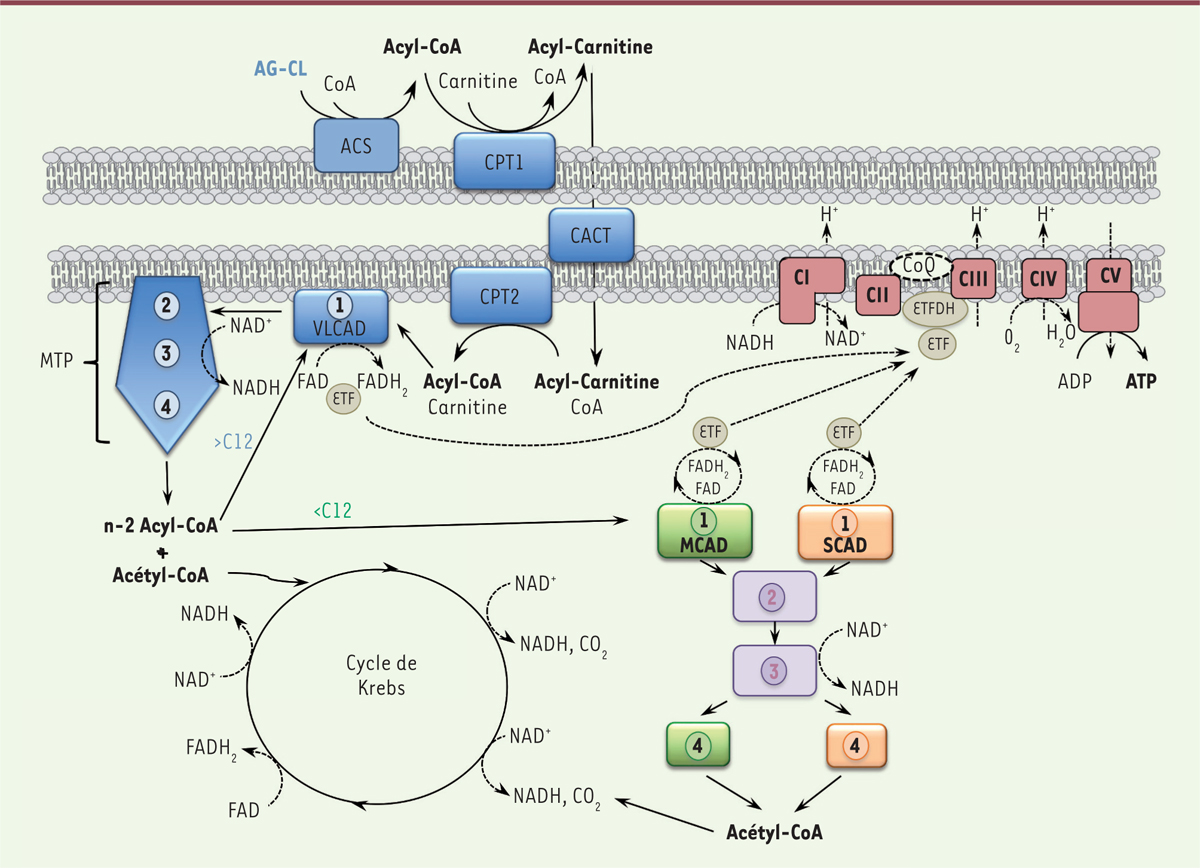
 | Figure 1. Organisation schématique de la β-oxydation
mitochondriale des acides gras. Les acides gras à
chaîne longue (AG-CL) activés en acyl-CoA par l’ACS (acyl-CoA
synthetase) sont pris en charge par la navette d’import
mitochondrial constituée de la CPT1 (carnitine palmitoyl transferase
1), de la CACT (carnitine acyl-carnitine
translocase) et de la CPT2 (carnitine palmitoyl
transferase 2), dont le fonctionnement dépend de la carnitine.
Les chiffres 1 à 4 correspondent aux quatre étapes de l’hélice de Lynen. À
l’intérieur de la mitochondrie, les acyl-CoA sont oxydés par la VLCAD
(very-long-chain acyl-Coa dehydrogenase) (étape 1) puis
par la MTP (mitochondrial trifunctional protein) (étapes 2,
3, 4) aboutissant à la formation d’un acyl-CoA raccourci de deux carbones
(n-2 acyl-CoA), d’un acétyl-CoA, d’un NADH, et d’un FADH2. Cette
séquence se reproduit à l’identique jusqu’à l’obtention d’un acyl-CoA à
chaîne moyenne (12 carbones) qui sera dirigé vers la MCAD (medium
chain acyl-CoA dehydrogenase) (étape 1) puis vers des isoformes
communes aux chaînes moyennes et courtes pour les étapes 2 et 3, et, enfin,
vers l’isoforme spécifique des chaînes moyennes en étape 4. Une fois réduit
à 6 carbones, l’acyl-CoA réagira finalement avec la SCAD (short
chain acyl-CoA dehydrogenase) (étape 1) puis avec les isoformes
communes des étapes 2 et 3, et avec l’isoforme spécifique des chaînes
courtes à l’étape 4. La conversion complète d’un AG-CL en acétyl-CoA
mobilise donc successivement toutes les isoformes enzymatiques (chaîne
longue, moyenne et courte). Le fonctionnement de la β-oxydation est
étroitement couplé à l’activité de la chaîne respiratoire, permettant la
production de grandes quantités d’ATP. Les électrons du FADH2
produits à l’étape 1, d’abord cédés à l’ETF (electron-transferring
factor) sont introduits dans la chaîne respiratoire
via un accepteur spécifique, l’ETF-DH
(electron-transferring factor dehydrogenase). Le NADH
produit au cours de la β-oxydation des acides gras alimente la chaîne
respiratoire au niveau du complexe I. |
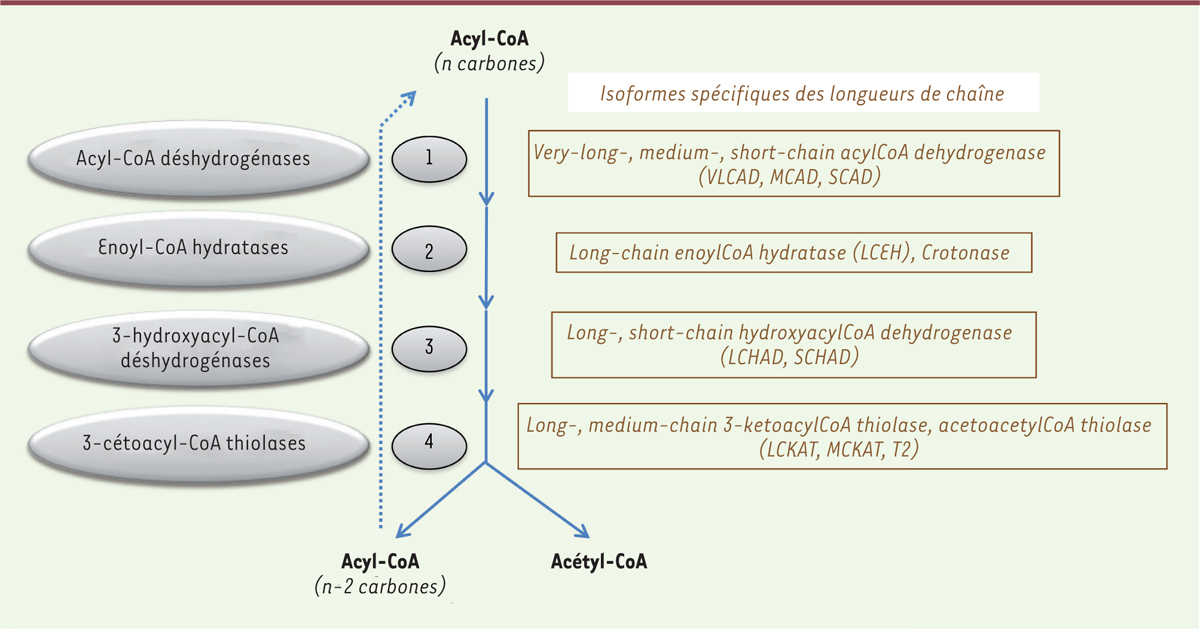
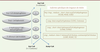 | Figure 2.
Étapes enzymatiques de l’hélice de Lynen.
|
Au delà des mécanismes classiques de production d’énergie, des données récentes,
recueillies dans différents modèles, suggèrent l’implication de la β-OAG dans des
fonctions qui sont restées longtemps insoupçonnées. La β-OAG pourrait ainsi participer
aux modifications épigénétiques de la chromatine [11], à la différenciation des cellules souches
neuronales [12, 13], ou déterminer le devenir de
cellules cancéreuses [14].
Cette voie métabolique serait donc impliquée dans une grande variété de types
cellulaires, dans des fonctions essentielles pour l’expression du génome ou la
croissance et la différenciation cellulaire. Ces fonctions, qui impliquent des voies de
signalisation et des échanges d’informations dont la nature reste encore hypothétique,
illustrent bien le niveau élevé d’intégration de l’activité du métabolisme énergétique
mitochondrial dans de multiples aspects de l’homéostasie cellulaire, en conditions
normales ou pathologiques. L’utilisation des acides gras comme substrats énergétiques fait intervenir une vingtaine
de protéines et enzymes impliquées dans la captation, l’activation ou l’import des
acides gras dans la mitochondrie, ou dans l’une des quatre étapes de l’hélice de Lynen.
La fourniture de carnitine dans le processus, via le transporteur
membranaire OCTN2 (organic cation/carnitine transporter), est également
indispensable. L’enzymologie de cette voie métabolique a fait l’objet d’une excellente
revue récente [15], et ne sera
pas détaillée ici. La Figure 1 en
présente un schéma général. Le nombre élevé d’enzymes impliquées dans ce processus
s’explique par l’existence de différentes isoformes. C’est le cas de la
carnitine palmitoyl transferase 1 (CPT1) qui participe, avec la
carnitine acyl carnitine translocase (CACT) et la CPT2, à la
navette d’import des acides gras à chaîne longue dans la mitochondrie, qui dépend de la
carnitine [16]. La CPT1 possède
trois isoformes qui sont « tissu-spécifiques » et codées par des gènes distincts : la
CPT1-A, qui a été caractérisée dans le foie, mais qui est exprimée également dans un
grand nombre d’autres tissus ; la CPT1-B, spécifique des muscles squelettiques et
cardiaques ; et la CPT1-C, exprimée exclusivement dans certaines régions du cerveau. Les
CPT1-A et CPT1-B diffèrent par leur sensibilité au malonyl-CoA, un inhibiteur
allostérique jouant un rôle important dans la régulation du flux de β-oxydation et dans
l’équilibre entre lipogenèse et catabolisme des acides gras. La CPT1-C, découverte plus
tardivement, est exprimée dans les neurones et reste de fonction mystérieuse car elle ne
possède qu’une très faible fonction CPT (carnitine palmitoyl
transferase) [17].
La machinerie de β-oxydation se caractérise également par l’existence d’isoformes
spécifiques des différentes longueurs de chaîne d’acides gras. La première étape de
l’hélice de Lynen met ainsi en jeu quatre isoformes enzymatiques des acyl-CoA
déshydrogénases (CAD), spécifiques des acides gras à chaîne très longue (VLCAD), longue
(LCAD), moyenne (MCAD), ou courte (SCAD) (Figure
2). Les acyl-CoA déshydrogénases constituent en fait une famille
de flavoprotéines à FAD (flavine adénine dinucléotide) dont il existe 11 isoformes, mais
toutes n’interviennent pas dans la β-oxydation. À noter que chez l’homme, contrairement
au rongeur, la LCAD, spécifique des acides gras à chaîne longue, n’est quasiment pas
exprimée et c’est la VLCAD, spécifique des acides gras à chaîne très longue, qui assure
la première étape de l’oxydation des acides gras à chaîne longue [18]. L’importance de la VLCAD ressort
notamment des données de génétique humaine puisqu’aucune mutation du gène codant la LCAD
n’a jamais été rapportée et associée à une maladie, alors que le déficit génétique en
VLCAD est, lui, bien caractérisé et responsable de pathologies [4, 15]. Cette première étape
de la β-oxydation dépend étroitement d’une autre flavoprotéine, l’ETF
(electron-transferring factor), qui est codée par les gènes
ETFA et ETFB. Cette protéine intervient comme
accepteur d’électrons de toutes les acyl-CoA déshydrogénases. Elle assure le transfert
de ces électrons vers l’ETF-DH (ETF deshydrogenase), codée par le gène
ETFDH, qui fait partie intégrante de la chaîne respiratoire. Cette
navette ETF/ETF-DH, souvent omise des descriptions de la β-OAG, joue un rôle fondamental
dans l’énergétique mitochondriale, comme le révèle les manifestations cliniques
associées aux déficits en ETF ou en ETF-DH [15].
En aval de la VLCAD, la MTP (mitochondrial trifunctional protein), un
complexe multienzymatique constitué de quatre sous-unités alpha et quatre sous-unités
beta codées par des gènes distincts (HADHA et HADHB),
catalyse les trois étapes finales de la β-OAG à chaîne longue. La MTP est ancrée dans la
membrane interne des mitochondries grâce à des interactions fortes avec les
phospholipides membranaires dont les cardiolipines (ou glycérol bisphosphatidyle). La
VLCAD possède également un domaine d’interactions avec les cardiolipines permettant son
association à la membrane interne de la mitochondrie. Ainsi, au contraire des isoformes
spécifiques des chaînes moyennes ou courtes, qui sont solubles dans la matrice
mitochondriale, la plupart des enzymes impliquées dans l’oxydation des acides gras à
chaîne longue sont associées aux membranes mitochondriales. Cette particularité
permettrait d’optimiser les transferts de substrats depuis la CPT1 jusqu’à la MTP en
formant un « metabolon »1 assurant un flux élevé de
β-OAG en raison de la grande proximité des différentes enzymes participant au processus.
Les interactions des enzymes avec les cardiolipines de la membrane favoriseraient
également la formation de super-complexes avec d’autres partenaires protéiques [19] : par exemple, entre la VLCAD
et la MTP, ou entre la MTP et les complexes III et IV de la chaîne respiratoire, ou
encore entre la VLCAD et les complexes de la chaîne respiratoire. Les enzymes de β-OAG à
chaîne longue seraient donc intégrées dans des super-complexes, ce qui permettrait
d’optimiser les transferts de substrats et d’électrons et de faciliter le couplage entre
la β-OAG et la chaîne respiratoire. |
Déficits héréditaires de la β-oxydation mitochondriale Une quinzaine de déficits génétiques de la β-OAG ont été décrits chez l’homme. Ils
ont principalement pour origine des mutations d’un gène (maladies monogéniques)
codant pour l’une des enzymes de la navette d’import mitochondrial, pour l’une des
étapes de l’hélice de Lynen, ou pour le transporteur de carnitine [15]. Ces déficits présentent une grande
hétérogénéité génétique, par le nombre total de gènes impliqués (plus de 15), et par
la variété des remaniements de l’ADN, allant de « simples » mutations faux-sens à
des mutations sévères (délétions, codons stop prématurés, etc.). Ces mutations
peuvent avoir des conséquences très variables, entraînant un déficit partiel ou
total de l’expression et de l’activité enzymatique de la protéine mutée associé à un
blocage plus ou moins profond de la β-OAG [4].
Sur le plan clinique, les déficits de la β-OAG sont associés à une morbidité et à
une mortalité importante. Ils englobent un large éventail de manifestations, allant
de défaillances multi-viscérales d’issue fatale chez le nourrisson à des phénotypes
modérés de déclaration tardive [20–22]. Quelle
que soit la gravité des phénotypes associés, il n’existe encore que peu de
traitements pour la plupart de ces déficits. La mise en place de mesures
nutritionnelles (régime hypolipidique enrichi en glucides, prévention du jeûne,
etc.) a néanmoins permis de diminuer la mortalité et d’améliorer, dans certains cas,
la condition des patients [23]. Dans de nombreux pays, le développement de la spectrométrie de
masse en tandem a permis l’implantation d’un dépistage systématique de certains de
ces déficits, par l’analyse du profil des acylcarnitines plasmatiques à partir des
prélèvements de sang sur buvard, réalisée chez tous les nouveau-nés à la naissance.
L’accumulation de ces dérivés d’acides gras incomplètement oxydés permet en effet
d’identifier l’étape enzymatique déficitaire dans la voie de β-OAG. Dans de nombreux
cas, les nouveau-nés dépistés comme positifs sont en fait asymptomatiques et il est
impossible de prévoir avec certitude l’évolution de leur condition au cours du temps
[24]. L’expression
phénotypique de ces maladies ne repose en effet pas uniquement sur la présence
d’altérations génétiques. Elle dépend également de facteurs physiologiques ou
environnementaux (jeûne, fièvre, froid, exercice, etc.) qui peuvent déclencher ou
aggraver les symptômes [22]. L’existence de
périodes asymptomatiques, alternant avec des manifestations cliniques intercurrentes
déclenchées par différents stress ou complètement imprévisibles, est une
caractéristique de ces maladies qui complique leur prise en charge et la mise en
place d’approches thérapeutiques. |
Les anomalies de la β-oxydation mitochondriale et le cœur Les arythmies cardiaques chez le nourrisson sont l’une des principales causes de
mortalité associée à plusieurs déficits innés de β-OAG (déficits en CPT2, VLCAD,
CACT, LCHAD [long-chain hydroxyacylCoA dehydrogenase], ou MTP),
dans leurs présentations sévères. Ces atteintes cardiaques surviennent le plus
souvent dans un contexte d’insuffisance hépatique grave car le déficit touchant la
β-OAG affecte également la production hépatique de glucose et de corps cétoniques,
et perturbe l’activité du cycle de l’urée à l’origine d’une hypoglycémie
hypocétotique avec élévation de l’ammoniémie2,.
Cette situation peut affecter le fonctionnement du cerveau, dont les principaux
substrats énergétiques (glucose et corps cétoniques) tendent alors à s’épuiser, et
qui subit les effets toxiques de l’hyperammoniémie. D’autres atteintes (acidose
rénale, hypotonie) peuvent également être observées chez ces nourrissons : ils
décèderont la plupart du temps avant un an [4,
15, 22]. Les insuffisances cardiaques graves associées aux déficits de β-OAG
sont très difficiles à prendre en charge. Des études récentes indiquent cependant
que l’administration orale d’acides gras à chaîne moyenne, à nombre impair de
carbones (triheptanoïne), a des effets bénéfiques importants et rapides sur les
fonctions cardiaques chez des enfants atteints de différents déficits génétiques de
la β-OAG (déficit en VLCAD, TFP, LCHAD, ou CACT) [25]. Le principe de cette approche
thérapeutique repose principalement sur les propriétés métaboliques de l’heptanoate
dont l’oxydation produit non seulement de l’acétyl-CoA mais également du
propionyl-CoA qui, une fois converti en succinyl-CoA, réapprovisionne le pool des
intermédiaires du cycle de Krebs (effet anaplérotique). En plus de ses effets
bénéfiques sur le métabolisme oxydatif mitochondrial, cette augmentation des
constituants du cycle de Krebs peut favoriser la néoglucogenèse. Ainsi, une étude
rétrospective réalisée chez 20 patients atteints de différents déficits de β-OAG, a
montré qu’un traitement par la triheptanoïne permettait également la suppression
quasi-complète des hospitalisations liées à des épisodes d’hypoglycémie chez les
jeunes patients déficitaires en β-OAG [26]. L’utilisation de triheptanoate représente donc une
approche très prometteuse pour le traitement des atteintes cardiaques et hépatiques
chez les patients atteints de formes sévères de déficits de β-OAG. La vulnérabilité du cœur à un déficit de β-OAG illustre l’extrême importance de cette
voie dans la fourniture d’ATP, et cela dès les stades précoces de vie du nouveau-né.
Dans le cœur adulte, 60 à 90 % de la production d’ATP sont assurés par la
β-oxydation des acides gras, 10 à 40 % relevant de l’oxydation du glucose et, dans
une moindre mesure, des corps cétoniques et du lactate [27]. Différents types d’insuffisance cardiaque
associés à des maladies communes chroniques sont imputables, au moins en partie, à
des altérations du métabolisme oxydatif mitochondrial [28]. Pourtant, l’implication de la β-OAG reste
controversée dans ces pathologies. En effet, certains auteurs ont mis en évidence
une diminution de l’expression cardiaque des gènes codant certaines enzymes de la
β-OAG (LCAD et MCAD en particulier) et des principaux régulateurs de cette
expression, que sont PPARa (peroxisome proliferator-activated receptor
alpha) et PGC-1a (PPARg
co-activator-1a), suggérant une baisse d’activité de la β-OAG
[29]. Pour d’autres
auteurs, les capacités de β-OAG seraient inchangées, voire augmentées, et une partie
des altérations pourrait reposer sur une augmentation du rapport entre acides gras
oxydés et glucose [28]. Différentes approches
thérapeutiques visant à inhiber la β-OAG afin de stimuler l’utilisation du glucose
ont ainsi été testées. La perhexiline et la trimétazidine, qui inhibent
respectivement l’entrée des acides gras à chaîne longue dans la mitochondrie et la
dernière étape de la β-OAG, sont ainsi utilisées comme agent anti-angineux3, dans plusieurs pays [3, 30].
Il est néanmoins important de souligner que même si la β-OAG est considérée depuis
longtemps comme une cible thérapeutique potentielle pour le traitement de certaines
maladies cardiaques, les stratégies thérapeutiques associées n’ont pas encore fourni
de résultats définitifs probants. Une diminution importante, et surprenante, des
accidents cardiovasculaires d’issue fatale et des hospitalisations liées à une
défaillance cardiaque a été observée dans l’essai clinique EMPA-REG OUTCOME. Cet
essai évaluait les effets de l’empagliflozine, un inhibiteur du transporteur
sodium-glucose, chez des patients diabétiques de type 2 qui présentaient un risque
cardiovasculaire élevé. L’une des hypothèses permettant d’expliquer les résultats
observés est que le blocage de la réabsorption du glucose au niveau rénal, considéré
comme un « jeûne accéléré », aurait pour conséquence une augmentation de la
lipolyse, conduisant ainsi à une élévation des concentrations en acides gras libres
circulants et à une augmentation de la β-oxydation mitochondriale. Au niveau
hépatique, cette augmentation aboutirait à une synthèse accrue des corps cétoniques.
Ces derniers deviendraient alors les substrats préférentiels du cœur diabétique, ce
qui rendrait compte, en partie, des améliorations spectaculaires des performances
cardiaques observées dans cet essai clinique [31, 32]. |
Les anomalies de la β-oxydation mitochondriale et le muscle Dans les formes plus modérées de certains déficits de β-oxydation (déficit en VLCAD
ou en LCHAD), des cardiomyopathies peuvent apparaître progressivement dans l’enfance
et persister à l’âge adulte. Elles sont en général plus rares et moins sévères que
les atteintes touchant le nourrisson, peut-être du fait de la flexibilité
métabolique du cœur qui lui permet de compenser un déficit partiel de β-OAG par
l’utilisation d’autres substrats. Ces déficits modérés de β-OAG sont cependant l’une
des causes importantes de myopathie métabolique. Ces atteintes isolées des muscles
squelettiques associées à un déficit en CPT2, en VLCAD, ou en LCHAD, apparaissent
aux abords de l’adolescence, ou chez le jeune adulte. Elles sont diagnostiquées en
général par une intolérance à l’effort, qui déclenche chez ces patients de fortes
myalgies et raideurs musculaires, avec un risque élevé de rhabdomyolyse4. Un grand nombre d’autres situations (jeûne,
exposition au froid, infection, etc.) aggravent ces symptômes musculaires et
déclenchent des épisodes de rhabdomyolyse. Chez les patients déficitaires en CPT2,
la survenue des épisodes de rhabdomyolyse pourrait être partiellement réduite par un
traitement par le bézafibrate [33]. Le bézafibrate stimule la β-OAG dans les cellules musculaires en
activant PPARd [34].
L’administration de triheptanoïne apparaît par contre sans effet sur ces symptômes
musculaires [25, 35]. En ce qui concerne les maladies communes
chroniques, de nombreux travaux suggèrent qu’un déficit modéré de l’activité de la
β-OAG dans le muscle pourrait provoquer une accumulation de dérivés d’acides gras
(acylcarnitines, diacylglycérols, triacylglycérols et/ou céramides). Ceci
conduirait, via l’activation de kinases impliquées dans les
réponses aux stress, à une diminution de l’activité de protéines participant à la
voie de signalisation de l’insuline, et donc à l’apparition d’une
insulino-résistance [1, 8]. Cependant, l’hypothèse selon laquelle une augmentation de la
β-OAG dans le muscle pourrait limiter l’accumulation de dérivés toxiques et ainsi
diminuer l’insulino-résistance reste controversée. En fait, très peu de patients
affectés par un déficit génétique de la β-OAG présentent un diabète ou des signes
d’insulino-résistance, et les données récentes obtenues sur une cohorte de patients
déficitaires en LCHAD souffrant de myopathie isolée n’indiquent pas d’anomalie de la
résistance musculaire à l’insuline [36]. |
Les anomalies de la β-oxydation mitochondriale et le foie Dans leurs formes modérées, certains déficits génétiques de la β-oxydation sont
associés à des insuffisances hépatiques qui se traduisent par une intolérance au
jeûne associée à un risque de coma hépatique. Ces traits phénotypiques souvent
transitoires ne concernent qu’un nombre relativement limité de déficits (déficits en
VLCAD ou en MCAD) et peuvent facilement être prévenus par un apport régulier en
glucose et un suivi nutritionnel [23]. Dans
le cadre des maladies communes, de nombreux auteurs s’accordent à admettre qu’un
dysfonctionnement de la β-OAG contribue probablement à la pathogenèse des atteintes
hépatiques associées au syndrome métabolique ou à l’obésité. C’est le cas des
différentes variantes des stéatoses hépatiques comme la NAFLD (non-alcoholic
fatty liver disease) ou la NASH (non-alcoholic
steatohepatitis) caractérisées par une accumulation ectopique de
lipides dans le foie. La NAFLD est une pathologie d’incidence élevée dans les pays
occidentaux. Elle touche 30 % de la population générale aux États-Unis et jusqu’à 90
% des patients obèses, et peut évoluer vers une cirrhose ou un cancer
hépatocellulaire. Les mécanismes impliqués dans cette maladie de déclaration
progressive sont probablement multiples (résistance à l’insuline, inflammation,
stress oxydant, lipotoxicité, stress du réticulum, etc.) mais ils pourraient
résulter d’un déséquilibre initial lié à un apport énergétique excessif qui
surpasserait les capacités hépatiques de la β-OAG, contribuant ainsi à
l’accumulation ectopique d’espèces lipidiques [9, 37, 38]. Il est ainsi admis qu’un
défaut de β-OAG, même partiel, pourrait contribuer aux phénotypes de plusieurs
maladies associées à un régime obésogène, incluant l’obésité, le diabète et la
NAFLD. Dans ce contexte, de nombreux travaux ont été menés dans le but de stimuler
la β-OAG hépatique en utilisant, par exemple, des activateurs de PPARa et/ou PPARd,
avec des résultats prometteurs [39]. De récentes études suggèrent qu’un déficit de β-oxydation pourrait également avoir
d’autres effets qui ne sont pas liés directement à la fourniture d’énergie
métabolique. Il existe ainsi un faisceau d’arguments suggérant que dans le foie, et
probablement dans d’autres tissus, la β-OAG pourrait fournir l’acétyl-CoA pour
l’acétylation d’une part des protéines mitochondriales et, d’autre part, des
histones [40]. Dans la
mitochondrie, ces modifications post-traductionnelles touchent un très grand nombre
d’enzymes participant à la β-OAG et au cycle de Krebs, sans que l’on connaisse
précisément leurs effets sur les flux métaboliques. On pense que les mécanismes
d’acétylation/déacétylation pourraient jouer un rôle de senseur métabolique pour
moduler le métabolisme énergétique mitochondrial dans différentes conditions
nutritionnelles (jeûne, régime hyperlipidique) ou pathologiques (diabète, syndrome
métabolique). Des travaux menés sur des hépatocytes indiquent que, dans le noyau,
les carbones des acides gras peuvent être incorporés dans l’épigénome au cours des
réactions d’acétylation des histones [41]. Ces modifications épigénétiques de la chromatine
établissent ainsi un lien fonctionnel entre la β-OAG et la modulation de
l’expression de nombreux gènes potentiellement stimulée en réponse à l’acétylation
des histones. Elles pourraient donc également servir de senseur métabolique en
contribuant à adapter l’expression des gènes du métabolisme lipidique à la
fourniture d’acides gras à la cellule. Ces processus d’acétylation, mitochondriaux
et nucléaires, leur rôle physiologique et leurs implications dans différentes
maladies (diabète, syndrome métabolique) ont fait l’objet d’une revue récente [11]. |
Les anomalies de la β-oxydation mitochondriale et le cerveau Les déficits génétiques de β-OAG sont, dans leurs formes sévères, une source majeure
de morbidité et de mortalité neurologique chez l’enfant [20, 22, 42]. Ils peuvent en effet être associés
à un large spectre d’atteintes neurologiques de type neuropathie ou encéphalopathie,
pouvant entraîner un retard cognitif ou des troubles du comportement [43]. Ces manifestations
neurologiques sont classiquement considérées comme secondaires aux épisodes aigus de
décompensation métabolique accompagnés d’états d’hyperammoniémie, et/ou
d’hypoxie-ischémie. En dehors de ce contexte, le déficit modéré en LCHAD est le seul
déficit de la β-OAG qui soit associé à l’apparition progressive d’une neuropathie
périphérique, en l’occurrence, une rétinopathie pigmentaire pouvant entraîner une
cécité, attribuée à une dégénérescence de l’épithélium pigmentaire rétinien [44]. Une expression élevée de
la MTP et d’autres enzymes associées à la β-OAG est en effet révélée par
immunohistochimie dans cet épithélium. Ces atteintes rétiniennes pourraient être
liées à la toxicité des hydroxy-acylcarnitines à chaîne longue qui s’accumulent
spécifiquement dans le cas du déficit en LCHAD. Cependant, les mécanismes
pathogéniques et le rôle exact de la β-OAG dans ce tissu restent largement inconnus.
Plus généralement, si l’on compare aux autres organes (mentionnés précédemment), il
n’existe que relativement peu de données concernant l’activité de la β-OAG dans le
système nerveux, et l’idée que le cerveau n’oxyde pas les acides gras prévaut
puisque les neurones utilisent principalement le glucose et des corps cétoniques
pour leurs besoins en énergie. Des travaux récents amènent cependant à nuancer cette
affirmation. Ils éclairent d’un jour nouveau le rôle de la β-OAG dans le système
nerveux central. Il a en effet été montré que les acides gras à chaîne longue ou
moyenne peuvent franchir la barrière hémato-encéphalique et être oxydés dans les
astrocytes. Ils constitueraient, chez la souris, un substrat oxydatif important pour
le cerveau chez l’embryon et au début de la vie postnatale [45, 46]. Appuyant ces observations, des études récentes démontrent
que les carnitine palmitoyl transférases (CPT1A et CPT2) sont fortement exprimées
dans plusieurs régions du cerveau, en particulier l’hippocampe et le cervelet, et
dans les astrocytes, mais pas dans les neurones. En dehors des astrocytes, on
observe une activité notable de β-OAG dans les cellules neurales progénitrices
connues pour former de nouveaux neurones au cours du développement [13] comme dans le cerveau de l’adulte [12]. L’inhibition pharmacologique ou la
délétion conditionnelle de la CPT1A chez la souris, au cours de la période
embryonnaire, perturbe fortement l’homéostasie des cellules souches neuronales et
leur différenciation, qu’il s’agisse de cellules souches embryonnaires [13] ou adultes [12]. Ces observations sont à rapprocher de l’existence de dysgénésies
cérébrales avec des défauts de migration neuronale chez les fœtus atteints des
formes les plus sévères de déficit en CPT2, ou d’autres déficits de β-OAG [16, 42]. Des altérations du métabolisme oxydatif mitochondrial pourraient être impliquées dans
la pathogenèse de certains troubles psychiatriques chez l’homme [47]. S’agissant de la β-OAG,
l’existence de retards de développement et de troubles du comportement apparentés à
l’autisme a été rapportée dans les déficits génétiques en VLCAD ou en LCHAD [43]. Des études métabolomiques menées sur
plusieurs cohortes d’individus atteints de troubles du spectre autistique ont
également identifié une sous-population de patients présentant des niveaux
plasmatiques d’acylcarnitines anormalement élevés, ce qui pourrait refléter un
déficit partiel de la β-OAG et/ou de la chaîne respiratoire chez ces patients [43]. Il sera nécessaire de confirmer
l’existence de dysfonctions mitochondriales et la nature exacte de ces dysfonctions
par des études ex vivo, sur des cellules isolées des patients, ou
in vivo. |
La sévérité des manifestations cliniques de certains déficits génétiques de la β-OAG
souligne bien le rôle critique de cette voie métabolique dans l’énergétique globale
de l’organisme et dans le fonctionnement de nombreux organes. Il existe un ensemble
de maladies rares et de maladies chroniques communes qui ont en commun un déficit
modéré de l’activité de la β-OAG. L’étude de ces pathologies nous éclaire sur les
rôles multiples de cette voie métabolique et sur les conséquences de ses
dysfonctionnements sur le plan énergétique, mais également du point de vue de
nombreux autres aspects du fonctionnement cellulaire. La β-OAG est ainsi considérée
désormais comme une cible thérapeutique potentielle pour le traitement de
différentes maladies (diabète, obésité, maladies cardiaques). En parallèle, les
données les plus récentes suggérant des fonctions entièrement nouvelles de la β-OAG,
dans l’acétylation des histones, le lignage des cellules souches neuronales, ou le
destin des cellules cancéreuses, ouvrent des champs de recherche extrêmement
excitants et novateurs pour les années à venir. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Footnotes |
1. Turner
N,
Cooney
GJ,
Kraegen
EW,
Bruce
CR. Fatty acid
metabolism, energy expenditure and insulin resistance in
muscle . J endocrinol.
2014; ;220
::T61.–T79. 2. Karwi
QG,
Uddin
GM,
Ho
KL,
Lopaschuk
GD. Loss of
metabolic flexibility in the failing heart .
Front Cardiovasc Med.
2018; ;5 ::68.. 3. Lionetti
V,
Stanley
WC,
Recchia
FA. Modulating fatty
acid oxidation in heart failure . Cardiovasc
Res.
2011; ;90
::202.–209. 4. Bastin
J. Regulation of
mitochondrial fatty acid beta-oxidation in human: what can we learn from
inborn fatty acid beta-oxidation deficiencies?
Biochimie.
2014; ;96
::113.–120. 5. Fan
W,
Evans
R, PPARs and ERRs:
molecular mediators of mitochondrial metabolism .
Curr Opin Cell Biol.
2015; ;33
::49.–54. 6. Nakamura
MT,
Yudell
BE,
Loor
JJ. Regulation of
energy metabolism by long-chain fatty acids .
Prog Lipid Res.
2014; ;53
::124.–144. 7. Rui
L. Energy metabolism
in the liver . Compr
Physiol.
2014; ;4
::177.–197. 8. Zhang
L,
Keung
W,
Samokhvalov
V, et al. Role of
fatty acid uptake and fatty acid beta-oxidation in mediating insulin
resistance in heart and skeletal muscle .
Biochim Biophys Acta.
2010; ;1801
::1.–22. 9. Fucho
R,
Casals
N,
Serra
D,
Herrero
L. Ceramides and
mitochondrial fatty acid oxidation in obesity .
FASEB J.
2017; ;31
::1263.–1272. 10. Aubert
G,
Vega
RB,
Kelly
DP. Perturbations in
the gene regulatory pathways controlling mitochondrial energy production in
the failing heart . Biochim Biophys
Acta.
2013; ;1833
::840.–847. 11. Menzies
KJ,
Zhang
H,
Katsyuba
E,
Auwerx
J. Protein
acetylation in metabolism: metabolites and cofactors .
Nat Rev Endocrinol.
2016; ;12
::43.–60. 12. Knobloch
M,
Pilz
GA,
Ghesquiere
B, et al. A fatty
acid oxidation-dependent metabolic shift regulates adult neural stem cell
activity . Cell Rep.
2017; ;20
::2144.–2155. 13. Xie
Z,
Jones
A,
Deeney
JT, et al., Inborn
errors of long-chain fatty acid beta-oxidation link neural stem cell
self-renewal to autism . Cell
Rep.
2016; ;14
::991.–999. 14. Carracedo
A,
Cantley
LC,
Pandolfi
PP. Cancer
metabolism: fatty acid oxidation in the limelight .
Nat Rev Cancer.
2013; ;13
::227.–232. 15. Houten
SM,
Violante
S,
Ventura
FV,
Wanders
RJ. The biochemistry
and physiology of mitochondrial fatty acid beta-oxidation and its genetic
disorders . Annu Rev
Physiol.
2016; ;78
::23.–44. 16. Bonnefont
JP,
Djouadi
F,
Prip-Buus
C, et al. Carnitine
palmitoyltransferases 1 and 2: biochemical, molecular and medical
aspects . Mol Aspects Med.
2004; ;25
::495.–520. 17. Casals
N,
Zammit
V,
Herrero
L, et al., Carnitine
palmitoyltransferase 1C: from cognition to cancer .
Prog Lipid Res.
2016; ;61
::134.–148. 18. Chegary
M,
Brinke
H,
Ruiter
JP, et al.
Mitochondrial long chain fatty acid beta-oxidation in man and
mouse . Biochim Biophys
Acta.
2009; ;1791
::806.–815. 19. Fould
B,
Garlatti
V,
Neumann
E, et al. Structural
and functional characterization of the recombinant human mitochondrial
trifunctional protein .
Biochemistry.
2010; ;49
::8608.–8617. 20. Baruteau
J,
Sachs
P,
Broue
P, et al. Clinical
and biological features at diagnosis in mitochondrial fatty acid
beta-oxidation defects: a French pediatric study of 187
patients . J Inherit Metab
Dis.
2013; ;36
::795.–803. 21. Knottnerus
SJG,
Bleeker
JC,
Wust
RCI, et al.
Disorders of mitochondrial long-chain fatty acid oxidation
and the carnitine shuttle . Rev Endocr Metab
Disord.
2018; ;19
::93.–106. 22. Olpin
SE
Pathophysiology of fatty acid oxidation disorders and resultant
phenotypic variability . J Inherit Metab
Dis.
2013; ;36
::645.–658. 23. Spiekerkoetter
U,
Bastin
J,
Gillingham
M, et al. Current
issues regarding treatment of mitochondrial fatty acid oxidation
disorders . J Inherit Metab
Dis.
2010; ;33
::555.–561. 24. Janeiro
P,
Jotta
R,
Ramos
R, et al. Follow-up
of fatty acid beta-oxidation disorders in expanded newborn screening
era . Eur J Pediatr.
2019; ;178
::387.–394. 25. Vockley
J,
Charrow
J,
Ganesh
J, et al.
Triheptanoin treatment in patients with pediatric
cardiomyopathy associated with long chain-fatty acid oxidation
disorders . Mol Genet Metab.
2016; ;119
::223.–231. 26. Vockley
J,
Marsden
D,
McCracken
E, et al. Long-term
major clinical outcomes in patients with long chain fatty acid oxidation
disorders before and after transition to triheptanoin treatment–A
retrospective chart review . Mol Genet
Metab.
2015; ;116
::53.–60. 27. Abdurrachim
D,
Luiken
JJ,
Nicolay
K, et al. Good and
bad consequences of altered fatty acid metabolism in heart failure: evidence
from mouse models . Cardiovasc
Res.
2015; ;106
::194.–205. 28. Fillmore
N,
Mori
J,
Lopaschuk
GD. Mitochondrial
fatty acid oxidation alterations in heart failure, ischaemic heart disease
and diabetic cardiomyopathy . Br J
Pharmacol.
2014; ;171
::2080.–2090. 29. Aubert
G,
Martin
OJ,
Horton
JL, et al., The
failing heart relies on ketone bodies as a fuel .
Circulation.
2016; ;133
::698.–705. 30. Jaswal
JS,
Keung
W,
Wang
W, et al. Targeting
fatty acid and carbohydrate oxidation: a novel therapeutic intervention in
the ischemic and failing heart . Biochim
Biophys Acta.
2011; ;1813
::1333.–1350. 31. Ferrannini
E,
Mark
M,
Mayoux
E. CV protection in
the EMPA-REG OUTCOME trial: a Thrifty Substrate hypothesis .
Diabetes care.
2016; ;39
::1108.–1114. 32. Mudaliar
S,
Alloju
S,
Henry
RR. Can a shift in
fuel energetics explain the beneficial cardiorenal outcomes in the EMPA-REG
OUTCOME study? A unifying hypothesis .
Diabetes care.
2016; ;39
::1115.–1122. 33. Bonnefont
JP,
Bastin
J,
Laforet
P, et al. Long-term
follow-up of bezafibrate treatment in patients with the myopathic form of
carnitine palmitoyltransferase 2 deficiency .
Clin Pharmacol Ther.
2010; ;88
::101.–108. 34. Djouadi
F,
Aubey
F,
Schlemmer
D,
Bastin
J. Peroxisome
proliferator activated receptor delta (PPARδ) agonist but not PPAR alpha
corrects carnitine palmitoyl transferase 2 deficiency in human muscle
cells . J Clin Endocrinol
Metab.
2005; ;90
::1791.–1797. 35. Gillingham
MB,
Heitner
SB,
Martin
J, et al.
Triheptanoin versus trioctanoin for long-chain fatty acid
oxidation disorders: a double blinded, randomized controlled
trial . J Inherit Metab Dis.
2017; ;40
::831.–843. 36. Gillingham
MB,
Harding
CO,
Schoeller
DA, et al. Altered
body composition and energy expenditure but normal glucose tolerance among
humans with a long-chain fatty acid oxidation disorder .
Am J Physiol Endocrinol Metab.
2013; ;305
::E1299.–E1308. 37. Mansouri
A,
Gattolliat
CH,
Asselah
T. Mitochondrial
dysfunction and signaling in chronic liver diseases .
Gastroenterology.
2018; ;155
::629.–647. 38. Ipsen
DH,
Lykkesfeldt
J,
Tveden-Nyborg
P
Molecular mechanisms of hepatic lipid accumulation in
non-alcoholic fatty liver disease . Cell Mol
Life Sci.
2018; ;75
::3313.–3327. 39. Ratziu
V,
Harrison
SA,
Francque
S, et al.
Elafibranor, an agonist of the peroxisome
proliferator-activated receptor-alpha and -delta, induces resolution of
nonalcoholic steatohepatitis without fibrosis worsening .
Gastroenterology.
2016; ;150((1147–59))
::e5.. 40. Pougovkina
O, te
Brinke
H,
Ofman
R, et al.
Mitochondrial protein acetylation is driven by acetyl-CoA
from fatty acid oxidation . Hum Mol
Genet.
2014; ;23
::3513.–3522. 41. McDonnell
E,
Crown
SB,
Fox
DB, et al. Lipids
reprogram metabolism to become a major carbon source for histone
acetylation . Cell Rep.
2016; ;17
::1463.–1472. 42. Tein
I. Impact of fatty
acid oxidation disorders in child neurology: from Reye syndrome to Pandora’s
box . Dev Med Child Neurol.
2015; ;57
::304.–306. 43. Barone
R,
Alaimo
S,
Messina
M, et al. A subset
of patients with autism spectrum disorders show a distinctive metabolic
profile by dried blood spot analyses . Front
Psychiatry.
2018; ;9 ::636.. 44. Tyni
T,
Paetau
A,
Strauss
AW, et al.
Mitochondrial fatty acid beta-oxidation in the human eye and
brain: implications for the retinopathy of long-chain 3-hydroxyacyl-CoA
dehydrogenase deficiency .
PediatrRes.
2004; ;56
::744.–750. 45. Jernberg
JN,
Bowman
CE,
Wolfgang
MJ,
Scafidi
S. Developmental
regulation and localization of carnitine palmitoyltransferases (CPTs) in rat
brain . J Neurochem.
2017; ;142
::407.–419. 46. Panov
A,
Orynbayeva
Z,
Vavilin
V,
Lyakhovich
V. Fatty acids in
energy metabolism of the central nervous system .
Biomed Res Int.
2014; ;2014
::472459.. 47. Pei
L,
Wallace
DC. Mitochondrial
etiology of neuropsychiatric disorders . Biol
Psychiatry.
2018; ;83
::722.–730. |