| |
| Med Sci (Paris). 35(10): 806–809. doi: 10.1051/medsci/2019149.Cent ans après, le retour de la phagothérapie
? Chroniques génomiques Bertrand Jordan1* 1UMR 7268 ADÉS, Aix-Marseille, Université /EFS/CNRS; CoReBio
PACA, case 901, Parc
scientifique de Luminy, 13288Marseille Cedex 09,
France MeSH keywords: Multirésistance bactérienne aux médicaments, Histoire du 20ème siècle, Histoire du 21ème siècle, Humains, Phagothérapie, histoire |

Les bactériophages, et en particulier le phage T4, ont joué un rôle essentiel dans les
débuts de la biologie moléculaire, avec des précurseurs comme Seymour Benzer, Max
Delbrück ou Günther Stent [1] :
ces pionniers les ont employés pour développer une nouvelle approche de la biologie,
plus rigoureuse et plus quantitative. C’est aussi un bactériophage qui, entre les mains
d’Alfred Hershey et de Martha Chase, confirma en 1952 que c’était bien l’ADN qui porte
l’information génétique [2].
Mais, en fait, ces virus bactériens étaient connus depuis le début du siècle et avaient
suscité des grands espoirs thérapeutiques avant d’être quasiment oubliés après la
deuxième guerre mondiale, lorsque la découverte des antibiotiques a pu faire croire que
les maladies infectieuses étaient définitivement vaincues. Aujourd’hui, un usage
inconsidéré de ces molécules a favorisé l’apparition de bactéries multi-résistantes qui
posent de redoutables problèmes, notamment pour les infections nosocomiales, et l’on
recommence à s’intéresser aux vertus thérapeutiques des bactériophages. Un article
récemment paru dans Nature Medicine [3] rapporte un cas clinique dans lequel la
phagothérapie a joué un rôle important, et illustre les possibilités et les limites de
cette approche thérapeutique. |
Petite histoire, de Paris à Tbilissi Félix d’Hérelle (Figure 1)
rapporte, en 1917, ses observations sur « un microbe invisible antagoniste des
bacilles dysentériques » [4],
un virus qu’il va bientôt baptiser « bactériophage ». Le britannique Frederick Twort
avait déjà fait une telle observation en 1915 [5], mais sans pouvoir définir s’il s’agissait
d’un virus ou d’un composé chimique.
 | Figure 1. Félix d’Hérelle, vers 1905 (Wikipedia
open). |
D’Hérelle consacrera les décennies suivantes à développer l’emploi de ces entités
pour traiter les infections bactériennes, et rencontrera un certain succès à une
époque, l’entre-deux guerres, où l’on était très démuni contre ces affections.
D’importantes entreprises pharmaceutiques s’y intéressèrent, notamment Eli
Lilly et Squibb aux États-Unis. En France, le «
Laboratoire du bactériophage » commercialisait des spécialités
à base de phages, une activité qui persista jusqu’à la fin des années 1960 [6]. Mais c’est en Union
Soviétique que la phagothérapie connut le plus de succès, notamment à Tbilissi
(aujourd’hui en Géorgie) sous l’impulsion de George Eliava qui avait connu d’Hérelle
lors d’un stage à l’Institut Pasteur et était à la tête d’un important institut.
Eliava fut victime en 1937 des purges staliniennes, mais son institut lui a survécu
et reste à l’heure actuelle le plus important centre de phagothérapie mondial,
employant plusieurs centaines de personnes. Il a donné naissance à plusieurs
entreprises, dont un « Centre de Phagothérapie » (Figure 2) qui propose aujourd’hui
ses traitements à des malades du monde entier [7]. La phagothérapie reste répandue dans les
pays de l’ex-URSS; elle fit également l’objet de recherches militaires aux
États-Unis et même d’une production à grande échelle dans l’Allemagne nazie… [6]
 | Figure 2. Le Centre de Phagothérapie dépendant de l’institut Eliava à
Tbilissi (Géorgie). L’analyse initiale à partir
d’un prélèvement coûte 200 dollars US, le coût d’un traitement (hors
voyage et hébergement) est de l’ordre de 5 000 dollars US (soit environ
4 500 €). Ce sont des montants somme toute assez raisonnables… (extrait
de la page d’accueil : http://www.phagetherapycenter.com/) |
|
Actualité de la phagothérapie Comme déjà mentionné, l’émergence de bactéries résistantes aux antibiotiques incite à
explorer à nouveau les approches de phagothérapie, qui ont fait assez récemment
l’objet d’une excellente Synthèse dans notre revue [11] (→).
(→) Voir la Synthèse de N. Dufour et L. Debarbieux, m/s n° 4,
avril 2017, page 410
On sait maintenant qu’il existe dans la nature un très grand nombre de phages, et que
chacun d’eux est spécifique d’une espèce bactérienne ou même d’une souche
particulière. Cela signifie que le traitement d’une infection donnée requiert
l’emploi d’un phage (ou d’un cocktail de phages) efficace sur la ou les bactéries
présentes chez le malade. Il s’agit en somme d’une médecine très personnalisée, qui
doit adapter le traitement à chaque cas particulier. Cela suppose donc d’être
capable d’identifier très précisément la bactérie pathogène, et d’avoir accès à une
« banque de phages » contenant un grand nombre de virus bien caractérisés. Dans ces
conditions, il est difficile d’organiser des essais cliniques puisque le traitement
doit être adapté « sur mesure » pour chaque patient. Les quelques travaux publiés
s’apparentent donc plutôt à des descriptions de cas cliniques, et ont généralement
fait l’objet de publications dans des revues plutôt confidentielles. Citons par
exemple un article récent [8]
émanant de plusieurs laboratoires californiens et décrivant le traitement d’un
patient diabétique souffrant d’une pancréatite et d’une infection par une bactérie
multirésistante Acinetobacter baumannii. En situation d’échec
thérapeutique, des dizaines de phages spécifiques pour cette bactérie et provenant
d’une banque établie par un laboratoire de la marine étatsunienne
(biological defense research directorate) ont été testés sur
des isolats provenant du patient. Neuf d’entre eux se sont avérés capables de lyser
les bactéries correspondantes, et ils ont été utilisés en injections par voies
intraveineuses et percutanées. L’état du malade s’est amélioré de manière
spectaculaire : initialement dans le coma, il a pu finalement quitter l’hôpital et
même reprendre son travail. À noter qu’au cours de la phagothérapie, sont apparues
des bactéries (toujours A. baumannii) résistantes au cocktail
utilisé, et qu’il a fallu cribler une nouvelle série de bactériophages pour
retrouver des souches actives (ce qui a été réalisé en trois jours, belle
performance). Notons enfin que l’ajout vers la fin de la thérapie d’un nouvel
antibiotique, la minocycline, a pu jouer un rôle. Au total, on a là un résultat
positif mais qui ne constitue pas une preuve formelle de l’efficacité de la
phagothérapie compte tenu de l’absence de témoin et de l’ajout de la minocycline; ce
travail montre aussi que la thérapie nécessite un ajustement précis du traitement au
patient et la capacité de l’adapter rapidement en cours de route. Un autre essai,
français celui-là, a tenté d’établir l’efficacité de la phagothérapie pour le
traitement de brûlures infectées par Pseudomonas aeruginosa [9]. Il s’agissait là d’un
véritable essai clinique en double aveugle, avec un groupe témoin traité de manière
conventionnelle (par la sulfadiazine argentique). Malheureusement, le titre des
suspensions de phages employées avait fortement baissé pendant les délais imposés
par la logistique et les aspects règlementaires, de sorte que la concentration
utilisée pour les traitements (environ 100 plaque forming unit
[PFU] par ml) était très faible, cent fois inférieure à celle employée dans
l’article précédemment cité [8]. Assez
logiquement, cette phagothérapie s’est avérée inopérante, mais l’essai a néanmoins
été publié1, [9]. Ce travail a le mérite de montrer comment un test valable de la
phagothérapie pourrait être organisé, et de pointer un autre problème de cette
approche : le manque de stabilité des suspensions de phages, et la difficulté à en
faire un réactif standardisé et stable. |
Les honneurs de Nature MedicineUn dernier article tout récent (mai 2019) a eu, lui, les honneurs d’une revue bien
cotée [3]. Il ne s’agit pourtant pas d’un
essai clinique en bonne et due forme, mais d’une étude de cas, certes assez
convaincante. La patiente, une jeune fille souffrant de mucoviscidose et d’une série
de pathologies annexes avait bénéficié d’une transplantation de poumons (souvent
pratiquée dans de tels cas) mais présentait une infection post-opératoire disséminée
par Mycobacterium abscessus, non contrôlée par les antibiotiques.
L’isolat bactérien obtenu de la patiente était résistant à tous les antibiotiques
testés2. Pour trouver des phages actifs sur
cette bactérie, les auteurs ont utilisé une collection de plus de 10 000 phages
actifs sur Mycobacterium smegmatis constituée dans le cadre d’un
autre projet, et ont identifié trois phages actifs sur la souche de M.
abscessus de la malade. Deux d’entre eux, dont le pouvoir lytique était
insuffisant, ont subi des modifications de leur ADN pour augmenter leurs capacités
de lyse. Un cocktail de ces trois phages à forte concentration (109
phages par dose) a alors été administré en injection par voie intraveineuse, dans le
cadre d’un traitement au long cours qui a aussi comporté des applications locales
sur les lésions cutanées. Toutes les lésions ont régressé ou disparu, tandis que la
capacité respiratoire de la patiente augmentait nettement au-delà de l’amélioration
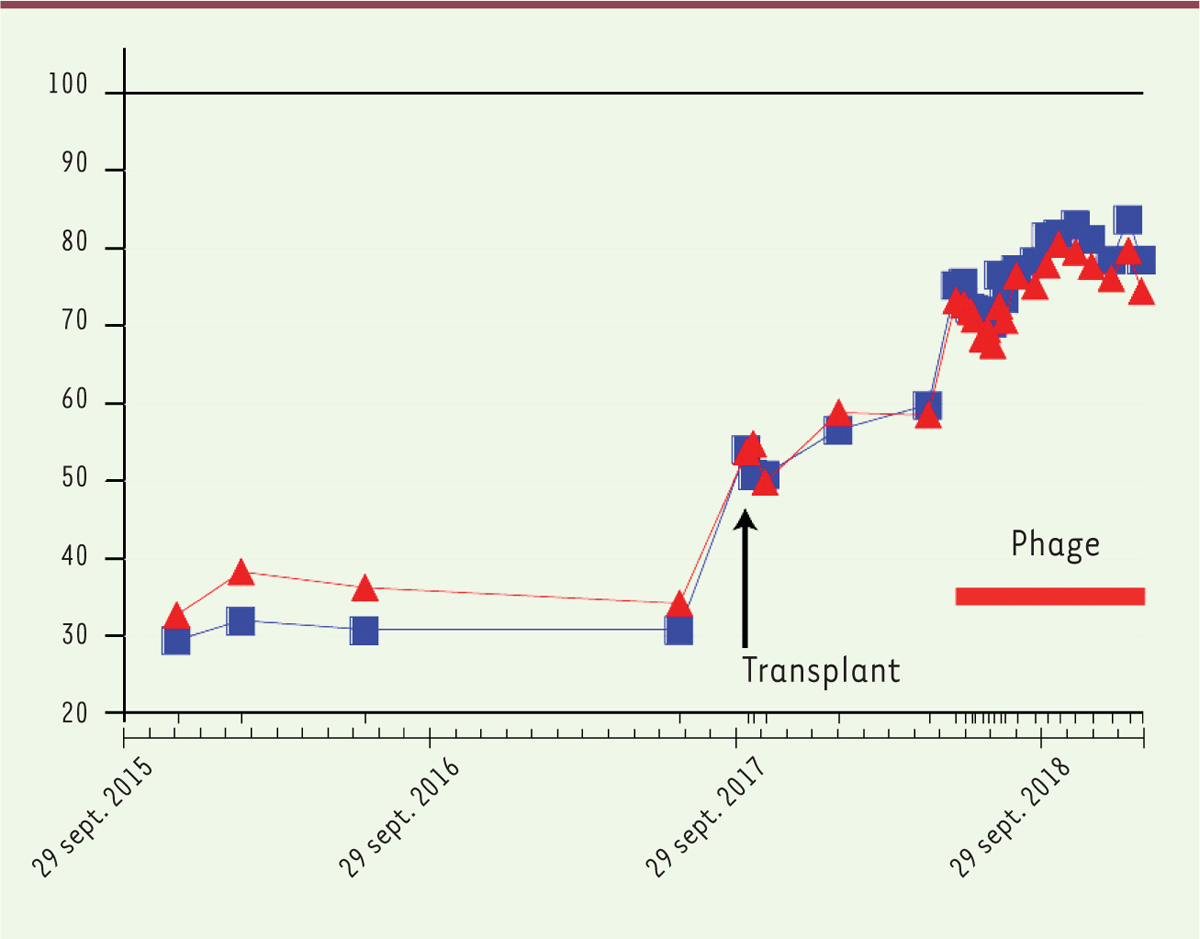
déjà apportée par la transplantation pulmonaire (Figure 3).
 | Figure 3.Capacité pulmonaire mesurée de la patiente, en pour cent de
la capacité théorique (ordonnée), au cours du
traitement. Les symboles rouges et bleus
correspondent à deux méthodes de mesure différentes (extrait partiel et
remanié de la figure 1 de [ 3]) |
Les auteurs ont pu mesurer le titre des phages dans le sérum, et ont observé des
titres élevés, jusqu’à 109 PFU/ml, ce qui suggère fortement qu’il y a eu
réplication des phages au cours du traitement. La patiente n’est pas guérie en ce
sens que les lésions n’ont pas totalement disparu et que M.
abscessus est encore détecté à leur niveau (bien que la bactérie reste
sensible au cocktail de phages), mais son état clinique s’est très nettement
amélioré, selon toute vraisemblance en raison de la phagothérapie. |
La phagothérapie, une voie d’avenir ? À la lecture de ces articles, on comprend mieux pourquoi la phagothérapie, si
séduisante en principe (lutter contre les bactéries en utilisant leurs ennemis
naturels), n’a pas vraiment pris place dans l’arsenal thérapeutique malgré le grave
problème des souches bactériennes multirésistantes. Il ne suffit pas d’administrer
des phages à un patient pour guérir son infection rebelle : il faut disposer d’un
vaste éventail de types de bactériophages, être capable de détecter rapidement ceux
qui peuvent être efficaces dans le cas qui se présente, éventuellement remanier un
peu leur ADN pour augmenter leur efficacité. On comprend que, face à la pénicilline,
les « microbes invisibles » de d’Hérelle n’aient pas fait le poids. Aujourd’hui,
face à la catastrophe sanitaire que constitue la perte d’efficacité de
l’antibiothérapie, ils ont sans doute leur rôle à jouer; mais cela suppose
d’importants investissements dans la constitution et le stockage de collections de
phages bien caractérisés. Il faut aussi améliorer les techniques de criblage afin de
composer rapidement le « meilleur » cocktail face à une infection donnée – et
pouvoir le modifier en cours de traitement si nécessaire. Plusieurs entreprises,
notamment aux États-Unis, développent des programmes allant dans ce sens [10], mais cela justifierait
sans doute aussi une action concertée d’équipes de recherches fondamentales et
cliniques… |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Footnotes |
1. Stent
GS. Molecular biology of
bacterial viruses . San
Francisco-London: : W.H. Freeman and
Co; , 1963. 2. Hershey
AD,
Chase
M. Independent
functions of viral protein and nucleic acid in growth of
bacteriophage . J Gen Physiol.
1952; ; 36 :
:39.–56. 3. Dedrick
RM,
Guerrero-Bustamante
CA,
Garlena
RA, et al.
Engineered bacteriophages for treatment of a patient with a
disseminated drug-resistant Mycobacterium
abscessus . Nat Med.
2019; ; 25 :
:730.–3. 4. D’Hérelle
F. Sur un microbe
invisible antagoniste des bacilles dysentériques . CR
Acad Sci (Paris).
1917; ; 165 :
:373.–5. 5. Twort
F. An investigation
on the nature of ultramicroscopic viruses .
Lancet.
1915; ; 11 : :1241.. 6. Dublanchet
A,
Fruciano
E. Brève histoire de
la phagothérapie . Med Mal Infect.
2008; ; 38 :
:415.–20. 7. Chanishvili
N. Phage therapy:
history from Twort and d’Hérelle through Soviet experience to current
approaches . Adv Virus Res.
2012; ; 83 :
:3.–40. 8. Schooley
RT,
Biswas
B,
Gill
JJ, et al.
Development and use of personalized bacteriophage-based
therapeutic cocktails to treat a patient with a disseminated resistant
Acinetobacter baumannii infection .
Antimicrob Agents Chemother.
2017; ; 61 :
:e00954.–17. 9. Jault
P,
Leclerc
T,
Jennes
S, et al.
Efficacy and tolerability of a cocktail of bacteriophages to
treat burn wounds infected by Pseudomonas aeruginosa
(PhagoBurn): a randomised, controlled, double-blind phase 1/2
trial . Lancet Infect Dis.
2019; ; 19 :
:35.–45. 11. Dufour
N,
Debarbieux
L. La phagothérapie
: une arme crédible face à l’antibiorésistance . Med
Sci (Paris).
2017; ; 33 :
:410.–6. |