| |
| Med Sci (Paris). 35(11): 825–827. doi: 10.1051/medsci/2019159.Les nanotubes membranaires des macrophages infectés par
le VIH-1 Un moyen pour le virus de se propager plus vite dans un
contexte de tuberculose Shanti Souriant,1,2* Maeva Dupont,1,2* Olivier Neyrolles,1,2 Isabelle Maridonneau-Parini,1,2 Geanncarlo Lugo-Villarino,1,2 and Christel Vérollet1,2# 1Institut de pharmacologie et biologie structurale, IPBS,
université de Toulouse, CNRS, UPS, 205 route de Narbonne, 31077Toulouse,
France 2Laboratoire international associé CNRS « IM-TB/HIV »
1167, Toulouse, FranceBuenos Aires,
Argentine MeSH keywords: Animaux, Différenciation cellulaire, Microenvironnement cellulaire, Co-infection, Évolution de la maladie, Infections à VIH, VIH-1 (Virus de l'Immunodéficience Humaine de type 1), Humains, Interleukine-10, Macaca, Activation des macrophages, Macrophages alvéolaires, Monocytes, Mycobacterium tuberculosis, Nanotubes, Récepteurs de surface cellulaire, Tuberculose, Réplication virale, microbiologie, virologie, physiologie, ultrastructure, métabolisme |
La co-infection VIH-1/tuberculose L’infection par le virus de l’immunodéficience humaine (VIH-1), responsable du
syndrome de l’immunodéficience acquise (sida), est à l’origine d’une pandémie
mondiale. De plus, son association avec d’autres agents pathogènes, notamment
Mycobacterium tuberculosis (Mtb), l’agent responsable de la
tuberculose, optimise la pathogénie de chacun et complique le diagnostic et le
traitement des patients. La co-infection VIH-1/Mtb, qui touche 1,2 million de
personnes dans le monde, est donc un problème majeur de santé publique,
particulièrement dans les pays en développement. L’association entre ces deux agents
pathogènes étant particulièrement meurtrière, il est primordial de mieux comprendre
comment VIH-1 et Mtb accélèrent mutuellement leur progression infectieuse. D’une
part, les patients infectés par le VIH-1 ont un risque accru de développer une
tuberculose dans sa forme active (primo-infection ou réactivation d’une tuberculose
latente), qui progressera alors rapidement. D’autre part, chez les patients
co-infectés, on observe une forte augmentation de la réplication du VIH-1 dans les
poumons, le site infectieux préférentiel de Mtb, ainsi que dans le fluide pleural et
le sang. Les mécanismes de réactivation de la tuberculose induite lors d’une
infection par le VIH-1 sont largement décrits, notamment à travers la modification
de l’organisation des granulomes, structures permettant de maintenir Mtb dans un
état de latence asymptomatique [1]. En revanche, les mécanismes par lesquels Mtb exacerbe l’infection
par le VIH-1 et accélère la progression du sida restent très mal connus. C’est à
cette question que nous nous sommes intéressés dans l’article que nous avons
récemment publié dans Cell Reports [2]. |
Un environnement associé à la tuberculose favorise la production de VIH-1 dans
les macrophages Nos travaux [2] démontrent que les macrophages
participent à l’exacerbation de l’infection par le VIH-1 associée à Mtb. Les
macrophages sont l’hôte principal de Mtb. En plus des lymphocytes T CD4+,
ils sont également une cible majeure pour le VIH-1 : ils permettent une réplication
virale productive et contribuent à l’établissement de réservoirs viraux persistants
[3]. Dans les poumons,
les macrophages alvéolaires sont les cibles principales du VIH-1. Nous nous sommes
donc demandé si le micro-environnement créé dans le poumon par les macrophages
infectés par la bactérie pourrait être propice à la multiplication du virus dans les
macrophages voisins. Pour mimer cet environnement, nous avons développé différents
modèles : un modèle in vitro fondé sur la différenciation des
macrophages en présence de surnageants de culture de macrophages infectés par Mtb
(appelé CmMTB, pour conditionned medium from Mtb-infected
macrophages), ainsi qu’un modèle ex vivo utilisant du
fluide pleural (PE) de patients tuberculeux (PE-TB). Nos travaux précédents
utilisant ces deux modèles avaient permis de montrer que, sous l’action majeure de
l’interleukine-10 (IL-10), une cytokine anti–inflammatoire, sécrétée par les
macrophages infectés par Mtb et présente dans le PE-TB, les monocytes nouvellement
recrutés se différencient préférentiellement en macrophages anti-inflammatoires,
appelés M(IL-10). Ces derniers sont caractérisés par une forte expression des
récepteurs de surface CD16a (le récepteur des IgG de type IIIa, RFcIIIa), CD163 (un
récepteur éboueur ou scavenger), et MerTK (c-mer
proto-oncogene tyrosine kinase), ainsi que par l’activation du facteur
de transcription STAT3 (signal transducer and activator of transcription
3), et présentent des modifications fonctionnelles, dont un défaut de
contrôle de la croissance de Mtb [4]. Dans des poumons de macaques tuberculeux, le nombre de macrophages
M(IL-10) est significativement augmenté et est associé à une charge bactérienne
élevée [4]. Plus important encore, nos travaux
récents montrent que cette accumulation des macrophages M(IL-10) est accentuée chez
les macaques co-infectés avec le virus de l’immunodéficience simienne (VIS). De
plus, le nombre de monocytes sanguins potentiellement précurseurs de macrophages
M(IL-10) est très élevé chez des patients co-infectés, comme le montre la présence
de trois fois plus de récepteurs solubles spécifiques des monocytes, sCD163 et sMer
(marqueurs des macrophages M[IL- 10]), dans le sérum des patients co-infectés par
rapport à des patients mono-infectés ou des donneurs sains. Cela nous a permis de
valider in vivo l’importance des macrophages M(IL-10) dans la
co-infection. Par la suite, en utilisant nos deux modèles (CmMTB et PE-TB), nous
avons montré que le microenvironnement associé à la TB augmente de manière
significative (1) la production virale globale par les macrophages,
(2) le nombre de macrophages infectés par le VIH-1, (3) la
formation des cellules géantes multinucléées (CGM), produites à partir de
macrophages infectés par le VIH-1 [5], et (4) la migration des macrophages, un moyen pour le virus de se
disséminer dans l’organisme [2]. Ces effets
sur l’infection par le VIH-1 sont spécifiques de Mtb puisque qu’ils ne sont pas
observés lorsque les macrophages sont traités avec des effusions pleurales de
patients ayant des infections non tuberculeuses. Ainsi, nous avons montré que les macrophages infectés par Mtb génèrent un
environnement qui module les macrophages voisins (effet
« bystander ») vers un programme d’activation qui les rend très
efficaces pour la production du VIH-1. |
Les nanotubes membranaires induits par la tuberculose favorisent le transfert du
VIH-1 entre les macrophages et augmentent ainsi la production virale Comment la voie de signalisation IL-10/STAT3 induite dans un contexte tuberculeux
agit-elle sur les macrophages pour augmenter la production du virus ? Pour répondre
à cette question, différents aspects et étapes de l’infection virale des macrophages
ont été analysés. Nous avons montré que ni l’entrée du VIH-1 dans les macrophages,
ni l’expression des facteurs de restriction virale ne sont affectés dans les
macrophages M(IL-10) in vitro. En revanche, leur capacité à former
des nanotubes membranaires est doublée par l’ajout de CmMTB, et est encore doublée
lorsqu’ils sont en plus infectés par le VIH-1 [2]. Les nanotubes sont de fines structures tubulaires non adhérentes qui
connectent au moins deux cellules entre elles et constituent une nouvelle voie de
communication intercellulaire (Figure
1). Ils sont impliqués dans la transmission entre cellules de
différents récepteurs, protéines solubles, ARN, mais aussi d’organites (lysosomes,
mitochondries, etc.) et d’agents infectieux [6, 7].
L’existence des nanotubes a été révélée dans de nombreux types cellulaires, et leurs
caractéristiques morphologiques et structurales sont assez différentes selon la
cellule à partir de laquelle ils sont formés [6]. Pour les macrophages, les nanotubes peuvent connecter deux cellules
proches (moins de 10 μm) ou éloignées (plus de 200 μm). Ils sont constitués de
membrane plasmique, de filaments d’actine, et contiennent parfois des microtubules
[7]. Alors que l’infection par le VIH-1
favorise à elle seule la formation des nanotubes dans les macrophages [8], nous avons mis en évidence,
pour la première fois, que le micro-environnement associé à la tuberculose induit la
formation de nanotubes larges (contenant des microtubules) ainsi que des nanotubes
fins (dépourvus de microtubules). Cette augmentation de la formation des nanotubes
induite par le traitement des monocytes avec le CmMTB est amplifiée par l’infection
par le VIH-1. Elle est responsable de l’augmentation de la production de virus dans
les cellules traitées avec du CmMTB par rapport aux cellules contrôles, comme nous
l’avons montré grâce à l’utilisation d’un inhibiteur de la formation des nanotubes
(TNTi), qui abolit l’exacerbation de l’infection virale induite par le CmMTB. La
formation des nanotubes dépend de l’IL-10 produite par les macrophages infectés par
Mtb et de l’activation du facteur de transcription STAT3. En effet, l’inhibition de
la voie de signalisation IL-10/STAT3 diminue la formation des nanotubes et, par
conséquent, la production virale. Enfin, dans des expériences de co-culture
effectuées en présence ou en l’absence du TNTi, nous avons observé que le virus est
transféré d’un macrophage à un autre, en partie en utilisant les nanotubes. Il est
possible que le VIH-1 emprunte majoritairement les nanotubes épais comme des tunnels
(Figure 2) [8], en utilisant éventuellement les microtubules
comme des rails. Ainsi, ce processus pourrait être différent de celui décrit pour le
transfert du VIH-1 entre les lymphocytes T CD4+, qui nécessite une
« synapse » à l’extrémité bout des nanotubes [9], ou pour le bacille de Calmette et Guérin (BCG), un autre
micro-organisme dérivé du bacille tuberculeux bovin (Mycobacterium
bovis), qui semble « surfer » à l’extérieur le long des nanotubes
[7]. Enfin, nous avons observé des
structures similaires à des nanotubes entre les macrophages M(IL-10) dans les
poumons de macaques co-infectés par le VIS et Mtb. Cependant, en raison de l’absence
d’un marqueur spécifique des nanotubes et des difficultés techniques pour étudier
ces structures in vivo, nous n’avons pas pu poursuivre leur
caractérisation.
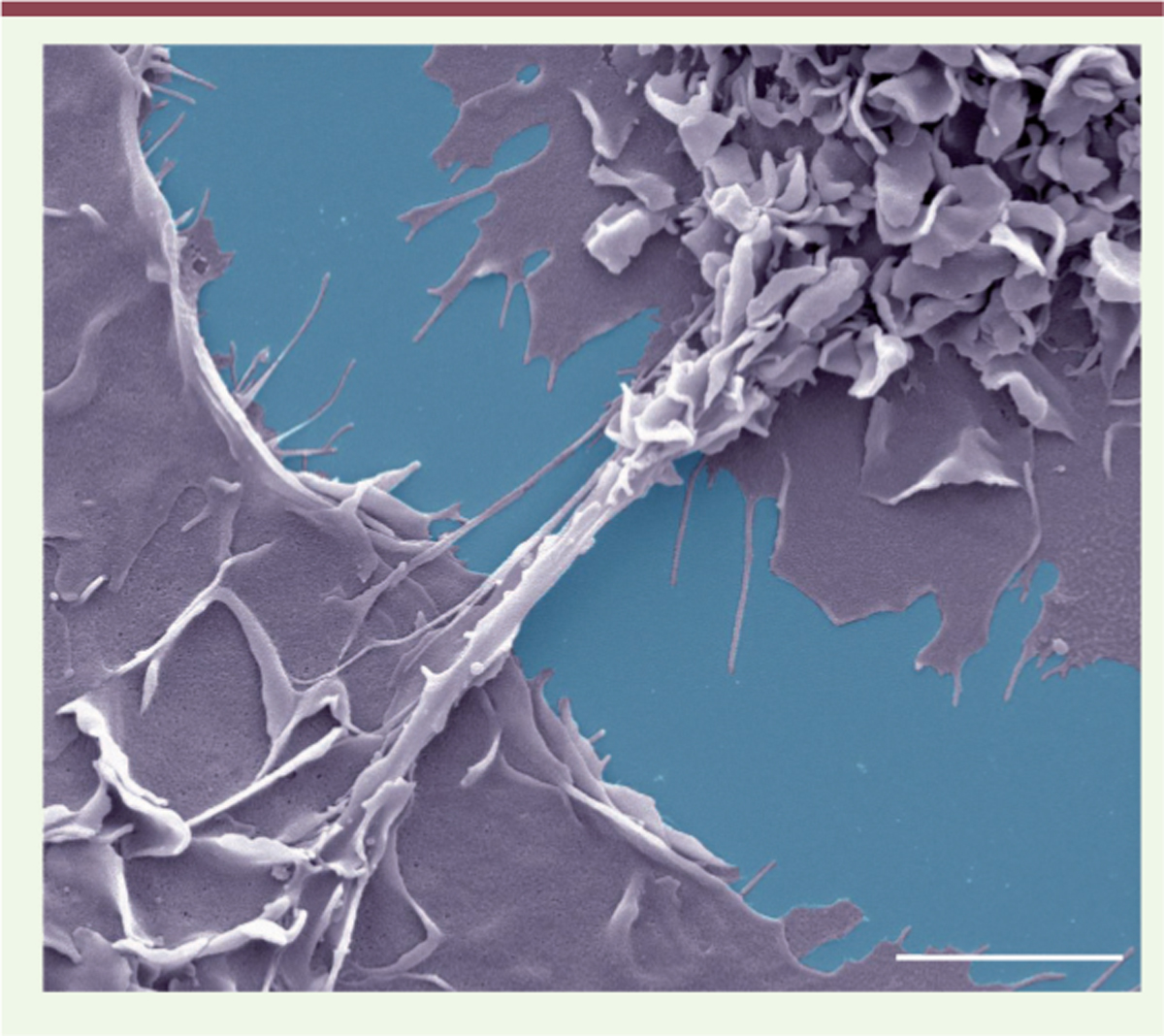
 | Figure 1 Formation de nanotubes membranaires entre les
macrophages. Des macrophages humains sont traités par le
CmMTB et infectés par le VIH-1, puis fixés et analysés en microscopie
électronique à balayage. Les macrophages ont été coloriés en gris et la
lamelle de verre en bleu. Barre d’échelle : 5 µm. |
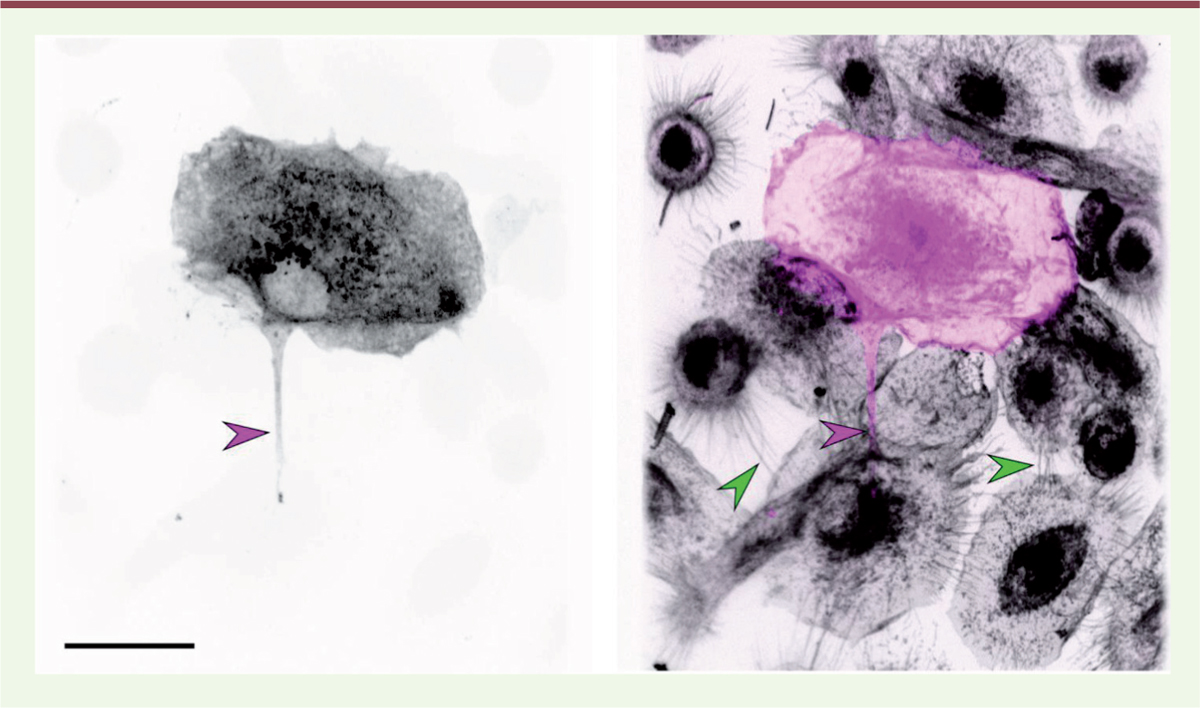
 | Figure 2 Le VIH-1 emprunte les nanotubes. Des macrophages humains
sont traités par le CmMTB et infectés par le VIH-1, puis fixés et
marqués. Photographie de gauche : immunomarquage de la protéine virale
Gag seule (niveaux de gris). Photographie de droite : immunomarquage de
Gag (en rose) et marquage des membranes par la lectine wheat
germ agglutinin (WGA, en gris). Les têtes de flèches
indiquent des nanotubes fins (vert), et un nanotube épais (rose) qui
contient la protéine virale Gag. Barre d’échelle : 10 µm. |
Ainsi, l’activation des macrophages par un signal anti-inflammatoire (IL-10) associé
à la tuberculose induit la formation de nanotubes qui jouent un rôle essentiel dans
la propagation du VIH-1 entre ces cellules et l’augmentation de la production
virale. |
Nos travaux ont permis d’identifier les mécanismes cellulaires et moléculaires mis en
jeu dans un contexte d’infection par Mtb pour favoriser la production du VIH-1 et sa
dissémination au sein des macrophages. Ceux-ci pourraient expliquer pourquoi la
charge virale est augmentée chez les patients co-infectés par le VIH-1 et Mtb. Ces
résultats nous permettent de proposer que la formation des nanotubes membranaires
par les macrophages infectés par le VIH-1 dans un environnement tuberculeux est une
stratégie du virus pour se propager au sein de l’hôte « sans être vu ». Nos travaux
ouvrent de nouvelles perspectives thérapeutiques fondées sur l’inhibition de la
formation des nanotubes pour améliorer le traitement des patients co-infectés par le
VIH- et Mtb, mais aussi dans d’autres contextes pathologiques tels que les cancers
ou les maladies neurodégénératives, pour lesquels un rôle des nanotubes membranaires
a été décrit [10]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Nous remercions nos collègues qui ont participé à cette étude, et présentons
nos excuses à ceux dont les travaux n’ont pu être cités faute d’espace. Nous
remercions également le laboratoire de niveau 3 de l’IPBS (P3 multi-pathogène)
et les plateformes du réseau d’imagerie TRI (Toulouse réseau imagerie,
Genotoul). Ces travaux sont financés par le centre national de la recherche
scientifique, l’université Paul Sabatier, l’agence nationale de la recherche
(ANR 2010-01301, ANR14-CE11-0020-02, ANR16-CE13-0005-01, ANR-11-EQUIPEX-0003),
l’agence nationale de recherche sur le sida et les hépatites virales
(ANRS2014-CI-2, ANRS2014-049, ANRS 2019), Sidaction, le programme ECOS-Sud
(A14S01), la fondation pour la recherche médicale (DEQ2016 0334894, DEQ2016
0334902) et la fondation Bettencourt Schueller.
|
1. Du Bruyn
E,
Wilkinson
RJ, The immune
interaction between HIV-1 infection and Mycobacterium
tuberculosis . Microbiol Spectr.
2016;:4.. 2. Souriant
S,
Balboa
L,
Dupont
M, et al.,
Tuberculosis exacerbates HIV-1 infection through
IL-10/STAT3-dependent tunneling nanotube formation in
macrophages . Cell Rep.
2019;;26::3586.–3599. 3. Rodrigues
V,
Ruffin
N,
San-Roman
M,
Benaroch
P, Myeloid cell
interaction with HIV: a complex relationship . Front
Immunol.
2017;;8::1698.. 4. Lastrucci
C,
Benard
A,
Balboa
L, et al.,
Tuberculosis is associated with expansion of a motile,
permissive and immunomodulatory CD16+ monocyte population via the
IL-10/STAT3 axis . Cell Res.
2015;;25::1333.–1351. 5. Verollet
C,
Souriant
S,
Bonnaud
E, et al., HIV-1
reprograms the migration of macrophages .
Blood.
2015;;125::1611.–1622. 6. Dupont
M,
Souriant
S,
Lugo-Villarino
G, et al., Tunneling
nanotubes: intimate communication between myeloid cells .
Front Immunol.
2018;;9::43.. 7. Onfelt
B,
Nedvetzki
S,
Benninger
RK, et al.,
Structurally distinct membrane nanotubes between human
macrophages support long-distance vesicular traffic or surfing of
bacteria . J Immunol.
2006;;177::8476.–8483. 8. Eugenin
EA,
Gaskill
PJ,
Berman
JW, Tunneling
nanotubes (TNT) are induced by HIV-infection of macrophages: a potential
mechanism for intercellular HIV trafficking .
Cell Immunol.
2009;;254::142.–148. 9. Sowinski
S,
Jolly
C,
Berninghausen
O, et al., Membrane
nanotubes physically connect T cells over long distances presenting a novel
route for HIV-1 transmission . Nat Cell
Biol.
2008;;10::211.–219. 10. Ariazi
J,
Benowitz
A, De
Biasi
V, et al., Tunneling
nanotubes and gap junctions. Their role in long-range intercellular
communication during development, health, and disease
conditions . Front Mol
Neurosci.
2017;;10::333.. |