| |
| Med Sci (Paris). 35(11): 828–830. doi: 10.1051/medsci/2019161.Pseudomonas aeruginosa utilise ses
bactériophages filamenteux pour manipuler la réponse immunitaire Mathieu De Jode1,2 and Laurent Debarbieux1* 1Institut Pasteur, groupe interactions
bactériophages-bactéries chez l’animal, département de
microbiologie, 25, rue du
Docteur Roux, 75015Paris,
France 2Sorbonne université, collège doctoral,
F-75005Paris,
France MeSH keywords: Animaux, Phénomènes physiologiques bactériens, Vaccins antibactériens, Mouvement cellulaire, Humains, Système immunitaire, Inovirus, Interféron de type I, Souris, Phagocytose, Pseudomonas aeruginosa, Facteur de nécrose tumorale alpha, Virulence, immunologie, physiologie, biosynthèse, pathogénicité |
Pseudomonas aeruginosa, ou bacille pyocyanique, est une bactérie
Gram-négative responsable d’infections diverses (pulmonaires, urinaires, cutanées,
etc.), qui sont d’autant plus sévères que cette bactérie est devenue plus résistante aux
antibiotiques. L’Organisation mondiale de la santé a d’ailleurs récemment classé
P. aeruginosa comme un pathogène prioritaire, contre lequel il est
urgent de découvrir de nouveaux traitements. La virulence de P.
aeruginosa repose sur de nombreux facteurs, tels que toxines, flagelle ou
pilus, mais dans un article récemment publié dans Science, Sweere
et al. ont montré que P. aeruginosa utilisait un
nouveau type de facteur de virulence : le bactériophage filamenteux Pf4, qui réduit la
réponse immunitaire dirigée contre cette bactérie [1]. |
Le bactériophage filamenteux Pf4 Les bactériophages filamenteux sont des bactériophages tempérés1, dont les virions, constitués de protéines structurales
enrobant le génome viral (ADN simple brin), ressemblent à de longs tubes (6 à 8 nm
de diamètre et 800 à 2 000 nm de longueur). Contrairement aux bactériophages
virulents utilisés en phagothérapie, qui lysent rapidement les bactéries qu’ils
infectent, les bactériophages filamenteux sont sécrétés par la bactérie sans la
détruire [2]. Les auteurs
avaient précédemment découvert que les bactériophages filamenteux de P.
aeruginosa perturbaient la réponse inflammatoire, et étaient ainsi
impliqués dans la virulence de ce pathogène [3]. Les bases mécanistiques de l’effet anti-inflammatoire du
bactériophage Pf4 sont rapportées dans leur nouvel article. |
Le phage filamenteux Pf4 est important pour la colonisation de l’organisme hôte
par P. aeruginosaAfin d’explorer le rôle du bactériophage Pf4 dans l’infection par P.
aeruginosa, les chercheurs ont supprimé l’ADN de ce bactériophage du
génome de la souche bactérienne PAO1. Ils ont ainsi pu découvrir, sur un modèle
murin d’infection, que les souches qui possèdent l’ADN de Pf4 colonisent mieux une
plaie ouverte que les souches qui en sont dépourvues. De plus, les infections par la
souche possédant l’ADN de Pf4 sont caractérisées par une augmentation de la
morbidité et de la mortalité des animaux par rapport aux infections par la souche
qui en est dépourvue. Pour expliquer cette augmentation de la virulence de
P. aeruginosa contenant le génome de Pf4, les auteurs ont
analysé les effets de Pf4 sur le système immunitaire de l’organisme hôte. |
Pf4 active une réponse anti-virale qui diminue la réponse
anti-bactérienne Le recrutement des cellules immunitaires sur le site de l’infection n’est pas affecté
par la présence du bactériophage, mais le nombre de bactéries internalisées par des
cellules dendritiques murines ou des macrophages murins et humains est réduit en
présence de Pf4. Cependant, la destruction des bactéries par phagocytose n’est pas
altérée, ce qui signifie que Pf4 agit sur l’étape de capture de la bactérie par le
macrophage. Les auteurs ont découvert que la production de TNF-α (tumor
necrosis factor alpha) par des macrophages, en réponse à une
stimulation de la réponse inflammatoire par l’ajout de lipopolysaccharide (LPS)
bactérien, est diminuée en présence de Pf4. Cette diminution est due à une induction
de la production d’interférons de type I (IFN-I),un marqueur de la réponse
immunitaire antivirale, stimulée par la présence du bactériophage Pf4. Les auteurs
ont ensuite montré que cette activation de la production d’IFN1 s’effectuait
via TRIF (TIR-domain-containing adapter-inducing
interferon-b), lui-même activé par TLR3 (Toll-like receptor
3), dont la fonction est notamment de reconnaître les molécules d’ARN
double brin. Des molécules d’ARN du bactériophage Pf4 ont ensuite été produites et purifiées afin
de montrer qu’elles sont capables d’activer TLR3 exprimé par des monocytes humains.
Étonnamment, des ARN correspondant à des gènes du bactériophage Pf4 ont également
été détectés dans les cellules humaines incubées avec celui-ci. Cela suggère que
soit l’ADN de ce bactériophage est transcrit dans les cellules eucaryotes, soit le
phage relargue des molécules d’ARN encapsidées lors de la formation des virions.
Aucune de ces deux hypothèses n’est explorée dans l’article, mais elles feront sans
aucun doute l’objet de futurs travaux de recherche. Les auteurs ont ensuite marqué le bactériophage Pf4 par un fluorophore, et suivi par
microscopie sa destination lorsqu’il est incubé avec des cellules dendritiques. Pf4
est absorbé par endocytose et est retrouvé co-localisé avec TLR3 dans les endosomes
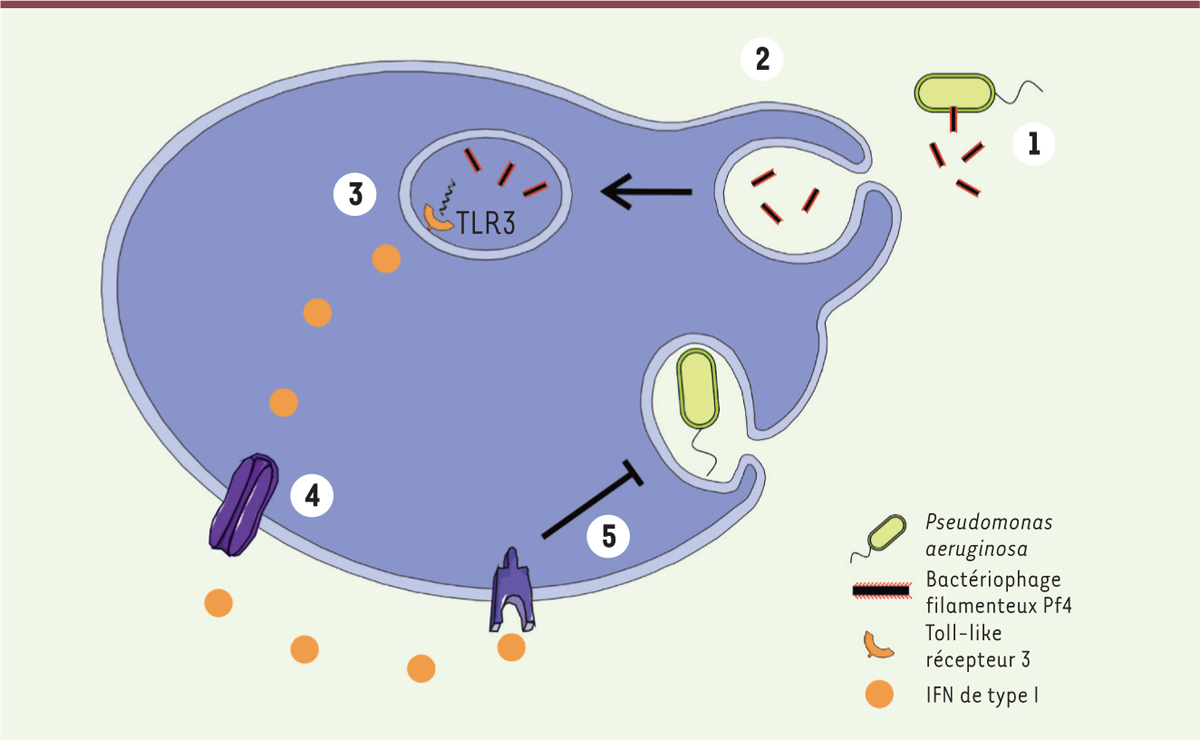
et les lysosomes. Ces résultats permettent aux auteurs de proposer la séquence
d’évènements suivante : Pf4 est sécrété par P. aeruginosa dans le
milieu extérieur, où il est capturé par des cellules phagocytaires, conduisant à
l’activation de TLR3, ce qui induit la production d’IFN-I, qui inhibe la production
de TNF-α et provoque une réduction de la phagocytose des bactéries. In
fine, cette cascade aboutit à une diminution de la clairance de
P. aeruginosa par le système immunitaire, et a pour conséquence
une colonisation bactérienne de l’hôte accrue (Figure 1).
 | Figure 1. La bactérie Pseudomonas aeruginosa utilise le
bactériophage filamenteux Pf4 pour augmenter sa virulence.
Certaines souches de P. aeruginosa produisent le
bactériophage Pf4 (étape 1), qui est absorbé (par endocytose) par les
cellules immunitaires (étape 2). Le récepteur TLR3 (Toll-like
récepteur 3) détecte alors la présence de molécules d’ARN
du phage, ce qui déclenche la production d’interférons de type I (étape
3), qui est secrété (étape 4) et provoque, par la liaison à son
récepteur, une réduction de la phagocytose de P.
aeruginosa (étape 5). |
|
Un vaccin contre P. aeruginosa ciblant le bactériophage
Pf4 À partir de leurs résultats associant le bactériophage Pf4 à la virulence de
P. aeruginosa, les auteurs ont proposé une approche inédite de
vaccin contre le bactériophage Pf4, fondée sur la production d’anticorps dirigés
contre la protéine principale de sa capside. Cette vaccination, testée chez la
souris, permet de réduire de moitié le nombre de plaies infectées par P.
aeruginosa, et in vitro, d’augmenter le nombre de
bactéries phagocytées. Ce résultat est très prometteur car il pourrait ouvrir la
voie au développement d’un nouveau type de vaccin, qui ne serait pas dirigé contre
la bactérie elle-même, mais contre les bactériophages filamenteux qu’elle produit.
La pertinence de cette approche est confirmée par une étude récente qui montre que
la prévalence des bactériophages filamenteux dans les souches de P.
aeruginosa isolées de patients atteints de mucoviscidose (chez qui
l’infection pulmonaire par cette bactérie est fréquente) est d’environ 30 % [4]. |
Implications pour la phagothérapie L’activation d’une réponse antivirale par les molécules d’ARN d’un bactériophage dont
le génome est constitué d’ADN simple brin est un phénomène inédit. Elle montre
clairement que certains bactériophages interagissent avec le système immunitaire.
Mais, comme le soulignent les auteurs, cette découverte ne remet pas en cause la
phagothérapie qui repose sur l’utilisation de bactériophages virulents à ADN double
brin comme agents antibactériens [8] (→).
(→) Voir la Synthèse de N. Dufour et L. Debarbieux, m/s n° 4,
avril 2017, page 410
Les deux types de bactériophages sont différents, et les travaux évaluant l’effet sur
le système immunitaire de traitements par les bactériophages virulents n’ont jamais
mis en évidence de réponse antivirale. De plus, notre équipe a démontré que les
bactériophages et le système immunitaire agissent de façon synergique dans
l’élimination de P. aeruginosa des poumons d’animaux infectés
[5,9] (→).
(→) Voir la Nouvelle de M.De Jode et al.,
m/s n° 4, avril 2018, page 291
Il est donc probable que le mécanisme décrit par ces auteurs soit restreint à
quelques bactériophages filamenteux [6, 7]. Faut-il
conclure de cette étude que ces bactériophages filamenteux détournent le système
immunitaire pour maintenir une densité de bactéries plus importante afin d’assurer
leur propre subsistance, ou bien les bactéries utilisent-elles ces bactériophages
comme des armes pour contrer le système immunitaire de l’hôte ? Ces travaux
témoignent en tout cas de notre connaissance très incomplète du rôle joué par les
bactériophages qui, plus de 100 ans après leur découverte [10] (→), nous réservent
probablement encore bien des surprises…
(→) Voir la Chronique génomique de B. Jordan, m/s n° 10, octobre 2019, page
806
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1. Sweere
JM, Van
Belleghem
JD,
Ishak
H, et al.,
Bacteriophage trigger antiviral immunity and prevent
clearance of bacterial infection .
Science.
2019;;363. 2. Mai-Prochnow
A,
Hui
JG,
Kjelleberg
S, et al., Big
things in small packages: the genetics of filamentous phage and effects on
fitness of their host . FEMS Microbiol
Rev.
2015;;39::465.–87. 3. Secor
PR,
Michaels
LA,
Smigiel
KS, et al.,
Filamentous bacteriophage produced by Pseudomonas
aeruginosa alters the inflammatory response and promotes
noninvasive infection in vivo . Infect
Immun.
2017;;85::e00648.–16. 4. Burgener
EB,
Sweere
JM,
Bach
MS, et al.,
Filamentous bacteriophages are associated with chronic
Pseudomonas lung infections and antibiotic resistance
in cystic fibrosis . Sci Transl
Med.
2019;;11((488)): pii:
eaau9748.. 5. Roach
DR,
Leung
CY,
Henry
M, et al., Synergy
between the host immune system and bacteriophage is essential for successful
phage therapy against an acute respiratory pathogen .
Cell Host Microbe.
2017;;22((38–47))::e4.. 6. Jonczyk-Matysiak
E,
Lusiak-Szelachowska
M,
Klak
M, et al., The
effect of bacteriophage preparations on intracellular killing of bacteria by
phagocytes . J Immunol Res.
2015;;2015::482863.. 7. Bille
E,
Meyer
J,
Jamet
A, et al., A
virulence-associated filamentous bacteriophage of Neisseria
meningitidis increases host-cell colonisation .
PLoS Pathog.
2017;;13::e1006495.. 8. Dufour
N,
Debarbieux
L, La phagothérapie
: une arme crédible face à l’antibiorésistance .
Med Sci (Paris).
2017;;33::410.–16. 9. De Jode
M,
Roach
D,
Debarbieux
L, La synergie
immunophage au cœur du succès de la phagothérapie pulmonaire.
Med Sci (Paris) .
2018;;34::291.–3. 10. Jordan
B, Cent ans après,
le retour de la phagothérapie ?
Med Sci (Paris).
2019;;35::80.. |