| |
| Med Sci (Paris). 35(11): 836–838. doi: 10.1051/medsci/2019163.Le cil primaire au cœur de la pathogénie du prolapsus
de la valve mitrale Michel Pucéat1* 1Inserm U1251, université Aix-Marseille, MMG,
27 boulevard Jean
Moulin, 13885Marseille,
France MeSH keywords: Protéine morphogénétique osseuse de type 2, Cadhérines, Différenciation cellulaire, Cils vibratiles, Facteur de croissance fibroblastique de type 8, Protéines Hedgehog, Hétérozygote, Humains, Valve atrioventriculaire gauche, Insuffisance mitrale, Prolapsus de la valve mitrale, Mutation, Myocytes cardiaques, Phénotype, Cellules souches pluripotentes, ARN messager, Facteur de croissance endothéliale vasculaire de type A, Dysfonction ventriculaire gauche, Protéine Wnt3A, physiologie, génétique, métabolisme, antagonistes et inhibiteurs, malformations, cytologie, complications, congénital, anatomopathologie, étiologie |
Les malformations congénitales des valves du cœur ont une prévalence estimée à environ
5 % des nouveau-nés, et sont présentes dans 20 % à 30 % des cas de malformation
cardio-vasculaire congénitale [1]. La valve mitrale est souvent affectée. Le prolapsus de la valve mitrale plus
modéré et sans symptôme est par ailleurs fréquent dans la population générale, affectant
1 individu sur 40, tous âges confondus [2]. Le prolapsus de la valve mitrale congénital non syndromique résulte
d’une anomalie du développement embryonnaire de cette valve. Ses conséquences sur la
fonction cardiaque ne s’observent cependant, pour la plupart des sujets atteints, qu’à
l’âge adulte. Des études génétiques ont idenjpgié, chez les individus atteints, des
mutations dans les gènes codant la filamine A (FLNA) [3], la LIM and cysteine-rich domains
1 (LMCD1), la tensine 1 (TNS1) [4], Dachsous
(DCHS1) [5],
et la zinc-finger protein (DZIP1) [6], mais ces mutations ne rendent compte
qu’à peine de 2 % des cas et leurs effets sur le développement de la valve mitrale
restent à déterminer. La malformation conduisant au prolapsus de la valve mitrale
résulte d’une sécrétion excessive de protéines de la matrice extracellulaire par les
cellules interstitielles dans les feuillets valvulaires, ce qui entraîne une
dégénérescence myxomateuse ou fibro-élastique de la valve. La fuite de sang vers
l’oreillette gauche lors de la contraction ventriculaire (régurgitation mitrale) [7] altère progressivement la
fonction du ventricule gauche, nécessitant alors une intervention chirurgicale pour
réparer ou changer la valve. Nous nous sommes intéressés au lien intrigant entre la mutation du gène
DCHS1, qui code Dachsous, une protéine impliquée dans la polarité
planaire des épithéliums, et le prolapsus de la valve mitrale. En effet, dans le cadre
du réseau transatlantique d’excellence MITRAL financé par la Fondation Leducq, nos
collaborateurs français et américains avaient idenjpgié, en France et aux États-Unis,
deux familles comportant plusieurs individus porteurs, à l’état hétérozygote, d’une
mutation faux-sens dans le gène DCHS1 (c.6988C>T ;
p.Arg2330Cys ou c.7538G>A ; p.Arg2513His) et atteints
d’un prolapsus de la valve mitrale [5]. |
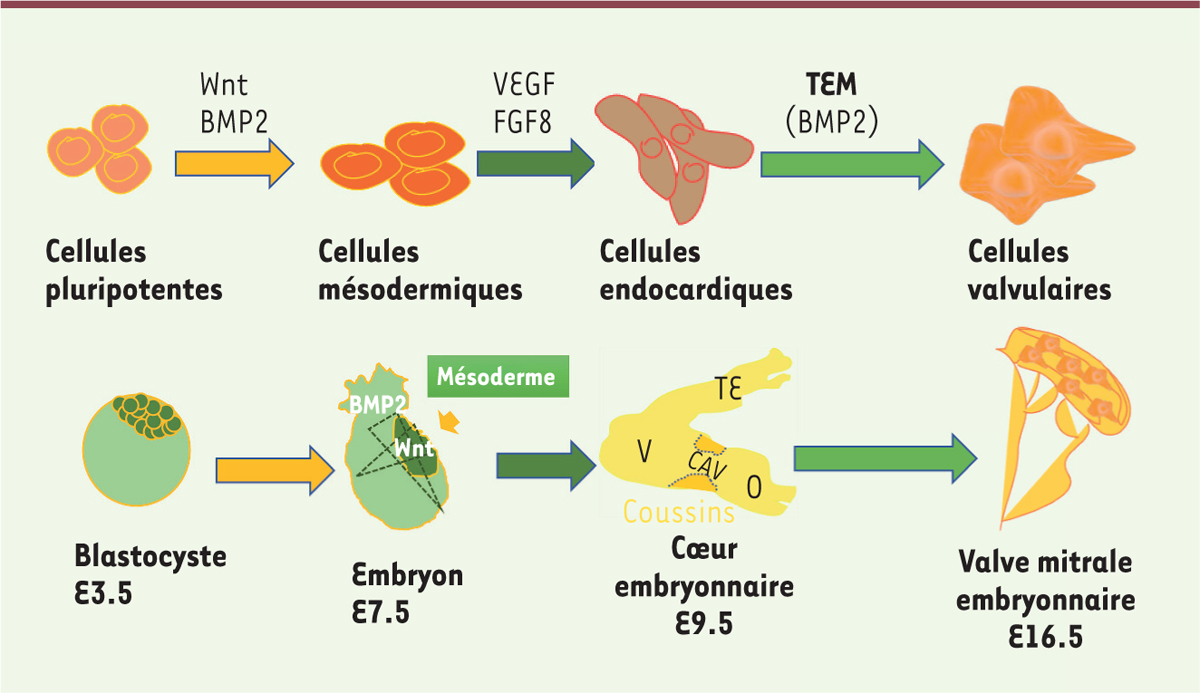
Différenciation de cellules souches pluripotentes induites en cellules
valvulaires Nous avons produit des cellules souches pluripotentes ou cellules iPS
(induced pluripotent stem cells) à partir de cellules
valvulaires d’un patient porteur de la mutation DCHS1:c.6988C>T
prélevées lors d’une intervention chirurgicale sur sa valve mitrale. Des cellules
iPS non mutées et les cellules iPS porteuses de la mutation ont été différenciées en
cellules endocardiques, puis en cellules valvulaires, par un protocole mimant le
scénario du développement normal des valves [8] pendant l’embryogenèse [9] (Figure
1). Les cellules iPS non mutées ont d’abord été
différenciées en cellules du mésoderme par l’action de la protéine BMP2
(bone morphogenetic protein 2) et de la protéine Wnt3a
(Wingless integration site 3a), puis en cellules endocardiques
par l’action du VEGF (vascular endothelial growth factor) et du
FGF8 (fibroblast growth factor 8). Afin de caractériser le
phénotype de ces cellules, nous avons comparé leur transcriptome et celui des
cellules endocardiques du canal atrio-ventriculaire de souris au stade embryonnaire
E9.5, au moment de la transition épithélio-mésenchymateuse d’une fraction des
cellules endocardiques qui est à l’origine des coussins puis des feuillets
valvulaires de la valve mitrale [8]. Cette
comparaison a révélé de nombreux transcrits communs aux deux préparations
cellulaires. Nous avons confirmé ce résultat en déterminant la séquence
nucléotidique des ARN messagers issus de cellules uniques. Cette analyse a révélé
l’hétérogénéité des cellules endocardiques obtenues par différenciation des cellules
iPS, incluant des cellules hémogéniques1 (une
possibilité connue de différenciation des cellules endocardiques [10]), mais aussi des cellules
endothéliales ou en cours de transition épithélio-mésenchymateuse, c’est-à-dire les
cellules à l’origine des valves. Cette analyse a également montré la fiabilité du
protocole de différenciation des cellules iPS in vitro (Figure 1). Afin de mimer la situation
physiologique, les cellules endocardiques obtenues à partir des cellules iPS non
mutées ont ensuite été cultivées en présence de BMP2 (qui est naturellement sécrétée
par les cellules du myocarde in vivo) pour déclencher la transition
épithélio-mésenchymateuse convertissant ces cellules endocardiques en cellules
valvulaires interstitielles. Le séquençage des ARN messagers issus de cellules
uniques a montré la diversité des cellules valvulaires interstitielles obtenues, et
notamment un début de différenciation vers les types cellulaires attendus dans les
différentes couches histologiques de la valve mitrale : fibrosa
(riche en protéoglycanes), spongiosa (riche en fibres de
collagène), et lamina atrialis ou lamina
ventricularis, qui sont les deux couches les plus superficielles
situées respectivement du côté atrial et du côté ventriculaire de la valve (riches
en fibres d’élastine et de collagène) [11]. L’analyse bioinformatique de ces transcriptomes a montré
que les cellules interstitielles se regroupaient en fonction de leur identité
cellulaire et de leur localisation future dans la valve.
 | Figure 1 La différenciation de cellules pluripotentes humaines in
vitro mime la valvulogenèse embryonnaire chez la
souris. TEM : transition
épithélio-mésenchymateuse ; V : ventricule primaire ; O : oreillette ;
CAV : canal atrio-ventriculaire ; TE : tronc efférent. |
La différenciation des cellules iPS porteuses de la mutation de
DCHS1 en cellules endocardiques par le même protocole a montré
tout d’abord que les cellules obtenues avaient conservé leur capacité de transition
épithélio-mésenchymateuse en présence de BMP2. Des analyses de protéines de la
matrice extracellulaire (collagène, hyaluronane et périostine) par
immunofluorescence ont montré une sécrétion accrue de ces protéines par ces
cellules. De plus, l’analyse du transcriptome de cellules uniques a montré une perte
d’identité des cellules valvulaires interstitielles mutées. Toutes exprimaient tous
les gènes codant les protéines de la matrice extracellulaire, et il n’était plus
possible de regrouper ces cellules en sous-types correspondant aux différentes
couches histologiques. Enfin, l’analyse du cil primaire des cellules interstitielles
mutées a révélé un nombre plus faible de cellules ciliées et la présence de cils
plus courts, comme cela avait été montré précédemment chez les souris hétérozygotes
invalidées pour le gène Dchs1 [5]. |
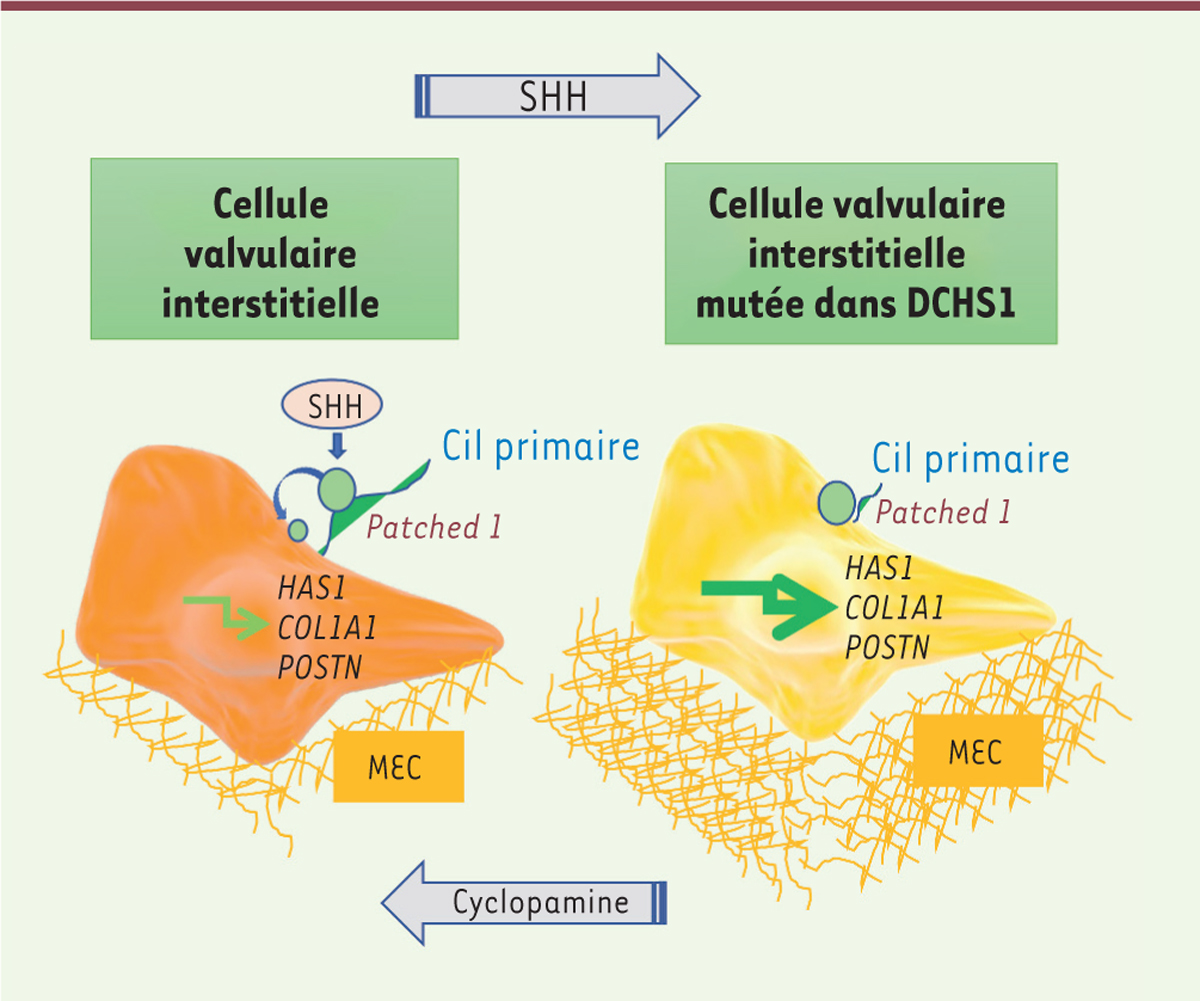
Le cil primaire au cœur de la pathogénie du prolapsus de la valve mitrale Le cil primaire transmet à la cellule des signaux extérieurs par l’intermédiaire de
différents récepteurs membranaires et voies de transduction, dont la voie de
Sonic hedgehog (SHH) et son récepteur membranaire
Patched 1 [12], connue pour activer l’expression de gènes codant des protéines de
la matrice extracellulaire [13]. SHH, par sa liaison à Patched 1 à la surface du
cil, induit la translocation de ce récepteur à la surface apicale de la cellule, ce
qui déclenche la signalisation intracellulaire. Nous avons fait l’hypothèse que les
cellules valvulaires interstitielles porteuses de la mutation de
DCHS1 dépourvues de cil primaire ou possédant un cil
anormalement court étaient incapables de transduire correctement le signal SHH. Une
analyse de la localisation de Patched 1 par immunofluorescence a en
effet montré que ce récepteur, normalement situé sur le cil primaire des cellules
non mutées en l’absence du ligand, était anormalement présent à la surface apicale
des cellules porteuses de la mutation, où son activation constitutive devait
stimuler la production de protéines de la matrice extracellulaire. Nous avons alors
testé l’efficacité d’un inhibiteur pharmacologique de la voie de SHH, la
cyclopamine, sur des cellules mutées, ce qui a permis de rétablir un phénotype
cellulaire normal. Inversement, une activation de la voie SHH dans les cellules non
mutées par l’ajout d’une forte dose du ligand entraîne un phénotype cellulaire
anormal (Figure 2).
 | Figure 2 Mécanisme d’activation constitutive de la voie de
signalisation de sonic hedgehog (SHH) et de la
sécrétion excessive de protéines de la matrice extracellulaire
dans les cellules valvulaires mutées. Dans la
cellule valvulaire interstitielle normale (à gauche), le récepteur
Patched 1, après liaison de son ligand SHH, se
déplace du cil primaire vers la surface apicale pour activer la voie de
signalisation intracellulaire. SHH active l’expression de gènes codant
des protéines de la matrice extracellulaire. Dans la cellule porteuse de
la mutation de DCHS1 (à droite), Patched
1 est anormalement localisé à la surface apicale même en
l’absence de SHH, et la voie de signalisation est constamment activée.
La cyclopamine, qui inhibe la voie de signalisation de SHH, corrige le
phénotype cellulaire anormal. Inversement, une suractivation de la voie
SHH dans des cellules non mutées leur confère un phénotype pathologique.
MEC : matrice extracellulaire ; HAS1 : gène codant la
hyaluronane synthase 1 ; COL1A1 : gène codant la chaîne
alpha-1 du collagène 1 ; POSTN : gène codant la
périostine. |
|
La voie de signalisation par SHH peut être manipulée pharmacologiquement. Elle joue
un rôle majeur au cours du développement embryonnaire, et est moins active dans
l’organisme adulte (en dehors de certaines maladies telles que le cancer ou la
fibrose tissulaire). Une inhibition de la voie SHH pourrait constituer une nouvelle
opportunité thérapeutique pour le prolapsus de la valve mitrale chez les individus
porteurs de mutations des gènes DCHS1 ou DZIP1
[6]. On ignore encore si cette voie de
signalisation est impliquée dans d’autres formes de prolapsus valvulaire. ◊ |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Footnotes |
1. Combs
MD,
Yutzey
KE. Heart valve
development: regulatory networks in development and disease .
Circ Res.
2009; ; 105 :
:408.–21. 2. Levine
RA,
Hagège
AA,
Judge
DP, et al.
Mitral valve disease : morphology and mechanisms .
Nat Rev Cardiol.
2015; ; 12 :
:689.–710. 3. Kyndt
F,
Gueffet
JP,
Probst
V, et al.
Mutations in the gene encoding filamin A as a cause for familial
cardiac valvular dystrophy .
Circulation.
2007; ; 115 :
:40.–9. 4. Dina
C,
Bouatia-Naji
N,
Tucker
N, et al.
Genetic association analyses highlight biological pathways
underlying mitral valve prolapse . Nat
Genet.
2015; ; 47 :
:1206.–11. 5. Durst
R,
Sauls
K,
Peal
DS, et al.
Mutations in DCHS1 cause mitral valve
prolapse . Nature.
2015; ; 525 :
:109.–13. 6. Toomer
KA,
Yu
M,
Fulmer
D, et al.
Primary cilia defects causing mitral valve
prolapse . Sci Transl Med.
2019; ; 11 : :493.. 7. Delling
FN,
Vasan
RS. Epidemiology and
pathophysiology of mitral valve prolapse: new insights into disease
progression, genetics, and molecular basis .
Circulation.
2014; ; 129 :
:2158.–70. 8. Puceat
M. Embryological
origin of the endocardium and derived valve progenitor cells: from
developmental biology to stem cell-based valve repair .
Biochim Biophys Acta.
2013; ; 1833 :
:917.–22. 9. Neri
T,
Hiriart
E, van
Vliet
PP, et al.
Human pre-valvular endocardial cells derived from pluripotent
stem cells recapitulate cardiac pathophysiological
valvulogenesis . Nat Commun.
2019; ; 10 : :1929.. 10. Van
Handel
B,
Montel-Hagen
A,
Sasidharan
R, et al.
Scl represses cardiomyogenesis in prospective hemogenic
endothelium and endocardium .
Cell.
2012; ; 150 :
:590.–605. 11. Schlotter
F,
Halu
A,
Goto
S, et al.
Spatiotemporal multi-omics mapping generates a molecular atlas of
the aortic valve and reveals networks driving disease .
Circulation . 2018; ;
138 :
:377.–93. 12. Rohatgi
R,
Milenkovic
L,
Scott
MP, Patched1
regulates hedgehog signaling at the primary cilium .
Science.
2007; ; 317 :
:372.–6. 13. Liu
J,
Li
Q,
Kuehn
MR, et al.
Sonic hedgehog signaling directly targets hyaluronic acid
synthase 2, an essential regulator of phalangeal joint
patterning . Dev Biol.
2013; ; 375 :
:160.–71. |