| |
| Med Sci (Paris). 35(11): 901–903. doi: 10.1051/medsci/2019176.Rôle de l’interaction entre le récepteur de la
thrombopoïétine et la calréticuline mutée dans les néoplasmes
myéloprolifératifs Maude Tetu,1a Kenza El Hachami,1b and Caroline Marty2,3,4c 1M1 Biologie Santé, Université Paris-Saclay,
91405Orsay,
France 2Inserm, UMR1170, Gustave Roussy,
Villejuif,
France 3Université Paris-Saclay, UMR 1170, Gustave
Roussy, Villejuif, France 4Gustave Roussy, UMR 1170, Villejuif,
France MeSH keywords: Calréticuline, Prolifération cellulaire, Cellules souches hématopoïétiques, Humains, Kinase Janus-2, Mutation, Syndromes myéloprolifératifs, Récepteurs à la thrombopoïétine, Facteur de transcription STAT-1, Thrombopoïétine, génétique, métabolisme, étiologie |
Mutations du gène de la calréticuline dans les néoplasmes
myéloprolifératifs Les néoplasmes myéloprolifératifs (NMP) classiques sont des maladies rares (incidence
de 1/100 000 cas par an) caractérisées par l’accumulation d’un ou plusieurs types de
cellules myéloïdes : les érythrocytes, dans la polyglobulie de Vaquez, les
plaquettes, dans la thrombocythémie essentielle (TE) et les mégacaryocytes et les
granulocytes, dans la myélofibrose primaire (MFP). Cette dernière forme est la plus
grave avec le développement d’une fibrose conduisant à une aplasie médullaire et une
splénomégalie [1]. Les
principaux risques associés aux NMP sont des complications thrombotiques et
hémorragiques, ainsi qu’une évolution possible en leucémie myéloïde aiguë.
L’avantage prolifératif des cellules myéloïdes dans les NMP est dû à l’acquisition
de mutations génétiques par les cellules souches hématopoïétiques, touchant les
voies de signalisation des récepteurs de facteurs de croissance hématopoïétiques,
érythropoïétine, thrombopoïétine (TPO) et G-CSF (granulocyte-colony
stimulating factor). Ces mutations activatrices affectent les gènes
codant le récepteur de la thrombopoïétine (MPL), la tyrosine kinase JAK2
(janus kinase 2) et la calréticuline (CALR)
[2–5]. Les mutations du gène CALR,
en particulier une délétion de 52 paires de bases (pb) (del52) et une insertion de 5
pb, sont les plus fréquentes après la mutation JAK2 V617F, et sont
exclusivement associées aux TE et MFP. La CALR est une protéine chaperonne, résidente du réticulum endoplasmique (RE) grâce
au signal de rétention KDEL présent dans sa partie carboxy-terminale (C-ter). Le RE
est un lieu de maturation et de transport des protéines néo-synthétisées destinées à
la membrane et à la sécrétion et CALR est directement impliquée dans le repliement
de protéines N-glycosylées, c’est-à-dire qui portent une ou plusieurs chaînes
oligosaccharidiques sur des résidus asparagine (N). Les mutations de la CALR génèrent un décalage du cadre de lecture (+
1 pb) aboutissant au remplacement d’une partie du C-ter par une nouvelle séquence
chargée positivement commune à tous les mutants et à la perte du signal KDEL. La
CALR mutée continue à être acheminée vers le RE de façon co-traductionnelle grâce à
son peptide signal. MPL est N-glycosylé sur 4 résidus N de son domaine extracellulaire dans le RE avant
de subir plusieurs autres étapes de maturation des chaînes oligosaccharidiques et
d’atteindre la surface; cependant, MPL ne fait pas partie des substrats de la CALR
sauvage. La CALR mutée acquiert la capacité à se fixer sur MPL au cours des
premières étapes de sa maturation dans le RE et l’accompagne à la surface
(Figure 1), où
l’interaction CALR del52-MPL entraine l’activation de la voie de signalisation
JAK2-STAT [6, 7]. Une étude menée par l’équipe de
Mullally publiée dans Blood [8], vise à caractériser la manière par laquelle la CALR mutée
active la voie de signalisation MPL-JAK2 aboutissant à l’apparition de la TE et/ou
MFP en identifiant précisément les bases moléculaires responsables de l’interaction
entre MPL et la CALR del52.
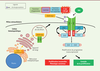 | Figure 1 Interactions moléculaires de la CALR mutée avec MPL dans
les NMP. Des mutations du gène de la CALR
entraînent une perte du peptide signal KDEL de rétention dans le RE et
le remplacement d’une extrémité C-ter acide par un domaine C-ter basique
chargé positivement (C-ter ∆52 pb). La CALR del52 mutée (CALR mut) se
fixe, via son domaine lectine, aux sites de
glycosylation du domaine extracellulaire du récepteur de la
thrombopoïétine (MPL). Ce site d’interaction est différent du site de
liaison du ligand de MLP, la thrombopoïétine (TPO). L’interaction CALR
mut-MPL a lieu dans le RE puis dans l’appareil de Golgi jusqu’à la
membrane plasmique. L’extrémité C-ter ∆52 pb de la protéine mutée
permet, grâce à sa forte charge positive, l’activation constitutive du
MPL. Le signal est alors transduit via la tyrosine
kinase JAK2 qui phosphoryle la tyrosine Y626 de MPL. Cela entraine le
recrutement et l’activation constitutive d’effecteurs comme les facteurs
de transcription STAT qui régulent l’expression de certains gènes,
favorisant ainsi une prolifération cellulaire excessive, caractéristique
des néoplasmes myéloprolifératifs. |
|
La CALR mutée fixe la partie extracellulaire du récepteur MPL Dans un premier temps, les auteurs de cette étude ont analysé l’interaction entre la
CALR del52 et les différents domaines de MPL (extracellulaire ou intracellulaire,
accompagnés du domaine transmembranaire) par des techniques d’immunoprécipitation.
Ils ont ainsi montré que CALR del52 se lie à la partie extracellulaire de MPL,
confirmant ainsi les données de l’équipe de Constantinescu [7]. De plus, une mutation du site de fixation du ligand endogène
TPO dans la partie extracellulaire de MPL n’affecte pas la capacité de liaison de la
CALR mutée au récepteur. Cela suggère que le site d’interaction de la CALR mutée
avec MPL est différent de celui de la TPO. |
L’extrémité C-ter de la protéine CALR mutée nécessite un seuil minimal de charges
positives pour son activité oncogénique La CALR del52 possède une extrémité C-ter constituée de résidus basiques chargés
positivement, contrairement à la protéine sauvage dont la partie C-ter est chargée
négativement. Des mutants de la CALR del52 plus ou moins tronqués en charges
positives ont été testés pour leur capacité à interagir avec MPL par des expériences
de co-immunoprécipitation, ainsi que pour leur capacité à activer la signalisation
MPL-JAK2-STAT et à induire une prolifération spontanée, en absence d’interleukine-3
(IL-3), des cellules Ba/F31 exprimant MPL. Les
auteurs ont pu mettre en évidence que la CALR del52 avec une extrémité C-ter
tronquée en charges positives reste capable d’interagir avec MPL mais sans que la
force de cette interaction soit suffisante pour induire la signalisation en aval de
ce récepteur [9]. |
La fonction lectine de la protéine CALR mutée est impliquée dans son activité
oncogénique La fonction de chaperonne de CALR repose sur deux composantes : le domaine
« poly-peptide binding » qui interagit avec les chaines
polypeptidiques, et le domaine lectine, qui lie les oligosaccharides fixés sur les
résidus asparagine des protéines (N-glycosylations). Des mutations ciblant des
résidus impliqués dans chacune de ces activités [10] ont permis de déterminer que la fonction
lectine est nécessaire pour induire la prolifération des cellules Ba/F3-MPL en
l’absence d’IL-3, alors que la fonction de chaperonne et l’activité de poly-peptide
binding ne sont pas indispensables (Figure 1). En mutant les sites
de N-glycosylation de MPL, Elf et al ont montré que le récepteur
doit nécessairement être glycosylé pour permettre la fixation de la CALR mutée. |
La tyrosine 626 du récepteur MPL est nécessaire à l’activité oncogénique de la
CALR mutée La liaison de la TPO à MPL ou l’interaction de la CALR mutée avec MPL permet le
rapprochement des domaines intracellulaires et donc la juxtaposition des deux
protéines JAK2 liées à chacun des monomères MPL. L’activation des JAK2 par
auto/trans phosphorylation permet la phosphorylation de résidus tyrosines (Y) clés
de MPL et le recrutement d’effecteurs comme les STAT. L’analyse des résidus Y591,
Y626 et Y631 du domaine intracellulaire de MPL impliqués dans sa signalisation
[11] a révélé
l’importance prédominante de Y626 dans l’activation de la signalisation de MPL et la
croissance cellulaire autonome (sans IL-3) induite par la CALR del52. Cependant,
d’autres résidus que les tyrosines du récepteur pourraient aussi jouer un rôle dans
l’induction des voies de signalisation de MPL par la CALR mutée [12]. |
Interaction MPL-CALR mutée : un espoir thérapeutique ? Les chercheurs ont montré que l’interaction anormale CALR del52-MPL implique le
domaine lectine de la CALR mutée et la N-glycosylation de sites spécifiques de MPL.
Cependant, la présence d’un nombre minimal de charges positives dans l’extrémité
C-ter de la protéine CALR mutée est nécessaire à son activité oncogénique. Cette
activité est dépendante de la capacité de CALR del52 à activer la signalisation de
MPL, indépendamment de la TPO, faisant intervenir la Y626 de MPL. Une meilleure
caractérisation moléculaire de l’interaction entre la protéine CALR mutée et MPL
pourrait ainsi permettre le développement de thérapies ciblées. ◊ |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1. Vainchenker
W,
Kralovics
R. Genetic basis and
molecular pathophysiology of classical myeloproliferative
neoplasms . Blood.
2017; ; 129 :
:667.–79. 2. James
C,
Ugo
V, Le
Couédic
JP, et al.
A unique clonal JAK2 mutation leading to constitutive signaling
causes polycythaemia vera .
Nature.
2005; ; 434 :
:1144.–8. 3. Klampfl
T,
Gisslinger
H,
Harutyunyan
AS, et al.
Somatic mutations of calreticulin in myeloprolifertaive
neoplasms . N Engl J Med.
2013; ; 369 :
:2379.–90. 4. Nangalia
J,
Massie
CE,
Baxter
EJ, et al.
Somatic CALR mutations in myeloproliferative neoplasms with
nonmutated JAK2 . N Engl J
Med.
2013; ; 369 :
:2391.–405. 5. Pikman
Y,
Lee
BH,
Mercher
T, et al.
MPLW515L is a novel somatic activating mutation in myelofibrosis
with myeloid metaplasia . PLoS
Med.
2006; ; 3 : :e270.. 6. Marty
C,
Pecquet
C,
Nivarthi
H, et al.
Calreticulin mutants in mice induce an MPL-dependent
thrombocytosis with frequent progression to myelofibrosis .
Blood.
2016; ; 127 :
:1317.–24. 7. Chachoua
I,
Pecquet
C,
El-Khoury
M, et al.
Thrombopoietin receptor activation by myeloproliferative neoplasm
associated calreticulin mutants .
Blood.
2016; ; 127 :
:1325.–35. 8. Elf
S,
Abdelfattah
NS,
Baral
AJ, et al.
Defining the requirements for the pathogenic interaction between
mutant calreticulin and MPL in MPN .
Blood.
2018; ; 131 :
:782.–6. 9. Elf
S,
Abdelfattah
NS,
Chen
E, et al.
Mutant calreticulin requires both its mutant C-terminus and the
thrombopoietin receptor for oncogenic transformation .
Cancer Discov.
2016; A ; 6 :
:368.–81. 10. Lum
R,
Ahmad
S,
Hong
SJ, et al.
Contributions of the lectin and polypeptide binding sites of
calreticulin to its chaperone functions in vitro in cells .
J Biol Chem.
2016; ; 2
(91) : :19631.–41. 11. Morita
H,
Tahara
T,
Matsumoto
A, et al.
Functional analysis of the cytoplasmic domain of the human Mpl
receptor for tyrosine-phosphorylation of the signaling molecules,
proliferation and differentiation . FEBS
Lett.
1996; ; 395 :
:228.–34. 12. Han
L,
Schubert
C,
Köhler
J, et al.
Calreticulin-mutant proteins induce megakaryocytic signaling to
transform hematopoietic cells and undergo accelerated degradation and
Golgi-mediated secretion . J Hematol
Oncol.
2016; ; 9 : :45.. |


