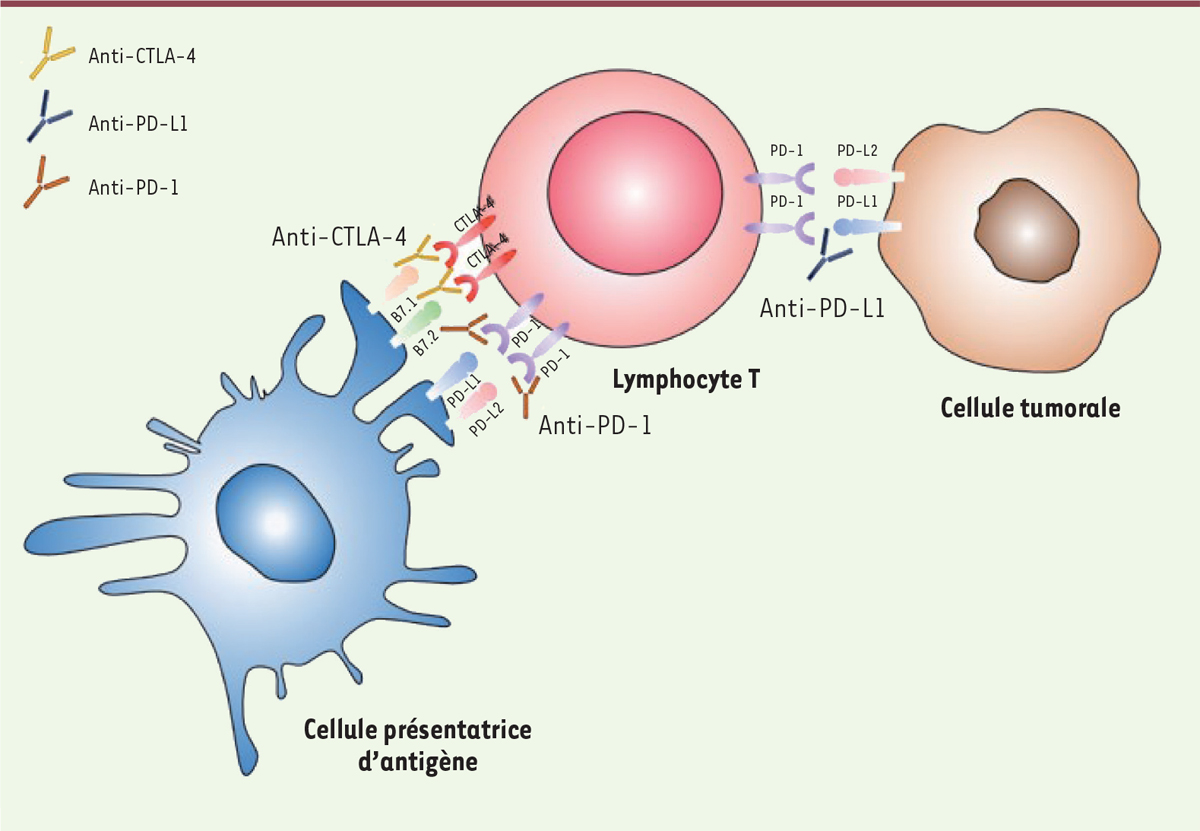
| |
| Med Sci (Paris). 35(12): 937–945. doi: 10.1051/medsci/2019225.L’immunothérapie, une révolution en
oncologie Revue de l’efficacité des inhibiteurs de points de contrôle
immunitaire Manon Dubois,1* Camille Ardin,2* Fanny André,1 Arnaud Scherpereel,2,3,4 and Laurent Mortier1,3,4a 1Service de dermatologie, CHU Lille,
Lille,
France 2Service de pneumologie et oncologie thoracique, CHU
Lille, Lille, France 3Université de Lille, Lille, France 4Unité Inserm 1189 OncoThAI, Lille, France |
Depuis une dizaine d’années, l’immunothérapie est en plein essor dans le monde de
l’oncologie, modifiant radicalement le pronostic de certains cancers et faisant
découvrir la complexité de l’immunité anti-tumorale. Il s’agit d’un changement complet
de paradigme: le traitement ne cible plus directement les cellules tumorales, mais le
système immunitaire du patient afin de restaurer une immunité anti-tumorale
efficace. L’importance de l’existence d’une immunité dans la réponse anti-tumorale est soupçonnée
depuis la fin du xixe siècle, suscitant de nombreux espoirs et enthousiasmes,
souvent suivis de désillusions. Les origines de l’immunothérapie remontent à 1893, avec
les observations de William B. Coley qui montra alors que l’injection de bactéries dans
une tumeur pouvait induire sa régression. L’explication du mécanisme d’un tel phénomène
ne fut apportée que plusieurs décennies plus tard lorsqu’il fut montré que la sécrétion
d’une cytokine, le tumor necrosis factor alpha (TNF-α) par les cellules
immunitaires était induite par les toxines bactériennes injectées et que cette molécule
pouvait provoquer des nécroses tumorales. Parallèlement, le concept de « surveillance
immunitaire » est apparu, postulant que les cellules de tumeurs débutantes étaient
reconnues comme un « non-soi » par le système immunitaire qui les élimine alors, avant
qu’elles ne se développent davantage. Cette théorie a été renforcée par les expériences
de Schreiber et al. qui ont démontré d’une part que des souris
immuno-déficientes développaient spontanément des cancers et, d’autre part, que les
tumeurs développées chez des souris immunocompétentes mettaient en place des mécanismes
d’échappement au système immunitaire. Ces expériences ont amené Schreiber à formuler la
théorie des « 3E » sur l’immunité anti-tumorale (Élimination, Équilibre, Échappement)
[1]. Il est ainsi désormais
admis que le développement d’une maladie cancéreuse est lié à une réponse insuffisante
du système immunitaire, les cellules tumorales utilisant à leur profit les voies
physiologiques d’inhibition du système immunitaire, les points de contrôle
immunitaire. Le concept de point de contrôle immunitaire est apparu dans les années 1990, avec la
découverte par James Allison du rôle inhibiteur de la réponse T anti-tumorale de CTLA-4
(cytotoxic T-lymphocyte-associated protein-4) (molécule découverte
par P. Golstein [41]), puis de
la voie PD-1/PD-L1 (programmed cell death-1 et son ligand,
programmed cell death-ligand 1) par Tasuku Honjo (Figure 1). La découverte de ces voies de
signalisation a été une révolution dans le monde de la cancérologie, saluée par la
remise du prix Nobel de Physiologie ou Médecine en 2018 à ces deux scientifiques. Des
anticorps anti-PD-1, anti-PDL-1 et anti-CTLA-4 ont ainsi été développés, faisant émerger
le concept « d’inhibiteur de points de contrôle immunitaire » (Tableau I). L’objectif de cette
approche est de lever l’inhibition du système immunitaire afin de restaurer une réponse
immunitaire efficace contre les cellules tumorales. Ces molécules sont actuellement
largement utilisées dans différentes indications (Tableau II).
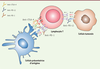 | Figure 1. Expression de CTLA-4 et de PD-1 sur les LT activés et fonctions.
L’activation lymphocytaire est suivie de l’expression de récepteurs
inhibiteurs de la réponse immunitaire, CTLA-4 et PD-1, afin d’éviter
l’emballement de cette dernière. L’expression de PD-L1 par la cellule
tumorale constitue un mécanisme d’échappement au système immunitaire. En
bloquant ces récepteurs inhibiteurs, les inhibiteurs de point de contrôle
immunitaire restaurent la réponse immunitaire. |
(→) Voir le Repères de W.H. Fridman et J.L. Teillaud, m/s n° 4,
avril 2019, page 367
Tableau I.
| Molécule |
Isotype |
Cible |
| Nivolumab (Opdivo®) |
IgG4 |
PD-1 |
|
| Pembrolizumab (Keytruda®) |
IgG4 |
PD-1 |
|
| Cémiplimab (Libtayo®) |
IgG4 |
PD-1 |
|
| Atézolizumab (Tecentriq®) |
IgG1 |
PD-L1 |
|
| Durvalumab (Imfinzi®) |
IgG1 |
PD-L1 |
|
| Avélumab (Bavencio®) |
IgG1 |
PD-L1 |
|
| Ipilimumab (Yervoy®) |
IgG1 |
CTLA-4 |
|
| Trémélimumab |
IgG2 |
CTLA-4 |
Molécules inhibitrices des points de contrôle immunitaire et
leurs cibles.
|
Tableau II.
| Nivolumab |
En monothérapie |
Mélanome non résécable ou métastatique
Mélanome de stade III ou IV après résection complète
(situation adjuvante)
Lymphome de Hodgkin classique en rechute ou réfractaire
après une greffe de cellules souches autologue et un
traitement par brentuximab védotine
CPNPC localement avancé ou métastatique après
chimiothérapie antérieure
Carcinome urothélial localement avancé non résécable ou
métastatique après chimiothérapie (sels de platine)
Cancer épidermoïde de la tête et du cou, en rechute ou
métastatique, après chimiothérapie (sels de platine)
Carcinome à cellules rénales avancé après un traitement
antérieur.
|
|
En association à : |
Ipilimumab : 1re ligne :
carcinome à cellules rénales avancé de pronostic
intermédiaire/défavorable
mélanome avancé (non résécable ou métastatique)
(actuellement non remboursé)
|
|
| Pembrolizumab |
En monothérapie |
Mélanome de stade III avec atteinte ganglionnaire, après
résection complète
Lymphome de Hodgkin classique : en rechute ou réfractaire
après échec d’une greffe de cellules souches (GCS)
autologue et d’un traitement par brentuximab védotine
(BV), ou inéligibles à une greffe et après échec d’un
traitement par BV.
Carcinome urothélial localement avancé ou métastatique
après chimiothérapie à base de sels de platine ou en
1ligne si inéligibles à une chimiothéra- pie à base de
cisplatine et si expression de PD-L1 avec un score
positif combiné (CPS)≥ 10
Carcinome épidermoïde de la tête et du cou (HNSCC)
récidivant ou métastatique; PD-L1 ≥ 50%, après
chimiothérapie (sels de platine)
CPNPC métastatique PD-L1 ≥ 50%, sans mutations tumorales
d’EGFR ou d’ALK
CPNPC localement avancé ou métastatique; PD-L1 ≥ 1%
|
|
En association à : |
Pémétrexed et sel de platine : CPNPC métastatique
non-épidermoïde sans mutations d’EGFR ou d’ALK
Carboplatine et paclitaxel / nab-paclitaxel : CPNPC
métastatique épidermoïde.
|
|
| Cémiplimab |
En monothérapie |
Carcinome épidermoïde avancé en 2° ligne ou si
contre-indication à une chimiothérapie par sel de
platine (Autorisation temporaire d’utilisation, ATU)
|
|
| Atézolizumab |
En monothérapie |
Carcinome urothélial localement avancé ou métastatique
après une chimiothérapie antérieure à base de platine,
ou si inéligibles au cisplatine et si PD-L1 tumoral ≥
5%
CPNPC localement avancé ou métastatique après une
chimiothérapie antérieure
|
|
En association à : |
Bévacizumab, paclitaxel et carboplatine : en
1re ligne si CPNPC non épidermoïde
métastatique. après échec des thérapies ciblées
appropriées si EGFR muté ou réarrangement ALK
Carboplatine, étoposide : 1re ligne si cancer
bronchique à petites cellules (CBPC) de stade étendu
Nab-paclitaxel ou au paclitaxel : cancer du sein triple
négatif métastatique ou localement avancé non résécable,
PD-L1 ≥ 1% (ATU)
|
|
| Durvalumab |
En monothérapie |
CPNPC localement avancé, non opérable; PD-L1≥ 1%, stables
après une chimio-radio-thérapie à base de platine
|
|
| Avélumab |
En monothérapie |
Carcinome à cellules de Merkel (CCM) métastatique de
l’adulte après échec ou contre-indication à la
chimiothérapie
|
|
| Ipilimumab |
En monothérapie |
Mélanome avancé non résécable ou métastatique
(actuellement non remboursé)
|
|
En association à : |
Nivolumab : mélanome avancé non résécable ou métastatique
non muté BRAF en l’absence de métastase cérébrale
|
Indications des inhibiteurs de point de contrôle immunitaire
(juillet 2019).
|
Cette revue a pour but de dresser un état des lieux des connaissances actuelles sur les
inhibiteurs de points de contrôle immunitaires, en se focalisant sur les deux tumeurs
les plus impactées par ceux-ci, le mélanome métastatique et le cancer pulmonaire (non à
petites cellules, CPNPC). |
Immunothérapie anti-tumorale en oncodermatologie Le mélanome métastatique est un cancer agressif caractérisé par sa chimiorésistance
primaire, et pour lequel peu de ressources thérapeutiques étaient disponibles
jusqu’en 2010. Les traitements reposaient sur la chimiothérapie (dacarbazine,
fotémustine) avec des résultats médiocres en termes de survie et de tolérance. De
nombreux essais ont été réalisés (42 essais entre 1977 et 2005), sans qu’aucun
d’entre eux ne montre de réel bénéfice en termes de survie. La méta-analyse de Korn et al. [2] réalisée en 2008 objectivait des progressions
très rapides de la maladie avec 86 % de progression à 6 mois, et une médiane de
survie (soit la moitié des patients encore vivants) à 6,2 mois, avec 25 % de sujets
en vie à un an. Depuis plusieurs décennies, les chercheurs se sont intéressés au
rôle de l’immunité dans le mélanome. Une première publication [3] en 1976, relevait déjà une
potentielle association entre vitiligo (une maladie de la peau caractérisée par
l’apparition de taches blanches et dépigmentées) et régression du mélanome,
suggérant un rôle des anticorps dans le contrôle anti-tumoral. Des phénomènes de
régression tumorale spontanée avaient également été décrits, renforçant l’idée que
l’immunité anti-tumorale pourrait jouer un rôle important dans le contrôle de la
maladie. Du fait de toutes ces données, de nombreuses molécules ou cellules liées au système
immunitaire ont été testées pour combattre le mélanome (injections d’interféron
alpha, d’interleukine-2, de cellules dendritiques), sans jamais prouver leur
efficacité. Seul l’interféron alpha, bénéficiant toujours d’une indication dans le
traitement adjuvant du mélanome, a conduit à une augmentation de survie sans
récidive, sans pour autant augmenter la survie globale. |
L’ipilimumab, première immunothérapie augmentant la survie dans le mélanome
métastatique La première molécule proposée a été l’ipilimumab (un anticorps anti-CTLA-4), qui a
obtenu l’autorisation de mise sur le marché (AMM) en France en 2011 en deuxième
ligne dans le traitement du mélanome avancé (non résécable ou métastatique), puis en
première ligne, en 2014. L’étude ayant prouvé son efficacité [4] évaluait l’ipilimumab en association à la
dacarbazine, en comparaison à la dacarbazine seule (chimiothérapie de référence):
une augmentation de la médiane de survie de 9 à 11 mois et une survie à 3 ans de
l’ordre de 20 % contre 12 % sous dacarbazine seule ont été alors montrées. Il
s’agissait du tout premier essai ayant prouvé une amélioration de la survie des
patients dans le mélanome métastatique. Le suivi de cette cohorte de patients a permis de montrer que la survie des patients
répondeurs à l’ipilimumab était prolongée, avec l’obtention d’un plateau à partir de
3 ans et une survie de 18,2 % des patients sous ipilimumab contre 8 % sous
dacarbazine à 5 ans [5].
L’ipilimumab a donc constitué une première révolution dans le traitement du
mélanome, susceptible d’augmenter significativement la survie des malades.
Cependant, très rapidement, les anticorps anti PD-1 (nivolumab et pembrolizumab) ont
détrôné l’ipilimumab qui n’est actuellement plus remboursé en monothérapie depuis
2017. |
Les anti-PD-1, une efficacité anti-tumorale nettement augmentée Deux études de phase III ont été menées simultanément: l’étude CheckMate-066 [6] a comparé le nivolumab en
première ligne de traitement dans le mélanome métastatique sans mutation du gène
BRAF à la dacarbazine. Une augmentation de la survie à 1 an des
patients traités par nivolumab (72,9 % de survie à 1 an sous nivolumab contre 42,1 %
sous dacarbazine) a ainsi été montrée, avec une médiane de survie sans progression
augmentée (de 2,2 mois à 5,5 mois) et un net gain du taux de réponse objective (40 %
contre 13,9 % sous dacarbazine). L’essai Keynote-006 [7] a évalué le pembrolizumab en comparaison à
l’ipilimumab. Il a montré un taux de réponse objective nettement augmenté (de 11 % à
32 %), un gain de survie à 1 an (58 % à 68 %) [8] ainsi qu’une survie clairement augmentée à 3
ans, passant de 39 % sous ipilimumab à 50 % sous pembrolizumab. |
La combinaison anti-CTLA-4 et anti-PD-1: une efficacité augmentée au prix
d’effets indésirables auto-immuns sévères La combinaison de deux inhibiteurs de points de contrôles immunitaires, un
anti-CTLA-4 et un anti-PD-1 a par la suite été testée dans l’essai CheckMate-067
[9]. Un gain en termes de
survie a été observé avec une médiane de survie non atteinte après 4 ans de suivi
(plus de la moitié des patients étaient encore en vie à 4 ans) pour les patients
traités par l’association ipilimumab et nivolumab, de 36 mois par nivolumab et de 19
mois avec l’ipilimumab. Le risque de récidive a été réduit de 58 % avec la
combinaison des deux immunothérapies en comparaison à l’ipilimumab seul, et le
risque de décès de 46 %. Les analyses statistiques n’ont malheureusement pas comparé
l’association des deux immunothérapies au nivolumab seul. On observe donc une nette
efficacité ; cependant, cette association est moins bien tolérée. On note en effet
59 % d’effets indésirables de grade 3-4 (diarrhées, colites, cytolyse hépatique)
contre 22 % sous nivolumab et 28 % sous ipilimumab seuls. |
Place de l’immunothérapie dans le traitement adjuvant L’immunothérapie est donc une arme de choix dans la lutte contre le mélanome
métastatique. Il s’agit d’un traitement souvent bien toléré permettant d’imaginer
une utilisation en stratégie adjuvante, c’est-à-dire chez des patients ayant un
mélanome non métastatique dont la tumeur ou les métastases ont été totalement
réséquées. L’essai Keynote-054 [10] a ainsi évalué le pembrolizumab en traitement adjuvant dans les
mélanomes de stade III totalement réséqués. Cet essai a montré un gain de survie
sans récidive à un an passant de 61 à 75 %, une réduction du risque de récidive de
46 %, avec peu d’effets indésirables. Une autre étude (CheckMate-238) [11] a montré la supériorité
du nivolumab face à l’ipilimumab dans cette stratégie adjuvante, avec des survies
sans progression augmentant de 60 à 70 % à un an, une réduction du risque de
récidive de 35 %, et avec une meilleure tolérance du nivolumab. Au stade avancé du mélanome, la chirurgie reste parfois une bonne option. Elle est
néanmoins souvent complexe, en raison de l’extension de la tumeur. L’utilisation des
inhibiteurs de points de contrôle immunitaire en situation néoadjuvante, visant à
faire diminuer le volume tumoral avant l’exérèse, est à l’étude chez les patients
atteints d’un mélanome de stade III (métastases ganglionnaires uniquement) [12]. Des résultats
intermédiaires, qui semblent prometteurs, ont été publiés sur un petit échantillon
de patients. La combinaison ipilimumab + nivolumab a conduit à un taux de réponse
objective de 73 % dont 45 % de réponse complète, contre 25 % sous nivolumab seul
avec 25 % de réponse complète. L’association semble donc efficace, mais au prix
d’une toxicité importante (73 % de toxicités de grade 3). |
Immunothérapie anti-tumorale en oncologie thoracique Avec près de 50 000 nouveaux cas par an en France, le cancer du poumon est le
2e cancer le plus fréquent (tous sexes confondus), et le plus
péjoratif, avec près de 31 000 décès en 2017 en France. Ce mauvais pronostic est
principalement lié à un diagnostic à un stade d’extension localement avancé ou
métastatique, ne permettant pas généralement un traitement à visée curative.
L’appellation générale de « cancer pulmonaire » recouvre des pathologies variées
dont la prise en charge et le pronostic sont différents. Le type le plus fréquent
(plus de 80 % des cas) est celui des carcinomes pulmonaires non à petites cellules
(CPNPC) où l’on distingue principalement deux sous types histologiques: les CPNPC
épidermoïdes et les CPNPC non-épidermoïdes, ces derniers étant majoritaires (2/3 des
CPNPC). De longue date et jusqu’à très récemment, le traitement standard de ces patients
porteurs d’un CPNPC localement avancé ou métastatique, reposait sur une
chimiothérapie combinant un sel de platine et un agent cytotoxique de 3e
génération (pémétrexed, docétaxel, etc.), associée, dans certains cas pour les
carcinomes non-épidermoïdes, à des anticorps anti-VEGF (vascular endothelial
growth factor ; bévacizumab) [13]. L’efficacité de ce traitement reste modeste, avec une
survie globale médiane de 12 à 18 mois pour les patients porteurs d’un CPNPC
métastatique. Une grande avancée a eu lieu dans les années 2000, avec la mise en évidence
d’altérations génétiques au sein des cellules tumorales, dont certaines sont
directement responsables de la croissance tumorale à travers la formation de
protéines anormales: on parle alors d’addiction oncogénique. Cependant, bien que de
nombreuses altérations moléculaires soient désormais connues, des traitements
spécifiques (thérapies ciblées) ne sont disponibles que pour quelques-unes d’entre
elles. Si ces traitements sont efficaces, ils ne concernent finalement qu’un nombre
restreint de patients (environ 15 %) [14]. En revanche, le développement des inhibiteurs des points de contrôle immunitaires
concerne la majorité des patients porteurs d’un CPNPC, et a permis d’élargir les
options thérapeutiques et d’espérer des survies prolongées. |
CPNPC métastatiques: l’immunothérapie en monothérapie Depuis 2015, le nivolumab, un anticorps anti-PD-1, est autorisé après échec d’un
traitement de première ligne [15] pour le traitement des patients atteints d’un CPNPC, épidermoïde ou
non épidermoïde, de stade métastatique, quel que soit le taux d’expression tumorale
de PD-L1 [16,17]. En effet, face au
docétaxel, chimiothérapie standard dans cette indication pour ces deux sous classes
de CPNPC, le taux de réponse au traitement plus élevé sous nivolumab (de l’ordre de
20 %, contre 10 % environ pour la chimiothérapie seule). La survie globale médiane a
été allongée de 3 mois chez les patients traités par nivolumab par rapport à ceux
ayant été traités par chimiothérapie. Ce bénéfice existait pour tous les patients
quel que soit le taux d’expression tumorale de PD-L1, mais il était encore plus
marqué chez les patients porteurs d’un CPNPC non épidermoïde, avec un haut niveau
d’expression tumorale de PD-L1 (expression supérieure à 10 %), avec une survie
globale médiane de 19,9 mois, soit le double par rapport à celle obtenue avec le
docétaxel, et un risque de décès réduit de 60 % [17]. Le suivi à long terme permet de montrer que 15 % des patients
traités par nivolumab sont vivants à 4 ans de traitement, contre seulement 5 % des
patients traités par docétaxel [17]. L’atézolizumab, un anticorps anti-PD-L1, est également autorisé en France en deuxième
ligne (ou plus) de traitement chez les patients porteurs d’un CPNPC épidermoïde et
non-épidermoïde, quel que soit le niveau d’expression de PD-L1, selon les données de
l’étude OAK [18]. Ces
données montrent que la survie globale médiane est plus élevée chez les patients
traités par l’atézolizumab (15,7 mois) que chez ceux traités par chimiothérapie
standard (10,3 mois). Si le taux de réponse est similaire dans chaque groupe (de
l’ordre de 15 %), la durée médiane de réponse au traitement s’est révélée être plus
longue sous atézolizumab (16,3 mois) que sous chimiothérapie standard (6,2
mois). Un autre anticorps spécifique de PD-1, le pembrolizumab, est également autorisé en
monothérapie, après échec d’au moins une ligne de chimiothérapie à base de sels de
platine, chez les patients porteurs d’un CPNPC localement avancé ou métastatique, si
le niveau d’expression de PD-L1 par les cellules tumorales est supérieur ou égal à 1
%. En effet, l’étude Keynote-010 [19] comparant le pembrolizumab au docétaxel a montré un bénéfice
significatif sur la survie globale du traitement par pembrolizumab: la survie
globale médiane est allongée d’environ 2 mois dans le groupe traité par cet
anticorps par rapport à celui traité par docétaxel (10,4 mois contre 8,5 mois). Une
fois encore, ce bénéfice s’est avéré être plus marqué pour les patients dont les
cellules tumorales expriment fortement PD-L1 (exprimé par plus de 50 % des
cellules), avec une survie globale nettement allongée dans le groupe traité par
pembrolizumab par rapport au docétaxel: 14,9 mois contre 8,2 mois. Le pembrolizumab en monothérapie a également été autorisé dès la première ligne
[20] chez les patients
atteints d’un CPNPC métastatique, quel que soit le type histologique, non éligibles
à un traitement par thérapie ciblée, à la condition que 50 % ou plus des cellules
tumorales expriment le marqueur PD-L1, ce qui représente environ 25 à 30 % des
patients. Dans cette population de patients (données de l’essai Keynote-024), le
pembrolizumab a montré un gain impressionnant de survie globale (30 mois contre 14
mois dans le bras contrôle « chimiothérapie standard à base de sels de platine »),
avec des réponses prolongées au pembrolizumab chez environ 30 % des patients. De
plus, le taux de réponse était plus élevé dans le bras pembrolizumab par rapport au
bras chimiothérapie (45 % vs 28 %) [21]. L’essai Keynote-042 a comparé le pembrolizumab à la chimiothérapie classique chez des
patients dont le taux d’expression tumorale de PD-L1 était plus faible (supérieur ou
égal à 1 %). Chez les patients exprimant fortement PD-L1 (plus de 50 %) sur leur
tumeur, les résultats se sont révélés concordants avec ceux de l’étude Keynote-024.
En revanche, chez des patients présentant un taux d’expression tumorale de PD-L1
compris entre 1 % et 50 %, aucun bénéfice en termes de survie globale (13,4
vs 12,1 mois) ou de survie sans progression médiane n’a été
observé [22]. L’analyse des
courbes de survie des patients des deux bras de l’étude, pour chaque seuil
d’expression de PD-L1, suggère même que l’utilisation de l’immunothérapie en
monothérapie en première ligne pourrait être délétère chez certains patients
(correspondant à une « hyperprogression », soit une croissance tumorale anormalement
rapide sous traitement). Si l’intérêt d’une monothérapie par pembrolizumab a été
démontré pour les patients porteurs d’un CPNPC métastatique exprimant PD-L1 à au
moins 50 %, ce traitement reste discutable pour les patients présentant une
expression tumorale de PD-L1 entre 1 et 50 %. Le seuil minimal d’expression de
PD-L1, actuellement fixé à 50 %, a été discuté dans de petites séries rétrospectives
« en vraie vie » [23]: dans
cette étude, pour un seuil d’expression tumorale de PD-L1 fixé à 75 %, puis à 90 %,
le taux de réponse au traitement par pembrolizumab et la survie globale apparaissent
meilleurs que pour les patients dont le taux d’expression tumorale de PD-L1 était
inférieur à ces seuils. La population susceptible de tirer le meilleur bénéfice du
traitement n’est donc pas encore clairement définie. Actuellement, pour les patients
présentant un seuil d’expression tumorale de PD-L1 entre 1 et 50 %, les options
thérapeutiques s’orientent plutôt vers des associations
immunothérapie/chimiothérapie |
CPNPC métastatiques: association à la chimiothérapie L’intérêt d’une association entre inhibiteurs de point de contrôle immunitaire et
chimiothérapie repose sur la capacité de certains agents cytotoxiques à engendrer ou
à faciliter une réponse immunitaire en déclenchant une mort cellulaire immunogène.
Ce type d’association permettrait d’améliorer le taux de réponse par rapport à des
traitements séparés, et de limiter le risque d’échec thérapeutique sous
immunothérapie, en particulier de limiter le phénomène d’hyperprogression, qui a été
rapporté chez quelques patients traités par ces inhibiteurs. La combinaison pembrolizumab-chimiothérapie standard adaptée à chaque sous-type
histologique dispose d’une AMM depuis septembre 2018, en première ligne dans le
traitement de CPNPC métastatique épidermoïde (essai Keynote-407 [24]) et non-épidermoïde (essai
Keynote-189 [25]), quel que
soit le taux d’expression tumorale de PD-L1. Ces études ont en effet mis en évidence
des taux de réponse au traitement significativement plus élevés dans les groupes
traités par pembrolizumab-chimiothérapie standard par rapport aux groupes
chimiothérapie seule. Les données de survie sont, dans chaque étude, en faveur du
bras pembrolizumab-chimiothérapie: le risque de décès est réduit de 35 à 50 % selon
le sous-type observé, et la survie globale est significativement allongée. Chez les patients avec un CPNPC métastatique et une expression de PD-L1 faible, nulle
ou inconnue, l’association chimiothérapie-immunothérapie semble donc s’imposer comme
le traitement standard de première ligne. L’atézolizumab, est également à l’essai en première ligne en association à une
chimiothérapie standard adaptée au type histologique concerné: essai IMpower131 pour
les CPNPC épidermoides [26]
et essai IMpower132 pour les CPNPC non épidermoïdes [27]. Dans chaque étude, un bénéfice de survie
sans progression modeste mais significatif a été observé pour l’association
atézolizumab-chimiothérapie par rapport à la chimiothérapie seule (gain de l’ordre
de 1 à 2 mois selon le sous-type considéré) sans, pour l’instant, de bénéfice
significatif en survie globale. L’association atézolizumab-bévacizumab-chimiothérapie est indiquée depuis février
2019 [28] en première ligne
pour le traitement pour les patients porteurs d’un CPNPC non épidermoïde, et pour
les patients porteurs d’une addiction oncogénique, après échec des thérapies
ciblées, selon les données de l’essai IMpower150 [29]. Cette étude a testé, comme biomarqueur
prédictif de la réponse à l’immunothérapie, non pas le taux d’expression tumorale de
PD-L1 seul, mais un critère composite: la signature génique de l’activation
lymphocytaire (T effecteur, Teff) composée du taux d’expression
d’ARN messager de trois gènes codants: PD-L1, CXCL9 (une chimiokine induisant la
synthèse d’interféron gamma [IFN-g]) et l’IFN-g, une cytokine immunostimulante
[30,31]. Cette signature permettrait
d’évaluer l’expression de PD-L1 et le type d’immunité présente dans le
microenvironnement tumoral avant le traitement. Les résultats ont montré un bénéfice sur la survie globale pour le groupe
atézolizumab-bévacizumab-chimiothérapie standard par rapport au groupe
bévacizumab-chimiothérapie standard pour tous les patients, quel que soit le score
immunologique « Teff », le taux d’expression de PD-L1, et la présence ou non d’une
addiction oncogénique [30]. De plus, chez tous les patients inclus, hormis ceux présentant une addiction
oncogénique, la médiane de survie sans progression était meilleure avec
l’association atézolizumab-bévacizumab-chimiothérapie (groupe ABCP) par rapport à
l’association bévacizumab-chimiothérapie (groupe BCP), le risque de progression de
la maladie tumorale sous traitement étant réduit de 40 %. Cette supériorité est
encore plus marquée chez les patients ayant une signature génique de l’activation
lymphocytaire élevée. En revanche, chez les patients présentant une signature
d’activation lymphocytaire faible, aucun bénéfice sur la survie sans progression
n’est apporté par l’ajout de l’atézolizumab à l’association
bévacizumab-chimiothérapie. |
CPNPC métastatiques: associations d’inhibiteurs de points de contrôle
immunitaires L’intérêt d’une association d’un anticorps anti-CTLA-4 à un anticorps anti-PD-1 ou
anti-PD-L1 semble pertinente, en inhibant les deux principaux points de contrôle
immunitaire. Ainsi, l’essai CheckMate 227 a évalué l’intérêt d’une association
ipilimumab-nivolumab, versus une chimiothérapie standard ±
nivolumab, en première ligne, chez des patients atteints d’un CPNPC et distingués
selon les sous-types histologiques de CPNPC, le taux d’expression de PD-L1 et la
charge mutationnelle1, testée comme biomarqueur
prédictif de réponse au traitement [32]. Cette étude est toujours en cours, mais les premiers
résultats montrent une médiane de survie sans progression plus longue dans le bras
ipilimumab-nivolumab par rapport au bras chimiothérapie standard, avec un taux de
réponse supérieur (45 % contre 27 %) chez les patients avec une charge mutationnelle
tumorale élevée (plus de 10 mutations par mégabase) [32]. |
CPNPC localement avancés: traitements en situation adjuvante Depuis juillet 2018, le durvalumab a une AMM pour un traitement de consolidation
durant un an, après chimio-radiothérapie concomitante dans les stades localement
avancés inopérables [33,34]. De
nombreux autres essais sont en cours, pour évaluer les inhibiteurs de points de
contrôle immunitaire en situation adjuvante. |
Autres types de cancers thoraciques Pour les autres types de cancers thoraciques, les inhibiteurs de points de contrôle
immunitaire semblent pouvoir influencer le pronostic globalement sombre des patients
de manière variable. Dans le cancer pulmonaire à petites cellules (CPC), une étude de phase III [35] a montré une supériorité
de l’association atézolizumab-chimiothérapie (carboplatine et étoposide) face à la
chimiothérapie seule, dès la première ligne de traitement: le gain de survie globale
médiane était d’environ 2 mois. Cependant, le taux de réponse au traitement et la
durée médiane de réponse étaient similaires dans les deux groupes. Dans le mésothéliome pleural malin (MPM), les options en seconde ligne et au-delà,
très limitées en l’absence de standard thérapeutique, bénéficient aussi d’une
révolution grâce aux inhibiteurs de point de contrôle immunitaire, notamment les
anticorps anti-PD-1 en monothérapie (pembrolizumab, nivolumab) seuls ou en
association avec les anticorps anti-CTLA-4 (nivolumab-ipilimumab) [36,37]. Ces nouvelles options ont été validées aux
États-Unis par les recommandations du National comprehensive cancer
network (NCCN) et par une AMM au Japon pour le nivolumab [38,39], mais sont en attente d’une AMM en France
pour cette indication. Les inhibiteurs de points de contrôle immunitaires sont aussi
en cours d’évaluation en première ligne de traitement du MPM inopérable: seuls
(nivolumab-ipilimumab) dans l’essai CA209-743, ou en association avec la
chimiothérapie standard par platine et pémétrexed (pembrolizumab dans l’essai
IND227-IFCT ou durvalumab dans l’essai DREAM) [40]. |
L’utilisation des inhibiteurs de points de contrôle immunitaire a révolutionné la
prise en charge et le pronostic des patients atteints de mélanome ou de CPNPC
métastatiques. Les indications de ces molécules tendent aujourd’hui à s’étendre,
notamment dans les carcinomes mammaires triples négatifs et certains cancers
digestifs. D’autres cibles sont à l’étude, comme la protéine LAG-3, elle aussi
inhibitrice de la réponse immunitaire, et de nouvelles stratégies de combinaison se
développent, notamment avec les thérapies ciblées, d’autres immunothérapies
(thérapies cellulaires, etc.), ou en combinaison à la radiothérapie, afin d’obtenir
un potentiel effet à distance de l’irradiation, dit « effet abscopal ». Ces
associations pourraient cependant majorer le risque de toxicités potentielles, déjà
observables sous immunothérapie, et justifiant l’organisation d’équipes expertes
pluridisciplinaires pour leur prise en charge. De nombreuses questions restent en
suspens, concernant l’optimisation des séquences thérapeutiques, la durée optimale
de traitement ou encore la validation de marqueurs prédictifs de réponse au
traitement. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
|
Adjuvant
|
la stratégie de traitement adjuvant consiste à administrer un
traitement anti-néoplasique alors que l’ensemble de la tumeur a été
retirée (chirurgicalement, ou par radiothérapie) et que celle-là
n’est plus détectable. En effet, malgré une chirurgie complète,
certaines cellules peuvent avoir échappé au traitement et ne sont
malgré tout pas visibles lors des examens de bilans biologiques ou
radiologiques. Ce traitement vise à détruire ces cellules et à
prévenir la survenue de récidive. |
|
Grades des effets indésirables
|
cotation selon le CTCAE (common terminology criteria for
adverse event) permettant de préciser l’importance des
toxicités en 5 grades: 1 (légère, n’affectant pas l’activité
quotidienne), 2 (modérée, perturbant les activités quotidiennes), 3
(sévère, empêchant les activités quotidiennes), 4 (très sévère,
menaçant le pronostic vital), 5 (décès). |
|
Hyperprogression
|
taux de croissance tumorale 2 fois supérieur à celui avant
immunothérapie. |
|
Médiane de survie
|
période de temps suivant le diagnostic ou le traitement au bout de
laquelle la moitié des individus sont décédés, l’autre moitié étant
encore vivante. Par exemple, lorsqu’on parle d’une survie médiane de
12 mois, 50 % des personnes malades seront encore en vie à 12 mois
du diagnostic ou du traitement de la maladie. |
|
Médiane de survie sans progression
|
période de temps suivant le diagnostic ou le traitement au bout de
laquelle la moitié des individus ont présenté une progression de la
maladie, l’autre moitié étant encore contrôlée sous traitement. |
|
Néo-adjuvant
|
la stratégie de traitement néo-adjuvant consiste à administrer un
traitement anti-néoplasique avant une chirurgie ou une
radiothérapie. Le but est de réduire la masse tumorale, afin de
proposer une chirurgie moins lourde, ou d’augmenter l’efficacité
d’une radiothérapie. |
|
Réponse complète
|
disparition complète de la tumeur sous traitement: les analyses
biologiques et l’imagerie ne détectent plus de tumeur. |
|
Réponse partielle
|
diminution de la tumeur de plus de 30 %, mais celle-là encore
détectable. |
|
Survie sans récidive/sans progression
|
période de temps entre le début du traitement et la récidive ou le
début de progression de la maladie. |
|
Survie globale
|
période de temps entre l’entrée du patient dans l’étude jusqu’au
décès. |
|
Taux de réponse objective
|
pourcentage des patients présentant une réponse objective de la
tumeur, qu’elle soit partielle (diminution de la taille tumorale) ou
complète (disparition de la tumeur). |
|
Footnotes |
1. Fridman
WH. Historique de
l’immunothérapie. Changement de paradigme ?
Bull Cancer (Paris).
2016;; 103:
:S122.–6. 2. Korn
EL,
Liu
PY,
Lee
SJ, et al.
Meta-analysis of phase II cooperative group trials in metastatic
stage IV melanoma to determine progression-free and overall survival
benchmarks for future phase II trials . J
Clin Oncol.
2008; ; 26:
:527.–534. 3. Gregor
RT. Vitiligo and
malignant melanoma: a significant association? .
South Afr Med J.
1976; ; 50:
:1447.–1449. 4. Robert
C,
Thomas
L,
Bondarenko
I, et al.
Ipilimumab plus dacarbazine for previously untreated metastatic
melanoma . N Engl J Med.
2011; ; 364:
:2517.–2526. 5. Maio
M,
Grob
J-J,
Aamdal
S, et al.
Five-year survival rates for treatment-naive patients with
advanced melanoma who received ipilimumab plus dacarbazine in a phase III
trial . J Clin Oncol.
2015; ; 33:
:1191.–1196. 6. Robert
C,
Long
GV,
Brady
B, et al.
Nivolumab in previously untreated melanoma without BRAF
mutation . N Engl J Med.
2015; ; 372:
:320.–330. 7. Robert
C,
Schachter
J,
Long
GV, et al.
Pembrolizumab versus ipilimumab in advanced
melanoma . N Engl J Med.
2015; ; 372:
:2521.–2532. 8. Schachter
J,
Ribas
A,
Long
GV, et al.
Pembrolizumab versus ipilimumab for advanced melanoma: final
overall survival results of a multicentre, randomised, open-label phase 3
study (Keynote-006) .
Lancet.
2017; ; 390:
:1853.–1862. 9. Hodi
FS,
Chiarion-Sileni
V,
Gonzalez
R, et al.
Nivolumab plus ipilimumab or nivolumab alone versus ipilimumab
alone in advanced melanoma (CheckMate 067): 4-year outcomes of a
multicentre, randomised, phase 3 trial .
Lancet Oncol.
2018; ; 19:
:1480.–1492. 10. Eggermont
AMM,
Blank
CU,
Mandala
M, et al.
Adjuvant Pembrolizumab versus placebo in resected stage III
melanoma . N Engl J Med.
2018; ; 378:
:1789.–1801. 11. Weber
J,
Mandala
M, Del
Vecchio
M, et al.
Adjuvant Nivolumab versus ipilimumab in resected stage III or IV
melanoma . N Engl J Med.
2017; ; 377:
:1824.–1835. 12. Amaria
RN,
Reddy
SM,
Tawbi
HA, et al.
Publisher correction: neoadjuvant immune checkpoint blockade in
high-risk resectable melanoma . Nat
Med.
2018; ; 24: :1942.. 13. Ettinger
DS,
Wood
DE,
Akerley
W, et al.
NCCN guidelines insights: non–small cell lung cancer, version
4.2016 . J Natl Compr Canc
Netw.
2016; ; 14:
:255.–264. 14. Duruisseaux
M,
Berghmans
T. Évolution et
révolution dans la prise en charge systémique des cancers du poumon. La
nouvelle place des immunothérapies . Rev Mal
Respir.
2018; ; 35:
:101.–102. 15. OPDIVO: indications en
France en août 2019 .
Paris: : ANSM; ,
2019. 16. Brahmer
J,
Reckamp
KL,
Baas
P, et al.
Nivolumab versus docetaxel in advanced squamous-cell
non-small-cell lung cancer . N Engl J
Med.
2015; ; 373:
:123.–135. 17. Borghaei
H,
Paz-Ares
L,
Horn
L, et al.
Nivolumab versus docetaxel in advanced nonsquamous non-small-cell
lung cancer . N Engl J Med.
2015; ; 373:
:1627.–1639. 18. Rittmeyer
A,
Barlesi
F,
Waterkamp
D, et al.
Atezolizumab versus docetaxel in patients with previously treated
non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre
randomised controlled trial .
Lancet.
2017; ; 389:
:255.–265. 19. Herbst
RS,
Baas
P,
Kim
D-W, et al.
Pembrolizumab versus docetaxel for previously treated,
PD-L1-positive, advanced non-small-cell lung cancer (Keynote-010): a
randomised controlled trial .
Lancet.
2016; ; 387:
:1540.–1550. 20. KEYTRUDA: indications en
France en juin 2019 .
Paris: : ANSM; ,
2019. 21. Reck
M,
Rodríguez-Abreu
D,
Robinson
AG, et al.
Pembrolizumab versus chemotherapy for PD-L1–positive
non–small-cell lung cancer . N Engl J
Med.
2016; ; 375:
:1823.–1833. 22. Lopes
G,
Wu
Y-L,
Kudaba
I, et al.
Pembrolizumab (pembro) versus platinum-based chemotherapy (chemo)
as first-line therapy for advanced/metastatic NSCLC with a PD-L1 tumor
proportion score (TPS) ≥ 1%: Open-label, phase 3 Keynote-042
study . J Clin Oncol.
2018;; 36: :LBA4.. 23. Jimenez
Alguilar
E,
Gainor
J,
Kravets
S, et al.
MA04.05 outcomes in NSCLC patients treated with first-line
pembrolizumab and a PD-L1 TPS of 50–74% vs 75–100% or 50–89% vs
90–100% . J Thorac Oncol.
2018;; 13:
:S367.–8. 24. Paz-Ares
L,
Luft
A,
Vicente
D, et al.
Pembrolizumab plus chemotherapy for squamous non–small-cell lung
cancer . N Engl J Med.
2018; ; 379:
:2040.–2051. 25. Gandhi
L,
Rodríguez-Abreu
D,
Gadgeel
S, et al.
Pembrolizumab plus chemotherapy in metastatic non–small-cell lung
cancer . N Engl J Med.
2018; ; 378:
:2078.–2092. 26. Jotte
RM,
Cappuzzo
F,
Vynnychenko
I, et al.
IMpower131: Primary PFS and safety analysis of a randomized phase
III study of atezolizumab + carboplatin + paclitaxel or nab-paclitaxel vs
carboplatin + nab-paclitaxel as 1L therapy in advanced squamous
NSCLC . J Clin Oncol.
2018;; 36: :LBA9000.. 27. WCLC 2018 .
IMpower132: Atezolizumab plus carboplatin and pemetrexed
in stage IV nonsquamous NSCLC . The
ASCO Post; , 2019. 28. TECENTRIQ: indications en
Europe en août 2019 .
Amsterdam: : European Medicines
Agency; , 2019. 29. Ryu
R,
Ward
KE. Atezolizumab for
the first-line treatment of non-small cell lung cancer (NSCLC): current
status and future prospects . Front
Oncol.
2018;; 8. 30. Socinski
MA,
Jotte
RM,
Cappuzzo
F, et al.
Overall survival (OS) analysis of IMpower150, a randomized Ph 3
study of atezolizumab (atezo) + chemotherapy (chemo) ± bevacizumab (bev) vs
chemo + bev in 1L nonsquamous (NSQ) NSCLC . J
Clin Oncol.
2018; ; 36: :9002.. 31. Socinski
MA,
Jotte
RM,
Cappuzzo
F, et al.
Atezolizumab for first-line treatment of metastatic nonsquamous
NSCLC . N Engl J Med.
2018; ; 378:
:2288.–2301. 32. Hellmann
MD,
Ciuleanu
T-E,
Pluzanski
A, et al.
Nivolumab plus ipilimumab in lung cancer with a high tumor
mutational burden . N Engl J
Med.
2018; ; 378:
:2093.–2104. 33. IMFIZI: indications en
Europe en août 2019 .
Amsterdam: : European Medicines
Agency; , 2018. 34. Antonia
SJ,
Villegas
A,
Daniel
D, et al.
Overall survival with durvalumab after chemoradiotherapy in stage
III NSCLC . N Engl J Med.
2018; ; 379:
:2342.–2350. 35. Horn
L,
Mansfield
AS,
Szcze˛sna
A, et al.
First-line Atezolizumab plus chemotherapy in extensive-stage
small-cell lung cancer . N Engl J
Med.
2018; ; 379:
:2220.–2229. 36. Alley
EW,
Katz
SI,
Cengel
KA, et al.
Immunotherapy and radiation therapy for malignant pleural
mesothelioma . Transl Lung Cancer
Res.
2017; ; 6:
:212.–219. 37. Scherpereel
A,
Mazieres
J,
Greillier
L, et al.
Nivolumab or nivolumab plus ipilimumab in patients with relapsed
malignant pleural mesothelioma (IFCT-1501 MAPS2): a multicentre, open-label,
randomised, non-comparative, phase 2 trial .
Lancet Oncol.
2019; ; 20:
:239.–253. 38. Forde
PM,
Scherpereel
A,
Tsao
AS. Use of Immune
Checkpoint Inhibitors in Mesothelioma . Curr
Treat Options Oncol.
2019; ; 20: :18.. 39. Ettinger
DS,
Aisner
DL,
Wood
DE, et al.
NCCN guidelines insights: non-small cell lung cancer, version
5.2018 . J Natl Compr Canc
Netw.
2018; ; 16:
:807.–821. 40. Scherpereel
A,
Wallyn
F,
Albelda
SM, et al.
Novel therapies for malignant pleural
mesothelioma . Lancet Oncol.
2018; ; 19:
:e161.–e172. 41. Fridman
WH,
Teillaud
JL. De la traversée
du désert au prix Nobel de Physiologie ou Médecine décerné à James Allison
et Tasuku Honjo: la longue marche de l’immunothérapie des cancers -
Entretien avec Wolf Hervé Fridman . Med Sci
(Paris).
2019; ; 35:
:367.–373. |