| |
| Med Sci (Paris). 35(12): 957–965. doi: 10.1051/medsci/2019192.La biologie des cibles PD-1 et CTLA-4 et la question
des biomarqueurs Marie-Caroline Dieu-Nosjean1* and Christophe Caux2** 1Sorbonne Université UMRS1135, Inserm U1135, Centre
d’Immunologie et des Maladies Infectieuses (Cimi-Paris), Faculté de Médecine
Sorbonne Université, Paris, France 2UMR Inserm 1052, Centre de Recherche en Cancérologie de Lyon
(CRCL), Lyon, France |
CD28,1CTLA-4 (cytolytic
T-lymphocyte-associated protein 4) et PD-1 (programmed cell death
1) sont trois récepteurs ayant des implications majeures dans le contrôle
de la balance activation/inhibition de la réponse immunitaire, en particulier dans le
contrôle de l’activation des lymphocytes T (LT). Nous discuterons ici de la fonction
biologique de ces molécules finement régulées et de la puissance de celles-ci comme
biomarqueurs chez les patients cancéreux. |
De la biologie de la cellule à la biologie des cibles Un des enjeux majeurs des stratégies ciblant les points de contrôle immunitaire (en
anglais immune checkpoint, ou ICP) est de restaurer les fonctions
cytotoxiques des cellules effectrices, fonctions intimement liées à leur état
d’activation. Alors que de nombreuses cellules de l’immunité adaptative et innée
participent au développement des réponses anti-tumorales, un grand intérêt est
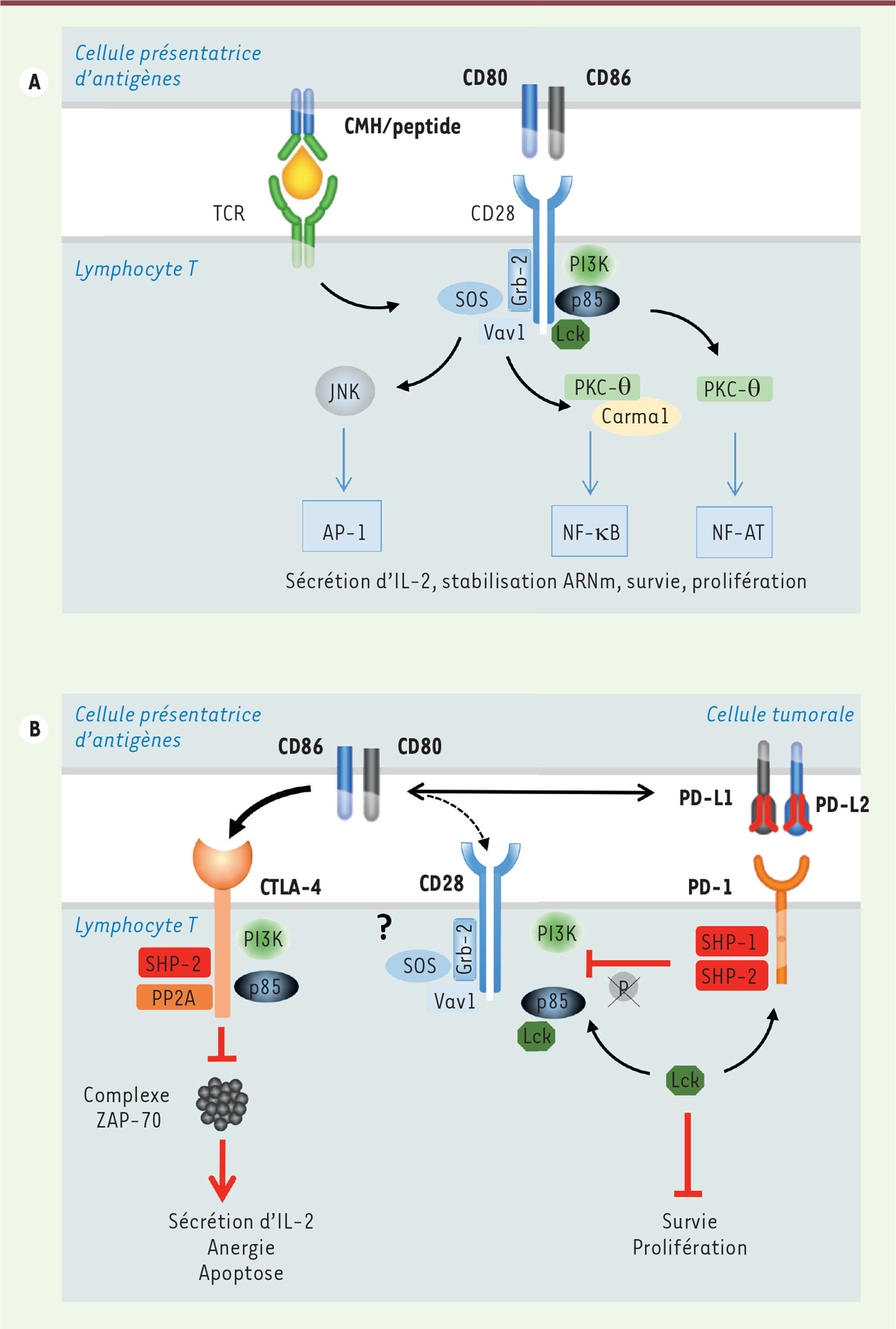
actuellement porté à l’activité cytolytique des LT CD8+. Les mécanismes de contrôle de l’activation du lymphocyte T L’axe TCR/complexe CMH-peptide L’activation complète du LT implique en premier lieu la reconnaissance par
son TCR ( T-cell receptor) du complexe constitué d’une
molécule du complexe majeur d’histocompatibilité (CMH) de classe I ou II et
d’un peptide antigénique, présenté par les cellules présentatrices
d’antigènes (CPA). Les molécules « accessoires », CD28, à la surface des LT,
et ses deux ligands CD80 et CD86, à la surface des CPA, vont ensuite être
engagées au niveau de la synapse immunologique pour conduire à l’activation
complète du LT. L’engagement du TCR induit la phosphorylation des résidus
tyrosines intracellulaires de CD28 par la kinase de la famille des tyrosines
kinases Src, Lck ( lymphocyte-specific protein tyrosine
kinase). Mais, en absence d’activité catalytique intrinsèque
dans la région intracellulaire de CD28, la transduction du signal nécessite
le recrutement d’autres molécules, telles que Grb2 ( growth factor
receptor bound protein 2) et PI3K ( phosphoinositide
3-kinase), conduisant in fine à la
stabilisation des ARN messagers codant des cytokines et à l’activation des
voies NF-AT ( nuclear factor of activated T cell), AP-1
( activator protein 1) et NFkB ( nuclear factor
kappa B) (Figure
1A). Cette cascade d’évènements va permettre la
sécrétion d’IL(interleukine)-2 et accroître la survie du LT en le
préservant, dans un premier temps, de l’épuisement. Cette activation
prolongée va cependant aboutir à la mise en place d’un « frein » immunitaire
avec l’expression à la membrane du LT de récepteurs régulateurs, tels que
CTLA-4 et PD-1, deux molécules découvertes respectivement par Pierre
Golstein [ 1] et
Tasuku Honjo [ 2] 2.
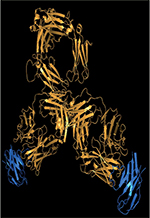
 | Figure 1.
Principaux mécanismes de régulation de l’activation
du lymphocyte T dépendante d’un signal TCR. A. Axe
TCR/CMH. B. Axe CTLA-4/CD28.
|
L’axe CTLA-4/CD28 La protéine CTLA-4 est stockée constitutivement dans des compartiments
intracellulaires du LT au repos, tels que le réseau trans-Golgi, les
endosomes et les lysosomes [ 3, 4].
Dès qu’un certain niveau d’activation est atteint, ces molécules sont
rapidement transloquées à la surface de la membrane de la cellule afin
d’être fonctionnelles au niveau de la synapse immunologique. C’est ainsi que
CTLA-4 va entrer en compétition avec CD28 pour se lier, lui aussi, aux
co-récepteurs CD80 et CD86 (Figure
1B). Cependant, son affinité et son avidité étant
plus fortes que celles de CD28, CTLA-4 va moduler négativement la
signalisation du TCR en recrutant la PI3K et les phosphatases SHP-2
( Src homology region 2 domain-containing phosphatase-2)
et PP2A ( protein phosphatase 2A), et ainsi limiter la
formation des complexes Zap-70 ( zeta-chain-associated protein of 70
kDa). Cette signalisation va se traduire par une diminution de
l’expression de l’IL-2 par le LT, à son anergie, voire à son apoptose. Alors
que l’engagement de CTLA-4 sur un LT conventionnel va conduire à la perte
progressive de ses fonctions effectrices, ce même engagement sur un LT
régulateur (LTreg) est, quant à lui, indispensable à l’acquisition des
fonctions immunosuppressives de ce dernier, en partie via
l’activation du promoteur de CTLA-4 par les facteurs de
transcription Foxp1 et 3 [ 5- 7]. Le
mécanisme d’action de l’anticorps thérapeutique anti-CTLA-4, l’ipilimumab,
reste néanmoins encore très débattu. Une activité potentiellement déplétante
de cet anticorps sur les LTreg a été avancée. L’axe PD-1/PD-L1-PD-L2 À la suite de l’engagement du TCR, d’autres récepteurs vont être exprimés à
la surface du LT. Parmi ces molécules, PD-1 sera, dans un premier temps, un
marqueur d’activation. Il deviendra un régulateur négatif lorsqu’il aura lié
l’un de ses ligands, PD-L1 et PD-L2 ( programmed cell death-ligand 1
/ 2), exprimés par des cellules tumorales et immunitaires.
Comme CD28, PD-1 va être phosphorylé par Lck (Figure 1B) et les phosphatases SHP-1 et -2
vont ensuite se fixer aux domaines ITIM ( immuno-receptor
tyrosine-based inhibition motif) et ITSM
( immuno-receptor tyrosine-based switch motif) de PD-1.
Cette étape est déterminante, puisqu’elle va conduire à la déphosphorylation
de CD28, ce qui diminuera fortement la capacité proliférative et les
fonctions effectrices du LT [ 8]. L’efficacité des anticorps anti-PD-1 ou anti-PD-L1 repose ainsi sur la levée
de l’inhibition que PD-1 exerce sur CD28. La voie de signalisation de CD28
est alors à nouveau activée, avec une augmentation de la survie, de la
prolifération et des fonctions cytotoxiques des LT CD8+ [9]. En d’autres termes,
le blocage de l’axe PD-1/PD-L1 requière l’expression de CD28 et des
molécules de co-stimulation afin de restaurer les fonctions effectrices des
LT, comme cela a été démontré dans des modèles d’infection virale chronique
et de carcinome colorectal [10]. La molécule de co-stimulation CD80 intervient à un second niveau dans
l’activation du LT. En se fixant à PD-L1, elle devient un puissant
compétiteur « naturel » pour PD-1 (Figure 1B) ; ceci a été démontré par
l’administration de molécules solubles de CD80 qui permet de restaurer
l’activation des LT CD4+ et CD8+
in vivo, en interférant avec l’axe PD-1/PD-L1 [11]. Le récepteur CD28 est donc assujetti à des régulations extrêmement fines et
déterminantes pour les fonctions du LT. Avec sa région extracellulaire, il
pourra interagir avec des molécules de co-stimulation et entrer en
compétition avec CTLA-4 pour les ligands qu’ils partagent ; avec sa région
intra-cytoplasmique, il liera des kinases et des phosphatases, dont SHP-2,
associée à PD-1. Mécanismes de régulation des régulateurs PD-1/PD-L1 et de CTLA-4 Co-régulation transcriptionnelle de certains récepteurs inhibiteurs et
épuisement des LT Une analyse, menée à l’échelle de la cellule unique, a permis de mettre en
évidence les mécanismes moléculaires contrôlant l’expression de certains ICP
sur les LT CD4 + et CD8 +. L’IL-27, une cytokine de la
famille de l’IL-12 impliquée dans la différenciation des LTreg producteurs
d’IL-10, induit l’expression de deux facteurs de transcription, PRDM1
( PR domain-containing protein 1), ou BLIMP-1
( B-lymphocyte-induced maturation protein-1), et c-MAF
( c-musculoaponeurotic fibrosarcoma), qui vont alors
activer la transcription d’un ensemble de gènes immuno-régulateurs, dont
ceux codant PD-1, TIM-3 ( T-cell immunoglobulin and mucin-domain
containing-3), LAG-3 ( lymphocyte-activation gene
3), TIGIT ( T cell immunoreceptor with Ig and ITIM
domains), et de deux autres récepteurs nouvellement classés
comme inhibiteurs, PROCR ( protein C receptor) ou EPCR
( endothelial protein C receptor) et PDPN (podoplanine)
[ 12]. PROCR
promeut l’épuisement total des LT, alors que PDPN limite leur survie aux
sites inflammatoires comme l’est par exemple un microenvironnement
tumoral. Dynamique de traduction de certains récepteurs inhibiteurs Des travaux récents ont démontré que l’expression de PD-1 est fortement
diminuée lorsque des LT CD4 +, CD8 + et LTgd circulants
activés sont traités par des inhibiteurs des microtubules [ 13]. Ces drogues conduisent
également à la perte d’expression d’autres ICP, tels que TIM-3, LAG-3,
TIGIT, CTLA-4 et BTLA ( B- and T-lymphocyte attenuator),
alors que l’expression de récepteurs activeurs (OX-40, GITR
[ glucocorticoid-induced tumor necrosis factor receptor
family-related protein], 4-1BB) n’est pas affectée. Seuls les
ARNm codant ces molécules inhibitrices sont transportés par les microtubules
et le moteur moléculaire Kinésine-1 pour fusionner avec des complexes
ribo-nucléoprotéiques au niveau des granules de stress et, in
fine, être traduits en protéines par les ribosomes. Les drogues
déstabilisant les microtubules (comme la colchicine) sont bien plus
efficaces que celles conduisant à leur stabilisation. Cette étude a mis
néanmoins en garde contre l’utilisation de telles drogues chez les patients
cancéreux car, au-delà de l’effet bénéfique escompté des thérapies anti-ICP,
un co-traitement par des inhibiteurs de microtubules les expose à un risque
particulièrement élevé de développer des maladies auto-immunes, comme cela a
été observé dans une analyse portant sur 202 693 cas d’effets secondaires de
patients cancéreux traités par nivolumab, pembrolizumab ou ipilimumab 3. Présence de variants solubles de PD-L1 Plusieurs études ont rapporté la présence d’ICP solubles dans le plasma de
patients. Deux mécanismes moléculaires sont à l’origine de ces formes
solubles: l’un reposant sur un épissage alternatif aboutissant à l’absence
du domaine transmembranaire de la protéine, l’autre faisant intervenir
l’action d’ecto-enzymes à la surface cellulaire. La présence de multiples
variants de PD-L1 a été rapportée chez des patients atteints d’un cancer du
poumon et en rechute de leur traitement par anticorps anti-PD-L1 [ 14]. Des mutations
somatiques dans le dernier exon codant le domaine extracellulaire de PD-L1
ont conduit à des formes tronquées dépourvues du domaine transmembranaire.
Des mutations ont également été retrouvées dans le gène TDP-43 ( TAR
DNA-binding protein) dans ces mêmes tumeurs. TDP-43 est un
facteur régulant l’épissage alternatif de nombreux gènes et la surexpression
in vitro de TDP-43 muté altère le profil des variants
de PD-L1, soulignant l’importance des mécanismes de régulation de la
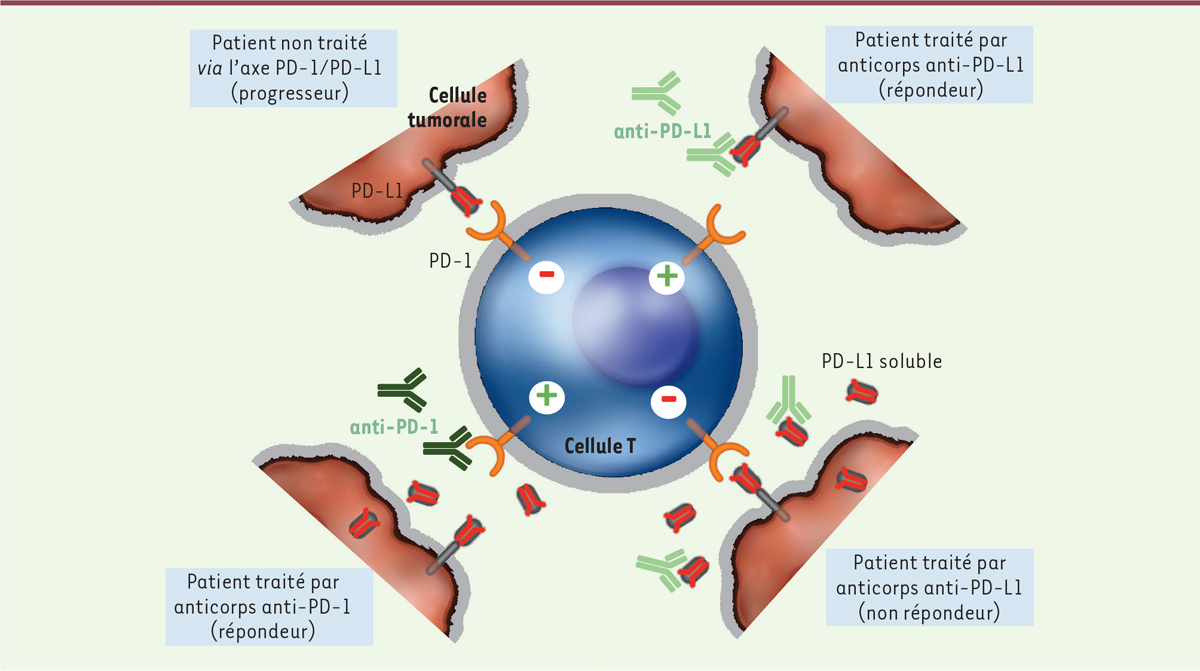
transcription des ARN, dans le cancer en particulier. Sur le plan fonctionnel, les deux formes solubles de PD-L1 conservent leur
capacité de se fixer à PD-1 (Figure
2) pouvant potentiellement exercer une action
inhibitrice à distance de la tumeur. De plus, ces variants solubles sont
capables de neutraliser l’anticorps anti-PD-L1 in vivo et,
en conséquence, d’abroger l’effet thérapeutique escompté. Une alternative
pourrait alors être de traiter les patients par un anticorps anti-PD-1.
Cependant, des formes solubles de PD-1 ont été rapportées dans la
polyarthrite rhumatoïde. Il serait donc judicieux de rechercher la présence
de PD-1 soluble avant toute initiation d’une thérapie par anticorps
anti-PD-1, et de définir si des formes solubles de PD-1 pourraient être
responsables de cas de résistance à ce traitement (voir plus loin).
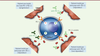 | Figure 2.
Mécanismes d’action des formes solubles de PD-L1
associées au phénomène de résistance des traitements par
anticorps anti-PD-L1.
|
Ces différentes études soulignent donc l’importance de mieux comprendre les
éléments de régulation des ICP au niveau transcriptionnel afin d’adapter les
traitements combinant des ICP. |
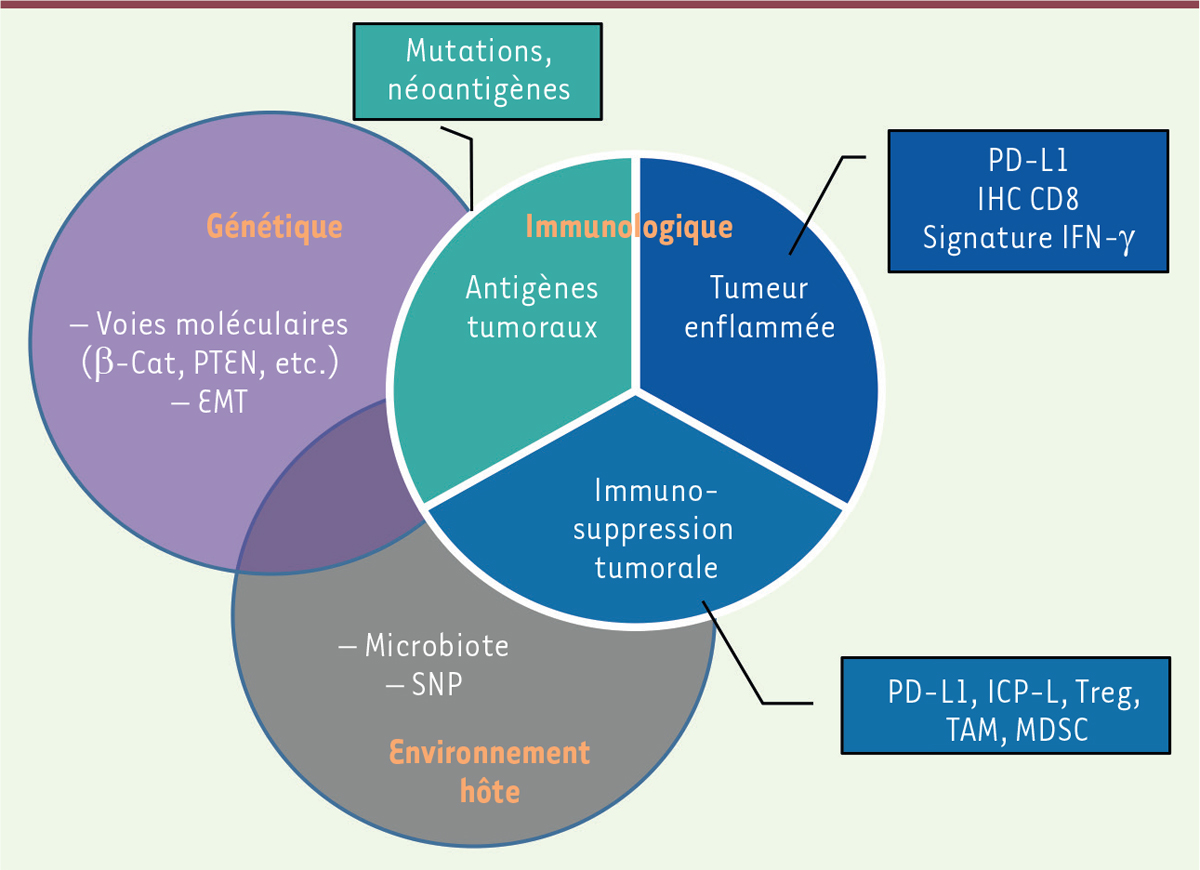
Biomarqueurs en immuno-oncologie Afin de prédire les chances de réponses ou, a contrario, les risques
d’hyper progression ou de toxicité, et de définir les mécanismes de résistance chez
les patients non répondeurs à des traitements ciblant PD-1 et CTLA-4, différents
biomarqueurs ont été identifiés. Il peut s’agir de biomarqueurs immunologiques ou de
biomarqueurs génétiques issus de la cellule tumorale et de son microenvironnement
[15] ; considérer le
biomarqueur en prenant en compte la dynamique de la réponse dans le temps peut
également s’avérer particulièrement adapté (Figure 3).
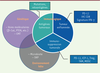 | Figure 3.
Biomarqueurs tumoraux et immunologiques proposés pour
prédire une meilleure réponse à l’immunothérapie.
|
Biomarqueurs immunologiques du microenvironnement tumoral Expression de PD-L1 L’expression de PD-L1 sur la cellule tumorale et/ou sur les cellules du
microenvironnement tumoral a été l’un des premiers biomarqueurs étudiés,
principalement par immuno-histochimie. L’expression de PD-L1 par les
cellules tumorales peut se révéler être relativement homogène, comme dans le
cancer du poumon, avec des tumeurs complètement négatives et des tumeurs
fortement positives [ 16], ou focale, généralement au contact du stroma, comme dans le
cancer de l’ovaire [ 17]. Les conséquences de cette expression sur le plan clinique sont variables
selon le type de cancer. Dans le cancer bronchique non-à-petites cellules
(CBNPC), le taux d’expression de PD-L1 est associé à la réponse du patient
aux thérapies anti-PD-1/PD-L1 [16]:
le pembrolizumab (un anticorps anti-PD1) est ainsi approuvé dans le CBNPC
sur la base de l’expression de PD-L1 par les cellules tumorales. Cependant,
dans d’autres types de cancers, comme le carcinome urothélial métastatique,
l’expression de PD-L1 n’apparaît pas comme étant un marqueur déterminant
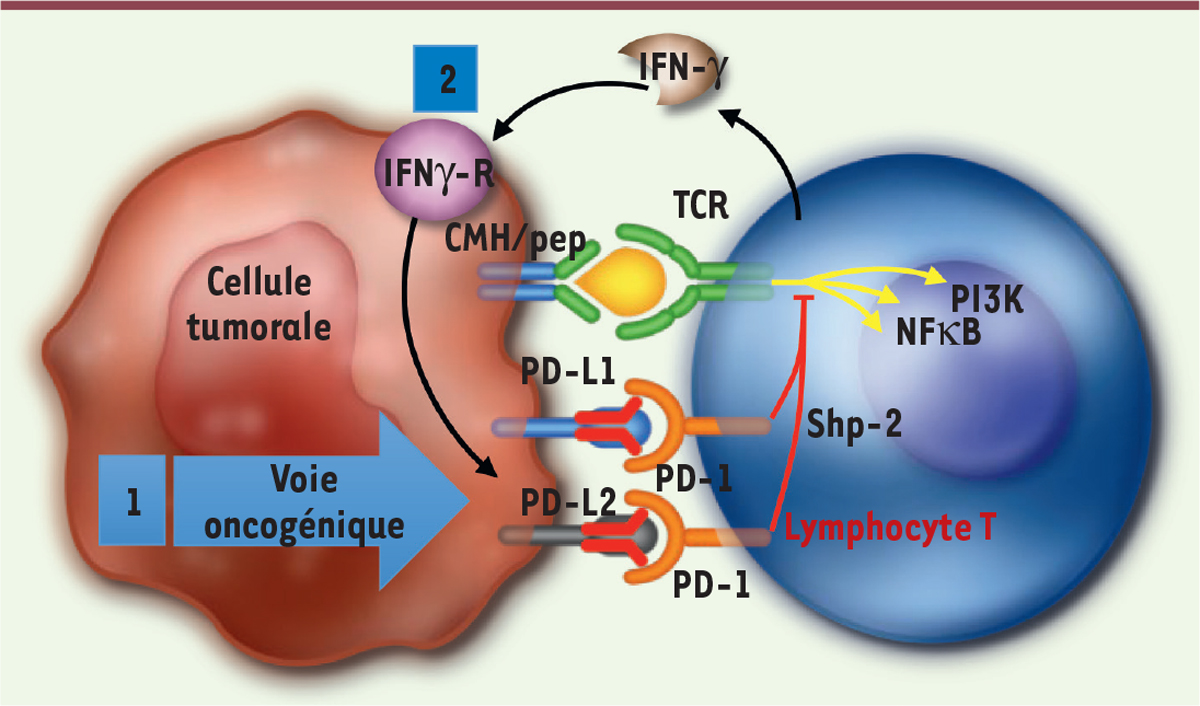
pour la décision thérapeutique [17]. Il est important de rappeler que l’expression de PD-L1 sur la cellule
tumorale peut être induite par les voies oncogéniques, mais surtout en
réaction à la réponse immunitaire associée à une production d’IFN
(interféron)-g [18]
(Figure 4).
Cette dynamique d’expression explique probablement que le bénéfice de la
combinaison anti-PD-1 + anti-CTLA-4 soit restreint aux patients porteurs
d’un mélanome exprimant peu PD-L1 [19].
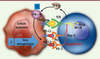 | Figure 4.Régulation positive de l’expression de PD-L1
induite par l’oncogenèse (1) ou par les lymphocytes T
(2) (d’après [ 18]). |
Il est également important de noter que les plus fortes réponses aux
anticorps anti-PD1/PD-L1 (80-90 %) sont observées dans le lymphome de
Hodgkin qui présente une amplification du locus codant PD-L1, PD-L2 et JAK2
(Janus kinase 2) [20]. L’expression de PD-L1 est donc un biomarqueur important, mais son analyse
reste complexe et présente plusieurs difficultés: (1) expression par les
cellules tumorales et par des cellules du microenvironnement, (2) expression
focale pouvant conduire à de faux négatifs sur biopsie, (3) expression
variable dans le temps et inductible sous immunothérapie, (4) l’impact de
son expression peut varier en fonction des combinaisons thérapeutiques et
(5) PD-1 peut aussi se lier à PD-L2. Ainsi, pour une meilleure appréciation
de l’expression de PD-L1, y compris au cours du traitement, il sera sans
doute nécessaire de développer l’imagerie in vivo [21]. Infiltration par les LT CD8+ et signature
transcriptomique L’infiltration de LT CD8 + avant le traitement, qui définit la
notion de tumeur chaude vs tumeur froide, est un autre
biomarqueur important dont l’impact a été montré dans le mélanome
métastatique [ 22]
et dans le cancer du poumon [ 23]. En complément de leur infiltration, la détection
de signatures transcriptomiques des LT activés/enflammés liés à l’IFN-g, est
associée à une meilleure réponse aux thérapies anti-PD-1/PD-L1 dans la
plupart des tumeurs solides [ 24]. En revanche, certains patients dont la tumeur
exprime cette signature ne répondent pas à cette immunothérapie, illustrant
la nécessité d’identifier des signatures géniques plus spécifiques. D’autres paramètres immunitaires intra-tumoraux semblent également contribuer
à la réponse aux anticorps anti-PD1/L1: 1) l’infiltration des cellules
dendritiques et des cellules NK, 2) la co-localisation de PD-1 et de PD-L1,
3) la présence de structures lymphoïdes tertiaires (TLS), plus prédictives
que la seule infiltration des LT CD8+ [25]. Ces observations plaident pour des études complémentaires afin de connaître
l’état d’activation des LT CD8+ infiltrants, l’expression
d’autres récepteurs co-régulateurs par les LT CD8+, ainsi que
pour l’analyse des LT CD4+ et d’autres cellules immunitaires. |
Biomarqueurs associés à la cellule tumorale: mutations et néo-épitopes Initialement montrée dans le mélanome et le cancer du poumon [26], puis confirmée récemment dans une étude de
phase III dans le cancer du poumon [27], la réponse aux immunothérapies ciblant PD-1 est clairement
associée au taux de mutations somatiques que présentent les tumeurs, qui peuvent
conduire à la génération de néo-épitopes (Figure 5). La plupart des tumeurs ayant un fort taux de
mutations somatiques sont en effet associées à de bonnes réponses cliniques au
traitement [28]. Des
tumeurs porteuses d’instabilités micro-satellitaires (MSI-H) ou d’un défaut de
réparation de l’ADN conduisant à l’accumulation de mutations, répondent aux
traitements par anticorps anti-PD-1/PD-L1: le pembrolizumab a ainsi obtenu
l’autorisation de mise sur le marché (AMM) pour ces tumeurs non résécables ou
métastatiques [29]. Il
existe cependant des tumeurs présentant un niveau de mutations non négligeable (cas
du cancer du côlon non MSI) qui ne répondent pas au traitement par anticorps
anti-PD1, suggérant l’existence d’autres voies d’immunosuppression [28]. Le cancer du rein semble également associé
à une fréquence élevée d’insertions/délétions conduisant également à la formation de
néo-épitopes [25]. La signature de LT
enflammés peut toutefois s’avérer élevée, mais sans corrélation avec le taux de
néo-épitopes [30]. Dans
leur majorité, les études récentes montrent une bonne réponse des tumeurs
d’étiologie virale aux anticorps anti-PD-1/PD-L1, probablement en lien avec
l’expression d’antigènes dominants d’origine virale [25, 31]: les
tumeurs du col de l’utérus et de la cavité orale liées au papillomavirus (HPV), les
tumeurs gastriques liées au virus d’Epstein-Barr (EBV), les carcinomes cutanés de
Merkel et les hépatocarcinomes associés au virus de l’hépatite B et C (HBV/HBC).
 | Figure 5.Relation entre la charge mutationnelle et la réponse aux
immunothérapies ciblant PD-1/PD-L1 (d’après
[ 28] ). |
La charge en néo-épitopes apparaît donc associée à la réponse aux anticorps ciblant
PD-1. Cependant, une tumeur non infiltrée peut avoir une charge élevée en
néo-épitopes et inversement, une tumeur infiltrée, une charge faible. Il sera
important dans les recherches futures d’inclure l’analyse des néo-épitopes CD8 et
CD4 et de leur clonalité, et de l’étendre à d’autres classes d’antigènes tumoraux, y
compris d’origine virale. |
Prise en compte de la dynamique de la réponse dans le temps L’analyse de la dynamique de la réponse au cours du traitement, sur des biopsies
tumorales et, d’accès plus aisé, dans le sang périphérique, apporte des informations
complémentaires importantes à prendre en considération. Données sur des biopsies avant et au cours du traitement Bien que les informations restent limitées, le niveau des réponses des patients
semble associé à une augmentation du nombre de lymphocytes au cours du
traitement [ 22], ainsi qu’à une perte
d’expression d’antigènes clonaux [ 25]. Analyses dans le sang Cellules immunitaires circulantes Un niveau faible de lymphocytes circulants, ou un ratio
neutrophiles/lymphocytes (NLR) élevé avant ou après 2-3 mois de traitement,
sont associés à une mauvaise réponse aux anticorps anti-PD1 dans l’ensemble
des tumeurs solides [ 32]. Des modifications dynamiques, liées au traitement par
anticorps anti-CTLA-4 ou anti-PD1, ont pu être reliées à un bénéfice
clinique avec, en particulier: (1) une diminution du nombre de LTreg et de
cellules myéloïdes suppressives (MDSC), (2) une augmentation de l’expression
d’ICOS par les LT, (3) une fréquence élevée de monocytes activés, et (4) une
augmentation de LT CD4 + mémoires [ 32]. Biomarqueurs immunitaires solubles circulants Quelques études suggèrent un rôle des cytokines plasmatiques (IFN-g, IL-2,
etc.) dans les effets secondaires, mais pas dans la réponse au traitement
[ 33]. La
présence de PD-L1 soluble (sPD-L1) mais pas de sPD-L2 [ 34], ainsi que celle d’une
forme associée aux exosomes [ 35], apparaissent de mauvais pronostic dans différentes
études. D’autres travaux décrivent un impact négatif des formes solubles de
CD73 [ 36] ou de
faibles taux de granzyme B (GranB) soluble [ 34]. Autres paramètres sanguins La diminution à court terme (2-4 semaines) du taux d’IL-8 ou d’ADN tumoral
circulants [ 33], comme marqueurs de
la charge tumorale, permettrait de prédire de façon plus précoce que les
technologies d’imagerie la réponse clinique à long terme dans le mélanome et
le CBNPC. Le taux de LT PD1 + activés circulants est également
prédictif d’une réponse anti-tumorale s’il est pondéré par la masse tumorale
initiale [ 37]. Il est donc important de pouvoir réaliser des biopsies précoces sous
traitement pour suivre l’évolution de la charge en néo-épitopes et celle de
leur clonalité, ainsi que l’évolution du compartiment LT CD8+ et
de son niveau d’activation. Les analyses réalisées sur le sang peuvent
permettre de suivre l’évolution de la masse tumorale et de la réponse
immunitaire. Il semble donc important de mettre en œuvre des études de
suivis dans le sang périphérique de l’ensemble des populations de cellules
immunitaires (fréquence, niveau d’activation et fonction) sur de grandes
cohortes de patients en vie réelle. |
Mécanismes de résistance à l’immunothérapie Altération des voies de présentation des antigènes Différents mécanismes de résistance, primaire ou acquise, aux immunothérapies
commencent à être décrits [ 31]. La perte
d’expression du CMH, par perte d’expression de la b2-microglobuline, la perte
d’hétérozygotie, ou la régulation négative des ARNm codant les molécules du
CMH-I ( via MEX3B) 4
représente un premier mécanisme de résistance. Des mutations ou des délétions
dans la voie de l’IFN-g (dont Jak 1/2) ont également été décrites dans plusieurs
études. L’inhibition de l’autophagie représenterait également un mécanisme de
résistance aux anticorps anti-CTLA-4, mais pas aux anticorps anti-PD-1
via une réduction de la présentation d’antigènes [ 38]. Autres mécanismes d’immunosuppression dominants Les analyses de l’infiltrat immunitaire in situ ou par
déconvolution du transcriptome suggèrent que les macrophages et les MDSC
s’opposent à la réponse thérapeutique, et même participent au phénomène
d’hyperprogression décrit chez certains patients sous traitement par anticorps
anti-PD-1 [ 25]. D’autres récepteurs inhibiteurs exprimés par les LT pourraient également
contribuer à la résistance aux anticorps anti-PD-1, tels que LAG-3, TIGIT, VISTA
(V-domain Ig suppressor of T cell activation) et plus
particulièrement TIM3. Les enzymes CD39 et CD73, de mauvais pronostic dans
différents cancers, pourraient également être impliquées, via
la production d’adénosine extracellulaire fortement immunosuppressive [25]. Altérations moléculaires intrinsèques à la cellule tumorale L’activation de la voie de la b-caténine dans le mélanome bloque l’infiltration
des cellules dendritiques participant au recrutement et à l’activation des LT
CD8 +. L’inactivation de la voie PTEN ( phosphatase and
tensin homolog) est, elle aussi, associée à un désert immunitaire
et à une absence de réponse à l’immunothérapie dans le mélanome, une observation
également confirmée dans les leiomysarcomes utérins 5 [ 39].
D’autres altérations moléculaires [de l’EGFR ( epidermal growth factor
receptor), par exemple], en particulier dans les CBNPC, semblent
également s’opposer à la réponse aux anticorps anti-PD-1. Les processus de
transition épithélio-mésenchymateuse, de réparation tissulaire, et le caractère
souche des cellules tumorales, semblent également associés aux mécanismes de
résistance intrinsèque à la cellule tumorale [ 31]. Stratégies pour lever la résistance aux anticorps anti-PD1 Ces observations ont conduit au développement de stratégies d’immunothérapie
combinant l’injection intra-tumorale de virus oncolytiques et d’anticorps
anti-PD-1 permettant une réponse chez plus de 60 % des patients atteints de
mélanome métastatique [ 40]. De nombreuses autres stratégies sont en cours d’évaluation dans
des modèles pré-cliniques ou dans des essais thérapeutiques, telles que la
combinaison avec des chimiothérapies immunogènes, des combinaisons d’anticorps
anti-ICP (anti-CTLA-4 + anti-PD-1, anti-PD-1 + anti-CD73, anti-PD-1 + anticorps
agoniste anti-TNFR, etc), l’association à des ligands du TLR3 ( Toll-like
receptor 3) ou encore l’inhibition des MDSC via la
neutralisation du récepteur du fragment C5a du complément (C5aR) [ 31]. |
En conclusion, différentes caractéristiques des ICP, allant de leur rôle régulateur
de la réponse immunitaire à leur rôle de cibles pour le développement de médicaments
pour les patients cancéreux, doivent être soulignées: 1. L’activation du TCR conduit
à la mise en place de freins immunitaires, dont le ciblage a donné des résultats
sans précédent quant à la survie sans récidive de certains patients. 2.
L’interaction croisée entre récepteurs activateurs et inhibiteurs partageant pour
certains les mêmes ligands rend l’équation complexe à modéliser. 3. Un meilleur
ciblage des récepteurs inhibiteurs pourrait venir d’une meilleure compréhension de
la régulation transcriptionnelle des gènes les codant. L’expression du ligand PD-L1 représente un biomarqueur important bien qu’imparfait,
dont l’analyse est rendue complexe du fait de son expression focale par différentes
cellules du microenvironnement tumoral et de sa dynamique d’expression au cours du
traitement. Si l’infiltration des LT CD8+, la clonalité des LT infiltrant
la tumeur et la signature transcriptomique des LT activés sont associées à une
meilleure réponse à l’immunothérapie, il est néanmoins important de mieux
caractériser l’état d’activation et l’expression d’autres récepteurs co-régulateurs
des LT CD4+ et CD8+ intra-tumoraux, de rechercher des
signatures moléculaires plus spécifiques et d’intégrer l’analyse d’autres acteurs de
l’immunité. Si la charge et la clonalité des néo-épitopes sont globalement associées
à la réponse aux immunothérapies ciblant PD-1, une tumeur non infiltrée peut
également avoir une charge élevée en néo-épitopes, ce qui implique de réaliser une
analyse de la réponse immunitaire contre ces néo-épitopes et d’inclure d’autres
antigènes tumoraux. L’importance de l’évolution dynamique de biomarqueurs potentiels
rend nécessaire de disposer de biopsies à des temps précoces après le début du
traitement, probablement plus informatives que les seules biopsies à T0, et de
réaliser une analyse poussée des paramètres immunitaires sanguins. Si divers
paramètres immunologiques, ou associés à la tumeur, s’avèrent des biomarqueurs
potentiels de réponse à l’immunothérapie, les travaux doivent tendre vers la
définition d’un prédicteur composite intégrant tout ou partie de ces différents
paramètres. Il est important de souligner que des paramètres de l’hôte (polymorphismes
génétiques) et de son environnement influencent la réponse aux immunothérapies. Des
travaux récents ont par exemple montré que le microbiote intestinal influence la
réponse aux anticorps anti-PD-1/PD-L1 [25]. Il faut aussi mentionner que la plupart des études de biomarqueurs de réponse aux
immunothérapies actuellement disponibles n’incluent pas de bras contrôle avec le
traitement de référence, rendant parfois difficile la distinction entre marqueurs
prédictifs et marqueurs pronostiques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1. Brunet
JF,
Denizot
F,
Luciani
MF, et al.
A new member of the immunoglobulin
superfamily-CTLA-4 . Nature.
1987; ; 328:
:267.–270. 2. Ishida
Y,
Agata
Y,
Shibahara
K,
Honjo
T. Induced
expression of PD-1, a novel member of the immunoglobulin gene superfamily,
upon programmed cell death . EMBO
J.
1992; ; 11:
:3887.–3895. 3. Leung
HT,
Bradshaw
J,
Cleaveland
JS,
Linsley
PS. Cytotoxic T
lymphocyte-associated molecule-4, a high-avidity receptor for CD80 and CD86,
contains an intracellular localization motif in its cytoplasmic
tail . J Biol Chem.
1995; ; 270:
:25107.–25114. 4. Valk
E,
Leung
R,
Kang
H, et al.
T cell receptor-interacting molecule acts as a chaperone to
modulate surface expression of the CTLA-4 coreceptor .
Immunity.
2006; ; 25:
:807.–821. 5. Read
S,
Greenwald
R,
Izcue
A, et al.
Blockade of CTLA-4 on CD4+CD25+ regulatory T cells abrogates
their function in vivo . J
Immunol.
2006; ; 177:
:4376.–4383. 6. Wing
K,
Onishi
Y,
Prieto-Martin
P, et al.
CTLA-4 control over Foxp3+ regulatory T cell
function . Science.
2008; ; 322:
:271.–275. 7. Ren
J,
Han
L,
Tang
J, et al.
Foxp1 is critical for the maintenance of regulatory T-cell
homeostasis and suppressive function . PLoS
Biol.
2019; ; 17:
:e3000270.. 8. Hui
E,
Cheung
J,
Zhu
J, et al.
T cell costimulatory receptor CD28 is a primary target for
PD-1-mediated inhibition .
Science.
2017; ; 355:
:1428.–1433. 9. Ahn
E,
Araki
K,
Hashimoto
M, et al.
Role of PD-1 during effector CD8 T cell
differentiation . Proc Natl Acad Sci U S
A.
2018; ; 115:
:4749.–4754. 10. Kamphorst
AO,
Wieland
A,
Nasti
T, et al.
Rescue of exhausted CD8 T cells by PD-1-targeted therapies is
CD28-dependent . Science.
2017; ; 355:
:1423.–1427. 11. Haile
ST,
Dalal
SP,
Clements
V, et al.
Soluble CD80 restores T cell activation and overcomes tumor cell
programmed death ligand 1-mediated immune suppression .
J Immunol.
2013; ; 191:
:2829.–2836. 12. Chihara
N,
Madi
A,
Kondo
T, et al.
Induction and transcriptional regulation of the co-inhibitory
gene module in T cells .
Nature.
2018; ; 558:
:454.–459. 13. Franchini
DM,
Lanvin
O,
Tosolini
M, et al.
Microtubule-driven stress granule dynamics regulate inhibitory
immune checkpoint expression in T cells .
Cell Rep.
2019; ; 26: (94–107)
:e7.. 14. Gong
B,
Kiyotani
K,
Sakata
S, et al.
Secreted PD-L1 variants mediate resistance to PD-L1 blockade
therapy in non-small cell lung cancer . J Exp
Med.
2019; ; 216:
:982.–1000. 15. Blank
CU,
Haanen
JB,
Ribas
A,
Schumacher
TN. Cancer
immunology. The cancer immunogram .
Science.
2016; ; 352:
:658.–660. 16. Garon
EB,
Rizvi
NA,
Hui
R, et al.
Keynote-001 investigators. Pembrolizumab for the treatment of
non-small-cell lung cancer . N Engl J
Med.
2015; ; 372:
:2018.–2028. 17. Nishino
M,
Ramaiya
NH,
Hatabu
H,
Hodi
FS. Monitoring
immune-checkpoint blockade: response evaluation and biomarker
development . Nat Rev Clin
Oncol.
2017; ; 14:
:655.–668. 18. Pardoll
DM. The blockade of
immune checkpoints in cancer immunotherapy .
Nat Rev Cancer.
2012; ; 12:
:252.–264. 19. Larkin
J,
Chiarion-Sileni
V,
Gonzalez
R, et al.
Combined nivolumab and ipilimumab or monotherapy in untreated
melanoma . N Engl J Med.
2015; ; 373:
:23.–34. 20. Ansell
SM,
Lesokhin
AM,
Borrello
I, et al.
PD-1 blockade with nivolumab in relapsed or refractory Hodgkin’s
lymphoma . N Engl J Med.
2015; ; 372:
:311.–319. 21. Bensch
F, van der
Veen
EL, Lub-de
Hooge
MN, et al.
89Zr-atezolizumab imaging as a non-invasive approach to assess
clinical response to PD-L1 blockade in cancer .
Nat Med.
2018; ; 24:
:1852.–1858. 22. Tumeh
PC,
Harview
CL,
Yearley
JH, et al.
PD-1 blockade induces responses by inhibiting adaptive immune
resistance . Nature.
2014; ; 515:
:568.–571. 23. Hu-Lieskovan
S,
Lisberg
A,
Zaretsky
JM, et al.
Tumor characteristics associated with benefit from pembrolizumab
in advanced non-small cell lung cancer . Clin
Cancer Res.
2019
May 21. pii: clincanres.4275.2018.. 24. Ott
PA,
Bang
YJ,
Piha-Paul
SA, et al.
T-cell-inflamed gene-expression profile, programmed death ligand
1 expression, and tumor mutational burden predict efficacy in patients
treated with pembrolizumab across 20 cancers: keynote-028 .
J Clin Oncol.
2019; ; 37:
:318.–327. 25. Havel
JJ,
Chowell
D,
Chan
TA. The evolving
landscape of biomarkers for checkpoint inhibitor
immunotherapy . Nat Rev
Cancer.
2019; ; 19:
:133.–150. 26. McGranahan
N,
Furness
AJ,
Rosenthal
R, et al.
Clonal neoantigens elicit T cell immunoreactivity and sensitivity
to immune checkpoint blockade .
Science.
2016; ; 351:
:1463.–1469. 27. Hellmann
MD,
Ciuleanu
TE,
Pluzanski
A, et al.
Nivolumab plus Ipilimumab in Lung Cancer with a High Tumor
Mutational Burden . N Engl J
Med.
2018; ; 378:
:2093.–2104. 28. Yarchoan
M,
Hopkins
A,
Jaffee
EM. Tumor mutational
burden and response rate to PD-1 inhibition .
N Engl J Med.
2017; ; 377:
:2500.–2501. 29. Prasad
V,
Kaestner
V,
Mailankody
S. Cancer drugs
approved based on biomarkers and not tumor type-FDA approval of
pembrolizumab for mismatch repair-deficient solid cancers .
JAMA Oncol.
2018; ; 4:
:157.–158. 30. Spranger
S,
Gajewski
TF. Impact of
oncogenic pathways on evasion of antitumour immune
responses . Nat Rev Cancer.
2018; ; 18:
:139.–147. 31. Ribas
A,
Wolchok
JD. Cancer
immunotherapy using checkpoint blockade .
Science.
2018; ; 359:
:1350.–1355. 32. Ménétrier-Caux
C,
Ray-Coquard
I,
Blay
JY,
Caux
C. Lymphopenia in
cancer patients and its effects on response to immunotherapy: an opportunity
for combination with cytokines? . J
Immunother Cancer.
2019; ; 7: :85.. 33. Yi
M,
Jiao
D,
Xu
H, et al.
Biomarkers for predicting efficacy of PD-1/PD-L1
inhibitors . Mol Cancer.
2018; ; 17: :129.. 34. Costantini
A,
Julie
C,
Dumenil
C, et al.
Predictive role of plasmatic biomarkers in advanced non-small
cell lung cancer treated by nivolumab .
Oncoimmunology.
2018; ; 7:
:e1452581.. 35. Chen
G,
Huang
AC,
Zhang
W, et al.
Exosomal PD-L1 contributes to immunosuppression and is associated
with anti-PD-1 response .
Nature.
2018; ; 560:
:382.–386. 36. Morello
S,
Capone
M,
Sorrentino
C, et al.
Soluble CD73 as biomarker in patients with metastatic melanoma
patients treated with nivolumab . J Transl
Med.
2017; ; 15: :244.. 37. Huang
AC,
Postow
MA,
Orlowski
RJ, et al.
T-cell invigoration to tumour burden ratio associated with
anti-PD-1 response . Nature.
2017; ; 545:
:60.–65. 38. Shukla
SA,
Bachireddy
P,
Schilling
B, et al.
Cancer-germline antigen expression discriminates clinical outcome
to CTLA-4 blockade . Cell.
2018; ; 173: (624–33)
:e8.. 39. Spranger
S,
Gajewski
TF. Impact of
oncogenic pathways on evasion of antitumour immune
responses . Nat Rev Cancer.
2018; ; 18:
:139.–147. 40. Ribas
A,
Dummer
R,
Puzanov
I, et al.
Oncolytic virotherapy promotes intratumoral T cell infiltration
and improves anti-PD-1 immunotherapy .
Cell.
2017; ; 170:
:1109.–19.e10. |