L’une des avancées majeures obtenue dans le domaine de l’immuno-oncologie au cours de ces dernières années a consisté à utiliser des inhibiteurs de points de contrôle de l’immunité. Des résultats sans précédent ont été obtenus en utilisant des anticorps monoclonaux (AcM) qui bloquent l’axe PD-1 (programmed-cell death protein 1)/PD-L1 (programmed-cell death ligand 1). Ces anticorps ont été approuvés pour de nombreuses indications en oncologie, mais seule une fraction de patients répond à ces immunothérapies. Un des enjeux majeurs en immuno-oncologie est donc de comprendre les mécanismes de résistance à ces traitements afin d’augmenter la proportion de patients qui pourraient en bénéficier [1]. Une façon d’atteindre cet objectif est d’identifier d’autres points de contrôle de la réponse immunitaire pour promouvoir une réponse immunitaire anti-tumorale efficace. La plupart des stratégies actuelles ciblent les récepteurs exprimés sur les cellules de l’immunité adaptative, les lymphocytes T, mais un intérêt croissant s’est fait jour ces dernières années pour le développement d’immunothérapies ciblant les cellules de l’immunité innée, notamment les cellules natural killer (NK). Ces cellules sont des grands lymphocytes granuleux qui participent à l’immunosurveillance tumorale et au contrôle des infections microbiennes. Elles sont capables de tuer des cellules tumorales tout en épargnant les cellules saines. Elles produisent également des cytokines, telles que l’interféron gamma (IFN-γ) qui participe à l’orientation de la réponse immunitaire adaptative. La manipulation des cellules NK dans le cancer pourrait avoir une action pléiotropique aboutissant à la mise en place d’une réponse immune cellulaire protectrice de longue durée [2].
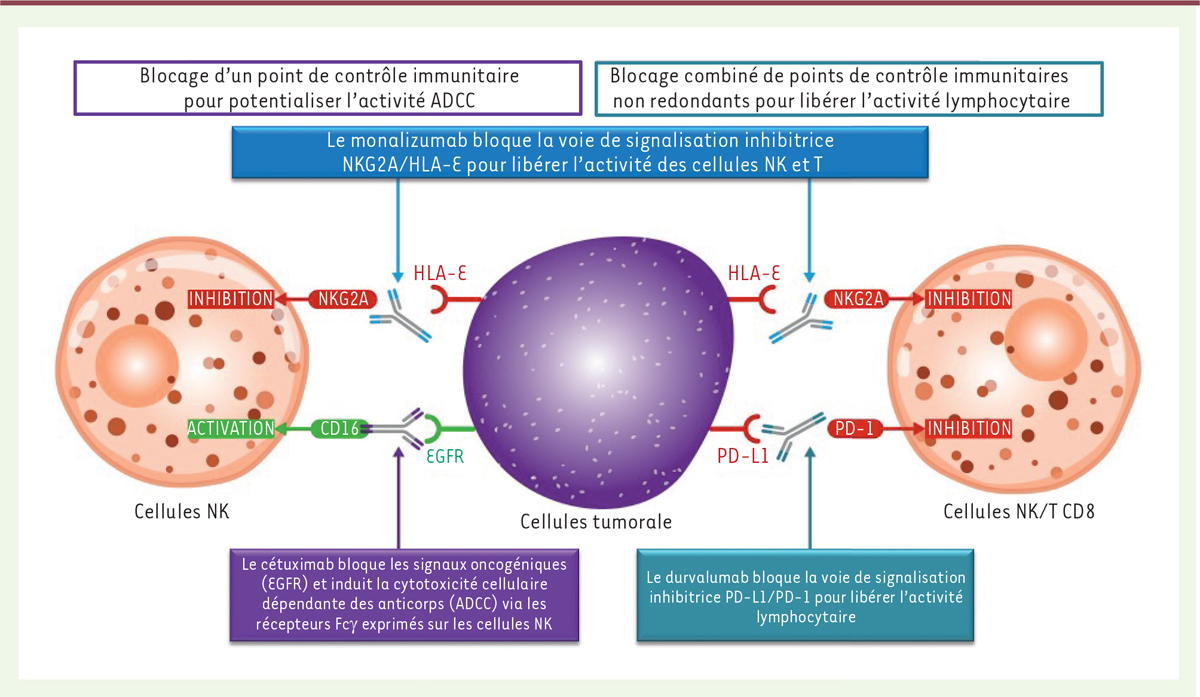
Dans l’étude de André et al. [3], nous nous sommes intéressés à NKG2A (natural killer group 2 member A), un récepteur inhibiteur et un point de contrôle exprimé par des cellules de l’immunité innées, les lymphocytes NK, et par des cellules de l’immunité adaptative, les lymphocytes T CD8+ infiltrés dans la tumeur. Ce récepteur transmembranaire délivre un signal d’inhibition via un motif protéique intracytoplasmique ITIM (immunoreceptor tyrosine-based inhibition motif). NKG2A reconnait une molécule du complexe majeur d’histocompatibilité de classe I, HLA-E. Cette reconnaissance empêche l’activation des cellules immunitaires exprimant NKG2A. Différentes tumeurs solides ou hématologiques expriment HLA-E, ce qui les protège de la destruction par les cellules immunitaires NKG2A+. HLA-E est en effet surexprimé dans une grande variété de tumeurs solides (jusqu’à 70-90 % des cas de cancer de la tête et du cou, de l’ovaire, de l’endomètre, du côlon, du col de l’utérus et du poumon), ainsi que dans divers types de leucémies et de lymphomes et jusqu’à 50 % des cas de mélanome et des cancers de l’œsophage. Le monalizumab est un anticorps de sous-classe d’immunoglobuline G4, IgG4, humanisé qui bloque la fonction inhibitrice de NKG2A. Nous avons montré in vitro et in vivo que le blocage de l’interaction entre NKG2A et son ligand induisait une augmentation de l’activité anti-tumorale exercée par les cellules NK et les lymphocytes T CD8+. De plus, le monalizumab potentialise l’activité d’autres thérapies ciblant les lymphocytes NK et T CD8+. Dans des essais de cytotoxicité in vitro, le monalizumab potentialise l’activité du cétuximab, un AcM anti-EGFR bloquant les signaux oncogéniques et induisant la cytotoxicité cellulaire dépendante des anticorps (ADCC) via les récepteurs Fcg (RFcg) exprimés sur les cellules NK. Le monalizumab potentialise également l’activité de l’AcM anti-PD-L1, durvalumab, en augmentant l’activité cytotoxique in vitro des lymphocytes NK et T CD8+ et l’activité anti-tumorale in vivo. Ces résultats précliniques supportent un rationnel pour combiner le monalizumab avec différentes immunothérapies dans le traitement contre le cancer. Plusieurs essais cliniques de phases I et I/II sont en cours dans différents types de tumeurs et des résultats préliminaires montrent une activité anti-tumorale. Dans une étude de phase II évaluant la tolérance et l’efficacité de la combinaison du monalizumab avec le cétuximab chez des patients prétraités présentant un carcinome épidermoïde de la tête et du cou en rechute et/ou métastatique, le taux de réponse globale était de 27,5 % [selon les critères RECIST (critères d’évaluation de la réponse des tumeurs solides ou « Response Evaluation Criteria in Solid Tumors »)]. Ainsi, ces données précliniques et cliniques constituent une base pour continuer l’exploration du monalizumab comme nouvel inhibiteur de point de contrôle immunitaire à large spectre, avec un effet en parallèle sur les cellules NK et T (Figure 1).
Parallèlement à l’avènement des inhibiteurs de points de contrôle qui ciblent un signal inhibiteur, est apparue une seconde classe d’immunothérapie fondée sur l’utilisation d’anticorps bispécifiques qui stimulent les lymphocytes T endogènes et provoque l’élimination spécifique des cellules malignes en se fixant d’une part à un antigène tumoral et, d’autre part, au complexe multimoléculaire qu’est le récepteur de l’antigène des lymphocytes T (CD3/TCR), ou sur l’utilisation de lymphocytes génétiquement modifiés, appelés CAR-T (cellules T à récepteur antigénique chimérique). Il s’agit dans ce dernier cas d’une thérapie génique constituée de lymphocytes T autologues prélevés par leucophérèse puis génétiquement modifiés ex vivo pour leur faire exprimer un récepteur chimérique à l’antigène ciblant un antigène tumoral. Les cellules CAR-T réinjectées se multiplient et s’activent in vivo après leur liaison aux cellules cibles exprimant l’antigène tumoral, conduisant à l’élimination de ces dernières. Des résultats cliniques sans précédent ont été observés dans certains cancers hématologiques, tels que la leucémie aiguë lymphoblastique à précurseurs B et le lymphome diffus à grandes cellules B réfractaire ou en rechute avec l’utilisation de CAR-T anti-CD19 (Yescarta® et Kymriah®). Quelques années auparavant, l’utilisation couronnée de succès du blinatumomab dans la LAL-B, un AcM bispécifique se liant à la protéine CD19 et à la protéine CD3, avait ouvert la voie à ce type de ciblage par CAR-T. Cependant, ces thérapies sont limitées par leur toxicité avec notamment l’apparition du syndrome de relargage des cytokines et un syndrome d’encéphalopathie. De plus, le contrôle des tumeurs solides par ce type d’approche reste un défi [4, 5]. Afin de limiter la toxicité associée à l’engagement des lymphocytes T, de nouvelles stratégies évaluent le recrutement des cellules cytotoxiques de l’immunité innée, les cellules NK. Une illustration de la différence entre lymphocytes T et NK vient de l’observation que l’infusion de lymphocytes NK n’induit pas d’attaque du greffon contre l’hôte chez les patients dans des conditions allogéniques [6]. De plus, la fréquence des cellules NK représente environ 10 % des lymphocytes T, ce qui limite les risques de syndrome de relargage des cytokines. Les lymphocytes NK expriment plusieurs récepteurs activateurs qui peuvent être ciblés pour induire une immunité anti-tumorale exercée par les cellules NK, tels que CD16 (RFcgIIIa), ceux de la famille des récepteurs apparentés aux lectines de type C (NKG2D et CD94/NKG2C) ou ceux de la famille des récepteurs de cytotoxicité naturelle (NKp30, NKp44, and NKp46). Ces derniers appartiennent à la superfamille des Ig et s’associent à des protéines adaptatrices contenant des motifs ITAM (immunoreceptor tyrosine-based activation motif) permettant de transduire un signal positif aux cellules NK. NKp46 est le marqueur le plus spécifique des cellules NK humaines et il joue un rôle majeur dans la reconnaissance des cellules tumorales. Il est exprimé de manière stable par toutes les cellules NK matures, y compris par les cellules NK infiltrant les tumeurs solides, ainsi que dans de rares sous-populations de lymphocytes Tαβ et Tγδ et de cellules innées lymphoïdes ILC1 et ILC3 [2]. Les ligands de NKp46 exprimés sur les cellules normales et tumorales n’ont pas encore été identifiés, mais plusieurs ligands solubles et des ligands d’origine bactérienne ont récemment été décrits [7]. L’engagement de NKp46 induit une activité cytotoxique des cellules NK, ainsi qu’une sécrétion de cytokines.
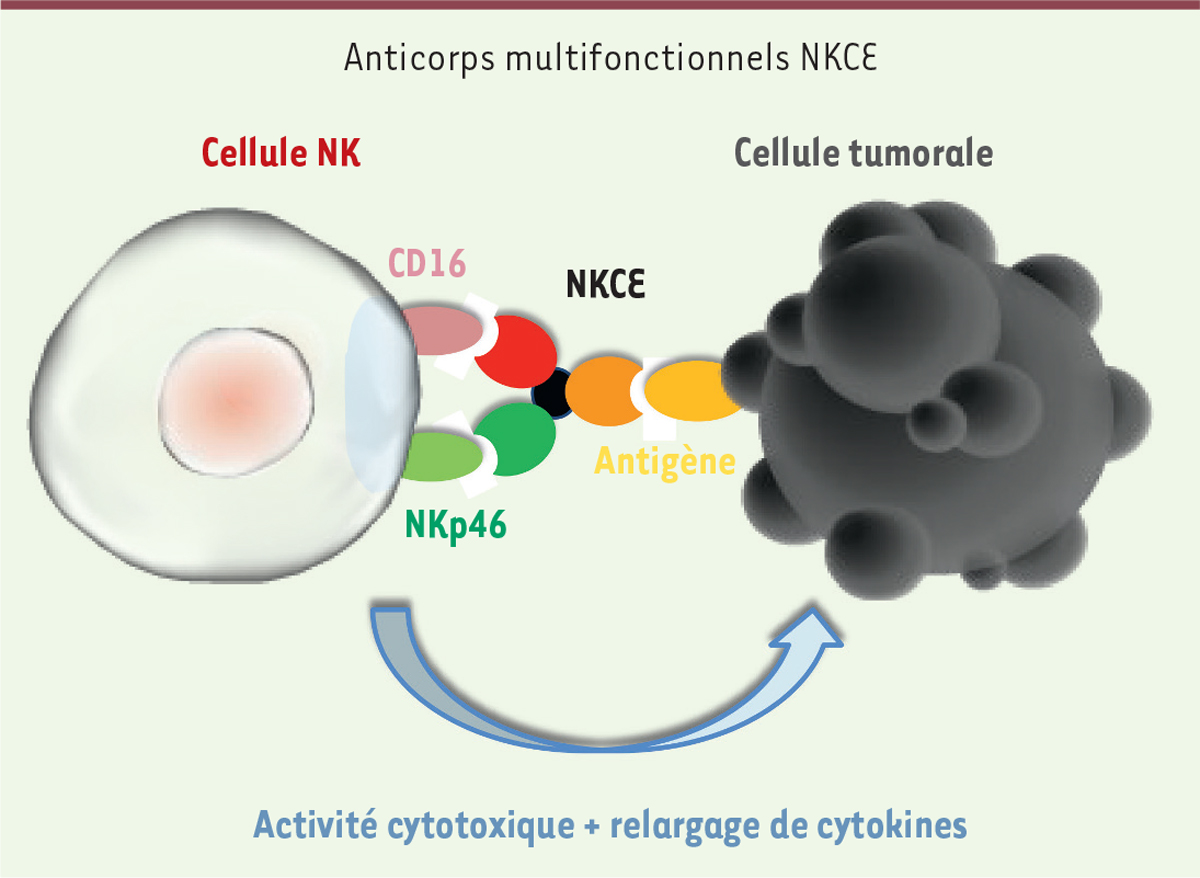
Dans l’étude de Gauthier et al.[8], nous avons généré différents formats d’anticorps multifonctionnels, les NKp46 NKCE (NKp46 NK cell engagers) se liant d’une part à un antigène exprimé à la surface de cellules tumorales, et, d’autre part, au récepteur NKp46 présent sur les cellules NK. Cette liaison déclenche l’activation et la destruction des cellules tumorales par les cellules NK. Les NKCE ne sont actifs qu’en présence des cellules tumorales, ce qui suggère que le risque de relargage de cytokines de façon non spécifique est faible. Cependant, les modèles in vitro et in vivo ne sont pas toujours prédictifs de la toxicité et encore moins de l’immunogénicité des anticorps observées chez l’homme. Nous avons également montré que l’engagement de NKp46 et de CD16a est synergique pour induire l’activation des cellules NK et la lyse tumorale et est plus efficace dans des essais in vivo que des formats d’anticorps classiques (en testant le rituximab, un anticorps anti-CD20) ou d’anticorps ayant une région Fc optimisée pour l’engagement du CD16a (en testant l’obinutuzumab, un anticorps anti-CD20). Ces résultats précliniques sont en faveur du développement clinique des anticorps multifonctionnels NKCE engageant NKp46 comme nouvelle immunothérapie dans le traitement contre le cancer (Figure 2).