| |
| Med Sci (Paris). 35(12): 1014–1016. doi: 10.1051/medsci/2019224.Place des anticorps thérapeutiques dans les maladies
cardiovasculaires et métaboliques aujourd’hui Denis Angoulvant1* and Atul Pathak2 1Service de cardiologie CHRU de Tours et EA4245, Loire Valley
Cardiovascular collaboration et Labex MabImprove, Université de
Tours, Tours, France 2Unité d’hypertension artérielle, facteurs de risque et
insuffisance cardiaque, Inserm U. 1048, Clinique Pasteur,
Toulouse,
France |
L’arrivée des anticorps thérapeutiques dans les domaines cardiovasculaire et métabolique
s’est fait attendre puisque qu’il n’y a actuellement que très peu d’indications
reconnues. Il faut toutefois garder en mémoire que c’est dans le domaine de la thrombose
coronaire que l’un des premiers Fab, issu d’un anticorps monoclonal, l’abciximab, est
utilisé depuis 1994 [1]. Un autre
Fab, dérivé d’anticorps polyclonaux de mouton, dirigé contre la digoxine
(Digifab®) est utilisé depuis 1976 pour les intoxications grave à la
digitaline [2]. Depuis le début
des années 2000, plusieurs cibles ont été identifiées comme étant susceptibles de
modifier le pronostic des patients atteints de troubles du métabolisme lipido-glucidique
et d’athérosclérose. Une autre approche s’est intéressée à la modulation de
l’inflammation en cause dans les lésions du myocarde au décours d’un infarctus. |
Pas d’indication pour les anticorps ciblant l’ischémie myocardique Des anticorps monoclonaux (AcM) dirigés contre des cibles en lien avec la réponse
inflammatoire post-ischémie myocardique ont été testés ces dernières années. Le
pexélizumab, dirigé contre le composant C5 du complément, n’a pas montré de bénéfice
sur la cardiopathie ischémique [3]. Pas plus que le rovélizumab et l’erlizumab, dirigés contre les
récepteurs des intégrines CD11/CD18 [4,5]. En
revanche, dans un essai de phase III de petite taille, l’inclacumab, dirigé contre
la sélectine P, injecté en phase aiguë, a entraîné une réduction de la taille
d’infarctus du myocarde sans démonstration d’un bénéfice sur les événements
cliniques [6]. Plus
récemment, le tocilizumab, un anticorps anti-IL (interleukine)-6, a également été
testé contre un placebo chez des patients ayant présenté un infarctus du myocarde,
sans montrer de bénéfice clinique [7]. L’étude RITA-MI (NCT03072199) teste actuellement la sécurité d’emploi du rituximab
chez des patients pris en charge à la phase aiguë d’un infarctus du myocarde.
L’objectif de ce traitement étant d’induire une déplétion en lymphocytes B afin de
moduler la réponse inflammatoire et le remodelage myocardique post-infarctus. |
Moduler l’inflammation pour réduire les complications de l’athérosclérose
coronaire L’IL-1β est une cytokine pro-inflammatoire impliquée dans de nombreux processus
pathologiques et, notamment, dans les phénomènes de progression de l’athérosclérose.
Le canakinumab, un AcM qui se lie à l’IL-1β et neutralise sa fixation à ses
récepteurs a été comparé à un placebo dans l’étude CANTOS, chez 10 061 patients
ayant eu un infarctus du myocarde et présentant un phénotype inflammatoire défini
par un dosage de la protéine C réactive (CRP) très sensible, supérieur ou égal à 2
mg/L [8]. Une diminution des
événements cliniques (infarctus du myocarde, revascularisation, arrêt cardiaque) a
été observée chez les patients ayant reçu une dose de 150 mg de canakinumab,
réduction proportionnelle à la baisse de la CRP. Les données de tolérance ont montré
une augmentation significative des infections fatales, expliquée en partie par une
incidence significativement plus importante de leucopénie. En revanche, une
réduction statistiquement significative des décès par cancer est observée. Cette
réduction est majoritairement liée à une moindre incidence des cancers pulmonaires
et des décès liés à ces cancers, dont le lien avec la signalisation inflammatoire
dépendant de l’IL-1β avait été décrit dans les modèles expérimentaux [9]. Il n’y a actuellement pas
d’indication à utiliser le canakinumab, ni aucun autre inhibiteur de l’IL-1β, chez
ces patients. |
La success story des anticorps anti-PCSK9 En 2003, une équipe de chercheurs franco-libano-canadiens, dirigée par Catherine
Boileau, démontre l’implication du gène codant la protéine PCSK9 (proprotein
convertase subtilisin/kexin de type 9) dans une forme rare
d’hypercholestérolémie familiale [10]. Il s’agissait d’un gain de fonction de cette protéine impliquée
dans la dégradation du récepteur du LDL (lipoprotéine de faible densité) cholestérol
(Figure 1). Plusieurs
stratégies d’inhibition de PCSK9 ont alors été développées (Figure 2). Trois AcM dirigés contre
PCSK9 atteignent, quelques années plus tard, le stade des essais de morbi-mortalité.
Tous entraînent des réductions du LDL cholestérol de l’ordre de 60 % de plus que
celles observées avec les traitements de référence que sont les statines et
l’ézétimibe. L’évolocumab sera le premier à montrer une diminution des événements
cliniques dans un essai de phase III (étude FOURIER) qui incluait 27 564 patients en
prévention secondaire de l’athérosclérose symptomatique [11]. L’alirocumab suivra avec l’étude ODYSSEY
OUTCOMES qui montrera également une diminution des événements cliniques chez 18 924
patients en post-infarctus du myocarde [12]. Le troisième anticorps anti-PCSK9, le bococizumab,
connaîtra un destin moins favorable en raison de l‘apparition d’anticorps
neutralisants chez les patients, conduisant à un arrêt prématuré des études et de
son développement [13].
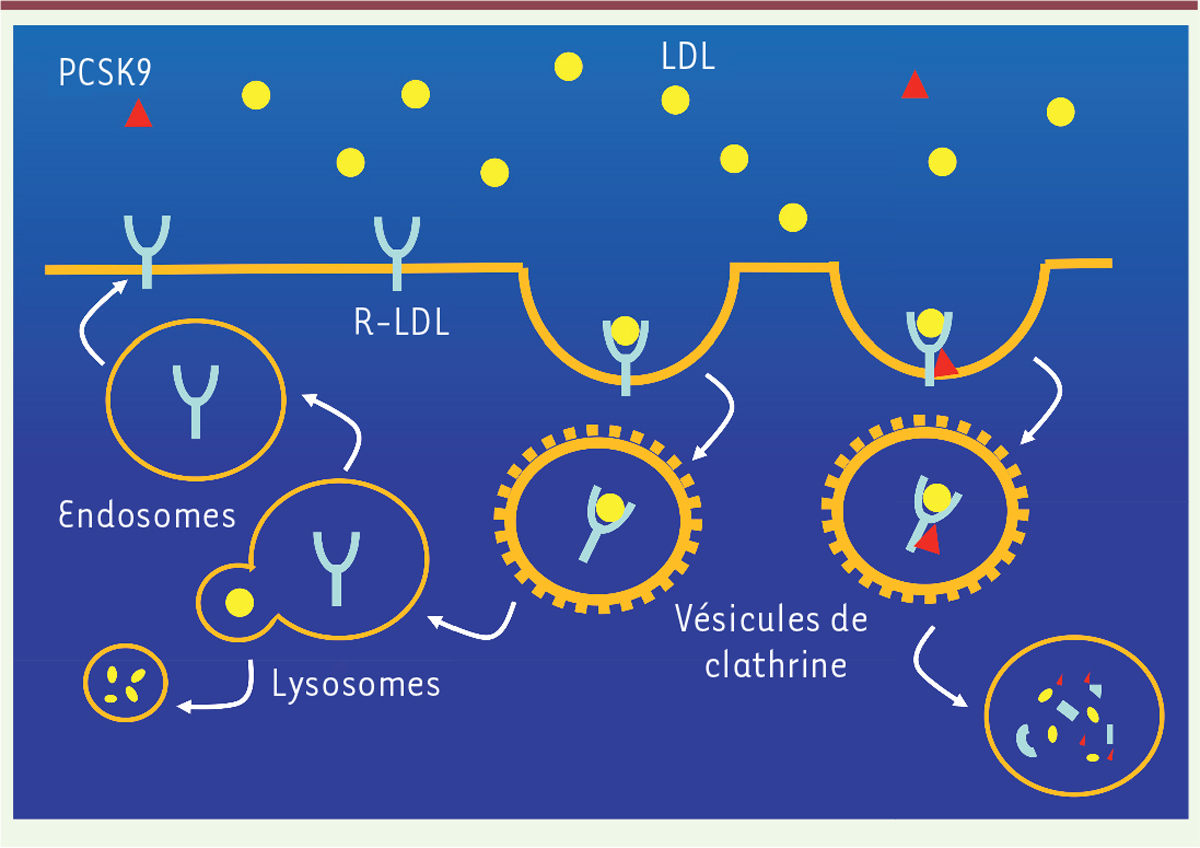
 | Figure 1. PCSK9 (proprotein convertase subtilisin/kexin de type 9)
est une protéine sécrétée notamment par les
hépatocytes. Lorsque PCSK9 se fixe au récepteur
des LDL (R-LDL), le complexe R-LDL/LDL formé sera internalisé et PCSK9
sera dégradé dans les lysosomes. Cela empêche qu’il soit recyclé vers la
membrane cellulaire pour capter une autre molécule de LDL. |
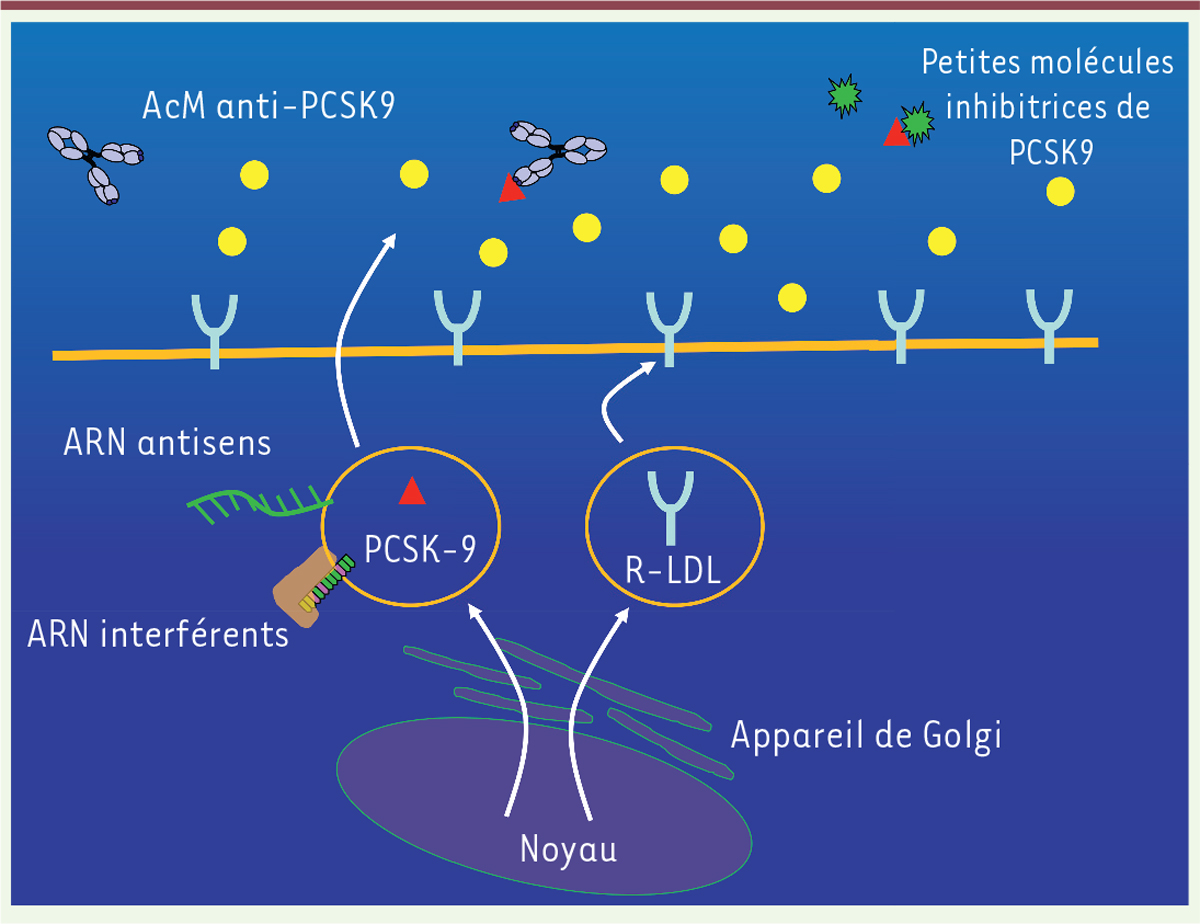
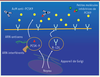 | Figure 2. Différentes stratégies d’inhibition de PCSK9 (proprotein
convertase subtilisin/kexin de type 9) sont actuellement
étudiées. Les AcM sont les seuls à avoir atteint
les essais de morbi-mortalité de phase III. Les petites protéines
inhibitrices ou les molécules ciblant la synthèse intracellulaire de
PCSK9 (ARN interférents ou ARN antisens) sont en cours d’évaluation. |
L’alirocumab et l’évolocumab, administrés par voie sous-cutanée tous les 15 jours,
ayant démontré leur efficacité clinique et leur excellente tolérance, ont tous deux
obtenus des indications de l’Agence européenne des médicaments dans différentes
situations cliniques. L’évolocumab (Repatha®) est indiqué en prévention
primaire dans l’hypercholestérolémie familiale homozygote à partir de 12 ans et dans
les autres formes d’hypercholestérolémies (hypercholestérolémies familiales
hétérozygotes et non familiales) en association aux autres hypolipémiants, si le
taux de LDL n’est pas suffisamment réduit. Il est également indiqué en prévention
secondaire des complications de l’athérosclérose. L’alirocumab
(Praluent®) est actuellement indiqué uniquement dans les
hypercholestérolémies (hypercholestérolémies familiales hétérozygotes et non
familiales) en association aux autres hypolipémiants, également si le taux de LDL
n’est pas suffisamment réduit. Les résultats récents de l’étude ODYSSEY OUTCOMES
devraient permettre une extension de son indication en prévention secondaire. En
France, le remboursement par l’Assurance Maladie reste restreint aux cas
d’hypercholestérolémie familiale homozygote pour l’évolocumab, et
d’hypercholestérolémie familiale hétérozygote éligible à la LDL aphérèse, pour
l’alirocumab. À noter que d’autres stratégies d’inhibition de la protéine PCSK9 sont
en cours d’investigation dans des études de phase III, comme l’inclisiran, un ARN
interférent administré tous les 3 à 6 mois [14]. |
Nouvelles cibles dans le diabète Deux anticorps anti-CD3 ont été testés chez des patients présentant un diabète de
type 1 d’installation récente. L’otélixizumab et le téplizumab ont montré des signes
encourageants, avec une réduction des doses d’insuline nécessaires [15]. Il n’y a cependant actuellement
pas d’indication pour ces anticorps dans le diabète. |
Les maladies cardiovasculaires et métaboliques constituent un champ thérapeutique
d’avenir pour les AcM. Ceci en raison notamment du nombre très important de patients
susceptibles de bénéficier de ces traitements sur des durées prolongées. C’est
également cet aspect qui peut apparaître comme un frein à leur utilisation, compte
tenu du coût élevé de ces traitements utilisés à grande échelle. Il est clair
aujourd’hui que l’identification de nouvelles cibles thérapeutiques visant à
protéger le système cardiovasculaire et/ou à corriger des désordres
lipido-glucidiques conduit les chercheurs à envisager une solution de modulation de
ces cibles notamment via les AcM. |
D. Angoulvant déclare avoir participé comme investigateur aux études sur
l›evolocumab, l’alirocumab et le bococizumab. Il déclare également avoir été
rémunéré pour des actions de communications et de conseil pour les laboratoires
Amgen, Sanofi et Pfizer. A. Pathak déclare avoir été rémunéré pour des actions
de communications et de conseil pour les laboratoires Amgen et Sanofi et
Pfizer.
|
1. Investigators EPIC .
Use of a monoclonal antibody directed against the platelet
glycoprotein IIb/IIIa receptor in high-risk coronary
angioplasty . N Engl J Med.
1994; ; 330:
:956.–961. 2. Smith
TW,
Haber
E,
Yeatman
L, et al.
Reversal of advanced digoxin intoxication with Fab fragments of
digoxin-specific antibodies . N Engl J
Med.
1976; ; 294:
:797.–800. 3. Testa
L, Van
Gaal
WJ,
Bhindi
R, et al.
Pexelizumab in ischemic heart disease: a systematic review and
meta-analysis on 15,196 patients . J Thorac
Cardiovasc Surg.
2008; ; 136:
:884.–893. 4. Baran
KW,
Nguyen
M,
McKendall
GR, et al.
Double-blind, randomized trial of an anti-CD18 antibody in
conjunction with recombinant tissue plasminogen activator for acute
myocardial infarction: limitation of myocardial infarction following
thrombolysis in acute myocardial infarction (LIMIT AMI)
study . Circulation.
2001; ; 104:
:2778.–2783. 5. Rusnak
JM,
Kopecky
SL,
Clements
IP, et al.
An anti-CD11/CD18 monoclonal antibody in patients with acute
myocardial infarction having percutaneous transluminal coronary angioplasty
(the FESTIVAL study) . Am J
Cardiol.
2001; ; 88:
:482.–487. 6. Stähli
BE,
Gebhard
C,
Duchatelle
V, et al.
Effects of the P-selectin antagonist Inclacumab on myocardial
damage after percutaneous coronary intervention according to timing of
infusion: Insights from the SELECT-ACS trial .
J Am Heart Assoc.
2016;; 5. 7. Carroll
MB,
Haller
C,
Smith
C. Short-term
application of tocilizumab during myocardial infarction
(STAT-MI) . Rheumatol Int.
2018; ; 38:
:59.–66. 8. Ridker
PM,
Everett
BM,
Thuren
T, et al.
Antiinflammatory therapy with Canakinumab for atherosclerotic
disease . N Engl J Med.
2017; ; 377:
:1119.–1131. 9. Ridker
PM,
MacFadyen
JG,
Thuren
T, et al.
Effect of interleukin-1β inhibition with canakinumab on incident
lung cancer in patients with atherosclerosis: exploratory results from a
randomised, double-blind, placebo-controlled trial .
Lancet.
2017; ; 390:
:1833.–1842. 10. Abifadel
M,
Varret
M,
Rabès
JP, et al.
Mutations in PCSK9 cause autosomal dominant
hypercholesterolemia . Nat
Genet.
2003; ; 34: :1546.. 11. Sabatine
MS,
Giugliano
RP,
Keech
AC, et al.
Evolocumab and clinical outcomes in patients with cardiovascular
disease . N Engl J Med.
2017; ; 376: (17):
:1322.. 12. Schwartz
GG,
Steg
PG,
Szarek
M, et al.
Alirocumab and cardiovascular outcomes after acute coronary
syndrome . N Engl J Med.
2018; ; 379:
:2097.–2107. 13. Ridker
PM,
Revkin
J,
Amarenco
P, et al.
Cardiovascular efficacy and safety of Bococizumab in high-risk
patients . N Engl J Med.
2017; ; 376:
:1527.–1539. 14. Stoekenbroek
RM,
Kallend
D,
Wijngaard
PL, et al.
Inclisiran for the treatment of cardiovascular disease: the ORION
clinical development program . Future
Cardiol.
2018; ; 14:
:433.–442. 15. Daifotis
AG,
Koenig
S,
Chatenoud
L, et al.
Anti-CD3 clinical trials in type 1 diabetes
mellitus . Clin Immunol.
2013; ; 149:
:268.–278. |