| |
| Med Sci (Paris). 35(12): 1017–1021. doi: 10.1051/medsci/2019201.Anticorps monoclonaux thérapeutiques En dermatologie aussi ! Aurélie Du-Thanh1,2* and Bernard Guillot1,2 1Univ Montpellier, Département de dermatologie, Hôpital
Saint-Eloi, CHU de Montpellier, 80 avenue Augustin Fliche,
34295Montpellier,
France 2Inserm 1058, Pathogenèse et contrôle des infections
chroniques (PCCI), 34394Montpellier,
France |
Dans son livre, la jeune médecin généraliste Jaddo décrit avec humour ses difficultés à
différencier eczéma et psoriasis [1]: « Quel que soit le diagnostic, ça se finira avec des corticoïdes locaux.
Alors bon à quoi bon ? ». Jaddo pourra-t-elle bientôt écrire que, quel que soit le
diagnostic, ça se finira avec des anticorps monoclonaux (AcM) thérapeutiques ? Pourtant
déjà bien installés en dermatologie (hospitalière), les AcM soulèvent encore la question
de leur coût et de leur innocuité à long terme (malgré une tolérance immédiate
satisfaisante), car, pour la plupart des médecins, les dermatoses inflammatoires
chroniques sont sans enjeu vital, et n’ont peu, voire pas, d’enjeu fonctionnel. Les
trois cas avérés et une suspicion de leucoencéphalopathie multifocale progressive
(LEMP)1 [2] chez des patients psoriasiques après traitement ont entraîné le
retrait du marché de l’éfalizumab en 2009, alors que ce risque est mieux accepté face à
une maladie de Crohn ou une polyarthrite rhumatoïde. Pourtant, l’impact des dermatoses
chroniques sévères sur la qualité de vie est important. La peau est en effet un organe à
la fois social et intime ; les maladies de peau, parfois défigurantes, et douloureuses
(tout comme leurs traitements topiques), sont au 4e rang mondial des
pathologies reconnues comme affectant le plus la qualité de vie [3]. Une méta-analyse récente met ainsi en évidence
une augmentation des tendances suicidaires chez les patients atteints de dermatite
atopique (DA) [4] et les
co-morbidités cardiovasculaires directement liées au psoriasis cutané encouragent sa
prise en charge active [5]. |
Trois exemples d’utilisation des anticorps monoclonaux thérapeutiques en
dermatologie inflammatoire Parmi les AcM thérapeutiques utilisés en dermatologie inflammatoire, la majorité sont
indiqués dans le psoriasis. Dans l’acné, pourtant première dermatose chronique en
France, les AcM ne seront utilisés que dans les formes syndromiques sévères de la
maladie et hors autorisation de mise sur le marché (AMM). Dans la dermatite atopique
et l’urticaire chronique spontanée (UCS), ils sont d’utilisation plus récente mais
tout aussi prometteurs. Les anticorps monoclonaux thérapeutiques dans l’eczéma/la dermatite
atopique La dermatite atopique est une dermatose inflammatoire chronique affectant
majoritairement les enfants mais également 4,52 % des adultes français de plus
de 15 ans, soit plus de 2 millions de personnes [ 3]. Elle se caractérise par des lésions cutanées
érythémato-vésiculeuses, prurigineuses, avec des topographies variables, y
compris les mains et le visage, selon l’âge. Des co-morbidités peuvent s’y
associer: asthme, rhinite allergique, etc. La gêne ressentie est « très ou assez
importante » dans la vie personnelle chez 50,3 % des patients et dans le cadre
professionnel chez 45,3 %. Comparé à la population générale, le score EQ-5D 2, montre une altération significative de la
qualité de vie des personnes souffrant d’eczéma [ 3]. Environ 100 000 personnes souffrent de formes sévères de
dermatite atopique, soit 6 % des patients. Au moins 3 grands acteurs semblent
être impliqués dans la physiopathologie de cette maladie et se potentialiser les
uns les autres: un défaut structurel de la barrière cutanée (avec, entre autres,
des mutations du gène codant la filaggrine 3
chez 1/3 des patients), une polarisation Th2 des lymphocytes avec une
sur-expression des IL(interleukines)-4 et 13, et une dysbiose du microbiote de
surface avec prédominance de Staphylococcus aureus [ 6]. Le dupilumab
(Dupixent) est le premier AcM disponible dans la dermatite atopique modérée à
sévère de l’adulte, en 2e ligne après la ciclosporine. Il s’agit d’un anticorps
humain de sous-classe IgG1 dirigé contre la sous-unité alpha du récepteur de
l’IL-4, capable de bloquer les voies de signalisation dépendant de l’IL-4 et de
l’IL-13 4. Il s’administre par voie
sous-cutanée à la posologie de 300 mg tous les 14 jours après une dose de charge
de 600 mg. Le dupilumab a obtenu l’AMM en France en février 2018 après les
études pivotales industrielles LIBERTY AD SOLO 1 & 2 et LIBERTY AD CHRONOS,
qui ont montré pour la première fois son efficacité [ 7, 8] en termes d’activité de la dermatite atopique (
Tableau I) et de qualité de
vie. Ces 3 études avaient pour critères de jugement une amélioration
significative des scores d’activité de la maladie comme l’IGA
( investigator global assessment) 0/1 et/ou un score EASI
( eczema area severity index) amélioré d’au moins 75 %.
Seuls variaient la durée de l’étude (16 ou 52 semaines), la possibilité
d’utiliser des traitements topiques additionnels, y compris dans le groupe
placebo, et un traitement antérieur par ciclosporine. Dans l’étude LIBERTY AD
CHRONOS, menée sur 52 semaines chez 740 patients atteints de dermatite atopique
modérée à sévère également traités par dermocorticoïdes, le bon résultat obtenu
sous deux doses différentes de dupilumab à la 16e semaine de traitement s’est
maintenu durant les 36 semaines restantes. Seuls 13 et 14 % des patients sous
dupilumab ont présenté des poussées pendant les 52 semaines (contre 41 % des
patients sous placebo, pourtant traités par dermocorticoïdes). La tolérance a
été jugée satisfaisante malgré 15 % de conjonctivites au total, contre 38 % dans
une étude française en vie réelle [ 9], retrouvant aussi une éosinophilie supérieure à 500
cellules/mm3, asymptomatique de signification indéterminée, chez 57 % des 241
patients de cette étude. Dans les recommandations européennes, le dupilumab
figure au même rang que les traitements immunosuppresseurs pour les formes
sévères de dermatite atopique de l’adulte [ 10]. D’autres AcM thérapeutiques sont en
cours d’étude, tels que des AcM dirigés spécifiquement contre les cytokines de
type Th2 (IL-4, IL-13, IL-5, IL-31), mais aussi, en particulier, un anticorps
anti-IL-17 (déjà disponible pour le psoriasis, intéressant pour certaines formes
cliniques de dermatite atopique), et un anticorps anti-TSLP (lymphopoïétine
stromale thymique). Les cibles thérapeutiques sont donc multiples et
probablement combinables.
Tableau I.
| Nom de l’étude |
N |
Durée de l’étude (semaines) |
Traitements topiques
systématiques |
Obtention de l’EASI 75 à 156
(%) |
Obtention IGA 0/1 à 156 ou -2
points (%) |
Survenue d’une conjonctivite |
Références |
| Dupilumab (2 doses) |
Placebo |
Dupilumab (2 doses) |
Placebo |
Dupilumab (2 doses) |
Placebo |
| Liberty ad solo 1 et 2 |
1 379 |
16 |
non |
44-51 |
12-15 |
36-38 |
10 |
10 |
2,7 |
[7] |
|
| Liberty ad chronos |
740 |
52 |
oui |
64-69 |
23 |
38,7-39,2 |
12,4 |
15,8 |
5,4 |
[8] |
|
| Liberty ad cafe |
325 |
16 |
oui |
59,1-62,6 |
29,6 |
NA |
NA |
16,4-28 |
11,1 |
[19] |
Résumé des principales études pivotales concernant le
dupilumab dans la dermatite atopique.
|
|
Les anticorps monoclonaux thérapeutiques dans l’urticaire chronique
spontanée Si 20 % de la population générale aura au moins un épisode d’urticaire aiguë, moins
de 10 % développeront une urticaire chronique (UC) qui durera au moins 6 semaines.
Aiguë ou chronique, l’urticaire se manifeste par des plaques érythémateuses et
œdémateuses prurigineuses et/ou des angiœdèmes, fugaces et mobiles. L’impact de l’UC
sur la qualité de vie est majeur, avec des scores de qualité de vie comparables à
ceux des insuffisants coronariens [11]. Depuis 2015, les patients adultes et
adolescents à partir de 12 ans, avec une UC spontanée rebelle aux anti-histaminiques
seuls (environ 10 % des cas) peuvent bénéficier d’un traitement additionnel par
omalizumab (Xolair®) 300 mg par voie sous-cutanée toutes les 4 semaines.
Il s’agit d’un anticorps monoclonal humanisé de sous-classe IgG1 anti-IgE, dont le
mécanisme d’action est mal compris dans l’UC : il préviendrait la dégranulation
mastocytaire par internalisation des récepteurs de la région Fc des IgE de type I
(RFceI) non occupés [12]. Trois études pivotales industrielles, ASTERIA I et II et
GLACIAL [13-15], ont permis de montrer son efficacité et sa bonne tolérance chez 978
patients urticariens. Les critères de jugement comportaient des scores d’activité,
tels que l’UAS (urticaria activity score) et le score de sévérité
du prurit (ISS, itch severity score). Dans le groupe de patients
traités par omalizumab à 300 mg, l’amélioration des scores a été significative par
rapport au placebo (Tableau
II). Dans les recommandations internationales sur l’urticaire
chronique de 2018, l’omalizumab figure en 3e ligne de traitement, après
échec des anti-histaminiques (1re ligne), des anti-histaminiques à
posologie augmentée (2e ligne) [16]. D’autres molécules sont en cours de
développement et/ou d’étude dans l’urticaire chronique, comme le ligélizumab
(NCT03580356).
Tableau II.
| Nom de l’étude |
N |
Durée de l’étude (semaines) |
Amélioration du score ISS
à la semaine 12 |
Amélioration du score UAS7à la
semaine 12 |
Références |
| OMA 300 mg/4 semaines |
Placebo |
OMA 300 mg/4 semaines |
Placebo |
| Asteria I |
319 |
24 |
– 9,4 |
– 3,63 |
– 20,75 |
– 8 |
[13] |
|
| Asteria II |
323 |
12 |
– 9,8 |
– 5,1 |
66 % UAS7 < 6 |
19 % UAS < 6 |
[14] |
|
| Glacial |
336 |
24 |
– 8,6 |
– 4 |
– 19 |
– 8,5 |
[15] |
Résumé des principales études pivotales concernant
l’omalizumab dans l’urticaire chronique spontanée.
|
|
Les anticorps monoclonaux thérapeutiques dans les angiœdèmes héréditaires L’angiœdème héréditaire, dû à un déficit en inhibiteur de la C1 estérase (C1
inhibiteur, C1-INH), est une maladie rare (1 naissance sur 50 000, en Italie)
caractérisée par la survenue imprévisible de crises d’angiœdème de topographie
variable, y compris au niveau de la muqueuse intestinale. L’atteinte laryngée
touchera la moitié des patients au moins une fois et sera létale sans traitement
dans 25 % des cas [17]. Il s’agit d’une affection autosomique dominante par mutation
du gène SERPING1 codant le C1-INH. La forme mutée de C1-INH
n’exerce plus son contrôle négatif sur la production de bradykinine par les
kininogénases5. Cette surproduction de
bradykinine entraîne alors une extravasation plasmatique brutale par fixation à des
récepteurs membranaires endothéliaux, responsable des symptômes. La prophylaxie à
long terme des crises est proposée en cas de crises fréquentes (plus de 5 par an en
France,
Tableau III
), mais l’utilisation au long cours des molécules disponibles est parfois
problématique chez certains patients avec des antécédents thromboemboliques ou avec
un capital veineux appauvri. Le lanadélumab, un AcM humain dirigé contre la
kallikréine inhibe son action protéolytique sur le kininogène de haute masse
moléculaire. Il prévient donc la formation excessive de bradykinine (Figure 1). Il est administré à la
posologie de 300 mg toutes les 2 semaines par voie sous-cutanée, actuellement en
phase post-ATU (autorisation temporaire d’utilisation) de cohorte, chez les patients
de plus de 12 ans. L’étude HELP [18] a montré une diminution significative du nombre
mensuel de crises avec le lanadélumab versus placebo, passant
respectivement de 3,5 et 4 crises par mois à 0,26 (contre 1,97) avec une bonne
tolérance clinique immédiate, en dehors de douleurs aux points d’injection.
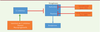 | Figure 1. Effet du lanadélumab. Le C1-INH (C1 inhibiteur) exerce un contrôle négatif sur les
kininogénases (dont la kallicréine) qui produisent la bradykinine
responsable des angiœdèmes. Le lanadélumab, un AcM humain dirigé contre
la kallicréine, inhibe son action protéolytique sur le kininogène de
haute masse moléculaire. Il prévient donc la formation excessive de
bradykinine chez les patients porteurs d’un déficit en C1-INH. |
Tableau III.
| Catégorie de population |
Prophylaxie à long terme si au moins 5 crises par
an |
| Femmes |
1. Macroprogestatifs per os (si en
âge de procréer)
2. Acide tranexamique per
os
3. Danazol per
os
4. Substitut de C1 inhibiteur intra-veineux
pluri-hebdomadaire |
|
| Femmes enceintes |
1. Acide tranexamique per
os
2. Substitut de C1 inhibiteur intra-veineux
pluri-hebdomadaire |
|
| Enfant |
1. Acide tranexamique per
os
2. Danazol per
os
3. Substitut de C1 inhibiteur intra-veineux
pluri-hebdomadaire |
|
| Hommes |
1. Acide tranexamique per
os
2. Danazol per
os
3. Substitut de C1 inhibiteur intra-veineux
pluri-hebdomadaire |
Prophylaxie à long terme dans l’angiœdème héréditaire avec
déficit en C1 inhibiteur.
|
|
En dermatologie inflammatoire, les AcM thérapeutiques sont toujours plus nombreux,
toujours plus performants. Des questions concernant leur place, leur coût, leur
innocuité à long terme, la durée du traitement, la définition de marqueurs
clinico-biologiques prédictifs de leur efficacité, se posent encore à l’heure où de
nouvelles molécules telles que les inhibiteurs de la kinase Janus font déjà leur
apparition dans le même champ de dermatoses. Leur utilisation et celle des
traitements topiques ou des anti-histaminiques ne sont pas mutuellement exclusives
dans l’eczéma et l’urticaire chronique, de même que le recours à l’éducation
thérapeutique du patient, qui devrait être un pré-requis à leur prescription pour
s’assurer d’abord de sa pertinence, puis de son optimisation. |
L’auteure est consultante ponctuelle pour les laboratoires Novartis, Sanofi,
Janssen, AbbVie. Elle a bénéficié de prises en charge de frais de
congrès.
|
Footnotes |
1. Jaddo .
Juste après dresseuse d’ours: les histoires brutes et
non romancées d’une jeune médecin généraliste .
Paris: : Fleuve
Éditions; , 2011: :304.
p. 2. Carson
KR,
Focosi
D,
Major
EO, et al.
Monoclonal antibody-associated progressive multifocal
leucoencephalopathy in patients treated with rituximab, natalizumab, and
efalizumab: a review from the research on adverse drug events and reports
(RADAR) project . Lancet
Oncol.
2009; ; 10:
:816.–824. 3. Richard
MA,
Corgibet
F,
Beylot-Barry
M, et al.
Sex- and age-adjusted prevalence estimates of five chronic
inflammatory skin diseases in France: results of the « objectifs peau »
study . J Eur Acad Dermatol
Venereol.
2018; ; 32:
:1967.–1971. 4. Sandhu
JK,
Wu
KK,
Bui
TL,
Armstrong
AW. Association
between atopic dermatitis and suicidality: A systematic review and
meta-analysis . JAMA
Dermatol.
2019; ; 155:
:178.–187. 5. Roubille
C,
Richer
V,
Starnino
T, et al.
The effects of tumour necrosis factor inhibitors, methotrexate,
non-steroidal anti-inflammatory drugs and corticosteroids on cardiovascular
events in rheumatoid arthritis, psoriasis and psoriatic arthritis: a
systematic review and meta-analysis . Ann
Rheum Dis.
2015; ; 74:
:480.–489. 6. Weidinger
S,
Novak
N. Atopic
dermatitis . Lancet.
2016; ; 387:
:1109.–1122. 7. Simpson
EL,
Bieber
T,
Guttman-Yassky
E, et al.
Two phase 3 trials of Dupilumab versus placebo in atopic
dermatitis . N Engl J Med.
2016; ; 375:
:2335.–2348. 8. Blauvelt
A, de
Bruin-Weller
M,
Gooderham
M, et al.
Long-term management of moderate-to-severe atopic dermatitis with
dupilumab and concomitant topical corticosteroids (liberty ad chronos): a
1-year, randomised, double-blinded, placebo-controlled, phase 3
trial . Lancet.
2017; ; 389:
:2287.–2303. 9. Faiz
S,
Giovannelli
J,
Podevin
C, et al.
Effectiveness and safety of dupilumab for the treatment of atopic
dermatitis in a real-life French multicenter adult cohort .
J Am Acad Dermatol.
2019; ; 81:
:143.–151. 10. Wollenberg
A,
Barbarot
S,
Bieber
T, et al.
Consensus-based European guidelines for treatment of atopic
eczema (atopic dermatitis) in adults and children: part II .
J Eur Acad Dermatol Venereol.
2018; ; 32:
:850.–878. 11. O’Donnell
BF,
Lawlor
F,
Simpson
J, et al.
The impact of chronic urticaria on the quality of
life . Br J Dermatol.
1997; ; 136:
:197.–201. 12. Chang
TW,
Chen
C,
Lin
CJ, et al.
The potential pharmacologic mechanisms of omalizumab in patients
with chronic spontaneous urticaria . J
Allergy Clin Immunol.
2015; ; 135:
:337.–342. 13. Saini
SS,
Bindslev-Jensen
C,
Maurer
M, et al.
Efficacy and safety of omalizumab in patients with chronic
idiopathic/spontaneous urticaria who remain symptomatic on H1
antihistamines: a randomized, placebo-controlled study .
J Invest Dermatol.
2015; ; 135:
:67.–75. 14. Maurer
M,
Rosén
K,
Hsieh
HJ, et al.
Omalizumab for the treatment of chronic idiopathic or spontaneous
urticaria . N Engl J Med.
2013; ; 368:
:924.–935. 15. Kaplan
A,
Ledford
D,
Ashby
M, et al.
Omalizumab in patients with symptomatic chronic
idiopathic/spontaneous urticaria despite standard combination
therapy . J Allergy Clin
Immunol.
2013; ; 132:
:101.–109. 16. Zuberbier
T,
Aberer
W,
Asero
R, et al.
The EAACI/GA²LEN/EDF/WAO guideline for the definition,
classification, diagnosis and management of urticaria .
Allergy.
2018; ; 73:
:1393.–1414. 17. Cicardi
M,
Aberer
W,
Banerji
A, et al.
Classification, diagnosis, and approach to treatment for
angioedema: consensus report from the Hereditary Angioedema International
Working Group . Allergy.
2014; ; 69:
:602.–616. 18. Banerji
A,
Riedl
MA,
Bernstein
JA, et al.
Effect of Lanadelumab compared with placebo on prevention of
hereditary angioedema attacks: a randomized clinical trial .
JAMA.
2018; ; 320:
:2108.–2121. 19. de
Bruin-Weller
M.. Time to get rid
of the investigator’s global assessment as the primary outcome for clinical
trials in atopic dermatitis ? . Br J
Dermatol.
2019; ; 181:
:12.–13. |