| |
| Med Sci (Paris). 35(12): 1029–1033. doi: 10.1051/medsci/2019204.Rhumatologie, la multitude des options Jacques Morel1* and Denis Mulleman2 1Département de rhumatologie, Université et CHU de
Montpellier ; UMR 5535, Institut de génétique moléculaire de Montpellier
(IGMM), Montpellier, France 2Université de Tours, EA 7501, Groupe insuffisance cardiaque
et cardiomyopathie (GICC), CHRU de Tours, Service de
rhumatologie, Tours, France |
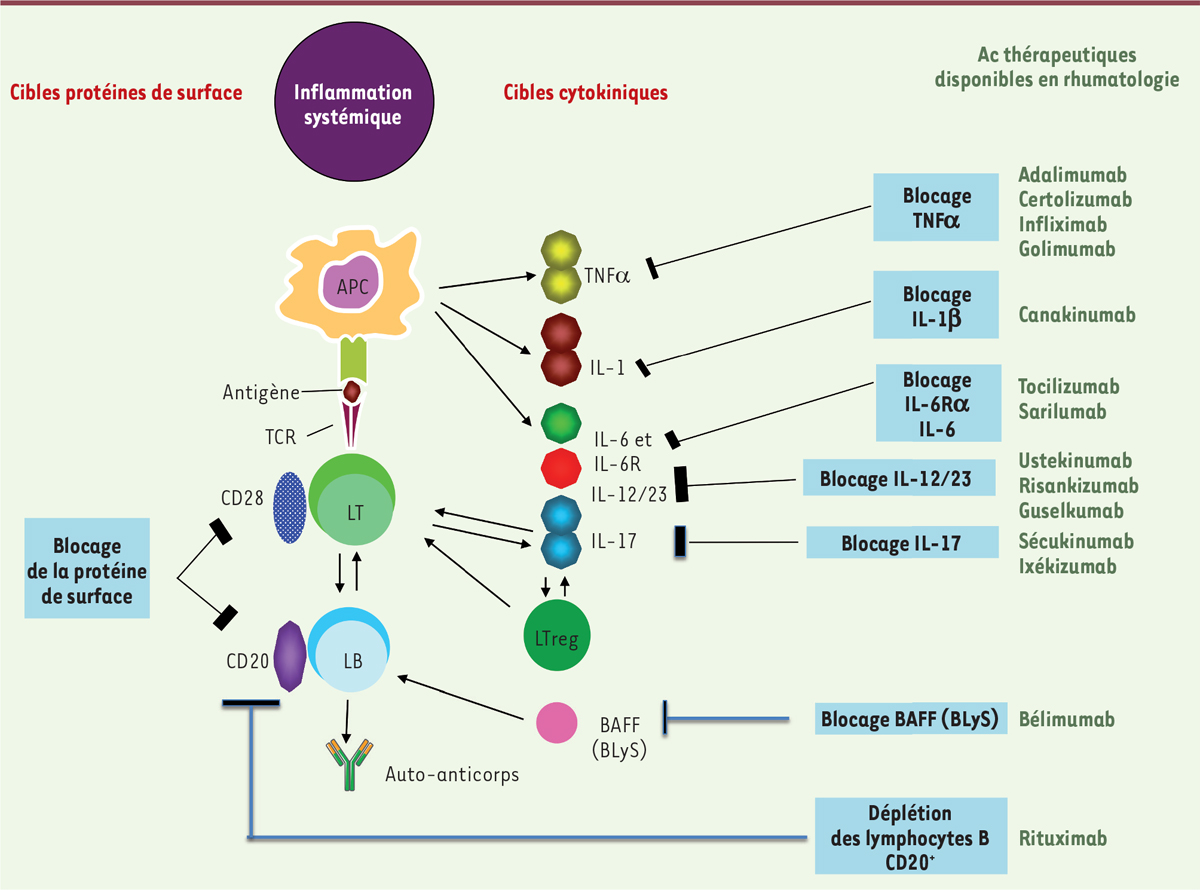
Une meilleure compréhension des mécanismes contrôlant l’immunité et l’inflammation a
permis d’identifier de nombreuses cibles thérapeutiques, telles que les cytokines, les
protéines de surface cellulaire ou les voies de signalisation intracellulaires [1]. À partir du concept simple
qu’un anticorps pouvait neutraliser une cible spécifique, associé aux progrès de la
biologie moléculaire qui ont permis d’envisager la synthèse et la modification
structurale d’anticorps monoclonaux (AcM), une nouvelle classe de médicament a ainsi vu
le jour: les biomédicaments. Cette nouvelle classe thérapeutique représente l’un des
progrès majeurs des XXe et xxi
e siècles, particulièrement en rhumatologie. Depuis 20 ans, le nombre
d’anticorps thérapeutiques disponibles en rhumatologie n’a cessé de croître et concerne
aussi bien les rhumatismes inflammatoires chroniques que les connectivites, les
vascularites et, dans une moindre mesure, les pathologies osseuses et l’arthrose. |
Anticorps thérapeutiques en rhumatologie Il existe actuellement deux principaux modes d’action des anticorps thérapeutiques
utilisés en rhumatologie. Le premier consiste à neutraliser une cytokine impliquée
dans l’immunité ou un facteur de croissance (Figure 1). Le premiers anticorps thérapeutique efficace
pour traiter les rhumatismes inflammatoires a été un anticorps dirigé contre le
TNF-a (tumor necrosis factor a) [2]. D’autres cytokines pro-inflammatoires ont
été ensuite ciblées comme l’interleukine (IL)-1β avec le canakinumab, ou l’IL-6. Des
anticorps dirigés contre leur récepteur, comme le tocilizumab ou le sarilumab, qui
reconnaissent le récepteur de l’IL-6, ont également été développés avec succès
[3]. D’autres cytokines
plus spécifiquement impliquées dans l’action des lymphocytes représentent également
des cibles d’intérêt telles que le B lymphocyte stimulator (BLyS).
Ainsi, un anticorps anti-BLyS (aussi appelé BAFF), le bélimumab, bloque l’activation
des lymphocytes B auto-réactifs [4]. Pour bloquer la voie des lymphocytes Th17, dont l’implication dans
les rhumatismes inflammatoires a été largement démontrée, il existe plusieurs
anticorps [5], dont certains
neutralisent directement une ou plusieurs isoformes de l’IL-17, comme le
sécukinumab, l’ixékizumab ou le bisékizumab. D’autres agissent plus en amont, en
bloquant un des récepteurs de l’IL-23 qui active la sécrétion d’IL-17 par les
lymphocytes Th17. L’ustékinumab agit ainsi sur la sous-unité p40 du récepteur,
tandis que le guselkumab et le risankizumab agissent sur sa sous-unité p19. Le
deuxième mode d’action consiste à cibler une molécule membranaire spécifique d’une
cellule qui peut soit réguler son activation, soit induire sa mort. Le rituximab
(RTX) est ainsi un anticorps dirigé contre la molécule de surface CD20 qui est
surtout exprimée sur les lymphocytes B après le stade pré-B et avant leur
différenciation en plasmocyte [6]. Le RTX induit une déplétion lymphocytaire B CD20+
prolongée sur plusieurs mois qui explique une efficacité durable et un retraitement
par RTX ne s’envisage pas avant 6 mois suivant le premier cycle de traitement.
 | Figure 1. Anticorps thérapeutiques disponibles en rhumatologie dans
les maladies inflammatoires à médiation immune.
En rouge: les cibles (inhibition de l’action d’une cytokine cible ou
d’un récepteur membranaire cible ou cytotoxicité [CD20]. En vert: les
anticorps thérapeutiques (DCI). |
|
Les anticorps thérapeutiques dans les rhumatismes inflammatoires
chroniques L’arrivée des biomédicaments a considérablement modifié la prise en charge des
rhumatismes inflammatoires chroniques comme la polyarthrite rhumatoïde (PR) et les
spondyloarthrites (SpA axiales ; rhumatisme psoriasique) avec, aujourd’hui, des
objectifs thérapeutiques plus ambitieux, tels que la rémission complète du
rhumatisme inflammatoire et l’épargne des traitements anti-inflammatoires
stéroïdiens et non stéroïdiens. Le premier anticorps thérapeutique à avoir obtenu une autorisation en rhumatologie a
été l’infliximab qui est un anticorps dirigé contre le TNF-a [7]. Du fait de leur grande efficacité sur les
douleurs et les gonflements des articulations, l’inflammation biologique et la
destruction articulaire observée dans la PR, d’autres AcM anti-TNF-a ont été
développés: adalimumab, certolizumab pegol, golimumab [8]. Cette efficacité démontrée d’abord dans la
PR sera ensuite élargie à d’autres rhumatismes inflammatoires chroniques, comme la
spondylarthrite ankylosante (SA), les spondyloarthrites non radiographiques, le
rhumatisme psoriasique, ou encore les arthrites juvéniles [9, 10]. Ce succès médical et commercial conduira au développement
de nombreux autres AcM. Ainsi, un anticorps monoclonal humanisé dirigé contre la
chaîne alpha du récepteur de l’IL-6, le tocilizumab (TCZ), démontrera d’abord son
efficacité dans la PR [11].
Ce biomédicament va bloquer à la fois l’activation directe de la cellule par l’IL-6
et l’activation indirecte par trans-signalisation. Dans la PR, le TCZ a montré une
efficacité au moins comparable à celle des anti-TNF-a. Depuis le TCZ, d’autres AcM
dirigés contre le récepteur de l’IL-6 ont été développés, comme le sarilumab qui
vient d’obtenir une autorisation de mise sur le marché (AMM) dans la PR [12]. Après les anticorps
anti-cytokines, la modulation des lymphocytes a été rendue possible grâce à la mise
à disposition du rituximab, un AcM initialement développé en hémato-oncologie, puis
testé avec efficacité dans la PR. Cet AcM chimérique entraîne une déplétion
périphérique lymphocytaire B qui s’accompagne souvent d’une diminution des
auto-anticorps, facteur rhumatoïde et anticorps anti-protéines citrullinées. Ces
anticorps thérapeutiques, une fois testés dans les rhumatismes inflammatoires
chroniques (RIC) sont ensuite souvent évalués dans d’autres maladies auto-immunes ou
inflammatoires. Ainsi, le rituximab est aujourd’hui proposé dans le traitement des
vascularites à ANCA (auto-anticorps anti-cytoplasmiques de neutrophiles) et le
tocilizumab dans l’artérite à cellules géantes [13, 14]. Les anticorps thérapeutiques permettent également d’apporter des informations
importantes sur l’implication des cytokines dans la physiopathologie des RIC [15]. En effet, si les
anti-TNF-a avaient démontré une efficacité aussi bien dans la PR que dans les SpA,
la neutralisation de l’IL-6 s’est avérée peu efficace dans les SpA [16]. Inversement, des anticorps ciblant
l’IL-17 se sont montrés peu efficaces dans la PR alors que leur efficacité a été
démontrée dans les SpA axiales et périphériques [17]. Deux anticorps anti-IL-17, le sécukinumab
et l’ixékizumab, ont en effet obtenu une AMM dans la spondylarthrite ankylosante et
le rhumatisme psoriasique [18]. Cette implication différente des cytokines IL-17 et IL-6 dans la PR
et les SpA n’est pas encore bien expliquée. Il est possible que ces cytokines
interviennent à des périodes différentes du développement du rhumatisme
inflammatoire. Une autre explication serait que l’IL-6 et l’IL-17 jouent un rôle
distinct dans le contrôle de la différenciation des lymphocytes T régulateurs.
Cibler la voie Th17 en neutralisant le récepteur de l’IL-23 avec l’ustékinumab, le
guselkumab et le risankizumab apparaît particulièrement efficace dans le rhumatisme
psoriasique qui s’exprime principalement par des manifestations articulaires
périphériques, même si l’atteinte axiale peut être observée [15]. Par contre, cibler le récepteur de l’IL-23 est inefficace
dans l’atteinte axiale des SpA. En effet, les essais thérapeutiques avec
l’ustékinumab, tout comme avec le risankizumab n’ont pas permis de démontrer une
efficacité dans la spondylarthrite ankylosante [19, 20]. Ces différences d’efficacité entre le ciblage direct de
l’IL-17 et le ciblage de l’IL-23 sur l’atteinte axiale restent actuellement une
énigme. Des études translationnelles pourraient permettre à l’avenir de préciser le
mécanisme physiopathologique de chacun de ces deux rhumatismes. |
Médecine personnalisée et prédictive, suivi thérapeutique pharmacologique Le principe du meilleur choix thérapeutique pour un patient donné
(personalized medicine) s’applique aux biomédicaments utilisés
dans les rhumatismes inflammatoires chroniques. La recherche de marqueurs cliniques
ou biologiques prédictifs de réponse à un traitement représente également un enjeu
de taille. Si certaines caractéristiques du patient ou de sa pathologie sont
associées à la réponse clinique à telle ou telle molécule, il n’existe pas pour le
moment de classification (patient stratification) pour définir
a priori quels patients atteints de la même maladie
inflammatoire chronique seraient plus répondeurs à un traitement plutôt qu’à un
autre. Ces dernières années, le suivi thérapeutique pharmacologique
(therapeutic drug monitoring, ou TDM) a connu un intérêt auprès
des sociétés savantes et des industriels pour essayer d’adapter au mieux la dose
d’anticorps thérapeutique à l’échelon individuel. C’est ainsi que la Société savante
européenne EULAR (european league against rheumatism) a créé en
2018 un groupe de travail sur ce sujet [21]. Le principe du TDM est d’ajuster la posologie d’une
molécule selon les caractéristiques du patient, comme par exemple l’activité de la
maladie, afin d’obtenir la concentration sérique de médicament souhaitée et ainsi
atteindre la réponse clinique. Cela présuppose qu’il existe une relation entre la
dose et la concentration du biomédicament (pharmacocinétique) et entre la
concentration et la réponse thérapeutique (relation
pharmacocinétique-pharmacodynamique). Il existe trois principaux arguments en faveur
du TDM des biomédicaments anti-TNF-a chez les patients atteints de rhumatismes
inflammatoires chroniques [22]. Premièrement, l’existence d’une variabilité pharmacocinétique. En
effet les concentrations d’AcM anti-TNF-a varient considérablement entre les
patients, certains présentant des concentrations indétectables, alors que d’autres
sont manifestement surexposés [23]. Deuxièmement, l’existence d’une relation concentration-réponse.
Celle-ci a largement été rapportée avec l’adalimumab dans la PR. Les patients ayant
obtenu une bonne réponse au traitement avaient des concentrations plus élevées que
les patients avec une réponse modérée ou ne présentant aucune réponse [24], suggérant que la
concentration est un des facteurs de réponse aux anticorps anti-TNF-a.
Troisièmement, un index thérapeutique étroit. En effet, une faible exposition lors
de l’initiation ou après une vacance thérapeutique est associée à un sur-risque de
développer des anticorps anti-médicaments (ADA pour anti-drug
antibodies), comme cela a été démontré avec l’infliximab dans la PR et
dans la spondyloarthrite [25, 26]. À
l’opposé, de fortes concentrations résiduelles d’infliximab sont associées à une
multiplication du risque de survenue d’infections d’un facteur 2 à 3 dans la SpA
[27] et d’un facteur
1,5 dans la PR [28]. L’objectif principal du TDM des anticorps thérapeutiques dans les rhumatismes
inflammatoires est d’améliorer la réponse clinique et la tolérance. Le TDM pourrait
également améliorer le rapport coût-efficacité [29]. Récemment, chez des patients traités par
adalimumab et ayant une concentration résiduelle supérieure à 8 μg/mL, il a été
démontré qu’espacer les injections toutes les trois semaines au lieu de deux
n’induisait pas de perte d’efficacité, suggérant la possibilité d’une économie
[30]. En utilisant un
modèle pharmacocinétique-pharmacodynamique pour décrire la relation
concentration-réponse, il a été possible de définir la concentration cible
nécessaire pour obtenir une faible activité de la PR selon le score DAS281 (disease activity score 28) en
prenant en compte l’activité de la maladie au moment de l’initiation du traitement.
Si cette approche est prometteuse afin d’établir une posologie individualisée, ce
résultat nécessite une validation prospective avant de pouvoir s’appliquer en
pratique [31]. Certains centres utilisent déjà le suivi des concentrations d’anticorps
thérapeutiques (pour l’essentiel des anticorps anti-TNF-a) ainsi que la détection
des ADA. Lorsqu’un biomédicament est utilisé pour un rhumatisme inflammatoire, les
principales situations rencontrées sont la non-réponse, la perte de réponse, la
rémission clinique de la maladie et la réaction clinique à l’injection, parfois
grave. L’évaluation de l’activité de la maladie par les scores, tels que
l’ASDAS2 pour les SpA ou le DAS28 pour la
PR d’une part, et la concentration de médicament et d’ADA d’autre part, sont des
éléments qui pourraient aider le clinicien dans sa décision vis-à-vis de la
poursuite du traitement et de l’adaptation de la dose ou de l’espacement entre les
prises. La concentration résiduelle apporte une information sur l’exposition du
patient au traitement ainsi qu’une probabilité de s’être immunisé contre l’anticorps
thérapeutique. La détection des ADA est critique, particulièrement en cas de
réaction à l’injection, et il est nécessaire d’avoir un test fiable pour distinguer
les réactions liées à l’immunogénicité de l’anticorps de celles qui sont liées à
d’autres mécanismes. Pour éviter les faux négatifs, il faut disposer d’un test qui
ne soit pas sensible à l’interférence avec le médicament (drug tolerant
assays). Des algorithmes ont été proposés par plusieurs équipes pour
adapter la dose de l’anticorps thérapeutique ou changer de traitement. Un exemple
est fourni par celui proposé par le groupe MAGE (monitoring of monoclonal
antibodies group in Europe) [32, 33] (Tableau I).
Tableau I.
| Exposition et immunogénicité |
Réponse clinique |
| Concentration résiduelle |
ADA |
Répondeur |
Non-répondeur |
|
| Au-dessus de l’intervalle cible |
NA |
Diminuer la posologie |
Switch pour une autre classe |
|
| Dans l’intervalle cible |
NA |
Même posologie |
Switch pour une autre classe |
|
| En dessous de
l’intervalle cible |
Indétectablea |
Discuter l’augmentation de la posologie ou décider
la même posologie ou l’arrêt du traitementb |
Augmentation de la posologie |
|
| Détectablea |
Discuter l’arrêt du traitement |
Discuter une augmentation de la posologie ou
switchc
|
|
| Indétectable |
Indétectabled |
Discuter l’augmentation de la posologie ou l’arrêt
du traitementb |
Augmentation de la posologie |
|
| Détectabled |
Discuter l’arrêt du traitement |
Switchc |
|
| L’algorithme aide à la décision selon
la réponse clinique par la mesure biologique de la concentration
de l’Ac injecté et, si nécessaire, de la détection d’ADA |
Algorithme décisionnel pour le TDM des biomédicaments dans
les maladies inflammatoires (d’après [ 33]). aPossibilité
d’utiliser un test drug-tolerant pour la détection des
ADA. bLa décision du clinicien peut varier selon les
traitements disponibles et les indications.
cSwitch intra-classe ou bien vers une
autre classe. dUtiliser un test
“ drug-sensitive” pour la détection des ADA.
Toujours vérifier la bonne observance du traitement en cas
d’auto-administration, particulièrement lorsque la concentration est
en-dessus de l’intervalle cible. Un changement de posologie reste la
décision du clinicien et nécessite une réévaluation de la réponse ainsi
qu’une vérification de la concentration. ADA, antidrug
antibodies ; NA, non-applicable ; TDM, therapeutic
drug monitoring (suivi thérapeutique pharmacologique). |
|
Pour conclure, les anticorps thérapeutiques utilisés en rhumatologie sont très
majoritairement des molécules dirigées contre des cytokines. Leur spécificité de
cibles a permis d’améliorer la connaissance des maladies rhumatologiques
inflammatoires (cytokine-based disease classification). Si cette
multitude d’options thérapeutiques a considérablement élargi l’éventail
thérapeutique dans les maladies inflammatoires et auto-immunes, de nombreuses
questions restent en suspens comme l’identification de biomarqueurs prédictifs de
réponse et de tolérance à ces traitements. L’optimisation de l’efficacité et de la
tolérance des biomédicaments par le monitoring de leurs concentrations sériques
reste une question d’actualité. Avec les progrès de la connaissance de la relation
dose-concentration-réponse des anticorps thérapeutiques, en particulier des
anticorps anti-TNF-a, le suivi thérapeutique de ces biomédicaments pourrait devenir
la pratique courante dans le futur pour les malades atteints de rhumatismes
inflammatoires chroniques. Plusieurs études sont cependant encore nécessaires avant
une utilisation en routine de ces tests. |
JM déclare n’avoir aucun lien d’intérêt concernant les données publiées
dans cet article.
Au cours des trois dernières années, DM a donné des conférences au titre de
son université pour Grifols, Novartis et Pfizer. Il a été invité à participer à
un congrès international par Janssen-Cilag et son université a reçu des
financements du Lions Club Tours Val-de-France.
|
Footnotes |
1. McInnes
IB,
Schett
G. The pathogenesis
of rheumatoid arthritis . N Engl J
Med.
2011; ; 365:
:2205.–2219. 2. Elliott
MJ,
Maini
RN,
Feldmann
M, et al.
Randomised double-blind comparison of chimeric monoclonal
antibody to tumour necrosis factor alpha (cA2) versus placebo in rheumatoid
arthritis . Lancet.
1994; ; 344:
:1105.–1110. 3. McInnes
IB,
Schett
G. Pathogenetic
insights from the treatment of rheumatoid arthritis .
Lancet.
2017; ; 389:
:2328.–2337. 4. Stohl
W.. Future prospects
in biologic therapy for systemic lupus erythematosus .
Nat Rev Rheumatol.
2013; ; 9:
:705.–720. 5. Mease
PJ. Inhibition of
interleukin-17, interleukin-23 and the TH17 cell pathway in the treatment of
psoriatic arthritis and psoriasis . Curr Opin
Rheumatol.
2015; ; 27:
:127.–133. 6. Edwards
JC,
Cambridge
G. B-cell targeting
in rheumatoid arthritis and other autoimmune diseases .
Nat Rev Immunol.
2006; ; 6:
:394.–403. 7. Maini
RN,
Breedveld
FC,
Kalden
JR, et al.
Therapeutic efficacy of multiple intravenous infusions of
anti-tumor necrosis factor alpha monoclonal antibody combined with low-dose
weekly methotrexate in rheumatoid arthritis .
Arthritis Rheum.
1998; ; 41:
:1552.–1563. 8. Nam
JL,
Takase-Minegishi
K,
Ramiro
S, et al.
Efficacy of biological disease-modifying antirheumatic drugs: a
systematic literature review informing the 2016 update of the EULAR
recommendations for the management of rheumatoid arthritis .
Ann Rheum Dis.
2017; ; 76:
:1113.–1136. 9. Braun
J,
Kiltz
U,
Heldmann
F,
Baraliakos
X. Emerging drugs
for the treatment of axial and peripheral spondyloarthritis .
Exp Opin Emerg Drugs.
2015; ; 20:
:1.–14. 10. Otten
MH,
Anink
J,
Spronk
S, van
Suijlekom-Smit
LW. Efficacy of
biological agents in juvenile idiopathic arthritis: a systematic review
using indirect comparisons . Ann Rheum
Dis.
2013; ; 72:
:1806.–1812. 11. Singh
JA,
Beg
S,
Lopez-Olivo
MA. Tocilizumab for
rheumatoid arthritis . Cochrane Database Syst
Rev.
2010: :CD008331.. 12. Scott
LJ. Sarilumab: first
global approval . Drugs.
2017; ; 77:
:705.–712. 13. Stone
JH,
Klearman
M,
Collinson
N. Trial of
Tocilizumab in giant-cell arteritis . N Engl
J Med.
2017; ; 377:
:1494.–1495. 14. Stone
JH,
Merkel
PA,
Spiera
R, et al.
Rituximab versus cyclophosphamide for ANCA-associated
vasculitis . N Engl J Med.
2010; ; 363:
:221.–232. 15. Baker
KF,
Isaacs
JD. Novel therapies
for immune-mediated inflammatory diseases: what can we learn from their use
in rheumatoid arthritis, spondyloarthritis, systemic lupus erythematosus,
psoriasis, Crohn’s disease and ulcerative colitis? .
Ann Rheum Dis.
2018; ; 77:
:175.–187. 16. Van den
Bosch
F,
Deodhar
A. Treatment of
spondyloarthritis beyond TNF-alpha blockade .
Best Practice Res Clin Rheumatol.
2014; ; 28:
:819.–827. 17. Kunwar
S,
Dahal
K,
Sharma
S. Anti-IL-17
therapy in treatment of rheumatoid arthritis: a systematic literature review
and meta-analysis of randomized controlled trials .
Rheumatol Int.
2016; ; 36:
:1065.–1075. 18. Sieper
J,
Poddubnyy
D. New evidence on
the management of spondyloarthritis . Nat Rev
Rheumato.
2016; ; 12:
:282.–295. 19. Baeten
D,
Ostergaard
M,
Wei
JC, et al.
Risankizumab, an IL-23 inhibitor, for ankylosing spondylitis:
results of a randomised, double-blind, placebo-controlled, proof-of-concept,
dose-finding phase 2 study . Ann Rheum
Dis.
2018; ; 77:
:1295.–1302. 20. Poddubnyy
D,
Hermann
KG,
Callhoff
J, et al.
Ustekinumab for the treatment of patients with active ankylosing
spondylitis: results of a 28-week, prospective, open-label, proof-of-concept
study (TOPAS) . Ann Rheum
Dis.
2014; ; 73:
:817.–823. 22. Mulleman
D,
Balsa
A. Adalimumab
concentration-based tapering strategy: as good as the recommended
dosage . Ann Rheum Dis.
2018; ; 77:
:473.–475. 23. St Clair
EW,
Wagner
CL,
Fasanmade
AA, et al.
The relationship of serum infliximab concentrations to clinical
improvement in rheumatoid arthritis: results from ATTRACT, a multicenter,
randomized, double-blind, placebo-controlled trial .
Arthritis Rheum.
2002; ; 46:
:1451.–1459. 24. Bartelds
GM,
Wijbrandts
CA,
Nurmohamed
MT, et al.
Clinical response to adalimumab: relationship to anti-adalimumab
antibodies and serum adalimumab concentrations in rheumatoid
arthritis . Ann Rheum Dis.
2007; ; 66:
:921.–926. 25. Bendtzen
K,
Geborek
P,
Svenson
M, et al.
Individualized monitoring of drug bioavailability and
immunogenicity in rheumatoid arthritis patients treated with the tumor
necrosis factor alpha inhibitor infliximab .
Arthritis Rheum.
2006; ; 54:
:3782.–3789. 26. Ducourau
E,
Mulleman
D,
Paintaud
G, et al.
Antibodies toward infliximab are associated with low infliximab
concentration at treatment initiation and poor infliximab maintenance in
rheumatic diseases . Arthritis Res
Ther.
2011; ; 13: :R105.. 27. Bejan-Angoulvant
T,
Ternant
D,
Daoued
F, et al.
Brief report: relationship between serum infliximab
concentrations and risk of infections in patients treated for
spondyloarthritis . Arthritis
Rheumatol.
2017; ; 69:
:108.–113. 28. Jani
M,
Dixon
WG,
Lunt
M, et al.
The association of biologic drug-levels with infection risk:
results from the british society for rheumatology biologics register for
rheumatoid arthritis . EULAR annual
meeting. Ann Rheum Dis.
2018: :A163.. 29. Krieckaert
CL,
Nair
SC,
Nurmohamed
MT, et al.
Personalised treatment using serum drug levels of adalimumab in
patients with rheumatoid arthritis: an evaluation of costs and
effects . Ann Rheum Dis.
2015; ; 74:
:361.–368. 30. L’Ami
MJ,
Krieckaert
CL,
Nurmohamed
MT, et al.
Successful reduction of overexposure in patients with rheumatoid
arthritis with high serum adalimumab concentrations: an open-label,
non-inferiority, randomised clinical trial .
Ann Rheum Dis.
2018; ; 77:
:484.–487. 31. Ducourau
E,
Ternant
D,
Lequerre
T, et al.
Towards an individualised target concentration of adalimumab in
rheumatoid arthritis . Ann Rheum
Dis.
2014; ; 73:
:1428.–1429. 33. Dreesen
E,
Bossuyt
P,
Mulleman
D, et al.
Practical recommendations for the use of therapeutic drug
monitoring of biopharmaceuticals in inflammatory diseases .
Clin Pharmacol.
2017; ; 9:
:1.–11. |