| |
| Med Sci (Paris). 35(12): 1034–1042. doi: 10.1051/medsci/2019227.Les immuno-conjugués en oncologie Les raisons du succès récent d’une approche
ancienne Alain Beck,1 Charles Dumontet,2,3,4 and Nicolas Joubert5* 1Institut de Recherche Pierre Fabre, Centre d’Immunologie
Pierre Fabre, 5 Avenue
Napoléon III, 74160Saint-Julien-en-Genevois,
France 2Cancer Research Center of Lyon (CRCL), Inserm
1052/CNRS, 69000Lyon,
France 3Université de Lyon, 69000Lyon,
France 4Hospices Civils de Lyon, 69000Lyon,
France 5GICC EA7501, Université de Tours, équipe IMT,
31 avenue Monge,
37200Tours,
France |
Les immunoconjugués (antibody-drug conjugates ou ADC en anglais) ont
fait des progrès considérables en 10 ans. Un ADC est une chimiothérapie vectorisée,
permettant la délivrance sélective d’un agent cytotoxique puissant au sein d’une tumeur.
Un ADC résulte du greffage généralement stochastique d’un agent cytotoxique sur un
anticorps monoclonal (AcM) par l’intermédiaire d’un bras espaceur judicieusement
construit (linker, en anglais), et se présente sous la forme d’un mélange complexe
d’immunoconjugués où varient la distribution DLD (drug loading and
distribution) et le DAR (drug-to-antibody ratio,
correspondant au nombre de molécules cytotoxiques greffées sur l’anticorps) [1, 2]. En 2009, le gemtuzumab ozogamicine
(Mylotarg®) était le seul ADC approuvé par la FDA (food and drug
administration) et 12 autres candidats étaient en études cliniques [3] (→).
(→) Voir la Synthèse de J.F. Haeuw et al., m/s
n° 12, décembre 2009, page 1046
À l’heure actuelle, quatre autres ADC ont été approuvés (Figure 1) et plus de 80 autres sont en études cliniques
actives dont 8 en phase III ou phase II pivotales (Tableau I). Plus de 50 candidats ont par ailleurs été
abandonnés en clinique pour des raisons toxicologiques, de manque d’efficacité ou de
priorisation de portefeuilles. Si on peut constater que, parmi les cinq ADC approuvés
aujourd’hui, quatre visent des cancers hématologiques (« tumeurs liquides » réputées
plus facile à cibler pour des ADC) contre un seul dirigé contre des tumeurs solides, les
ADC en phase clinique avancée sont au contraire principalement dirigés vers les tumeurs
solides (six contre des tumeurs solides ; deux dirigés contre des myélomes ou des
lymphomes).
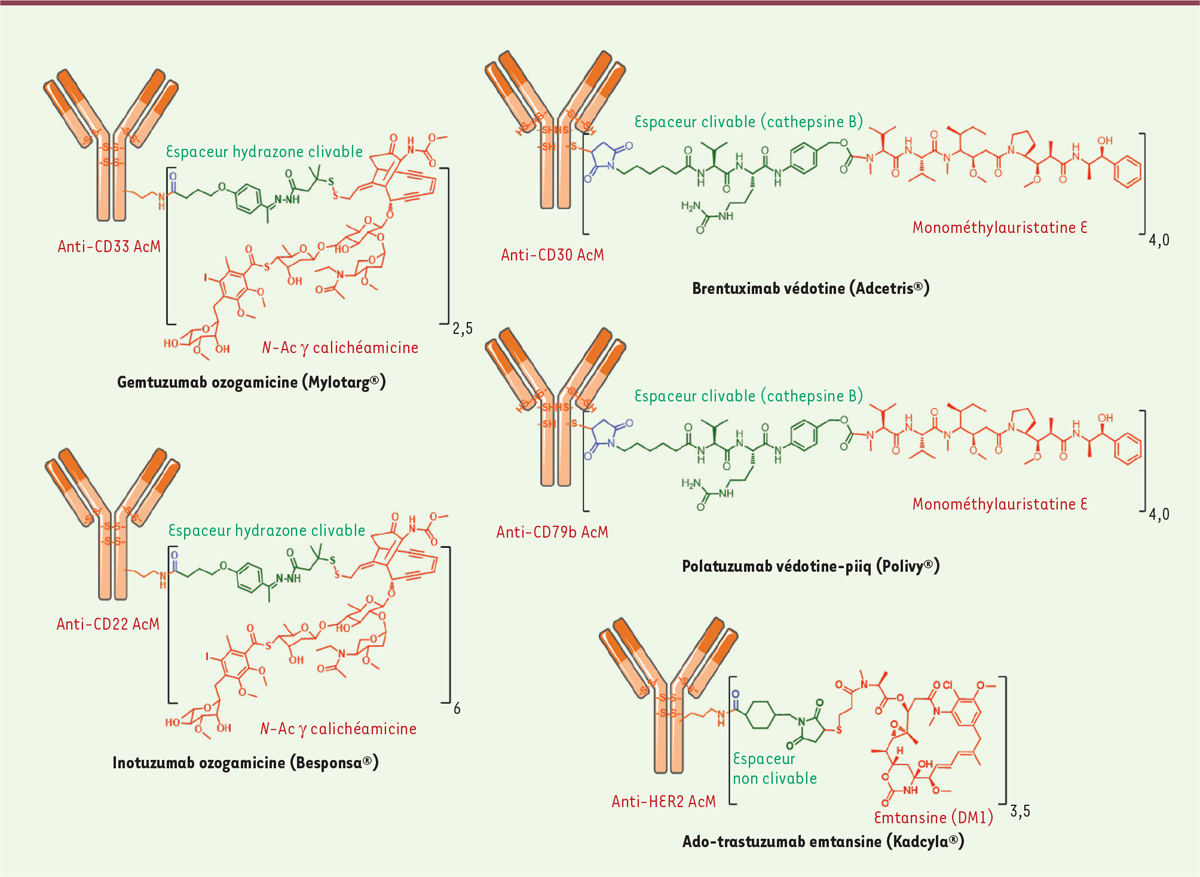
 | Figure 1.
Représentation des 5 ADC approuvés par la FDA:
Mylotarg®, Adcetris®, Kadcyla®,
Besponsa® et Polivy®.
|
Tableau I.
| ADC (cytotoxique) |
Isotype et Cible |
Indication, date d’approbation/Statut Ph clinique |
| gemtuzumab ozogamicine (CAL) |
IgG4 CD33 |
2000-2010/2017 AML |
|
| brentuximab védotine (AUR) |
IgG1 CD30 |
2011 ALCL et lymphoma de Hodgkin |
|
| trastuzumab emtansine (MAY) |
IgG1 HER2+ |
2013 cancer du sein métastatique HER2+++ |
|
| inotuzumab ozogamicine (CAL) |
IgG4 CD22 |
2017 ALL and CLL |
|
| polatuzumab védotine (AUR) |
IgG1 CD79b |
2019 DLBCL |
|
| sacituzumab govitécan (IRI)* |
IgG1 TROP-2 |
BLA, TNBC métastatique |
|
| enfortumab védotine (AUR)* |
IgG1 Nectine 4 |
BLA, Piv. Ph 2 cancer urothéliale |
|
| trastuzumab déruxtécan (EXA)* |
IgG1 HER2/neu+ |
Ph 3 cancer du sein HER2+++ vs T-DM1 |
|
| trastuzumab duocarmazine (DUO)* |
IgG1 HER2/neu+ |
Ph 3 cancer du sein HER2+++ vs T-DM1 |
|
| mirvetuximab soravtansine (MAY)* |
IgG1 Folate R1 |
Ph 3 cancer de l’ovaire épithélial |
|
| belantamab mafodotine (AUR) |
IgG1afuc BCMA |
Piv. Ph2 myélome multiple |
|
| loncastuximab tésirine (PBD) |
IgG1 CD19 |
Piv. Ph2 DLBCL |
|
|
depatuxizumab mafodotine (AUR)
|
IgG1 EGFRvIII
|
Ph 3 glioblastome (étude stoppée)
|
|
|
rovalpituzumab tésirine (PBD)
|
IgG1 DLL3
|
Ph 3 cancer du poumon à petites cellules (étude
stoppée)
|
ADC approuvés ou en phases cliniques avancées (III ou II
pivotale).
|
Six ADC ont reçu par la FDA les statuts de percée thérapeutique ou désignation accélérée
ou examen prioritaire: examen prioritaire du sacituzumab govitécan dans le cancer du
sein triple négatif métastatique (23 juillet 2018) ; désignation de traitement de pointe
pour le trastuzumab déruxtécan contre le cancer du sein métastatique HER2-positif (30
août 2017) ; désignation accélérée pour le trastuzumab duocarmazine contre le cancer du
sein métastatique HER2-positif (28 janvier 2018) ; désignation accélérée pour le
mirvétuximab soravtansine contre le cancer de l’ovaire résistant au traitement par les
dérivés du platine (18 juin 2018) ; désignation de traitement de pointe pour
l’enfortumab védotine pour le cancer métastatique urothélial (28 mars 2018). Désignation
de percée thérapeutique pour le bélantamab mafodotine pour le myélome multiple (2
novembre 2017). Cette revue, en deux parties, sera focalisée sur les ADC approuvés et en phase de
développement tardif, leur limitation, ainsi que leur toxicité et mécanismes de
résistances associés, les nouvelles stratégies émergentes pour y faire face, dont les
constructions moléculaires de 3e génération, le choix de vecteurs
alternatifs, les systèmes de libération innovants et les combinaisons ADC avec la
chimiothérapie conventionnelle ou des inhibiteurs de point de contrôle immunitaire. En 2009, les calichéamycines, les auristatines et les maytansinoïdes étaient les classes
principales de cytotoxiques utilisés. Dix ans plus tard, ces mêmes molécules sont
toujours utilisées avec des structures et agents de liaison optimisés pour une meilleure
stabilité et hydrophilie. De nouvelles classes de molécules cytotoxiques sont apparues:
pyrrolobenzodiazépines (PBD), duocarmycines, dérivés de camptothécine. En 10 ans, des
progrès considérables ont été réalisés en ingénierie d’anticorps pour permettre des
conjugaisons plus site-spécifique, améliorer l’homogénéité et la stabilité des
constructions et amener en clinique des ADC de 2e et de 3e
génération dans l’espoir d’élargir la fenêtre thérapeutique (delta entre la dose
maximale tolérée [DMT] et la dose minimale efficace [DME]) [4]. Plusieurs dizaines de technologie de
bioconjugaison ont été proposées en préclinique, fondées sur l’utilisation de résidus
cystéines, d’acides aminés non-naturels ou de motifs introduits par ingénierie
moléculaire au niveau des chaînes légères ou lourdes, ou bien des techniques de
re-pontage des résidus cystéines. Enfin, les ADC ont également été améliorés grâce à des
cibles antigéniques mieux choisies et en optimisant des mécanismes de libération de
l’agent cytotoxique au sein de la tumeur [5]. |
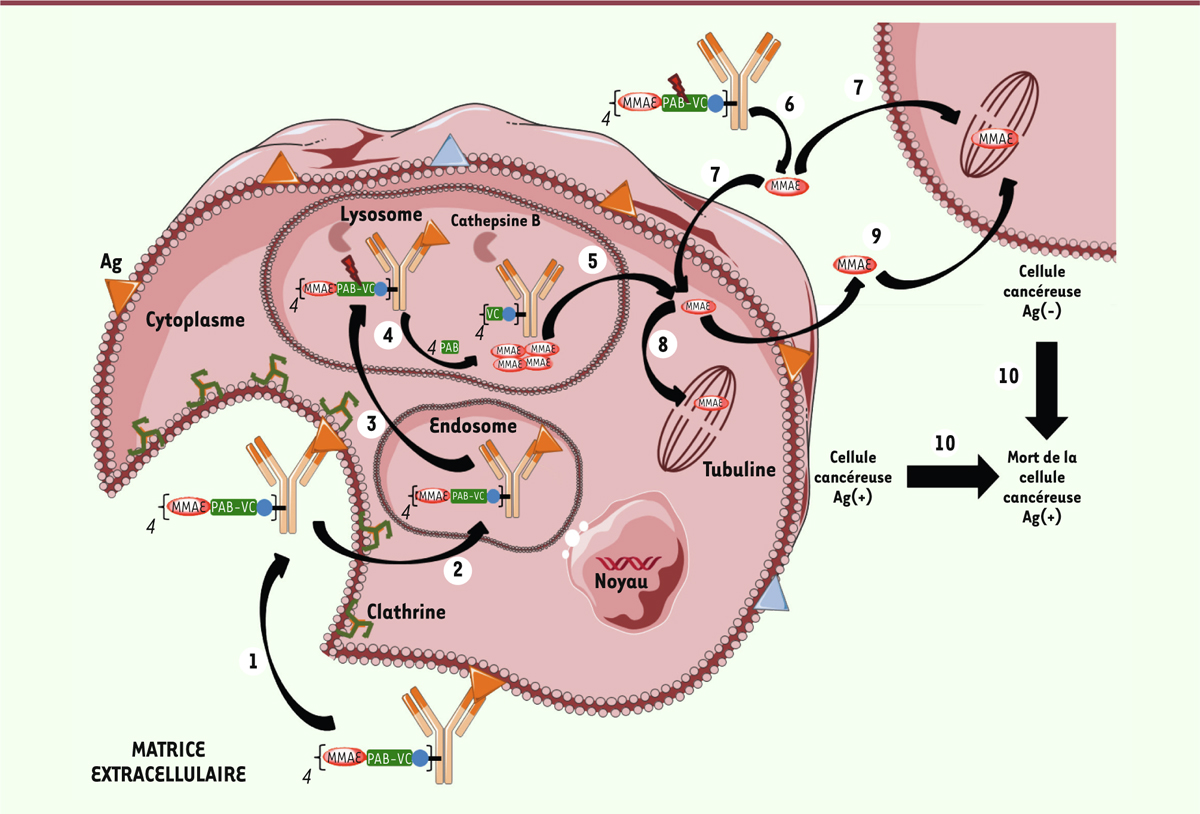
Conception et mécanisme d’action des ADC approuvés en clinique Le développement des immunoconjugués en oncologie a permis l’émergence de deux
éléments clés nécessaires pour assurer le succès d’un ADC. Le premier concerne la
nature et la nécessité d’un espaceur en tant qu’intermédiaire entre l’anticorps (Ac)
et la molécule cytotoxique que nous désignerons désormais par « le cytotoxique ». Ce
système Ac-espaceur-cytotoxique a d’abord été conçu avec un espaceur clivable
(Figure 2) supposé
stable dans les conditions physiologiques dans la circulation plasmatique, puis
clivé rapidement après endocytose dans la cellule tumorale, afin d’y libérer
sélectivement le cytotoxique et limiter l’apparition d’effets secondaires
indésirables. Ce type d’espaceur est sensible aux conditions lysosomales (protéases,
acidité, milieu réducteur). Le second est corrélé à la nécessité d’avoir un agent
cytotoxique puissant greffé à l’anticorps. Les premiers ADC étaient caractérisés par
un faible indice thérapeutique en raison de la faible puissance du cytotoxique
(e.g. anthracycline), entraînant un effet thérapeutique très
limité à la DMT (DMT et DME confondues à 100 mg/kg). Ce phénomène peut être expliqué
conjointement par la densité antigénique à la surface des cellules cancéreuses et
par la quantité d’ADC arrivant à la surface des cellules tumorales par rapport à
celle injectée (ne dépassant guère 0,1 %) [6].
 | Figure 2.
Représentation schématique d’un ADC ou anticorps
armé.
|
Mylotarg®, Besponsa® et l’espaceur clivable de première
génération Le Mylotarg ® (gemtuzumab ozogamicine) a été approuvé par la FDA avec
une indication de traitement de la leucémie myéloïde aiguë (LMA) [ 7, 8]. En effet, le Mylotarg ® est le
résultat de la conjugaison de la calichéamycine, un puissant agent alkylant de
l’ADN [ 9] possédant une
activité subnanomolaire, au gemtuzumab, un AcM anti-CD33, via
une liaison hydrazone labile en milieu acide (Figure 1). Après l’internalisation de l’ADC, la
liaison hydrazone de cet espaceur peut être hydrolysée dans les lysosomes pour
libérer un précurseur de la calichéamycine, qui subit ensuite une réduction par
le glutathion, suivie d’une cyclisation de Bergman pour libérer la
calichéamycine active (Figure
3).
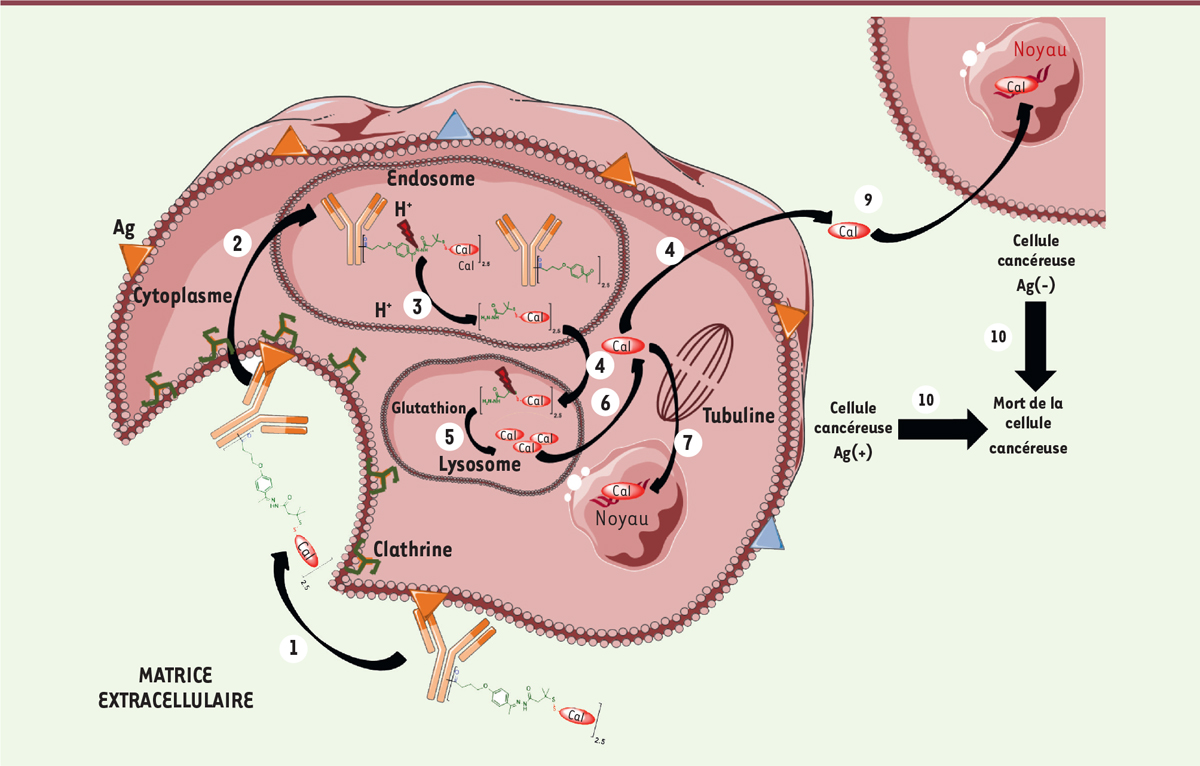
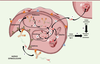
 | Figure 3. Mécanisme d’action du Mylotarg® ou du
Besponsa®. Les différentes
étapes sont: (1) liaison à un antigène
(Ag) spécifique, suivie de l’internalisation du complexe ADC-Ag
selon un mécanisme dépendant de la clathrine ;
(2) transfert dans les
endosomes ; (3) le clivage du linker
dans les lysosomes s’effectue au niveau de l’hydrazone
acido-sensible ; (4) transfert de la
pro-calichéamycine dans le lysosome ;
(5) clivage du pont disulfure pour
donner la calichéamycine puis (6)
transfert de la calichéamycine dans le cytoplasme ;
(7) transfert de la
calichéamycine dans le noyau. (8)
Alternativement à 7, transfert de la calichéamycine dans le
cytoplasme puis: (9) diffusion de la
calichéamycine dans les cellules cancéreuses voisines pour obtenir
un effet bystander cytotoxique ;
(10) toutes les étapes
précédentes conduisent à la mort cellulaire. |
Théoriquement, les hydrazones devaient être stables dans la circulation sanguine
à pH neutre et subir une hydrolyse après internalisation dans un environnement
cellulaire qui possède un pH plus acide (respectivement un pH de 5,0 à 6,5 pour
les endosomes et de 4,5 à 5,0 pour les lysosomes). Cependant, l’espaceur du
Mylotarg® présente une certaine instabilité, entraînant la
libération prématurée du cytotoxique dans la circulation plasmatique [10], ce qui explique son
retrait volontaire en 2010. Le Mylotarg® a bénéficié du savoir
accumulé en clinique ces dernières années pour être réapprouvé par la FDA en
2017, utilisé à une dose plus faible, avec un schéma d’administration modifié et
pour une population différente de patients. En parallèle, un espaceur semblable
a été développé et utilisé pour greffer la calichéamycine sur l’inotuzumab
anti-CD22, conduisant au Besponsa® (inotuzumab ozogamicine,
Figure 1
), approuvé par la FDA en 2017 contre la leucémie aiguë lymphoblastique
(LAL) et la leucémie lymphoïde chronique (LLC) [11]. Kadcyla® et la notion d’espaceur non clivable Devant ces constats, des stratégies alternatives pour la conception d’un espaceur
étaient nécessaires pour continuer le développement des ADC. Ainsi, une
attention particulière a été portée sur l’utilisation d’espaceurs permettant la
conjugaison de dérivés de maytansines et incorporant un système de libération
utilisant une liaison disulfure sensible au glutathion [ 12]. Ces espaceurs innovants chimiquement
labiles devaient permettre une libération contrôlée grâce au glutathion
(GSH) 1 dont la concentration
cytoplasmique dans les cellules cancéreuses est environ 1 000 fois plus élevée
que dans le plasma. En complément, un choix réfléchi des groupements (méthyles)
voisins de la liaison disulfure a permis un contrôle de la cinétique de
libération [ 13]. Ainsi,
la concentration élevée des molécules réductrices dans la tumeur aurait dû
garantir une libération sélective du cytotoxique dans les cellules cancéreuses
par rapport au plasma. Ce type d’espaceur n’a pas encore permis de fabriquer un
ADC qui soit approuvé sur le marché 2. Cependant, une découverte fortuite a permis d’identifier un ADC d’une efficacité
inattendue. La conjugaison de la DM1 (derivative maytansine 1,
un inhibiteur des microtubules) aux résidus lysine du trastuzumab anti-HER2/neu
via un espaceur non clivable thioéther hétérobifonctionnel
contenant un ester de NHS (succinimidyl-4-(N-maléimidométhyl)
cyclohexane-1-carboxylate ou SMCC) a permis d’aboutir au Kadcyla®
(T-DM1 ou ado-trastuzumab emtansine,
Figure 1
), qui a été approuvé par la FDA en 2013 [14]. Étonnamment, lors de son
développement, il a été observé in vitro que cet ADC original
était très puissant dans un modèle de cancer du sein HER2/neu-positif, la
structure n’étant active qu’après internalisation et digestion enzymatique
complète de l’ADC dans le lysosome, conduisant à la formation du métabolite
actif, le lysine-MCC-DM1 (Figure
4). Suite à cette découverte, plusieurs remarques peuvent
être faites: (1) le métabolite lysine-MCC-DM1 conserve le potentiel cytotoxique
de la DM1 libre, permettant à l’ADC d’atteindre une activité in
vitro de l’ordre du picomolaire ; (2) cet ADC ne présente aucun
effet collatéral de cytotoxicité (bystander killing effect) en
raison du caractère chargé de son métabolite actif à pH physiologique ; (3)
l’ADC avec l’espaceur clivable ne peut cibler que les cellules Ag-positives ;
(4) un ADC avec l’espaceur non-clivable présente une toxicité limitée sur les
tissus normaux et se révèle plus stable qu’un ADC avec espaceur clivable.
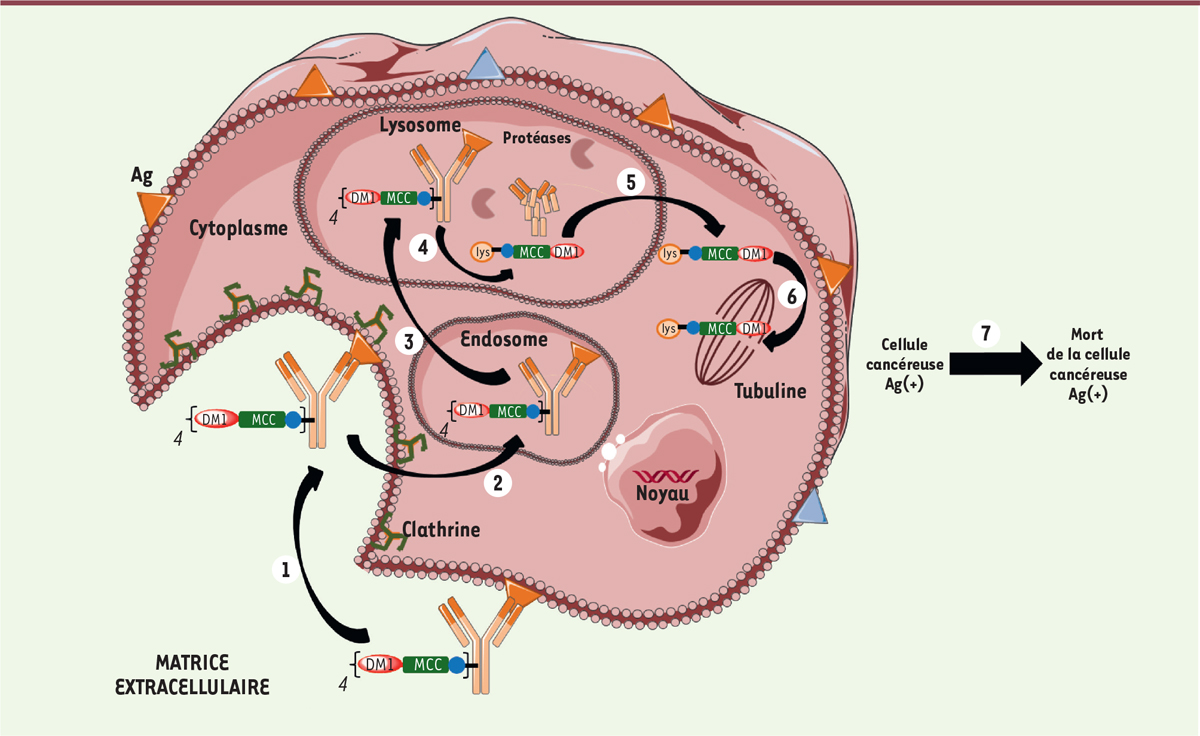
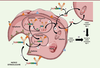 | Figure 4. Mécanisme d’action du
Kadcyla®. Les différentes étapes
sont: (1) fixation du
Kadcyla® sur son antigène
(Ag) spécifique HER2/neu, suivie
d’une internalisation du complexe T-DM1-HER2/neu par un mécanisme
dépendant de la clathrine ; (2)
transfert dans l’endosome puis (3)
dans le lysosome ; (4) digestion
complète du trastuzumab pour libérer le métabolite actif, l’acide
LYS-NCL-DM1 ; (5) transfert dans le
cytoplasme. (6) Pas d’effet
bystander cytotoxique, et transfert vers la
tubuline. (7) Toutes les étapes
précédentes conduisent à la mort cellulaire de la cellule cancéreuse
HER2-positive. |
Adcetris® et Polivy® et l’espaceur clivable de seconde
génération Par ailleurs, une technologie d’espaceur permettant la bioconjugaison de dérivés
de la dolastatine (telle que la monométhyl auristatine E ou MMAE) aux résidus
cystéine d’un AcM anti-CD30 a été mise au point. Après réduction ménagée,
l’anticorps a été bioconjugué à un espaceur hétérobifonctionnel maléimide
clivable possédant une gâchette peptidique valine-citrulline (ValCit) sensible à
la cathepsine B lysosomale et un alcool para-aminobenzylique (PAB) en tant
qu’espaceur auto-immolable permettant la libération de la MMAE après
internalisation dans la cellule tumorale CD30-positive
(maléimidocaproyl-valine-citrulline-p-aminobenzyloxycarbonyle), pour produire
l’Adcetris ® (SGN-35 ou brentuximab védotin, Figure 1) [ 15- 17]. L’Adcetris® a été approuvé par la FDA en 2011 et cible le lymphome à
grandes cellules anaplasiques et le lymphome de Hodgkin. Après l’internalisation
de l’ADC avec CD30, suivie de la dégradation de l’espaceur clivable, la MMAE
libérée est capable de détruire la cellule ciblée et de diffuser dans la tumeur
pour atteindre et tuer les cellules cancéreuses voisines. Ce phénomène est
responsable du phénomène dit du bystander killing effect [18, 19], permettant à la MMAE libérée
de tuer les cellules cancéreuses CD30+ et CD30- à
l’intérieur de la tumeur (Figure
5) [20], et de l’efficacité particulière de l’Adcetris® dans
des lymphomes hétérogènes in vivo. Récemment, Neri et son
équipe ont démontré que l’espaceur utilisé dans cet ADC peut également être
clivé avant internalisation [21], participant à faire tomber le dogme stipulant qu’un ADC devait
cibler un antigène internalisant [22] pour être sélectif et actif3. De manière similaire, le même espaceur a permis de
conjuguer la MMAE au polatuzumab anti-CD79b, conduisant au Polivy®
(polatuzumab védotine-piiq,
Figure 1), approuvé par la FDA
en 2019 en association avec la chimiothérapie à base de bendamustine et de
rituximab, pour traiter les patients adultes atteints de lymphome diffus à
grandes cellules B (DLBCL) [23, 24].
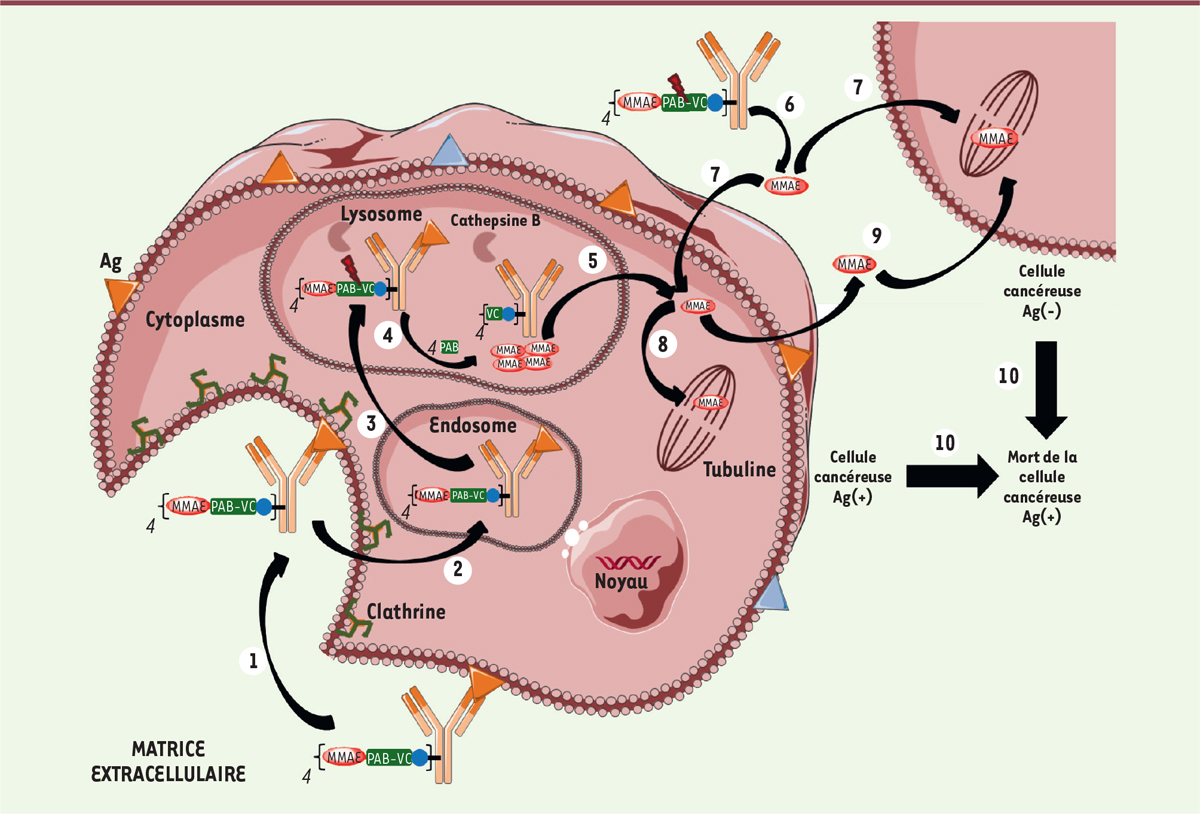
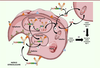 | Figure 5. Mécanisme d’action de l’Adcetris® ou du
Polivy®. Les différentes
étapes sont: (1) liaison à un antigène
(Ag) spécifique, suivie de l’internalisation du complexe ADC-Ag
selon un mécanisme dépendant de la clathrine ;
(2) transfert dans les
endosomes puis (3) dans les lysosomes
; (4) le clivage du linker dans les
lysosomes s’effectue entre la séquence peptidique (ValCit) et
l’espaceur auto-immolable (PAB) ; (5)
transfert de la MMAE dans le cytoplasme.
(6) La MMAE peut également être
libérée avant internalisation, puis
(7) entrer dans la cellule ciblée
(ou une cellule proche voisine). (8)
Dans tous les cas, la MMAE libérée peut ensuite agir sur la
tubuline. Alternativement à (8),
(9) diffusion de la MMAE dans
les cellules cancéreuses voisines non ciblées par l’ADC conduisant à
un effet bystander cytotoxique. Toutes les étapes
précédentes conduisent à la mort cellulaire. |
La conception structurale de l’Adcetris® ou du Polivy®
possède néanmoins deux limitations: la première est liée à l’instabilité du
maléimide utilisé pour la bioconjugaison, capable de réaliser une réaction de
rétro-Michael4 dans le plasma,
entraînant une déconjugaison partielle puis un transfert lent vers l’albumine,
éventuellement corrélé à une toxicité non ciblée [25] ; la seconde est liée à la gâchette «
ValCit » dans l’Adcetris®, décrite comme substrat de la
carboxylestérase 1C plasmatique et de certaines protéases sécrétées par des
neutrophiles (par exemple, l’élastase), ce qui pourrait expliquer en partie les
effets indésirables hématologiques liés à l’Adcetris® (par exemple,
la neutropénie) [26-28]. |
Toxicité et conditions d’utilisation L’utilisation d’un conjugué fortement toxique a modifié le paradigme d’une
immunothérapie dirigée contre les antigènes tumoraux et possédant des effets
secondaires relativement limités en relation avec l’expression de la cible. Les deux
anticorps de cette famille les plus utilisés, le rituximab dirigé contre CD20 et le
trastuzumab dirigé contre HER2/neu, ont tous deux un profil de toxicité leur
permettant d’être combinés à des agents de chimiothérapie conventionnels sans
toxicité redondante avec celle de ces derniers. Dans le cas des ADC, la situation
est différente dans la mesure où certains effets secondaires sont similaires à ceux
des agents cytotoxiques classiques alors que d’autres sont spécifiques aux conjugués
utilisés. La survenue de ces effets secondaires, parfois sévères, est en partie
expliquée par le fait que seule une faible fraction de la dose totale injectée
atteint la tumeur, le reste pouvant se fixer de façon non spécifique, avec une
libération non contrôlée au moins partielle du conjugué ou de ses métabolites. Le
développement de ces agents, que ce soit en monothérapie ou en combinaison, s’est
donc avéré complexe, comme en témoigne le cas du gemtuzumab ozogamicine. Le gemtuzumab ozogamicine ou les montagnes russes du premier ADC approuvé
chez l’homme Le gemtuzumab ozogamicine (Mylotarg ®) est un AcM humanisé ayant une
région Fc d’IgG4 humaine, anti-CD33, approuvé en 2000 par la FDA pour le
traitement de certains patients atteints de leucémie aiguë myéloblastique (LAM).
Dès 2001, la FDA émettait une alerte en raison de l’observation de cas de
maladie veino-occlusive. En 2004, une étude randomisée comparant un traitement
classique avec un bras associant le Mylotarg ® fut interrompue
prématurément en raison d’un taux de mortalité augmenté dans ce dernier. En
2010, le Mylotarg ® fut retiré de la plupart des marchés, à
l’exception du Japon. L’étude 0701 de l’association française Acute
Leukemia French Association (ALFA) devait ensuite montrer que le
fractionnement de l’administration en trois doses permettait une amélioration à
la fois de la survie sans évènement et de la survie globale, sans toxicité
significative supplémentaire, en particulier sur le plan hépatique [ 29]. Le cas du Mylotarg® est intéressant à de multiples titres. En raison
des méthodes analytiques limitées disponibles lors des premières études
cliniques, le Mylotarg® n’était notamment pas un produit homogène en
termes de DAR. Alors que le DAR théorique était de l’ordre de 2, plus de 50 %
des anticorps contenus dans les préparations pharmaceutiques n’étaient pas
conjugués alors que d’autres avaient un DAR de 4 ou 5. Les difficultés de
développement du Mylotarg® montrent également la difficulté
d’identifier un schéma posologique permettant d’obtenir un index thérapeutique
satisfaisant et la nécessité de ne pas abandonner le développement d’un ADC
après l’exploration d’un seul schéma posologique. Le brentuximab védotine dans le traitement de la maladie de Hodgkin Le brentuximab védotine (Adcetris ®) est un anticorps dirigé contre
CD30, approuvé dans certaines formes de syndromes lymphoprolifératifs exprimant
CD30 dont la maladie de Hodgkin. Le conjugué védotine (MMAE) est un puissant
anti-tubuline. Cet ADC possède une forte activité antitumorale en monothérapie,
à la fois dans certaines formes de lymphomes T tels que les lymphomes
anaplasiques à grandes cellules (ALCL) et la maladie de Hodgkin réfractaire
( NCT00848926) [ 30, 31]. L’Adcetris ® en monothérapie a été associé à des
neuropathies périphériques pouvant être sévères, des neutropénies et des
thrombopénies, des effets secondaires classiques des agents anti-tubuline. Des
cas rares, mais graves, de leucoencéphalopathies multifocale progressive (LMP),
ont été observés, ainsi que, de façon plus inattendue, une augmentation de la
toxicité pulmonaire en cas de combinaison avec la bléomycine, un agent connu
pour induire des fibroses pulmonaires [ 32]. Les toxicités classiques ou inattendues des ADC Certaines toxicités observées avec les immunoconjugués sont attendues dans la
mesure où les conjugués ciblent soit la tubuline et le fuseau mitotique
(auristatines, maytansinoïdes), soit l’ADN (calichéamycine, PBD). Ceux-ci
comportent notamment une toxicité médullaire pouvant atteindre des grades 4, des
toxicités neurologiques sensitives et végétatives. En revanche, plusieurs effets
secondaires, qui ne sont pas observés avec les agents cytotoxiques standards,
ont été rapportés. Ceux-ci comportent notamment des toxicités oculaires à type
de kératites ou de dépôts cornéens avec les ADC comportant de la MMAF ou DM4,
pouvant constituer une toxicité limitante pour ces composés [ 26]. Le Kadcyla ® peut augmenter
le risque de radionécrose [ 33]. Une meilleure compréhension et prise en charge de ces toxicités
inattendues seront essentielles pour une utilisation optimale de ces agents. |
Mécanismes de résistance aux ADC Le mécanisme d’action des ADC au niveau de la cellule cible tumorale comporte
plusieurs étapes: liaison à l’antigène, internalisation, libération du conjugué,
relargage du conjugué dans le cytoplasme, puis liaison à la cible moléculaire du
conjugué induisant la mort cellulaire par apoptose. Chacune de ces étapes peut être
impliquée dans des phénotypes de résistance comme le suggèrent plusieurs travaux
précliniques utilisant des lignées cellulaires ou dans des modèles animaux:
expression réduite de l’antigène cible [34, 35], modification des pompes de transport lysosomales [36], du cytosquelette microtubulaire ou
des voies des prostaglandines [37]. D’autres mécanismes tels que la surexpression de pompes d’efflux
ont également été invoqués [38, 39], bien
que certains conjugués ne soient pas de bons substrats pour les pompes de type
ABC. La pertinence clinique de ces différents mécanismes potentiels de résistance reste à
démontrer. Cela n’a rien de surprenant dans la mesure où la détermination des
mécanismes cliniques de résistance à des composés présents depuis plusieurs
décennies dans la pharmacopée restent encore mal connus. De plus, il est complexe
d’avoir accès à des échantillons tumoraux immédiatement avant la mise en place d’un
traitement par ADC puis lors de la rechute qui suit un tel traitement. Enfin, dans
le cadre de combinaisons thérapeutiques, il peut être difficile de discerner les
mécanismes de résistance aux ADC de ceux des autres composés administrés. Malgré
cela, les observations réalisées dans des modèles précliniques soulèvent des pistes
intéressantes pour l’analyse de la résistance aux ADC chez l’homme. |
Limites des approches actuelles De nombreux ADC, en développement clinique ou utilisés en clinique, reposent sur un
format d’immunoglobuline G (IgG) complet ciblant un antigène (Ag) capable d’être
internalisé une fois le complexe Ac-Ag formé et dont le taux de surexpression est
extrêmement élevé. Ces ADC sont conjugués à des inhibiteurs de polymérisation de la
tubuline en utilisant des techniques de bioconjugaison stochastiques [4]. Cependant, les ADC utilisant un format d’IgG
complète sont caractérisés par des ratios tumeur/sang et tumeur/organe sub-optimaux,
ainsi que par des problèmes de pénétration des tumeurs riches en stroma [40, 41], et sont recyclés par le récepteur Fc
néo-natal (FcRn), conduisant à une distribution indésirable de l’ADC dans
l’endothélium vasculaire et le foie, responsable d’effets indésirables. De plus,
après internalisation, l’efficacité des ADC repose sur un trafic intracellulaire
favorable pour atteindre le lysosome, où leur dégradation permettra la libération
contrôlée du cytotoxique. Cependant, cette stratégie présente plusieurs facteurs
limitants. Premièrement, la capacité d’internalisation des ADC est intimement liée à
la forte expression de l’Ag de surface (par exemple, CD30 et HER2/neu) [42], ce qui explique pourquoi
ces ADC utilisant des inhibiteurs classiques de la polymérisation de la tubuline
(par exemple, les auristatines et les maytansinoïdes) ne présentent pas d’activité
cytotoxique sur les cellules à faible expression antigénique. Des cytotoxiques très
puissants (par exemple, des dimères de pyrrolobenzodiazépine) ont été développés
pour surmonter ces limitations, mais les ADC correspondants présentent un index
thérapeutique limité, en particulier dans les tumeurs solides. Deuxièmement, les ADC
internalisants, y compris le Kadcyla®, induisent une résistance des
tumeurs par plusieurs mécanismes. En effet, des perturbations concernant
l’internalisation, le trafic intracellulaire ou le recyclage de l’AcM, le relargage
de l’Ag (shedding) et/ou une dégradation lysosomale défectueuse des ADC entraînent
une libération réduite du médicament dans le cytosol, compromettant ainsi
l’efficacité de ces derniers [34, 35, 43]. Il existe donc aujourd’hui un besoin important de
développer de nouvelles technologies afin de faire progresser le développement des
ADC. Pour surmonter les limitations précédemment mentionnées, des ADC innovants ont
été conçus et font actuellement l’objet d’évaluations précliniques et d’études en
phase clinique. Ces nouveaux ADC sont caractérisés par des innovations concernant la
chimie de bioconjugaison (menant à des ADC homogènes), la partie ciblage (anticorps
ou fragments), l’espaceur (mécanisme de libération) ou le cytotoxique (mécanisme
d’action). Chaque stratégie est discutée dans l’article suivant en tant qu’alternative
potentielle aux ADC hétérogènes internalisants utilisés aujourd’hui en clinique pour
élargir leurs champs d’applications [1]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1. Joubert
N,
Denevault-Sabourin
C,
Bryden
F, et al.
Towards antibody-drug conjugates and prodrug strategies with
extracellular stimuli-responsive drug delivery in the tumor microenvironment
for cancer therapy . Eur J Med
Chem.
2017; ; 142:
:393.–415. 2. Beck
A,
Terral
G,
Debaene
F, et al.
Cutting-edge mass spectrometry methods for the multi-level
structural characterization of antibody-drug conjugates .
Expert Rev Proteomics.
2016; ; 13:
:157.–183. 3. Haeuw
JF,
Caussanel
V,
Beck
A. Les
immunoconjugués, anticorps « armés » pour combattre le
cancer . Med/Sci (Paris).
2009; ; 25:
:1046.–1052. 4. Beck
A,
Goetsch
L,
Dumontet
C, et al.
Strategies and challenges for the next generation of
antibody–drug conjugates . Nat Rev Drug
Discov.
2017; ; 16:
:315.–337. 5. Martin
C,
Kizlik-Masson
C,
Pèlegrin
A, et al.
Antibody-drug conjugates: design and development for therapy and
imaging in and beyond cancer, labEx MAbImprove industrial workshop, July
27–28, 2017, Tours . France.
MAbs.
2017; ; 10:
:210.–221. 6. Joubert
N,
Viaud-Massuard
MC. Antibody-drug
conjugates: historical developments and mechanisms of
action . Optimizing antibody-drug conjugates for
targeted Delivery of Therapeutics .
Bielefeld University; ,
Germany: : Future Science
Ltd., 2015:
:6.–21. 7. Linenberger
ML,
Hong
T,
Flowers
D, et al.
Multidrug-resistance phenotype and clinical responses to
gemtuzumab ozogamicin .
Blood.
2001; ; 98:
:988.–994. 8. Hamann
PR,
Hinman
LM,
Hollander
I, et al.
Gemtuzumab ozogamicin, a potent and selective anti-CD33
antibody-calicheamicin conjugate for treatment of acute myeloid
leukemia . Bioconjug Chem.
2002; ; 13:
:47.–58. 9. Ricart
AD. Antibody-drug
conjugates of calicheamicin derivative: gemtuzumab ozogamicin and inotuzumab
ozogamicin . Clin Cancer
Res.
2011; ; 17:
:6417.–6427. 10. Trail
P,
Willner
D,
Lasch
S, et al.
Cure of xenografted human carcinomas by BR96-doxorubicin
immunoconjugates . Science.
1993; ; 261:
:212.–215. 11. Kantarjian
HM,
DeAngelo
DJ,
Stelljes
M, et al.
Inotuzumab ozogamicin versus standard therapy for acute
lymphoblastic leukemia . N Engl J
Med.
2016; ; 375:
:740.–753. 12. Chari
RVJ. Targeted cancer
therapy: conferring specificity to cytotoxic drugs .
Acc Chem Res.
2008; ; 41:
:98.–107. 13. Erickson
HK,
Widdison
WC,
Mayo
MF, et al.
Tumor delivery and in vivo processing of disulfide-linked and
thioether-linked antibody-maytansinoid conjugates .
Bioconjug Chem.
2010; ; 21:
:84.–92. 14. Erickson
HK, Lewis
Phillips
GD,
Leipold
DD, et al.
The effect of different linkers on target cell catabolism and
pharmacokinetics/pharmacodynamics of trastuzumab maytansinoid
conjugates . Mol Cancer
Ther.
2012; ; 11:
:1133.–1142. 15. Sun
MMC,
Beam
KS,
Cerveny
CG, et al.
Reduction-alkylation strategies for the modification of specific
monoclonal antibody bisulfides . Bioconjug
Chem.
2005; ; 16:
:1282.–1290. 16. Doronina
SO,
Toki
BE,
Torgov
MY, et al.
Development of potent monoclonal antibody auristatin conjugates
for cancer therapy . Nat
Biotech.
2003; ; 21:
:778.–784. 17. Katz
J,
Janik
JE,
Younes
A. Brentuximab
vedotin (SGN-35) . Clin Cancer
Res.
2011; ; 17:
:6428.–6436. 18. Li
F,
Emmerton
KK,
Jonas
M, et al.
Intracellular released payload influences potency and
bystander-killing effects of antibody-drug conjugates in preclinical
models . Cancer Res.
2016; ; 76:
:2710.–2719. 19. Kovtun
Y V.,
Audette
CA,
Ye
Y, et al.
Antibody-drug conjugates designed to eradicate tumors with
homogeneous and heterogeneous expression of the target
antigen . Cancer Res.
2006; ; 66:
:3214.–3221. 20. Ogitani
Y,
Hagihara
K,
Oitate
M, et al.
Bystander killing effect of DS-8201a, a novel anti-human
epidermal growth factor receptor 2 antibody-drug conjugate, in tumors with
human epidermal growth factor receptor 2 heterogeneity .
Cancer Sci.
2016; ; 107:
:1039.–1046. 21. Dal Corso
A,
Cazzamalli
S,
Gébleux
R, et al.
Protease-cleavable linkers modulate the anticancer activity of
noninternalizing antibody-drug conjugates .
Bioconjug Chem.
2017;; 28:
:1826.–33. 22. Teicher
B.. Antibody-drug
conjugate targets . Curr Cancer Drug
Targets.
2009; ; 9:
:982.–1004. 23. Pfeifer
M,
Zheng
B,
Erdmann
T, et al.
Anti-CD22 and anti-CD79B antibody drug conjugates are active in
different molecular diffuse large B-cell lymphoma subtypes .
Leukemia.
2015; ; 29:
:1578.–1586. 25. Alley
SC,
Benjamin
DR,
Jeffrey
SC, et al.
Contribution of linker stability to the activities of anticancer
immunoconjugates . Bioconjug
Chem.
2008; ; 19:
:759.–765. 26. Donaghy
H.. Effects of
antibody, drug and linker on the preclinical and clinical toxicities of
antibody-drug conjugates .
MAbs.
2016; ; 8:
:659.–671. 27. Dorywalska
M,
Dushin
R,
Moine
L, et al.
Molecular basis of valine-citrulline-PABC linker instability in
site-specific ADCs and Its mitigation by linker design .
Mol Cancer Ther.
2016; ; 15:
:958.–970. 28. Zhao
H,
Gulesserian
S,
Malinao
MC, et al.
A potential mechanism for ADC-induced neutropenia: role of
neutrophils in their own demise . Mol Cancer
Ther.
2017; ; 16:
:1866.–1876. 29. Castaigne
S,
Pautas
C,
Terré
C, et al.
Effect of gemtuzumab ozogamicin on survival of adult patients
with de-novo acute myeloid leukaemia (ALFA-0701): a randomised, open-label,
phase 3 study . Lancet.
2012; ; 379:
:1508.–1516. 30. A phase 2 study of
brentuximab vedotin in patients with relapsed or refractory CD30-positive
non-Hodgkin lymphomas: interim results in patients with DLBCL and other
B-cell lymphomas . Clin Adv Hematol
Oncol.
2014;; 12:
:3.–4. 31. Connors
JM,
Jurczak
W,
Straus
DJ, et al.
Brentuximab vedotin with chemotherapy for stage III or IV
Hodgkin’s lymphoma . N Engl J
Med.
2018; ; 378:
:331.–344. 32. Younes
A,
Connors
JM,
Park
SI, et al.
Brentuximab vedotin combined with ABVD or AVD for patients with
newly diagnosed Hodgkin’s lymphoma: a phase 1, open-label, dose-escalation
study . Lancet Oncol.
2013; ; 14:
:1348.–1356. 33. Carlson
JA,
Nooruddin
Z,
Rusthoven
C, et al.
Trastuzumab emtansine and stereotactic radiosurgery: an
unexpected increase in clinically significant brain edema .
Neuro Oncol.
2014; ; 16:
:1006.–1009. 34. Loganzo
F,
Tan
X,
Sung
M, et al.
Tumor cells chronically treated with a trastuzumab-maytansinoid
antibody-drug conjugate develop varied resistance mechanisms but respond to
alternate treatments . Mol Cancer
Ther.
2015; ; 14:
:952.–963. 35. Chen
R,
Hou
J,
Newman
E, et al.
CD30 downregulation, MMAE resistance, and MDR1 upregulation are
all associated with resistance to brentuximab vedotin .
Mol Cancer Ther.
2015; ; 14:
:1376.–1384. 36. Hamblett
KJ,
Jacob
AP,
Gurgel
JL, et al.
SLC46A3 is required to transport catabolites of noncleavable
antibody maytansineconjugates from the lysosome to the
cytoplasm . Cancer Res.
2015; ; 75:
:5329.–5340. 37. Sauveur
J,
Matera
E-L,
Chettab
K, et al.
Esophageal cancer cells resistant to T-DM1 display alterations in
cell adhesion and the prostaglandin pathway .
Oncotarget.
2018;; 9. 38. Yu
SF,
Zheng
B,
Go
M, et al.
A novel anti-CD22 anthracycline-based antibody-drug conjugate
(ADC) that overcomes resistance to auristatin-based ADCs .
Clin Cancer Res.
2015; ; 21:
:3298.–3306. 39. Chang
CH,
Wang
Y,
Zalath
M, et al.
Combining ABCG2 Inhibitors with IMMU-132, an anti-trop-2 antibody
conjugate of SN-38, overcomes resistance to SN-38 in breast and gastric
cancers . Mol Cancer Ther.
2016; ; 15:
:1910.–1919. 40. Yasunaga
M,
Manabe
S,
Matsumura
Y. New concept of
cytotoxic immunoconjugate therapy targeting cancer-induced fibrin
clots . Cancer Sci.
2011; ; 102:
:1396.–1402. 41. Yasunaga
M,
Manabe
S,
Tarin
D, et al.
Cancer-stroma targeting therapy by cytotoxic immunoconjugate
bound to the collagen 4 network in the tumor tissue .
Bioconjug Chem.
2011; ; 22:
:1776.–1783. 42. Lambert
JM,
Morris
CQ. Antibody-drug
conjugates (ADCs) for personalized treatment of solid tumors: a
review . Adv Ther.
2017; ; 34:
:1015.–1035. 43. Barok
M,
Joensuu
H,
Isola
J. Trastuzumab
emtansine: mechanisms of action and drug resistance .
Breast Cancer Res.
2014; ; 16: :3378.. |