| |
| Med Sci (Paris). 35(12): 1043–1053. doi: 10.1051/medsci/2019228.Les immunoconjugués en oncologie Les nouvelles stratégies en développement Alain Beck,1 Charles Dumontet,2,3,4 and Nicolas Joubert5* 1Institut de Recherche Pierre Fabre, Centre d’Immunologie
Pierre Fabre, 5 Avenue
Napoléon III, 74160Saint Julien-en-Genevois,
France 2Cancer Research Center of Lyon (CRCL), Inserm
1052/CNRS, 69000Lyon,
France 3Université de Lyon, 69000Lyon,
France 4Hospices Civils de Lyon, 69000Lyon,
France 5GICC EA7501, Université de Tours, équipe IMT,
31 avenue Monge,
37200Tours,
France |
Pour surmonter les limitations des ADC actuels précédemment mentionnées en première
partie, cette seconde partie se focalisera sur des ADC innovants conçus et faisant
actuellement l’objet d’évaluations précliniques et d’études en phase clinique. Ces
nouveaux ADC sont caractérisés par des innovations concernant la chimie de
bioconjugaison (menant à des ADC homogènes), la partie ciblage (anticorps ou fragments),
l’espaceur (mécanisme de libération) ou le cytotoxique (mécanisme d’action). Enfin, les
combinaisons avec la chimiothérapie classique ou les inhibiteurs de points de contrôles
seront également discutées. |
ADC de troisième génération ADC homogènes (site-specific ADC) Chaque ADC approuvé est un mélange hétérogène rendant très difficile son analyse
[ 1] et le contrôle de
son procédé de fabrication. Le DAR n’est pas maîtrisé, et le mélange complexe
d’une préparation d’ADC influence significativement les profils de
pharmacocinétique-pharmacodynamique (PK-PD) de l’ADC: l’anticorps nu pourrait
être un inhibiteur compétitif, les conjugués ayant un DAR faible sont peu
efficaces et ceux au DAR élevé sont rapidement éliminés, compromettant la
fenêtre thérapeutique de l’ADC. Afin d’élargir cette dernière, des méthodologies
de bioconjugaison régio-spécifiques ont été développées depuis 2008 [ 2- 4] et peuvent être divisées en trois
catégories: (1) la bioconjugaison d’acides aminés naturels ou non, (2) la
bioconjugaison à l’aide d’enzymes ou (3) la bioconjugaison à base
d’espaceurs. Une première approche a consisté à introduire des acides aminés spécifiques par
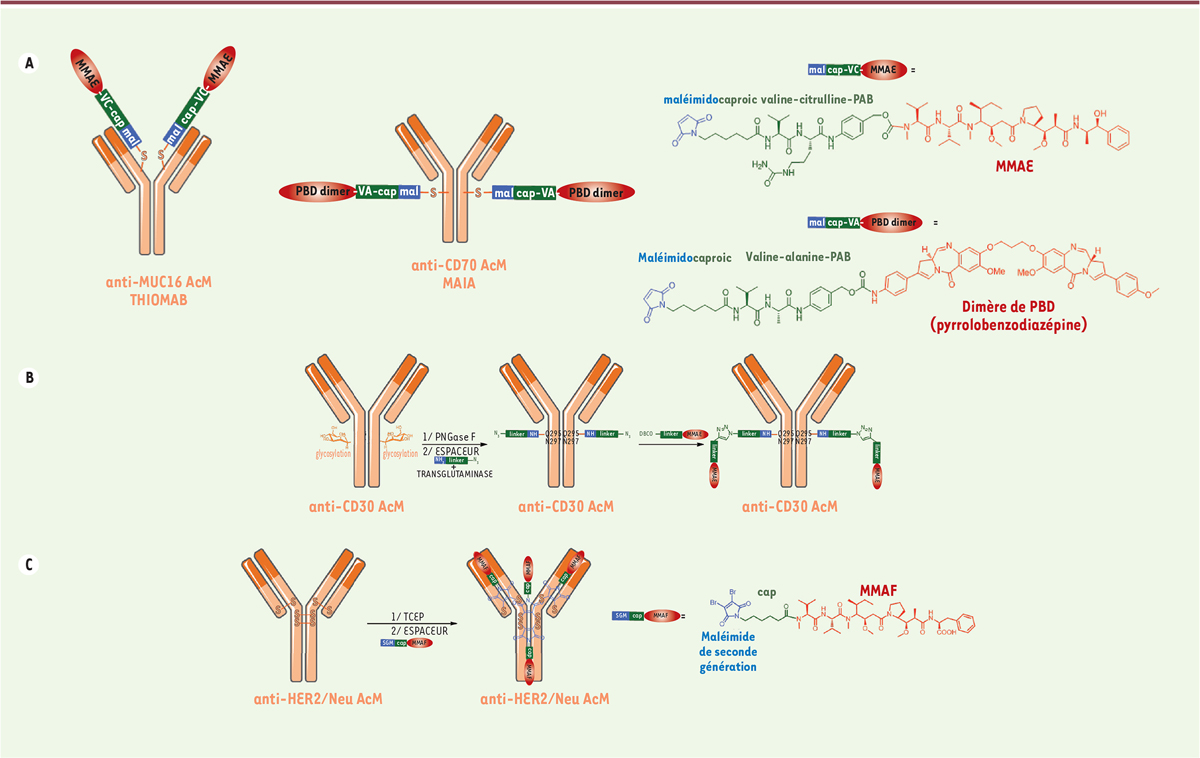
ingénierie d’anticorps. Junutula et ses collègues ont été les pionniers en 2008
en démontrant que la bioconjugaison contrôlée (régio-spécifique) d’un
cytotoxique sur un AcM améliorait l’indice thérapeutique de l’ADC [5]. Pour permettre la
conjugaison spécifique de l’espaceur-cytotoxique de l’Adcetris® à un
AcM ciblant l’antigène du cancer de l’ovaire MUC16, ces auteurs ont mis au point
deux substitutions par cystéine afin de préserver le repliement de
l’immunoglobuline (IgG), son assemblage et la liaison à l’antigène (Ag)
(Figure 1A). L’ADC
THIOMAB (TDC) résultant a été comparé à un ADC généré à partir d’une méthode de
bioconjugaison stochastique (en utilisant des cystéines issues de ponts
disulfures inter-chaînes réduits). ADC et TDC étaient également efficaces dans
les modèles de xénogreffe de souris, mais le TDC était toléré à des doses plus
élevées que l’ADC chez le rat et le singe cynomolgus et présentait une moindre
toxicité systémique in vivo. Inspirés par cette stratégie, deux
firmes ont mis au point une technologie analogue MAIA, pour la bioconjugaison de
leurs dimères pyrrolobenzodiazépines (PBD), en introduisant une mutation
sérine-cystéine en position 239 dans la région charnière de l’anticorps
(Figure 1A) [6].
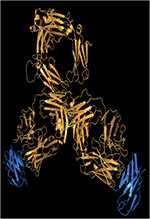
 | Figure 1. A. ADC homogènes générés par ingénierie d’anticorps
suivie d’une bio-conjugaison
régio-spécifique (DAR 2). B. ADC
homogène généré par déglycosylation
(position Q295) en présence de PNGase F suivie d’une bioconjugaison
par la transglutaminase (position 297) (L’immunoconjugué azoture, en
présence de DBCO-espaceur-MMAE, permet la production d’un ADC
homogène de DAR 2). C. ADC homogène de DAR 4 obtenu
par réduction ménagée (TCEP) des 4 ponts
disulfures inter-chaînes suivie d’une réaction de bioconjugaison via
un espaceur dibromomaléimide (DBM). |
Une deuxième possibilité est l’utilisation de technologies de bioconjugaison
régio-spécifique à l’aide d’une réaction enzymatique. La transglutaminase et les
sortases peuvent être utilisées à cette fin [2-4] ; par exemple, la
transglutaminase catalyse la formation de liaisons amides entre une chaîne
latérale de glutamine et une molécule contenant une amine primaire [7]. Ainsi, Strop et
al. ont mis au point une méthodologie en trois étapes utilisant la
transglutaminase pour construire un ADC [7]. L’AcM est tout d’abord déglycosylé par l’enzyme PNGase F au niveau
de l’asparagine 297. Ensuite, un espaceur hétérobifonctionnel aminé et azoté est
bioconjugué à l’AcM sur la glutamine 295 en présence d’une transglutaminase
microbienne. Enfin, la MMAE est greffée via une cyclo-addition
de Huisgen sans catalyse au cuivre (SPAAC) entre le conjugué azoture et un
espaceur portant le dibenzylcyclooctyne (DBCO) et la MMAE, afin de générer un
ADC avec un DAR de 2 (Figure
1B). Enfin, des ADC régiospécifiques peuvent également être générés à partir d’AcM
natifs. Dans cette stratégie, des espaceurs hétérobifonctionnels comprenant un
maléimide de seconde génération (SGM), par exemple le dibromomaléimide (DBM)
[8, 9] ou le dithiophénylmaléimide
(DSPh) [10], peuvent
générer des ADC plus homogènes et stables par bioconjugaison régiospécifique,
avec un DAR de 4 (dans le cas de l’IgG1). Les systèmes de bioconjugaison SGM
régiospécifiques offrent l’avantage, par rapport à la bioconjugaison
stochastique avec le maléimide classique, de limiter la formation d’espèces à
DAR faible et élevé, d’améliorer la stabilité structurelle des anticorps après
bioconjugaison ainsi que les propriétés pharmacocinétiques et l’indice
thérapeutique de l’ADC résultant (Figure
1C) [10]. Nouveaux formats d’ADC Malgré leur efficacité, la plupart des ADC ciblant des tumeurs solides n’ont pas
progressé au-delà d’essais cliniques de phase II, ce qui suggère qu’il existe
des paramètres supplémentaires nécessitant d’être optimisés pour atteindre une
mise sur le marché [ 11,
12]. Le nombre
d’ADC pour le traitement des tumeurs solides est limité et un nombre croissant
de ces conjugués ont été arrêtés en raison d’une activité insuffisante à des
doses répétées, à la DMT. Ceci peut être expliqué par le fait que presque tous
les ADC sont fondés sur un format IgG complet. Par conséquent, leur efficacité
est limitée par leur taille (150 kDa), associée à une pénétration et une
absorption médiocres dans la tumeur [ 13]. En plus de la taille de l’IgG, il est maintenant
considéré que la région Fc de celle-ci est délétère pour l’efficacité de l’ADC
[ 14]. En effet, la
longue demi-vie des ADC due à leur recyclage par le récepteur néonatal de la
région Fc (FcRn) [ 15]
augmente l’exposition aux tissus sains, et que les récepteurs pour la région Fc
des IgG (RFcγ) exprimés sur de nombreuses cellules du système immunitaire
peuvent fixer ces ADC, ces deux phénomènes étant associés à une toxicité
off-target [ 16, 17]. Des formats de conjugués de plus petites tailles [14, 18, 19]
ont été explorés pour remédier à ces inconvénients, notamment en utilisant
peptides [20],
fragments d’anticorps à domaine unique (sdAb ou VHH) [21], fragments variables à chaîne unique
(scFv) [22], fragments
de liaison à l’antigène (Fab) [23] ou de petites immuno-protéines (SIP sous forme de scFv
dimérisées à l’aide d’un domaine CHε4) [24]. Étonnamment, seuls quelques exemples de molécules
cytotoxiques (appelés ci-après « cytotoxiques ») efficacement vectorisés avec
ces nouveaux formats d’anticorps ont été publiés: l’équipe de Janda a décrit
plusieurs conjugués scFv-duocarmycine (DAR 1 ou 2), ciblant l’intégrine
α3β1, avec une EC50 comprise entre 2,7 et
180,8 nM sur les cellules de carcinome pancréatique SW1990 [25]. L’équipe de Godwin a décrit un
conjugué Fab-MMAE site-spécifique (DAR 1), ciblant HER2/neu et présentant une
EC50 de 0,2 nM sur des cellules de cancer du sein SK-BR-3 [23]. Quant à l’équipe de Spidel, elle a
généré deux conjugués scFv-auristatine F optimisés (DAR 2), ciblant CA9, un
antigène associé aux tumeurs du colon, présentant une efficacité similaire, avec
une EC50 de 0,57 et 0,81 nM sur des cellules cancéreuses du colon
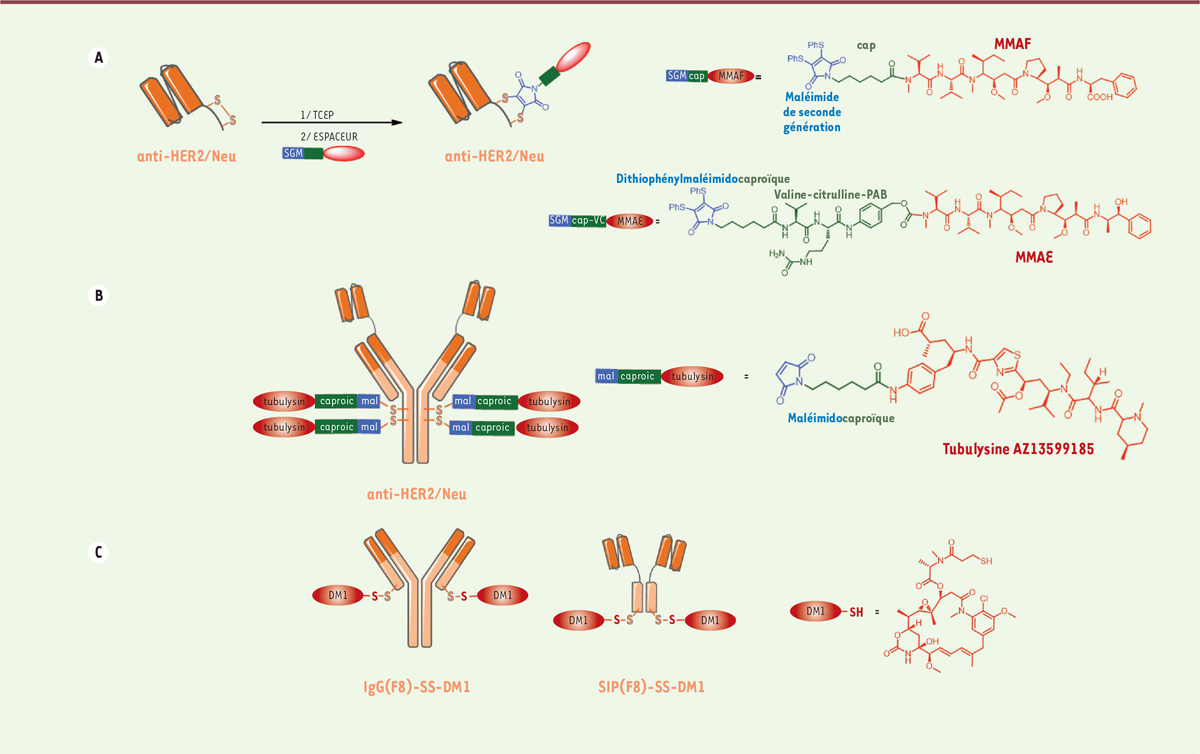
HT116-CA9 [26]. Plus récemment, deux cystéines ont été judicieusement incorporées en position
C-terminale d’un scFv anti-HER2/neu afin de permettre la bioconjugaison
contrôlée d’un espaceur hétérobifonctionnel, comprenant un maléimide de seconde
génération, clivable (pour la MMAE) ou non clivable (pour la MMAF), et de
générer deux nouveaux conjugués scFv-cytotoxique (SDC, Figure 2A) [27]. Les deux SDC conservent leur
affinité pour HER2/neu et sont capables de tuer efficacement les cellules
SK-BR-3 HER2/neu+
in vitro à des concentrations subnanomolaires (EC50
de 0,68 nM et 0,32 nM), sans effet sur les cellules MCF-7 HER2/neu-.
Les SDC de DAR 1 ne sont pas encore aussi puissants que les ADC correspondants
de DAR 4 [28], mais
leur potentiel est prometteur contre les tumeurs solides [29]. Les ADC actuels ciblant HER2 sont inefficaces pour éliminer les cellules
cancéreuses exprimant des niveaux faibles de HER2/neu. Par conséquent, environ
20 % seulement des patientes atteintes d’un cancer du sein sont éligibles pour
des thérapies ciblées sur HER2/neu. De plus, l’hétérogénéité intra-tumorale de
l’expression de HER2/neu est finalement responsable de la rechute des patientes
ayant initialement répondu au traitement. Afin d’obtenir une activité
anti-tumorale puissante dans les cellules cancéreuses présentant une gamme plus
large d’expression de HER2/neu, un ADC biparatopique ciblant HER2/neu a été
développé (Figure 2B)
[30], visant deux
épitopes de HER2/neu distincts (épitopes ciblés individuellement par le
trastuzumab et le pertuzumab), induisant un pontage des récepteurs HER2/neu,
favorisant une internalisation rapide, ainsi qu’un trafic et une dégradation
lysosomale améliorés. Deux résidus cystéine par chaîne lourde (S239C et S442C)
ont été introduits par ingénierie, pour produire un ADC biparatopique de DAR 4,
via la bioconjugaison régio-spécifique d’un espaceur
maléimidocaproyle lié à la tubulysine AZ13599185 (inhibiteur de microtubules).
Ce cytotoxique très puissant (IC50 de l’ordre du picomolaire)
présente également une très faible affinité pour les MDR (multidrug
resistance proteins: protéines transmembranaires assurant l’efflux
des xénobiotiques hors des cellules). Par conséquent, l’ADC biparatopique
démontre une activité anti-tumorale supérieure à celle du Kadcyla®
dans divers modèles de tumeurs représentant diverses sous-populations de
patientes. En outre, deux mutations combinées (L234F et S239C) ont réduit la
liaison aux RFcg afin de minimiser l’internalisation aspécifique de l’ADC
(indépendante de HER2/neu) due aux RFcg des tissus normaux, réduisant ainsi la
toxicité non ciblée conduisant par exemple à une thrombocytopénie [31]. Les essais cliniques
de cet ADC ont aussi été arrêtés, en 2018. Nouveaux ciblages et systèmes de libération associés Le ciblage d’antigènes membranaires exposés à la surface de cellules cancéreuses
et qui internalisent une fois fixés par un anticorps spécifique (appelés
ci-après internalisants) peut être extrêmement difficile dans les tumeurs
solides riches en stroma intercellulaire. Ainsi, une nouvelle approche consiste
à cibler le microenvironnement tumoral (stroma ou vaisseaux) au lieu des
cellules cancéreuses [ 32, 33].
Dans cette stratégie, des composants de la matrice extracellulaire (protéases,
milieu acide ou glutathion réducteur) pourraient être utilisés pour une
libération extracellulaire efficace de cytotoxiques utilisés dans des ADC
non-internalisants. À cette fin, Neri et ses collaborateurs ont décrit des immunoconjugués fondés sur
un mutant F8 d’une immunoprotéine SIP (small immunoprotein)
ciblant le domaine extracellulaire non internalisé de la fibronectine. La
fibronectine est un composant de la matrice extracellulaire sous-endothéliale de
la tumeur, facilement accessible aux immunoconjugués par rapport à la surface de
la cellule cancéreuse [34]. Le format SIP résulte de la fusion d’un scFv avec le domaine
CH4ε d’une IgE humaine [34]. Le SIP(F8) a
également été produit avec deux résidus cystéine non appariés en position
C-terminale, permettant la bioconjugaison contrôlée de deux molécules de DM1
afin de produire le conjugué SIP(F8)-SS-DM1 avec un DAR 2 (Figure 2C) [24]. Ceci a été comparé à son homologue
IgG(F8)-SS-DM1, portant un résidu de cystéine non apparié en position
C-terminale de chaque chaîne légère (Figure 2C). Dans ces immunoconjugués, le pont disulfure
formé après bioconjugaison est sensible au glutathion extracellulaire tumoral,
libérant la DM1 non modifiée sans aucun espaceur résiduel.
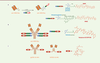 | Figure 2. A. SDC (scFv-drug conjugate) homogène
de DAR 1 obtenu par réduction ménagée (TCEP) du pont disulfure
intra-chaîne en C-terminal suivie d’une réaction de bioconjugaison
via un linker dithiophénylmaléimide (DSPh). B.
ADC homogène de DAR 4 comprenant un
anticorps biparatopique anti-HER2 conjugué à une tubulysine via un
linker maléimidocaproïque. C. Immunoconjugués
IgG(F8)-SS-DM1 et SIP(F8)-SS-DM1 et formule du cytotoxique
DM1. |
SIP(F8)-SS-DM1 s’est avéré être un meilleur candidat que son analogue
IgG(F8)-SS-DM1 dans des expériences thérapeutiques in vivo.
Neri et ses collègues ont démontré que le SIP(F8)-SS-DM1 s’accumulait
préférentiellement dans la matrice tumorale extracellulaire sous-endothéliale,
présentait une cinétique de libération de DM1 plus rapide et était bien toléré à
des doses cliniquement pertinentes [24].
Enfin, l’avantage des ADC non-internalisants est le contournement de certains
mécanismes de résistance par rapport aux immunoconjugués internalisants. Nouveaux agents cytotoxiques En parallèle, de nouveaux cytotoxiques ont été développés pour cibler les
cellules cancéreuses à faible expression d’Ag ou résistantes aux auristatines ou
aux maytansinoïdes. À cette fin, des dimères de PBD ont été mis au point,
contenant deux fonctions imines alkylantes, capables de former des liaisons
covalentes avec l’ADN: ils sont environ 50 à 100 fois plus efficaces que les
cytotoxiques classiques utilisés pour les ADC (MMAE ou DM1), présentant une
activité picomolaire contre les cellules de nombreuses lignées tumorales
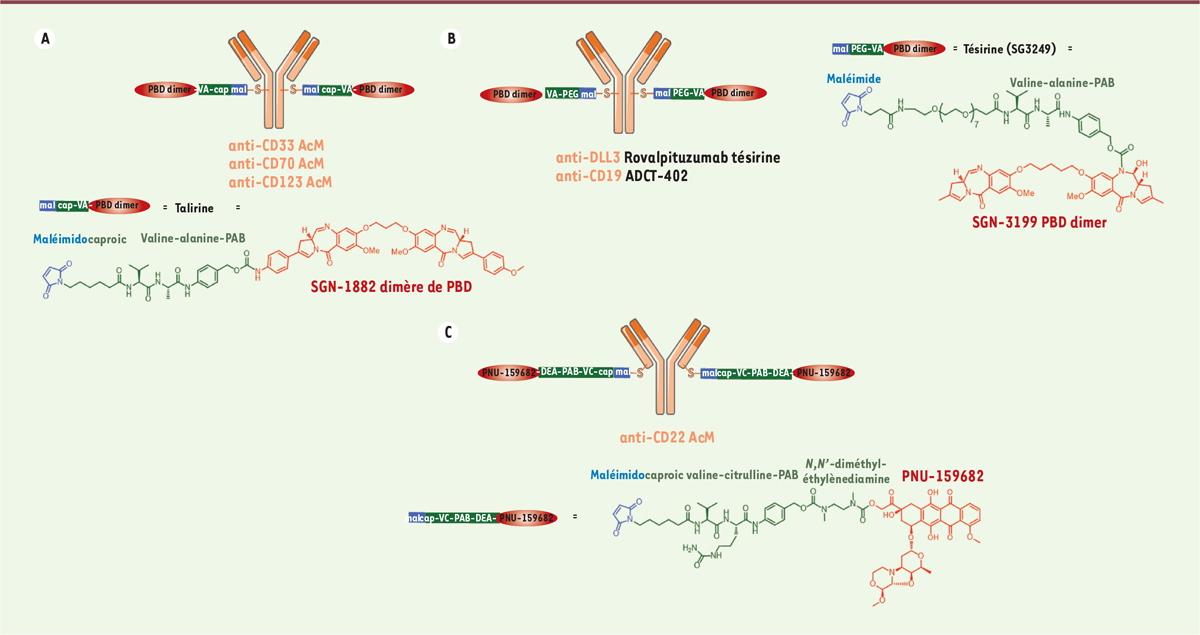
humaines (IC 50 = 2 - 7 pM) [ 35]. Les dimères de PBD ont été introduits en tant que
cytotoxiques d’ADC à la fin des années 2000. Cela a conduit au développement de
SGN-CD33A [ 6] et de SGN-CD70A [ 36], deux ADC à base de
PBD dont les essais cliniques de phase III ont été récemment arrêtés. Les deux
ADC contiennent le même espaceur-cytotoxique clivable appelé talirine ; un
espaceur maléimidocaproyle avec une gâchette valine-alanine-PAB sensible à la
cathepsine B, capable de conjuguer le dimère de PBD SGN-1882 à deux résidus
cystéines incorporés par ingénierie dans la région charnière de l’AcM (mutation
S239C), donnant un DAR contrôlé de 2 (Figure 3A). La toxicité élevée de ces ADC permet le
ciblage d’Ag moins exprimés, tel que CD33 ou CD70. De plus, les dimères de PBD
n’étant pas des substrats des MDR et ne visant pas la tubuline, ils peuvent
également être utilisés en tant que cytotoxiques d’ADC contre des tumeurs
résistantes aux ADC à base de MMAE ou de DM1. Si la talirine conjuguée n’a pas donné satisfaction en clinique, son homologue,
la tésirine conjuguée, offre un résultat mitigé (Figure 3B): le rovalpituzumab tésirine (Rova-T
ou SC16LD6.5) est un ADC anti-DLL3 dont l’essai en phase III dans le cancer du
poumon à petites cellules a récemment été arrêté, tandis que le loncastuximab
tésirine (ADCT-402) est testé en phase II pivotale contre la leucémie aiguë
lymphoblastique à cellules B. La tésirine (SG3249) a été conçue pour combiner
une activité anti-tumorale puissante avec des propriétés physico-chimiques
souhaitables (e.g. hydrophobie favorable et bioconjugaison
améliorée). Une des imines réactives est coiffée d’un espaceur valine-alanine
clivable par la cathepsine B. De manière analogue, en 2009, Ravi Chari et ses collègues ont présenté les
indolinobenzodiazépines (IGN) [37]. Leur utilisation en tant que cytotoxiques d’ADC a permis de
générer des ADC très puissants contre les cellules cancéreuses même
multi-résistantes in vitro (IC50 = 5 - 20 pM)
exprimant de faibles niveaux d’Ag (7 000 Ag par cellule). En parallèle, un nouvel analogue d’anthracycline, nommé PNU-159682, a récemment
été développé. Les anthracyclines sont l’une des classes de chimiothérapies les
plus largement utilisées. Le très puissant PNU-159682 (IC50 de 20-100
pM) a été utilisé pour générer l’ADC anti-CD22-NMS249, via un
espaceur MC-VC-PAB-DEA auto-immolable allongé comprenant en plus du PAB
classique une N,N’-diméthyléthylènediamine
(DEA) (Figure 3C) [38]. In
vivo, cet ADC anti-CD22-NMS249 était au moins aussi efficace qu’un
ADC anti-CD22-VC-MMAE dans des modèles tumoraux de xénogreffe, mais conservait
son efficacité dans un modèle résistant à l’ADC anti-CD22-VC-MMAE [38].
 | Figure 3. A. ADC homogène de DAR2 portant la talirine incluant un
dérivé dimérique de pyrrolobenzodiazépine
(SGN-1882). B. ADC homogènes de DAR2 portant la
tésirine incluant un dérivé dimérique de
pyrrolobenzodiazépine (SGN-3199).
C. ADC homogène incluant un dérivé
d’anthracycline (PNU-159682). PBD dimer:
dimère de PBD. |
Stratégies combinées au-delà des dogmes: ADC en phase II pivotale ou en phase
III Le développement des ADC a généré de nombreux dogmes. Parmi eux, on peut citer le
ciblage d’un Ag non exprimé de manière ubiquitaire, le ciblage d’un Ag fortement
surexprimé, un Ag internalisant, un cytotoxique dont le potentiel d’activité
devait atteindre celui des auristatines et maytansines, et l’IgG comme seul
format pour garantir un temps de demi-vie élevé et éventuellement la
conservation de l’activité effectrice de l’anticorps à partir duquel l’ADC était
généré. Nous allons voir que parmi les ADC les plus avancés dans les études
cliniques, non seulement ces derniers combinent plusieurs innovations (parmi
lesquelles la cible, le format, le système de libération, le mécanisme d’action
du cytotoxique), mais ils bousculent également un ou plusieurs dogmes avec
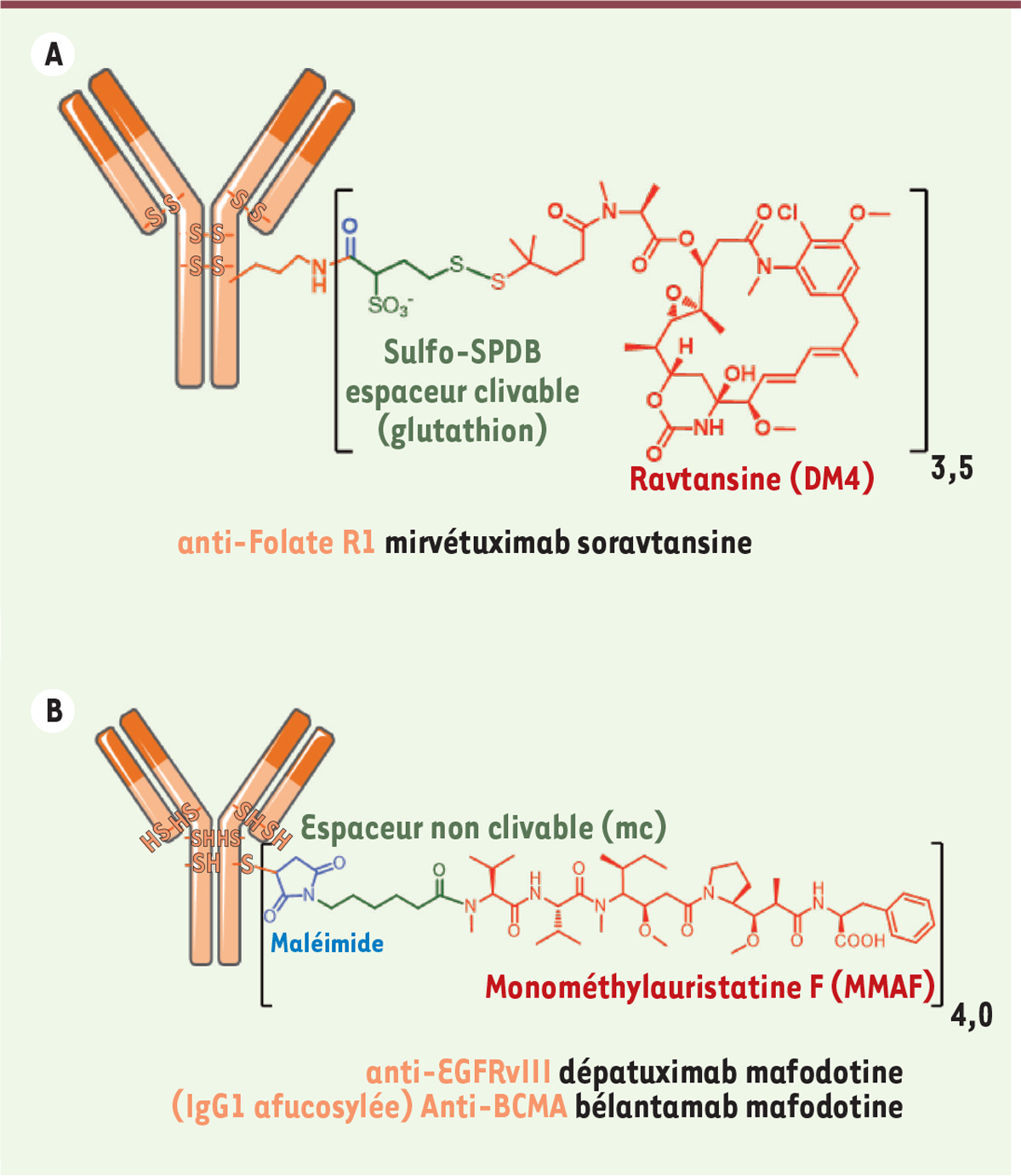
succès. Parmi eux, le mirvétuximab soravtansine est un exemple de développement très
intéressant [39-41]. Cet ADC est plutôt
surprenant car le système de libération en conditions réductrices fut considéré
comme trop sensible lors du développement de l’ado-trastuzumab emtansine. Le
mirvétuximab soravtansine résulte donc de la bioconjugaison de la ravtansine
(DM4) à un anticorps anti-folate R1, via un espaceur clivable
en milieu réducteur (glutathion), optimisé par la présence de deux groupements
méthyles en position alpha du pont disulfure et par la présence d’un groupement
sulfonyle améliorant l’hydrophilie de l’espaceur et donc la bioconjugaison de la
DM4 (Figure 4A). Cet ADC
est actuellement testé contre le cancer épithélial de l’ovaire dans une étude
clinique de phase III. Etonnamment, malgré le développement de nombreuses technologies permettant une
bioconjugaison régiosélective d’un AcM, à l’index thérapeutique amélioré (10 en
étude clinique et plus de 40 en pré-clinique), aucune d’entre elles n’a encore
été validée par l’approbation d’un ADC homogène. On retrouve d’ailleurs
l’espaceur-cytotoxique de seconde génération de l’Adcetris®
(mc-VC-MAB-MMAE, Figure
1A) dans l’enfortumab védotine, un ADC résultant d’une
bioconjugaison stochastique sur les résidus cystéines d’un anticorps ciblant la
Nectine 4, actuellement en étude clinique de phase II pivotale [42]. Le 16 juillet 2019, un BLA
(Biologics License Application) pour cet ADC a été soumis à
la FDA pour une possible mise sur le marché accélérée pour des patients atteints
de cancers urothéliaux métastatiques et préalablement traités par des anticorps
anti-PD1/PDL1. L’EGFR (epithelial growth factor receptor) est exprimé de
manière ubiquitaire au niveau des cellules épithéliales en général et la peau en
particulier, et ne semblait pas être une cible favorable pour un ADC. Pourtant,
l’ADC ABT-414 a été généré en bioconjuguant de manière stochastique la MMAF
(auristatine optimisée pour être utilisée avec un espaceur non clivable)
via un espaceur maléimide à un AcM ciblant une isoforme
particulière de l’EGFR surexprimée dans les tumeurs, l’EGVRvIII (Figure 4B). Le dépatuximab
mafodotine était encore récemment testé contre le glioblastome dans des études
cliniques de phase III [43] arrêtées en 2019. Par contre, le bélantamab mafodotine,
utilisant la même technologie de conjugaison (maléimide + MMAF) sur un anticorps
de type IgG1 afucosylé anti-BCMA (B-cell maturation antigen)
(Figure 4B), est
actuellement en étude clinique de phase II pivotale contre le lymphome diffus à
grandes cellules B.
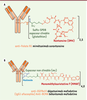 | Figure 4.
A. Formule du mirvétuximab soravtansine, anticorps
anti-folate R1 conjugué à la DM4 via un espaceur non
clivable. B. Formule des dépatuximab mafodotine et
bélantuzumab mafodotine, anticorps conjugués à la MMAF via
un espaceur non clivable.
|
Malgré le ciblage spécifique d’un antigène, les ADC sont encore associés à une
forte toxicité, spécifique ou non à leur cible due à plusieurs mécanismes
engendrant la libération anticipée non contrôlée du cytotoxique en dehors de la
tumeur. Devant ce constat, certaines sociétés se sont tournées vers
l’utilisation de cytotoxiques moins puissants que la MMAE ou la DM1, et au
mécanisme d’action original pour lutter contre la résistance aux inhibiteurs de
la polymérisation de la tubuline. Ces ADC possèdent également des systèmes de
libération pas forcément spécifiques de conditions intracellulaires. À cette fin, un triple pari a été gagné avec la génération du sacituzumab
govitécan (IMMU-132,
Figure 5A
), un anticorps anti-Trop-2 (cible peu exprimée) [44] conjugué au SN-38 (métabolite
actif de l’irinotécan, moins actif que MMAE et DM1, avec un mécanisme d’action
original) via un espaceur maléimide clivable (à pH acide,
système de libération mixte intra- et extracellulaire) et pégylé.
L’accomplissement est d’autant plus impressionnant que cet ADC est indiqué dans
le cancer du sein triple négatif (TNBC) pour lequel il n’existe toujours pas de
traitement [45]. Grâce
à son espaceur pégylé, cet ADC possède un DAR 8, sans compromettre sa tolérance
ni son efficacité. Le DAR 4 a longtemps été idéalisé comme optimal (DM1 ou
MMAE). Cet ADC montre que, désormais, le DAR optimal d’un ADC va dépendre de
nombreux paramètres, principalement du caractère hydrophile de la combinaison de
l’espaceur et du cytotoxique greffé. Enfin, cet ADC est aujourd’hui en instance
d’être accepté par la FDA (en statut BLA) après une phase III réalisée avec
succès à condition de résoudre certains problèmes de CMC (Chemistry
Manufacturing Control).
 | Figure 5. A. Formule du sacituzumab govitécan, anticorps
anti-Trop-2 conjugué au SN-38 via un
espaceur clivable (acidité).
B. Formule du DS-8201a, trastuzumab conjugué à
l’exatécan DX-8951 via un espaceur sensible
à la protéolyse. C. Formule du SYD985, trastuzumab
anti-HER2/neu conjugué à la seco-DUBA via
un espaceur clivable (cathepsine
B). |
De manière analogue, un dérivé de l’irinotécan, le DXd (exatécan ou DX-8951),
permettant de ne pas utiliser un espaceur particulièrement hydrophile, a été
élaboré au Japon ; il s’agit d’un cytotoxique plus actif que le SN-38 in
vitro sur des cellules cancéreuses, qui conduit à un effet
cytotoxique collatéral sur les cellules tumorales avoisinantes
(bystander killing effect). La bioconjugaison du DXd au
trastuzumab anti-HER2/neu via un espaceur maléimide sensible à
la protéolyse a permis d’obtenir l’ADC trastuzumab deruxtécan (DS-8201a) de DAR
8 (Figure 5B) [46]. Malgré son DAR 8
élevé, le DS-8201a est très bien toléré, et est actuellement testé
comparativement au Kadcyla® dans une étude clinique de phase III dans
le cancer du sein métastatique HER2/neu+. En parallèle, un ADC, le trastuzumab duocarmazine (SYD985) a été récemment
développé [47]. Cet ADC
a un DAR moyen de 2,8 et résulte de la combinaison d’un AcM anti-HER2/neu et
d’un précurseur de la duocarmycine (seco-DUBA), relié par un espaceur clivable
sensible à la cathepsine B, optimisé grâce à la présence de deux unités pégylées
pour assurer une meilleur solubilité (et donc conjugaison) de
l’espaceur-cytotoxique (Figure
5C). SYD985 est actuellement testé comparativement au T-DM1
dans une étude clinique de phase III dans le cancer du sein métastatique
HER2/neu+. |
Les résultats prometteurs obtenus en monothérapie en situation de rechute ou
réfractaire ont permis l’approbation de plusieurs ADC. Plusieurs questions se posent
désormais sur la place que vont occuper les ADC dans les traitements des patients
atteints de cancers. Combinaisons avec la chimiothérapie conventionnelle De nombreuses études explorent actuellement les combinaisons de
l’Adcetris ® ou du Kadcyla ® avec la chimiothérapie
conventionnelle. L’objectif peut être de remplacer un agent anti-tubuline par un
ADC couplé à un agent anti-tubuline et susceptible d’entraîner une toxicité
moindre, par exemple en remplaçant la vincristine par l’Adcetris ®
dans le traitement de certains lymphomes (NCT01777152). Un autre objectif peut
être de renforcer l’activité d’une combinaison établie et dont les mécanismes
d’action sont différents, comme dans la combinaison de l’Adcetris ®
avec une combinaison de cisplatine, dexaméthasone et cytarabine pour le
traitement de la maladie de Hodgkin [ 48]. Traitements adjuvants, d’entretien ou de consolidation Un nombre croissant de patients cancéreux sont mis en rémission par un traitement
de première ligne, sans pour autant être en rémission complète ou guéris.
Plusieurs situations font actuellement appel à un traitement adjuvant (lorsque
la maladie n’est pas détectable) ou d’entretien (lorsque les patients ont une
réponse partielle). Le Kadcyla ® a ainsi montré sa supériorité par
rapport au trastuzumab, son équivalent non conjugué, dans l’étude randomisée
KATHERINE (NCT01772472) en tant que traitement adjuvant chez des patientes
conservant une maladie résiduelle mammaire ou ganglionnaire après un traitement
néo-adjuvant, avec une diminution de 50 % du risque de récidive locale ou de
décès [ 49]. Il est
probable que d’autres maladies dans lesquelles un traitement d’entretien par des
anticorps nus ont déjà fait la preuve de leur efficacité, telles que certains
types de lymphomes malins par exemple, bénéficieront également de
l’administration d’ADC à la suite d’un traitement de première ligne. Combinaisons des ADC et des inhibiteurs de points de contrôle immunitaire
(immune checkpoints) L’intérêt de combiner des chimiothérapies cytotoxiques avec des inhibiteurs des
points de contrôle immunitaire (IPCI) tels que les AcM anti-PD1 et anti-PDL1
fait actuellement l’objet de très nombreuses études cliniques [ 50]. Outre des mécanismes d’action
complémentaires, la possibilité d’augmenter l’immunogénicité des tumeurs par le
biais d’une mort immunogène induite par la chimiothérapie constitue un argument
fort pour l’association de certains agents cytotoxiques avec des
immunothérapies. La combinaison d’ADC avec des IPCI apparait donc comme une
démarche logique, en particulier chez des patients déjà lourdement prétraités et
chez qui l’on veut éviter la toxicité systémique de la chimiothérapie. Une étude
de phase I/II de combinaison de l’Adcetris ® avec le nivolumab, un
anticorps dirigé contre PD1, chez des patients atteints de maladie de Hodgkin en
rechute ou réfractaire, a montré un taux de réponse de 82 %, dont 61 % de
réponses complètes [ 51]. Ces résultats ont ensuite été confirmés dans l’étude Checkmate 205,
avec des réponses chez plus des deux tiers des patients [ 52]. D’une façon plus générale, les ADC se sont montrés efficaces en situation de
rechute et, plus récemment, en situation adjuvante dans le cancer du sein
HER2/neu+. Le positionnement de ces agents dans l’avenir va
dépendre de plusieurs facteurs, notamment de l’importance des avantages apportés
par rapport à la chimiothérapie conventionnelle (soit en termes de toxicité,
soit d’activité anti-tumorale), des alternatives thérapeutiques disponibles et
du coût de la prise en charge. Les ADC constituent une famille de composés
encore récente, dont les agents approuvés sont fondés sur des conjugués
fortement toxiques, aux mécanismes d’action similaires à ceux de la
chimiothérapie cytotoxique conventionnelle. Le développement de nouveaux ADC,
fondés soit sur des agents conventionnels tels que le sacituzumab govitécan, un
anticorps dont le conjugué est le métabolite actif de l’irinotécan, soit sur des
conjugués ayant des mécanismes d’action originaux, pourrait également avoir un
impact important sur l’utilisation en clinique des ADC. |
Conclusion et perspectives Les ADC classiques internalisants actuellement utilisés en clinique sont conçus pour
délivrer spécifiquement de puissants agents cytotoxiques aux cellules cancéreuses.
Cependant, malgré leur conception assez élaborée, les ADC font l’objet de plusieurs
limitations (par exemple, pénétration de tumeurs solides limitée, toxicité) et sont
associés à l’apparition de mécanismes de résistance. Pour surmonter ces limitations,
de nouveaux formats d’anticorps, de nouveaux systèmes de libération, des cibles
antigéniques mieux choisies et non internalisantes, de nouveaux agents cytotoxiques
et des méthodes de bioconjugaison régio-spécifiques (ingénierie d’anticorps ou
espaceurs originaux), ont été étudiés afin de faire avancer le développement des
ADC. Malheureusement, de nombreuses innovations n’ont pas encore été validées par
une utilisation dans des protocoles cliniques. Les ADC qui en découlent sont encore
en étude préclinique ou clinique, et un petit nombre sont allés jusqu’en phase
clinique II pivotale ou phase III. Néanmoins, ce champ de recherche offre de
nombreuses perspectives encourageantes, notamment lorsque les ADC seront combinés
avec de la chimiothérapie classique ou des inhibiteurs de point de contrôle
immunitaire, afin de mieux potentialiser leurs effets. Cela leur permettra peut-être
de se rapprocher un peu plus de la magic bullet imaginée par Paul
Ehrlich au début du XXe siècle. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
1. Beck
A,
Terral
G,
Debaene
F, et al.
Cutting-edge mass spectrometry methods for the multi-level
structural characterization of antibody-drug conjugates .
Expert Rev Proteomics.
2016; ; 13:
:157.–183. 2. Panowski
S,
Bhakta
S,
Raab
H, et al.
Site-specific antibody drug conjugates for cancer
therapy . MAbs.
2014; ; 6:
:34.–45. 3. Agarwal
P,
Bertozzi
CR. Site-specific
antibody-drug conjugates: the nexus of bioorthogonal chemistry, protein
engineering, and drug development . Bioconjug
Chem.
2015; ; 26:
:176.–192. 4. Jackson
DY. Processes for
constructing homogeneous antibody drug conjugates .
Org Process Res Dev.
2016; ; 20:
:852.–866. 5. Junutula
JR,
Raab
H,
Clark
S, et al.
Site-specific conjugation of a cytotoxic drug to an antibody
improves the therapeutic index . Nat
Biotechnol.
2008; ; 26:
:925.–932. 6. Sutherland
MSK,
Walter
RB,
Jeffrey
SC, et al.
SGN-CD33A: a novel CD33-targeting antibody-drug conjugate using a
pyrrolobenzodiazepine dimer is active in models of drug-resistant
AML . Blood.
2013; ; 122:
:1455.–1463. 7. Strop
P.. Versatility of
microbial transglutaminase versatility of microbial transglutaminase pavel
strop . Bioconj Chem.
2014; ; 25:
:855.–862. 8. Behrens
CR,
Ha
EH,
Chinn
LL, et al.
Antibody-drug conjugates (ADCs) derived from Interchain cysteine
cross-linking demonstrate improved homogeneity and other pharmacological
properties over conventional heterogeneous ADCs .
Mol Pharm.
2015; ; 12:
:3986.–3998. 9. Joubert
N,
Viaud-Massuard
MC,
Respaud
R. Novel antibody-drug
conjugates and the use of same in therapy, WO2015004400. 2015;
WO2015004400A1.. 10. Schumacher
FF,
Nunes
JPM,
Maruani
A, et al.
Next generation maleimides enable the controlled assembly of
antibody–drug conjugates via native disulfide bond bridging .
Org Biomol Chem.
2014; ; 12: :7261.. 11. Govindan
S V.,
Sharkey
RM,
Goldenberg
DM.. Prospects and
progress of antibody-drug conjugates in solid tumor
therapies . Expert Opin Biol
Ther.
2016; ; 16:
:883.–893. 12. Nagayama
A,
Ellisen
LW,
Chabner
B, et al.
Antibody-drug conjugates for the treatment of solid tumors:
clinical experience and latest developments .
Target Oncol.
2017; ; 12:
:719.–739. 13. Jain
RK. Physiological
barriers to delivery of monoclonal antibodies and other macromolecules in
tumors . Cancer Res.
1990; ; 50:
:s814s.–s8149. 14. Deonarain
MP,
Yahioglu
G,
Stamati
I, et al.
Emerging formats for next-generation antibody drug
conjugates . Expert Opin Drug
Discov.
2015; ; 10:
:463.–481. 15. Brachet
G,
Respaud
R,
Arnoult
C, et al.
Increment in drug loading on an antibody-drug conjugate increases
its binding to the human neonatal Fc receptor in vitro .
Mol Pharm.
2016; ; 13:
:1405.–1412. 16. Litvak-Greenfeld
D,
Benhar
I. Risks and
untoward toxicities of antibody-based immunoconjugates .
Adv Drug Deliv Rev.
2012; ; 64:
:1782.–1799. 17. de Goeij
BECG,
Lambert
JM. New developments
for antibody-drug conjugate-based therapeutic approaches .
Curr Opin Immunol.
2016; ; 40:
:14.–23. 18. Casi
G,
Neri
D. Antibody-dDrug
conjugates and small molecule-drug conjugates: opportunities and challenges
for the development of selective anticancer cytotoxic
agents . J Med Chem.
2015; ; 58:
:8751.–8761. 19. Deonarain
M,
Yahioglu
G,
Stamati
I, et al.
Small-format drug conjugates: a viable alternative to ADCs for
solid tumours? . Antibodies.
2018; ; 7:
:16.–35. 20. You
Y,
Xu
Z,
Chen
Y. Doxorubicin
conjugated with a trastuzumab epitope and an MMP-2 sensitive peptide linker
for the treatment of HER2-positive breast cancer .
Drug Deliv.
2018; ; 25:
:448.–460. 21. Massa
S,
Xavier
C, De
Vos
J
, et al.
Site-specific labeling of cysteine-tagged camelid single-domain
antibody-fragments for use in molecular imaging .
Bioconjug Chem.
2014; ; 25:
:979.–988. 22. Albrecht
H,
Burke
PA,
Natarajan
A, et al.
Production of soluble ScFvs with C-terminal-free thiol
for . Bioconjug Chem.
2004: :16.–26. 23. Badescu
G,
Bryant
P,
Bird
M, et al.
Bridging disulfides for stable and defined antibody drug
conjugates . Bioconjug Chem.
2014; ; 25:
:1124.–1136. 24. Gebleux
R,
Wulhfard
S,
Casi
G, et al.
Antibody format and drug release rate determine the therapeutic
activity of noninternalizing antibody-drug conjugates .
Mol Cancer Ther.
2015; ; 14:
:2606.–2612. 25. Lillo
AM,
Sun
C,
Gao
C, et al.
A Human single-chain antibody specific for integrin α3β1 capable
of cell internalization and delivery of antitumor agents .
Chem Biol.
2004; ; 11:
:897.–906. 26. Spidel
JL,
Albone
EF,
Cheng
X, et al.
Engineering humanized antibody framework sequences for optimal
site-specific conjugation of cytotoxins .
MAbs.
2017; ; 9:
:907.–915. 27. Aubrey
N,
Allard-Vannier
E,
Martin
C, et al.
Site-specific conjugation of auristatins onto engineered scFv
using second generation maleimide to target HER2-positive breast cancer in
vitro . Bioconjug Chem.
2018; ; 29:
:3516.–3521. 28. Bryden
F,
Martin
C,
Letast
S, et al.
Impact of cathepsin B-sensitive triggers and hydrophilic linkers
on in vitro efficacy of novel site-specific antibody-drug
conjugates . Org Biomol
Chem.
2018; ; 16:
:1882.–1889. 29. Adams
GP,
McCartney
JE,
Tai
MS, et al.
Highly specific in vivo tumor targeting by monovalent and
divalent forms of 741F8 anti-c-erbB-2 single-chain Fv .
Cancer Res.
1993; ; 53:
:4026.–4034. 30. Li
JY,
Perry
SR,
Muniz-Medina
V, et al.
A Biparatopic HER2-targeting antibody-drug conjugate induces
tumor regression in primary models refractory to or ineligible for
HER2-targeted therapy . Cancer
Cell.
2016; ; 29:
:117.–129. 31. Uppal
H,
Doudement
E,
Mahapatra
K, et al.
Potential mechanisms for thrombocytopenia development with
trastuzumab emtansine (T-DM1) . Clin Cancer
Res.
2015; ; 21:
:123.–133. 32. Joubert
N,
Denevault-Sabourin
C,
Bryden
F, et al.
Towards antibody-drug conjugates and prodrug strategies with
extracellular stimuli-responsive drug delivery in the tumor microenvironment
for cancer therapy . Eur J Med
Chem.
2017; ; 142:
:393.–415. 33. Matsumura
Y.. Cancer stromal
targeting (CAST) therapy . Adv Drug Deliv
Rev.
2012; ; 64:
:710.–719. 34. Casi
G,
Neri
D. Noninternalizing
targeted cytotoxics for cancer therapy . Mol
Pharm.
2015; ; 12:
:1880.–1884. 35. Mantaj
J,
Jackson
PJM,
Rahman
KM, et al.
From anthramycin to pyrrolobenzodiazepine (PBD)-containing
antibody-drug conjugates (ADCs) . Angew
Chemie Int Ed.
2017; ; 56:
:462.–488. 36. Sandall
SL,
McCormick
R,
Miyamoto
J, et al.
SGN-CD70A, a pyrrolobenzodiazepine (PBD) dimer linked ADC,
mediates DNA damage pathway activation and G2 cell cycle arrest leading to
cell death . Cancer Res.
2015;; 75: :946. ( abstract
946.). 37. Chari
RVJ,
Miller
ML,
Widdison
WC. Antibody-drug
conjugates: an emerging concept in cancer therapy .
Angew. Chemie - Int. Ed.
2014; ; 53:
:3796.–3827. 38. Yu
SF,
Zheng
B,
Go
M, et al.
A novel anti-CD22 anthracycline-based antibody-drug conjugate
(ADC) that overcomes resistance to auristatin-based ADCs .
Clin Cancer Res.
2015; ; 21:
:3298.–3306. 39. Ponte
JF,
Ab
O,
Lanieri
L, et al.
Mirvetuximab soravtansine (IMGN853), a folate receptor alpha
targeting antibody-drug conjugate, potentiates the activity of standard of
care therapeutics in ovarian cancer models .
Neoplasia (United States).
2016; ; 18:
:775.–784. 40. Sun
X,
Ponte
JF,
Yoder
NC, et al.
Effects of drug-antibody ratio on pharmacokinetics,
biodistribution, efficacy, and tolerability of antibody-maytansinoid
conjugates . Bioconjug Chem.
2017; ; 28:
:1371.–1381. 41. Widdison
WC,
Ponte
JF,
Coccia
JA, et al.
Development of anilino-maytansinoid ADCs that efficiently release
cytotoxic metabolites in cancer cells and induce high levels of bystander
killing . Bioconjug Chem.
2015; ; 26:
:2261.–2278. 42. Challita-Eid
PM,
Satpayev
D,
Yang
P, et al.
Enfortumab vedotin antibody-drug conjugate targeting nectin-4 is
a highly potent therapeutic agent in multiple preclinical cancer
models . Cancer Res.
2016; ; 76:
:3003.–3013. 43. Goss
GD,
Vokes
EE,
Gordon
MS, et al.
Efficacy and safety results of depatuxizumab mafodotin (ABT-414)
in patients with advanced solid tumors likely to overexpress epidermal
growth factor receptor .
Cancer.
2018; ; 124:
:2174.–2183. 44. Goldenberg
DM,
Cardillo
TM,
Govindan
S V, et al.
Trop-2 is a novel target for solid cancer therapy with
sacituzumab govitecan (IMMU-132), an antibody-drug conjugate
(ADC) . Oncotarget.
2015; ; 6:
:22496.–22512. 45. Govindan
SV,
Starodub
AN,
Juric
D, et al.
Efficacy and safety of anti-trop-2 antibody drug conjugate
sacituzumab govitecan (IMMU-132) in heavily pretreated patients with
metastatic triple-negative breast cancer . J
Clin Oncol.
2018; ; 2017:
:2141.–2148. 46. Ogitani
Y,
Aida
T,
Hagihara
K, et al.
DS-8201a, a novel HER2-targeting ADC with a novel DNA
topoisomerase I inhibitor, demonstrates a promising antitumor efficacy with
differentiation from T-DM1 . Clin Cancer
Res.
2016; ; 22:
:5097.–5108. 47. Elgersma
RC,
Coumans
RGE,
Huijbregts
T, et al.
Design, synthesis, and evaluation of linker-duocarmycin payloads:
toward selection of HER2-targeting antibody-drug conjugate
SYD985 . Mol Pharm.
2015; ; 12:
:1813.–1835. 48. Hagenbeek
A,
Mooij
H,
Zijlstra
J, et al.
Phase I dose-escalation study of brentuximab-vedotin combined
with dexamethasone, high-dose cytarabine and cisplatin, as salvage treatment
in relapsed/refractory classical Hodgkin lymphoma: the HOVON/LLPC transplant
BRaVE study . Haematologica.
2019; ; 104:
:e151.–e153. 49. von
Minckwitz
G,
Huang
C-S,
Mano
MS, et al.
Trastuzumab emtansine for residual invasive HER2-positive breast
cancer . N Engl J Med.
2019; ; 380:
:617.–628. 50. Mahoney
KM,
Rennert
PD,
Freeman
GJ. Combination
cancer immunotherapy and new immunomodulatory targets .
Nat Rev Drug Discov.
2015; ; 14:
:561.–584. 51. Herrera
AF,
Moskowitz
AJ,
Bartlett
NL, et al.
Interim results of brentuximab vedotin in combination with
nivolumab in patients with relapsed or refractory Hodgkin
lymphoma . Blood.
2018; ; 131:
:1183.–1194. 52. Armand
P,
Engert
A,
Younes
A, et al.
Nivolumab for relapsed/refractory classic Hodgkin lymphoma after
failure of autologous hematopoietic cell transplantation: extended follow-up
of the multicohort single-arm phase II checkmate 205 trial .
J Clin Oncol.
2018; ; 36:
:1428.–1439. |