| |
| Med Sci (Paris). 35(12): 1083–1091. doi: 10.1051/medsci/2019216.Imiter la réponse immunitaire humorale
polyclonale De l’association de deux anticorps monoclonaux aux
productions oligoclonales Christel Larbouret,1 Marie-Alix Poul,1 and Thierry Chardès1,2* 1Institut de Recherche en Cancérologie de Montpellier (IRCM),
Inserm U1194, Université de Montpellier, Institut régional du Cancer de
Montpellier (ICM), 34298Montpellier,
France 2Centre National de la Recherche Scientifique
(CNRS), Paris, France |
Au xixe siècle, les travaux pionniers de Shibasaburo Kitasato et Emil
von Behring en Allemagne, et d’Emile Roux en France, ouvrirent la voie à la
sérothérapie, qui consiste en l’utilisation à but thérapeutique de sérums d’animaux ou
d’hommes préalablement immunisés, contenant des anticorps spécifiques de pathogènes
comme principe actif. César Milstein et Georges Köhler ont révolutionné ce concept en
inventant la technique d’hybridation lymphocytaire et ont permis le développement d’une
nouvelle classe pharmacologique de biomédicaments, les anticorps monoclonaux (AcM) qui
font l’objet de ce numéro de médecine/sciences. Toutefois, les réponses
partielles et éphémères, souvent associées à des phénomènes de résistance (bien étudiés
en recherche fondamentale), limitent l’efficacité clinique des AcM. Pour pallier ces
obstacles, des associations d’AcM, le plus souvent évalués séparément ou oligoclonaux,
cocktail d’anticorps considéré comme un biomédicament unique, sont en cours de
développement. En effet, le système immunitaire a naturellement évolué pour développer
une réponse humorale polyclonale, optimisant ainsi sa capacité à combattre les maladies,
plutôt qu’une stratégie monoclonale telle que proposée par les biomédicaments anticorps
actuellement approuvés. L’autorisation de mise sur le marché (AMM) de deux combinaisons
d’anticorps thérapeutiques a récemment validé ce concept de « mime » de la réponse
immunitaire humorale polyclonale en oncologie. Les améliorations techniques dans la
capacité à produire des mélanges oligoclonaux reproductibles d’anticorps, chaque
composant étant sélectionné sur des critères précis, tels que la spécificité épitopique,
l’affinité ou son activité biologique intrinsèque, permettent maintenant d’imiter la
réponse immunitaire humorale polyclonale, ouvrant ainsi la voie à la sérothérapie du
xxi
e siècle. |
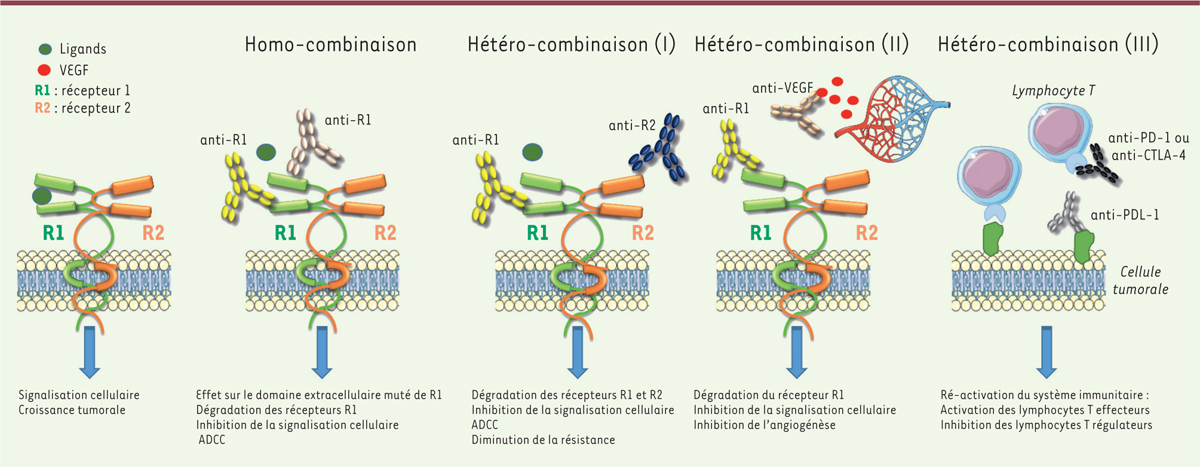
Les prémices d’un mélange oligoclonal thérapeutique maitrisé: homo-combinaison et
hétéro-combinaison d’anticorps en préclinique Co-ciblage anti-tumoral Autour des années 2000, le concept d’homo-combinaison d’anticorps, engageant des
épitopes distincts sur un même récepteur, a été proposé par plusieurs équipes,
dont celle de Yosef Yarden (institut Weizmann, Israël). Ainsi, des
homo-combinaisons d’anticorps anti-EGFR ( epidermal growth factor
receptor) [ 1], anti-HER2 ( human epidermal growth factor
receptor-2) [ 2]
ou anti-cMET (ou hepatocyte growth factor [HGF] receptor)
[ 3] induisent une
activité anti-tumorale synergique due à l’accélération de la dégradation des
récepteurs ciblés et à une cytotoxicité à médiation cellulaire dépendant des
anticorps (ADCC) renforcée (Figure
1). Ces combinaisons permettent de contrer la résistance
au traitement provoquée par une monothérapie anti-EGFR dans le cancer colorectal
[ 4], ou anti-cMET
dans le cancer gastrique [ 5], et de maintenir une activité anti-tumorale malgré la présence de
mutations des domaines extracellulaires de ces récepteurs [ 6]. Dès 2007, notre équipe à
l’institut de recherche en cancérologie de Montpellier [ 7], démontrait que l’hétéro-combinaison
d’anticorps anti-EGFR/anti-HER2 engageant des épitopes distincts sur ces deux
récepteurs collaborant fonctionnellement, induisait une synergie anti-tumorale
en favorisant l’ADCC, la diminution de l’expression de ces récepteurs et la
formation des homodimères, mais aussi en inhibant les voies de signalisation
intracellulaires [ 8]. Ces
travaux précliniques, confirmés par d’autres groupes de recherche [ 9], ont permis la mise en
place de l’essai clinique de phase I THERAPY dans le cancer du pancréas
métastatique et progressant sous gemcitabine. L’association
cétuximab/trastuzumab (qui ciblent respectivement l’EGFR et HER2) a induit une
stabilisation de la maladie chez 27 % des patients, sans réponse objective, mais
avec une corrélation positive entre une toxicité cutanée et la survie sans
progression des patients [ 10]. L’essai n’a pu être poursuivi à cause de cette toxicité,
soulignant ainsi la nécessité de repenser la dose active dans le cas de
combinaison d’anticorps. Ce concept d’hétéro-combinaison d’anticorps a pour but
d’éviter les phénomènes de signalisation compensatoire liés au ciblage par les
anticorps d’un récepteur unique. Il a été étendu au double ciblage EGFR/HER3
dans les tumeurs résistantes au cétuximab [ 4]. Ces hétéro-combinaisons d’anticorps peuvent également associer
le ciblage d’un ligand, tel que le VEGF ( vascular endothelial growth
factor) ou l’HGF, pour agir sur le microenvironnement, et le
ciblage d’un récepteur spécifique de la tumeur [ 11]. Enfin, des cocktails oligoclonaux de
trois [ 12] ou six
[ 13] anticorps
ciblant respectivement l’EGFR, HER2 et HER3 ont démontré un effet anti-tumoral
accru dans des modèles expérimentaux, avec un blocage des voies de signalisation
sous-jacentes ERK ( extracellular signal-regulated kinases) et
AKT (protéine kinase B), et une dégradation accélérée des récepteurs. L’homo- ou
l’hétéro-combinaison d’anticorps en hémato-oncologie a également été proposée à
l’aide d’anticorps ciblant les molécules CD20, CD22 ou CD52 exprimées par les
lymphocytes B (et T en ce qui concerne CD52) [ 14].
 | Figure 1.Les homo- ou hétero-combinaisons d’anticorps
monoclonaux (adapté d’après [ 55]). |
Co-ciblage anti-microbien Reproduire la réponse immunitaire humorale par une combinaison d’anticorps
thérapeutiques trouve aussi tout son sens dans le cadre d’une thérapie
anti-infectieuse. En effet, les virus et les bactéries sont complexes (souches,
facteurs de virulence, variabilité, etc.) et adoptent de nombreuses stratégies
d’échappement et ont des mécanismes d’action variés. Dès 1982, Volk et
al. montrent que la combinaison de deux anticorps ciblant le virus
de la stomatite vésiculaire améliore la neutralisation virale [ 15]. Depuis lors, des anticorps
oligoclonaux ciblant le VIH (virus de l’immunodéficience humaine) [ 16], le virus Ebola
[ 17], le virus de
l’hépatite B [ 18], le
virus de la vaccine [ 19], le MERS-coronavirus (responsable du syndrome respiratoire du
Moyen-Orient) [ 20], le
virus de la rage [ 21],
ou des toxines des bactéries Clostridium difficile [ 22], de C.
botulinum [ 23] ou de Bordetella pertussis [ 24], entre autres, ont démontré une
synergie dans leur capacité de neutralisation. Toutes ces démonstrations
précliniques ont largement souligné l’intérêt de combiner des anticorps
thérapeutiques pour imiter la réponse immunitaire humorale polyclonale. Co-ciblage des molécules de contrôle immunitaire: réveiller le système
immunitaire L’importance des points de contrôle immunitaire, telles que CTLA-4
( cytotoxic T lymphocyte-associated protein 4) et PD-1
( programmed cell death 1), pour moduler la réponse T
anti-tumorale a été soulignée récemment par l’attribution du prix Nobel de
physiologie ou médecine 2018 à James Allison et Tasuku Honjo. La compréhension
de leurs rôles dans la régulation de l’activation des lymphocytes et dans
l’échappement immunitaire des tumeurs a conduit au développement d’associations
d’anticorps ciblant les molécules de cette famille fonctionnelle, qui sont
classées en molécules co-inhibitrices (que l’on cherche à bloquer) ou molécules
co-activatrices (que l’on cherche à stimuler). L’hétéro-combinaison d’anticorps
anti-CTLA-4/anti-PD-1 bloquants a conduit dès 2010 à valider une synergie
thérapeutique anti-tumorale dans des modèles murins de cancer colorectal et de
mélanome, marquée par une infiltration accrue de lymphocytes T cytotoxiques et
une inhibition de lymphocytes T régulateurs et de cellules myéloïdes
suppressives [ 25].
D’autres hétéro-combinaisons d’anticorps anti-points de contrôle immunitaire
PD-1/4-1-BB (CD137 ou tumor necrosis factor receptor superfamily member
9) ou PD-1/LAG3 ( lymphocyte-activation gene 3)
[ 26], TIM3
( T-cell immunoglobulin and mucin-domain containing-3)
[ 27], entre autres,
ont été proposées pour moduler les réponses immunitaires dans les cancers. Le
lien, récemment démontré, entre l’expression ou la surexpression de PD-L1 (le
ligand de PD-1) chez certains patients et l’efficacité d’anticorps anti-HER2/Neu
[ 28] suggère qu’il
serait intéressant de combiner des anticorps ciblant des membres de la famille
HER avec des anticorps ciblant les points de contrôle immunitaires dans certains
cancers. |
La preuve de concept clinique: trastuzumab/pertuzumab dans le cancer du sein et
nivolumab/ipilimumab dans le mélanome La première association d’anticorps approuvée en 2012 a été l’homo-combinaison
anti-HER2 trastuzumab/pertuzumab associée au docétaxel1 dans le cancer du sein métastatique HER2-amplifié. L’essai de phase
III CLEOPATRA, portant sur 808 patientes, a montré une survie moyenne sans
progression (PFS) de 18,7 mois dans le groupe traité par la combinaison anticorps +
docétaxel contre 12,4 mois dans le groupe traité par le trastuzumab seul + docétaxel
[29], avec une toxicité
cardiaque comparable dans les deux bras de traitement. Cette combinaison associée au
docétaxel a ensuite été approuvée en traitement néo-adjuvant chez des patientes
nouvellement diagnostiquées (Essais APHINITY et NEOSHERE [30]). Toutefois, l’essai clinique NEOSPHERE a
révélé une plus forte toxicité dans le bras traité par la combinaison
trastuzumab/pertuzumab. Tous les essais cliniques de phase III associant des
anticorps n’ont cependant pas conduit à des résultats positifs. Ainsi, dans le
cancer gastrique HER2-positif (étude JACOB), l’association pertuzumab et trastuzumab
avec le cisplatine ou le 5-fluoro-uracile n’a pas amélioré la survie des patients
[31]. L’étude CAIRO2
[32], associant
l’hétéro-combinaison bévacizumab/cétuximab avec l’oxaliplatine et la capécitabine,
l’étude PACCE [33]
impliquant bévacizumab/panitumumab associé à l’oxaliplatine et l’irinotécan dans le
cancer colorectal métastatique, et l’étude AVEREL [34], associant trastuzumab et bévacizumab dans
le cancer du sein HER2-amplifié, se sont aussi révélées infructueuses. Le co-ciblage
du VEGF avec les récepteurs EGFR ou HER2 ne semble donc pas pertinent en termes de
synergie ou d’additivité, peut-être à cause d’interactions négatives entre voies de
signalisation, ou d’interactions pharmacodynamiques (défaut de vascularisation
tumorale, inhibition de l’expression d’un des deux récepteurs) [35]. Seuls 20-30 % des patients atteints de mélanome métastatique répondent à la
monothérapie avec les anticorps anti-CTLA-4 ou anti-PD-1 bloquant les points de
contrôle immunitaire. Dès 2013, un essai clinique de phase I associant l’anti-CTLA-4
ipilimumab avec l’anti-PD1 nivolumab démontrait une régression tumorale chez 50 %
des patients traités [36].
Dans l’essai clinique de phase III Checkmate 067, portant sur 945 patients atteints
de mélanome métastatique, la survie sans progression a été supérieure dans le bras
traité par l’hétéro-combinaison ipilimumab/nivolumab (11,5 mois), comparativement
aux bras traités par le nivolumab (6,9 mois), ou par l’ipilimumab (2,9 mois) [37]. Toutefois, ce bénéfice
en ce qui concerne la survie est associé à une toxicité accrue dans le bras traité
par l’hétéro-combinaison nivolumab/ipilimumab (55 % des patients ont des effets
secondaires de grade 3 et 4), comparé aux bras monothérapie (16 % pour le nivolumab
et 27 % pour l’ipilimumab) [38]. Cet essai a conduit la food and drug
administration (FDA) américaine à approuver cette combinaison
d’anticorps anti-points de contrôle immunitaire dans le mélanome métastatique.
Depuis, des essais cliniques de phase III, associant anti-CTLA-4 et anti-PD-1 ou
anti-PD-L1, ont donné des résultats positifs dans le cancer du poumon et le
carcinome rénal. Enfin, la combinaison de l’anticorps anti-PD-L1 atézolizumab avec
l’anticorps anti-VEGF bévacizumab, associée à la chimiothérapie dans le cancer du
poumon, a récemment montré un bénéfice en terme de survie sans progression par
rapport au bras sans atézolizumab (8,3 mois vs 6,8 mois) [39]. Environ 300 essais cliniques2 utilisant une
combinaison d’anticorps, associée ou non avec une chimiothérapie, sont actuellement
en cours dans de nombreuses indications [40-42]. En cancérologie, l’essentiel des études, complètes ou en cours de
recrutement, implique l’association ipilimumab/nivolumab (environ 130 essais, dont
une cinquantaine dans les indications mélanome et cancer du poumon [42]) et l’association trastuzumab/pertuzumab
(environ 40 études [40]). D’autres essais
impliquant des homo- ou hétéro-combinaisons sont répertoriés :
-
Anti-HER2 trastuzumab/anti-PD-L1 atézolizumab (3 essais),
-
Anti-HER2 pertuzumab/anti-PD-L1 atézolizumab (3 essais),
-
Anti-EGFR cétuximab/anti-PD-L1 avélumab (4 essais),
-
Anti-PD-L1 durvalumab/anti-CTLA-4 trémélimumab (35 essais),
-
Anti-VEGF bévacizumab/anti-PD-L1 atézolizumab (16 essais),
-
Anti-VEGF bévacizumab/anti-PD1 pembrolizumab (6 essais),
-
Anti-VEGF bévacizumab/anti-HER2 trastuzumab (4 essais),
-
Anti-VEGF bévacizumab/anti-EGFR cétuximab (12 essais),
-
ADC trastuzumab-Emtansine/pertuzumab ou trastuzumab ou pembrolizumab ou
atézolizumab ou anti-4-BB1 (11 essais).
La plupart de ces combinaisons d’anticorps sont administrées séquentiellement, à
partir d’entités biologiques anticorps développées individuellement comme
biomédicament, et ayant obtenu initialement une AMM en tant qu’anticorps monoclonal
« principe actif unique ». Le choix de la séquence de traitement reste encore à
optimiser, notamment si des combinaisons d’anticorps anti-tumeur avec des anticorps
anti-point de contrôle immunitaire sont proposées. En infectiologie, une vingtaine
d’essais cliniques sont recensés (Tableau
I). Dans quelques cas, de nouvelles stratégies industrielles
de production/formulation, développées par certaines sociétés pharmaceutiques, ont
permis de rationaliser et d’optimiser la production de combinaison d’anticorps
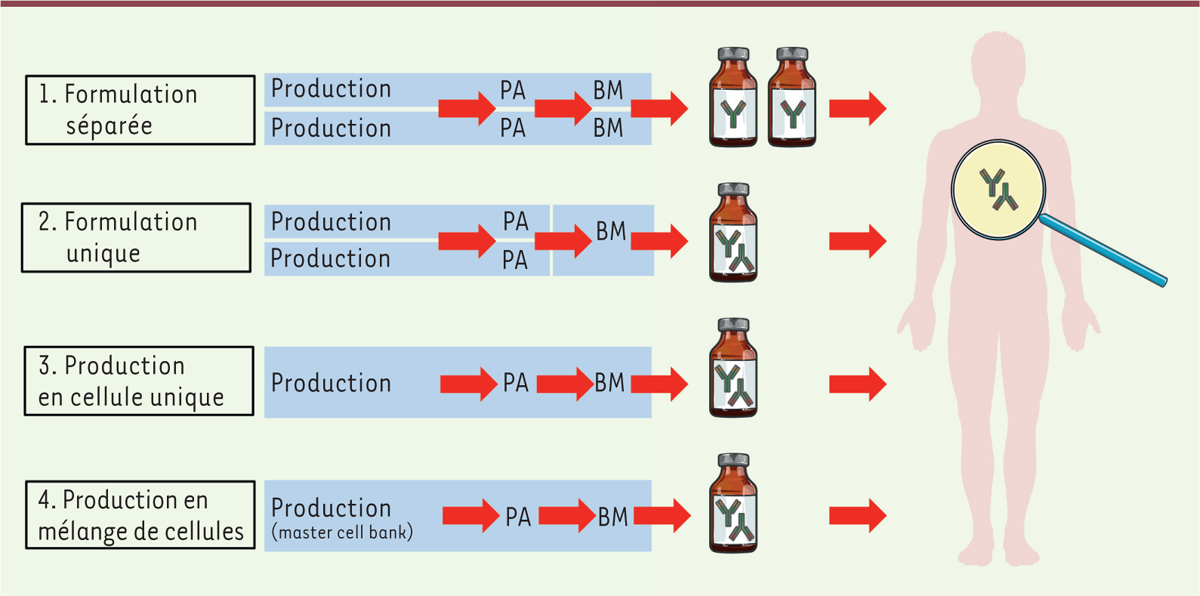
(Figure 2).
 | Figure 2.Différentes stratégies pour produire un biomédicament (BM)
représentant un mélange d’anticorps thérapeutiques, à partir de
deux principes actifs (PA) anticorps. La
stratégie « Production en cellule unique » permet de produire un mélange
d’anticorps mono- ou bi-spécifique (adapté d’après [ 52]). |
Tableau I.
| Pathogène |
Anticorps |
Formulation |
Cibles |
Phase clinique |
Date |
| Virus de l’immunodéficience humaine |
3BNC117 + 10-1074 |
Séparée |
CD4bs-gp120 + V3 glycan site Env |
Phase I |
2018 |
|
|
VRC01LS + 10-1074 |
Séparée |
CD4bs-gp120 + V3 glycan site Env |
Phase I/II |
2018 |
|
|
10E8VLS + VRC07-523LS |
Séparée |
gp41 + CD4bs-gp120 |
Phase I |
2018 |
|
|
VRC01LS + VRC07-523LS |
Séparée |
CD4bs-gp120 + CD4bs-gp120 |
Phase I |
2018 |
|
|
PGDM1400 + PGT121 |
Séparée |
V2-loop Env + V3 glycan site Env |
Phase I |
2017 |
|
|
2G12 + 4E10 + 2F5 |
Unique |
Env |
Phase I/II |
2007 |
|
| Virus de la grippe |
CT-P27 |
Unique |
Hémaglutinines groupe 1 et 2 |
Phase IIb |
2018 |
|
|
CR8020 + CR6261 |
Séparée |
Hémaglutinines |
Phase IIa |
2014 |
|
|
Clostridium difficile
|
MK-6072 + MK-3415A |
Séparée |
Toxines A et B |
Phase III |
2018 |
|
|
MK-3415 + MK-6072 + MK-3415A |
Séparée |
Toxines A et B |
Phase III |
2018 |
|
|
MK-6072 + MK-3415A |
Séparée |
Toxines A et B |
Phase III |
2018 |
|
|
GS-CDA1 + MDX-1388 |
Séparée |
Toxines A et B |
Phase II |
2010 |
|
|
Shigella
|
caStx1 + CaStx2 |
Unique |
Toxines Shiga 1 et 2 |
Phase II |
2013 |
|
| Virus de la rage |
SYN023 (CTB011 + CTB012) |
Unique |
Rabies G protein |
Phase I |
2018 |
|
|
CL184 |
Unique |
Rabies G protein |
Phase II |
2013 |
|
| Virus respiratoire syncitial |
Motavizumab (MEDI-524) + Palivizumab |
Séparée |
RSV |
Phase II |
2012 |
|
|
Clostridium botulinum
|
NTM-1633 (XE02 + XE06 + XE17) |
Unique |
Neurotoxines E1, E3 et E4 |
Phase I |
2018 |
|
|
NTM-1634 (XC41+XC42+XC44+XC84) |
Unique |
Neurotoxines C et D |
Phase I |
2018 |
|
|
NTM-1632 (3 Abs) |
Unique |
Neurotoxine B |
Phase I |
2017 |
|
|
Xoma 3AB |
Unique |
Neurotoxine A |
Phase I |
2014 |
|
| Virus Ebola |
GamEMab |
Unique |
Ebola |
Phase I |
2018 |
|
|
Zmapp (Zmab + c2G4 + c4G7) |
Unique |
Protéine GP |
Phase I |
2018 |
|
|
REGN3470+3471+3479 |
Unique |
protéine GP |
Phase I |
2018 |
|
| MERS coronavirus |
REGN3048 + REGN3051 |
Séparée |
Protéine Spike |
Phase I |
2018 |
|
|
Staphylococcus aureus
|
ASN100 (ASN-1 + ASN-2) |
Unique |
a-hémolysine et leukotoxines |
Phase II |
2018 |
Principaux essais cliniques utilisant une combinaison
d’anticorps en thérapie anti-infectieuse. gp120:
glycoprotéine d’enveloppe (Env) ; V3 glycan site Env: site de
glycosylation de la région V3 de gp120. |
|
La validation industrielle des combinaisons d’anticorps: formulation « unique »
ou « séparée », production en « cellule unique » ou « par un mélange de plusieurs
cellules » ? La production d’anticorps pour développer des associations thérapeutiques peut se
réaliser selon 4 stratégies principales (Figure 2), qui ont conduit au développement clinique de
mélanges oligoclonaux d’anticorps (Tableau
I et II) :
Tableau II.
| Indication thérapeutique |
Anticorps |
Formulation |
Cibles |
Phase clinique |
Date |
| Cancer colorectal/cancer du poumon |
MM-151 |
Unique |
3xEGFR |
Phase I* |
2015 |
|
| Cancer colorectal/cancer du poumon |
MM-151 + MM-121 |
Séparée |
3xEGFR + HER3 |
Phase I* |
2015 |
|
| Cancer colorectal/glioblastome |
Sym004: futuximab + modotuximab |
Unique |
2xEGFR |
Phase II |
2018 |
|
| Cancers épithéliaux |
Sym013 |
Plusieurs cellules |
2xEGFR + 2xHER2 + 2x HER3 |
Phase II* |
2016 |
|
| Tumeurs cMET-amplifié |
Sym015 |
Plusieurs cellules |
2xcMET |
Phase II |
2016 |
|
| Cancer du sein |
Bispécifique MCLA-128 |
Cellule unique |
HER2/HER3 |
Phase I |
2017 |
|
| Leucémie myéloïde aiguë |
Bispécifique MCLA-117 |
Cellule unique |
CLEC12A/CD3 |
Phase I |
2017 |
|
| Cancer colorectal |
Bispécifique MCLA-158 |
Cellule unique |
LGR5/EGFR |
Phase I |
2018 |
Principaux essais cliniques utilisant un mélange
d’anticorps en oncologie. *Développement
stoppé. |
– Stratégie « formulation séparée »: les principes actifs «
anticorps » sont produits séparément à partir de chaque lignée cellulaire (surtout
des cellules CHO) ; la formulation pharmaceutique est réalisée individuellement et
les biomédicaments anticorps sont injectés séquentiellement lors du traitement.
Cette stratégie pharmaceutique est la plus classique lorsqu’on utilise des
biomédicaments « anticorps monoclonal » déjà approuvés. Elle est à la base de
l’approbation des combinaisons trastuzumab/pertuzumab et nivolumab/ipilimumab par
les autorités règlementaires et est utilisée dans la plupart des essais cliniques en
cours. – Stratégie « formulation unique » : les principes actifs «
anticorps » sont produits séparément à partir de chaque lignée cellulaire
(généralement la lignée CHO) et l’étape de formulation pharmaceutique mélange les
principes actifs pour conduire au biomédicament « combinaison ». Cette stratégie a
été développée pour produire la combinaison Sym004 de 2 anticorps anti-EGFR, le
futuximab et le modotuximab avec une stœchiométrie 1/1 [43], cette combinaison étant actuellement en
essai clinique de phase II dans le cancer colorectal métastatique et le
glioblastome. Une autre combinaison de trois anticorps anti-neurotoxine de
C. botulinum (Xoma 3AB) a été développée jusqu’en phase I
[44]. Cette stratégie a
aussi été utilisée pour produire l’anticorps MM-151 [6,45], mélange
stœchiométrique 2/2/1 de trois anticorps anti-EGFR, testé jusqu’en phase I, en
association avec de la chimiothérapie ou avec l’anticorps anti-HER3 MM-121, dans le
cancer colorectal et le cancer du poumon. – Stratégie « production en cellule unique » : Les principes actifs
« anticorps » sont produits ensemble par les cellules d’une seule lignée cellulaire.
Une formulation pharmaceutique unique conduit au biomédicament « combinaison ». Ce
procédé Oligoclonics® [46], utilise la lignée cellulaire PER.C6 transfectée avec une
construction génétique codant une seule chaîne légère kappa, et deux constructions
génétiques codant chacune une chaîne lourde H de spécificité différente (technologie
« common light chain »). Des mélanges d’anticorps mono-spécifiques
et bi-spécifiques ont été développés en utilisant cette approche. À noter que cette
technologie a été ensuite associée avec l’ingénierie du domaine CH3 pour forcer la
production préférentielle d’anticorps bi-spécifiques, dont certains sont en cours de
développement clinique, tels que les anticorps ciblant HER2/HER3 [47] dans le cancer du sein et le cancer
gastrique, EGFR/Lgr5 (leucine-rich repeat containing G protein-coupled
receptor 5) dans les tumeurs solides, et CD3/CLEC12A (C-type
lectin domain family 12 member A) dans la leucémie aiguë myéloïde. – Stratégie « production par un mélange de plusieurs cellules » :
les lignées cellulaires produisant les principes actifs « anticorps » sont
initialement mélangées pour produire une « master-cell bank »
cellulaire polyclonale. Une formulation unique conduit au biomédicament «
combinaison ». Le procédé permet d’intégrer d’une manière site-spécifique chaque
construction anticorps sur le même locus chromosomique dans chaque lignée cellulaire
(Flp-In, CHO, CHO-DG44) [48], dans le but d’uniformiser le niveau d’expression de chaque anticorps
après mélange des lignées cellulaires transformées. Ainsi, un mélange maîtrisé de 25
anticorps anti-RhD (Rhésus D) (rozrolimupab ou Sym001 [49]) a été produit et testé
en phase II dans le purpura thrombocytopénique [50], un mélange de deux anticorps anti-cMET
avec une stœchiométrie 1/1 (Sym015 [3,5]) en phase II dans les tumeurs MET-amplifiées,
et un mélange oligoclonal de deux anticorps anti-EGFR, deux anticorps anti-HER2/Neu
et deux anticorps anti-HER3 (Sym013 [4,13]) en phase I dans les cancers
épithéliaux. |
Avantages/inconvénients et règlementation des associations d’anticorps L’homo- ou l’hétéro-combinaison d’anticorps présente de nombreux avantages par
rapport à la monothérapie anticorps (Tableau
III). La combinaison d’anticorps permet de cibler plusieurs
épitopes bien définis présents sur un ou plusieurs antigènes, avec un rapport
stœchiométrique d’anticorps parfaitement contrôlé et ajustable. Au sein d’un
cocktail, chaque anticorps peut être adapté en termes d’affinité, d’épitope,
d’isotype, ou de glycosylation. Le fait de cibler plusieurs épitopes sur un même
récepteur ou un pathogène, ou sur plusieurs récepteurs ou souches de pathogènes,
permet également d’augmenter le nombre de cibles recrutées et donc le nombre
d’anticorps liés par entité biologique (cellule ou pathogène). Les réponses
biologiques induites par ces anticorps s’en trouvent renforcées, comme les
mécanismes immunitaires effecteurs dépendant de la région Fc de l’IgG (ADCC, CDC
[complement-dependent cytotoxicity], ADCP
[antibody-dependent cell phagocytosis]), l’inhibition d’une
signalisation cellulaire compensatoire (éventuellement par l’élimination ou
l’internalisation/dégradation de la, ou des cibles) qui repose sur la partie Fab de
l’IgG, ou la neutralisation et la clairance de virus. Dans le cas de
l’hétéro-combinaison d’anticorps anti-points de contrôle immunitaire ou dirigés
contre leurs ligands (comme PDL-1 par exemple), la combinaison permet de contrer
simultanément les mécanismes de régulation négative redondants exploités par les
tumeurs pour échapper au système immunitaire. Un mélange oligoclonal d’anticorps
permet ainsi d’élargir le spectre d’activité du biomédicament, anticipant et évitant
d’éventuelles résistances au traitement, préexistantes ou acquises par émergence de
clones résistants sous l’effet d’un des constituants de l’association. Enfin, en
cancérologie, les hétéro-combinaisons ciblant la cellule cancéreuse ou le
microenvironnement tumoral immunitaire et les vaisseaux, procèdent de mécanismes
d’action potentiellement synergiques in vivo dont les modalités
restent à clarifier.
Tableau III.
|
Avantages |
Inconvénients |
| Combinaison
d’anticorps |
Ciblage de plusieurs épitopes |
Production des mélanges : |
| Synergie fonctionnelle: |
coût |
| aggrégation |
réglementation |
| activation/inhibition du système immunitaire |
Toxicité |
| activation/inhibition de la signalisation
Fab-dépendante |
Pharmacocinétique différentielle de chaque
anticorps |
| Élimination de la cible |
La formulation stœchiométrique |
| Diminution de la résistance aux traitements |
La dose et la fréquence d’injection |
Avantages et inconvénients des mélanges
d’anticorps.
|
La production des mélanges d’anticorps est globalement régie selon les bonnes
pratiques de fabrication classiquement utilisées pour produire les anticorps
thérapeutiques [51].
Actuellement, la stratégie de « formulation séparée » continue à prévaloir pour
associer deux AcM, que ce soit dans les formulations déjà approuvées ou en cours
d’essais cliniques. Toutefois, cette stratégie sera de plus en plus coûteuse si on
souhaite développer des mélanges de trois à six anticorps, avec des procédures et
des contraintes de réglementation de plus en plus lourdes et compliquées. En effet,
les règlementations de l’EMA (agence européenne des médicaments) et de la FDA
imposent d’évaluer les composants d’un mélange oligoclonal individuellement et en
combinaison, pour leur toxicité, leur efficacité et leur pharmaco-cinétique. Les
procédures règlementaires sont donc dédoublées pour chaque anticorps « principe
actif », chacun étant considéré comme un biomédicament unique dans une association.
Face à ces difficultés, les stratégies « production en cellule unique » ou «
production par un mélange de plusieurs cellules » devraient permettre de maîtriser
les procédés et coûts de production, et de faciliter les procédures réglementaires
et d’enregistrement [52]. Concrètement, la
FDA a déjà autorisé des mélanges oligoclonaux d’anticorps, préparés selon la
stratégie « formulation unique », à être utilisés dans des tests cliniques de phase
I et II [44]. Des essais de phase I avec le
Sym004 [53] et le MM-151
[54], obtenus selon la
stratégie « formulation unique », ont obtenu l’autorisation de la FDA pour être
testés comme « biomédicament unique » en cancérologie. Il est donc nécessaire
d’évaluer très précocement, au stade préclinique, la stratégie de production de
mélanges oligoclonaux pour réduire les risques et les coûts. Reste à savoir comment
la FDA ou l’EMA appréhenderont d’un point de vue règlementaire les nouveaux mélanges
oligoclonaux d’anticorps préparés selon les stratégies de « production en cellule
unique » ou de « production par un mélange de cellules ». Un mélange oligoclonal est formulé selon un rapport stœchiométrique d’anticorps
défini lors de la demande règlementaire initiale d’« investigational new
drug »3,. Du fait de la
pharmacocinétique différentielle de chaque anticorps (absorption, distribution,
métabolisme et excrétion), la formulation stœchiométrique ne sera probablement pas
maintenue chez le patient traité. Ce problème doit être appréhendé dès les études
précliniques. La sélection de la dose et de la séquence de traitement chez l’homme
doit tenir compte de la pharmacocinétique particulière de chaque anticorps dans le
mélange. Ainsi, le rapport stœchiométrique des six anticorps constituant le mélange
Sym013 variera in vivo au cours du temps en fonction de
l’exposition à la cible, forte pour l’EGFR, ou allant de moyenne à faible pour
HER2/Neu et HER3. Cela sera encore plus vrai pour des mélanges oligoclonaux
anti-infectieux pour lesquels l’élimination in vivo du pathogène
dépend de multiples facteurs. La potentialisation de la toxicité, observée dans
certains essais cliniques de combinaison [10], souligne la nécessité de bien ajuster le choix de la dose dans les
essais cliniques de phase I. Celle-ci ne sera pas obligatoirement calquée sur la
dose approuvée en monothérapie. Actuellement, les deux combinaisons approuvées en
clinique utilisent les doses d’anticorps identifiés dans les essais cliniques en
monothérapie. La caractérisation des mécanismes d’action propres au mélange
oligoclonal, en comparaison avec chaque AcM présent dans le mélange, devra être
réalisée précocément dans des modèles précliniques pertinents afin de bien étayer le
développement clinique. |
Conclusion: vers un mime de la réponse immunitaire polyclonale thérapeutique
? Le système immunitaire a naturellement évolué pour développer une réponse humorale
polyclonale. Le développement d’associations ou de mélanges oligoclonaux d’anticorps
pour améliorer les thérapies ciblées existantes aborde un tournant décisif. Il
devrait permettre de mimer cette réponse immunitaire humorale. Toutefois, des
contraintes biologiques, pratiques et règlementaires, doivent être franchies pour
enrichir la classe pharmacologique des anticorps avec ce nouveau concept. |
Christel Larbouret, Marie-Alix Poul et Thierry Chardès déclarent avoir
participé à des interventions ponctuelles (collaboration pour des travaux
scientifiques) avec les sociétés Roche, LFB, CisBio et GamaMabs.
|
Les auteurs remercient André Pèlegrin, Isabelle Navarro-Teulon, Bruno Robert, Nadège
Gaborit, Yassamine Lazrek et Gaëlle Thomas pour leur contribution aux travaux de
l’équipe auxquels il est fait référence dans cet article ; ils remercient également
Véronique Garambois, Geneviève Heintz, Sabine Bousquié, et toute l’équipe de
l’animalerie de l’IRCM pour leur assistance technique. Ces travaux ont été financés
par la Ligue contre le Cancer, le cancéropôle GSO, le GEFLUC, le programme FUI13
UmAbHER3 (BPI France), le SIRIC Montpellier Cancer, Inserm Transfert et le LabEx
MAbImprove ANR-10-LABX-53-01.
|
Footnotes |
1. Friedman
LM.
Rinon
A.
Schechter
B, et al.
Synergistic down-regulation of receptor tyrosine kinases by
combinations of mAbs: implications for cancer immunotherapy .
Proc Natl Acad Sci USA.
2005; ; 102:
:1915.–1920. 2. Ben-Kasus
T.
Schechter
B.
Lavi
S, et al.
Persistent elimination of ErbB-2/HER2-overexpressing tumors using
combinations of monoclonal antibodies: relevance of receptor
endocytosis . Proc Natl Acad Sci
USA.
2009; ; 106:
:3294.–3299. 3. Poulsen
TT.
Grandal
MM.
Skartved
NJØ, et al.
Sym015: a highly efficacious antibody mixture against
MET-amplified tumors . Clin Cancer
Res.
2017; ; 23:
:5923.–5935. 4. Iida
M.
Brand
TM.
Starr
MM, et al.
Overcoming acquired resistance to cetuximab by dual targeting HER
family receptors with antibody-based therapy .
Mol Cancer.
2014; ; 13: :242.. 5. Pollmann
SE.
Calvert
VS.
Rao
S, et al.
Acquired resistance to a MET antibody in vivo can be overcome by
the MET antibody mixture Sym015 . Mol Cancer
Ther.
2018; ; 17:
:1259.–1270. 6. Arena
S,
Siravegna
G,
Mussolin
B, et al.
MM-151 overcomes acquired resistance to cetuximab and panitumumab
in colorectal cancers harboring EGFR extracellular domain
mutations . Sci Transl Med.
2016;; 8: :324ra14.. 7. Larbouret
C.
Robert
B.
Navarro-Teulon
I, et al.
In vivo therapeutic synergism of anti-epidermal growth factor
receptor and anti-HER2 monoclonal antibodies against pancreatic
carcinomas . Clin Cancer
Res.
2007; ; 13:
:3356.–3362. 8. Thomas
G.
Chardès
T.
Gaborit
N, et al.
HER3 as biomarker and therapeutic target in pancreatic cancer:
new insights in pertuzumab therapy in preclinical models .
Oncotarget.
2014; ; 5:
:7138.–7148. 9. Maron
R.
Schechter
B.
Mancini
M, et al.
Inhibition of pancreatic carcinoma by homo- and
heterocombinations of antibodies against EGF-receptor and its kin
HER2/ErbB-2 . Proc Natl Acad Sci
USA.
2013; ; 110:
:15389.–15394. 10. Assenat
E.
Azria
D.
Mollevi
C, et al.
Dual targeting of HER1/EGFR and HER2 with cetuximab and
trastuzumab in patients with metastatic pancreatic cancer after gemcitabine
failure: results of the THERAPY phase 1–2 trial .
Oncotarget.
2015; ; 6:
:12796.–12808. 11. Van
Cutsem
E.
Eng
C.
Nowara
E, et al.
Randomized phase Ib/II trial of rilotumumab or ganitumab with
panitumumab versus panitumumab alone in patients with wild-type KRAS
metastatic colorectal cancer . Clin Cancer
Res.
2014; ; 20:
:4240.–4250. 12. Mancini
M.
Gal
H.
Gaborit
N, et al.
An oligoclonal antibody durably overcomes resistance of lung
cancer to third-generation EGFR inhibitors .
EMBO Mol Med.
2018; ; 10:
:294.–308. 13. Jacobsen
HJ.
Poulsen
TT.
Dahlman
A, et al.
Pan-HER, an antibody mixture simultaneously targeting EGFR, HER2,
and HER3, effectively overcomes tumor heterogeneity and
plasticity . Clin. Cancer
Re.
2015; ; 21:
:4110.–4122. 14. Strauss
SJ.
Morschhauser
F.
Rech
J, et al.
Multicenter phase II trial of immunotherapy with the humanized
anti-CD22 antibody, epratuzumab, in combination with rituximab, in
refractory or recurrent non-Hodgkin’s lymphoma .
J Clin Oncol.
2006; ; 24:
:3880.–3886. 15. Volk
WA.
Synder
RM.
Benjamin
DC, et al.
Monoclonal antibodies to the glycoprotein of vesicular stomatitis
virus: comparative neutralizing activity . J
Virol.
1982; ; 42:
:220.–227. 16. Bar-On
Y.
Gruell
H.
Schoofs
T, et al.
Safety and antiviral activity of combination HIV-1 broadly
neutralizing antibodies in viremic individuals .
Nat Med.
2018; ; 24:
:1701.–1707. 17. Qiu
X,
Audet
J,
Lv
M, et al.
Two-mAb cocktail protects macaques against the Makona variant of
Ebola virus . Sci Transl
Med.
2016;; 8: :329ra33.. 18. Galun
E.
Eren
R.
Safadi
R, et al.
Clinical evaluation (phase I) of a combination of two human
monoclonal antibodies to HBV: safety and antiviral
properties . Hepatology.
2002; ; 35:
:673.–679. 19. Lantto
J. Haahr
Hansen
M.
Rasmussen
SK, et al.
Capturing the natural diversity of the human antibody response
against vaccinia virus . J
Virol.
2011; ; 85:
:1820.–1833. 20. Pascal
KE.
Coleman
CM.
Mujica
AO, et al.
Pre- and postexposure efficacy of fully human antibodies against
Spike protein in a novel humanized mouse model of MERS-CoV
infection . Proc Natl Acad Sci
USA.
2015; ; 112:
:8738.–8743. 21. Bakker
ABH.
Marissen
WE.
Kramer
RA, et al.
Novel human monoclonal antibody combination effectively
neutralizing natural rabies virus variants and individual in vitro escape
mutants . J Virol.
2005; ; 79:
:9062.–9068. 22. Marozsan
AJ.
Ma
D.
Nagashima
KA, et al.
Protection against Clostridium difficile infection with broadly
neutralizing antitoxin monoclonal antibodies .
J Infect Dis.
2012; ; 206:
:706.–713. 23. Fan
Y.
Garcia-Rodriguez
C.
Lou
J, et al.
A three monoclonal antibody combination potently neutralizes
multiple botulinum neurotoxin serotype F subtypes .
PLoS One.
2017; ; 12:
:e0174187.. 24. Nguyen
AW,
Wagner
EK,
Laber
JR, et al.
A cocktail of humanized anti-pertussis toxin antibodies limits
disease in murine and baboon models of whooping cough .
Sci Transl Med.
2015;; 7: :316ra195.. 25. Curran
MA.
Montalvo
W.
Yagita
H, et al.
PD-1 and CTLA-4 combination blockade expands infiltrating T cells
and reduces regulatory T and myeloid cells within B16 melanoma
tumors . Proc Natl Acad Sci
USA.
2010; ; 107:
:4275.–4280. 26. Chen
S.
Lee
L-F,
Fisher
TS, et al.
Combination of 4–1BB agonist and PD-1 antagonist promotes
antitumor effector/memory CD8 T cells in a poorly immunogenic tumor
model . Cancer Immunol Res.
2015; ; 3:
:149.–160. 27. Guo
Z.
Cheng
D.
Xia
Z, et al.
Combined TIM-3 blockade and CD137 activation affords the
long-term protection in a murine model of ovarian cancer .
J Transl Med.
2013; ; 11: :215.. 28. Chaganty
BKR.
Qiu
S.
Gest
A, et al.
Trastuzumab upregulates PD-L1 as a potential mechanism of
trastuzumab resistance through engagement of immune effector cells and
stimulation of IFNγ secretion . Cancer
Lett.
2018; ; 430:
:47.–56. 29. Baselga
J.
Cortés
J.
Kim
SB, et al.
Pertuzumab plus trastuzumab plus docetaxel for metastatic breast
cancer . N Engl J Med.
2012; ; 366:
:109.–119. 30. von
Minckwitz
G.
Procter
M. de
Azambuja
E, et al.
Adjuvant pertuzumab and trastuzumab in early HER2-positive breast
cancer . N Engl J Med.
2017; ; 377:
:122.–131. 31. Tabernero
J.
Hoff
PM.
Shen
L, et al.
Pertuzumab plus trastuzumab and chemotherapy for HER2-positive
metastatic gastric or gastro-oesophageal junction cancer (JACOB): final
analysis of a double-blind, randomised, placebo-controlled phase 3
study . Lancet Oncol.
2018; ; 19:
:1372.–1384. 32. Tol
J.
Koopman
M.
Cats
A, et al.
Chemotherapy, bevacizumab, and cetuximab in metastatic colorectal
cancer . N Engl J Med.
2009; ; 360:
:563.–572. 33. Hecht
JR.
Mitchell
E.
Chidiac
T, et al.
A randomized phase IIIB trial of chemotherapy, bevacizumab, and
panitumumab compared with chemotherapy and bevacizumab alone for metastatic
colorectal cancer . J Clin
Oncol.
2009; ; 27:
:672.–680. 34. Gianni
L.
Romieu
GH.
Lichinitser
M, et al.
AVEREL: a randomized phase III Trial evaluating bevacizumab in
combination with docetaxel and trastuzumab as first-line therapy for
HER2-positive locally recurrent/metastatic breast cancer .
J Clin Oncol.
2013; ; 31:
:1719.–1725. 35. Heskamp
S.
Boerman
OC.
Molkenboer-Kuenen
JDM, et al.
Cetuximab reduces the accumulation of radiolabeled bevacizumab in
cancer xenografts without decreasing VEGF expression .
Mol Pharm.
2014; ; 11:
:4249.–4257. 36. Wolchok
JD.
Kluger
H.
Callahan
MK, et al.
Nivolumab plus ipilimumab in advanced melanoma .
N Engl J Med.
2013; ; 369:
:122.–133. 37. Wolchok
JD.
Chiarion-Sileni
V.
Gonzalez
R, et al.
Overall survival with combined nivolumab and ipilimumab in
advanced melanoma . N Engl J
Med.
2017; ; 377:
:1345.–1356. 38. Larkin
J.
Chiarion-Sileni
V.
Gonzalez
R, et al.
Combined nivolumab and ipilimumab or monotherapy in untreated
melanoma . N Engl J Med.
2015; ; 373:
:23.–34. 39. Socinski
MA.
Jotte
RM.
Cappuzzo
F, et al.
Atezolizumab for first-line treatment of metastatic nonsquamous
NSCLC . N Engl J Med.
2018; ; 378:
:2288.–2301. 40. Henricks
LM.
Schellens
JHM.
Huitema
ADR, et al.
The use of combinations of monoclonal antibodies in clinical
oncology . Cancer Treat.
Rev.
2015; ; 41:
:859.–867. 41. Corti
D.
Kearns
JD. Promises and
pitfalls for recombinant oligoclonal antibodies-based therapeutics in cancer
and infectious disease . Curr Opin
Immunol.
2016; ; 40:
:51.–61. 42. Chae
YK,
Arya
A,
Iams
W, et al.
Current landscape and future of dual anti-CTLA4 and PD-1/PD-L1
blockade immunotherapy in cancer; lessons learned from clinical trials with
melanoma and non-small cell lung cancer (NSCLC) .
J Immunother Cancer.
2018;; 6 h :39.. 43. Pedersen
MW.
Jacobsen
HJ.
Koefoed
K, et al.
Sym004: a novel synergistic anti-epidermal growth factor receptor
antibody mixture with superior anticancer efficacy .
Cancer Res.
2010; ; 70:
:588.–597. 44. Nayak
SU.
Griffiss
JM.
McKenzie
R, et al.
Safety and pharmacokinetics of XOMA 3AB, a novel mixture of three
monoclonal antibodies against botulinum toxin A .
Antimicrob. Agents Chemother.
2014; ; 58:
:5047.–5053. 45. Napolitano
S.
Martini
G.
Martinelli
E, et al.
Antitumor efficacy of triple monoclonal antibody inhibition of
epidermal growth factor receptor (EGFR) with MM151 in EGFR-dependent and in
cetuximab-resistant human colorectal cancer cells .
Oncotarget.
2017; ; 8:
:82773.–82783. 46. de Kruif
J.
Kramer
A.
Nijhuis
R, et al.
Generation of stable cell clones expressing mixtures of human
antibodies . Biotechnol
Bioeng.
2010; ; 106:
:741.–750. 47. Geuijen
CAW. De
Nardis
C.
Maussang
D, et al.
Unbiased combinatorial screening identifies a bispecific IgG1
that potently inhibits HER3 signaling via HER2-guided ligand
blockade . Cancer Cell.
2018; ; 33: (922–936)
:e10.. 48. Rasmussen
SK.
Nielsen
LS.
Müller
C, et al.
Recombinant antibody mixtures; optimization of cell line
generation and single-batch manufacturing processes .
BMC Proc.
2011; ; 5: Suppl (8)
:O2.. 49. Wiberg
FC.
Rasmussen
SK.
Frandsen
TP, et al.
Production of target-specific recombinant human polyclonal
antibodies in mammalian cells . Biotechnol
Bioeng.
2006; ; 94:
:396.–405. 50. Robak
T.
Windyga
J.
Trelinski
J, et al.
Rozrolimupab, a mixture of 25 recombinant human monoclonal RhD
antibodies, in the treatment of primary immune
thrombocytopenia . Blood.
2012; ; 120:
:3670.–3676. 51. Chon
JH.
Zarbis-Papastoitsis
G. Advances in the
production and downstream processing of antibodies .
N Biotechnol.
2011; ; 28:
:458.–463. 52. Rasmussen
SK.
Næsted
H.
Müller
C, et al.
Recombinant antibody mixtures: production strategies and cost
considerations . Arch Biochem
Biophys.
2012; ; 526:
:139.–145. 53. Kojima
T.
Yamazaki
K.
Kato
K, et al.
Phase I dose-escalation trial of Sym004, an anti-EGFR antibody
mixture, in Japanese patients with advanced solid tumors .
Cancer Sci.
2018; ; 109:
:3253.–3262. 54. Lieu
CH.
Harb
WA.
Beeram
M, et al.
Phase 1 trial of MM-151, a novel oligoclonal anti-EGFR antibody
combination in patients with refractory solid tumors .
JCO.
2014; ; 32: :2518.. 55. Carvalho
S.
Levi-Schaffer
F.
Sela
M, et al.
Immunotherapy of cancer: from monoclonal to oligoclonal cocktails
of anti-cancer antibodies: IUPHAR Review 18 .
Br J Pharmacol.
2016; ; 173:
:1407.–1424. |