| |
| Med Sci (Paris). 35(12): 1098–1105. doi: 10.1051/medsci/2019218.La région charnière des anticorps
thérapeutiques L’importance capitale d’une courte séquence Quentin Deveuve,1 Valérie Gouilleux-Gruart,1,2 Gilles Thibault,1,2 and Laurie Lajoie1* 1Université de Tours, EA7501 GICC (Groupe Innovation et Ciblage
Cellulaire), équipe FRAME (Fc Récepteurs, Anticorps
et MicroEnvironnement), 37032 Tours, France 2Service d’immunologie, CHRU de Tours, 37044Tours,
France |
L’importance des anticorps monoclonaux (AcM) thérapeutiques a été illustrée en 2018 par
le prix Nobel de physiologie ou médecine décerné à James Allison et Tasuku Honjo pour
leurs recherches sur le traitement des cancers par inhibition des points de contrôle
immunitaire. Actuellement, les AcM thérapeutiques sont utilisés dans diverses
pathologies et agissent selon différents mécanismes (agonisme/antagonisme,
neutralisation, cytotoxicité) résultant de leur dualité structurale et des nombreux
formats développés par ingénierie. Ainsi, le choix du format optimal demeure un enjeu
majeur dans le développement des nouveaux AcM. |
Les immunoglobulines G humaines (IgG) : relation structure/fonctions Les AcM thérapeutiques ayant obtenu à ce jour une autorisation de mise sur le marché
(AMM) ont dans leur grande majorité une structure d’immunoglobuline G (IgG) humaine
intégrale et possèdent ainsi une dualité fonctionnelle. On distingue la région Fab
(fragment antigen binding) permettant la liaison à l’antigène,
et la région Fc (fragment crystallisable), assurant les fonctions
effectrices de l’anticorps. En effet, cette dernière est capable d’activer la voie
classique du complément par le recrutement de la protéine soluble C1q ou les
effecteurs cellulaires par l’intermédiaire des récepteurs pour la région Fc des IgG
(RFcγ). Ces différents effecteurs de l’immunité peuvent ainsi agir sur l’antigène ou
la cellule qui l’exprime. La région Fc est également capable de se lier au récepteur
néonatal pour la région Fc des IgG (FcRn) impliqué dans leur demi-vie. Ces deux
régions, Fab et Fc, sont reliées par la région charnière qui est essentielle à la
conformation spatiale de l’anticorps. S’il existe classiquement quatre sous-classes d’IgG chez l’homme, définies par la
nature de leur chaîne lourde (γ1, γ2, γ3 et γ4), seuls des AcM au format d’IgG1,
IgG2 et IgG4 sont présents sur le marché. La structure de type IgG1 est celle
retenue pour les AcM dits « cytolytiques » qui ont, après leur liaison à l’antigène
cible, une forte capacité à recruter les effecteurs de l’immunité. L’effet
cytolytique peut résulter d’un mécanisme de cytotoxicité dépendante du complément
(CDC), de la phagocytose cellulaire dépendante des anticorps (ADCP) ou encore de la
cytotoxicité cellulaire dépendante des anticorps (ADCC). Lorsque le recrutement des
effecteurs immunitaires n’est pas désiré, la structure privilégiée est alors celle
des IgG2 ou des IgG4. C’est notamment le cas des AcM qui ciblent la molécule
inhibitrice PD-1 (programmed cell death 1), tels que le nivolumab
(Opdivo®) et le pembrolizumab (Keytruda®), tous les deux
des IgG4. Ces anticorps empêchent l’interaction de PD-1 avec son ligand PD-L1
(programmed death-ligand 1), permettant ainsi la levée de
l’anergie des lymphocytes T présents dans l’environnement tumoral. Les AcM de classe
IgG3 n’ont pas été développés à des fins thérapeutiques, essentiellement en raison
de leur faible demi-vie (8 jours). Cependant, les IgG3 possèdent de très fortes
capacités de recrutement des effecteurs de l’immunité et l’absence d’AcM de ce
format en clinique reste discutable. Bien que la séquence protéique de leurs chaînes lourdes soit très conservée (90 %
d’homologie), chacune des sous-classes possède des capacités fonctionnelles propres
résultant largement des différences localisées dans la région charnière (29 %
d’homologie). |
La région charnière : pivot des mécanismes de recrutement des effecteurs La région charnière (hinge en anglais) est une région hydrophile
longtemps considérée comme un simple lien flexible entre les régions Fab et la
région Fc de l’immunoglobuline. Cependant, sa taille et sa composition protéique
conditionnent la flexibilité générale des IgG ainsi que la fonctionnalité de
l’anticorps de par ses interactions avec les effecteurs de l’immunité. Selon la
sous-classe, la région charnière des IgG est codée par un exon (IgG1, IgG2 et IgG4)
ou plusieurs (IgG3). Toutefois, la structure de la région charnière inclut une
partie du domaine CH2 de la chaîne lourde. En effet, au niveau protéique, le motif
APEXX(G)GP (Figure 1), codé
par l’exon du domaine CH2, possède une structure lâche et désorganisée similaire à
celle de la charnière [1].
Ainsi, comme le suggère Burton et al., nous définirons la région
charnière en 3 sous-parties : la charnière haute qui débute au niveau du glutamate
en position 219 (E219), en position C-terminale du domaine CH1, sachant que la
position de ce glutamate peut être décalée de ± 2 unités selon l’AcM considéré; la
charnière centrale, riche en proline et cystéine, qui contient les ponts disulfures
liant les deux chaînes lourdes; et la charnière basse, qui s’étend jusqu’à la
proline en position 241 pour les IgG1, 237 pour les IgG2, 288 pour les IgG3 et 238
pour les IgG4, précédant la partie N-terminale du premier brin β du domaine CH2
(Figure 1
et Table
1).
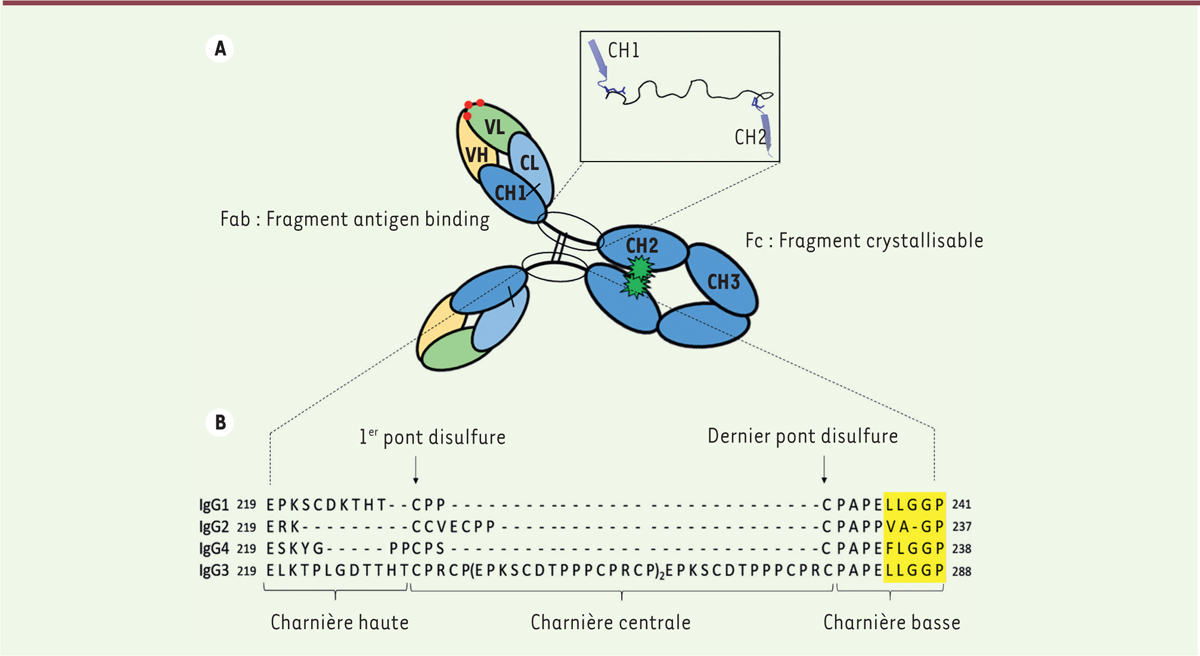
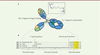 | Figure 1 Représentation schématique de la structure d’une IgG1
humaine (A) et séquence protéique de la région charnière des
quatre sous-classes d’IgG humaines (B). La
région Fab (fragment antigen-binding) est composée du
domaine variable VH (jaune) et du domaine constant CH1 (bleu foncé) de
la chaîne lourde ainsi que du domaine variable VL (vert) et constant CL
(bleu clair) de la chaîne légère. Chaque domaine variable contient trois
CDR (complementarity determining region) qui permettent
la reconnaissance spécifique de l’antigène (ronds rouges). La région Fc
(fragment crystallisable) est constituée des
domaines constants CH2 et CH3 de la chaîne lourde (bleu foncé). La
glycosylation de l’asparagine en position 297 dans le domaine CH2 est
représentée par les étoiles vertes. La structure tridimensionnelle de la
région charnière est présentée dans l’encadré. La charnière, illustrée
par la représentation en « ruban » en noir, débute par une glutamine en
position 219 et se termine par la proline précédant le domaine CH2
(violet). Le début des domaines CH1 et CH2 sont également représentés
(en bleu). L’alignement des séquences est présenté selon la notation EU.
Les acides aminés impliqués dans l’interaction avec les RFcγ et le C1q
sont surlignés en jaune. |
Table 1
|
IgG1 |
IgG2 |
IgG3 |
IgG4 |
| Nombre d’acides animés |
23 |
19 |
70 |
20 |
|
| Ponts disulfure (inter-chaînes lourdes) |
2 |
4 |
11 |
2 |
|
| Angle Fab-Fab en degré (moyenne ± SD) |
117±43 |
127±32 |
136±53 |
129±39 |
|
| Angle Fab-Fc en degré (moyenne ± SD) |
107±30 |
99±32 |
86±36 |
98±25 |
|
| Ratio dimère:tétramèrea |
0.83:1 |
0.35:1 |
8.4:1 |
0.48:1 |
|
| Flexibilité |
++ |
+ |
++++ |
+ |
Caractéristiques de la région charnière des quatre
sous-classes d’IgG humaines.
a Le ratio dimère : tétramère représente la flexibilité de la
charnière. |
La charnière basse Cette charnière basse est composée d’une séquence d’acides aminés (AA) impliquée
dans la liaison aux RFcγ et au C1q (en jaune dans la Figure 1
). Ces interactions asymétriques n’impliquent pas les mêmes AA de chacune
des deux chaînes lourdes. La fixation aux RFcγ repose directement sur des
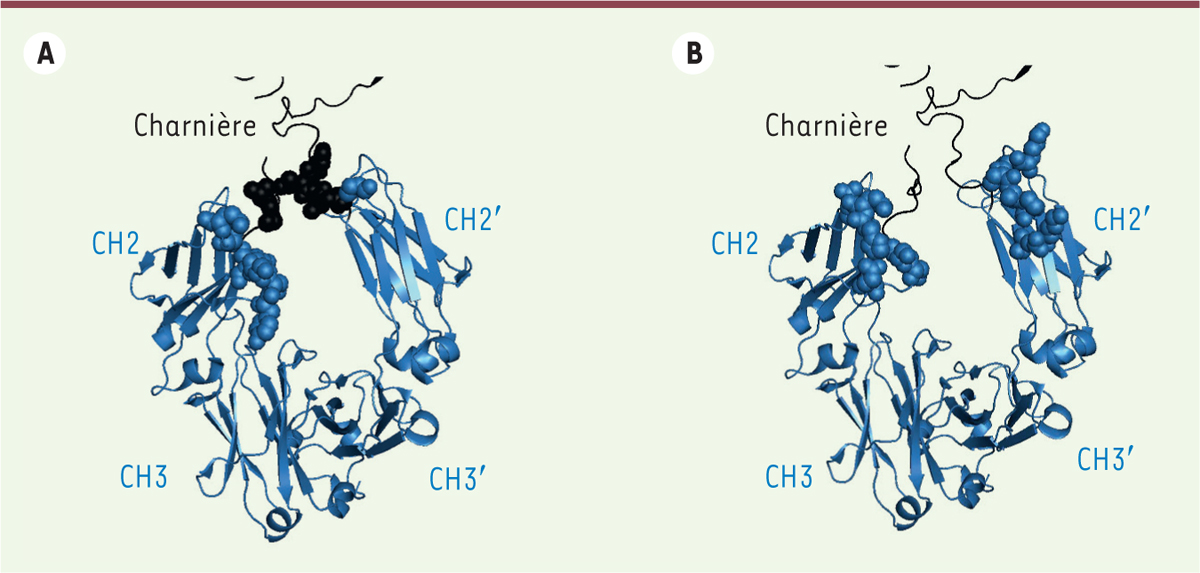
liaisons avec les AA de la région charnière (Figure 2A). En revanche, bien que le C1q
interagisse uniquement avec des AA du domaine CH2, la structure
tridimensionnelle de la charnière, proche du site d’interaction, conditionne
cette liaison (Figure 2B)
[ 2]. Le rapprochement
des régions Fc de plusieurs molécules d’anticorps, via des
interactions au niveau de la zone d’interface CH2-CH3, est indispensable pour
former une structure multimérique permettant la liaison efficace du C1q.
L’hexamère d’Ig est ainsi la structure optimale pour l’ancrage des six têtes
globulaires du C1q, alors que le trimère, et plus récemment le pentamère, ont
été décrits somme les structures minimales pour la liaison du C1q et
l’activation de la voie classique du complément [ 3]. Les substitutions présentes dans la
séquence des IgG2 et IgG4 (Figure
1) sont associées à une diminution de leur interaction avec
les RFcγ et le C1q [ 4,
5], et à des
activités de CDC, ADCP et ADCC faibles, voire nulles. L’ensemble de ces données
montre que le choix de la charnière basse et/ou de la sous-classe d’IgG est un
point clé dans le développement d’un AcM thérapeutique.
 | Figure 2 Zone d’interaction Fc-RFcg et Fc-C1q.
Vue générale du fragment Fc d’une IgG (code PDB : 1HZH) dont les
domaines CH2 et CH3 sont représentés en bleu et la région charnière
en noir. Les acides aminés de l’IgG (en bleu) et de la région
charnière (en noir) impliqués dans cette interaction asymétrique
avec le RFcγI (A) et le C1q
(B) sont représentés par les
sphères. |
La charnière haute et centrale Si la région basse de la charnière est nécessaire à l’activation des fonctions
effectrices, elle n’est pas suffisante. Guddat et al. ont
révélé, à l’aide de la cristallographie, qu’en l’absence des charnières haute et
centrale, les régions Fab d’une IgG1 étaient très proches de la région Fc. Cet
encombrement stérique empêche alors l’accès du C1q à son site de fixation, sans
compromettre l’accessibilité à celui du RFcγI [ 6]. La charnière haute et centrale est
constituée de 11 AA pour les IgG2 et les IgG4, 14 pour les IgG1, et 61 pour les
IgG3. La taille que donne ce nombre d’AA joue un rôle prépondérant pour obtenir
la distance suffisante entre les Fab et le Fc favorable au déclenchement des
réponses effectrices. Il est important de noter que les acides aminés
supplémentaires que présentent les IgG1 par rapport aux IgG2 et IgG4, favorisent
le recrutement des effecteurs (Figure
1). La structure protéique des charnières haute et centrale module la conformation
spatiale des IgG. Plusieurs études de cristallographie et de dynamique
moléculaire ont ainsi montré que les charnières haute et centrale permettent la
torsion, la flexion et l’extension des régions Fab, définissant ainsi la notion
de flexibilité de la charnière des anticorps (Figure 3) [7]. Par une approche d’interaction entre
anticorps et anticorps anti-idiotype1, Roux
et al. ont montré la variabilité de cette flexibilité. Dans
ce modèle, l’interaction entre des IgG1, par les régions Fab, entraîne la
formation d’une grande quantité de dimères, démontrant la capacité de ces
régions à adopter une conformation « fermée ». Au contraire, l’interaction entre
des IgG2 génère une forte proportion de tétramères, la rigidité de la charnière
de cette sous-classe ne permettant pas aux régions Fab d’adopter une
conformation fermée. Un ratio important dimère/tétramère indiquera ainsi une
flexibilité accrue de la charnière.
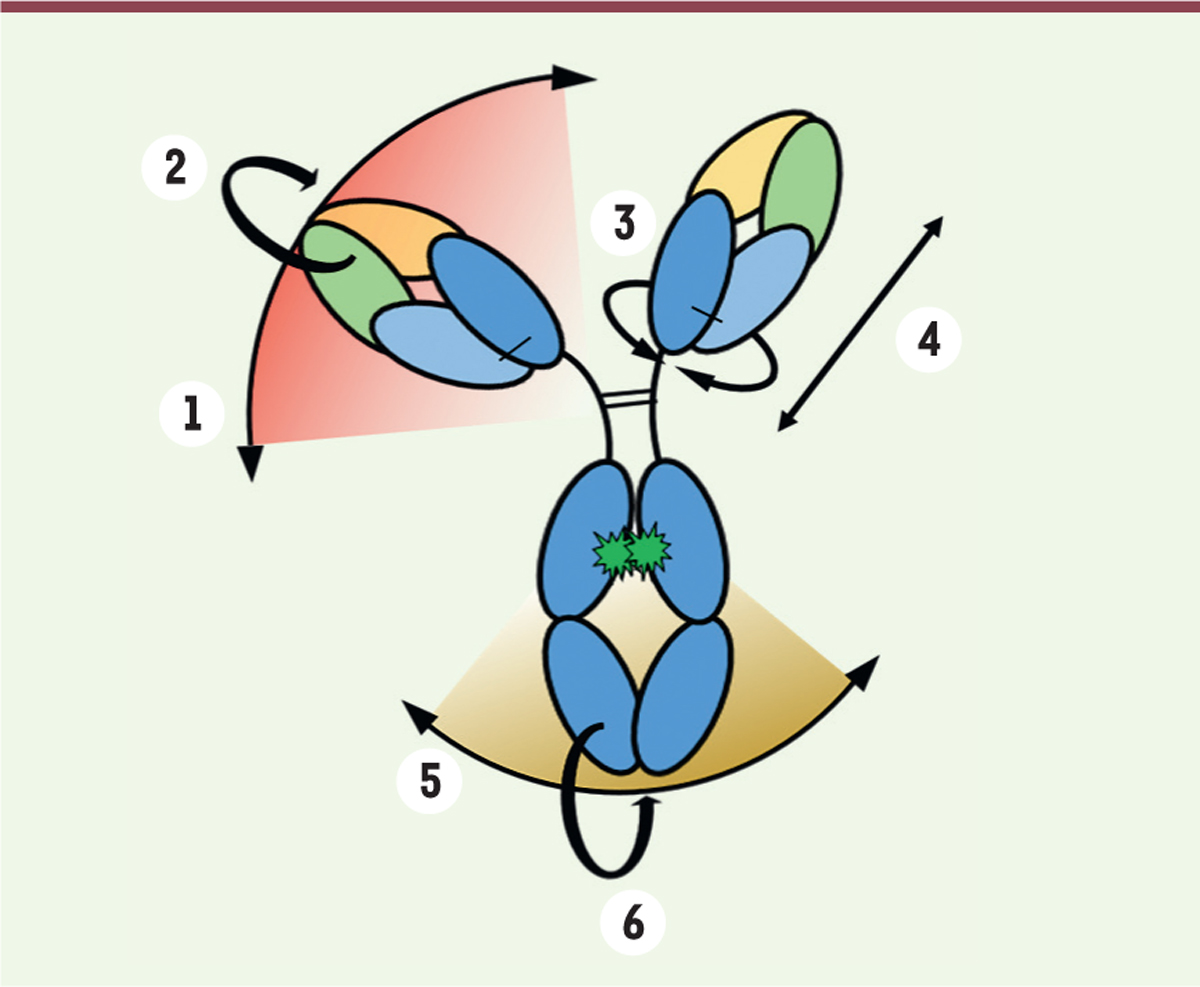
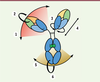 | Figure 3 Représentation schématique de la flexibilité des
IgG. Les charnières haute et centrale sont
responsables du mouvement des régions Fab. Ces dernières peuvent
effectuer des mouvements « latéraux »
(1), de « flexion »
(2) ou de « torsion »
(3). L’angle entre les 2
régions Fab module ainsi l’accessibilité aux antigènes dans
différents plans de l’espace. Ces mouvements de « flexion »
(2) facilitent également
l’accès aux effecteurs immunitaires. Enfin, la fixation des régions
Fab à des antigènes plus ou moins éloignés est possible par des
mécanismes de « rétractation » ou « d’étirement » de la charnière
haute (4). La charnière basse module
la flexibilité de la région Fc par des « mouvements latéraux »
(5) ou par « flexion »
(6) facilitant ainsi
l’interaction avec les effecteurs de l’immunité. |
La flexibilité des sous-classes varie selon l’ordre suivant :
IgG3>IgG1>IgG2=IgG4 ; la charnière des IgG3 conférant le plus de
flexibilité aux régions Fab et Fc de par sa grande taille [8]. Bien que cette flexibilité soit
associée à la capacité de chaque sous-classe à interagir avec les effecteurs de
l’immunité, elle n’explique que partiellement leur activité. En fait, plus la
structure de la charnière est flexible, plus la capacité à recruter les
effecteurs de l’immunité est élevée [9]. La région charnière des IgG3, presque 4 fois plus longue
que celle des IgG1, permettrait le meilleur recrutement des effecteurs
immunitaires. Toutefois, la flexibilité des IgG1 permet d’offrir un angle
optimal à la fixation des RFcγ et du C1q [10]. Les IgG2 possèdent une charnière
courte et peu flexible. Cette rigidité s’explique par la conformation de cette
sous-classe et par la présence de quatre ponts disulfures au sein de sa
charnière centrale. Plusieurs appariements possibles entre les cystéines des
chaînes lourdes et légères entraînent la formation d’isomères naturels de cette
sous-classe dont la fonction reste à explorer [11]. Les deux charnières centrales des IgG4, constituées de la séquence CPSC,
possèdent la particularité de pouvoir se dissocier in vivo et
générer des hémi-IgG4. La présence d’une sérine à la place d’une proline en
position 228 entraîne le rapprochement des cystéines d’une même chaîne
conduisant à la formation de ponts disulfures intra-chaînes [12]. C’est le cas du natalizumab
(Tysabri®, une IgG4 anti-intégrine α4β1) qui, sous la forme
d’hémi-IgG, peut se réassocier avec une hémi-IgG4 endogène et former un
anticorps bispécifique indésiré [13]. Cette particularité résulte également de la présence
d’une arginine en position 409, qui diminue les interactions entre domaines CH3.
La courte charnière des IgG4 entraîne une faible flexibilité qui ne permet pas
aux effecteurs immunitaires d’accéder à leur site de liaison sur
l’immunoglobuline [14].
L’ensemble des caractéristiques que nous avons décrites font ainsi de la région
charnière une région pivot pour la modulation de l’activité immunologique des
AcM thérapeutiques. En modifiant la séquence ou le nombre de ponts disulfures de
la région charnière d’un AcM, il est ainsi possible de modifier à façon ses
propriétés. |
L’ingénierie de la région charnière pour l’optimisation des fonctions
effectrices Les nombreux progrès en ingénierie moléculaire ont permis, par l’humanisation des AcM
thérapeutiques, d’augmenter leur demi-vie, de réduire leur immunogénicité et
d’accroître ainsi leur efficacité. Toutefois, au sein de la diversité des formats
dérivés de la structure des IgG, les modifications de la région charnière
représentent un point clé pour la modulation de leur fonctionnalité. Ainsi, la
mutation S228P2, en stabilisant la région
charnière des IgG4 et, par conséquent, en inhibant la formation d’hémi-IgG [15], a permis une avancée
majeure dans le développement des AcM sous ce format. C’est le cas pour le nivolumab
et le pembrolizumab utilisés chez les patients atteints de cancer, et de
l’ixekizumab (Taltz®, IgG4 anti-IL(interleukine)17) dans le traitement du
psoriasis [16].
L’introduction de cette mutation n’améliore cependant pas les fonctions effectrices
de cette sous-classe, ce qui en fait la sous-classe de choix pour les AcM pour
lesquels une fonction cytotoxique n’est pas recherchée. Il est à noter que la
rigidité de la région charnière des IgG4 ne permet pas une accessibilité optimale
des régions Fab aux antigènes ciblés. Plusieurs laboratoires ont développé des AcM
dont la structure est fondée sur celle d’une IgG1, mais dépourvue d’activité
cytolytique. Il est ainsi possible de combiner les mouvements des régions Fab de
cette sous-classe à des mutations de la région charnière, permettant d’éteindre les
fonctions effectrices : une méthode que l’on appelle Fc
silencing. Une première stratégie consiste à muter les acides aminés de la charnière basse
directement impliqués dans l’interaction avec les effecteurs de l’immunité. Ainsi,
la substitution L239A (Leucine239 en Alanine) et G241A (Glycine241 en Alanine),
permet au védolizumab (Entyvio®, une IgG1 anti-intégrine α4β7), utilisé
dans des pathologies inflammatoires chroniques, d’empêcher l’accès des lymphocytes T
mémoires au site inflammatoire mais les préserve de la lyse [17]. L’anifrolumab (une IgG1 anti-récepteur de
l’IFN[interféron] α) est un autre exemple de silencing pour un AcM
actuellement en phase III dans le traitement du lupus. Dans ce cas, il s’agit d’un
triple mutant L234F/L235E/P331S3 qui permet
d’abolir toutes les fonctions effectrices de l’immunoglobuline [18, 19]. Les mutations réalisées au sein de la région charnière ont en majorité pour but
d’abolir les fonctions effectrices. Toutefois, il est possible de potentialiser
l’effet antagoniste d’un AcM par des mutations touchant la charnière haute. La
rigidité de la structure ainsi obtenue limite les mouvements des régions Fab,
empêchant la dimérisation de la cible à la surface de la cellule4 [20]. La mutation S219C (sérine219 remplacée par une cystéine) du rituximab
(Mabthera®), une IgG1 anti-CD20, potentialise l’effet pro-apoptotique
de l’AcM in vitro en restreignant les mouvements des régions Fab de
l’anticorps. La charnière basse n’étant pas modifiée, le rituximab conserve sa
capacité à activer les fonctions effectrices [21]. Ces récentes études précisent l’importance
de certains AA de la région charnière pour l’optimisation des AcM à usage
thérapeutique. La région charnière est également un élément clé pour la bioconjugaison des anticorps
« armés » (antibody drug-conjugated, ADC). En effet, si le bras de
conjugaison est couplé aux cystéines des ponts disulfures de l’AcM, sa structure
générale pourra s’en trouver modifiée, inhibant ainsi les fonctions liées à sa
région charnière. Cette région peut également être capitale dans la conception de
nouveaux formats d’AcM. Wang et al. ont montré qu’un anticorps
« triple tandem », c’est-à-dire possédant deux régions Fab et trois régions Fc
reliées par une région charnière, présentait une meilleure CDC et une efficacité
augmentée dans un modèle d’infection à Klebsiella pneumoniae [22]. Cette stratégie permet
d’améliorer l’avidité de l’AcM pour les effecteurs de l’immunité en multipliant les
sites d’interaction. L’ensemble des exemples que nous avons décrits montre ainsi
l’intérêt majeur de considérer la région charnière comme une région clé pour le
développement de nouvelles molécules thérapeutiques utilisant une région Fc. |
Le clivage de la région charnière Bien qu’il soit possible d’améliorer les capacités fonctionnelles d’un AcM en
modifiant la région charnière, il est indispensable de préciser que cette région
présente la particularité d’être sensible au clivage protéolytique. Historiquement,
ce phénomène a permis l’obtention des fragments5 Fab et F(ab’)2 par l’utilisation respectivement de la
papaïne et de la pepsine [23, 24]. Ces 2
protéases ont été d’une grande utilité pour caractériser et comprendre la structure
des anticorps. Implication du microenvironnement dans le clivage in vivo
Des études récentes ont montré que la région charnière des IgG était sensible au
clivage par des protéases qui sont retrouvées dans le microenvironnement tumoral
et/ou inflammatoire, telles que les métalloprotéinases matricielles (MMP3, MMP7,
MMP12, MMP9) et la cathepsine G, ou encore dans des situations infectieuses
(comme l’IdeS, pour immunoglobulin-degrading enzyme of Streptococcus
pyogenes ou la glutamyl endopeptidase GluV8 de
Saphyloccocus aureus)[ 25]. Bien que ce phénomène ait été évalué
in vitro, plusieurs études rapportent la détection d’IgG
clivées dans des biopsies de tumeurs ainsi que dans le liquide synovial de
patients atteints de polyarthrite rhumatoïde [ 26]. Les protéases présentes dans des
biopsies issues de patients atteints de maladies inflammatoires intestinales
sont d’ailleurs capables de cliver l’adalimumab (Humira ®, IgG1
anti-TNF-α), l’infliximab (Remicade ®, IgG1 anti-TNFα) et l’étanercept
(Enbrel ®, protéine de fusion TNFR-Fc) [ 27]; l’étanercept, composé d’une région
charnière et de la région Fc d’une IgG1, est plus facilement clivé par la MMP3
et la MMP12 que ces deux AcM anti-TNF-α. La structure de la molécule
thérapeutique est donc un point clé dans ce mécanisme de clivage protéolytique
puisque la nature de la charnière basse conditionne la susceptibilité au
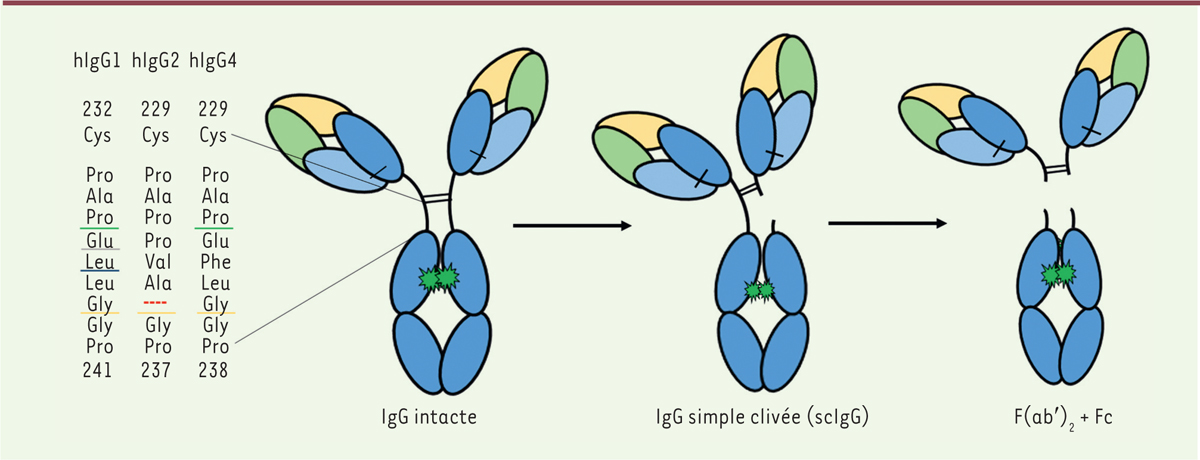
clivage. Cinétique de clivage Pour la plupart, les protéases décrites clivent séquentiellement la charnière
basse des IgG au niveau de sites spécifiques conservés entre les sous-classes
(Figure 4). Un
premier clivage rapide de l’une des deux chaînes lourdes entraîne la formation
d’IgG simple clivée (scIgG). Le clivage de la seconde chaîne lourde, plus lent,
produit un fragment F(ab’) 2 et libère le fragment Fc. Bien que
l’hypothèse n’ait pas été vérifiée, il est postulé que le premier clivage
modifie la conformation des scIgG, limitant la vitesse du second clivage [ 28]. La cinétique de
clivage est propre à chacune des protéases. Pour une même IgG1, le clivage par
l’IdeS s’effectue en quelques minutes tandis que celui réalisé par la MMP3 et la
MMP12 nécessite plusieurs heures [ 25,
26]. La cinétique de clivage des IgG2
par l’IdeS est plus lente [ 29] et les substitutions d’AA au sein de la charnière de cette
sous-classe ( Figure 1
) la rendent complètement résistante au clivage par les
MMP, au contraire des IgG1 et IgG4. Finalement, la structure de la molécule
thérapeutique (IgG versus protéine de fusion) ainsi que la
composition de la région charnière sont les seuls paramètres connus capables
d’influencer la susceptibilité au clivage protéolytique.
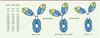 | Figure 4 Clivage de la charnière basse des trois sous-classes
d’IgG présentes sur le marché. Les sites de
clivages spécifiques de la MMP (matrix
metalloproteinase) 3 et de la MMP12 (vert), de la
cathepsine G (gris), de la pepsine et de MMP7 (bleu) ainsi que
d’IdeS (jaune) sont représentés sur la gauche. Le clivage séquentiel
des deux chaînes lourdes est représenté à droite. Le clivage d’une
des deux chaînes lourdes génère des IgG simples clivées (scIgG). Le
clivage de la seconde forme un fragment F(ab’)2 et un
fragment Fc. |
Le clivage se situant dans la région charnière basse a des conséquences
fonctionnelles très importantes. Il est évident que la génération de fragments
F(ab’)2 d’un AcM entraîne une perte des fonctions effectrices
reposant sur la région Fc et une élimination rapide de l’anticorps, qui n’est
plus pris en charge par le FcRn. Pour les scIgG, en revanche, les interactions
des glycanes des deux chaînes lourdes ainsi que celles des domaines CH3
permettent de conserver la structure de l’IgG (c’est-à-dire avec une région Fc
complète) [25], et leur fixation au FcRn
n’est pas altérée. La demi-vie in vivo des scAcM est ainsi
comparable à celle des AcM intacts [25]. Mécanismes d’échappement aux thérapies dépendantes d’une région Fc Le simple clivage d’un anticorps anti-CD20 entraîne une inhibition de son
interaction avec les RFcγIIa, les RFcγIIIa, alors que l’interaction avec le
RFcγI est peu diminuée. Les fonctions effectrices associées telles que l’ADCC ou
la CDC ne sont également plus activées efficacement lorsque les effecteurs
immunitaires sont stimulés par le sc-trastuzumab ou le sc-pertuzumab
(Perjeta ®, IgG1 anti-HER2/neu), les formes scIgG des AcM [ 30]. De même, Fan
et al. ont montré que le sc-trastuzumab est incapable
d’éliminer efficacement les cellules tumorales HER2/Neu + chez des
souris xénogreffées [ 31]. Le clivage des AcM entraîne donc des conséquences fonctionnelles
favorisant l’échappement au traitement par les anticorps. Si le clivage de la charnière basse semble capital lorsqu’il s’agit des fonctions
effectrices reposant sur la région Fc, il ne faut toutefois pas négliger le
clivage de la charnière haute des IgG par plusieurs protéases, telles que
l’élastase humaine qui est sécrétée par les neutrophiles. Ce type de clivage
devient problématique lors du développement d’un anticorps bispécifique qui
perdrait une des 2 régions Fab suite à la coupure protéique. Le mécanisme
premier de ce type d’anticorps serait alors aboli. Des modifications de la charnière basse peuvent être envisagées pour contrer ce
phénomène protéolytique. Ainsi, une étude a récemment montré que la substitution
des résidus ELLG de la charnière basse d’une IgG1 par les résidus PVA de la
charnière basse d’une IgG2 permettait de rendre un AcM anti-CD20 résistant au
clivage par la MMP3 et la MMP12 (Figure
1). Il a néanmoins été nécessaire d’introduire les
mutations S239D et I332E afin de restaurer les fonctions effectrices de l’AcM
[32]. Cette
approche représente un premier pas vers l’élaboration d’anticorps résistant au
clivage protéolytique. Détection du clivage des IgG endogènes Le clivage des IgG engendre des néoépitopes, dès la forme scIgG, qui sont à
l’origine de la production d’anticorps anti-charnière (AHA ou anti-hinge
antibody). Ces AHA sont spécifiques des AA C-terminaux du site de
clivage mais ne reconnaissent pas la région charnière d’IgG non clivée [ 33]. Physiologiquement,
ces AHA soulèvent de nombreuses questions, puisqu’une étude rapporte qu’ils sont
détectables chez 70 % des sujets sains [ 34]. Leur présence suggère donc que le clivage des IgG se
réalise in vivo, dans la population générale. In
vitro, ces AHA peuvent restaurer indirectement les fonctions d’ADCC
et de CDC à des scIgG et des fragments F(ab’) 2, en procurant une
région Fc fonctionnelle aux molécules clivées une fois fixés à celles-ci [ 35]. Si l’importance
clinique de ces AHA reste à explorer, leur spécificité permet de les utiliser
comme outils. Par une approche d’immunisation peptidique, Ryan et
al. ont en effet développé des AHA dirigés contre les sites de
clivages de la MMP3, de la cathepsine G et d’IdeS [ 26]. Cette stratégie reste néanmoins discutable puisqu’elle
utilise des peptides linéaires excluant ainsi la reconnaissance d’épitopes
conformationnels. Marqueur de pronostic clinique chez les patients L’utilisation d’AHA a permis de montrer qu’une augmentation de scIgG dans le
tissu tumoral chez des patientes présentant un cancer du sein était associée à
une évolution clinique péjorative, en particulier à la présence de métastases
dans les ganglions axillaires drainants [ 36]. Biancheri et al. ont montré qu’un
niveau élevé de scIgG dans le sérum de patients atteints de maladies
inflammatoires chroniques de l’intestin est également associé à une mauvaise
réponse clinique à des traitements par des anticorps anti-TNF-α [ 27]. Le clivage des AcM thérapeutiques in vivo apparaît donc
possible. Si la présence des scIgG a pu être détectée ex vivo,
la proportion des formes clivées des AcM thérapeutiques chez les patients
traités n’a pas été évaluée à ce jour. Au vu des conséquences fonctionnelles du
clivage, qui n’influencent cependant pas la fixation au FcRn, il paraît
nécessaire de développer des méthodes de quantification de ces formes clivées
chez le patient. Finalement, évaluer la quantité de formes clivées d’AcM
circulantes permettrait d’améliorer les modèles pharmacocinétiques et d’adapter
les doses d’anticorps dans la prise en charge des patients. Application de la susceptibilité au clivage de la région charnière à la
réduction de la pathogénicité d’(auto-)anticorps En clinique, il est possible de tirer profit du mécanisme de clivage des
anticorps dans le cas où le traitement repose sur l’élimination d’anticorps
pathogènes. Dans un modèle animal du syndrome de Guillain-Barré impliquant des
anticorps pathogènes développé chez le lapin, il a en effet été montré que la
survie des animaux traités par l’IdeS de Streptococcus pyogenes
(qui clive les anticorps) était augmentée en comparaison de celle de lapins
contrôles [ 37].
L’utilisation de protéases est donc envisageable dans des maladies nécessitant
une élimination rapide des anticorps responsables de la pathologie. Une étude a
ainsi récemment montré que l’utilisation d’IdeS (Imfilidase ®) était
bénéfique dans l’élimination des anticorps anti- Human Leukocyte
Antigen (HLA) ( donor specific antibody ou DSA)
pour la prévention du rejet de greffe rénale induite par ces anticorps [ 38, 39]. Le clivage des anticorps
pathogènes par l’IdeS semble également être une piste prometteuse dans le
traitement des thrombocytopénies induites par l’héparine [ 40]. |
L’utilisation des AcM et des protéines de fusion pour le traitement de cancers et de
maladies inflammatoires chroniques est aujourd’hui en plein essor. Une grande
proportion de ces biomédicaments a la particularité d’être pourvue d’une région Fc
capable d’interagir, via la charnière basse et le domaine CH2, avec
les effecteurs de l’immunité. Les progrès en ingénierie moléculaire ont permis de
générer des formats d’AcM adaptés à des pathologies données. Les modifications
apportées, plus particulièrement au niveau de la charnière basse, ont permis de
moduler l’efficacité de ces molécules thérapeutiques. La compréhension de la
relation structure/fonction des charnières haute et centrale reste cependant à
approfondir. Parmi ces nombreuses innovations, la problématique du mécanisme de
clivage protéolytique concerne l’ensemble des formats. De nouvelles modifications de
la région charnière semblent nécessaires afin de rendre les formats d’AcM résistant
à la protéolyse in vivo. Les conséquences fonctionnelles de ce
phénomène rendent également compte de la nécessité de développer des outils
permettant leur quantification in vivo chez les patients afin de
déterminer si les formes clivées représentent des marqueurs d’intérêt en clinique
humaine. Dans l’affirmative, cette approche théranostique permettrait d’améliorer la
prise en charge des patients traités par ces biomédicaments. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article. |
Q. Deveuve est financé par l’agence nationale de la recherche dans le cadre
du programme Investissements d’avenir (n° ANR-10-LABX-53-01).
|
Footnotes |
1.
Burton
DR , Immunoglobulin
G: functional sites . Mol
Immunol .
1985;;22::161.–206. 2.
Ugurlar
D,
Howes
SC, de
Kreuk
BJ, et al.,
Structures of C1-IgG1 provide insights into how danger
pattern recognition activates complement .
Science .
2018;;359::794.–7. 3.
Strasser
J, De
Jong
RN,
Beurskens
FJ, et al.,
Unraveling the macromolecular pathways of IgG oligomerization
and complement activation on antigenic surfaces .
Nano Lett .
2019;;19::4787.–96. 4.
Bindon
CI , Human
monoclonal IgG isotypes differ in complement activating function at the
level of C4 as well as C1q . J Exp
Med .
1988;;168::127.–42. 5.
Morgan
A,
Jones
ND,
Nesbitt
AM, et al.,
The N-terminal end of the CH2 domain of chimeric human IgG1
anti-HLA-DR is necessary for C1q, Fc gamma RI and Fc gamma RIII
binding . Immunology .
1995;;86::319.–24. 6.
Guddat
LW,
Herron
JN,
Edmundson
AB ,
Three-dimensional structure of a human immunoglobulin with a
hinge deletion . Proc Natl Acad Sci
USA .
1993;;90::4271.–75. 7.
Saphire
EO,
Stanfield
RL, Max
Crispin
MD, et al.,
Contrasting IgG structures reveal extreme asymmetry and
flexibility . J Mol Biol .
2002;;319::9.–18. 8.
Roux
KH,
Strelets
L,
Michaelsen
TE , Flexibility of
human IgG subclasses . J
Immunol .
1997;;159::3372.–82. 9.
Bruhns
P,
Iannascoli
B,
England
P, et al.,
Specificity and affinity of human Fc receptors and their
polymorphic variants for human IgG subclasses .
Blood .
2009;;113::3716.–25. 10.
Rayner
LE,
Hui
GK,
Gor
J, et al.,
The solution structures of two human IgG1 antibodies show
conformational stability and accommodate their C1q and FcγR
ligands . J Biol Chem .
2015;;290::8420.–38. 11.
Dillon
TM,
Ricci
MS,
Vezina
C, et al.,
Structural and functional characterization of disulfide
isoforms of the human IgG2 subclass . J Biol
Chem .
2008;;283::16206.–15. 12.
Rispens
T,
Ooijevaar-de Heer
P,
Bende
O, et al.,
Mechanism of immunoglobulin G4 Fab-arm
exchange . J Am Chem Soc .
2011;;133::10302.–11. 13.
Labrijn
AF,
Buijsse
AO, van den
Bremer
ETJ, et al.,
Therapeutic IgG4 antibodies engage in Fab-arm exchange with
endogenous human IgG4 in vivo . Nat
Biotechnol .
2009;;27::767.–71. 14.
Rayner
LE,
Hui
GK,
Gor
J, et al.,
The Fab conformations in the solution structure of human
immunoglobulin G4 (IgG4) restrict access to its Fc region: Implications for
functional activity . J Biol
Chem .
2014;;289::20740.–56. 15.
Bloom
JW,
Madanat
MS,
Marriott
D, et al.,
Intrachain disulfide bond in the core hinge region of human
IgG4 . Protein Sci .
2008;;6::407.–15. 16.
Liu
L,
Lu
J,
Allan
BW, et al.,
Generation and characterization of ixekizumab, a humanized
monoclonal antibody that neutralizes interleukin-17A .
J Inflamm Res . 2016;;
9: :39.–50. 17.
Wyant
T,
Yang
L,
Fedyk
E , In vitro
assessment of the effects of vedolizumab binding on peripheral blood
lymphocytes . mAbs .
2013;;5::842.–50. 18.
Peng
L,
Oganesyan
V,
Wu
H, et al.,
Molecular basis for antagonistic activity of anifrolumab, an
anti-interferon – α receptor 1 antibody .
mAbs .
2015;;7::428.–39. 19.
Riggs
JM,
Hanna
RN,
Rajan
B, et al.,
Characterisation of anifrolumab, a fully human
anti-interferon receptor antagonist antibody for the treatment of systemic
lupus erythematosus . Lupus Sci
Med .
2018;;5::e000261.. 20.
Gonzalez
A,
Broussas
M,
Beau-Larvor
C, et al.,
A novel antagonist anti-cMet antibody with antitumor
activities targeting both ligand-dependent and ligand-independent c-Met
receptors: A full antagonist anti-c-Met MAb with in vivo
activity . Int J Cancer .
2016;;139::1851.–63. 21.
Könitzer
JD,
Sieron
A,
Wacker
A, et al.,
Reformatting Rituximab into human IgG2 and IgG4 isotypes
dramatically improves apoptosis induction in vitro
. PLoS One .
2015;;10::e0145633.. 22.
Wang
Q,
Chen
Y,
Pelletier
M, et al.,
Enhancement of antibody functions through Fc
multiplications . mAbs .
2017;;9::393.–403. 23.
Porter
RR , The hydrolysis
of rabbit y-globulin and antibodies with crystalline papain .
Biochem J .
1959;;73::119.–26. 24.
Nisonoff
A,
Wissler
FC,
Lipman
LN , Properties of
the major component of a peptic digest of rabbit antibody .
Science .
1960;;132::1770.–1. 25.
Brezski
RJ,
Vafa
O,
Petrone
D, et al.,
Tumor-associated and microbial proteases compromise host IgG
effector functions by a single cleavage proximal to the
hinge . Proc Natl Acad Sci
USA .
2009;;106::17864.–69. 26.
Ryan
MH,
Petrone
D,
Nemeth
JF, et al.,
Proteolysis of purified IgGs by human and bacterial enzymes
in vitro and the detection of specific proteolytic fragments of endogenous
IgG in rheumatoid synovial fluid . Mol
Immunol .
2008;;45::1837.–46. 27.
Biancheri
P,
Brezski
RJ, Di
Sabatino
A, et al.,
Proteolytic cleavage and loss of function of biologic agents
that neutralize tumor necrosis factor in the mucosa of patients with
inflammatory bowel disease .
Gastroenterology .
2015;;149::1564.–74. 28.
Brezski
RJ,
Jordan
RE , Cleavage of IgGs by
proteases associated with invasive diseases. mAbs .
2010;;2::212.–20. 29.
Brezski
RJ,
Oberholtzer
A,
Strake
B, et al.,
The in vitro resistance of IgG2 to proteolytic attack concurs
with a comparative paucity of autoantibodies against peptide analogs of the
IgG2 hinge . mAbs .
2011;;3::558.–67. 30.
Hsiao
HC,
Fan
X,
Jordan
RE, et al.,
Proteolytic single hinge cleavage of pertuzumab impairs its
Fc effector function and antitumor activity in vitro and in
vivo . Breast Cancer Res .
2018;; 20; 20h43.. 31.
Fan
X,
Brezski
RJ,
Fa
M, et al.,
A single proteolytic cleavage within the lower hinge of
trastuzumab reduces immune effector function and in vivo
efficacy . Breast Cancer
Res .
2012;;14::R116.. 32.
Kinder
M,
Greenplate
AR,
Grugan
KD, et al.,
Engineered protease-resistant antibodies with selectable
cell-killing functions . J Biol
Chem .
2013;;288::30843.–54. 33.
Brezski
RJ,
Luongo
JL,
Petrone
D, et al.,
Human anti-IgG1 hinge autoantibodies reconstitute the
effector functions of proteolytically inactivated IgGs .
J Immunol .
2008;;181::3183.–92. 34.
Falkenburg
WJ, van
Schaardenburg
D,
Ooijevaar-de Heer
P, et al.,
Anti-hinge antibodies recognize IgG subclass- and
protease-restricted neoepitopes . J
Immunol .
2017;;198::82.–93. 35.
Fan
X,
Brezski
RJ,
Deng
H, et al.,
A novel therapeutic strategy to rescue the immune effector
function of proteolytically inactivated cancer therapeutic
antibodies . Mol Cancer
Ther .
2015;;14::681.–91. 36.
Zhang
N,
Deng
H,
Fan
X, et al.,
Dysfunctional antibodies in the tumor microenvironment
associate with impaired anticancer immunity .
Clin Cancer Res .
2015;;21::5380.–90. 37.
Wang
Y,
Shi
Q,
Lv
H, et al.,
IgG-degrading enzyme of Streptococcus
pyogenes (IdeS) prevents disease progression and facilitates
improvement in a rabbit model of Guillain-Barré syndrome .
Exp Neurol .
2017;;291::134.–40. 38.
Jordan
SC,
Lorant
T,
Choi
J, et al.,
IgG Endopeptidase in highly sensitized patients undergoing
transplantation . N Engl J
Med .
2017;;377::442.–53. 39.
Lonze
BE,
Tatapudi
VS,
Weldon
EP, et al.,
IdeS (Imlifidase): A novel agent that cleaves human IgG and
permits successful kidney transplantation across high-strength
donor-specific antibody . Ann
Surg .
2018;;268::488.–96. 40.
Kizlik-Masson
C,
Deveuve
Q,
Zhou
Y, et al.,
Cleavage of anti-PF4/heparin IgG by a bacterial protease and
potential benefit in heparin-induced thrombocytopenia .
Blood .
2019;;133::2427.–35. |