L’efficacité d’un anticorps thérapeutique dépend fortement de ses propriétés
pharmacocinétiques. Ces propriétés reposent sur plusieurs caractéristiques, dont
leur activité de liaison à leur cible, leur charge, leur degré de glycosylation et
leur capacité de recyclage. Les anticorps sont des protéines de haute masse
moléculaire, d’environ 150 kDa. Ils sont polaires et se déplacent lentement entre
les cellules endothéliales vasculaires périphériques du sang vers les espaces
interstitiels des tissus. Les concentrations les plus élevées d’anticorps sont ainsi
observées dans des tissus très richement perfusés et présentant un réseau vasculaire
lâche, tels que la moelle osseuse, la rate ou le foie. La pénétration des anticorps
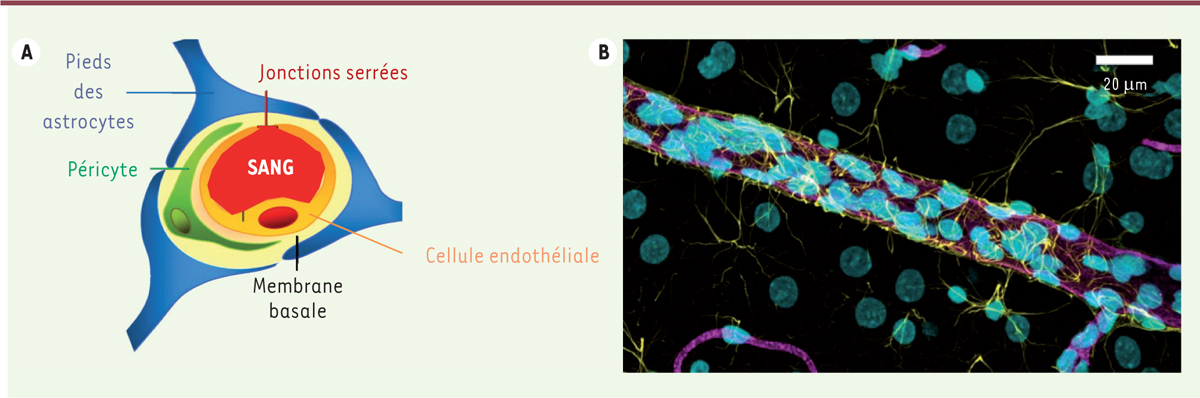
est beaucoup plus limitée dans des tissus comme le cerveau, protégé par la BHE, et
les tumeurs dont les réseaux de vascularisation sont très peu en contact avec la
circulation lymphatique. Une des stratégies principales pour accroître la
concentration d’anticorps thérapeutiques dans le tissu tumoral consiste à cibler un
ou plusieurs antigènes spécifiquement surexprimés par les tumeurs [4]. Nous exposerons ici essentiellement les
résultats obtenus et les essais en cours visant à faciliter le passage des anticorps
au travers de la BHE et accroître ainsi l’exposition cérébrale à ces anticorps. Nous
nous limiterons aux anticorps administrés par voie systémique (ce qui représente la
majorité des cas). Nous ne traiterons donc pas des administrations par les autres
voies (intrathécale, intracérébrale et intranasale notamment) ni les rares cas de
formulations nanoparticulaires ou d’administrations facilitées par des
ultrasons.
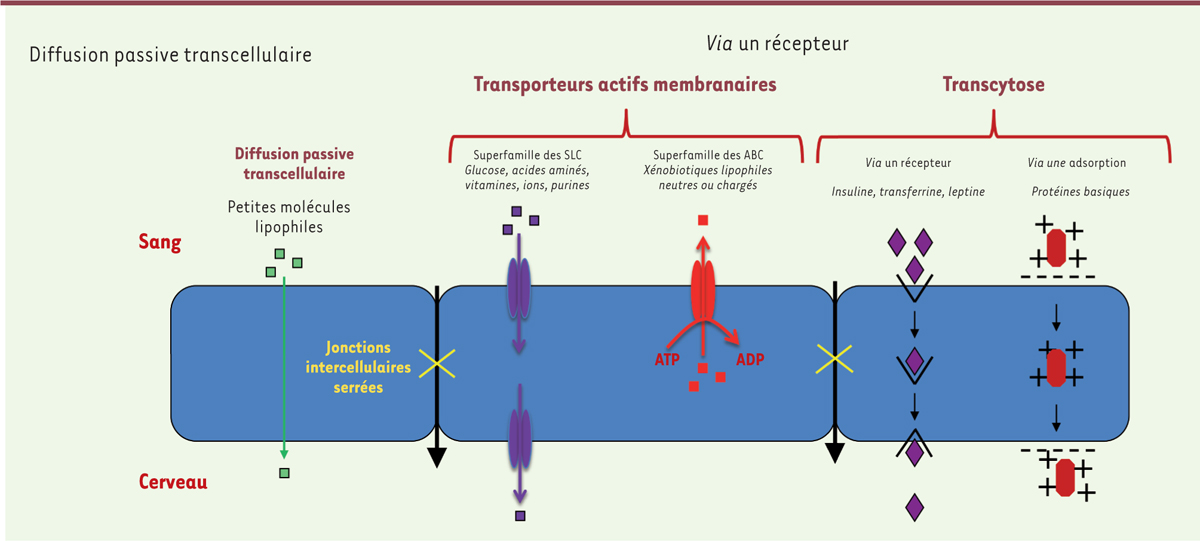
Alors que les concentrations d’immunoglobulines (IgG) dans les organes richement
perfusés sont généralement comprises entre 10 et 50 % de leur taux plasmatique
[6], celles dans le
cerveau ne représentent, en moyenne, que de 0,01 % à 0,4 % du taux plasmatique
[1]. L’une des façons d’augmenter
l’exposition cérébrale d’un anticorps administré par voie systémique est donc de lui
adjoindre un « module » spécifique qui lui permettra de traverser la BHE par
transcytose.
Plusieurs stratégies ont été développées au cours des dernières décennies pour
administrer des protéines au cerveau. L’une d’elles repose sur l’ajout de charges
positives aux protéines ciblant la TMA. L’équipe de William Pardridge, physiologiste
américain de l’université de Californie à Los Angeles, avait en effet montré, dès
1987, que les IgG cationisées par l’ajout de résidus polyamines, présentaient une
meilleure distribution cérébrale que des IgG natives [7]. Toutefois, l’affinité de ces anticorps
cationisés est souvent réduite, ce qui peut limiter leurs activités biologiques. Le
cytosol des cellules, qui est un milieu réducteur, peut également altérer la
structure des IgG en réduisant les ponts disulfures intra-domaines, en particulier
celui du domaine variable, entraînant une modification conformationnelle avec,
in fine, une perte de reconnaissance de l’antigène par
l’anticorps. La TMA n’est par ailleurs pas spécifique d’un type de tissu ou d’une
cellule. Des effets secondaires touchant différentes cibles peuvent donc apparaître
en cas d’utilisation thérapeutique. Enfin, ces mécanismes d’endocytose qui dépendent
des charges des molécules sont souvent considérés comme étant toxiques.
D’autres stratégies ont été élaborées afin de cibler les mécanismes de TMR. Elles
consistent à utiliser des modules transporteurs qui sont inspirés de ceux présents
au niveau de la BHE elle-même et des mécanismes qui lui permettent d’importer les
protéines endogènes qui lui sont indispensables. Les transporteurs les plus étudiés
aujourd’hui sont ceux de l’insuline et de la transferrine. Des travaux pionniers,
conduits par William Pardridge [8], ont montré l’intérêt de ces transporteurs pour véhiculer des
protéines dans le cerveau et ont inspiré une variété de formats d’anticorps
multi-spécifiques qui ont permis d’augmenter leur exposition cérébrale, parfois d’un
facteur important. Ces nouveaux formats sont, par exemple, des anticorps contre les
récepteurs de l’insuline ou de la transferrine auxquels est fusionnée une protéine
thérapeutique qui peut-être une enzyme, un facteur de croissance, un anticorps ou un
de ses fragments (comme par exemple un scFv [single chain fragment
variable] ou un Fab).
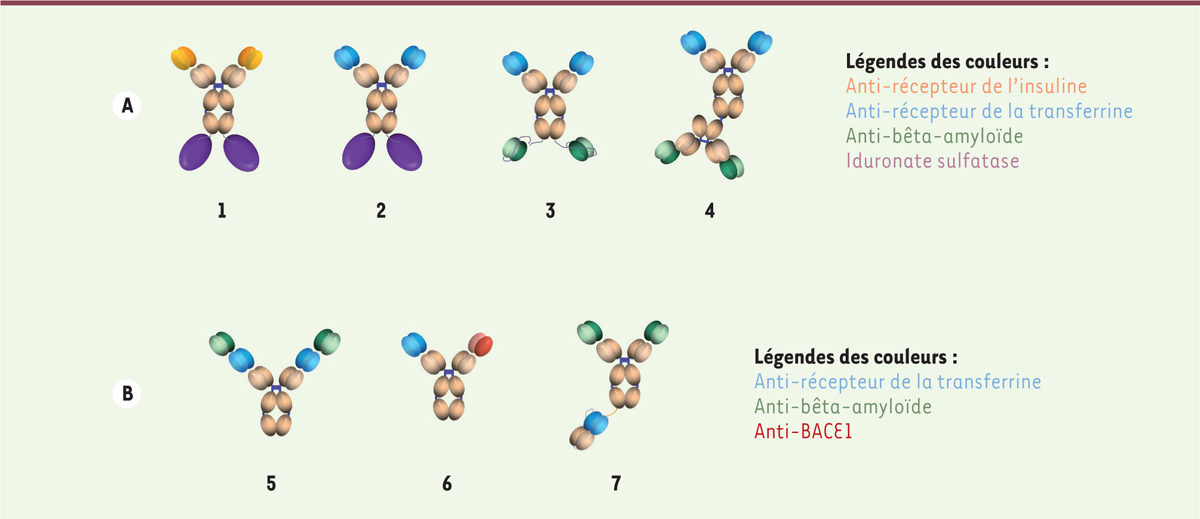
Quelques constructions appartenant à cette catégorie (Figure 3A) sont en développement clinique, comme
des protéines de fusion constituées de l’enzyme lysosomale iduronate sulfatase
fusionnée avec un anticorps contre le récepteur de l’insuline [9] (Figure 3A, -1-) ou avec un anticorps contre le
récepteur de la transferrine [10] (Figure 3A,
-2-), avec lesquelles des études cliniques de phase II sont en cours
pour traiter la mucopolysaccharidose2.
Plusieurs protéines de fusion de ce type ont été construites avec des anticorps
anti-bêta-amyloïde soit sous forme de fragments ScFv (
Figure 3A, -3-) [11] ou de fragments F(ab’)2
de ces anticorps [12]
(Figure 3A, -4-).
Elles ont montré un intérêt dans des modèles murins ou en imagerie de la maladie
d’Alzheimer [13]. Des
protéines de fusion avec d’autres protéines thérapeutiques ont été décrites, comme
celle fusionnée avec l’érythropoiëtine [14], ou avec une protéine inhibitrice du TNF-a (tumor
necrosis factor alpha) [15] ou avec des enzymes lysosomales [16].
 | Figure 3. Nouveaux formats d’anticorps thérapeutiques à pénétration
cérébrale renforcée. BACE1:
beta-secretase 1. |
Une deuxième catégorie de constructions (Figure
3B) consiste en des anticorps thérapeutiques dans lesquels
un paratope3 spécifique a été incorporé. Ce
paratope peut reconnaître le récepteur de la transferrine, soit sous forme de
bispécifiques bivalents (Figure 3B,
-6-)comme les DVD (dual variable domain) [17] ou les TBTI
(tetravalent bispecific tandem IgG) [18] ou monovalents (Figure 3B, -7-) [19], ou résultant de la fusion d’un
domaine scFv (Figure 3B, -8-)
[20]. Là encore, des
anticorps se sont révélés prometteurs dans la maladie d’Alzheimer [un anticorps
contre la protéine beta-amyloïde (Figure
3B, -6,8-) et un anticorps contre l’enzyme BACE1
(beta-secretase 1) (Figure 3B, -7-) qui est responsable des coupures de la
protéine à l’origine des fragments toxiques].
La pénétration des anticorps dans les tissus repose sur leur affinité pour leurs
cibles. Ce processus, qui a été décrit pour la distribution des anticorps au sein
des tumeurs [21], a été
également observé pour l’exposition d’anticorps dirigés contre le récepteur de la
transferrine dans le cerveau. Un laboratoire américain a ainsi montré que des
mutations touchant le paratope d’anticorps spécifiques de ce récepteur, affectant
leur affinité pour leur cible, pouvaient augmenter, dans certaines conditions, leur
exposition dans le parenchyme cérébral [18].
Un grand groupe pharmaceutique européen a également décrit le fait que certains
formats d’anticorps monovalents, spécifiques du récepteur de la transferrine
(Figure 3B, -7-), qui
ont une avidité réduite pour leur cible, présentent des expositions cérébrales
augmentées [20]. Le potentiel de ces avancées
permettant d’accroître les expositions cérébrales d’anticorps dirigés contre des
récepteurs exprimés par la BHE est très prometteur dans toutes les indications
concernant le système nerveux central, que ce soient les maladies neurodégénératives
ou les désordres centraux liés à certaines maladies génétiques, ou le glioblastome,
les lymphomes cérébraux et les métastases cérébrales. Quelques formats sont d’ores
et déjà en développement. Ils ont fait la preuve de leur innocuité. Néanmoins, pour
certains, comme les anticorps contre les récepteurs de l’insuline ou de la
transferrine, un ajustement très fin de leurs propriétés reste nécessaire afin
d’éviter, pour les uns, des problèmes de toxicité liés à leurs effets sur la
glycémie [22] ou des
désordres pancréatiques [23], ou, pour les autres, des désordres sanguins ou médullaires [24]. L’avenir nous dira si ce
potentiel livre toutes ses promesses.
De nouveaux formats d’anticorps ont fait récemment leur apparition. Ils sont issus
d’immunoglobulines d’autres espèces animales que l’homme. Les camélidés (chameaux,
dromadaires, lamas, alpagas, etc.) ont la particularité de produire des anticorps
conventionnels possédant des chaînes lourdes et légères mais aussi deux sous-classes
d’IgG formées uniquement de dimères de chaînes lourdes [25]. Le paratope de ces anticorps à domaine
unique est constitué d’un seul domaine VH, appelé VHH ou
nanobodyTM. Ces anticorps homodimériques dont la
chaîne lourde se caractérise par l’absence de domaine CH1, révèlent ainsi que le
répertoire anticorps ne repose pas uniquement sur une combinatoire VH-VL. Des
anticorps à domaine unique ont aussi été trouvés dans les poissons cartilagineux
comme le requin. Leurs fragments (VNAR) présentent le même type de
propriétés que les VHH [26]. Un grand nombre d’anticorps à domaine unique ayant une affinité
élevée vis-à-vis d’un antigène ont déjà été isolés par la technique du phage
display4, ou par ribosome
display5. En raison de leur
pouvoir de diffusion élevé lié à leur petite taille (15 kDa), de leur sélectivité et
de l’absence de réactions immunologiques lorsqu’ils sont injectés dans des animaux
d’autres espèces ou chez l’homme, ces VHH combinent les avantages des
anticorps conventionnels à ceux des petites molécules [27]. Ils sont aussi naturellement très stables:
ils supportent des températures élevées et la réduction de leur pont disulfure
intra-domaine n’entraîne pas de perte de reconnaissance de l’antigène qu’ils
ciblent. Cette dernière propriété permet ainsi d’utiliser ces VHH, après
leur transfection à l’intérieur d’une cellule, comme marqueur intracellulaire [28]. Environ 2/3 des
VHH ont un point isoélectrique basique. Ils sont donc naturellement
cationisés ce qui leur confère la capacité de traverser facilement la BHE in
vivo. Lafaye et al. ont en effet montré que des
VHH ayant un point isoélectrique basique et dirigés contre la
protéine fibrillaire gliale acide (glial fibrillary acidic protein,
ou GFAP), un marqueur spécifique des astrocytes, étaient capables, après leur
injection intra-carotidienne chez la souris, de se lier à cette protéine dans le
cytoplasme des astrocytes [29]. Cette capacité des VHH de traverser la barrière a été
confirmée récemment avec des VHH dirigés contre les deux principales
lésions de la maladie d’Alzheimer: les plaques amyloïdes intra-cérébrales et les
dégénérescences neurofibrillaires (DNF) intra-neuronales. Ces VHH marqués
par un fluorochrome vert ont en effet été testés in vivo dans deux
modèles murins de maladie d’Alzheimer. Après injection par voie intraveineuse, les
VHH traversent la BHE et interagissent avec les plaques amyloïdes et
les DNF [30] ; une étude
pharmacocinétique utilisant le VHH dirigé contre les plaques amyloides
montre que, deux heures après l’injection intraveineuse, 0,5 % de la dose injectée
est retrouvé dans le cerveau. Le marquage intracérébral que permettent ces 3
VHH repose sur un ensemble de propriétés que les anticorps
conventionnels n’ont pas: (1) la capacité de traverser la BHE et d’entrer dans les
cellules, car ils sont cationisés ; (2) une petite taille permettant leur diffusion
dans le tissu cérébral ; (3) la reconnaissance spécifique d’un antigène
intracellulaire grâce à leur très grande stabilité ; et, enfin, (4) leur capacité à
transporter des molécules pour le diagnostic ou la thérapie.