| |
| Med Sci (Paris). 35(12): 1114–1120. doi: 10.1051/medsci/2019208.Mécanismes d’action et toxicités potentielles des
anticorps monoclonaux Theodora Bejan-Angoulvant1,2* and Joachim Alexandre3 1Service de Pharmacologie médicale, CHRU de Tours ; EA 7501,
GICC, équipe PATCH, Université de Tours, 37000Tours,
France 2LabEx MabImprove, 3Service de Pharmacologie, CHU Caen ; EA4650, Normandie
Université, Caen, 14000, France MeSH keywords: Animaux, Anticorps monoclonaux, Effets secondaires indésirables des médicaments, Humains, Système immunitaire, Surveillance post-commercialisation des produits de santé, Transduction du signal, effets indésirables, immunologie, usage thérapeutique, épidémiologie, étiologie, effets des médicaments et substances chimiques, métabolisme |
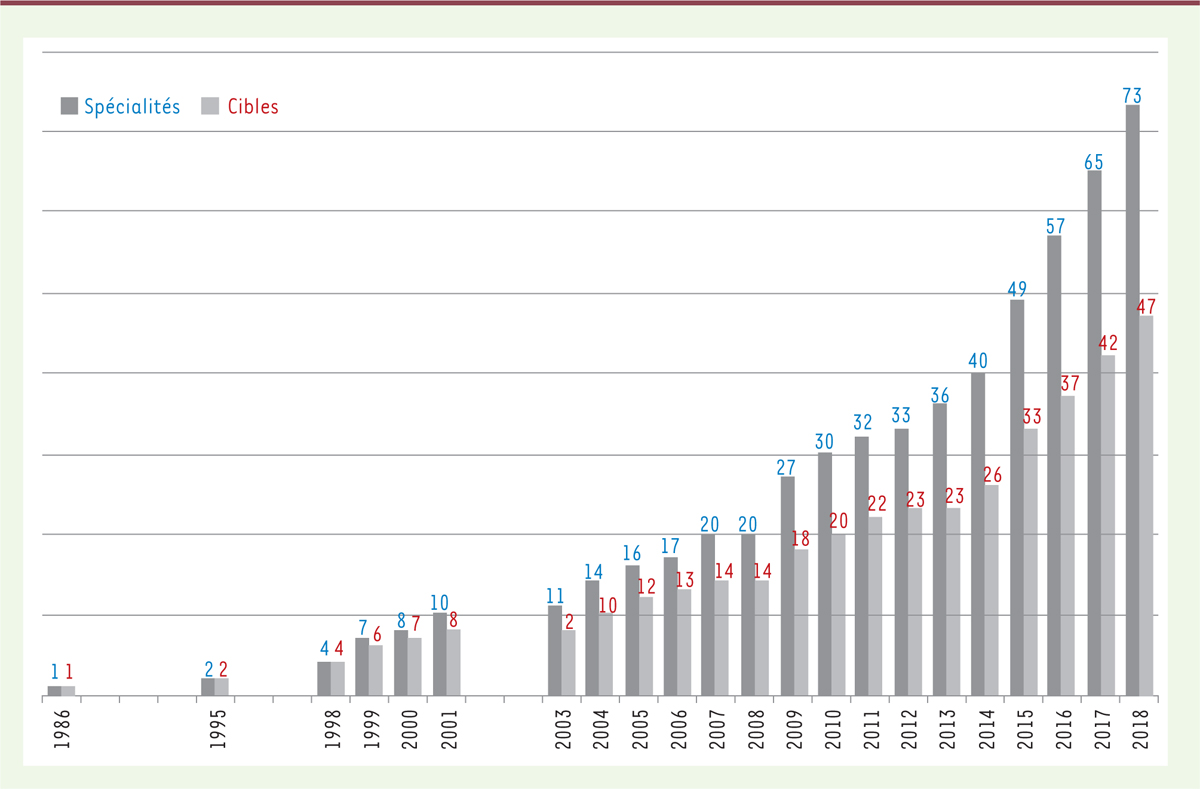
Les anticorps thérapeutiques monoclonaux (AcM) représentent le plus important progrès
pharmacologique et thérapeutique des 20 dernières années. Ce progrès est marqué non
seulement par le nombre croissant de ces anticorps qui sont mis sur le marché mais
également par le nombre croissant des cibles antigéniques que ces anticorps
reconnaissent (Figure 1).
 | Figure 1.
Nombre de spécialités d’anticorps monoclonaux ayant une
autorisation de mise sur le marché, et de leurs cibles (fin
2018).
|
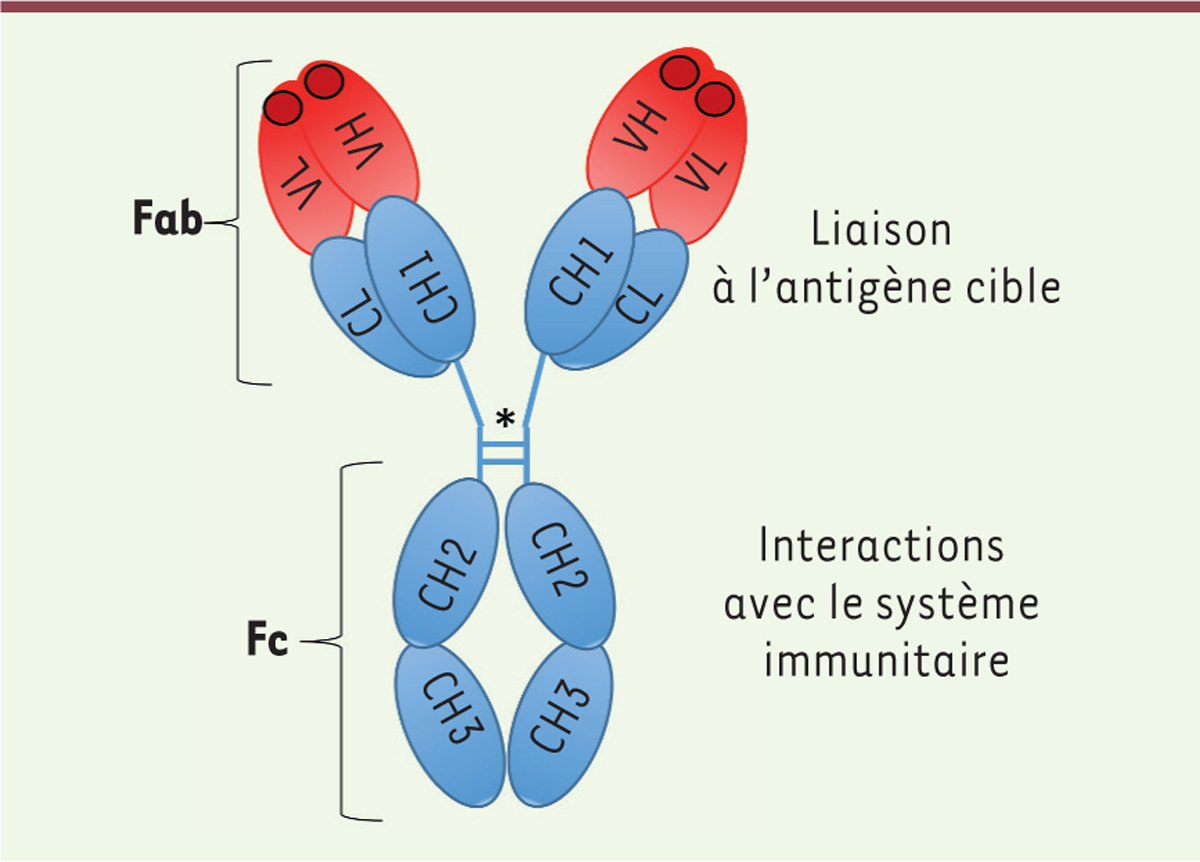
Les anticorps thérapeutiques sont des immunoglobulines (Ig) monoclonales produites par
des cellules en culture et spécifiques d’une cible thérapeutique. Ils ont ainsi 2
propriétés importantes pour leur action pharmacologique (Figure 2) : la liaison très spécifique à l’antigène
cible par leur région Fab (fragment « antigen binding ») et
l’interaction avec le système immunitaire par leur région Fc (fragment cristallisable).
La région Fc leur confère en plus une autre propriété très importante pour leur
pharmacocinétique, la liaison au récepteur FcRn (récepteur néonatal de la région Fc des
Ig). Cette liaison est en grande partie responsable de la distribution des AcM
thérapeutiques, mais également de celle des Ig endogènes et de l’albumine. Elle confère
aux AcM une demi-vie très prolongée, entre 4 et 31 jours (la médiane étant de 16,5
jours), ce qui permet leur administration à des intervalles de temps de 1, 2, 4, ou 8
semaines, voire au-delà.
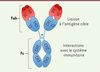 | Figure 2. Structure générale d’un anticorps monoclonal
thérapeutique. Domaines variables (V) et constants
(C) ; chaîne légère L (light) et lourde H
(heavy) ; région de liaison à l’antigène, Fab
(fragment antigen-binding) incluant les CDR
(Complementarity Determining Region) ; et fragment
cristallisable Fc, reliés par une région charnière (*). |
|
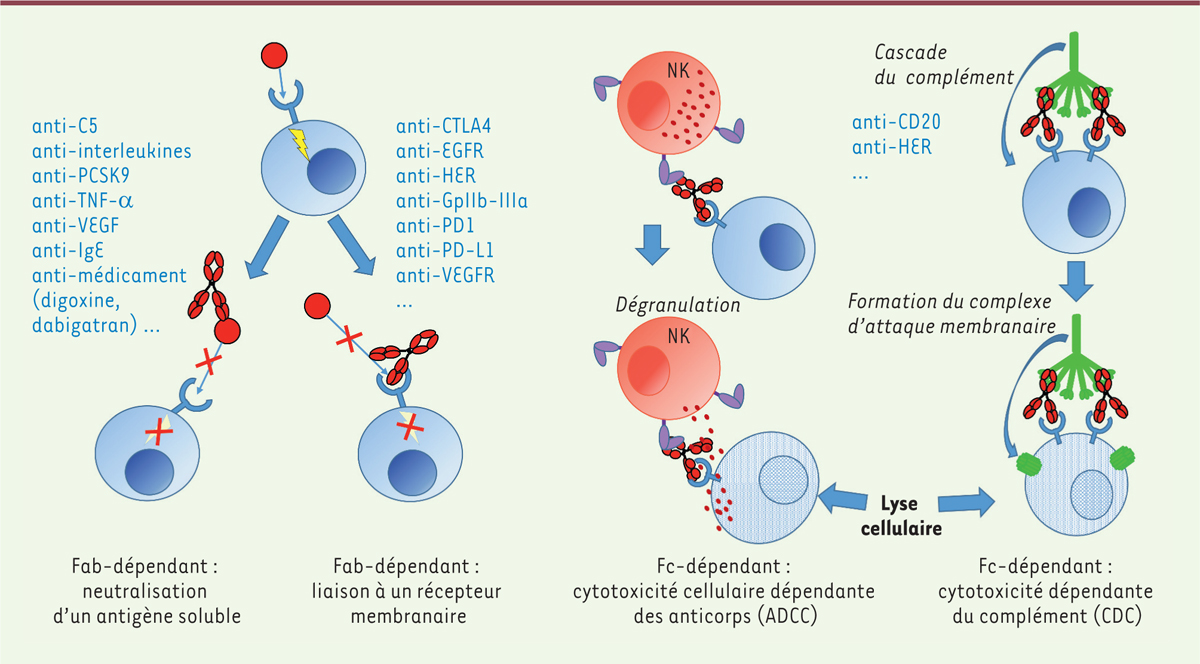
Le mécanisme d’action des AcM est double: un mécanisme dépendant de la région Fab et
un mécanisme dépendant de la région Fc (Figure
3) [1]. Les antigènes cibles sont nombreux, et l’on peut regrouper les AcM en
fonction de ceux-ci selon leur nature, ligands circulants (cytokines, protéines, Ig,
médicaments, etc.), ou récepteurs ou protéines membranaires.
 | Figure 3.
Mécanismes d’action (très schématique) des anticorps
monoclonaux à usage thérapeutique.
|
La liaison de la région Fab à sa cible, qu’elle soit circulante ou membranaire,
permet généralement l’antagonisme pharmacologique de l’action de cette dernière. Par
exemple, la liaison du bévacizumab au VEGF (vascular endothelial growth
factor) libre, le VEGF-A, bloque sa liaison à ses récepteurs tyrosine
kinase, VEGFR1 et VEGFR2, et empêche la cascade de transduction intracellulaire qui
en résulte. De même, la liaison du ramucirumab au VEGFR2 empêche la liaison du VEGF
et donc ses effets cellulaires. Ces deux anticorps exerceront donc une action
antagoniste de la voie du VEGF, inhibant ainsi la prolifération, la migration et la
différenciation des cellules endothéliales, et donc l’angiogenèse. Il est beaucoup
plus rare que la liaison de l’anticorps à sa cible ait comme conséquence une
activation cellulaire (action agoniste d’un récepteur par exemple). Ce fut le cas du
TGN1412, un anticorps anti-CD28 agoniste conduisant à l’activation des lymphocytes T
sans nécessité de liaison de l’antigène au TcR (T cell receptor)
[2]. Son développement
fut cependant arrêté précocement du fait d’effets indésirables très graves lors d’un
essai de phase I sur des volontaires sains. La liaison de l’AcM à son antigène, via sa région Fab, est
nécessaire, mais non suffisante pour induire une action thérapeutique. Une action
cytotoxique est en effet obtenue via sa région Fc, dont le rôle est d’activer la
voie classique du complément (liaison au C1q), conduisant à une cytotoxicité
dépendante du complément (CDC) et de recruter et d’activer des cellules du système
immunitaire, les cellules NK (natural killer), les monocytes et les
neutrophiles, qui expriment des récepteurs pour la région Fc des IgG, les RFcg,
activateurs, induisant ainsi une cytotoxicité cellulaire dépendante des anticorps
(ADCC) (Figure 3). Un AcM peut
en fait avoir une action thérapeutique au travers de plusieurs voies d’action
pharmacologique. Par exemple, le rituximab se lie par sa région Fab à la molécule
CD20 exprimé par une grande partie des lymphocytes B. Il induit des modifications de
leur cycle cellulaire et leur apoptose. Cet AcM se lie également par sa région Fc
aux cellules RFcg+. Cette fixation induit la lyse des lymphocytes B par
ADCC et CDC [3] L’interaction de la région Fc avec le système immunitaire dépend de l’isotype de
l’anticorps. La grande majorité des AcM sont des IgG1 [67 % des 73 AcM qui ont reçu
une autorisation de mise sur le marché (AMM) à la fin de 2018], les autres étant des
IgG2 et/ou IgG4 (22 %), ou des fragments d’AcM (Fab, Fab pégylés, nanobody,
anticorps bispécifique). Le choix de l’isotype pour le futur AcM dépend ainsi de
l’interaction avec le système immunitaire souhaitée, les IgG1 ayant la meilleure
activité cytolytique. |
Effets indésirables liés ( on target) ou non ( off
target) à la cible Comparés aux médicaments classiques, les AcM ont plutôt moins d’effets indésirables
et peu de toxicité limitant la dose dans les essais de phase I ou II. Les effets
indésirables des AcM sont très majoritairement des effets liés à leur mécanisme
d’action, donc à l’action qu’ils ont sur leur cible (on target).
Quand la cible et son rôle sont connus, comme par exemple pour le VEGF, le récepteur
du facteur de croissance épithélial (EGFR), le TNF-α (tumor necrosis factor
alpha) ou pour le composant C5 du complément, les effets indésirables
des AcM peuvent être anticipés dès leur phase de développement (toxicité
prévisible). Cependant, pour beaucoup d’AcM, les conséquences de leur action sur la cible sont
souvent peu connues, principalement en raison de la méconnaissance de la
distribution et du rôle de la cible dans l’organisme (par exemple, pour le
trastuzumab, un AcM anti-HER2/neu et ses effets secondaires myocardiques liés à
l’expression de HER2/neu sur les cardiomyocytes) ou de l’absence de prévisibilité de
la nature ou de l’intensité des effets liés à une interaction complexe avec le
système immunitaire (par exemple avec le natalizumab et le risque de
leucoencéphalopathie multifocale progressive (LEMP), ou avec les anticorps
anti-point de contrôle immunitaire et de leurs effets dysimmunitaires). Il s’agit
donc d’effets indésirables non prévisibles et qui sont inattendus lors de la
commercialisation. La surveillance post-commercialisation des AcM aura ainsi pour objectif de dépister
les effets indésirables non attendus et d’évaluer leur mécanisme, puis d’estimer
leur incidence et sévérité, d’optimiser leur dépistage et prise en charge de façon à
optimiser la balance bénéfices / risques. Étant donné la multiplicité des AcM et de
leurs cibles, il est en fait difficile de faire une synthèse de tous les effets
indésirables ; c’est la raison pour laquelle nous avons fait le choix dans cette
revue, de présenter certains de ces effets indésirables, groupés par type. Réactions liées à la perfusion Les réactions liées à la perfusion des AcM sont fréquentes. Elles apparaissent le
plus souvent dans les 30 minutes à 2h après le début de la perfusion de
l’anticorps et surviennent généralement lors des premières injections. Elles
peuvent être plus rarement tardives, jusqu’à 24 à 72h après la fin de la
perfusion. Leur fréquence varie selon l’anticorps, les plus fréquentes ayant été
décrites avec le rituximab et l’alemtuzumab (plus de 50 % des cas), le
trastuzumab et le blinatumomab (dans environ 40 % des cas), et le cétuximab
(moins de 20 %) [ 4]. Même
si ces réactions à la perfusion sont le plus souvent légères, elles peuvent
parfois présenter des symptômes évocateurs de réactions d’hypersensibilité:
bronchospasme, urticaire, hypotension [ 5]. Les mécanismes sous-jacents à ces réactions restent
encore largement inconnus. Les réactions de relargage de cytokines sont un des
mécanismes supposés. Elles seraient liées à l’interaction entre l’AcM avec sa
cible antigénique exprimée sur des cellules sanguines circulantes, des cellules
tumorales ou des cellules effectrices du système immunitaire recrutées au site
tumoral. C’est, par exemple, le cas des premières perfusions de rituximab pour
lesquelles les réactions ont été corrélées à l’activation du complément et au
nombre de lymphocytes B circulants [ 3], et
à un pic de cytokines (TNF-α et IL[interleukine]-6) observé après 90 minutes de
perfusion, associé aux symptômes habituellement décrits avec un relargage de
cytokines: fièvre, frissons, nausées, vomissements, hypotension et dyspnée
[ 5]. Ce fut aussi le cas, de façon
bien plus massive, chez 6 volontaires sains ayant reçu, dans un essai de phase
I, le TGN1412, un anti-CD28 « super-agoniste » de ce récepteur stimulant les
lymphocytes T: tous les volontaires ont développé une défaillance multi- organes
[ 6]. Ces réactions
cytokiniques sont à distinguer des syndromes de lyse tumorale (hyperuricémie,
hyperkaliémie, hyperphosphatémie, insuffisance rénale, arythmies, convulsions),
qui peuvent être fatals. Ils ont été décrits par exemple avec le rituximab dans
certains lymphomes ou leucémies lymphoïdes chroniques. Cette lyse résulte de
l’action pharmacologique attendue du médicament [ 7]. Des réactions anaphylactiques dépendant des IgE, ou anaphylactoïde, n’impliquant
pas les IgE, sont d’autres mécanismes de ces réactions survenant lors des
perfusions. Le cas du cétuximab est un cas particulier puisque des réactions
anaphylactiques ont été observées dès la première perfusion, certaines ayant
conduit au décès du patient. Ces réactions sont liées à la présence d’IgE
dirigées contre le cétuximab avant le traitement. Ces IgE anti-cétuximab sont en
fait spécifiques d’un oligosaccharide, le galactose alpha-1,3 galactose, présent
sur la partie Fab de la chaîne lourde du cétuximab [8]. Cet oligosaccharide est produit par les
cellules de mammifères non primates par une enzyme (la
α1,3-galactosyltransférase), absente chez l’homme [4]. Une immunisation contre ce sucre peut ainsi survenir
chez l’homme, à la suite de la consommation de viande (patients allergiques à la
viande) ou de piqûres de tiques par exemple, qui transmettent ce glycane
immunogénique chez l’homme. La distinction entre réactions cytokiniques et réactions dépendant des IgE est
importante, car, si la réinjection (le rechallenge, terme consacré en
pharmacovigilance) de l’anticorps est possible dans le cas des premières, elle
est contre-indiquée dans le cas des secondes. Dans une étude récente, les
réactions d’hypersensibilité apparues à la suite de l’injection de 16 AcM
(principalement le rituximab, l’infliximab, le tocilizumab, le brentuximab, et
le trastuzumab) ont été examinées chez 104 patients pour lesquels une
désensibilisation avait été proposée, suite à une première réaction allergique
[9]: la majorité (63
%) des tableaux cliniques de ces réactions étaient de type I (allergie immédiate
et anaphylaxie), suivies de réactions de relargage cytokinique (13 %) ou mixte
(type I/relargage). Ces réactions (cytokiniques ou allergiques) peuvent aussi survenir lors de
l’administration sous-cutanée (SC) des AcM, dans les 24 heures ou plus
retardées. Cependant, l’administration SC est le plus souvent associée à des
réactions cutanées (érythème, prurit, éruption) ou locales (douleur, rougeur,
gonflement) peu sévères et transitoires. Risque infectieux Plus de la moitié des AcM actuellement sur le marché ciblent un antigène qui est
exprimé par les cellules du système immunitaire ou hématologique, et la très
grande majorité d’entre eux contiennent une région Fc d’IgG1 qui interagit avec
les RFcg exprimés par un grand nombre de cellules du système immunitaire,
notamment les cellules myéloïdes. De plus, un nombre non négligeable de ces AcM
ciblent des antigènes membranaires exprimés par ces cellules, conduisant à leur
destruction (par exemple l’alemtuzumab qui détruit des lymphocytes T et B) ou
leur modulation. Il est donc attendu que ces interactions
immuno-pharmacologiques soient susceptibles de perturber la fonction de ces
cellules, en particulier, leur activité de défense contre les pathogènes:
perturbation de leurs fonctions effectrices, déplétion des lymphocytes B ou T,
ou inhibition de la production de cytokines [ 10]. Ainsi, un risque infectieux est très
souvent décrit dans les essais cliniques évaluant un AcM. Il constitue l’une des
principales raisons de l’établissement de mesures réglementaires pour
l’utilisation des biomédicaments [avertissement encadré dans le RCP (résumé des
caractéristiques du produit) ou « black box warning », 1 lettres aux professionnels de santé] [ 11, 12]. Ce sur-risque est plus précisément
décrit et évalué lorsque la cible antigénique ou la cellule qui l’exprime a un
rôle particulièrement bien documenté dans la défense contre les pathogènes. Le TNF-α jour un rôle majeur dans la formation du granulome inflammatoire dans
les infections à Mycobacterium tuberculosis (ou bacille de
Koch). Ce granulome permet d’isoler la bactérie. L’inhibition du TNF-α conduit
ainsi à un défaut de formation de ces granulomes permettant la dissémination de
la bactérie et/ou à leur régression (réactivation) pouvant favoriser des formes
disséminée et sévères de la maladie [13, 14]. Des infections tuberculeuses ont été observés très rapidement,
dès les premiers essais, dans le développement des anticorps anti-TNF-α, malgré
l’exclusion des patients présentant un antécédent de tuberculose traitée [15], avec une incidence
plus importante que pour d’autres infections opportunistes [16]. Afin de réduire ce risque, des
mesures spécifiques fondées sur des tests de détection évaluant le taux sanguin
d’interféron gamma (IFN-γ) (signe d’une réponse immunitaire contre la bactérie),
ont donc été mises en place pour détecter une tuberculose latente, avant le
traitement des patients par les anticorps anti-TNF-α [17]. Le complément joue également un rôle majeur dans les défenses antibactériennes,
soit directement, pour les bactéries Gram négatives, soit par activation du
système immunitaire et phagocytose pour les autres pathogènes [18]. Les déficits congénitaux, mais
aussi l’inhibition des voies d’activation du complément par l’éculizumab qui
inhibe le composant C5 du complément, sont associés à un risque accru
d’infections à bactéries encapsulées, notamment de méningites à méningocoque
[19]. Le risque
d’infections à méningocoque a été estimé chez les patients traités à 1,5 % (soit
une augmentation de risque de 10 000 fois par rapport à la population générale),
et cela malgré une vaccination préalable recommandée [19]. Le risque de réactivation d’infections virales, notamment par le virus JC (pour «
John Cunningham », le premier patient chez lequel ce virus a été découvert)
responsable de LEMP, a été décrit pour plusieurs AcM: le natalizumab (premiers
cas décrits), l’éfalizumab (retiré du marché) et le rituximab [20]. Le mécanisme décrit pour le
natalizumab et l’éfalizumab, tous deux inhibant des molécules d’adhérence
(respectivement, la sous-unité α4 de VLA-4 [intégrine α4β1, very late
antigen-4]), et la sous-unité α de LFA-1 [ou CD11a/CD18,
lymphocyte function-associated antigen 1]) est principalement
l’inhibition du passage des lymphocytes T au travers de l’endothélium
vasculaire, empêchant ainsi leur action antivirale dans le système nerveux
central [20]. Effets indésirables cardiovasculaires Des effets indésirables cardiovasculaires ont été décrits pour des anticorps
thérapeutiques bloquant la voie du VEGF [ 21], la voie HER2 (ErbB2) [ 22], le TNF-α [ 23] et, plus récemment, pour les anticorps
bloquant les points de contrôle immunitaire [ 24]. Trois anticorps thérapeutiques aujourd’hui commercialisés, conduisent à
l’inhibition de la voie du VEGF, principal facteur de croissance impliquée dans
la néo-angiogenèse pathologique: le bévacizumab et ses biosimilaires, qui
ciblent le VEGF-A circulant, utilisés en cancérologie ; le ranibizumab,
également spécifique du VEGF-A, utilisé dans des pathologies rétiniennes (en
injections intravitréennes), et le ramucirumab ciblant le VEGFR-2, un récepteur
tyrosine kinase de type 2 du VEGF-A utilisé en cancérologie. Le VEGF a un rôle
fondamental dans le maintien de la fonction et la trophicité des vaisseaux
sanguins et du myocarde, dans la régulation de la pression artérielle, mais
aussi dans d’autres organes, comme le rein, le foie, le tube digestif ou la
thyroïde [25, 26]. Le blocage de la
voie du VEGF peut ainsi être à l’origine d’effets indésirables
cardiovasculaires, mais également rénaux, thyroïdiens ou touchant le tube
digestif. Les principaux effets indésirables cardiovasculaires observés avec les
AcM anti-VEGF sont une élévation de la pression artérielle, allant jusqu’à une
hypertension artérielle de sévérité variable, des accidents ischémiques
artériels (infarctus du myocarde, accident cérébro-vasculaires), des accidents
hémorragiques, une dysfonction ventriculaire gauche pouvant aller jusqu’à une
insuffisance cardiaque, des accidents thromboemboliques veineux. D’autres effets
indésirables ont également été décrits, comme une protéinurie ou un défaut de
cicatrisation. La voie HER2 (ErbB2), pour laquelle la surexpression et l’amplification de
HER2/neu est associée à un mauvais pronostic de certains cancers, comme le
cancer du sein ou le cancer gastrique, est inhibée par le trastuzumab, qui cible
le domaine IV de la région extra-membranaire du récepteur. Lors de son
développement clinique, la cardiotoxicité du trastuzumab (dysfonction
contractile ventriculaire gauche, symptomatique ou non, généralement réversible)
n’a pas été anticipée [27]. Ce n’est en fait que secondairement que le mécanisme de cette
cardiotoxicité a pu être expliqué avec la découverte de la présence du récepteur
HER2 sur les cardiomyocytes et de son rôle trophique [28]. Le pertuzumab est un autre anticorps
qui cible HER2/neu au niveau de son domaine II transmembranaire, empêchant ainsi
sa dimérisation nécessaire pour l’activation des tyrosines kinases de la cascade
intracellulaire [29].
Son utilisation, en association avec le trastuzumab, n’a cependant pas montré
d’augmentation supplémentaire du risque de cardiopathie [27]. Le rôle délétère du TNF-α à forte concentration sur la fonction ventriculaire
gauche dans l’insuffisance cardiaque avait été suggéré dans plusieurs études
précliniques et chez l’homme [23].
Plusieurs essais cliniques, conduits chez des patients ayant une insuffisance
cardiaque à fraction d’éjection gauche altérée, ont permis d’évaluer,
comparativement à celui d’un placebo, l’effet d’un anticorps anti-TNF-α,
l’infliximab, sur cette altération cardiaque. L’étude ATTACH, utilisant deux
doses de l’anticorps, n’a pas montré de bénéfice clinique dans l’insuffisance
cardiaque. Elle a même révélé un effet délétère sur la mortalité et les
hospitalisations pour insuffisance cardiaque dans le groupe ayant reçu la plus
forte dose de l’AcM (10 mg/kg). Cette observation a conduit à contre-indiquer
les anticorps anti-TNF-α chez les patients ayant une insuffisance cardiaque à
fraction d’éjection altérée, correspondant au stade III/IV dans la
classification de la New York heart association (NYHA). Autres effets indésirables Une toxicité cutanée, le plus souvent de type éruption acnéiforme du visage et de
la partie supérieure du tronc, a été observée chez plus de 80 % des patients
traités par le cétuximab ou le panitumumab [ 12]. Ces deux AcM ciblent l’EGFR ou HER1/ERBb1) exprimé par les
cellules épithéliales (kératinocytes, glandes sébacées et sudoripares,
épithélium folliculaire) mais également par plusieurs tumeurs solides, dont le
cancer colorectal et les cancers du poumon, de la tête, et du cou, pour lesquels
son expression est corrélée à la progression tumorale et à un mauvais pronostic
[ 30]. Avec l’abciximab, anticorps chimérique reconnaissant la glycoprotéine IIb/IIIa
plaquettaire, bloquant la fixation du fibrinogène, du facteur Willebrand et
d’autres molécules d’adhérence aux plaquettes activées, une thrombocytopénie
aiguë a été décrite [12]. Elle survient
chez 1 % des patients traités, dans les heures suivant le début de la première
perfusion, probablement en raison de la présence d’anticorps préexistants
dirigés contre des épitopes murins exposés par l’anticorps. La fréquence de
cette thrombocytopénie est plus élevée après la deuxième perfusion (touchant
environ 10 % des patients), et peut survenir de façon retardée, jusqu’à une
semaine après cette perfusion. Elle semble être liée au développement de
nouveaux anticorps dirigés également contre des épitopes murins de la région Fab
de l’anticorps (anticorps anti-anticorps) [31]. Une thrombocytopénie, dont le
mécanisme pourrait être similaire, a été également décrite avec d’autres AcM
(infliximab, rituximab, éfalizumab) [31]. En interagissant avec le système immunitaire, les AcM pourraient être en cause
dans l’apparition d’un certain nombre d’effets indésirables auto-immuns. Par
exemple, le traitement par des anticorps anti-TNF-a a été associé à l’apparition
d’autoanticorps anti-nucléaires et anti-ADN, et, dans de très rares cas, à des
manifestations cliniques auto-immunes de type lupus [32]. D’autres manifestations auto-immunes,
de type psoriasis ou de type maladies démyélinisantes, ont également été
décrites [33], mais
elles sont à considérer avec précaution, la pathologie sous-jacente pouvant
également être un facteur de risque de manifestations auto-immunes [34]. Le risque de cancer associés à l’utilisation des anticorps anti-TNF-a reste
controversé. Dans une méta-analyse [35], un sur-risque de cancer a été retrouvé, mais plusieurs
autres publications, y compris des études de vraie vie [36], n’ont pas révélé d’augmentation du
risque de cancers solides, ni de lymphomes. Des incertitudes persistent pour le
risque de mélanome ou d’autres cancers de la peau [37]. Relation entre effets indésirables dépendants de la cible et efficacité des
AcM Une relation entre la survenue d’effets indésirables liés au mécanisme d’action
des AcM et leur efficacité thérapeutique, en termes de réponse clinique, a été
décrite pour les anticorps anti-EGFR [ 38] et anti-VEGF [ 39]. Les résultats de ces revues systématiques de la
littérature restent cependant discordants, les patients présentant l’effet
indésirable ayant une survie (sans progression ou globale) meilleure que les
patients n’ayant pas présenté d’effet indésirable. D’autres études n’ont pas
retrouvé ces résultats. Effets indésirables non liés au mécanisme d’action des AcM Aujourd’hui, peu d’effets indésirables ne sont pas liés au mécanisme d’action des
AcM. Les réactions anaphylactiques observées avec le cétuximab qui sont liées à
la pré-existence d’IgE dirigées contre le galactose-alpha-1,3-galactose présent
sur l’anticorps et immunogénique chez l’homme, en sont un exemple. On peut aussi
citer les réactions dûes à une immunisation contre les AcM utilisés pour les
traitements, qui consistent en l’apparition d’anticorps anti-anticorps
monoclonal ( anti-drug antibody) qui conduisent, d’une part, à
une perte d’efficacité de l’AcM, et, d’autre part, à des effets indésirables
potentiels (réactions à la perfusion intraveineuse et réactions cutanées après
injection par voie sous-cutanée). |
Les AcM sont des Ig monoclonales thérapeutiques agissant par liaison très spécifique
à leur antigène cible et pouvant interagir avec le système immunitaire. Leurs effets
indésirables sont très majoritairement liés à leur mécanisme d’action. Ce sont
principalement des réactions à la perfusion, souvent peu sévères, et un risque
infectieux. La surveillance post-commercialisation est fondamentale pour le
dépistage des effets indésirables et l’amélioration des connaissances sur leur
mécanisme. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Nous remercions le Dr Christophe Passot dont les figures ont inspiré celles
utilisées pour illustrer la structure et les mécanismes d’action des anticorps
monoclonaux.
|
Footnotes |
1. Congy-Jolivet
N,
Probst
A,
Watier
H,
Thibault
G. Recombinant
therapeutic monoclonal antibodies: mechanisms of action in relation to
structural and functional duality . Crit Rev
Oncol Hematol.
2007; ; 64:
:226.–233. 3. Cartron
G,
Watier
H,
Solal-Celigny
P. From the bench to
the bedside: ways to improve rituximab efficacy .
Blood.
2004; ; 104:
:2635.–2642. 4. Daguet
A,
Watier
H, 2nd,
Richet
Charles,
Héricourt
Jules. workshop:
therapeutic antibodies and anaphylaxis. May 31-June
1, 2011, Tours; ,
France: .
MAbs. ; 2011;:
3
:417.–421. 5. Chung
CH. Managing
premedications and the risk for reactions to infusional monoclonal antibody
therapy . Oncologist.
2008; ; 13:
:725.–732. 6. Suntharalingam
G,
Perry
MR,
Ward
S, et al.
Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal
antibody TGN1412 . N Engl J
Med.
2006; ; 355:
:1018.–1028. 7. Cairo
MS,
Coiffier
B,
Reiter
A,
Younes
A. TLS expert panel.
Recommendations for the evaluation of risk and prophylaxis of tumour lysis
syndrome (TLS) in adults and children with malignant diseases: an expert TLS
panel consensus . Br J
Haematol.
2010;; 149:
:578.–86. 8. Chung
CH,
Mirakhur
B,
Chan
E, et al.
Cetuximab-induced anaphylaxis and IgE specific for
galactose-alpha-1,3-galactose . N Engl J
Med.
2008; ; 358:
:1109.–1117. 9. Isabwe
GAC, Garcia
Neuer
M
de Las Vecillas Sanchez
L, et al.
Hypersensitivity reactions to therapeutic monoclonal antibodies:
Phenotypes and endotypes . J Allergy Clin
Immunol.
2018; ; 142:
:159.–170.e2. 10. Uettwiller
F,
Rigal
E,
Hoarau
C. Infections
associated with monoclonal antibody and fusion protein therapy in
humans . mAbs.
2011;; 3:
:461.–6. 11. Giezen
TJ,
Mantel-Teeuwisse
AK,
Straus
SM, et al.
Safety-related regulatory actions for biologicals approved in the
United States and the European Union .
JAMA.
2008; ; 300:
:1887.–1896. 12. Hansel
TT,
Kropshofer
H,
Singer
T, et al.
The safety and side effects of monoclonal
antibodies . Nat Rev Drug
Discov.
2010; ; 9:
:325.–338. 13. Kindler
V,
Sappino
AP,
Grau
GE, et al.
The inducible role of tumor necrosis factor in the development of
bactericidal granulomas during BCG infection .
Cell.
1989; ; 56:
:731.–740. 14. Flynn
JL,
Goldstein
MM,
Chan
J, et al.
Tumor necrosis factor-alpha is required in the protective immune
response against Mycobacterium tuberculosis in mice .
Immunity.
1995; ; 2:
:561.–572. 15. Maini
R, St
Clair
EW,
Breedveld
F, et al.
Infliximab (chimeric anti-tumour necrosis factor alpha monoclonal
antibody) versus placebo in rheumatoid arthritis patients receiving
concomitant methotrexate: a randomised phase III trial .
ATTRACT study group. Lancet.
1999; ; 354:
:1932.–1939. 16. Keane
J,
Gershon
S,
Wise
RP, et al.
Tuberculosis associated with infliximab, a tumor necrosis factor
alpha-neutralizing agent . N Engl J
Med.
2001; ; 345:
:1098.–1104. 18. Heesterbeek
DAC,
Angelier
ML,
Harrison
RA,
Rooijakkers
SHM. Complement and
bacterial infections: from molecular mechanisms to therapeutic
applications . J Innate
Immun.
2018; ; 10:
:455.–464. 19. Winthrop
KL,
Mariette
X,
Silva
JT, et al.
ESCMID study group for infections in compromised hosts (ESGICH)
consensus document on the safety of targeted and biological therapies: an
infectious diseases perspective (soluble immune effector molecules [II]:
agents targeting interleukins, immunoglobulins and complement
factors) . Clin Microbiol
Infect.
2018; ; 24: Suppl (2)
:S21.–S40. 20. Carson
KR,
Focosi
D,
Major
EO, et al.
Monoclonal antibody-associated progressive multifocal
leucoencephalopathy in patients treated with rituximab, natalizumab, and
efalizumab: a review from the research on adverse drug events and reports
(RADAR) project . Lancet
Oncol.
2009; ; 10:
:816.–824. 21. Bloom
MW,
Hamo
CE,
Cardinale
D, et al.
Cancer therapy-related cardiac dysfunction and heart failure:
Part 1: definitions, pathophysiology, risk factors, and
imaging . Circ Heart Fail.
2016; ; 9: :e002661.. 22. De
Keulenaer
GW,
Doggen
K,
Lemmens
K. The vulnerability
of the heart as a pluricellular paracrine organ: lessons from unexpected
triggers of heart failure in targeted ErbB2 anticancer
therapy . Circ Res.
2010; ; 106:
:35.–46. 23. Khanna
D,
McMahon
M,
Furst
DE. Anti-tumor
necrosis factor alpha therapy and heart failure: what have we learned and
where do we go from here? . Arthritis
Rheum.
2004; ; 50:
:1040.–1050. 24. Johnson
DB,
Balko
JM,
Compton
ML, et al.
Fulminant myocarditis with combination immune checkpoint
blockade . N Engl J Med.
2016; ; 375:
:1749.–1755. 25. Kamba
T,
McDonald
DM. Mechanisms of
adverse effects of anti-VEGF therapy for cancer .
Br J Cancer.
2007; ; 96:
:1788.–1795. 26. Chen
HX,
Cleck
JN. Adverse effects
of anticancer agents that target the VEGF pathway .
Nat Rev Clin Oncol.
2009; ; 6:
:465.–477. 27. Ewer
MS,
Ewer
SM. Cardiotoxicity
of anticancer drugs . Nat Rev
Cardiol.
2015; ; 12:
:547.–558. 28. Crone
SA,
Zhao
YY,
Fan
L, et al.
ErbB2 is essential in the prevention of dilated
cardiomyopathy . Nat Med.
2002; ; 8:
:459.–465. 29. Parakh
S,
Gan
HK,
Parslow
AC, et al.
Evolution of anti-HER2 therapies for cancer
treatment . Cancer Treat
Rev.
2017; ; 59:
:1.–21. 30. Macdonald
JB,
Macdonald
B,
Golitz
LE, et al.
Cutaneous adverse effects of targeted therapies: Part I:
inhibitors of the cellular membrane . J Am
Acad Dermatol.
2015; ; 72:
:203.–218. 31. Aster
RH,
Bougie
DW. Drug-induced
immune thrombocytopenia . N Engl J
Med.
2007; ; 357:
:580.–587. 32. Shovman
O,
Tamar
S,
Amital
H, et al.
Diverse patterns of anti-TNF-α-induced lupus: case series and
review of the literature . Clin
Rheumatol.
2018; ; 37:
:563.–568. 33. Pérez-De-Lis
M,
Retamozo
S,
Flores-Chávez
A, et al.
Autoimmune diseases induced by biological agents. A review of
12,731 cases (BIOGEAS Registry) . Expert Opin
Drug Saf.
2017; ; 16:
:1255.–1271. 34. Bar
Yehuda
S,
Axlerod
R,
Toker
O, et al.
The association of inflammatory bowel diseases with autoimmune
disorders: a population-based report from the epi-IIRN .
J Crohns Colitis.
2019;; 13:
:324.–9. 35. Bongartz
T,
Sutton
AJ,
Sweeting
MJ, et al.
Anti-TNF antibody therapy in rheumatoid arthritis and the risk of
serious infections and malignancies: systematic review and meta-analysis of
rare harmful effects in randomized controlled trials .
JAMA.
2006; ; 295:
:2275.–2285. 36. de La Forest
Divonne, M,
Gottenberg
JE,
Salliot
C. Safety of
biologic DMARDs in RA patients in real life: a systematic literature review
and meta-analyses of biologic registers .
Joint Bone Spine.
2017; ; 84:
:133.–140. 37. Ramiro
S,
Gaujoux-Viala
C,
Nam
JL, et al.
Safety of synthetic and biological DMARDs: a systematic
literature review informing the 2013 update of the EULAR recommendations for
management of rheumatoid arthritis . Ann
Rheum Dis.
2014; ; 73:
:529.–535. 38. Abdel-Rahman
O,
Fouad
M. Correlation of
cetuximab-induced skin rash and outcomes of solid tumor patients treated
with cetuximab: a systematic review and meta-analysis .
Crit Rev Oncol Hematol.
2015; ; 93:
:127.–135. 39. Zhang
CJ,
Zhang
SY,
Zhang
CD, et al.
Usefulness of bevacizumab-induced hypertension in patients with
metastatic colorectal cancer: an updated meta-analysis .
Aging (Albany NY).
2018; ; 10:
:1424.–1441. |