| |
| Med Sci (Paris). 35(12): 1130–1136. doi: 10.1051/medsci/2019210.Variabilité pharmacocinétique des anticorps
thérapeutiques David Ternant1* and Stéphanie Chhun2 1EA 7501 GICC, Université de Tours,
Tours,
France; Service de
pharmacologie médicale, CHU de Tours, Tours,
France 2Hôpital Necker-Enfants Malades, Inserm U1151, INEM,
Laboratoire d’immunologie biologique, Assistance Publique-Hôpitaux de
Paris, Paris, France |
Depuis près de trois décennies, un nombre sans cesse croissant d’anticorps monoclonaux
(AcM) thérapeutiques est disponible. Ils ont permis de révolutionner le traitement de
pathologies de plus en plus variées, incluant les cancers et les maladies
inflammatoires, mais aussi des maladies dans le domaine de l’hématologie, l’allergologie
et des dyslipidémies. Les anticorps thérapeutiques sont des immunoglobulines d’isotype G (IgG), protéines de
masse moléculaire importante (environ 150 kDa), qui associent deux régions Fab (fragment
antigen-binding) et une région Fc (fragment cristallisable). La
région Fab contient trois régions hypervariables responsables de la fixation à la cible
antigénique avec de grandes affinité et spécificité. La région Fc est impliquée dans le
recrutement des effecteurs du système immunitaire, dont les effecteurs cellulaires
exprimant les récepteurs de la région Fc (RFcg), et la molécule C1q de la voie classique
du complément. La région Fc permet également la fixation des IgG également au FcRn
(neonatal Fc receptor), un récepteur impliqué dans leur
demi-vie. Si beaucoup d’anticorps sont administrés par voie intraveineuse (iv), un nombre sans
cesse croissant sont administrés par voie sous-cutanée (sc). Cette dernière permet une
absorption lente de l’anticorps [1-4]. Si cette voie
permet d’augmenter le confort des patients et de diminuer les coûts liés à
l’hospitalisation, elle ne permet pas l’administration de grands volumes. Elle entraîne
aussi un surcroît de risque immunogène et une augmentation de la variabilité
pharmacocinétique (PK) [5]. L’élimination des AcM suit deux voies :
-
une élimination endogène, non-spécifique, qui a lieu dans les lysosomes après
endocytose. Le FcRn permet la protection des IgG de cette dégradation et
leur recyclage vers le pôle vasculaire des cellules endothéliales, ce qui
confère aux IgG une longue demi-vie d’élimination (T½ d’environ 3
semaines).
-
une élimination impliquant la cible, spécifique, qui a lieu du fait de la
fixation de forte affinité des AcM sur leurs cibles antigéniques. La
probabilité de dissociation des complexes AcM-cible ainsi formés est très
faible. Ils sont éliminés par internalisation pour certaines cibles
exprimées à la surface cellulaire, par phagocytose (macrophages) pour les
cibles circulantes, ou via d’autres cellules du système
réticulo-endothélial. La cinétique d’élimination des complexes est le plus
souvent plus rapide que celles de l’anticorps et de la cible à l’état libre.
L’élimination des AcM est, dans certaines conditions, dépendante de la masse
antigénique, qui correspond au nombre de cibles antigéniques disponibles
pour être liées à l’anticorps en question.
La grande spécificité de la fixation de l’anticorps à la cible n’empêche pas une grande
variabilité de la réponse thérapeutique. Cette variabilité de la réponse est expliquée,
au moins en partie, par la variabilité PK, qui est large chez l’homme [2-4,6]. Au
1er janvier 2019, 177 publications indexées dans Pubmed ont analysé la PK
des anticorps chez l’homme par modélisation. Parmi elles, 13 % ont impliqué en première
ligne le CHU et l’université de Tours et plus de 75 % datent des 10 dernières années
[7] (→).
(→) Voir la Synthèse de G. Paintaud, m/s n° 12, décembre 2009,
page 1057
Même si l’oncologie reste un enjeu majeur du développement des AcM, elle ne concerne que
38 % des études de pharmacocinétique des anticorps chez l’homme. La variabilité pharmacocinétique a fait l’objet de plusieurs revues, même si aucune
d’elles ne présente les facteurs individuels de variabilité de façon systématique [1-3,6,8-13]. La présente revue propose une analyse systématique et synthétique des
principaux facteurs influençant la variabilité PK interindividuelle des AcM. |
Modélisation de la pharmacocinétique des anticorps chez l’homme – état de
l’art La PK des médicaments (en général) et des AcM (en particulier) peut être décrite de
façon non-compartimentale, notamment lors des essais précoces (phase I) ou à l’aide
de modèles compartimentaux (phases II-IV). La modélisation PK compartimentale permet
l’estimation des paramètres PK (constantes d’absorption, de distribution et
d’élimination, volumes de distribution, clairances, demi-vies) qui décrivent les
différentes étapes de la PK des AcM (absorption, distribution, élimination,
interaction avec la masse antigénique). Ces paramètres sont le plus souvent estimés
par approche de population. Il s’agit d’une approche puissante permettant non
seulement la quantification de la distribution interindividuelle des paramètres PK
dans la population mais, en plus, de tester et de quantifier l’association de ces
paramètres avec certains facteurs individuels de variabilité (covariables) [14,15]. Puisque l’analyse de population fait
l’objet de standards de qualité internationaux, elle permet également des
comparaisons inter-études. La PK des anticorps thérapeutiques est le plus souvent décrite à l’aide de modèles
bicompartimentaux [1-3,6,9] qui en permettent
une description exhaustive [16]. La valeur du volume de distribution central, de 3-4 L, permet de
vérifier cette exhaustivité. La valeur du volume périphérique, de 2-4 L, montre une
distribution faible mais non négligeable dans les tissus. La clairance systémique de
l’anticorps est faible (0,2 à 0,4 L/jour), du fait de son recyclage par le FcRn. La
cinétique de l’absorption des anticorps administrés par voie sc est invariable,
décrite à l’aide d’une constante d’ordre 1, ce qui suppose une vitesse d’absorption
proportionnelle à la quantité d’anticorps présent au niveau du derme (Figure 1).
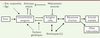
 | Figure 1. A. Modèle compartimental général pour
décrire la pharmcocinétique des anticorps thérapeutiques. L’absorption
des anticorps est décrite par une cinétique d’ordre 1, c’est-à-dire une
vitesse proportionnelle à la quantité d’où part le flux, quantifiée par
la constante d’absorption kA. La distribution vers le
compartiment périphérique est bidirectionnelle, décrite par les
constantes de transfert inter-compartimentales k12 et
k21. L’élimination est décrite à l’aide de la constante
d’élimination k10. Le turnover
(renouvellement) de la cible est décrit à l’aide de constantes de
production (ksyn, ordre 0) et de destruction
(kdeg, ordre 1) endogènes. L’association et la dissociation
de l’anticorps et de la cible sont décrites à l’aide des constantes
respectives d’association (ordre 2) et de dissociation (ordre 1).
L’élimination des complexes est décrite à l’aide de la constante
kint (ordre 1), dont la valeur est le plus souvent
supérieure à k10 et à kdeg.
B. Concentrations d’anticorps au
cours du temps pour des valeurs croissantes de masse antigénique. La
courbe la plus claire indique une absence de masse antigénique. Les
courbes plus foncées correspondent à des masses antigéniques plus
importantes, qui ont pour conséquence une non-linéarité plus
prononcée. |
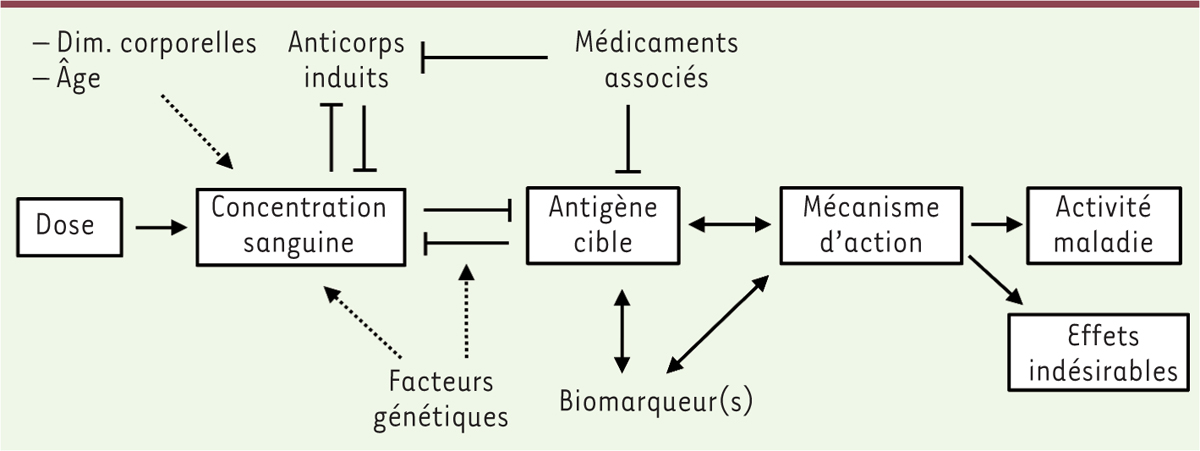
 | Figure 2.
Schéma synthétique représentant la relation
dose-concentration-effet des anticorps thérapeutiques et les
facteurs individuels de variabilité pharmacocinétique.
|
La description des cinétiques conjointes de l’anticorps et de la cible est réalisée à
l’aide de modèles TMDD (target-mediated drug disposition) qui
ajoutent au modèle bicompartimental décrivant la cinétique de l’anticorps libre un
compartiment représentant le turnover de la cible à l’état libre
(son renouvellement considérant sa production et sa destruction endogènes) et un
compartiment représentant l’association et la dissociation du complexe AcM-cible et
la destruction de ce dernier par le système immunitaire (Figure 1) [9,17,18]. La masse antigénique est considérée aujourd’hui comme un facteur de
variabilité majeur dont l’influence sur la PK des AcM nécessite d’être
impérativement décrite de façon précise. L’influence des covariables peut être codée de façons différentes. Pour les
covariables continues (poids, concentration d’albumine, etc.), le codage est le plus
souvent allométrique (loi puissance)1, la
valeur de la covariable étant rapportée à la médiane dans la population. Les
covariables discrètes, notamment binaires, sont en général codées par rapport à une
catégorie de référence (pour le sexe, par exemple, les femmes sont considérées comme
la catégorie de référence). Depuis plus de 15 ans, nous analysons de façon régulière la littérature portant sur
la variabilité pharmacocinétique des anticorps chez l’homme décrite par
modélisation. Parmi les 177 publications ayant modélisé la PK d’anticorps
thérapeutiques chez l’homme, un modèle à 2 compartiments a été utilisé dans 80 % des
publications, l’utilisation d’un modèle à 1 compartiment provenait de données
pauvres ou de l’absence de données PK obtenues après administration iv dans les
études impliquant des AcM administrés par voie sc. L’analyse de la variabilité PK,
qui est un enjeu crucial puisqu’elle influence les facteurs de variabilité PK, a été
recherchée dans 137 publications. |
Facteurs individuels de variabilité pharmacocinétique (covariables) Les facteurs de variabilité dont l’influence a été la plus étudiée sont (par ordre
décroissant) les dimensions corporelles (recherché dans 99 % des 137 publications),
l’âge (88 %), le sexe (85 %), la masse antigénique (69 %), l’origine
ethnique/géographique (48 %), la concentration sérique d’albumine (50 %), les
traitements concomitants (42 %) et l’immunisation (31 %). Parmi ces facteurs, ceux
qui ont été retrouvés comme influençant le plus fréquemment la variabilité PK des
anticorps sont (par ordre décroissant) les dimensions corporelles (influence
significative dans 88 % des études dans lesquelles elle a été testée),
l’immunisation (74 %), la concentration d’albumine (63 %), la masse antigénique (46
%), le sexe (33 %), les traitements concomitants (26 %), l’origine
ethnique/géographique (18 %) et l’âge (15 %). Influence des dimensions corporelles et du sexe Les dimensions corporelles sont le plus souvent mesurées à l’aide du poids
corporel (dans plus de 95 % des publications) et codées de façon allométrique.
Des dimensions corporelles élevées sont associées à un volume de distribution
et/ou une clairance élevé(s) avec un coefficient allométrique de l’ordre de
0,5-0,9. Selon les anticorps, les dimensions corporelles peuvent expliquer de 5
à 20 % de la variabilité PK totale. Cette influence importante a conduit à
ajuster la posologie au poids (ou à la surface corporelle), notamment pour les
anticorps injectés par voie iv, cet ajustement existant de façon marginale pour
les anticorps injectés par voie sc (par exemple l’omalizumab, un anticorps
anti-IgE). La variabilité PK des anticorps injectés par voie sc est donc
susceptible d’être plus importante que celle des anticorps injectés par voie iv,
du fait d’un surplus de variabilité dû à l’absorption et de l’abandon de
l’ajustement de la dose aux dimensions corporelles. Indépendamment du poids, certaines études ont observé que le volume de
distribution et/ou la clairance étaient plus élevées chez les hommes (5-15 %)
que chez les femmes. Cette influence n’a toutefois jamais conduit à un
ajustement posologique par rapport au sexe. Influence de l’immunisation Dès le début des années 2000, l’utilisation des anticorps anti-TNF-a
( tumor necrosis factor alpha) dans les maladies
inflammatoires chroniques a fait l’objet de plusieurs analyses en ce qui
concerne la PK. En effet, les AcM injectés peuvent induire la formation
d’anticorps (ADA pour anti-drug antibodies), dont la présence
est associée à des concentrations d’anticorps thérapeutiques diminuées, parfois
très fortement [ 4, 19], en raison d’une augmentation de leur
clairance variant d’un facteur 1,5 à 4, et ceci même avec les anticorps «
complètement » humains, comme l’adalimumab [ 4, 20]. La
présence d’ADA serait ainsi la principale cause de perte de réponse aux
traitements par les anticorps anti-TNF-a. À noter que l’utilisation de
traitement immunosuppresseurs, dont le méthotrexate, a permis de diminuer le
risque de développer des ADA chez les patients atteints de polyarthrite
rhumatoïde et traités par des AcM anti-TNF-a [ 21]. Toujours dans la polyarthrite
rhumatoïde, le traitement par le rituximab peut également induire le
développement d’ADA, sans toutefois altérer la réponse clinique [ 22]. Ces anticorps sont
rarement recherchés en cancérologie. Cependant, leur présence est associée à une
clairance augmentée, dans 4/9 des publications concernant cette question, et
peut altérer la réponse clinique, comme pour l’ipilimumab (anti-CTLA-4
[ cytotoxic T-lymphocyte-associated protein 4]) [ 23]. Il est donc
indispensable que la recherche de l’influence des ADA sur la PK et la relation
concentration-effet des anticorps soit systématiquement recherchée lors du
développement des molécules. Influence de la concentration d’albumine sérique La concentration pré-thérapeutique d’albumine dans le sérum est le plus souvent
retrouvée inversement corrélée à la clairance des anticorps lorsqu’elle est
testée (avec un coefficient allométrique de l’ordre de – 0,9). La grande
majorité des études interprètent ce résultat de la façon suivante: puisque
l’albumine et les IgG sont toutes deux recylées par le FcRn dans le sérum de
façon vraisemblablement non-compétitive [ 24], le lien entre forte concentration d’albumine et faible
clairance des anticorps pourrait être dû à une activité du FcRn élevée.
Certaines études admettent toutefois que cette explication est approximative,
évoquant notamment les liens étroits entre inflammation, concentration
d’albumine, expression du FcRn, et même masse antigénique [ 25]. Même s’il n’existe pas de lien
causal direct entre concentration d’albumine et PK des anticorps, elle est
néanmoins considérée comme un « marqueur » de leur élimination endogène. Influence de la masse antigénique Comme nous l’avons évoqué, la forte affinité de la liaison entre l’anticorps et
sa cible entraîne une très faible probabilité de dissociation des complexes
AcM-cible. Leur élimination est donc le plus souvent plus rapide que leur
dissociation. Ainsi, une quantité de cibles élevée est associée à des
concentrations d’anticorps faibles, ce qui est le plus souvent dû à une
clairance spécifique (reposant sur la cible) d’autant plus élevée que la masse
antigénique est forte. La variabilité au cours du temps de la masse antigénique
confère, dans certains cas, une variation des paramètres PK des anticorps
(notamment de la clairance) et donc une PK non-linéaire, qui sera observée
notamment lorsque l’anticorps sera en défaut stœchiométrique par rapport à la
masse antigénique. Une PK non-linéaire est rapportée dans 38 % des publications
[ 9]. Les modèles TMDD, qui permettent
de décrire les cinétiques conjointes de l’anticorps et de la cible et donc
d’évaluer la clairance dépendant de la cible, nécessitent de mesurer la
concentration d’anticorps, ainsi que les quantités de cibles libres et des
complexes, ce qui est rarement possible. Des modèles simplifiés peuvent être
utilisés pour décrire l’élimination non-linéaire des anticorps: modèles imposant
une fixation anticorps-cible à l’équilibre (hypothèse de
quasi-steady-state, modèle qui néglige la dissociation des
complexes anticorps-cible ( irreversible binding), ou modèle
imposant une masse antigénique totale (libre + liée) constante (modèles à
élimination de Michaelis-Menten) [ 9, 17, 18, 26]. On
notera que la proportion de publications où une PK non-linéaire est rapportée
concerne deux fois plus souvent la cancérologie (48 % des publications) que les
autres pathologies (23 %). Toutefois, une PK apparemment linéaire indique un excès stœchiométrique de
l’anticorps et donc une saturation de l’élimination spécifique, et non une
absence d’influence de la masse antigénique. En effet, la masse antigénique est
décrite comme influençant significativement la PK dans 43 % des études dans
lesquelles la PK était apparemment linéaire. La masse antigénique peut être
mesurée de façon très spécifique (quantité/concentration de la cible),
moyennement spécifique (biomarqueur corrélé à la masse antigénique) ou peu
spécifique (activité de la maladie). À titre d’exemple, la corrélation positive
entre la concentration sérique de CRP (C-reactive protein), une
protéine produite au cours des inflammations, et la clairance des anticorps
anti-TNF-a est probablement due au fait que les concentrations de CRP et de
TNF-a sont liées [3], l’influence de la
CRP étant un reflet de l’élimination spécifique de ces AcM. Dans la majorité des
cas, la masse antigénique a été testée en tant que covariable sur les paramètres
PK et une corrélation positive entre masse antigénique et clairance de
l’anticorps a été observée. Dans de rares cas, une masse antigénique élevée
semble associée à une augmentation de la demi-vie terminale, comme pour le
rituximab dans les lymphomes de haut grade [27], l’anticorps étant alors d’autant plus
« séquestré » que la masse antigénique est importante. Cette situation
s’observerait dans les cas où l’élimination des complexes est lente [9]. Influence des traitements concomitants Puisque ni l’absorption ni l’élimination des anticorps ne font intervenir de
transporteurs ni de (co)enzymes de métabolisme, il est courant de penser que les
AcM ne peuvent faire l’objet d’interactions médicamenteuses [ 28]. Toutefois, il a été rapporté
que la co-administration de méthotrexate était associée à une diminution de la
clairance de l’infliximab et de l’adalimumab (deux anticorps anti-TNF-a). Le
méthotrexate pourrait en fait participer à la réduction des concentrations
sériques de TNF-a, et donc diminuer l’élimination spécifique et la clairance
totale des anticorps spécifiques. De même, cinq publications sur les six portant
sur la pharmacocinétique des AcM anti-PCSK9 (proprotéine convertase
subtilisine/kexine de type 9) ont montré une influence des statines sur leur
élimination, avec une clairance endogène [ 29] ou une élimination spécifique [ 30] des anticorps,
augmentées en leur présence. En effet, l’utilisation des statines semble
augmenter la sécrétion de la PCSK9 [ 28],
ce qui provoque l’augmentation de la formation de complexes AcM-PCSK9, et donc
l’élimination accrue de l’anticorps [ 31]. Influence de l’âge L’influence de l’âge sur la PK des anticorps reste peu claire. Chez les adultes,
l’augmentation de la clairance avec l’âge est la plus fréquemment rapportée.
Cependant, la clairance des anticorps semble être supérieure chez les enfants
comparativement à celle des adultes, et ce malgré une augmentation de la
clairance avec le poids corporel. Cela a été montré pour le canakinumab (un
anticorps anti-IL-1β) [ 32]. Les raisons de cette augmentation restent obscures, même si des
différences en termes de perméabilité et de densité capillaires et d’expression
du FcRn ont été évoquées [ 33]. Influence de l’origine ethnique/géographique Dans la mesure où règne une grande hétérogénéité dans la définition même des
critères ethniques (définis sous les termes « race » ou «
ethnicity » dans les publications) ou géographiques, ainsi
que dans leur codage, il est très difficile, voire impossible, de décrire
précisément cette influence. Toutefois, certaines études ont rapporté une
clairance augmentée chez les sujets d’origine sub-saharienne. Les études
rapportant une influence de l’origine ethnique/géographique lui reconnaissent
toutefois une force insuffisante pour être prise en compte ou interprétée. Autres facteurs individuels de variabilité Nous présentons dans cette partie des facteurs individuels de variabilité moins
fréquemment testés et/ou détectés comme influençant la PK des anticorps. Ils ne
sont exposés ici que dans un but scientifique. Ils sont en effet trop
inconstamment détectés et/ou présentent un effet trop faible pour être pris en
compte en recherche clinique. Fonctions rénale et hépatique Dans les protocoles de recherche clinique, notamment industriels, il est
souvent recherché une influence de la fonction rénale (créatininémie,
clairance de la créatinine) et de la fonction hépatique (activité
enzymatique des amino-transférases, gamma glutamyl transférases) sur la PK
des anticorps, même si une telle influence n’est théoriquement pas possible.
Cependant, une fonction rénale augmentée (clairance de la créatinine élevée)
et/ou une fonction hépatique diminuée (enzymes augmentées) sont associées à
une clairance des AcM accrue dans environ 20 % des publications dans
lesquelles ces associations ont été examinées. Difficiles à interpréter, ces
associations sont souvent considérées comme liées à d’autres variables qui
n’ont pas été analysées. Influence des IgG endogènes Même si elles sont rarement testées, les concentrations d’IgG endogènes sont
plus d’une fois sur deux corrélées positivement à la clairance des AcM. Une
interprétation possible est que des concentrations élevées d’IgG, en plus
des AcM administrés, sont susceptibles d’entraîner une saturation du FcRn,
provoquant une diminution de la proportion d’IgG recyclée et donc une
augmentation de leur clairance, dont celle de l’anticorps thérapeutique. Schématiquement, les chaînes lourdes des IgG1 (les plus nombreuses)
présentent deux allotypes qui confèrent aux immunoglobulines des affinités
différentes vis-à-vis du FcRn: l’allotype G1m17,1 présentant une meilleure
affinité que l’allotype G1m3,-1. Chez les patients atteints de
spondylarthropathies traités par l’infliximab, d’allotype G1m17,1, la
demi-vie d’élimination de l’AcM est plus élevée chez les patients dont les
IgG sont d’allotype G1m3,-1 que chez les autres patients. En effet,
l’allotype G1m17,1 ayant une affinité plus élevée pour le FcRn, l’infliximab
est un meilleur compétiteur pour le FcRn que les IgG endogènes des sujets
G1m3,-1. L’AcM est donc mieux recyclé que les immunoglobulines du patient.
Ce recyclage est plus faible chez les sujets G1m17,1 pour lesquels
l’infliximab et leurs IgG endogènes ont des affinités pour le FcRn
identiques [34]. Polymorphismes génétiques Le gène FCGRT ( Fc fragment of IgG receptor and
transporter) qui code le FcRn, présente un nombre variable de
répétions d’une séquence particulière (VNTR pour various number
tandem repeat). Le niveau d’expression du récepteur est lié au
nombre de ces répétitions [ 35]. Les patients homozygotes pour 3 répétitions semblent ainsi
présenter une activité de distribution et d’élimination des anticorps plus
élevée [ 36, 37] Cet effet reste
toutefois d’amplitude relativement faible et ne présente probablement pas
d’intérêt clinique. Le gène FCGR3A (Fc IgG receptor IIIa) code
le récepteur RFcgIIIa, ou CD16a, un récepteur de la région Fc des IgG
exprimé à la surface d’effecteurs cellulaires, notamment des cellules NK. Ce
gène présente un polymorphisme bi-allélique, FCGR3A-158V/F,
qui génère un allèle V (valine) ou F (phénylalanine). In
vitro, le récepteur présentant la valine à la position 158 a
une affinité plus importante pour les IgG que celui présentant une
phénylalanine à cette position. In vivo, chez les patients
atteints de lymphomes non-Hodgkiniens folliculaires, cela se traduit par une
meilleure efficacité du rituximab chez les homozygotes V/V que chez les
porteurs du variant F. Ce polymorphisme influence la relation
concentration-effet des anticorps, aussi bien ex vivo
[38]
qu’in vivo [39,40] chez des patients transplantés rénaux traités par
immunoglobulines anti-lymphocytaires. Cependant, dans la maladie de Crohn,
pour l’infliximab et dans la leucémie lymphoïde chronique pour le rituximab,
le génotype V/V a été associé à une élimination spécifique plus élevée que
chez les patients présentant un autre polymorphisme. Cela suggère que la
meilleure affinité du FcgRIIIa V/V pour les IgG entraîne une élimination
plus rapide des complexes anticorps-cellule par les cellules NK, et donc une
plus grande « consommation » de l’anticorps thérapeutique [9]. |
La variabilité pharmacocinétique des anticorps, habituellement assez large, nécessite
d’être décrite précisément car elle influence, au moins en partie, la variabilité de
leur effet clinique. Aujourd’hui, un grand nombre de facteurs individuels permettent
d’expliquer cette variabilité à des niveaux très divers. Si certains facteurs
(dimensions corporelles, immunisation, masse antigénique, concentration d’albumine)
constituent des prédicteurs2, de variabilité
quantitativement pertinents, d’autres facteurs ont une influence plus modeste. Ils
peuvent cependant présenter un intérêt dans la compréhension du mécanisme d’action
des anticorps chez l’homme (IgG endogènes, polymorphismes génétiques). Certains
facteurs, dont les dimensions corporelles ou l’âge, mériteraient des analyses plus
poussées. En effet, si le poids est la mesure corporelle de loin la plus utilisée,
certaines études ont montré que d’autres mesures (taille [36] ou poids maigre [41]) ont une influence plus importante sur la variabilité
PK. Le développement d’ADA a été particulièrement décrit dans le cadre des pathologies
inflammatoires chroniques, notamment parce que leur présence entraîne bien souvent
une augmentation de la clairance de l’anticorps qui se traduit par des
concentrations très diminuées et un risque de perte de réponse secondaire à ce
phénomène. Les incertitudes autour des ADA sont toutefois nombreuses. En effet, le
risque de perte de réponse en présence d’ADA est très variable selon les anticorps,
les pathologies et les patients, et il n’existe aujourd’hui aucune méthode fiable
pour prédire le risque individuel d’immunisation et ses implications cliniques avant
le traitement. Ce risque reste encore aujourd’hui un champ majeur de recherches
[3]. La masse antigénique modifie la PK des anticorps, là aussi de façon variable en
fonction des anticorps, des pathologies et des patients. La quantification de cette
influence chez l’homme est cependant essentielle car elle détermine la première dose
à administrer, qui ne peut que très difficilement être extrapolée de l’animal. Elle
permettra également de définir la dose à administrer, afin que l’anticorps soit en
excès stœchiométrique par rapport aux cibles chez la majorité des patients.
Toutefois, cette stratégie a ses limites. Elle peut, notamment, conduire à une
sur-exposition chez la majorité des patients, avec, en plus d’une augmentation du
risque de survenue d’effets indésirables, un surcoût qui peut être important.
L’ajustement de la dose à la quantité de masse antigénique n’est toutefois par la
règle dans la mesure où celle-ci n’est pas toujours directement mesurable [9]. Même si l’influence de l’âge sur la PK des anticorps a été peu décrite, il semble
exister des différences notables entre les adultes et les jeunes enfants. Ces
derniers semblent en effet éliminer les anticorps de façon plus rapide que les
adultes. Il est probable que le schéma posologique de certains anticorps nécessite
d’être adapté aux indications pédiatriques. Si de nombreux facteurs individuels de variabilité PK des anticorps ont été
aujourd’hui quantifiés, ils ne permettent, ensemble, d’expliquer qu’une partie de la
variabilité et peuvent être insuffisants pour optimiser le schéma posologique. Pour
les anti-TNF-a, la posologie doit ainsi être adaptée à chaque patient [42]. L’existence d’une
relation concentration-effet pour le bévacizumab [36] et le cétuximab [43, 44]
plaident pour la nécessité d’un ajustement posologique fondé sur les concentrations.
La modélisation PK est ainsi un outil de choix pour la détermination du schéma
posologique optimal.[8] |
David Ternant a réalisé des formations pour les employés des laboratoires
Amgen, Bohringer et Sanofi. Stéphanie Chhun déclare n’avoir aucun lien
d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1. Dirks
NL,
Meibohm
B. Population
pharmacokinetics of therapeutic monoclonal antibodies .
Clin.
2010; ; 49:
:633.–659. 2. Dostalek
M,
Gardner
I,
Gurbaxani
BM, et al.
Pharmacokinetics, pharmacodynamics and physiologically-based
pharmacokinetic modelling of monoclonal antibodies .
Clin Pharmacokinet.
2013; ; 52:
:83.–124. 3. Ternant
D,
Bejan-Angoulvant
T,
Passot
C, et al.
Clinical pharmacokinetics and pharmacodynamics of monoclonal
antibodies approved to treat rheumatoid arthritis .
Clin Pharmacokinet.
2015; ; 54:
:1107.–1123. 4. Ternant
D,
Karmiris
K,
Vermeire
S, et al.
Pharmacokinetics of adalimumab in Crohn’s
disease . Eur J Clin Pharmacol.
2015; ; 71:
:1155.–1157. 5. Kagan
L,
Turner
MR,
Balu-Iyer
SV,
Mager
DE. Subcutaneous
absorption of monoclonal antibodies: role of dose, site of injection, and
injection volume on rituximab pharmacokinetics in rats .
Pharm Res.
2012; ; 29:
:490.–499. 6. Lobo
ED,
Hansen
RJ,
Balthasar
JP. Antibody
pharmacokinetics and pharmacodynamics . J
Pharm Sci.
2004; ; 93:
:2645.–2668. 7. Paintaud
G..
Pharmacocinétique des anticorps monoclonaux. Med Sci
(Paris).
2009; ; 25:
:1057.–1062. 8. Passot
C,
Pouw
MF,
Mulleman
D, et al.
Therapeutic drug monitoring of biopharmaceuticals may benefit
from pharmacokinetic and pharmacokinetic-pharmacodynamic
modeling . Ther Drug Monit.
2017; ; 39:
:322.–326. 9. Ternant
D,
Azzopardi
N,
Raoul
W, et al.
Influence of antigen mass on the pharmacokinetics of therapeutic
antibodies in humans . Clin
Pharmacokinet.
2018; ; 2018:
:018.–0680. 10. Ternant
D,
Paintaud
G. Pharmacokinetics
and concentration-effect relationships of therapeutic monoclonal antibodies
and fusion proteins . Expert Opin Biol
Ther.
2005; ; 5:
:S37.–S47. 11. Liu
L.
Pharmacokinetics of monoclonal antibodies and Fc-fusion
proteins . Protein Cell.
2018;; 9 h
:15.–32. 12. Yu
T,
Enioutina
EY,
Brunner
HI, et al.
Clinical pharmacokinetics and pharmacodynamics of biologic
therapeutics for treatment of systemic lupus erythematosus .
Clin Pharmacokinet.
2017; ; 56:
:107.–125. 13. Gill
KL,
Machavaram
KK,
Rose
RH,
Chetty
M. Potential sources
of inter-subject variability in monoclonal antibody
pharmacokinetics . Clin
Pharmacokinet.
2016; ; 55:
:789.–805. 14. Duffull
SB,
Wright
DF,
Winter
HR. Interpreting
population pharmacokinetic-pharmacodynamic analyses - a clinical
viewpoint . Br J Clin
Pharmacol.
2011; ; 71:
:807.–814. 15. Mould
DR,
Upton
RN. Basic concepts
in population modeling, simulation, and model-based drug development-part 2:
introduction to pharmacokinetic modeling methods .
CPT Pharmacometrics Syst Pharmacol.
2013; ; 2013: :14.. 16. Fronton
L,
Pilari
S,
Huisinga
W. Monoclonal
antibody disposition: a simplified PBPK model and its implications for the
derivation and interpretation of classical compartment
models . J Pharmacokinet
Pharmacodyn.
2014; ; 41:
:87.–107. 17. Gibiansky
L,
Gibiansky
E. Target-mediated
drug disposition model: approximations, identifiability of model parameters
and applications to the population pharmacokinetic-pharmacodynamic modeling
of biologics . Expert Opin Drug Metab
Toxicol.
2009; ; 5:
:803.–812. 18. Gibiansky
L,
Gibiansky
E,
Kakkar
T,
Ma
P. Approximations of
the target-mediated drug disposition model and identifiability of model
parameters . J Pharmacokinet
Pharmacodyn.
2008; ; 35:
:573.–591. 19. Baert
F,
Noman
M,
Vermeire
S, et al.
Influence of immunogenicity on the long-term efficacy of
infliximab in Crohn’s disease . N Engl J
Med.
2003; ; 348:
:601.–608. 20. Radstake
TR,
Svenson
M,
Eijsbouts
AM, et al.
Formation of antibodies against infliximab and adalimumab
strongly correlates with functional drug levels and clinical responses in
rheumatoid arthritis . Ann Rheum
Dis.
2009; ; 68:
:1739.–1745. 21. Ternant
D,
Ducourau
E,
Perdriger
A, et al.
Relationship between inflammation and infliximab pharmacokinetics
in rheumatoid arthritis . Br J Clin
Pharmacol.
2014; ; 78:
:118.–128. 22. Thurlings
RM,
Teng
O,
Vos
K, et al.
Clinical response, pharmacokinetics, development of human
anti-chimaeric antibodies, and synovial tissue response to rituximab
treatment in patients with rheumatoid arthritis .
Ann Rheum Dis.
2010; ; 69:
:409.–412. 23. Kverneland
AH,
Enevold
C,
Donia
M, et al.
Development of anti-drug antibodies is associated with shortened
survival in patients with metastatic melanoma treated with
ipilimumab . Oncoimmunology.
2018; ; 7: :2018.. 24. Schmidt
MM,
Townson
SA,
Andreucci
AJ, et al.
Crystal structure of an HSA/FcRn complex reveals recycling by
competitive mimicry of HSA ligands at a pH-dependent hydrophobic
interface . Structure.
2013; ; 21:
:1966.–1978. 25. Lu
JF,
Bruno
R,
Eppler
S, et al.
Clinical pharmacokinetics of bevacizumab in patients with solid
tumors . Cancer Chemother
Pharmacol.
2008; ; 62:
:779.–786. 27. Tout
M,
Casasnovas
O,
Meignan
M, et al.
Rituximab exposure is influenced by baseline metabolic tumor
volume and predicts outcome of DLBCL patients: a Lymphoma study association
report . Blood.
2017; ; 129:
:2616.–2623. 28. Ferri
N,
Bellosta
S,
Baldessin
L, et al.
Pharmacokinetics interactions of monoclonal
antibodies . Pharmacol Res.
2016; ; 111:
:592.–599. 29. Djebli
N,
Martinez
JM,
Lohan
L, et al.
Target-mediated drug disposition population pharmacokinetics
model of alirocumab in healthy volunteers and patients: pooled analysis of
randomized phase I/II/III studies . Clin
Pharmacokinet.
2017; ; 56:
:1155.–1171. 30. Kuchimanchi
M,
Grover
A,
Emery
MG, et al.
Population pharmacokinetics and exposure-response modeling and
simulation for evolocumab in healthy volunteers and patients with
hypercholesterolemia . J Pharmacokinet
Pharmacodyn.
2018; ; 2018:
:018.–9592. 31. Gibbs
JP,
Doshi
S,
Kuchimanchi
M, et al.
Impact of target-mediated elimination on the dose and regimen of
Evolocumab, a human monoclonal antibody against proprotein convertase
Subtilisin/Kexin type 9 (PCSK9) . J Clin
Pharmacol.
2017; ; 57:
:616.–626. 32. Sun
H,
Van
LM,
Floch
D, et al.
Pharmacokinetics and pharmacodynamics of Canakinumab in patients
with systemic juvenile idiopathic arthritis .
J Clin Pharmacol.
2016; ; 56:
:1516.–1527. 33. Malik
P,
Edginton
A. Pediatric
physiology in relation to the pharmacokinetics of monoclonal
antibodies . Expert Opin Drug Metab
Toxicol.
2018; ; 14:
:585.–599. 34. Ternant
D,
Arnoult
C,
Pugniere
M, et al.
IgG1 Allotypes Influence the pharmacokinetics of therapeutic
monoclonal antibodies through FcRn binding .
J Immunol.
2016; ; 196:
:607.–613. 35. Sachs
UJ,
Socher
I,
Braeunlich
CG, et al.
A variable number of tandem repeats polymorphism influences the
transcriptional activity of the neonatal Fc receptor alpha-chain
promoter . Immunology.
2006; ; 119:
:83.–89. 36. Caulet
M,
Lecomte
T,
Bouche
O, et al.
Bevacizumab pharmacokinetics influence overall and
progression-free survival in metastatic colorectal cancer
patients . Clin
Pharmacokinet.
2016; ; 55:
:1381.–1394. 37. Passot
C,
Azzopardi
N,
Renault
S, et al.
Influence of FCGRT gene polymorphisms on pharmacokinetics of
therapeutic antibodies .
MAbs.
2013; ; 5:
:614.–619. 38. Dall’Ozzo
S,
Tartas
S,
Paintaud
G, et al.
Rituximab-dependent cytotoxicity by natural killer cells:
influence of FCGR3A polymorphism on the concentration-effect
relationship . Cancer Res.
2004;; 64:
:4664.–9. 39. Ternant
D,
Buchler
M,
Beneton
M, et al.
Interindividual variability in the concentration-effect
relationship of antilymphocyte globulins: a possible influence of
FcgammaRIIIa genetic polymorphism . Br J Clin
Pharmacol.
2008; ; 65:
:60.–68. 40. Ternant
D,
Buchler
M,
Thibault
G, et al.
Influence of FcgammaRIIIA genetic polymorphism on T-lymphocyte
depletion induced by rabbit antithymocyte globulins in kidney transplant
patients . Pharmacogenet
Genomics.
2014; ; 24:
:26.–34. 41. Sharma
S,
Mittapalli
RK,
Holen
KD,
Xiong
H. Population
pharmacokinetics of ABT-806, an investigational anti-epidermal growth factor
receptor (EGFR) monoclonal antibody, in advanced solid tumor types likely to
either over-express wild-type EGFR or express variant III mutant
EGFR . Clin Pharmacokinet.
2015; ; 54:
:1071.–1081. 42. Paintaud
G,
Passot
C,
Ternant
D, et al.
Rationale for therapeutic drug monitoring of biopharmaceuticals
in inflammatory diseases . Ther Drug
Monit.
2017; ; 39:
:339.–343. 43. Azzopardi
N,
Lecomte
T,
Ternant
D, et al.
Cetuximab pharmacokinetics influences progression-free survival
of metastatic colorectal cancer patients .
Clin Cancer Res.
2011; ; 17:
:6329.–6337. 44. Pointreau
Y,
Azzopardi
N,
Ternant
D, et al.
Cetuximab pharmacokinetics influences overall survival in
patients with head and neck cancer . Ther
Drug Monit.
2017; ; 38:
:567.–572. |



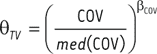 ,
où βCOV est le coefficient d’association entre
qTV et COV.
,
où βCOV est le coefficient d’association entre
qTV et COV.