| |
| Med Sci (Paris). 35(12): 1153–1159. doi: 10.1051/medsci/2019219.La bioproduction des anticorps
monoclonaux Simon Joubert,1 Vincent Dodelet,1 Roland Béliard,2 and Yves Durocher1,3* 1Centre de recherche sur les thérapeutiques en santé humaine,
Conseil national de recherche du Canada, Montréal, QuébecH4P 2R2,
Canada 2Laboratoires français du fractionnement et des
biotechnologies, Les Ulis,
Courtaboeuf Cedex, France 3Département de biochimie et médecine moléculaire, Université
de Montréal, Montréal,
QuébecH3C 3J7,
Canada |
Depuis la création du premier anticorps monoclonal (AcM) en 1975 par Georges Köhler et
César Milstein, les AcM sont devenus un des outils thérapeutiques et diagnostiques les
plus puissants de la médecine moderne. Parmi les 10 médicaments les plus vendus dans le
monde, cinq sont maintenant des AcM, représentant des ventes de plus de 50 milliards de
dollars (environ 45 milliards d’euros) en 2017. Le chiffre d’affaires pour l’ensemble
des AcM sur le marché, avec plus de 80 produits commercialisés, a dépassé le cap des 100
milliards de dollars (environ 90 milliards d’euros) cette même année. Plusieurs
centaines d’autres AcM sont à divers stades de développement pour le diagnostic et le
traitement d’une diversité toujours croissante d’indications. De quelques centaines de
grammes au début des essais cliniques, la production annuelle d’un AcM peut atteindre
plusieurs centaines de kilos pour un « blockbuster » (Figure 1). Il est estimé que la demande
mondiale se situe entre 15 et 20 tonnes par an et que les prévisions de croissance se
maintiennent au-delà de 10 % annuellement pour les 5 à 10 prochaines années.
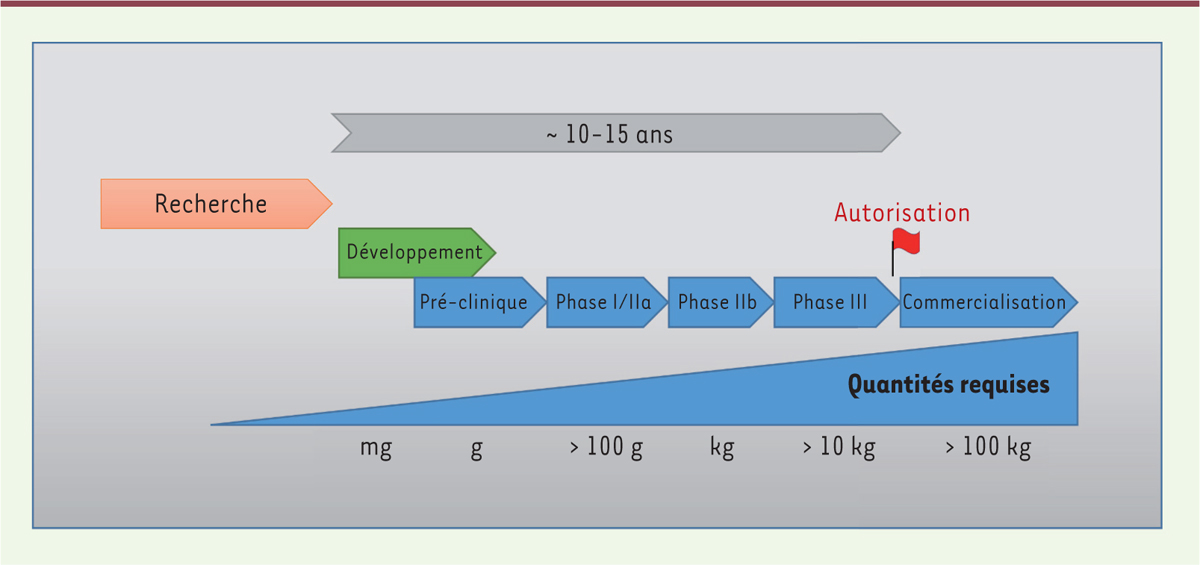
 | Figure 1. Représentation schématique des grandes étapes allant de la
recherche à la production commerciale d’un
anticorps. La durée accordée à la recherche est
difficilement quantifiable et peut s’étendre sur plusieurs décennies. La
durée en développement et essais de phases cliniques est indiquée à titre
indicatif et peut également varier selon le projet. De la découverte d’un
anticorps thérapeutique à l’autorisation réglementaire, ce processus prend
typiquement 10-15 ans. Les quantités d’anticorps généralement requises sont
indiquées, mais peuvent être moindres selon les doses thérapeutiques
nécessaires et le nombre de patients. |
Le marché des AcM évolue également avec l’avènement de nouveaux formats (anticorps
bispécifiques, fragments d’anticorps et protéines de fusion), des besoins pointus pour
la médecine personnalisée ainsi que la croissance du marché des biosimilaires. Ces
changements mettent une grande pression sur l’industrie de la bioproduction afin
d’augmenter ses rendements et diminuer ses coûts, et ce, à de multiples échelles de
production pour une diversité croissante de produits. La sélection des systèmes
d’expression, des plateformes de production et de purification est donc critique, car
chacun de ces éléments aura un impact sur le temps et les coûts de développement ainsi
que sur la qualité du produit final. |
C’est en 1984 que Georges Köhler et César Milstein ont obtenu le prix Nobel de
physiologie ou médecine pour leur travail sur la génération d’hybridomes pour la
production d’AcM, qui consiste à fusionner un lymphocyte B de souris (cellule
produisant un anticorps, mais incapable de se reproduire) avec une cellule de
myélome murin (cellule cancéreuse se reproduisant de façon indéfinie) [1]. Ces hybridomes, capables de
sécréter de façon continue des anticorps en quantités importantes, ont marqué le
début d’une ère nouvelle en médecine. Le muromonab-CD3 (OKT3) a été le premier AcM
produit à grande échelle par un hybridome et fut commercialisé en 1985 par
Ortho Biotech pour une utilisation dans la prévention du rejet
aigu des allogreffes rénales. On a rapidement constaté que lorsqu’injecté à
répétition chez le patient, celui-ci développe fréquemment des anticorps
neutralisants dirigés contre l’anticorps murin, réduisant ou même annulant son
efficacité thérapeutique, sans compter les risques de réactions allergiques et
d’anaphylaxie. Avec l’avancée des méthodes de biologie moléculaire, la production
d’AcM recombinants a rapidement complété puis remplacé l’utilisation d’hybridomes.
La biologie moléculaire a ainsi permis de construire des anticorps chimériques plus
« humains », en greffant les domaines variables d’anticorps murins aux domaines
constants d’anticorps humains. Initialement, ces AcM chimérisés puis les anticorps
humanisés étaient produits dans les hybridomes (Sp2/0) ou myélomes murins (NS0). Comme pour les anticorps murins, les AcM produits par des cellules NS0 et Sp2/0 sont
aussi à l’origine d’une réponse immunitaire, en partie à cause des séquences
variables murines résiduelles, mais aussi à cause de la présence de faibles
quantités de certains sucres qui sont immunogènes chez l’humain (surtout le
galactose-α-1,3-galactose). Ces systèmes sont encore utilisés aujourd’hui pour
certains des produits les plus anciens, ainsi que pour quelques anticorps à
utilisation diagnostique pour l’imagerie. Pour ces derniers, la productivité du
système d’expression et la glycosylation aberrante ont moins d’impact, car les
quantités requises pour ces produits sont moindres et ils ne sont administrés qu’en
petites doses et de façon non chronique. Un tournant dans l’histoire de la fabrication des AcM a été la mise en œuvre des
cellules ovariennes de hamster chinois (CHO) pour la biofabrication de l’activateur
tissulaire du plasminogène (tPA) en 1987. Se sont ensuite succédées plusieurs
protéines recombinantes thérapeutiques, dont l’érythropoïétine (EPO) en 1989, le
premier anticorps recombinant chimérique abciximab (ReoPro) en 1994, suivi du
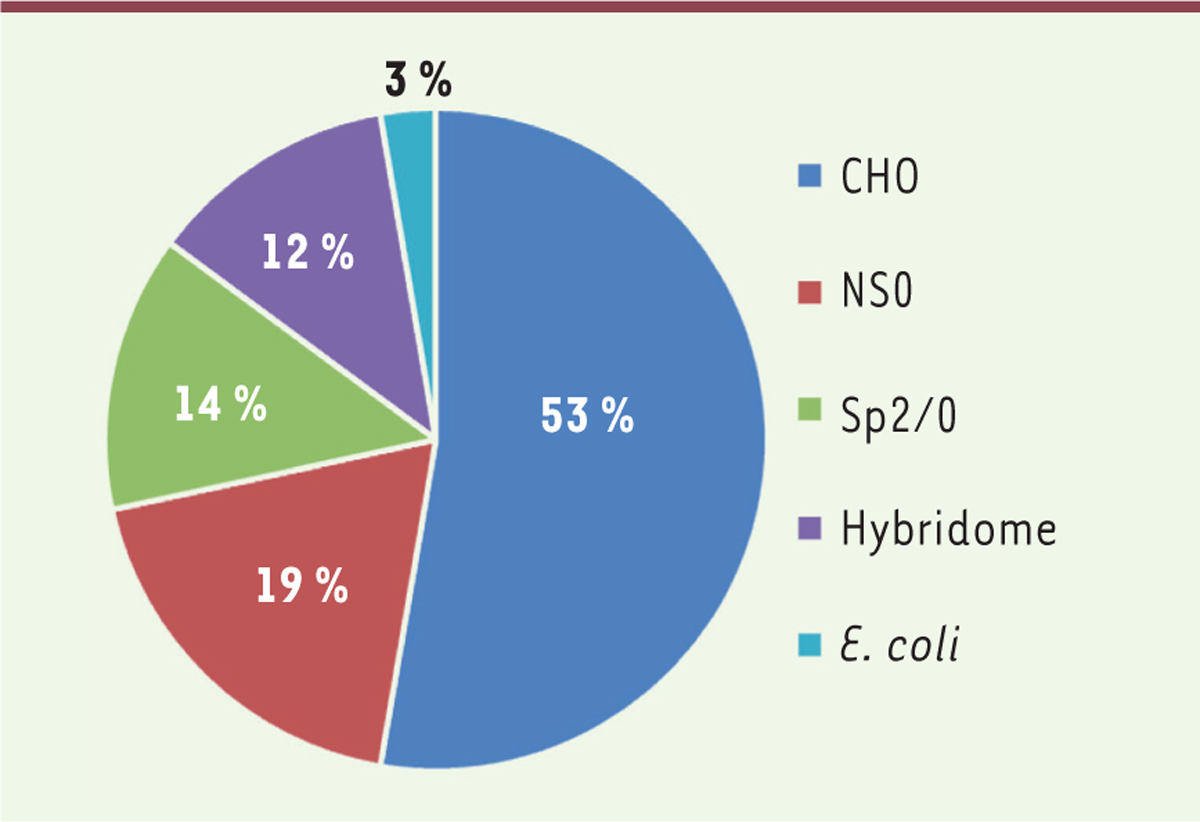
premier anticorps humanisé, le daclizumab (Zenapax) en 1997. Depuis, le mode d’expression en cellule CHO domine. Aujourd’hui, plus de 50 % des AcM
commerciaux sont fabriqués dans ces cellules et ce pourcentage atteint 80 % pour
ceux mis sur le marché au cours des cinq dernières années (Figure 2). Les raisons pour
lesquelles ce système s’est imposé au fil des ans sont relativement simples: 1) les
cellules CHO se sont avérées être des cellules robustes et faciles à manipuler
génétiquement ; 2) la qualité, la reproductibilité et l’innocuité des nombreux
produits commerciaux manufacturés avec ces cellules rassurent les autorités
réglementaires ; et 3) il y a une somme astronomique de connaissances accumulées au
fil des ans sur ce système d’expression par l’industrie biotechnologique et les
structures académiques.
 | Figure 2. Distribution des systèmes d’expression utilisés pour la
production d’anticorps monoclonaux
commercialisés (imagerie médicale et anticorps
thérapeutiques). |
|
Les systèmes d’expression alternatifs aux cellules CHO Malgré la domination des cellules CHO, de nombreux systèmes d’expression alternatifs
pour la bioproduction d’AcM (et autres protéines recombinantes) sont actuellement en
développement. Cependant, à ce jour, seuls quelques-uns sont utilisés pour la
génération d’anticorps commerciaux ou pour des études en phases cliniques. Parmi
ceux-ci, les cellules humaines Per.C6® (cellules de rétine humaines
immortalisées) [2] sont
utilisées pour la production de l’otilimab, un anticorps indiqué pour le traitement
de l’arthrite rhumatoïde sévère (phase II). Ce système d’expression confère une
meilleure biocompatibilité puisqu’il n’y a pas addition de glycanes non humains à
l’anticorps ; de plus, il montre une productivité s’approchant des cellules CHO. Par
contre, l’expérience en développement clinique est loin d’être aussi étendue que
pour les cellules CHO, et cette lignée est potentiellement susceptible d’être
contaminée par des virus (humains) transmis par les manipulateurs [3, 4]. Il y a aussi les cellules HEK293 provenant
d’un rein embryonnaire humain utilisées, entre autres, pour la bioproduction de
protéines de fusion Fc1,, tels que les facteurs
de coagulation VIII (Eloctate® ; rFVIII-Fc) et IX (Alprolix® ;
rFIX-Fc) pour le traitement respectif des hémophilies A et B, et l’agoniste du
récepteur du GLP-1 (peptide-1 de type glucagon), le dulaglutide
(Trulicity® ; GLP-1-Fc) pour le traitement du diabète de type 2
[4]. Les cellules d’hybridome de rat YB2/0, qui permettent la production d’AcM avec un
faible niveau de fucosylation (afin d’augmenter leur activité thérapeutique) [5], sont, quant à elles,
utilisées pour fabriquer le rolédumab, une Ig(immunoglobuline) d’isotype G1 humaine
dirigée contre l’antigène D du système rhésus sanguin, pour la prévention de
l’allo-immunisation fœto-maternelle chez les femmes RhD-négatives (phase II), ou
l’ublituximab, un anticorps chimérique dirigé contre l’antigène CD20 utilisé, entre
autres, dans le traitement de la leucémie lymphoïde chronique et de la sclérose en
plaques de type récurrente-rémittente (phase III). Pour les systèmes de levures, plusieurs souches sont utilisées pour la production
d’enzymes ou d’autres protéines recombinantes (insuline, interférons, hormone de
croissance), mais seule Pichia pastoris est actuellement mise à
contribution pour la production d’AcM, avec, dans certains cas, des titres de
l’ordre de 1 à 2 g/L de culture dans des bioréacteurs [6]. Pichia constitue un système
prometteur afin de réduire les coûts de production, car cet organisme prolifère
rapidement (temps de division d’environ 1 à 3 h, comparé aux cellules de lignées de
mammifères qui se divisent tous les 10 à 24 h environ) dans des milieux de culture
simples et peu coûteux. La modification génétique de ce système est relativement
aisée et permet d’introduire ou d’éliminer les gènes d’enzymes de glycosylation
nécessaires ou problématiques afin d’obtenir des protéines présentant des motifs de
glycosylation humains [7].
Aujourd’hui, ce système est utilisé pour la fabrication de l’eptinézumab, une IgG1
humanisée mais non glycosylée (mutation N297A) dirigée contre des peptides
apparentés aux séquences codées par le gène de la calcitonine (calcitonin
gene-related peptide, CGRP), qui est en phase clinique III pour le
traitement de la migraine. Depuis plusieurs années, un travail considérable a été réalisé pour amener la
production d’AcM dans des systèmes d’expression provenant des études de biologie
moléculaire effectuées chez les végétaux. L’utilisation de méthodes d’ingénierie
génétique a permis d’éliminer les enzymes responsables de la présence de sucres
immunogéniques, tels le xylose ou le α-1,3 fucose. Récemment, des plants de tabac
ont été utilisés pour la production de trois anticorps (cosfroviximab, larcaviximab
et porgaviximab) pour le traitement d’infections par le virus Ebola (actuellement
testés dans des essais cliniques de phase I/II). Aussi, la lignée cellulaire
parenchymateuse BY2, dérivée de la plante Nicotiana tabacum [8], est utilisée pour la
production du tulinercept, une protéine de fusion constituée du domaine
extracellulaire du récepteur de type II du TNF-a (tumor necrosis factor
alpha receptor, TNFRII) fusionné à la région Fc d’une IgG1 humaine,
pour le traitement de colites ulcératives (ou recto-colites hémorragiques) (en phase
II). Quoique ces systèmes d’expression présentent certains avantages par rapport aux
cellules CHO (coûts de production réduits, mise à l’échelle facilitée ou rapidité
accrue de mise en production industrielle), le nombre important de nouveaux AcM en
développement et en phase clinique qui sont actuellement produits en cellules CHO
indique que ces cellules vont certainement demeurer le système d’expression
commercial prédominant pour les 20 à 30 prochaines années. |
Ingénierie cellulaire pour améliorer les rendements, la qualité et accélérer le
développement de clones stables Au fil des ans, la productivité volumétrique des cellules CHO a été grandement
améliorée. Au début des années 1990, celle-ci était de 50-100 mg/l. Aujourd’hui, on
parle plutôt de 3 g/l en moyenne (avec des titres rapportés allant jusqu’à 10 g/l)
pour des échelles de production entre 2 000 et 20 000 litres [9, 10]. Afin d’augmenter la productivité et aussi d’accélérer le
long et fastidieux processus de génération de clones stables, plusieurs approches
novatrices ont été développées. Après sa transfection dans les cellules, le vecteur
d’expression qui code la séquence de l’AcM doit s’intégrer de façon stable dans le
génome cellulaire. Puisque ce phénomène d’intégration est relativement rare et
aléatoire, il est généralement nécessaire de cribler plusieurs centaines, voire des
milliers de cellules (clones) afin de trouver celles qui produisent l’anticorps en
grande quantité, et ce, de façon stable dans le temps (idéalement plus de 60 jours
sans perte de productivité). Afin de favoriser l’intégration dans des régions
transcriptionnellement actives du génome, et aussi pour les maintenir dans cet état,
des séquences particulières d’ADN (S/MAR [scaffold/matrix attachment
regions] ou UCOE [ubiquitous chromatin opening
elements]) sont ajoutées au plasmide d’expression [11]. Un site précis du génome de la
cellule préalablement caractérisé comme étant transcriptionnellement actif, peut
être également ciblé. Cela peut se faire à l’aide de recombinases (Flp, Cre) et de
vecteurs d’expression contenant des sites de recombinaison (FRT ou
loxP) [12]. Une fois qu’une lignée clonale mère est sélectionnée (selon sa
forte productivité, sa stabilité et la qualité du produit), sa simple transfection
avec un autre vecteur d’expression codant pour un anticorps permet, en présence de
la recombinase, d’échanger la séquence codante déjà intégrée dans le génome par
celle contenue dans ce nouveau vecteur. Ceci permet d’obtenir très rapidement des
clones producteurs stables ayant des performances très similaires à celles de la
lignée mère, mais qui produisent un autre anticorps. Ces approches d’échange de
cassette par recombinaison (recombination-mediated cassette
exchange, ou RMCE) attirent l’intérêt de l’industrie, car elles
permettent de réduire le temps nécessaire à la génération de lignées stables de
plusieurs mois et pourraient bientôt être déployées pour la génération de lignées
CHO productrices commerciales [13]. Ce n’est que récemment que les techniques de séquençage de nouvelle génération ont
fait leur apparition dans la communauté CHO. La première percée fut certainement le
séquençage du génome des cellules CHOK1 [14], un sous-clone dérivé de la lignée parentale, suivi par
d’autres génomes de cellules CHO et aussi celui du hamster chinois, dont elles sont
issues [15]. Combinée aux
autres techniques « omiques », telles la protéomique, la transcriptomique, la
métabolomique et la fluxomique, la génomique ouvre aujourd’hui la porte à la
génération d’une abondance de connaissances approfondies sur ce qui caractérise les
clones CHO très performants. Avec la venue de l’intelligence artificielle qui
permettra d’intégrer les sommes immenses de données générées par ces techniques, et
de l’utilisation du système CRISPR/Cas9, qui facilite grandement les manipulations
génétiques, l’application des résultats de ces recherches dans la création de
lignées CHO plus performantes ne saurait tarder [16]. Les systèmes d’expression utilisés pour la production de glycoprotéines ont des
machineries de glycosylation très différentes. Les plantes, les levures et les
lignées cellulaires non humaines peuvent générer des glycanes qui sont souvent
absents des protéines humaines naturelles. Pour éviter toute réponse immunitaire
potentielle, les glycanes présents sur les protéines biothérapeutiques doivent être
compatibles avec une utilisation chez l’humain. Au fil des ans, beaucoup d’études
ont contribué à élucider le rôle de la glycosylation des protéines dans leurs
fonctions biologiques. En ce qui concerne les AcM, le glycane présent dans la région
Fc de l’IgG (lié à l’asparagine en position 297) joue un rôle important dans la
modulation de nombreuses fonctions effectrices immunitaires et biologiques
essentielles, telles les activités de cytotoxicité cellulaire dépendante des
anticorps (ADCC), de la phagocytose cellulaire dépendante des anticorps (ADCP) ou de
la cytotoxicité dépendante du complément (CDC), l’induction de réponses
anti-inflammatoires, ou la modulation de la demi-vie de la molécule dans la
circulation [17, 18]. Ainsi, les glycanes non fucosylés de la région Fc d’IgG1 humaine renforcent la
liaison aux récepteurs de la région Fc de type III (RFcγIIIa ou CD16a) présents à la
surface des lymphocytes NK (natural killer) et sur des
sous-populations de monocytes, de macrophages et de cellules dendritiques [19]. Cette augmentation
d’affinité permet une meilleure activité thérapeutique des anticorps utilisés dans
le traitement de cancers, en déclenchant une forte ADCC [20]. Puisque les AcM représentent de loin la
classe la plus importante de glycoprotéines thérapeutiques, la recherche pour le
développement de stratégies permettant de produire des anticorps ayant des glycanes
faiblement ou non fucosylés s’est intensifiée. Initialement, les cellules CHO-Lec13
et les cellules de myélome de rat YB2/0 (EMABling® ont été utilisées, la
première du fait de son déficit de synthèse de GDP-fucose (dû à l’absence de
l’enzyme GDP-mannose 4,6-déhydratase) et la seconde en raison de son niveau
d’expression réduit de l’enzyme fucosyltransférase FUT8 [21]. Depuis lors, une lignée CHO dont le gène
FUT8 a été délété, FUT8-KO (knock-out), a été
établie (CHO Potelligent®) et plusieurs anticorps non fucosylés produits
avec ces cellules sont maintenant commercialisés (benralizumab, mogamulizumab,
etc.). Alternativement, la plateforme GlycoMAb consiste à surexprimer l’enzyme
β(1,4)-N-acétylglucosaminyltransférase-III (GnTIII) afin d’ajouter un résidu de
N-acétylglucosamine en position bissectrice sur le glycane de la région Fc, le
rendant moins reconnaissable par l’enzyme FUT8 et réduisant ainsi le niveau de
fucosylation de l’anticorps produit. Depuis, plusieurs autres méthodes pour réduire
le niveau de fucosylation des glycanes des anticorps ont été développées [22, 23]. L’acide sialique (ou acide N-acétylneuraminique) peut être conjugué au galactose
terminal du glycane de la région Fc en liaison α-2,3 ou en liaison α-2,6. La
sialylation de type α-2,6 (et non α-2,3) sur des IgG polyclonales provenant de
donneurs (IVIg, intravenous immunoglobulins), joue un rôle critique
dans l’activité anti-inflammatoire de ces immunoglobulines [24]. Dans les cellules CHO, la sialylation est
essentiellement de type α-2,3 car ces cellules n’expriment pas l’enzyme SIAT6
(sialyltransferase 6) permettant la génération de liaisons
α-2,6. Des travaux d’ingénierie cellulaire ont donc été réalisés afin de produire
des cellules CHO capables d’incorporer efficacement des acides sialiques sur les
glycanes des anticorps avec des liaisons α-2,6 [25, 26]. Dans le futur, certains anticorps ou domaines d’anticorps
pourraient être produits à grande échelle avec ces cellules de façon à modifier le
profil de sialylation et ainsi bonifier leur activité biologique. |
Le futur de la biofabrication L’avènement de la médecine personnalisée a définitivement contribué à l’apparition de
thérapeutiques qui s’adressent à des marchés plus petits et plus diversifiés. Ces
nouveaux marchés nécessitent des procédés de biofabrication mieux adaptés et plus
flexibles afin d’offrir des médicaments aux coûts plus abordables. De plus,
l’accélération du développement de produits biologiques permettant d’atteindre la
clinique plus rapidement est un enjeu clé, surtout pour les petites et moyennes
entreprises dont le financement est souvent précaire et limité. Depuis un peu plus
d’une dizaine d’années, l’utilisation de systèmes à usage unique s’est largement
répandue dans l’industrie. Contrairement aux systèmes réutilisables en verre ou
acier inoxydable, les systèmes jetables permettent de s’affranchir des étapes de
nettoyage et de stérilisation de tous les composés venant en contact avec le
matériel biologique, de même que de la validation et de la documentation de ces
étapes. Ceci permet de réduire considérablement les risques de contaminations
biologiques, maximise l’utilisation de la suite de bioproduction et réduit
significativement l’investissement nécessaire à la construction de nouvelles usines
de biofabrication [27,
28]. Une tendance plus récente dans l’industrie biotechnologique est l’adoption de
procédés en continu pour la biofabrication de molécules thérapeutiques [29]. Cette approche consiste
à alimenter le bioréacteur avec un flux continu de milieu de culture frais et
enrichi tout en soutirant un volume identique de la culture. De cette culture
soutirée en continu, on sépare, à l’aide de filtres spéciaux, le milieu contenant
l’anticorps des cellules qui, elles, sont retournées dans le bioréacteur.
L’anticorps contenu dans le milieu clarifié est purifié en continu sur résine de
protéine A2, grâce à des colonnes de
chromatographie agencées en parallèle. S’ensuivent des étapes d’inactivation virale,
de « polissage » du produit3, et de
filtration/diafiltration afin de s’assurer de l’innocuité et de la stérilité de
celui-ci. Cette approche, surtout lorsqu’elle est combinée aux systèmes à usage
unique, offre plusieurs avantages par rapport aux procédés de cuvées alimentées4 tant au niveau du coût des matières premières,
des investissements en équipements/infrastructures, que de la flexibilité accrue du
lieu de biofabrication et de la qualité/reproductibilité supérieure du produit
fabriqué [30]. Plutôt que de développer des clones stables, ce qui nécessite un investissement
important et des délais appréciables, des méthodes alternatives moins coûteuses et
plus rapides, mais garantissant la qualité et l’innocuité du produit, sont
nécessaires. Des progrès importants ont été réalisés permettant de produire très
rapidement des populations polyclonales de cellules CHO (pools)
dont la productivité dépasse souvent le gramme d’anticorps par litre. La qualité de
ces AcM étant égale à celle obtenue par l’utilisation de clones, il serait alors
possible d’utiliser cette façon de les produire pour des études cliniques [31, 32]. De plus, les plateformes de transfection
transitoires, qui consistent à introduire le vecteur d’expression dans les cellules
cultivées en bioréacteur à l’aide d’agents de transfection efficaces (comme le
polyéthylènimine), génèrent aussi des titres volumétriques qui s’approchent ou
dépassent le gramme par litre [33-35]. Étant
donné que ces titres peuvent être atteints en moins de trois semaines suivant la
transfection, cette approche serait industriellement viable afin de répondre à des
pandémies (pour la production d’anticorps neutralisants) ou même pour des études
cliniques exploratoires (phase 0) [32]. Une
autre approche, qui gagne aussi en intérêt, est la production d’AcM par
transcription-traduction in vitro. Une construction plasmidique
codant le gène d’une protéine d’intérêt est transcrite en ARN messager puis traduite
en protéine lorsqu’elle est incubée avec des extraits ribosomiques cellulaires (de
bactéries, de levures ou même de cellules CHO) et de cofacteurs spécifiques. Quoique
cette approche ne soit pas de la « biofabrication » en tant que telle, elle permet
la production de protéines contenant des acides aminés non naturels, permettant de
les conjuguer de façon site-spécifique (par exemple pour la fabrication d’anticorps
conjugués à des toxines ou antibody-drug conjugates, ADC) [36]. Cette technologie a été
utilisée à des échelles de plus de 100 litres et a permis d’obtenir des titres
dépassant les 700 mg/L de GM-CSF (facteur de stimulation des colonies de
granulocytes et de macrophages) en seulement 10 heures [37]. Il y a actuellement un ADC produit par
cette technique en essai clinique de phase I, ciblant la molécule CD745 qui est fortement exprimée dans le myélome
multiple (MM) et les lymphomes non Hodgkiniens (LNH). La chromatographie d’affinité sur des colonnes remplies de billes de résine couplées
à la protéine A est, à l’heure actuelle, la méthode de purification des anticorps
par excellence, en raison de la liaison hautement spécifique entre la protéine A et
la région Fc des IgG [38].
Cependant, la productivité de cette approche est limitée par le débit restreint
pouvant être appliqué sur ces colonnes, de même que par leur taille limitée.
Récemment, un système de membrane tridimensionnelle en hydrogel polymère a été
développé. Ce système est destiné à remplacer les matrices classiques à base de
billes de résines pour la purification. Cette technique permettrait de gagner
jusqu’à trente fois plus en capacité de purification, quand on la compare à
l’utilisation de résines conventionnelles pour des applications similaires. Plus
important encore, ce gain de productivité signifie que l’étape de purification ne
constituerait plus un goulot d’étranglement dans l’ensemble du processus de
production, contrairement aux systèmes actuels [39]. Des méthodes employant la précipitation
par des polymères de polyéthylène glycol directement dans le milieu récolté sont
également en développement et sont potentiellement beaucoup plus économiques que les
billes de résines couplées à la protéine A pour la capture en continu des anticorps
[40]. La fabrication de
molécules thérapeutiques utilisant ces procédés pourrait ainsi éventuellement coûter
beaucoup moins cher qu’aujourd’hui. |
L’engouement de l’industrie pour les AcM ne semble pas prêt de se tarir. Avec la
multitude de nouveaux formats d’anticorps, tels les anticorps bispécifiques, les
anticorps couplés à des toxines et les nano-anticorps, cette famille de molécules va
continuer à dominer le paysage des biothérapeutiques dans les années à venir [41, 42]. Étant donné que certains de ces nouveaux
formats présentent des défis de bioproduction, l’amélioration des performances des
systèmes d’expression actuels ou le déploiement de nouveaux systèmes d’expression
mieux adaptés pour ces molécules seront nécessaires. L’utilisation de systèmes à
usage unique couplés à des procédés de production et de purification en continu
contribuera certainement à réduire leurs coûts de biofabrication, permettant
peut-être de démocratiser davantage l’accès à ces nouveaux médicaments. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
Roland Béliard est CEO de LFB Biomanufacturing dont la plateforme YB2/0 est
citée dans le texte. Ceci est une publication du CNRC portant le numéro
NRC-HHT_53456.
|
Footnotes |
1. Köhler
G,
Milstein
C. Continuous
cultures of fused cells secreting antibody of predefined
specificity . Nature.
1975; ; 256:
:495.–497. 2. Jones
D,
Kroos
N,
Anema
R, et al.
High-level expression of recombinant IgG in the human cell line
per.c6 . Biotechnol Prog.
2003; ; 19:
:163.–168. 3. Tsuruta
LR, Lopes Dos
Santos
M,
Yeda
FP, et al.
Genetic analyses of Per. C6 cell clones producing a therapeutic
monoclonal antibody regarding productivity and long-term
stability . Appl Microbiol
Biotechnol.
2016; ; 100:
:10031.–10041. 4. Dumont
J,
Euwart
D,
Mei
B, et al.
Human cell lines for biopharmaceutical manufacturing: history,
status, and future perspectives . Crit Rev
Biotechnol.
2015: :1.–13. 5. Sibéril
S, de
Romeuf
C,
Bihoreau
N, et al.
Selection of a human anti-RhD monoclonal antibody for therapeutic
use: impact of IgG glycosylation on activating and inhibitory Fc gamma R
functions . Clin Immunol.
2006; ; 118:
:170.–179. 6. Berdichevsky
M,
d’Anjou
M,
Mallem
MR, et al.
Improved production of monoclonal antibodies through
oxygen-limited cultivation of glycoengineered yeast .
J Biotechnol.
2011;; 155:
:217.–24. 7. Love
KR,
Dalvie
NC,
Love
JC. The yeast stands
alone: the future of protein biologic production .
Curr Opin Biotechnol.
2018; ; 53:
:50.–58. 8. Hanania
U,
Ariel
T,
Tekoah
Y, et al.
Establishment of a tobacco BY2 cell line devoid of plant-specific
xylose and fucose as a platform for the production of biotherapeutic
proteins . Plant Biotechnol
J.
2017; ; 15:
:1120.–1129. 9. Wurm
FM. Production of
recombinant protein therapeutics in cultivated mammalian
cells . Nat Biotechnol.
2004; ; 22:
:1393.–1398. 10. Li
F,
Vijayasankaran
N,
Shen
AY, et al.
Cell culture processes for monoclonal antibody
production . MAbs.
2010; ; 2:
:466.–479. 11. Saunders
F,
Sweeney
B,
Antoniou
MN, et al.
Chromatin function modifying elements in an industrial antibody
production platform–comparison of UCOE, MAR, STAR and cHS4
elements . PLoS One.
2015; ; 10:
:e0120096.. 12. Zhang
L,
Inniss
MC,
Han
S, et al.
Recombinase-mediated cassette exchange (RMCE) for monoclonal
antibody expression in the commercially relevant CHOK1SV cell
line . Biotechnol Prog.
2015; ; 31:
:1645.–1656. 13. Hamaker
NK,
Lee
KH. Site-specific
integration ushers in a new era of precise CHO cell line
engineering . Curr Opin Chem
Eng.
2018; ; 22:
:152.–160. 14. Xu
X,
Nagarajan
H,
Lewis
NE, et al.
The genomic sequence of the Chinese hamster ovary (CHO)-K1 cell
line . Nat Biotechnol.
2011; ; 29:
:735.–741. 15. Rupp
O,
MacDonald
ML,
Li
S, et al.
A reference genome of the Chinese hamster based on a hybrid
assembly strategy . Biotechnol
Bioeng.
2018; ; 115:
:2087.–2100. 16. Stolfa
G,
Smonskey
MT,
Boniface
R, et al.
CHO-omics review: the impact of current and emerging technologies
on chinese hamster ovary based bioproduction .
Biotechnol J.
2018; ; 13:
:e1700227.. 17. Jennewein
MF,
Alter
G. The
immunoregulatory roles of antibody glycosylation .
Trends Immunol.
2017; ; 38:
:358.–372. 18. Jefferis
R.. Glycosylation as
a strategy to improve antibody-based therapeutics .
Nat Rev Drug Discov.
2009; ; 8:
:226.–234. 19. Shields
RL,
Lai
J,
Keck
R, et al.
Lack of fucose on human IgG1 N-linked oligosaccharide improves
binding to human Fcgamma RIII and antibody-dependent cellular
toxicity . J Biol Chem.
2002; ; 277:
:26733.–26740. 20. Niwa
R,
Sakurada
M,
Kobayashi
Y, et al.
Enhanced natural killer cell binding and activation by low-fucose
IgG1 antibody results in potent antibody-dependent cellular cytotoxicity
induction at lower antigen density . Clin
Cancer Res.
2005; ; 11:
:2327.–2336. 21. Durocher
Y,
Butler
M. Expression
systems for therapeutic glycoprotein production .
Curr Opin Biotechnol.
2009; ; 20:
:700.–707. 22. Pereira
NA,
Chan
KF,
Lin
PC, et al.
The less-is-more in therapeutic antibodies: Afucosylated
anti-cancer antibodies with enhanced antibody-dependent cellular
cytotoxicity . MAbs.
2018; ; 10:
:693.–711. 23. Lalonde
ME,
Durocher
Y. Therapeutic
glycoprotein production in mammalian cells .
J Biotechnol.
2017; ; 251:
:128.–140. 24. Anthony
RM,
Ravetch
JV. A novel role for
the IgG Fc glycan: the anti-inflammatory activity of sialylated IgG
Fcs . J Clin Immunol.
2010; ; 30: Suppl (1)
:S9.–14. 25. Raymond
C,
Robotham
A,
Spearman
M, et al.
Production of alpha2,6-sialylated IgG1 in CHO
cells . MAbs.
2015; ; 7:
:571.–583. 26. Washburn
N,
Schwab
I,
Ortiz
D, et al.
Controlled tetra-Fc sialylation of IVIg results in a drug
candidate with consistent enhanced anti-inflammatory
activity . Proc Natl Acad Sci
USA.
2015; ; 112:
:E1297.–E1306. 27. Shukla
AA,
Gottschalk
U. Single-use
disposable technologies for biopharmaceutical manufacturing .
Trends Biotechnol.
2013; ; 31:
:147.–154. 28. Frank
GT. Transformation
of biomanufacturing by single-use systems and technology .
Curr Opin Chem Eng.
2018; ; 22:
:62.–70. 29. Bielser
JM,
Wolf
M,
Souquet
J, et al.
Perfusion mammalian cell culture for recombinant protein
manufacturing . A critical review. Biotechnol
Adv.
2018; ; 36:
:1328.–1340. 30. Fisher
AC,
Kamga
MH,
Agarabi
C, et al.
The current scientific and regulatory landscape in advancing
integrated continuous biopharmaceutical manufacturing .
Trends Biotechnol.
2019; ; 37:
:253.–267. 31. Fan
L,
Rizzi
G,
Bierilo
K, et al.
Comparative study of therapeutic antibody candidates derived from
mini-pool and clonal cell lines . Biotechnol
Prog.
2017; ; 33:
:1456.–1462. 32. Stuible
M, van
Lier
F,
Croughan
MS, et al.
Beyond preclinical research: production of CHO-derived
biotherapeutics for toxicology and early-phase trials by transient gene
expression or stable pools . Curr Opin Chem
Eng.
2018; ; 22:
:145.–151. 33. Daramola
O,
Stevenson
J,
Dean
G, et al.
A high-yielding CHO transient system: coexpression of genes
encoding EBNA-1 and GS enhances transient protein
expression . Biotechnol Prog.
2014; ; 30:
:132.–141. 34. Rajendra
Y,
Hougland
MD,
Alam
R, et al.
A high cell density transient transfection system for therapeutic
protein expression based on a CHO GS-knockout cell line: process development
and product quality assessment . Biotechnol
Bioeng.
2015; ; 112:
:977.–986. 35. Stuible
M,
Burlacu
A,
Perret
S, et al.
Optimization of a high-cell-density polyethylenimine transfection
method for rapid protein production in CHO-EBNA1 cells .
J Biotechnol.
2018; ; 281:
:39.–47. 36. Martin
RW, Des
Soye
BJ,
Kwon
YC, et al.
Cell-free protein synthesis from genomically recoded bacteria
enables multisite incorporation of noncanonical amino acids .
Nat Commun.
2018; ; 9: :1203.. 37. Zawada
JF,
Yin
G,
Steiner
AR, et al.
Microscale to manufacturing scale-up of cell-free cytokine
production: a new approach for shortening protein production development
timelines . Biotechnol
Bioeng.
2011; ; 108:
:1570.–1578. 38. Liu
Z,
Mostafa
SS,
Shukla
AA. A comparison of
protein A chromatographic stationary phases: performance characteristics for
monoclonal antibody purification . Biotechnol
Appl Biochem.
2015; ; 62:
:37.–47. 39. Jacquemart
R,
Vandersluis
M,
Zhao
M, et al.
A single-use strategy to enable manufacturing of affordable
biologics . Comput Struct Biotechnol
J.
2016; ; 14:
:309.–318. 40. Burgstaller
D,
Jungbauer
A,
Satzer
P. Continuous
integrated antibody precipitation with two-stage tangential flow
microfiltration enables constant mass flow .
Biotechnol Bioeng.
2019; ; 116:
:1053.–1065. 41. Richards
DA. Exploring
alternative antibody scaffolds: antibody fragments and antibody mimics for
targeted drug delivery . Drug Discov Today
Technol.
2018; ; 30:
:35.–46. 42. Bannas
P,
Hambach
J,
Koch-Nolte
F. Nanobodies and
nanobody-based human heavy chain antibodies as antitumor
therapeutics . Front
Immunol.
2017; ; 8: :1603.. |