| |
| Med Sci (Paris). 35(12): 1163–1170. doi: 10.1051/medsci/2019231.Développabilité Jacques Dumas,1a Sylvain Huille,2b and Catherine Prades1c 1Biologics Research/Sanofi R&D,
13 quai Jules Guesde,
94403Vitry-sur-Seine,
France 2Biologics Drug Products Development/Sanofi
R&D, 13 quai Jules
Guesde, 94403Vitry-sur-Seine,
France |
De nos jours il ne suffit pas de découvrir un anticorps capable de faire ce pourquoi il a
été « designé » (conçu structuralement et fonctionnellement),
c’est-à-dire reconnaître une cible antigénique, qu’elle soit circulante ou membranaire,
puis bloquer ou stimuler l’activité biologique de la dite cible, mais il faut en plus
que cette molécule soit un agent thérapeutique « développable ». Par développable, nous
entendons que l’anticorps thérapeutique doit être produit avec un certain rendement
(ratio quantité/qualité/coût) et doit être compatible avec le mode d’administration visé
(infusion intraveineuse, injection par voie sous-cutanée avec ou sans dispositif
d’injection) dans une formulation qui en assure la stabilité selon les conditions bien
décrites par l’ICH (conseil international d’harmonisation des exigences techniques pour
l’enregistrement des médicaments à usage humain, ICH Q6B et Q5C concernant les produits
biologiques) appliquées par les agences règlementaires américaine (food and drug
administration, FDA) et européenne (agence européenne des médicaments, EMA)
et les industries pharmaceutiques… faute de quoi le projet se verrait stoppé après que
des sommes importantes aient été dépensées en recherche et développement. Il est donc nécessaire, dès les phases de recherche, de mettre en place des études
précoces qui permettront de sélectionner le bon candidat, aligné en ce qui concerne ses
propriétés avec les exigences du produit final attendu. Les groupes pharmaceutiques
mettent alors en place des études de dévelopabilité rationalisées. La
sélection des candidats est ainsi d’abord guidée par la fonction biologique puis
immédiatement suivie par les propriétés physicochimiques adaptées aux phases de
développement cliniques conférant une bonne stabilité et un faible taux d’agrégats.
Enfin, les molécules candidates doivent correctement se produire dans le système
d’expression (USP, upstream process), avec un bon rendement du procédé
de purification (DSP, downstream process). Dans cet article, nous nous
proposons de partager différentes considérations qui permettent aujourd’hui de générer
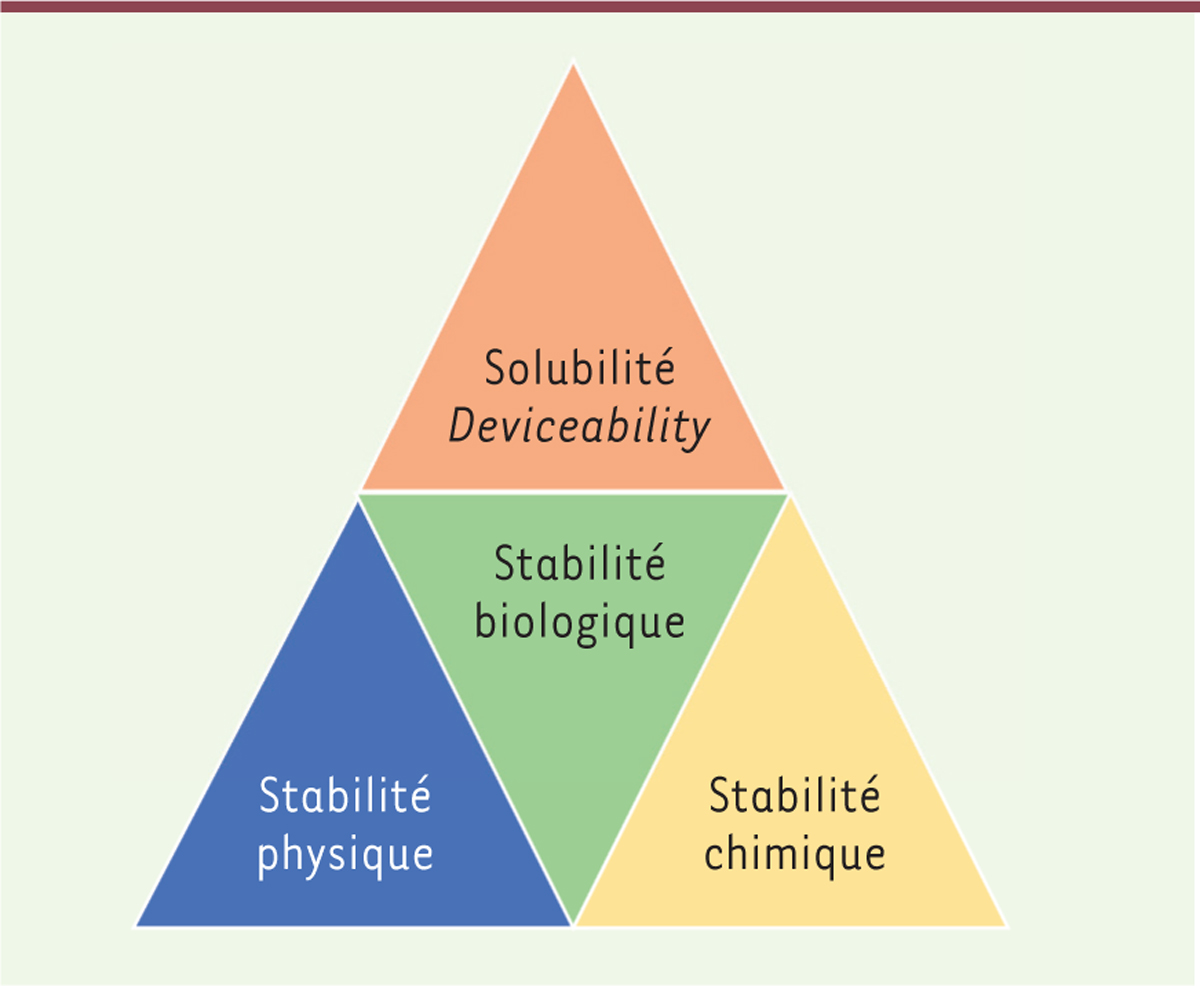
des produits de plus en plus efficaces et robustes (Figure 1).
 | Figure 1.
Critères à considérer pour la développabilité.
|
|
De la génération des anticorps monoclonaux aux premières étapes de sélection
( Figure 2) Quelle que soit la plateforme de génération d’anticorps monoclonal (AcM) utilisée,
les premières étapes de sélection se feront en fonction des propriétés de
reconnaissance de la cible, d’affinités plus ou moins importantes pour cette cible,
puis de leurs activités biologiques. Actuellement, lors de cette phase de «
découverte », les meilleurs anticorps d’activité biologique attendue sont évalués
puis catégorisés sur la base de leurs séquences (originalité/diversité de séquence),
leur germinalité1, leur contenu en résidus
potentiellement problématiques dans les régions déterminantes de la complémentarité
(CDR), mais aussi en fonction de leurs propriétés physicochimiques et structurales
prédites. Bien entendu, un anticorps non-humain devra être humanisé le plus possible
afin de limiter les risques d’immunogénicité. Le rôle des analyses in
silico est ici particulièrement important. Ensuite, le format adapté à
l’usage du candidat final devra être choisi: en effet, dès les phases en amont côté
recherche, il convient de produire l’anticorps dans le format le plus proche du
format final: mono-spécifique, multi-spécifique, fonction effectrice ou pas (choix
de l’isotype de l’immunoglobuline, de la région Fc), anticorps conjugué à une
molécule cytotoxique ou à une protéine de fusion, etc. Enfin, il est nécessaire d’anticiper, dès la sélection de l’anticorps, le dispositif
de délivrance du médicament qui devra être mis en œuvre en fonction de la voie
d’administration. |
C’est donc fondé sur l’expérience et sur un ensemble de procédés mis en place pour
développer une biomolécule que les différents groupes biopharmaceutiques vont
identifier des molécules candidates présentant des propriétés prometteuses à un
stade précoce du développement du médicament. En effet, dès les premiers stades de découverte, seuls les anticorps ayant des taux
de production corrects dans le système d’expression utilisé sont sélectionnés pour
les phases ultérieures. Ledit système se doit donc d’être aussi proche possible de
celui qui est envisagé ensuite pour la production. Puis, l’évaluation in silico de la développabilité des AcM s’appuie
sur des analyses de séquences et de structures se référant aux propriétés
physicochimiques des protéines. Ces propriétés intrinsèques biochimiques et
biophysiques prédites vont être évaluées lors de tests de stress forcés (ou «
stabilité accélérée ») et peuvent être parfois associées à des variations de taux de
production, d’efficacité, voire même parfois de tolérance (safety)
in vivo. Certains de ces critères seront rédhibitoires pour la
sélection du lead (molécule candidate phare) ; d’autres conduiront
systématiquement à des modifications de l’anticorps (réingénierie par mutations
ciblées de certains acides aminés). Ces motifs problématiques mis en évidence
in silico pourront donc être modifiés sans trop affecter la
qualité ou le niveau d’expression de l’anticorps, sa stabilité (physique ou
chimique) et, bien sûr, dans la mesure où leur impact sur sa fonctionnalité reste
minime. Les modifications chimiques sur les résidus problématiques les plus décrits et connus
comme ayant potentiellement des impacts majeurs sur la stabilité, l’expression, la
viscosité et la solubilité sont les suivantes : 1. Les N-glycosylations et les cystéines libres dans les régions variables peuvent
induire une modification de l’affinité, une plus grande hétérogénéité, un risque de
l’augmentation de l’immunogénicité [1]. 2. L’oxydation est un des mécanismes les mieux décrits concernant la dégradation des
anticorps qui peut survenir lors de la production, la formulation ou le stockage du
composé. Un certain nombre d’acides aminés peuvent être affectés, tels que les
méthionines [2], les
tryptophanes, en particulier dans les CDR, mais aussi les cystéines, histidines et
tyrosines. Cette oxydation peut induire une diminution de la stabilité thermique ou
augmenter la susceptibilité de l’anticorps à s’agréger. Les tryptophanes en
s’oxydant peuvent aussi, sous certaines conditions, produire une coloration jaune
orangée du produit final [3]. Ces oxydations dépendent de facteurs intrinsèques aux molécules telles que le temps
d’exposition à la surface du résidu, mais aussi de facteurs externes tels que
l’exposition à la lumière, le pH et la composition du tampon de formulation. Aussi, la mise en place de contrôles appropriés tout le long du procédé afin
d’évaluer la susceptibilité de ces acides aminés à s’oxyder sera importante et
pourra parfois être maitrisée par une formulation appropriée [4]. 3. La déamidation des asparagines plus particulièrement lorsqu’elles sont suivies
d’une glycine et dans une moindre mesure de glutamines, induit la formation d’acide
aspartique et iso-aspartique ou d’acide glutamique. Ceci peut parfois entraîner une
diminution de l’affinité pour la cible. La déamidation peut aussi avoir lieu lorsque
l’asparagine est suivie par une thréonine ou une sérine ; elle survient surtout
lorsque l’acide aminé à risque est accessible au solvant ou s’il se trouve dans une
région flexible. Le taux de déamidation est aussi fonction des conditions de pH,
température, formulation et concentration du produit [5]. 4. L’isomérisation des acides aspartiques (Asp) est aussi fréquemment rencontrée
lorsqu’ils sont suivis d’une glycine, d’une sérine ou d’une histidine. Tout comme
pour la déamidation, les paramètres structuraux peuvent impacter la propension de
l’acide aminé à se dégrader. L’environnement structural, la flexibilité de
l’anticorps, ainsi que la taille de l’acide aminé adjacent sont pris en compte dans
la prédiction de la possibilité de dégradation des résidus Asp et Asn [6]. D’autres caractéristiques telles que la viscosité et le taux d’agrégation peuvent
aussi avoir des conséquences sur la qualité du produit final. En effet, la
propension des anticorps à s’agréger va non seulement générer une hétérogénéité du
produit final, mais peut aussi diminuer l’activité du produit en induisant la
formation de composants potentiellement immunogéniques [7]. Une corrélation a ainsi été montrée entre
l’exposition de régions hydrophobes ou chargées et le taux d’agrégats ou une
augmentation de la clairance du produit (soit son élimination métabolique, soit sa
demi-vie) [8-10]. En fait, naturellement, les anticorps vont internaliser leurs régions hydrophobes
pour exposer au maximum les domaines les plus hydrophiles – exception faite de
certaines régions impliquées dans des interactions protéine-protéine (FcRn
binding domain, CDR, etc.). Néanmoins, sous certaines conditions
(stress thermiques, agitation, pH, augmentation de concentration), les anticorps
pourront exposer plus ou moins certaines surfaces généralement moins exposées
(hydrophobes ou chargées) ; ainsi, en augmentant les fréquences de contact
protéine-protéine, les possibilités de formation d’agrégats augmentent
proportionnellement [11,
12]. Les agrégats non
covalents (interactions hydrophobes et/ou électrostatiques) peuvent être
réversibles, mais les agrégats covalents (généralement formés par des ponts
disulfures) sont quasiment irréversibles. C’est ainsi que les logiciels de prédictions permettent d’identifier la propension
des AcM à s’agréger, sur la base de l’identification de régions sujettes à
l’agrégation et de leur contribution à la stabilité thermodynamique de la protéine
[13]. Les charges et
leur répartition ont également un impact sur la stabilité et la viscosité des
anticorps formulés à haute concentration [14, 15]. Ces dernières années, la conception de logiciels s’est attachée à tenter de mieux
prédire la tendance à l’agrégation des anticorps. Beaucoup d’algorithmes conçus à
cet effet n’utilisent que leurs séquences. D’autres concepteurs suggèrent
l’utilisation complémentaire des données de structure, lorsqu’elles sont disponibles
[16]. Une méthode
purement structurale est une des métriques de la propension d’agrégation structurale
(SAP, pour spatial-aggregation-propensity) [17] qui identifie les points chauds pour
l’agrégation en fonction de l’exposition dynamique d’acides aminés hydrophobes
adjacents dans l’espace paramétré. Ce score permet de détecter des régions
superficielles sujettes à l’agrégation, puis de classer les candidats par rapport à
un anticorps connu. Un profil de développabilité, ou index de développabilité [18], peut alors être calculé,
mais cette analyse au niveau atomique de la propension d’agrégation dépend des
modèles d’homologie statique et, compte tenu de la précision de la prédiction des
structures, elle fait parfois l’objet de discussion. Néanmoins, combiné à des
approches de design rationnel, ce type d’analyse a démontré son utilité [19]. Alors que la découverte de médicaments du type « petites molécules chimiques »
bénéficie de « la règle des cinq » de Lipinski2
pour guider la sélection de molécules aux propriétés biophysiques appropriées, il
n’existait jusque-là aucune règle in silico similaire pour la sélection des
anticorps. Une publication récente tente de combler ce manque pour les anticorps
thérapeutiques. En effet, les auteurs ont construit un modèle d’anticorps monoclonal
« développable » sur la base d’un ensemble d’anticorps thérapeutiques post-phase I.
Ils ont ensuite dérivé cinq critères impliqués dans le potentiel de développabilité,
et ont développé un outils nommé therapeutic antibody profiler
(TAP), qui permet de calculer différents critères pour un anticorps candidat et de
mettre en évidence ses forces et faiblesses comparé à des AcM thérapeutiques de
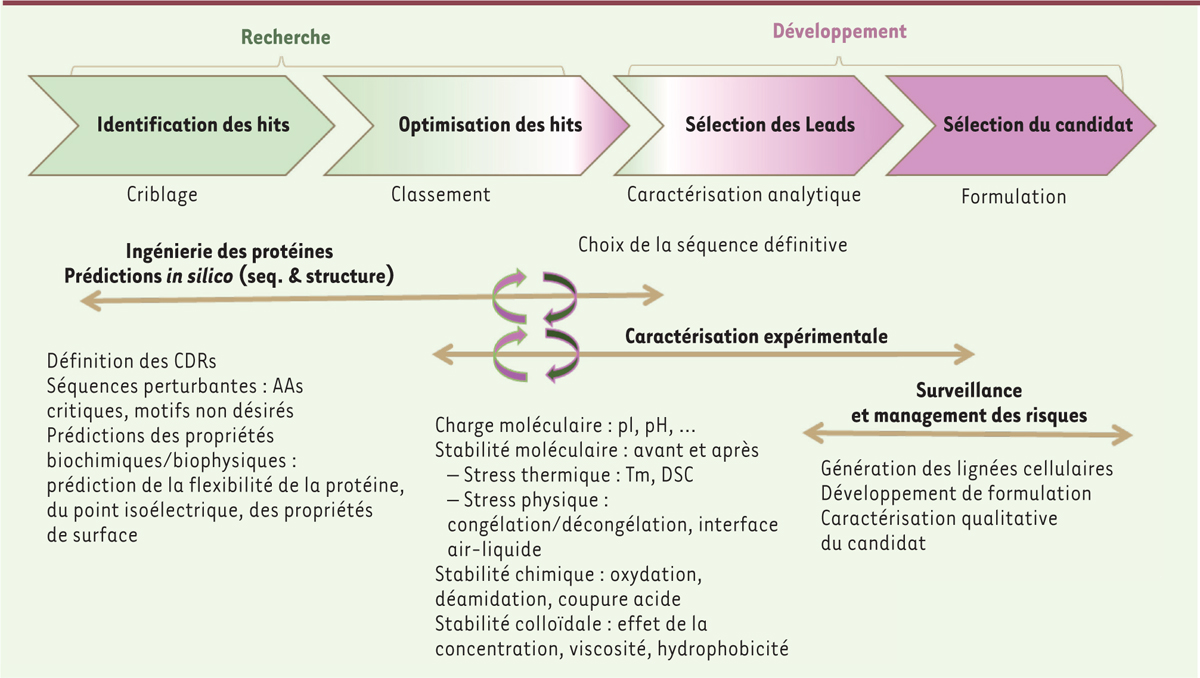
référence [20]. Ces différents motifs et caractéristiques physicochimiques calculés in silico
(Figure 3) seront réellement
évalués expérimentalement lors des étapes de caractérisations et sous conditions de
stress forcés. Il faut néanmoins noter qu’un certain nombre de motifs retrouvés très
fréquemment in silico n’ont jamais aucun impact négatif sur la
stabilité du composé et, par conséquent, aucune répercussion sur le développement de
l’anticorps. À l’inverse, les motifs à risque affectant la capacité du candidat à
obtenir un rendement acceptable, un profil de qualité approprié ou la possibilité
d’être formulé pour la voie d’administration souhaitée, amèneront à une modification
de la séquence d’acides aminés afin d’atténuer les risques identifiés.
 | Figure 3.
De la recherche au développement: intégration des critères
afin de sélectionner les molécules les plus prometteuses à
chaque étape clé.
|
|
Évaluation expérimentale: stress tests et sélection de candidats
développables Les outils in silico permettent donc de mieux comprendre les
déterminants moléculaires des anticorps qui se « comportent » bien ou mal, mais ce
sont les approches expérimentales efficaces, prédictives, rapides et à faible
consommation de matériel protéique, nécessitant de la haute technologie, qui vont
être systématiquement utilisées pour identifier les attributs défavorables à éviter
avant de commencer le développement. Ainsi la stabilité, l’expression, les
modifications chimiques et la solubilité sont des attributs qui sont
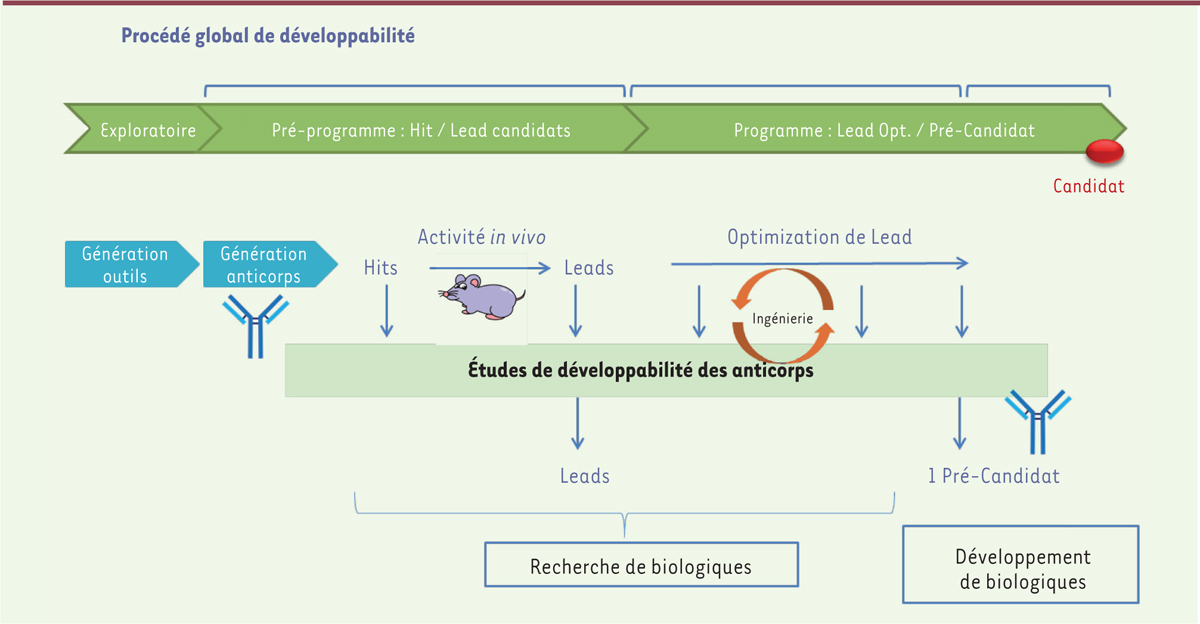
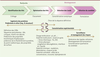
systématiquement évalués expérimentalement [21]. Les différentes étapes de développabilité (Figure 2) se doivent d’être intégrées à la chaîne de
génération-sélection des anticorps (hits puis
leads et enfin candidat) afin de ne pas retarder le flux et
l’identification de candidats, mais bien venir compléter les critères
classiques.
 | Figure 2. Procédé de développabilité: les différentes
étapes. SEC: chromatographie d’exclusion
stérique ; A4F: fractionnement par couplage flux-force ; DLS: diffusion
dynamique de la lumière ; RMM: mesure de masse par résonance ; svAUC:
vitesse de sédimentation par ultracentrifugation analytique ;
Flow imaging : imagerie par (microscopie de)flux ;
Light obscuration: obscurcissement de la lumière. |
Lors de la sélection de hits, il convient d’étudier, dans un premier
temps, la stabilité chimique puis, dans un deuxième temps, lors de la sélection de
leads, quand on dispose de plus de matériel, la stabilité
physique. Les stress de dégradations accélérées peuvent être réalisés de différentes manières:
il peut s’agir de stress thermiques consistant à incuber l’anticorps plusieurs
semaines à 40 °C ou lui faire subir des cycles de décongélation-recongélation,
d’exposition à la lumière ou d’agitation, etc. [22]. Dans tous les cas, on analysera le produit
au temps 0, puis à différents temps de stress afin d’observer des tendances de
modifications. Bien entendu, il conviendra de tester le produit en solution dans
différents tampons de pH variables, au moins un pH acide et un pH basique, en
présence ou absence de sels, avec ou sans stabilisants tels que des polyols
(sucrose), ou des surfactants (polysorbates). La quantité de matériel purifié à chaque stade fixera les études possibles. En effet,
certaines analyses sont plus consommatrices que d’autres en produit. Surtout,
certaines études sont très rapides et peu coûteuses en protéine, comme la nanoDSF
(differential scanning fluorimetry), d’autres modérément
consommatrices mais coûteuses aussi bien en terme de technologie qu’en temps de
manipulateur, comme la spectrométrie de masse en tandem (MS-MS) qui permet de
réaliser des cartes peptidiques afin d’identifier les modifications
post-traductionnelles (PTM). D’autres sont moyennement consommatrices mais longues
en temps d’occupation des appareils et du manipulateur comme la chromatographie
d’exclusion de taille (SEC, size exclusion chromatography). Les
études effectuées lors des phases de recherche se veulent les plus pertinentes
possibles en adéquation avec la quantité d’anticorps disponible ou qu’il est
possible de produire. Il est alors assez évident que certaines études nécessitant
des quantités élevées ne peuvent être réalisées dans les tout premiers stades de la
découverte. C’est donc en fractionnant les études de développabilité en fonction du
matériel qu’il est possible de produire que la stratégie est établie. Les études de stabilité (tests de stress) comme les études de pharmacocinétique /
pharmacodynamique (PK/PD) consomment quelques dizaines de mg. Elles ne sont donc
réalisées qu’avec les meilleurs leads, car, au stade de sélection
précoce, lorsque les anticorps se comptent par dizaines, voire centaines, ce type de
productions n’est pas envisageable. Les études prédictives concernant la formulation sont les plus consommatrices. Elles
seront donc réservées pour la sélection du candidat au moment du passage de la
recherche au développement. Un des facteurs limitants principaux est sans nul doute
le fait qu’il faille atteindre des concentrations élevées en anticorps. Lors de
productions à petites échelles (moins de quelques dizaines de mg) il est difficile
de maîtriser une purification à haute concentration et/ou une étape de concentration
ultérieure sans s’exposer à des pertes importantes et/ou agrégations. Il est
cependant nécessaire d’utiliser les évaluations obtenues lors des études de
stabilité et les résultats analytiques qui caractérisent le mieux possible
biochimiquement et biophysiquement l’anticorps, afin d’éviter l’utilisation de
tampons (pH pour les dilutions ou les concentrations) pouvant entraîner des
difficultés en pharmacocinétique. Les mesures de turbidimétrie spectrale (à 280 nm),
et la chromatographie (SEC) sont alors indispensables pour déterminer la quantité
soluble de produit injectée dans les évaluations précliniques in
vivo. Avant de s’engager dans le développement de procédé, les voies spécifiques de
dégradation de l’anticorps, qui peuvent affecter sa fonctionnalité biologique, les
méthodes de contrôle du procédé et la stratégie déployée pour la formulation et le
dispositif d’administration, devront être déterminées. Ces dégradations peuvent en
effet affecter les caractéristiques PK/PD dans les études réalisées chez les
primates non humains, ce qui pourrait conduire à l’arrêt du projet [23]. Parfois, les variations de glycosylation jouent un rôle important. Elles affectent en
effet la qualité, l’homogénéité, voire l’activité de l’anticorps. C’est pourquoi les
variants de glycosylation (N- et O-glycosylations) nécessitent d’être étudiés et
documentés. Les méthodes de choix sont la chromatographie par échange de cations
(CEX), l’iso-électro-focalisation (IEF ou cIEF) et la spectrométrie de masse une ou
deux dimensions (1 ou 2D LC-MS). Le choix du candidat présentant le point
isoélectrique optimal fera ainsi l’objet d’une attention particulière [24-28]. Une étude réalisée sur 23 anticorps
approuvés par la FDA révèle des points isoélectriques variant entre 6,1 et 9,4,
indiquant une variabilité importante, mais ces valeurs sont généralement en accord
avec les prédictions obtenues en utilisant un logiciel tel que vector
NTI ou d’autres logiciels ayant les mêmes fonctionnalités. Cette étude
montre également que les taux de variants acides, déterminés par chromatographie
d’échange de cations génériques, sont surestimés [29]. Les études de développabilité apportent donc les éléments nécessaires à la décision
ou non qu’un anticorps candidat soit développé. Parfois, trop de signaux de danger
nécessitent de nouveau une ingénierie afin de minimiser les risques identifiés. Une
fois en phases de développement, il ne sera quasiment plus possible de modifier
l’anticorps. Il est donc nécessaire que les études de pharmacocinétique et
pharmacodynamique et les études de stabilité dans le sérum (afin d’identifier
d’éventuelles protéolyses) soient réalisées très en amont. Dans tous les cas, il sera important de garder à l’esprit que, s’agissant d’un
produit biologique, toute modification lors des phases de développement et de
production (USP et DSP ainsi que la mise en forme pharmaceutique Fill and
Finish du produit injectable) peut engendrer des changements
significatifs. C’est donc par une bonne anticipation et d’excellentes connaissances
de l’anticorps, que les risques d’échec seront limités. Un processus de suivi
(chemistry manufacturing and control, CMC) collectera toutes
les informations concernant, lors des phases de recherche, l’expression, la
purification, la stabilité, la solubilité. Ces informations consignées aideront aux
décisions et à mieux comprendre la molécule. Elles seront transmises aux équipes
chargées de produire la molécule candidate retenue. Le profil recherché pour le produit considèrera la forme de dosage commerciale visée
et le mode d’administration, et donc certains critères de développabilité. Se
poseront ensuite les questions de la faisabilité de la fabrication, des risques
d’instabilités à prévoir pour la formulation dans sa mise en forme pharmaceutique
finale liquide ou lyophilisée, et de la compatibilité avec les dispositifs
d’administration envisagés. |
Le choix du candidat sélectionné et les dispositifs d’administration Pour la quasi-totalité des produits biothérapeutiques, la voie d’administration est
dite invasive et s’effectue par infusion intraveineuse ou par injection par voie
sous-cutanée ou intramusculaire. La connaissance des besoins et des préférences du
patient ou du personnel soignant est essentielle pour établir les caractéristiques
du dispositif d’administration [30, 31]. En
oncologie, la tendance est de faire en sorte que l’administration par voie
intraveineuse, qui est généralement pratiquée en milieu hospitalier, soit la moins
contraignante possible pour le patient et soit remplacée, si possible, par une
approche ambulatoire rendue possible par l’utilisation de la voie sous-cutanée. De
nombreux dispositifs d’injection, externes ou implantables, ont été développés pour
faciliter l’administration par injection. L’utilisation de dispositifs automatiques
ou semi-automatiques améliore la précision et la répétabilité du dosage, réduit le
temps de préparation et libère du temps pour le personnel médical. Pour le
traitement de maladies chroniques (hypercholestérolémie, eczéma atopique,
polyarthrite rhumatoïde, etc.), l’administration par injection par voie sous-cutanée
est privilégiée avec des dispositifs adaptés permettant au patient de suivre son
traitement à domicile [32].
Ces dispositifs augmentent ainsi l’autonomie du patient en limitant, voire même en
évitant, les déplacements à l’hôpital. La posologie fixant la dose et la fréquence d’injection est adaptée pour la
pathologie visée en fonction de l’activité de l’anticorps, de sa biodisponibilité
(F%) et de sa demi-vie (t1/2) dans l’organisme. Les anticorps sont souvent utilisés
à des doses thérapeutiques élevées, notamment pour des traitements oncologiques
(souvent de l’ordre de 10 mg/Kg environ). D’importants efforts sont aussi consentis
afin d’accroître leur activité ou d’optimiser leurs propriétés pharmacocinétiques
(F% et t1/2). Par exemple, les demi-vies peuvent varier significativement d’un
anticorps à l’autre, ce qui nécessite de produire des anticorps stables à hautes
concentrations, solubles et stables en dilution sérique, sans risques majeurs
d’agrégations sous conditions de stress externes (températures, lumière, agitations,
etc.), et compatibles avec le dispositif d’administration. Certains anticorps ne
peuvent être formulés en solution et requièrent une mise en forme pharmaceutique à
l’état solide, sous la forme lyophilisée. Ces lyophilisats nécessitent d’être
reconstitués en solution juste avant l’injection, ce qui représente des facteurs de
stress supplémentaires. Les auto-injecteurs sont largement utilisés pour l’injection d’anticorps
thérapeutiques et les dispositifs de pompes portables pour la délivrance de grands
volumes (au-delà de 2 ml et jusqu’à 10-20 ml) connaissent un développement
important, en s’appuyant notamment sur les technologies de microfluidique. Dans ces
dispositifs, de plus en plus sophistiqués, la présence de matériaux plastiques et
d’interfaces hydrophobes telles que air / eau ou huile silicone / eau, ainsi que les
contraintes de cisaillement sous écoulement qui s’exercent lors de l’injection, sont
autant de paramètres critiques pour la stabilité de l’anticorps [33]. Le choix des matériaux et la
conception des systèmes d’écoulements du dispositif dépendent aussi des propriétés
de l’anticorps et de sa formulation. L’approche classique de développement
séquentiel selon laquelle la structure et la séquence de l’anticorps sont conçues en
premier, puis la formulation et, en toute fin, le dispositif d’administration, n’est
plus applicable. Il faut au contraire que, dès l’évaluation de la développabilité,
aucune décision de conception relative à l’anticorps, sa formulation et son
dispositif d’administration ne soit prise séparément. Le développement du dispositif d’administration doit suivre une approche intégrée
prenant en compte toutes les composantes du développement de l’anticorps, de sa
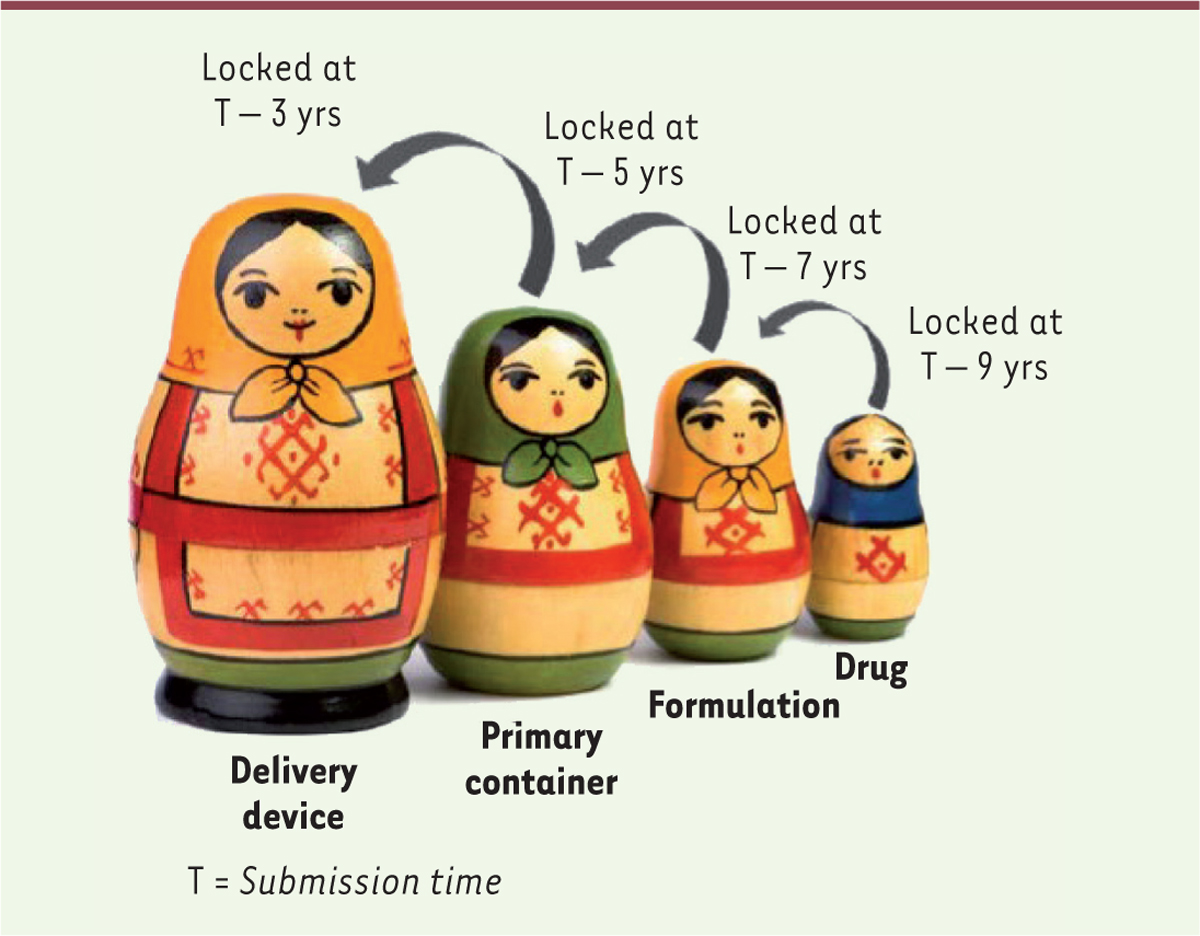
formulation et de sa mise en forme pharmaceutique (Figure 3). On peut figurer cette approche intégrée
par des poupées russes s’emboîtant parfaitement l’une dans l’autre (Figure 4).
 | Figure 4.
Approche intégrée dite des « poupées russes »
|
Ainsi, pour un auto-injecteur comme dispositif d’administration sous-cutanée, la
structure et la séquence des anticorps déterminent la viscosité de la formulation et
son augmentation avec la concentration. La concentration de formulation détermine le
volume d’injection et limite donc potentiellement le choix du conteneur principal et
de la technologie du dispositif d’administration. La concentration de formulation
détermine également la stabilité de l’anticorps pour le stockage et pour les
conditions d’utilisation et d’injection. La formulation et les caractéristiques de
l’anticorps induisent des interactions potentielles avec le conteneur principal et
sa stabilité. Les principaux composants du conteneur (matériau, lubrifiant, etc.)
définissent la force de frottement et le diamètre (Gauge) de l’aiguille fixe la
force hydrodynamique. Ainsi, afin d’évaluer et choisir les anticorps les plus robustes dès les stades les
plus précoces, les sociétés de développement biopharmaceutiques ont donc mis en
place une série de tests de stress chimiques et physiques analysés par les
technologies appropriées [21, 34]. Les résultats de ces
tests servent ainsi à élaborer une prédiction de la stabilité des anticorps lors des
périodes de stockage et pendant l’administration au patient ; ils permettent aussi
d’écarter des dispositifs d’administration inappropriés pour un candidat donné ou, à
l’inverse, d’écarter certains hits, si le type de dispositif
d’administration est un prérequis. Le défi est donc de maintenir une forte interface entre la recherche et le
développement et d’anticiper au stade de la recherche les risques potentiels pour le
développement. L’enjeu est d’aller rapidement de la découverte au patient en
augmentant la qualité des biologiques, leur sécurité et le taux de succès. |
Évaluer la développabilité d’un anticorps consiste donc, sur la base des
connaissances acquises des propriétés biophysiques et biochimiques des molécules
candidates, à améliorer leur qualité, leur efficacité, leur stabilité et leur
tolérance. La connaissance de la séquence, de la structure, ainsi que des outils
in silico permettant la prédiction des zones de risque de
modifications chimiques ou physiques, participent au processus d’évaluation. Pour
réussir leur développement, les anticorps doivent être bien exprimés, avoir l’effet
biologique souhaité et présenter une bonne solubilité et une viscosité appropriée à
des concentrations élevées. Cette capacité de développement des anticorps fait donc
référence à la possibilité de développement réussi d’un anticorps candidat en un
médicament anticorps stable, pouvant être fabriqué, sans danger et efficace. Cette développabilité est donc un des critères de sélection important pour
l’identification d’une molécule candidate clinique présentant des propriétés
prometteuses à un stade précoce du développement du médicament. Par conséquent, la
possibilité de monitorer et d’améliorer ces propriétés au moyen de méthodes
in silico associées à des mesures expérimentales rationnelles
est un domaine important permettant la diminution des coûts et des risques d’échec.
Comme ces biomolécules sont des entités biologiques très sensibles au moindre
changement et qui renferment encore beaucoup de secrets, la compréhension de leurs
différents comportements spatio-temporels mérite des efforts collectifs afin
d’identifier les meilleures pratiques allant de la biologie in
silico à leur production, en passant par leur génération et sélection
expérimentale. Une bonne évaluation de la développabilité est une des conditions
préalables à un accès rapide aux phases cliniques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1. Huang
L,
Biolsi
S,
Bales
KR,
Kuchibhotla
U. Impact of
variable domain glycosylation on antibody clearance: An LC/MS
characterization . Anal
Biochem.
2006; ; 349:
:197.–207. 2. Mo
J,
Yan
Q,
So
CK, et al.
Understanding the impact of methionine oxidation on the
biological functions of IgG1 antibodies using hydrogen/deuterium exchange
mass spectrometry . Anal
Chem.
2016; ; 88:
:9495.–9502. 3. Wei
Z,
Feng
J,
Lin
HY, et al.
Identification of a single tryptophan residue as critical for
binding activity in a humanized monoclonal antibody against respiratory
syncytial virus . Anal Chem.
2007; ; 79:
:2797.–2805. 4. Dashivets
T,
Stracke
J,
Dengl
S, et al.
Oxidation in the complementarity-determining regions
differentially influences the properties of therapeutic
antibodies . mAbs.
2016;; 8:
:1525.–35. 5. Sydow
JF,
Lipsmeier
F,
Laraillet
V, et al.
Structure-based prediction of asparagine and aspartate
degradation sites in antibody variable regions .
PLoS One.
2014; ; 9: :e100736.. 6. Lu
X,
Nobrega
RP,
Lynaugh
H, et al.
Deamidation and isomerization liability analysis of 131
clinical-stage antibodies .
mAbs.
2019;; 11:
:45.–57. 7. Jefferis
R..
Posttranslational modifications and the immunogenicity of
biotherapeutics . J. Immunol
Res.
2016; ; 2016:
:5358272.. 8. Chennamsetty
N,
Voynov
V,
Kayser
V, et al.
Design of therapeutic proteins with enhanced
stability . Proc Natl Acad Sci
USA.
2009; ; 106:
:11937.–11942. 9. Lee
CC,
Perchiacca
JM,
Tessier
PM. Toward
aggregation-resistant antibodies by design .
Trends Biotechnol.
2013; ; 31:
:612.–620. 10. Dobson
CL,
Devine
PW,
Phillips
JJ, et al.
Engineering the surface properties of a human monoclonal antibody
prevents self-association and rapid clearance in vivo .
Sci Rep.
2016; ; 6: :38644.. 11. Manning
MC,
Chou
DK,
Murphy
BM, et al.
Stability of protein pharmaceuticals: an update .
Pharm Res.
2010; ; 27:
:544.–575. 12. Telikepalli
SN,
Kumru
OS,
Kalonia
C, et al.
Structural characterization of IgG1 mAb aggregates and particles
generated under various stress conditions . J
Pharm Sci.
2014; ; 103:
:796.–809. 13. van der
Kant
R,
Karow-Zwick
AR, van
Durme
J, et al.
Prediction and reduction of the aggregation of monoclonal
antibodies . J Mol Biol.
2017; ; 429:
:1244.–1261. 14. Sule
SV,
Fernandez
JE,
Mecozzi
VJ, et al.
Assessing the impact of charge variants on stability and
viscosity of a high concentration antibody formulation .
J Pharm Sci.
2017; ; 106:
:3507.–3514. 15. Tomar
DS,
Kumar
S,
Singh
SK, et al.
Molecular basis of high viscosity in concentrated antibody
solutions: strategies for high concentration drug product
development . mAbs.
2016;; 8:
:216.–28. 16. Sharma
VK,
Patapoff
TW,
Kabakoff
B, et al.
In silico selection of therapeutic antibodies for development:
viscosity, clearance, and chemical stability .
Proc Natl Acad Sci USA.
2014; ; 111:
:18601.–18606. 17. Chennamsetty
N,
Voynov
V,
Kayser
V, et al.
Prediction of aggregation prone regions of therapeutic
proteins . J Phys Chem B.
2010; ; 114:
:6614.–6624. 18. Lauer
TM,
Agrawal
NJ,
Chennamsetty
N, et al.
Developability index: a rapid in silico tool for the screening of
antibody aggregation propensity . J Pharm
Sci.
2012; ; 101:
:102.–115. 19. Courtois
F,
Schneider
CP,
Agrawal
NJ,
Trout
BL. Rational design
of biobetters with enhanced stability . J
Pharm Sci.
2015; ; 104:
:2433.–2440. 20. Raybould
MIJ,
Marks
C,
Krawczyk
K, et al.
Five computational developability guidelines for therapeutic
antibody profiling . Proc Natl Acad Sci
USA.
2019; ; 116:
:4025.–4030. 21. Jarasch
A,
Koll
H,
Regula
JT, et al.
Developability assessment during the selection of novel
therapeutic antibodies . J Pharm
Sci.
2015; ; 104:
:1885.–1898. 22. Nowak
C,
Cheung
JK,
Dellatore
SM, et al.
Forced degradation of recombinant monoclonal antibodies: a
practical guide . mAbs.
2017;; 9:
:1217.–30. 23. Yang
X,
Xu
W,
Dukleska
S, et al.
Developability studies before initiation of process
development . mAbs.
2013;; 5:
:787.–94. 24. Largy
E,
Cantais
F, van
Vyncht
G, et al.
Orthogonal liquid chromatography-mass spectrometry methods for
the comprehensive characterization of therapeutic glycoproteins, from
released glycans to intact protein level . J
Chromatogr A.
2017; ; 1498:
:128.–146. 25. Biacchi
M,
Said
N,
Beck
A, et al.
Top-down and middle-down approach by fraction collection
enrichment using off-line capillary electrophoresis-mass spectrometry
coupling: application to monoclonal antibody Fc/2 charge
variants . J Chromatogr A.
2017; ; 1498:
:120.–127. 26. Debaene
F,
Wagner-Rousset
E,
Colas
O, et al.
Time resolved native ion-mobility mass spectrometry to monitor
dynamics of IgG4 Fab arm exchange and bispecific monoclonal antibody
formation . Anal Chem.
2013; ; 85:
:9785.–9792. 27. Beck
A,
Lambert
J,
Sun
M,
Lin
K. Fourth world
antibody-drug conjugate summit. mAbs.
2012; ; 4:
:637.–647. 28. Wurch
T,
Lowe
P,
Caussanel
V, et al.
Development of novel protein scaffolds as alternatives to whole
antibodies for imaging and therapy: status on discovery research and
clinical validation . Curr Pharm
Biotechnol.
2008; ; 9:
:502.–509. 29. Goyon
A,
Excoffier
M,
Janin-Bussat
MC, et al.
Determination of isoelectric points and relative charge variants
of 23 therapeutic monoclonal antibodies . J
Chromatogr B.
2017; ; 1065–66:
:119.–128. 30. Bittner
B,
Richter
W,
Schmidt
J. Subcutaneous
administration of biotherapeutics: an overview of current challenges and
opportunities . Biodrugs.
2018; ; 32:
:425.–440. 31. Mathaes
R,
Koulov
A,
Joerg
S,
Mahler
HC. Subcutaneous
injection volume of biopharmaceuticals-pushing the
boundaries . J Pharm Sci.
2016; ; 105:
:2255.–2259. 32. Dent
R,
Joshi
R,
Djedjos
S, et al.
Evolocumab lowers LDL-C safely and effectively when
self-administered in the at-home setting .
SpringerPlus.
2016; ; 5: :300.. 33. Li
K,
Rogers
G,
Nashed-Samuel
Y, et al.
Creating a holistic extractables and leachables (E-L) program for
biotechnology products . PDA J Pharm Sci
Technol.
2015; ; 69:
:590.–619. 34. Xu
Y,
Wang
D,
Mason
B, et al.
Structure, heterogeneity and developability assessment of
therapeutic antibodies .
mAbs.
2019;; 11:
:239.–64. |