La mucoviscidose (en anglais, cystic fibrosis ou CF) est une maladie génétique grave affectant principalement la population caucasienne dans une proportion d’une naissance sur 4 000. Des mutations du gène codant la protéine CFTR (cystic fibrosis transmembrane conductance regulator) entraînent des changements de flux ioniques à travers la membrane plasmique de cellules épithéliales, qui altèrent le réseau de mucines dans plusieurs organes comme les poumons et l’intestin [1-3]. Les mucines polymériques sont de grandes glycoprotéines qui organisent la couche de mucus et assurent la lubrification et la protection des muqueuses contre l’invasion d’agents infectieux. Chez les patients atteints de mucoviscidose, le dysfonctionnement du canal ionique CFTR modifie le mucus, qui devient visqueux et adhère aux parois des bronches et du tube digestif. Dans les poumons, l’obstruction des voies aériennes est propice aux infections bactériennes [4]. De plus, les propriétés antibactériennes de la couche de mucus sont diminuées chez des animaux modèles développant certains symptômes de la maladie [5]. Une infection précède généralement le développement d’une inflammation, il est tentant de penser qu’une infection précoce puisse déclencher la pathogénèse pulmonaire et provoquer une réaction inflammatoire chronique chez les patients atteints de mucoviscidose. A l’appui de cette hypothèse, des lésions pulmonaires causées par l’inflammation peuvent être détectées très tôt par imagerie médicale fondée sur la tomodensitométrie (en anglais, computed tomography ou CT). En effet, 22 % des patients atteints de mucoviscidose présentent des lésions dès l’âge de 1 an [6]. Les descriptions de la progression de la maladie font donc souvent référence au cercle vicieux « obstruction-infection-inflammation » (dans cet ordre), car l’inflammation est fréquemment associée à la présence de microorganismes pathogènes. Cependant, notre étude récemment publiée dans le journal Science Translational Medicine démontre que l’inflammation précède l’infection bactérienne et que le mucus pourrait être à l’origine de cette réponse inflammatoire [7]. L’accumulation de mucus est, de plus, détectée avant les premiers signes de lésions pulmonaires, suggérant, là encore, que les propriétés anormales du mucus chez ces patients déclenchent une réponse immunitaire et constituent ainsi le point de départ de la maladie de la mucoviscidose.
Pour élucider la pathogenèse de ces symptômes pulmonaires précoces, nous avons analysé des liquides de lavage broncho-alvéolaire (en anglais, bronchoalveolar lavage fluids ou BALF) obtenus chez des enfants de moins de 5 ans atteints de mucoviscidose (groupe CF, âge moyen 3,3 ± 1,7 ans), ainsi que chez des enfants du même âge sans mutation du gène CFTR (groupe non-CF, âge moyen 3,2 ± 2,0 ans). Notre étude, réalisée en collaboration avec le groupe du Dr Stephen Stick en Australie (Australian respiratory early surveillance team for cystic fibrosis, AREST CF, The University of Western Australia), a porté sur la nature de l’environnement pulmonaire chez l’enfant et la relation entre mucus, inflammation et flore bactérienne/microbiote. À la naissance, la structure histologique des poumons chez les individus souffrant de la maladie est d’apparence normale, mais la destruction progressive des tissus s’installe rapidement et les premiers signes de bronchectasie se manifestent très tôt dans l’enfance [6]. La déshydratation du mucus due aux modifications des transports transépithéliaux d’ions Cl- et Na+ liés au dysfonctionnement de CFTR persiste. Ce mucus hyperconcentré entraîne la compression et l’immobilisation des cils des cellules épithéliales des bronchioles, ce qui ralentit la clairance pulmonaire [8, 9]. D’autres mécanismes pathogéniques ont été proposés. Ils font intervenir l’incapacité de l’épithélium à sécréter des ions bicarbonate (HCO3 -) en l’absence de fonctionnement du canal CFTR, ce qui rend l’environnement plus acide et inactive certains peptides antimicrobiens appelés défensines [5, 10]. L’infection bactérienne qui en résulte induirait alors une réponse immunitaire intense, accompagnée de la surproduction de mucus. Il est donc important de mieux comprendre le point de départ de la maladie pour une prise en charge médicale efficace dès le plus jeune âge, afin de minimiser la progression des symptômes pulmonaires.
Nous avons analysé 124 BALF collectés (lors de plusieurs consultations médicales) chez 46 enfants atteints de mucoviscidose dans un état clinique stable, ainsi que 32 BALF collectés chez 16 enfants sans mutation du gène CFTR, mais présentant néanmoins des symptômes respiratoires (pour des raisons éthiques, il était impossible d’effectuer des lavages broncho-alvéolaires chez des enfants sans symptôme pulmonaire). Pour les enfants porteurs de mutations de CFTR, les visites médicales de routine étaient accompagnées d’imagerie par tomodensitométrie, qui a montré l’existence d’un épaississement des parois pulmonaires (en anglais, bronchial wall thickening) et d’une bronchectasie respectivement dans 65 % et 24 % des lobes pulmonaires pour la population étudiée. Bien que certains enfants, aussi bien parmi ceux atteints de mucoviscidose que parmi ceux non atteints de cette maladie, aient été sous traitement par antibiotique lors des visites médicales, nous avons détecté une concentration de mucines plus élevée chez les enfants atteints de mucoviscidose, alors qu’ils présentaient un taux d’infection bactérienne moins élevé que les autres enfants étudiés. L’analyse des bactéries recueillies par BALF, réalisée par culture traditionnelle en boîtes de Pétri, a en effet montré que le groupe d’enfants sans mutation de CFTR (groupe non-CF) avait une incidence et un taux plus élevés de bactéries pathogènes que le groupe d’enfants atteints de mucoviscidose (groupe CF). Rappelons que les enfants du groupe non-CF présentaient des symptômes respiratoires actifs, d’où la présence fréquente de bactéries pathogènes dans cette population. Dans le groupe CF, la proportion d’enfants non infectés était de 92 % (pour un statut d’infection défini à > 104 CFU/ml). Des analyses du microbiome plus poussées, par la technique de qPCR (quantitative polymerase chain reaction) et le séquençage d’ADN, ont donné des résultats similaires, et ont révélé une taxonomie génétique principalement associée aux microorganismes de la cavité buccale pour les enfants du groupe CF qui présentaient une infection [7, 11]. Malgré un faible taux d’infections et une absence de lésions pulmonaires détectables par tomodensitométrie, les enfants du groupe CF présentaient un profil muco-inflammatoire plus marqué que les autres enfants, indiquant que l’accumulation de mucus et l’inflammation sont les premiers symptômes de la maladie pulmonaire dans la mucoviscidose.
La concentration des mucines a été mesurée par réfractométrie et diffusion dynamique de la lumière (refractometry/light scattering), et a pu également être estimée par immunohistofluorescence en marquant les deux mucines principales des poumons, MUC5B et MUC5AC [12]. Ces deux techniques ont révélé que la concentration des mucines était plus élevée dans les BALF des enfants du groupe CF, indépendamment de leur statut infectieux. Toutefois, si la concentration des mucines n’était pas directement liée à l’infection, elle correspondait de manière significative aux marqueurs associés à l’inflammation neutrophilique et à l’obstruction des voies aériennes. Après une analyse multivariée, une corrélation positive a été établie entre la concentration des mucines et le nombre de neutrophiles, le niveau d’interleukine-8, l’hypoxie, et le stress oxydant. Ces résultats ont suscité une attention particulière portée au mucus et à l’inflammation.
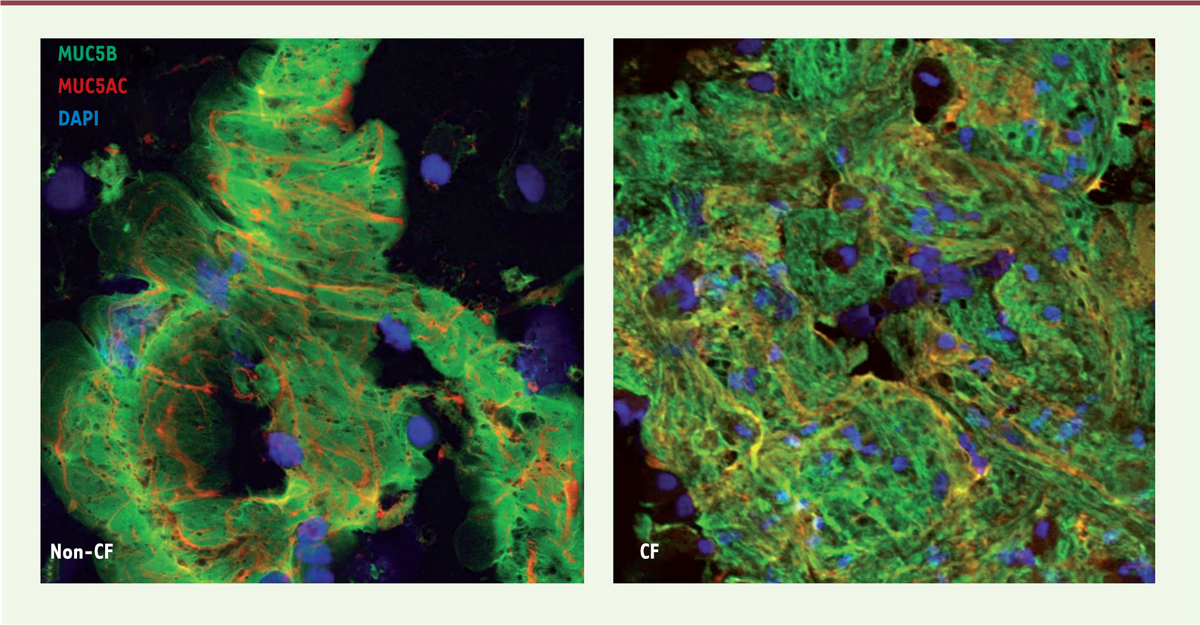
L’observation des BALF par microscopie électronique à balayage (scanning electron microscopy) a dévoilé la présence de minuscules « flocons » de mucus (de taille allant de 20 à 200 µm) qui, en excès de solution saline, étaient résistants à l’expansion et/ou à la dissolution ; en d’autres termes, un gel de mucus immuable et persistant (Figure 1). Or les mucines respiratoires, qui forment des polymères linéaires, devraient, en excès de fluide, se trouver en phase diluée ou semi-diluée [8, 13]. La présence d’un gel persistant suggérait donc la formation excessive de ponts disulfures ou d’autre(s) interaction(s) chimique(s) [14]. Les images d’immunohistofluorescence ont montré que ces flocons de mucus sont formés d’un entrelacement de mucines contenant MUC5B et MUC5AC (Figure 2), suggérant la participation de l’épithélium à l’agencement de ces mini-plaques de mucus, puisque les glandes sous-muqueuses ne produisent pas MUC5AC [12]. Bien que les flocons de mucus apparaissent chez les enfants du groupe CF et chez ceux du groupe non-CF (i.e., porteurs ou non d’une mutation du gène CFTR), ces flocons ont une apparence plus granuleuse ou plus condensée chez les enfants du groupe CF, et l’analyse par calcul d’images a montré une différence significative de « rugosité » de ces flocons entre les deux groupes, évoquant une expansion anormale des mucines lors de l’exocytose des granules ou un changement irréversible dû à la déshydratation dans le groupe CF.
| Figure 2. Images représentatives de flocons de mucus obtenues par
immunohistofluorescence à partir des BALF d’enfants avec (CF) ou
sans (non-CF) mutation de CFTR. Les échantillons,
analysés en microscopie confocale, ont été marqués par des anticorps
anti-MUC5B (en vert) et anti-MUC5AC (en rouge), ainsi que par le DAPI, qui
rend visibles les noyaux cellulaires (en bleu). |
Les inhalations de déoxyribonucléase recombinante humaine (rhDNase ou dornase alfa) constituent actuellement l’une des approches médicales les plus efficaces pour faciliter la clairance muco-ciliaire chez les patients atteints de mucoviscidose [15, 16]. Le traitement par la rhDNase hydrolyse les longues molécules d’ADN extracellulaire, entrelacées avec les réseaux de mucines, qui forment les « pièges extracellulaires des polynucléaires neutrophiles » (en anglais, neutrophil extracellular traps) ou proviennent de cellules inflammatoires mortes, et qui sont couramment observées chez les patients plus âgés [15, 16]. Puisque la cible pharmacologique de la rhDNase est l’ADN libéré par les cellules inflammatoires, un statut d’inflammation chronique est nécessaire pour que cette approche soit efficace. Les mesures de la concentration d’ADN dans les BALF recueillis chez les enfants des deux groupes ont montré qu’elle est déjà plus élevée chez les enfants du groupe CF dès le plus jeune âge. Cependant, l’ADN apparaît principalement contenu dans le noyau des cellules présentes dans ces BALF, et ne devrait donc pas contribuer fortement à la viscosité du mucus [15]. Nous avons testé l’efficacité de la rhDNase sur la dissolution des flocons de mucus, et avons montré que la rhDNase était moins efficace que la réduction des ponts disulfures pour obtenir la dissolution complète des flocons. Cependant plusieurs études cliniques ont montré le manque d’efficacité de la N-acétylcystéine (NAC), le seul agent réducteur dont l’utilisation en inhalation est médicalement approuvée pour traiter les patients atteints de mucoviscidose [17, 18]. Une autre de nos études montre que la NAC a une cinétique lente, produisant un nombre limité de réactions chimiques avant d’être chassée des poumons ou absorbée, ce qui expliquerait son manque d’efficacité pour les maladies muco-obstructives [19]. Nous avons alors testé des agents réducteurs avec des cinétiques plus rapides (dithiothréitol [DTT] et un autre agent développé par Parion Sciences, P2062), et avons obtenu une dissolution rapide et complète des flocons de mucus, contrastant avec la faible efficacité de la NAC et de la rhDNase.
En résumé, notre étude apporte des précisions physiopathologiques importantes sur les premières étapes de la maladie pulmonaire de la mucoviscidose, qui sont caractérisées, même en l’absence d’infection bactérienne, par la concentration des mucines et la présence de flocons de mucus persistants, et sont associées à un profil inflammatoire et à des signes d’hypoxie. Cette étude ne remet pas en cause le rôle de l’infection bactérienne dans l’évolution de la maladie, mais nous pensons que la déshydratation et l’adhérence du mucus aux parois des voies aériennes constituent une niche pour l’inflammation et entraînent des conditions anaérobiques favorisant l’invasion bactérienne par la flore buccale, ce qui aggrave l’inflammation et accentue la production de mucus. Ces conditions facilitent alors l’infection par des bactéries pathogènes associées à un pronostic sévère telles que Pseudomonas aeruginosa (bacille pyocyanique). Chez ces jeunes patients, l’inhalation de rhDNase et la réhydratation du mucus par inhalation de solutions salines hypertoniques ne semblent pas suffisamment efficaces pour dissoudre complètement les flocons de mucus. Une approche fondée sur la réduction des ponts disulfures qui ancrent les monomères de mucines ou sur des médicaments anti-inflammatoires semble plus appropriée, et mériterait donc une évaluation clinique approfondie.