| |
| Med Sci (Paris). 35: 13–17. doi: 10.1051/medsci/2019047.Le(s) long(s) parcours de la mise sur le marché des
médicaments Christophe Duguet1* 1Directeur des affaires publiques,
AFM-Téléthon, 1, rue de
l’internationale, 91002Évry,
France |
L’arrivée sur le marché d’un médicament innovant ne relève pas d’un effet
off/on. Il ne s’agit pas d’une bascule instantanée entre un avant
sans, et un après avec. C’est au contraire un processus très progressif et qui prend du
temps. Le chemin qui conduit à la commercialisation se décline au pluriel. Il n’existe
pas un parcours réglementaire, mais des parcours réglementaires. Ils partagent un
certain nombre d’étapes, obligatoires, mais se différencient par des chemins de traverse
liés aux spécificités de chaque principe actif. Dans tous les cas, la route est longue
(voire très longue) et tortueuse en raison de la complexité d’une réglementation qui, de
surcroît, évolue en permanence. Des nouveautés réglementaires sont déjà annoncées pour
les mois et même les semaines à venir. Il faut en permanence se tenir à jour. |
Une succession d’incontournables En Europe, le parcours réglementaire d’un médicament innovant, notamment dans le
domaine des maladies rares, commence souvent avant même les essais cliniques. Il
s’agit de la demande et de l’obtention, par le laboratoire, de la désignation du
statut de « médicament orphelin » au niveau européen. Ce statut donne quelques
avantages, en termes de simplification, pour le développement. Si seule une petite
partie des produits désignés « médicament orphelin » iront jusqu’à obtenir une
autorisation de mise sur le marché (AMM), ils bénéficieront alors d’une protection
relative puisque l’Union européenne s’engage dès lors à ne pas accepter, pendant une
période de 10 ans, de nouveaux médicaments qui ne feraient pas mieux que le
médicament déjà autorisé. La deuxième étape du parcours est celle des essais
cliniques et donc, en amont, des demandes d’autorisations d’essais cliniques. Pour
accorder cette autorisation, les autorités de santé jugent si, d’un point de vue
réglementaire, elles autorisent des patients dûment informés à prendre un « risque »
lié au nouveau traitement, au vue de premières données qui présument de son effet
positif éventuel. L’étape suivante consiste à préparer, en interaction avec les
autorités, l’obtention de l’AMM. Cette autorisation de commercialisation est
délivrée sur le constat que le médicament fait plus de bien que de mal. En d’autres
termes, son rapport bénéfice/risque est positif. Néanmoins, la délivrance d’une AMM
ne préjuge pas de la valeur du nouveau médicament dans la stratégie thérapeutique,
par rapport aux autres produits déjà commercialisés. Cette appréciation relève d’une
autre étape, appelée en anglais HTA, pour health technology
assessment. Ses résultats nourrissent l’étape suivante, de fixation du
niveau de prise en charge financière par la collectivité (taux de remboursement)
puis de négociation du prix. La dernière étape, à ne pas oublier, est dite de «
post-AMM » : une fois le prix fixé et le médicament en vente, des études
complémentaires peuvent être demandées. Pour pratiquement tous les médicaments, il
existe à ce stade des obligations en termes de registre et de suivi. Cette phase de
post-AMM porte notamment des enjeux de pharmacovigilance. |
Des points communs européens et des spécificités nationales Les étapes successives du parcours se déroulent à différents niveaux territoriaux. La
désignation de médicament orphelin et l’AMM relèvent par exemple d’une décision
centralisée, à l’échelle de l’Europe. Les médicaments innovants pour nos maladies
neuromusculaires sont soumis obligatoirement à une procédure gérée par l’Agence
européenne du médicament (European Medicines Agency ou EMA). Une
décision de mise sur le marché prise par l’EMA s’impose à l’ensemble du territoire
européen. Concrètement, cela signifie que, pour la France, l’Agence nationale de
sécurité du médicament et des produits de santé (ANSM) ne prend pas de décision
d’AMM pour les médicaments innovants. Il faut garder ce point important à l’esprit.
A contrario, c’est à chaque pays de décider s’il autorise ou
non un essai clinique à se dérouler sur son territoire. Dans l’Hexagone, cette
décision revient à l’ANSM et à des comités d’éthique (les comités de protection des
personnes ou CPP). Cette procédure va néanmoins changer très bientôt, sous
l’impulsion d’un règlement européen qui date de quelques années mais n’est pas
encore entré en application. à partir de 2020, la demande d’autorisation d’un essai
clinique, qu’il concerne un seul pays ou plusieurs, relèvera d’une procédure unique
centralisée à l’échelle européenne. En matière d’accès anticipé d’un médicament
innovant au marché, chaque pays possède ses propres règles. Cet accès anticipé
constitue un « raccourci » du parcours réglementaire–type, primordial dans les
maladies rares pour lesquelles il n’existe pas d’alternative thérapeutique. Il peut
s’ouvrir avant même l’obtention de l’AMM, sur la base de premiers résultats d’essais
cliniques. Si des résultats permettent de penser qu’il y a une forte présomption que
le médicament présente un réel intérêt pour soigner des patients, il peut y avoir un
accès anticipé. Des patients peuvent ainsi en bénéficier avant que les différentes
phases obligatoires (AMM, évaluation, négociation de prix…) n’aient abouti. La
France a opté en ce domaine pour le système des autorisations temporaires
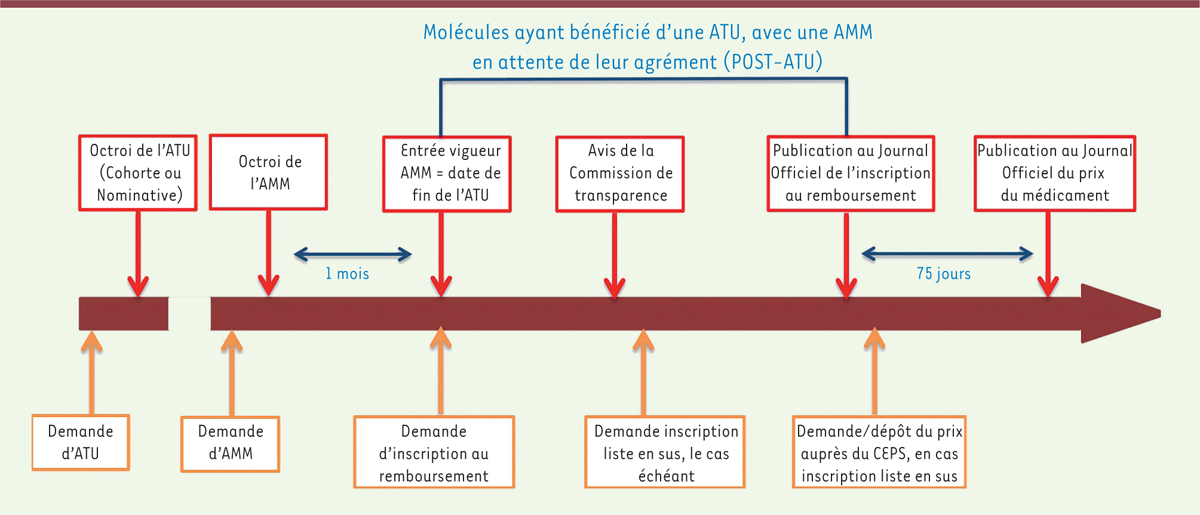
d’utilisation (ATU) (Figure 1)
et des post-ATU, qui fait beaucoup d’envieux dans les autres pays. Les étapes
d’évaluation HTA (health technology assessment), de négociation du
prix et de prise en charge, relèvent de la responsabilité exclusive de chacun des
États européens. Or ils adoptent des logiques, des approches et des procédures
différentes. Le coût et le remboursement d’un même médicament peuvent donc s’avérer
très différents d’un pays à l’autre. Bien que bénéficiant d’une AMM généralisée à
l’ensemble de l’Union européenne, il peut ne pas être disponible dans un grand
nombre de pays. En France, l’évaluation HTA revient à la Commission de la
transparence et à la Commission évaluation économique et de santé publique (CEESP)
de la Haute autorité de santé (HAS), la négociation du prix et la fixation du taux
de remboursement au Comité économique des produits de santé (CEPS). Toutes ces
décisions ne s’appliquent que pendant une durée limitée. En post-AMM sont opérées
des révisions régulières aussi bien de l’AMM que de l’évaluation HTA du médicament.
Les conclusions de ces réévaluations peuvent avoir des conséquences notamment sur le
prix et le taux de remboursement du médicament, et éventuellement sur son maintien
sur le marché. Les processus de mise sur le marché des médicaments innovants sont
très longs. Entre l’obtention de l’AMM et la décision de prix, il ne devrait (en
théorie) pas s’écouler plus de 180 jours. Et la moitié de cette durée réglementaire
(90 jours) devrait être consacrée à l’évaluation HTA. En France, la HAS parvient peu
ou prou à tenir ce délai. En revanche, les négociations de prix durent souvent
beaucoup plus longtemps que les 90 jours restant prévus. Par exemple, des
négociations de prix en cours pour certains médicaments indiqués dans des maladies
rares ont débuté il y a 18 mois, voire deux ans ! Notre chance en France, c’est de
pouvoir recourir au dispositif des ATU et de post-ATU. Ils permettent aux patients
d’accéder à un médicament innovant avant que ces discussions n’aboutissent.
 | Figure 1. Le circuit des médicaments bénéficiant d’une
ATU (source : Comptes de la Sécurité sociale,
rapport de septembre 2017). |
|
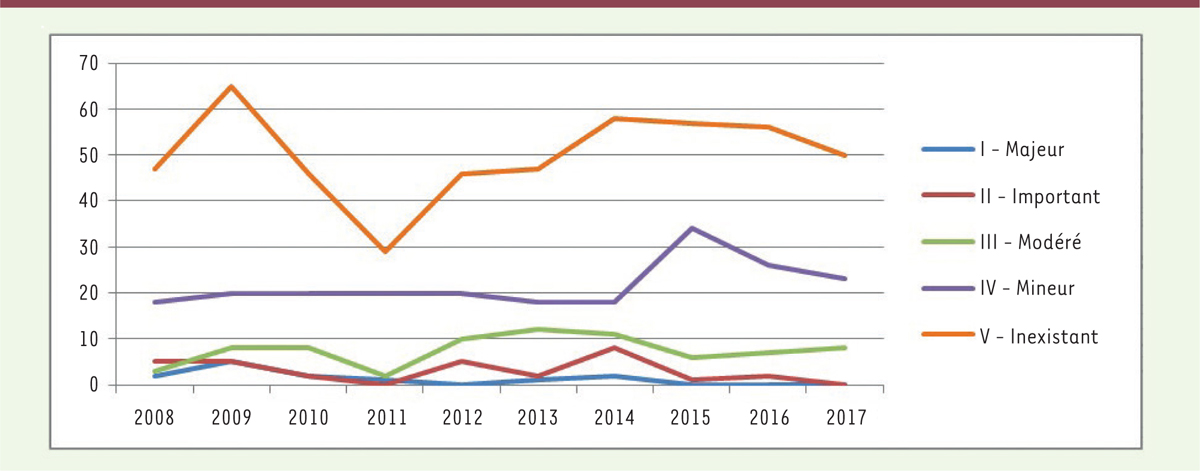
Des paramètres médicaux et économiques L’évaluation de la HAS porte sur deux critères : le service médical rendu (SMR) et
l’amélioration du service médical rendu (ASMR) (Figure 2). Déterminer le premier permet de répondre
à la question : le médicament doit-il être remboursé ? Pour le second,
l’interrogation est différente : le produit améliore-t-il la situation clinique des
patients par rapport aux autres traitements disponibles ? Il s’agit donc d’un
indicateur comparatif, relatif et non absolu. Pour déterminer le SMR d’un nouveau
médicament, la Commission de la transparence prend en compte notamment les
caractéristiques de la maladie (sévérité), l’efficacité et les effets indésirables
du médicament, sa place dans la stratégie thérapeutique, son caractère préventif,
curatif ou symptomatique et son intérêt pour la santé publique. L’analyse de ces
critères permet d’attribuer un SMR important, modéré, faible ou insuffisant. À
chacun correspond un taux de remboursement. Si le SMR est jugé insuffisant, il n’y
aura pas de remboursement. On ne discute même plus du prix et dans la majorité des
cas il ne sera pas réellement commercialisé. Le taux de remboursement sera au
contraire de 65% pour un SMR important, 30% s’il est modéré et 15% s’il est faible.
Cette dégressivité n’a finalement pas vraiment d’impact pour les maladies qui nous
concernent puisqu’elles ouvrent droit à une prise en charge à 100% dans le cadre des
affections longue durée (ALD). L’ASMR est pour sa part cotée de I (amélioration
majeure du service médical rendu) à V (pas d’amélioration). Moins d’un médicament
par an se voit attribuer une ASMR I. La plupart obtiennent une ASMR IV ou V. Cette
cotation a des conséquences en termes de négociation du prix. Pour une ASMR IV par
exemple, le prix pourra être égal à celui des médicaments déjà disponibles auquel le
nouveau médicament a été comparé. Pour une ASMR de I à III, son prix pourra être
supérieur. Par ailleurs, un médicament avec une ASMR I, II ou III, et de façon
exceptionnelle IV, pourra être inscrit sur la « liste en sus ». Ce système
dérogatoire permet aux établissements de santé de financer des traitements
excessivement coûteux. En principe, un établissement est remboursé par la Sécurité
sociale de la prise en charge (notamment médicamenteuse) d’un patient via un
paiement forfaitaire global. C’est le principe de la tarification à l’activité, la
T2A. Or ces forfaits sont très insuffisants pour des médicaments innovants qui, trop
souvent, sont excessivement onéreux. L’inscription de ces médicaments
particulièrement coûteux sur la « liste en sus » ouvre droit pour l’hôpital à un
remboursement intégral de chaque boîte qu’il utilise. Par ailleurs, les médicaments
dépassant un certain chiffre d’affaires font également l’objet d’une autre
évaluation, menée cette fois par la Commission d’évaluation économique et de santé
publique (CEESP) de la HAS. Elle porte sur l’efficience médico-économique des
produits les plus innovants et les plus coûteux, en pratique ceux pour lesquels sont
revendiqués par les industriels une ASMR I, II ou III et qui sont susceptibles
d’avoir un « impact significatif » sur les dépenses de l’Assurance maladie. La CEESP
juge notamment de l’impact budgétaire global de l’arrivée du produit. Elle détermine
également un paramètre assez complexe : le ratio différentiel coût-résultat (RDCR),
qui évalue le coût supplémentaire en euros par année de vie gagnée en bonne santé
(quality adjusted life year ou Qaly). Son avis d’efficience
éclaire les négociations de prix, sans pour autant fixer un seuil absolu.
 | Figure 2. Évolution de la répartition des ASMR attribuées par la
HAS (demandes de première inscription ou
d’inscription dans une nouvelle indication) (source : HAS. Ces données
ne portent pas sur les demandes d’avis ayant fait l’objet d’une
procédure simplifiée). |
|
Le cas particulier des molécules repositionnées
Un médicament qui a déjà obtenu une AMM dans une indication peut s’avérer
présenter un intérêt thérapeutique dans une autre pathologie. Pour cette
nouvelle indication, si une extension d’AMM n’est pas demandée ou pas encore
obtenue, la prescription peut se faire « hors AMM ». En effet, si la loi
stipule que la prescription d’une spécialité pharmaceutique doit toujours
être conforme à son AMM ou à son ATU, elle supporte une dérogation : un
médecin peut prescrire en dehors de son AMM (indication thérapeutique,
posologie, âge) un médicament disponible en France au vu des données
acquises de la science, et sous sa responsabilité. Deux obligations
s’imposent toutefois au prescripteur. La première est d’en informer le
malade. La seconde est d’indiquer sur l’ordonnance que la prescription est
réalisée hors AMM, une exigence de fait très rarement respectée… ce qui
permet d’ailleurs au malade de se faire rembourser. Dans le domaine des
maladies rares, l’Assurance maladie n’a de toute façon que rarement les
moyens de savoir si la molécule a été prescrite hors AMM ou pas… Mais afin
de sécuriser l’utilisation et le remboursement d’un médicament utilisé hors
AMM, un dernier dispositif peut être sollicité. Il s’agit de la
recommandation temporaire d’utilisation (RTU). Comparable à une ATU de
cohorte, la RTU est également délivrée par l’Agence nationale de sécurité
des médicaments et des produits de santé à la demande, par exemple, d’un
Centre de référence maladies rares. Néanmoins, ce dispositif réglementaire
fonctionne mal et s’avère peu adapté à des nombreuses situations dans le
domaine des maladies rares. Il va probablement connaitre des évolutions qui
pourraient faciliter son utilisation.
|
|
Un accès anticipé via l’ATU En amont, avant même l’obtention d’une AMM, un médicament innovant peut bénéficier
d’une autorisation temporaire d’utilisation ou ATU. Géré par l’ANSM, ce possible
accès anticipé au marché ne concerne que les produits destinés à traiter, prévenir
ou diagnostiquer des maladies graves ou rares. Il ne doit pas exister de traitement
approprié déjà disponible sur le marché français. La présomption d’un rapport
efficacité/sécurité positif du nouveau médicament doit être élevée. Ce traitement ne
peut pas être différé sans risque d’une perte de chance importante pour les
patients. Deux dispositifs coexistent, l’ATU nominative (ATUn) et l’ATU de cohorte
(ATUc). La première concerne les situations où une autorisation d’utilisation
anticipée est demandée pour un patient donné, par un médecin et sous sa
responsabilité. Elle s’applique uniquement au cas où cette personne ne peut pas être
incluse dans un essai clinique en cours et qu’il n’existe pas d’ATU de cohorte déjà
en vigueur. Le dispositif de l’ATU nominative a été allégé en septembre 2018 avec la
mise en place notamment d’une demande simplifiée si le médicament figure dans un
référentiel1. Ce dernier recense près de
170 produits disponibles en ATU nominatives et précise, pour chacun d’entre eux, les
critères d’octroi de l’autorisation d’usage anticipé et notamment les indications à
respecter. A partir du moment où le médecin demandeur s’engage à se conformer à ces
critères, il n’a pas à justifier sa demande et obtient rapidement l’ATU nominative.
Sensiblement différente, l’ATU de cohorte est obtenue pour un groupe de patients à
condition que le laboratoire s’engage à déposer sa demande d’AMM dans un délai fixé.
Une fois l’ATUc en vigueur, elle s’applique à tous les patients qui répondent à des
critères médicaux précis sans que le clinicien n’ait à justifier sa prescription
pour chacun de ces patients. Ces critères sont définis dans un protocole
d’utilisation thérapeutique (PTU) et de recueil d’informations. |
Des dispositions financières essentielles Toutes les ATU sont supprimées, de façon automatique, dans un délai de 1 à 2 mois une
fois l’AMM obtenue et ce quelles que soient les indications qu’elle retient. En
France, un relais a été créé afin de couvrir cette phase critique de suppression de
l’accès anticipé : le dispositif post-ATU. Il permet aux patients de continuer à
bénéficier du nouveau médicament, alors même que son prix n’est pas encore fixé.
Lorsque le champ des indications de l’AMM est plus large que celui de l’ATUc, les
indications supplémentaires (ne figurant pas dans l’ATUc) peuvent tout de même
bénéficier d’une prise en charge dans le cadre du dispositif post-ATU, à la
condition toutefois qu’il n’existe pas d’alternative thérapeutique constatée par la
Haute autorité de santé. Point important, pendant toutes les formes d’accès anticipé
au marché (ATUn, ATUc, post-ATU), le laboratoire possède une liberté sur le prix de
son médicament. Il peut le facturer aux établissements de santé ou le leur délivrer
gratuitement. Et lorsque le laboratoire choisit de le faire payer, c’est lui qui
décide du montant de la facture. Cependant, une fois le prix définitif fixé par les
autorités de santé, plusieurs mois ou années plus tard, le « trop perçu » éventuel
du laboratoire en phases d’ATU et de post-ATU devra être remboursé aux
établissements de santé. Dans tous les cas, et contrairement à une idée reçue, quel
que soit le prix facturé par le laboratoire pendant la période des ATU et post-ATU,
les hôpitaux se font rembourser intégralement leurs dépenses par l’Assurance
maladie. Et il n’y a ni ligne budgétaire spécifique, ni plafonnement. Le coût d’un
traitement en accès anticipé ne pèse donc pas sur le budget de l’hôpital. Il peut
avoir à payer, parfois très cher, un médicament mais s’en fait rembourser chaque
boite à 100%. Cette disposition règlementaire doit balayer les réticences de
certains hôpitaux, qui disent ne pas pouvoir dispenser de médicaments en ATU ou en
post-ATU en raison de leurs coûts prohibitifs... Le seul obstacle, réel, à leur
achat est celui de difficultés à faire une avance de trésorerie, une situation rare.
Au bilan, l’achat d’un médicament en ATU ou en post-ATU ne coûte rien à un
établissement de santé. |
Du prix officiel du produit, au coût réel du traitement La phase de négociation du prix entre le laboratoire et l’État ne concerne que les
médicaments très coûteux ou ceux qui seront remboursés en ville. Les produits
utilisés à l’hôpital ne sont pas concernés. Ils font l’objet d’une négociation
directe entre la pharmacie de l’établissement de santé et le laboratoire. Hors ce
cas particulier, la logique est celle d’un prix dit « administré ». Il revient à
l’État de fixer le montant auquel le produit peut être vendu et remboursé, au terme
d’une négociation très cadrée à la fois par la Loi et par des accords
conventionnels. Cette négociation est conduite par une instance interministérielle,
le Comité économique des produits de santé (CEPS), sur la base des évaluations
successives qui jalonnent le parcours réglementaire (le SMR, l’ASMR, l’efficience
médico-économique) et des prix pratiqués dans les pays de référence. Point
important, les industriels n’ont pas à justifier des coûts qu’ils supportent ou ont
supporté pour argumenter le prix qu’ils demandent. Ils n’ont cette obligation ni en
France, ni dans d’autres pays. Pour les médicaments particulièrement innovants et
qui ne possèdent aucune alternative thérapeutique, les négociations de prix sont
excessivement compliquées et souvent très longues, avec des rapports de force
parfois assez disproportionnés. Les négociations de prix et les accords commerciaux
conclus sont toujours secrets. Pour tous les médicaments très coûteux, le prix
facial c’est-à-dire le prix public facturé, payé par l’hôpital et remboursé par
l’Assurance maladie, s’avère de plus en plus souvent supérieur voire très supérieur
au prix final réel une fois le système des remises de fin d’année mis en œuvre. Ces
remises secrètes englobent notamment les accords de « caping »,
systématique au-delà d’un coût de traitement de 50 000 euros par patient et par an.
Un tel accord consiste à se mettre d’accord sur un prix facial. Le CEPS convient
d’acheter à ce prix public le médicament pour X patients, X étant toujours très
inférieur au nombre de patients qui seront effectivement traités. De son côté, le
laboratoire s’engage à traiter tous les patients qui médicalement en auront besoin.
En fin d’année, le laboratoire rembourse tout ce qu’il a facturé au-delà de ce
nombre X. C’est ainsi que, pour tous nos médicaments innovants, le prix payé par
l’établissement de santé pour acheter le médicament, et qui lui est remboursé par
l’Assurance maladie, peut se montrer très supérieur au prix réel, qui est protégé
par le secret des affaires. Personne ne le connaît en dehors du CEPS et de
l’industriel, ce qui complique la compréhension des données connues sur le prix de
tel ou tel médicament. A son arrivée dans les établissements de santé, le médicament
doit encore franchir d’autres étapes, réglementaires ou non. Délivrer un traitement
innovant génère en effet une série de coûts associés qu’ils soient humains,
techniques, organisationnels, de suivi, de registres… Ils ne sont pas pris en compte
par les hôpitaux via des mécanismes aussi automatiques que ceux appliqués à l’achat
du médicament, ce qui peut les mettre en difficulté. Certains établissements
s’organisent pour faire face à ces coûts associés. Ailleurs, des retards ou des
blocages sont introduits par la Commission du médicament et des dispositifs médicaux
stériles (COMEDIMS) de l’hôpital. Elle donne son avis sur le rôle du médicament,
alors même qu’une décision nationale a été prise à ce sujet et que, normalement,
elle devrait s’imposer à tous. Mais dans la réalité, en attendant qu’elle se
réunisse, parfois les patients ne peuvent pas commencer à être traités et ce retard
est difficilement acceptable. Il arrive enfin que des craintes financières, sans
aucun fondement au regard de la réglementation, fassent hésiter certains hôpitaux. «
Le médicament est trop cher. Il ne sera pas remboursé… ». Encore une fois un produit
coûteux, qu’il bénéficie d’une ATU, d’une post-ATU ou soit inscrit sur la liste en
sus, ne pèse pas sur les finances d’un établissement puisqu’il se fait rembourser
intégralement ses achats, à la boîte près. |
Mutualiser les connaissances pour mieux anticiper Sur ce point comme sur de nombreux autres, la complexe et mouvante réglementation
reste mal connue ou mal interprétée par certains acteurs locaux, a
fortiori sur le champ des médicaments vraiment innovants. Dans ce
contexte, le partage et la circulation d’informations réglementaires validées au
sein la filière de santé des maladies rares neuromusculaires Filnemus parait
vivement souhaitable. Le plan national maladies rares III, annoncé au début du mois
de juillet 2018, prévoit la création d’un observatoire des traitements dans chaque
filière de santé maladies rares (action 4.2). Ce pourrait être un outil pour
échanger ces informations réglementaires et pour évaluer les conséquences de la mise
sur le marché des nouveaux médicaments. Espérons que Filnemus puisse être
suffisamment précurseur en ce domaine et mette en place le plus vite possible cette
instance. Nous pourrons alors travailler collectivement à l’arrivée des thérapies
innovantes. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Footnotes |