| |
| Med Sci (Paris). 35(2): 100–102. doi: 10.1051/medsci/2019014.Inuline : la belle et la bête Alexis Bretin1 and Benoit Chassaing1,2* 1Institute for Biomedical Sciences, Georgia State University,
Petit Science Center room 708, 30303Atlanta, GA,
États-Unis 2Neuroscience Institute, Georgia State University, Petit
Science Center room 820, 30303Atlanta, GA,
États-Unis MeSH keywords: Animaux, Carcinome hépatocellulaire, Compléments alimentaires, Microbiome gastro-intestinal, Humains, Inflammation, Inuline, Tumeurs du foie, Souris, induit chimiquement, effets indésirables, effets des médicaments et substances chimiques, physiologie, prévention et contrôle |
L’ère de la nourriture ultra-transformée et des compléments alimentaires Les changements sociétaux associés au développement de l’industrie agroalimentaire
ont conduit à une augmentation de la consommation de nourriture transformée,
généralement riche en sucre et en graisse. Ces évolutions sociétales s’accompagnent
également d’une diminution de la consommation journalière de fruits et de légumes,
naturellement riches en fibres. Ces changements d’habitudes alimentaires ont joué un
rôle majeur dans l’augmentation de la prévalence de l’obésité et des maladies
métaboliques [1-3] (→).
(→) Voir la Nouvelle de B. Chassaing, m/s n° 6-7,
juin-juillet 2015, page 586
L’introduction sur le marché de produits faibles en graisse n’ayant pas permis de
ralentir l’épidémie d’obésité, la mise en place d’approches nutritionnelles
alternatives semble désormais nécessaire. Ainsi, afin de compenser les effets
délétères d’un régime dit « occidentalisé » à faibles teneurs en fibres, la
supplémentation de notre alimentation en fibres dérivées de plantes est désormais
envisagée (et appliquée aux États-Unis). Ces fibres alimentaires peuvent être
classées en deux catégories : les fibres solubles, qui peuvent être fermentées et
métabolisées par les bactéries de notre microbiote intestinal, et les fibres
insolubles qui sont résistantes à la fermentation. La fermentation des fibres
solubles par les bactéries de notre microbiote produit des acides gras à chaîne
courte (AGCC), qui représentent les principaux éléments conférant un bénéfice à
l’hôte. |
Inuline : acides gras à chaîne courte et propriétés anti-inflammatoires Parmi les fibres solubles, l’une des plus étudiée est l’inuline : elle est fermentée
par le microbiote intestinal pour être transformée en AGCC, tels que l’acétate, le
butyrate et le propionate. Ces AGCC servent de source d’énergie pour les cellules
épithéliales intestinales et ils favorisent la différenciation des lymphocytes T
régulateurs anti-inflammatoires [4]. Parmi les effets bénéfiques de l’inuline, il a été récemment
démontré que cette fibre soluble était capable de réduire la prise de poids, de
prévenir le développement d’une inflammation intestinale, et d’améliorer les
dérégulations de la glycémie induite par un régime gras [5]. Dans une étude récemment publiée dans la
revue Cell, nous avons recherché si une alimentation enrichie en
inuline pouvait également prévenir l’inflammation intestinale et les dérégulations
métaboliques observées dans le modèle de souris invalidée pour le gène
TLr5 (Toll-like receptor 5) (ou souris TLR5-KO
[knock out]). Les souris TLR5-KO, qui sont incapables de
reconnaître, au niveau intestinal, la flagelline bactérienne (un PAMP
[pathogen-associated molecular pattern] reconnu par ce
récepteur de l’immunité innée), développent une inflammation à bas bruit associée à
des dérégulations métaboliques [6, 7]. Nous avons
donc étudié les effets potentiellement bénéfiques d’une supplémentation en inuline
dans ce modèle de souris. Les résultats obtenus furent cependant tout autres… |
L’inuline protège contre l’inflammation intestinale, mais entraîne l’apparition
de carcinomes hépatocellulaires Comme observé précédemment à la suite d’un régime alimentaire riche en graisse [5,8], l’inuline permet de réduire l’incidence et la sévérité de
l’obésité des souris TLR5-KO. Cependant, et de manière surprenante, des
investigations plus approfondies ont révélé que le sérum de ces souris, sous régime
enrichi en inuline, présentait une teinte jaune… qui s’est avérée ensuite être due à
des niveaux sanguins élevés de bilirubine. Une augmentation de la bilirubine sérique
pouvant être un marqueur d’une anomalie hépatique (comme c’est le cas dans la
jaunisse du nourrisson), nous nous sommes donc intéressés au foie de ces souris.
Nous avons alors mis en évidence une inflammation hépatique, une augmentation de la
quantité d’acides biliaires dans le sérum, également appelée cholémie, et
l’apparition de carcinomes hépatocellulaires (CHC ou cancer du foie) chez environ
40 % des souris sous régime riche en inuline. Afin de vérifier si le développement des CHC était une conséquence spécifique de
l’inuline, nous avons alors nourri des souris avec d’autres fibres solubles (pectine
et fructo-oligosaccharides) ou insolubles (comme la cellulose). Après 6 mois, nous
avons observé l’apparition de CHC uniquement chez les souris nourries avec un régime
enrichi en fibres solubles. À l’inverse les souris nourries avec un régime enrichi
en fibres insolubles ne présentaient aucun signe de CHC, démontrant ainsi que le
développement de CHC était associé, dans ce modèle, à une consommation de fibres
solubles. |
Inuline et carcinomes hépatocellulaires : rôle central du microbiote
intestinal L’une des conséquences du défaut d’immunité innée des souris TLR5-KO est une
altération du microbiote intestinal, ou dysbiose [6-7, 10] (→).
(→) Voir la Nouvelle de B. Chassaing, m/s n° 4, avril 2015,
page 355
Nous avons donc cherché à comprendre le rôle joué par le microbiote intestinal et son
déséquilibre dans la survenue du cancer du foie observé chez ces souris sous régime
enrichi en inuline. Nous avons pu mettre en évidence une dysbiose du microbiote
intestinal ainsi qu’une augmentation de la charge bactérienne intestinale chez les
souris présentant un niveau élevé de bilirubine. Cette dysbiose était caractérisée
par une diminution de la richesse microbienne (c’est-à-dire le nombre d’espèces
bactériennes présentes), une augmentation des protéobactéries, souvent associées à
un phénotype pro-inflammatoire, ainsi qu’une augmentation des
Clostridia, une classe bactérienne qui comporte de nombreuses
espèces capables de fermenter les fibres solubles en AGCC. Afin d’étudier l’importance du microbiote intestinal dans la survenue de CHC, nous
avons utilisé des souris TLR5-KO axéniques, totalement dépourvues de microbiote, ou
traitées par des antibiotiques. Nous avons alors observé que ces souris ne
développaient pas de CHC sous régime enrichi en inuline, démontrant ainsi que le
microbiote intestinal des souris TLR5-KO était requis pour provoquer l’apparition de
CHC. Nous avons ensuite montré que lorsque les souris TLR5-KO et des souris sauvages
étaient hébergées dans une même cage, les souris sauvages développaient également
des CHC à la suite d’un régime riche en inuline (celles-ci n’en développant pas
lorsqu’elles sont hébergées séparément). Or les souris sont coprophages et la
cohabitation dans une même cage permet la transmission du microbiote entre souris
(TLR5-KO et sauvages). Ces observations montrent donc que la transmission du
microbiote intestinal des souris TLR5-KO permet de rendre les souris sauvages,
recevant un régime riche en inuline, susceptibles au CHC. |
Rôle des bactéries fermentant l’inuline dans le développement de CHC Dans le but de comprendre plus finement les mécanismes expliquant les effets
carcinogènes de l’inuline, une analyse du profil des AGCC a été réalisée. Elle a
montré une augmentation de la production de butyrate chez les souris soumises à un
régime riche en inuline et présentant un fort taux de bilirubine. Afin de comprendre
le rôle du butyrate dans le développement des CHC, nous avons donc traité les souris
avec du butyrate, en absence d’inuline. Une exposition prolongée au butyrate
entraîne une augmentation du taux de bilirubine, une inflammation hépatique ainsi
qu’une augmentation des marqueurs de CHC et de fibrose du foie. Bien qu’aucune
tumeur n’ait été observée, ces données suggèrent que le butyrate joue un rôle dans
la survenue des CHC. Ainsi, l’hypothèse selon laquelle la fermentation de l’inuline
en butyrate promeut le développement de CHC sous-entend que l’inhibition de cette
fermentation pourrait réduire l’incidence des CHC. Afin de tester cette hypothèse,
nous avons utilisé des β-acides qui ont la propriété de bloquer la fermentation
bactérienne. Ce traitement, en plus de diminuer de façon significative les niveaux
de butyrate, s’est avéré suffisant pour prévenir complètement le développement des
CHC. Ces résultats démontrent donc qu’une exposition prolongée aux produits de
fermentation microbienne (butyrate) des fibres alimentaires solubles (inuline)
conduit au développement de CHC chez des souris présentant une dysbiose du
microbiote intestinal. |
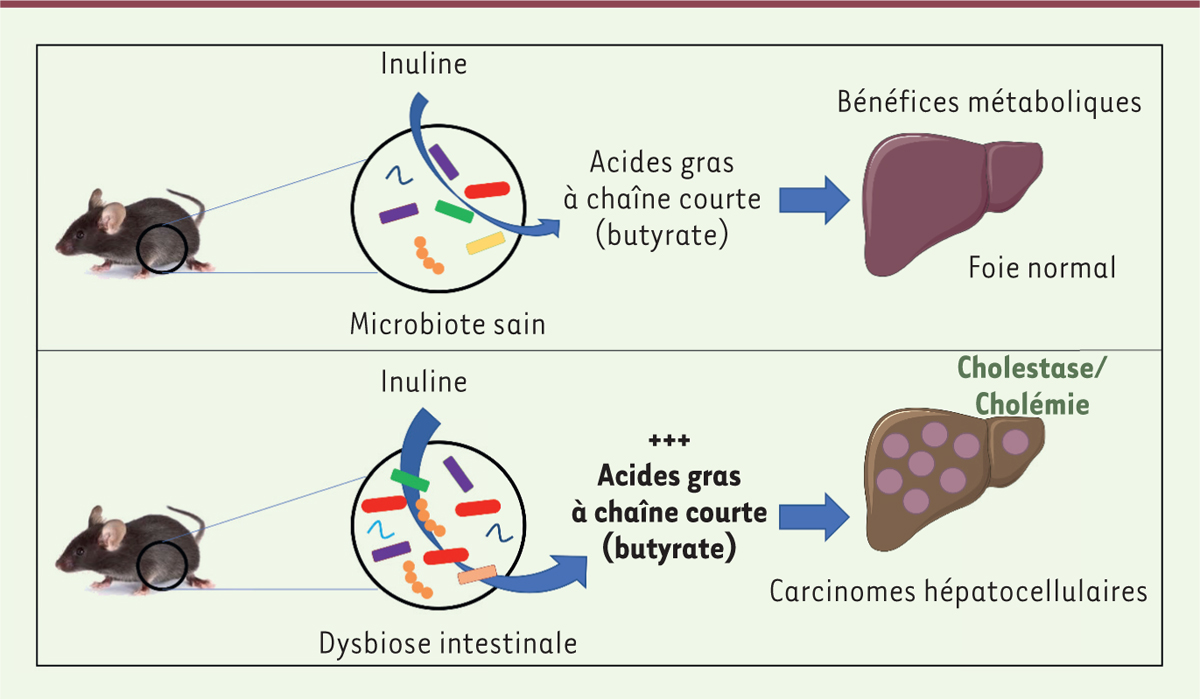
Conclusions et perspectives Dans cet article publié dans la revue Cell [9], nous avons donc montré qu’un régime enrichi
en fibres alimentaires solubles purifiées conduisait au développement de CHC. Ces
cancers hépatiques n’apparaîssaient que chez des souris présentant une dysbiose
intestinale et produisant une quantité accrue de butyrate via la
fermentation de l’inuline (Figure
1). Ces résultats dévoilent un nouveau rôle central joué par
notre microbiote intestinal, et démontrent que la consommation de fibres solubles
purifiées sous forme de compléments alimentaires n’est pas sans conséquences. Suite
à la publication de nombreuses études démontrant les rôles bénéfiques joués par les
fibres solubles, notamment l’inuline, la consommation de ces compléments
alimentaires est en constante augmentation. En France, par exemple, la part de la
population qui consomme quotidiennement des compléments alimentaires est passée de
20 % à près de 30 % entre 2007 et 20151,. Alors
que de nombreuses études ont précédemment montré l’impact bénéfique d’un régime
supplémenté en fibre soluble [5, 11], l’observation de cancer
du foie chez les souris présentant une dysbiose illustre une face plus sombre des
fibres solubles [9]. Ces résultats nécessitent
désormais d’être transposés chez l’homme, mais ils suggèrent néanmoins qu’une partie
de la population, et notamment les personnes atteintes d’une dysbiose de leur
microbiote intestinal, présenteraient un risque de complications majeures suite à la
consommation d’inuline ou d’autres fibres solubles purifiées. Ces résultats
devraient ainsi nous inciter à reconsidérer notre usage des compléments alimentaires
et à favoriser les aliments naturellement riches en fibre solubles. Des études sont
actuellement en cours afin de distinguer les aspects nocifs et bénéfiques de la
fermentation intestinale de l’inuline, et l’impact du microbiote intestinal dans ces
différences, ouvrant ainsi la voie vers un usage plus personnalisé des compléments
alimentaires afin de promouvoir la santé de façon sûre.
 | Figure 1. Représentation schématique de l’implication de l’inuline
dans le développement de carcinomes
hépatocellulaires. L’inuline est une fibre soluble
fermentée par les bactéries présentes au sein du microbiote intestinal
en acides gras à chaîne courte (AGCC). Ces AGCC ont des effets
bénéfiques sur le métabolisme de l’hôte, mais en condition de dysbiose
intestinale, une augmentation de la production des AGCC a été observée.
Cela va alors avoir des effets délétères et conduire, en association
avec la cholestase et la cholémie, à la formation de carcinomes
hépatocellulaires. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Benoit Chassaing remercie la Crohn’s and colitis foundation ainsi que la Kenneth
Rainin foundation pour leur soutien.
|
Footnotes |
1. Chapman-Kiddell
CA,
Davies
PSW,
Gillen
L, et al.
Role of diet in the development of inflammatory bowel
disease . Inflamm Bowel Dis.
2010; ; 16 :
:137.–151. 2. Bretin
A,
Gewirtz
AT,
Chassaing
B. Microbiota and
metabolism: what’s new in 2018? . Am J Physiol
Endocrinol Metab.
2018; ; 315 :
:E1.–E6. 3. Chassaing
B. Rôle de certains
additifs alimentaires dans l’apparition d’une inflammation intestinale et du
syndrome métabolique chez la souris . Med Sci
(Paris).
2015;; 31 :
:586.–8. 4. Smith
PM,
Howitt
MR,
Panikov
N, et al.
The microbial metabolites, short-chain fatty acids, regulate
colonic Treg cell homeostasis . Science.
2013; ; 341 :
:569.–573. 5. Zou
J,
Chassaing
B,
Singh
V, et al.
Fiber-mediated nourishment of gut microbiota protects against
diet-induced obesity by restoring IL-22-mediated colonic
health . Cell Host Microbe.
2018; ; 23 :
:41.–53. 6. Vijay-Kumar
M,
Aitken
JD,
Carvalho
FA, et al.
Metabolic syndrome and altered gut microbiota in mice lacking
Toll-like receptor 5 . Science.
2010; ; 328 :
:228.–231. 7. Chassaing
B,
Ley
RE,
Gewirtz
AT. Intestinal
epithelial cell toll-like receptor 5 regulates the intestinal microbiota to
prevent low-grade inflammation and metabolic syndrome in
mice . Gastroenterology.
2014; ; 147 :
:1363.–1377. 8. Schroeder
BO,
Birchenough
GMH,
Ståhlman
M, et al.
Bifidobacteria or fiber protects against diet-induced
microbiota-mediated colonic mucus deterioration .
Cell Host Microbe.
2018; ; 23 :
:27.–40. 9. Singh
V,
Yeoh
BS,
Chassaing
B, et al.
Dysregulated microbial fermentation of soluble fiber induces
cholestatic liver cancer . Cell.
2018; ; 175 :
:679.–694. 10. Le
Chassaing B..
microbiote intestinal, un acteur de la réponse immunitaire
adaptative antivirale ? . Med Sci (Paris).
2015; ; 31 :
:355.–357. 11. Chassaing
B,
Miles-Brown
J,
Pellizzon
M, et al.
Lack of soluble fiber drives diet-induced adiposity in
mice . Am J Physiol Gastrointest Liver
Physiol.
2015; ; 309 :
:G528.–G541. |