| |
| Med Sci (Paris). 35(2): 118–122. doi: 10.1051/medsci/2019020.La sous-unité catalytique de
l’anaphase-promoting complex APC11 est
impliquée dans la progression tumorale des cancers colorectaux présentant une
instabilité chromosomique Caroline Moyret-Lalle,1,2,3,4,5* Youenn Drouet,6,7 and Alain Puisieux1,2,3,4,5 1Inserm U1052, CNRS UMR 5286, Cancer research center of
Lyon, Lyon,
F-69008,
France 2Centre Léon Bérard, 28, rue Laënnec, Lyon, F-69008, France 3Université Lyon1, ISPB, Lyon, F-69008, France 4Université de Lyon, Lyon, F-69622, France 5LabEx DEVweCAN, Université de Lyon, F-69000Lyon,
France 6Centre Léon Bérard, Département de santé publique,
28, rue Laënnec,
Lyon, F-69008, France 7CNRS UMR 5558, Laboratoire de biométrie et biologie
évolutive, Lyon, F-69373, France MeSH keywords: Séquence d'acides aminés, Sous-unité APC11 du complexe promoteur de l'anaphase, Domaine catalytique, Instabilité des chromosomes, Tumeurs colorectales, Évolution de la maladie, Humains, Ubiquitin-protein ligases, composition chimique, physiologie, génétique, anatomopathologie |
Cancers colorectaux et instabilités génétiques Les cancers colorectaux (CRC) sont parmi les cancers les plus fréquents dans le monde
et sont au deuxième rang de la mortalité par cancer en France. Pour optimiser la
prise en charge des patients atteints de CRC, plusieurs classifications moléculaires
ont été établies depuis une dizaine d’années. Parmi les marqueurs moléculaires
retenus, on retrouve notamment l’instabilité génétique. Il existe deux types
d’instabilité génétique, l’instabilité génomique comprenant l’instabilité
microsatellitaire (MSI) et l’hypermutabilité, présente dans 15 % des CRC, et
l’instabilité chromosomique (CIN) retrouvée dans 85 % des CRC. En 2015, un
consortium international a proposé une classification des CRC en 4 groupes distincts
nommés CMS (consensus molecular subtypes) [1]. Dans le groupe CMS1 (représentant 14 % des
CRC), l’instabilité MSI est prédominante, ainsi que le phénotype d’hyperméthylation
des ilôts CpG des promoteurs (CIMP+, CpG Island methylator
phenotype) et d’infiltration immunitaire. Les groupes CMS2 (37 % des
CRC) et CMS4 (23 % des CRC) sont enrichis en tumeurs présentant une forte
instabilité CIN et le groupe CMS3 (13 % des CRC) présente des tumeurs à la fois
MSI+ et MSI-, CIMP-, qui sont relativement
stables au niveau chromosomique [1].
Récemment, une nouvelle étude a permis de confirmer le premier sous-type CMS1 et de
montrer une plus grande hétérogénéité des sous-types CMS2 et CMS4 présentant un
génotype CIN ; en effet, certaines tumeurs présentent un génotype stable avec une
hyperméthylation de l’ADN et des mutations dans les gènes K-ras (Kirsten rat
sarcoma viral oncogene homolog), SOX9 (Sex-determining
region-related HMG-box gene 9) et PCBP1 (beta-subunit
acetyl/propionyl-CoA carboxylase) [2]. Au cours de la progression tumorale, dans
une tumeur colorectale de type CIMP+, une mutation du gène
B-RAF (B-Raf proto-oncogene, serine/threonine
kinase) sera préférentiellement associée à un infiltrat immunitaire,
alors qu’une mutation du gène suppresseur de tumeur APC
(adenomatous polyposis coli) sera associée à une mutation du
gène suppresseur de tumeur TP53 (tumor protein 53)
dans une tumeur présentant de l’instabilité CIN (Figure 1). Le doublement du génome (dû à une
endo-reduplication ou à un défaut de division), survenant très précocement au cours
de la transformation tumorale, peut être l’événement initiateur de l’apparition de
l’instabilité CIN dans un grand nombre de cancers et en particulier dans les CRC
[3]. Une mutation dans le
gène PIK3CA (phosphatidylinositol-3-kinase alpha de classe
I), mutation fréquente dans les tumeurs CRC
CIN+, confère une tolérance à la tétraploïdisation et ceci même dans
des cellules dont l’axe suppresseur de tumeur p53-p21 (inhibiteur de kinases
cycline-dépendantes) est fonctionnel. L’instabilité CIN peut également être générée
et/ou amplifiée par des altérations d’acteurs clés de la mitose [4].
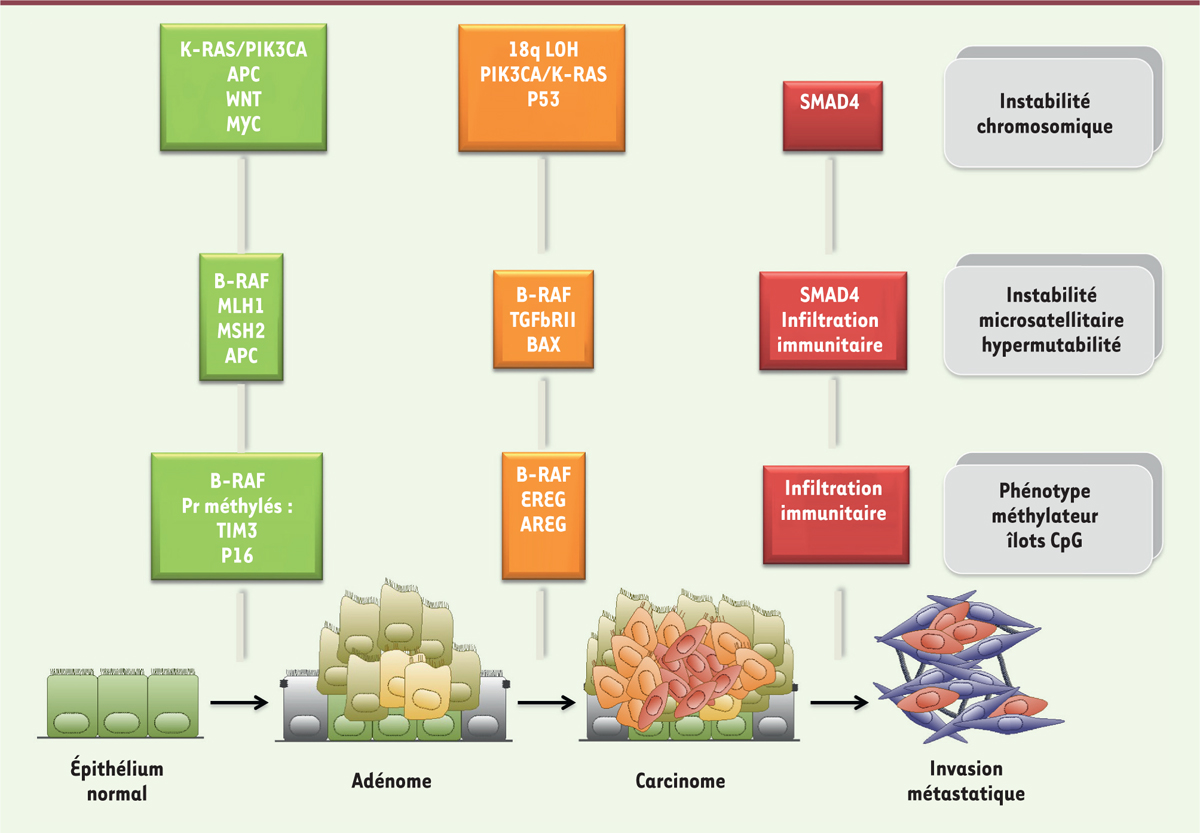
 | Figure 1. Événements génétiques et épigénétiques survenant au cours
de la progression tumorale des cancers
colorectaux. Événements génétiques et épigénétiques
associés à la progression tumorale des cancers colorectaux présentant
une forte instabilité chromosomique. Distinction entre ceux présentant
une instabilité nucléotidique (chromosomique ou microsatellitaire) et
ceux présentant une forte méthylation des îlots CpG dans les régions
promotrices des gènes. En vert sont représentées les protéines
initiatrices, en orange celles impliquées dans la transformation en
adénocarcinome et en rouge les facteurs et processus de l’invasion
métastatique. APC : anaphase-promoting complex ; AREG :
amphiréguline ; B-RAF proto-oncogene, serine/threonine
kinase ; EREG : épiréguline ; K-ras : Kirsten rat
sarcoma viral oncogene homolog ; MYC : protooncogène ;
MLH1 : MutL homolog 1, MSH2 : MutS protein
homolog 2 ; PIK3CA :
phosphatidylinositol-4,5-bisphosphate 3-kinase catalytic
subunit alpha ; P16 : protéine suppresseur de tumeur,
inhibiteur des kinases cdk4 et cdk6 ; p53 tumor protein
53 ; SMAD4 : mothers against decapentaplegic
homolog 4 ; TGFbRII : transforming growth
factor b-receptor 2 ; TIM3 :
T-cell immunoglobulin and mucin-domain
containing-3 ; Wnt : voie de signalisation impliquant la β
caténine ; 18q LOH : perte du chromosome 18q. |
|
Rôle du complexe E3-ubiquitine ligase de l’anaphase promoting complex dans
l’instabilité chromosomique Chaque phase du cycle cellulaire est contrôlée par un couple formé d’une kinase
appelée cdk (cyclin-dependent kinase) et d’une protéine activatrice
appelée cycline. L’oscillation des protéines cyclines, synthétisées puis dégradées
au cours du cycle cellulaire, permet ainsi le passage d’une phase à l’autre par
l’activation puis l’inhibition de la kinase cdk. Deux complexes E3-ubiquitine ligase
jouent un rôle essentiel dans la protéolyse des cyclines. Le complexe SCF
(Skp1/Cdc53/F box protein) orchestre la dégradation des
cyclines des phases G1 et S alors que le complexe APC/C (anaphase-promoting
complex/cyclosome) va ubiquitinyler les cyclines mitotiques dont la
cycline B1 provoquant ainsi la sortie du cycle cellulaire par inactivation du couple
cdk1-cycline B1 [5]
(→).
(→) Voir la Nouvelle de P. Colombe et al.,
m/s n° 8-9, août-septembre 2009, page 673
Le complexe multi-enzymatique APC/C est l’acteur clé de la transition
métaphase-anaphase en induisant la protéolyse des protéines sécurine qui ont pour
effet d’activer les séparases, des cystéine protéases responsables du clivage des
cohésines, un signal initiateur de la séparation des chromatides sœurs en anaphase.
Les cohésines sont des complexes protéiques qui assurent l’appariement des
chromatides sœurs condensées sur la plaque métaphasique. Le déroulement de la
pro-métaphase et de la métaphase peut être interrompu lorsqu’une chromatide sœur est
non attachée au fuseau mitotique ou en présence d’un défaut de tension des
microtubules sur les kinétochores. Le point de contrôle du fuseau mitotique va alors
être activé (nommé SAC, spindle assembly checkpoint) et le complexe
MCC (mitotic checkpoint complex) composé, entre autres, des
sous-unités Bub1 (budding uninhibited by benzimidazole 1), BubR1
(budding uninhibited by benzimidazole-related 1), Bub3 et Mad2
(mitotic arrest deficient 2), va empêcher l’activation de
l’APC/C par séquestration de sa sous-unité activatrice Cdc20 (cell-division
cycle). Lorsqu’un des composants du MCC est déficient, la mitose se
poursuit anormalement même en présence d’agents thérapeutiques dépolymérisateurs des
microtubules et peut entraîner l’apparition d’une instabilité CIN dans les cellules
tumorales, qui conduira à une résistance au traitement [6] (→).
(→) Voir la Synthèse de A. Castro et al.,
m/s n° 3, mars 2003, page 309
APC/C possède d’autres substrats protéiques, notamment la protéine à boîte F Skp2
(S-phase kinase-associated protein 2), élément important de
l’autre complexe E3-ubiquitine ligase du cycle cellulaire, SCF (Skp, cullin,
F-box containing complex). APC/C est un très large complexe enzymatique dans lequel ont été identifiés trois
domaines : le domaine cœur portant l’activité catalytique, constitué de trois
sous-unités, APC2, 10 et 11, qui présente un domaine RING-H21, capable de fixer les unités d’ubiquitine aux substrats ; un
deuxième domaine formant la plateforme sur laquelle les cibles protéiques viennent
se positionner, constitué lui-même de trois sous-unités, APC1, 4, et 5 ; et, enfin,
un bras riche en répétitions de tétratricopeptides2 (TPR) composé des quatre sous-unités APC3, 6, 7 et 8. Il a été montré
in vitro qu’un hétérodimère composé des sous-unités APC2 et
APC11 était suffisant pour catalyser l’ubiquitinylation de la cycline B1 et de la
sécurine. Les deux sous-unités activatrices interagissent à tour de rôle avec le
complexe ; Cdc20 active APC/C en mitose et Cdh1 en phase G1. L’activité du complexe
et le recrutement des substrats sont dépendants de la sous-unité activatrice liée au
complexe. Des dérégulations d’acteurs clés de la mitose ont été associées à de l’instabilité
CIN dans des cancers colorectaux. Une expression anormale de cycline B1 ou de
sécurine est considérée comme un risque majeur de polyploïdie. La surexpression de
la sous-unité activatrice Cdc20 est également associée à de l’instabilité CIN dans
de nombreux cancers dont les CRC [7]. Une mutation germinale dans le gène BUBR1
prédispose au cancer et génère de l’instabilité CIN [4]. Notre laboratoire a été le premier à identifier des mutations dans
des gènes codant différentes sous-unités du complexe APC/C dans des lignées
tumorales de différentes origines et notamment dans des lignées colorectales [8]. Récemment, une étude a
montré que la très grande majorité des mutations faux-sens retrouvées dans des gènes
codant des sous-unités APC/C affectent des sous-unités structurales, quand seulement
3 sur 132 (2 %) affectent le gène APC11 [9]. |
Une analyse intégrative révèle APC11, la sous-unité catalytique du complexe
APC/C, comme un marqueur prédictif probable de l’évolution des cancers colorectaux
en lien avec l’instabilité chromosomique L’exploration des banques de données publiques trancriptomiques et génomiques de
lignées cellulaires tumorales (CCLE, cancer cell line encyclopedia)
et de tumeurs primaires (TCGA, the cancer genome atlas) a permis de
mettre en évidence une très forte expression en ARN messagers (ARNm) de la
sous-unité catalytique APC11 corrélée à une instabilité chromosomique. Cette
surexpression est également associée à la maladie résiduelle. L’analyse des niveaux
d’ARNm des deux autres sous-unités du domaine catalytique, APC10 et APC2, n’a pas
permis de mettre en évidence une corrélation statistiquement significative de leur
expression avec l’instabilité CIN. Ainsi, parmi les trois sous-unités catalytiques
d’APC/C, seule une dérégulation d’APC11 est associée à une instabilité chromosomique
et cette association est indépendante du statut mutationnel du gène
TP53 [10]. Dans une approche génomique intégrative, notre équipe a également analysé par
immuno-histochimie, sur une cohorte de patients atteints de CRC, l’expression de la
protéine APC11 ainsi que celle de 7 marqueurs protéiques connus pour être impliqués
dans des tumeurs CRC (E-cadhérine, Ki67 [marqueur de prolifération], MLH1
[MutL homolog 1], MSH2 [MutS protein homolog
2], DCC [deleted in colorectal cancer)], P53 et BCL2
[B-cell lymphoma 2]) [10]. Par des modèles de régression logistique et de Cox multivarié3,
,
4, et une analyse factorielle des
correspondances multiples (AFCM), nous avons pu montrer qu’une surexpression de la
protéine APC11 était probablement un nouveau facteur de mauvais pronostic,
indépendant des autres marqueurs protéiques étudiés. L’expression de la protéine
APC11 ne semble pas non plus associée à un sous-type particulier de la
classification CMS [10]. |
Dérégulation d’APC11 dans les CRC et perspectives thérapeutiques L’instabilité CIN a été associée depuis longtemps à la résistance au traitement. Ceci
peut s’expliquer par le fait que l’instabilité CIN permet le maintien dans la
population tumorale de différents caryotypes conférant, après traitement, un
avantage sélectif. Par ailleurs, l’efficacité de traitements antimitotiques, tels
que le paclitaxel5,, est augmentée dans des
tumeurs présentant un taux élevé d’instabilité CIN. Ces deux observations sont
contradictoires seulement en apparence. En effet, au cours de la progression
tumorale, un équilibre doit être atteint pour limiter l’accumulation d’instabilité
CIN qui, si elle est trop importante peut entraîner la mort de la cellule. Des
altérations limitant la propagation de l’instabilité CIN doivent être sélectionnées,
au cours de la progression tumorale, afin d’optimiser la survie des cellules
tumorales [3]. Il est possible d’émettre
l’hypothèse que dans un contexte d’activation prolongée du point de contrôle du
fuseau mitotique, par exemple lorsque la protéine BubR1 est surexprimée, par
compensation, une surexpression d’APC11 permettrait d’assurer le déroulement normal
de la mitose au cours de la progression tumorale (Figure 2). Par conséquent, un inhibiteur d’APC/C en
combinaison avec un antimitotique pourrait réduire le taux de survie des cellules
aneuploïdes et représenter ainsi une stratégie thérapeutique pour des CRC présentant
une instabilité de type CIN.
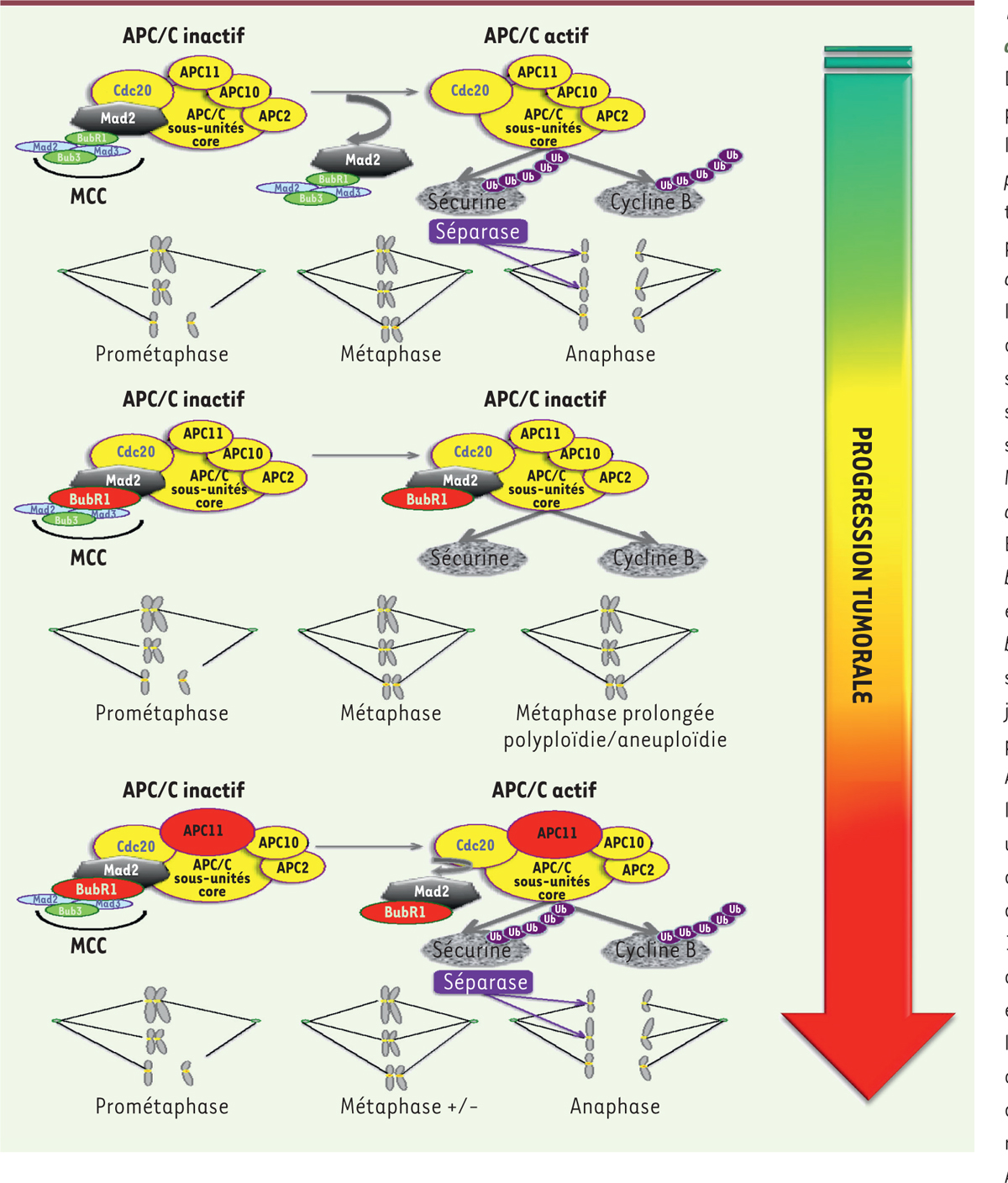
 | Figure 2. Facteurs contrôlant le déclenchement de
l’anaphase. Dans les cellules normales, en
prométaphase et en métaphase le complexe APC/C (anaphase
promoting-complex) est maintenu dans un statut inactif par
le complexe MCC (mItotic checkpoint complex) jusqu’à
l’alignement et l’attachement de toutes les chromatides sœurs sur la
plaque métaphasique. La sous-unité Cdc20 est séquestrée par le complexe
MCC (Mad2 [mitotic arrest deficient 2], Mad1, Mad3/
BudR1 [budding uninhibited by benzimidazole-related 1],
et Bub3 [budding uninhibited by benzimidazole 3]),
inhibant sa capacité à activer l’APC/C, jusqu’à la transition
métaphase-anaphase. Le complexe APC/C est alors activé par la libération
de Cdc20, et va ainsi ubiquitinyler, via le complexe
catalytique cœur (constitué des sous-unités APC2, 10 et 11), la sécurine
qui sera dégradée par le protéasome et qui est associée à une protéase,
la séparase. La séparase va alors cliver le complexe des cohésines,
permettant la séparation des chromatides sœurs. APC/C ubiquitinyle
également la cycline B pour permettre la sortie de mitose. Dans les
premières étapes de la progression tumorale, une sur-activation du SAC
(spindle-activated checkpoint) par surexpression
d’un des facteurs du MCC, comme la kinase BubR1 retrouvée surexprimée
dans des CRC, peut entraîner un arrêt prolongé en métaphase qui conduira
la cellule vers une catastrophe mitotique et la mort, ou vers une
endoreduplication, une polyploïdie et une instabilité de type CIN
(chromosomal instability). Des variations dans la
durée de la mitose peuvent potentiellement compromettre l’attachement et
la séparation des chromatides sœurs. Un faible niveau de CIN est mieux
toléré par les cellules et représente un moteur de la progression
tumorale, tandis qu’un niveau élevé peut être délétère pour celles-ci.
Afin de stabiliser ou d’atténuer l’accumulation de CIN, processus
dynamique au cours de la progression tumorale, des altérations
compensant une CIN excessive sont sélectionnées, comme la surexpression
d’APC11. En exploitant la fonction suppresseur de tumeur d’une très
forte instabilité CIN, l’utilisation d’un inhibiteur d’APC/C
contribuerait à la cytotoxicité d’un poison du fuseau tel que le
paclitaxel. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1. Guinney
J,
Dienstmann
R,
Wang
X, et al.
The consensus molecular subtypes of colorectal
cancer . Nat Med.
2015; ; 21 :
:1350.–1356. 2. Yang
L,
Nilay
S S,
Toshinori
H, et al.
Comparative molecular analysis of gastrointestinal
adenocarcinomas . Cancer Cell.
2018; ; 33 :
:721.–735. 3. Sansregret
L,
Vanhaesebroeck
B,
Swanton
C. Determinants and
clinical implications of chromosomal instability in cancer .
Nat Rev Clin Oncol.
2018; ; 15 :
:139.–150. 4. Sansregret
L,
Swanton
C. The role of
aneuploidy in cancer evolution . Cold Spring Harb
Perspect Med.
2017;; 7 : pii :
a028373.. 5. Coulombe
P,
Rodier
G,
Meloche
S. Un nouvel axe du
mal tumoral ? . Med Sci (Paris).
2009; ; 25 :
:673.–675. 6. Castro
A,
Vigneron
S,
Lorca
T,
Labbé
JC. La mitose sous
surveillance. Med Sci (Paris).
2003; ; 19 :
:309.–317. 7. Gayyed
MF,
El-Maqsoud
NM,
Tawfiek
ER, et al.
A comprehensive analysis of CDC20 overexpression in common
malignant tumors from multiple organs: its correlation with tumor grade and
stage . Tumour Biol.
2016; ; 37 :
:749.–762. 8. Wang
Q,
Moyret-Lalle
C,
Couzon
F, et al.
Alterations of anaphase-promoting complex genes in human colon
cancer cells . Oncogene.
2003; ; 22 :
:1486.–1490. 9. Sansregret
L,
Patterson
JO,
Dewhurst
S, et al.
APC/C dysfunction limits excessive cancer chromosomal
instability . Cancer Discov.
2017; ; 7 :
:218.–233. 10. Drouet
Y,
Treilleux
I,
Viari
A, et al.
Integrated analysis highlights APC11 protein expression as a
likely new independent predictive marker for colorectal
cancer . Sci Rep.
2018; ; 8 : :7386.. |