| |
| Med Sci (Paris). 35(2): 132–137. doi: 10.1051/medsci/2019002.VEGF-C et vaisseaux lymphatiques Une épée à double tranchant dans le développement tumoral et
la dissémination métastatique Papa Diogop Ndiaye1 and Gilles Pagès1,2* 1Université Côte d’Azur, Institut de recherche sur le cancer
et le vieillissement de Nice, CNRS UMR 7284 ; Inserm U1081, Centre Antoine
Lacassagne, 33, avenue de
Valombrose, 06189Nice,
France 2Centre scientifique de Monaco, Département de biologie
médicale, 8, quai Antoine
Ier, MC-98000Monaco, Principauté
de Monaco |
Vignette (Photo © Inserm - Gérard Alonso). L’identification de marqueurs spécifiques des vaisseaux lymphatiques durant ce dernier
quart de siècle a provoqué un regain d’intérêt dans l’étude du système lymphatique. Ce
système et son rôle en conditions physiologiques et pathologiques sont ainsi de mieux en
mieux compris. Le manque de marqueurs fonctionnels de ces vaisseaux avait conduit
jusqu’à récemment au dogme stipulant l’absence de ces vaisseaux au sein de la tumeur
[1]. Cependant, la
découverte, en 2013, de « signatures fonctionnelles » a suggéré qu’ils étaient en fait
présents à ce niveau, mais collapsés en raison de la pression intra-tumorale et, par
conséquent, non fonctionnels [2].
Le réseau lymphatique péri-tumoral subit certaines modifications au cours de la
tumorigenèse, notamment un élargissement des vaisseaux induit par la sécrétion de VEGF
(vascular endothelial growth factor) C et D, deux facteurs de
croissance majeurs des cellules endothéliales lymphatiques (CEL). Nous examinerons dans
cette revue, le rôle du VEGF-C, de son récepteur VEGFR3, et du système lymphatique,
depuis les phases précoces du développement tumoral jusqu’aux phases tardives de
dissémination métastatique. |
L’origine du système lymphatique Deux théories expliquent l’origine embryonnaire du système lymphatique. La première
repose sur des expériences réalisées en 1902 par l’anatomiste Florence Sabin qui,
par des injections d’encre de chine dans des embryons de porc, avait observé que les
vaisseaux lymphatiques bourgeonnaient à partir de la veine cardinale1 [3]. La seconde, repose sur l’observation, en 1910, par Georges
Huntington et Charles F. W. McClure, qui étudiaient des coupes d’embryons de chat
par un système de reconstruction en trois dimensions, que les vaisseaux lymphatiques
provenaient de la différenciation de cellules mésenchymateuses [4]. Ces deux théories, de Sabin et de
Huntington/McClure, appelées respectivement centrifuge et centripète, se sont
affrontées durant près de 100 ans avant que les progrès de la génétique, de la
biologie moléculaire et de l’imagerie les réconcilient finalement. L’identification du gène PROX1 (prospero homeodomain
1), exprimé dans certaines cellules endothéliales de la veine cardinale
[5], a en effet permis de
valider la théorie de F. Sabin : les cellules exprimant PROX1
forment le bourgeon qui donne naissance au sac lymphatique primitif puis au réseau
lymphatique. PROX1 code un facteur de transcription dont
l’expression est essentielle à la différenciation des CEL et son invalidation
entraîne une létalité embryonnaire chez la souris en raison d’un défaut de
spécification de ces cellules [6]. Les CEL ont une origine différentes selon l’organisme considéré :
elles proviennent de cellules endothéliales veineuses et de lymphangioblastes dans
des embryons de poulets [7]
ou de grenouilles [8], ou de
veines primitives chez le poisson zèbre [9]. Un suivi des cellules par une méthode de « lineage
tracing » a été réalisé dans un modèle de souris génétiquement
modifiées. Le traçage des cellules modifiées exprimant LacZ, associé à un marquage
par un anticorps spécifique de la protéine PROX1, a permis de révéler l’existence
chez cet animal, d’un petit nombre de CEL exprimant PROX1 dans et à proximité de la
veine cardinale dès le jour 9,5 du développement embryonnaire (E9,5) [10]. Les cellules
endothéliales de la veine cardinale antérieure sont, dans ce cas, probablement la
source la plus précoce de progéniteurs de CEL exprimant PROX1. Elles contribuent au
développement des sacs lymphatiques et des vaisseaux lymphatiques périphériques.
Quelques CEL persistent cependant au niveau de la veine, afin de constituer les
valves qui empêcheront le reflux vers le sang [11]. La théorie de F. Sabin sur l’origine
embryonnaire des vaisseaux lymphatiques est désormais bien établie [50] (→).
(→) Voir la Nouvelle de T. Jaffredo, m/s n° 6-7, juin-juillet
2008, page 567
Mais la participation de cellules d’une autre origine n’est pas à exclure, notamment
la transdifférenciation de leucocytes ou de macrophages en CEL, chez l’adulte [12]. L’expression de PROX1
dépend du facteur de transcription SOX18 (SRY box 18), détectable
avant PROX1 dans une sous-population de cellules endothéliales de la veine
cardinale. L’invalidation du gène Sox18 provoque des œdèmes
sous-cutanés et est létale à E14,5 [13]. Le facteur COUP-TFII (chicken ovalbumin upstream
promoter transcription factor) est également exprimé dans les cellules
endothéliales veineuses à E8,5 [14] et dans les CEL durant l’embryogenèse et à l’âge adulte. Son
invalidation provoque un défaut de formation des vaisseaux lymphatiques durant le
développement embryonnaire [15]. Il régule l’expression du récepteur du VEGF, VEGFR3 [16] dans les cellules
endothéliales des vaisseaux sanguins (E10, 5) [17], une expression qui sera ensuite restreinte
aux CEL [5]. VEGFR3 dépend également de PROX1
qui, lui-même, dépend de VEGFR3 afin de maintenir l’identité et le nombre de
cellules progénitrices de CEL [18]. Le ligand le mieux caractérisé de VEGFR3 est le VEGF-C, qui est
produit à E10,5 par les cellules mésenchymateuses proches des CEL bourgeonnantes qui
expriment le récepteur [19]. L’invalidation de VEGF-C n’a pas d’effet sur PROX1 et donc sur la
différenciation des CEL. Néanmoins, en l’absence de VEGF-C, les CEL ne bourgeonnent
pas et ne forment pas de sac lymphatique primitif [19]. Le rôle du VEGF-D est moins bien compris. Chez le poisson zèbre, il
régule l’angiogenèse et la lymphangiogenèse au cours du développement [20]. Chez la souris, des
expériences de double invalidation des gènes Vegfd et
Sox18 suggèrent qu’ils contrôlent le développement vasculaire
en modulant l’activité de SOX18 [21]. CCBE1 (collagen- and calcium-binding EGF domain 1)
est nécessaire à la maturation et à l’activation du VEGF-C [22]. L’invalidation de son gène induit une
diminution, au niveau de la veine cardinale, des CEL qui expriment PROX1 et LYVE-1
(lymphatic vessel endothelial hyaluronan receptor-1) avec pour
conséquence une mauvaise vascularisation lymphatique, de sévères œdèmes et une
mortalité in utéro chez la souris [23]. LYVE-1 est exprimé entre E9,5 et E10,5 au
niveau de l’endothélium veineux embryonnaire [24], avant PROX1 [5]. Il est également présent dans une sous-population de
macrophages et de cellules de la rate. Son invalidation n’empêche pas le
développement du réseau lymphatique [25]. La podoplanine (PDPN) est produite par les cellules
fibroblastiques réticulaires des ganglions lymphatiques et par les CEL [26]. Son expression débute à
E10,5 dans les cellules exprimant PROX1 qui migrent hors de la veine cardinale
[27]. PDPN se situe en
aval de PROX1 dans la cascade de signalisation induisant le développement du système
lymphatique : des sites de fixation fonctionnels de PROX1 ont en effet été
identifiés dans le promoteur du gène Pdpn [28]. PDPN est nécessaire au processus
d’initiation et de maintien de la séparation des vaisseaux sanguins et lymphatiques,
un processus auquel participe également CLEC2 (C-type lectin domain family
2), un récepteur présent à la surface des plaquettes, et qui est à
l’origine de leur agrégation, qui permet la séparation entre le sang et la lymphe
[29]. L’invalidation de
son gène provoque ainsi un mélange de sang et de lymphe dans l’embryon de souris et
chez la souris adulte [30]. |
Le réseau lymphatique dans les tumeurs Dans le microenvironnement tumoral, les vaisseaux lymphatiques proviennent
essentiellement de vaisseaux préexistants [31]. Sous l’action du VEGF-C, et/ou du VEGF-D, produits par les
cellules tumorales, les cellules immunitaires et les fibroblastes du
microenvironnement tumoral, de nouveaux branchements s’établissent, qui colonisent
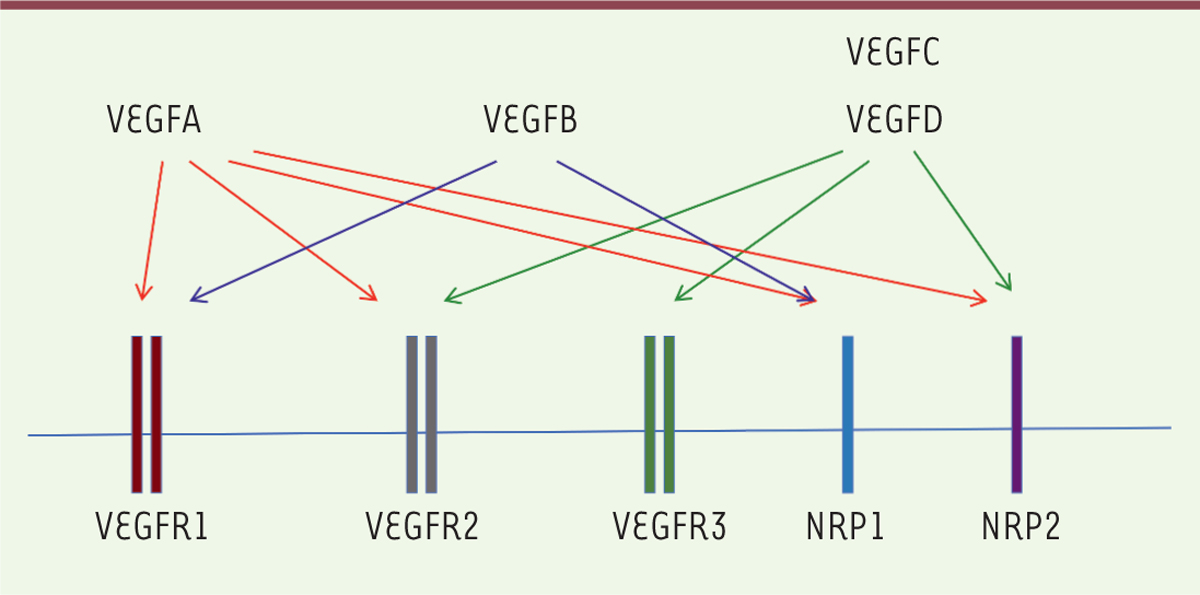
la périphérie de la tumeur [32]. Ces facteurs induisent la prolifération et la migration des CEL en
stimulant l’expression de VEGFR3 (Figure
1), conduisant ainsi à la formation de nouveaux vaisseaux
lymphatiques et au développement du système lymphatique. Au cours du développement
tumoral, le système lymphatique participe aux échanges entre les cellules tumorales
et le sang : du plasma s’infiltre constamment dans le milieu interstitiel,
constituant ainsi la lymphe qui assure le transport des nutriments jusqu’aux
cellules. Ces échanges sont bidirectionnels. Ils permettent l’évacuation des déchets
métaboliques. Ce processus est indispensable à la croissance des cellules tumorales
afin d’éliminer les toxines qu’elles produisent au cours de leur importante
prolifération. Ces déchets seront ainsi canalisés par le réseau lymphatique avant
leur élimination via la circulation sanguine [33]. La prolifération et la migration
des CEL, qui contribuent au développement du réseau lymphatique, favorisent le
développement des tumeurs [34]. Cette prolifération des CEL est également associée à la dilatation
des vaisseaux lymphatiques que l’on observe dans plusieurs cancers (Figure 2) [35].
 | Figure 1. Les membres de la famille du VEGF, leurs récepteurs et corécepteurs. |
La prostaglandine E2 et ses récepteurs EP2, EP3 et EP4, qui sont exprimés par les
cellules tumorales et les cellules immunitaires, forment un axe de signalisation qui
stimule l’expression du VEGF-C et promeut la lymphangiogenèse et les métastases
[36, 37]. Cette voie de signalisation et le
système lymphatique tumoral sont donc principalement associés à une progression
tumorale. |
Le VEGF-C, la lymphangiogenèse et les métastases Durant ces 20 dernières années, la découverte de marqueurs lymphatiques a permis de
mieux comprendre le fonctionnement de ce système, son rôle et celui du VEGF-C, dans
la dissémination métastatique [32]. Le VEGF-C
est en effet l’un des principaux facteurs qui stimulent la lymphangiogenèse et
induisent des métastases dans de nombreux cancers [38]. Le blocage de l’axe VEGF-C, -D/VEGFR3
inhibe la lymphangiogenèse tumorale et toute intervention sur cette voie modifie le
développement lymphatique. Ainsi, la voie WNT1, qui inhibe l’expression de VEGF-C
dans les mélanomes, réduit le développement des vaisseaux lymphatiques [39]. L’inhibition de la
neuropiline 2 (NRP2), le corécepteur de VEGFR3, réduit, quant à elle, la migration
des CEL, mais pas leur prolifération in vitro et in
vivo, diminuant ainsi l’incidence de métastases lymphatiques [40]. L’inhibition de mTOR
(mammalian target of rapamycin) altère la lymphangiogenèse et
les métastases [41] dans
les cancers de la tête et du cou. Bien d’autres molécules, comme le VEGF-A, le FGF2
(fibroblast growth factor), ou l’EGF (epidermal growth
factor), favorisent le développement du système lymphatique dans le
microenvironnement tumoral [42]. Pourtant, dans un model murin de xénogreffe d’adénocarcinome
pancréatique, l’inhibition du TGFβ (transforming growth factor-b)
stimule le développement du système lymphatique, via l’expression
de VEGF-C, révélant ainsi un rôle pour cette molécule, non plus de facilitateur,
mais de répresseur de la lymphangiogenèse. Plusieurs molécules sont donc capables de
freiner ou d’accélérer le développement du réseau lymphatique dans l’environnement
tumoral. Les vaisseaux lymphatiques sont plus perméables que les vaisseaux sanguins. Leur
élargissement dans la périphérie de la tumeur augmente également la surface de
contact accessible aux cellules tumorales et donc leur entrée dans les vaisseaux
qu’elles utilisent pour coloniser d’autres organes (Figure 2). Au sein de la tumeur, plusieurs cellules
produisent le VEGF-C ou le VEGF-D et surtout leur récepteur VEGFR3. Une expression
élevée des facteurs lymphangiogéniques, et la lymphangiogenèse qui en découle, ont
été corrélées au développement des métastases et constituent des facteurs de mauvais
pronostic. Les acteurs participant à la lymphangiogenèse tumorale représentent donc
des cibles thérapeutiques pertinentes dans les tumeurs métastatiques. Actuellement,
les effets de leur activation ou de leur inhibition sur les différents types
cellulaires présents dans le microenvironnement tumoral ne sont cependant que
partiellement compris (Figure
3).
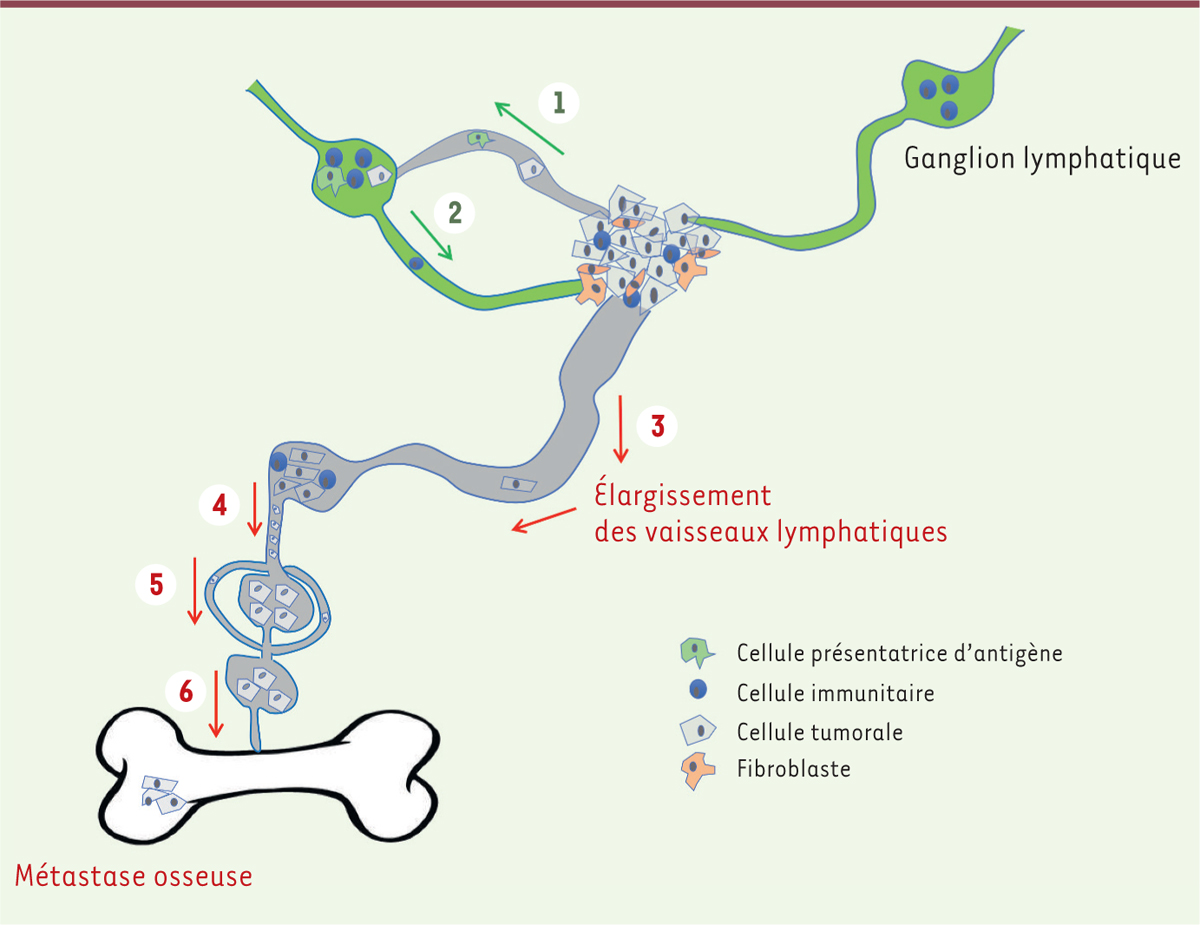
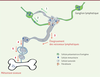 | Figure 2. Interactions entre cellules du microenvironnement tumoral et du réseau
lymphatique. 1. Les cellules
présentatrices d’antigène rejoignent les ganglions et activent les
lymphocytes T. 2. Les lymphocytes T
activés rejoignent la tumeur et participent à l’immunité antitumorale.
3. L’élargissement des vaisseaux
lymphatiques péri-tumoraux permet aux cellules tumorales de pénétrer
dans les vaisseaux lymphatiques. 4. Des
cellules tumorales envahissent les ganglions et disséminent dans
l’organisme via les vaisseaux lymphatiques.
5. Les cellules tumorales
produisent du VEGF-C, ce qui stimule la création de nouveaux vaisseaux
lymphatiques. 6. Les cellules tumorales
disséminent dans d’autres tissus, dont l’os. |
|
VEGF-C : lymphangiogenèse et régulation de l’immunité antitumorale En plus de son rôle dans l’homéostasie, le système lymphatique joue un rôle
régulateur pour le système immunitaire. Les vaisseaux lymphatiques constituent en
effet une voie importante permettant aux cellules présentatrices de présenter les
antigènes dans les ganglions lymphatiques aux lymphocytes T afin de les éduquer
(Figure 2). Un
dysfonctionnement du système lymphatique pourra donc se traduire par une altération
de l’activité immunitaire. En produisant la chimiokine CCL21 (C-C motif
chemokine ligand 21), les CEL attirent et activent les cellules
immunitaires qui expriment son récepteur à leur surface, CCR7 (CC-chemokine
receptor 7), comme les macrophages, les lymphocytes T et B, qui
rejoindront, au cours d’une inflammation, le site inflammatoire via
le réseau lymphatique. Le réseau lymphatique et le VEGF-C qui participe à sa
formation constituent donc une voie physiologique de circulation privilégiée des
cellules immunitaires (Figure
3). L’importance du système lymphatique et du VEGF-C dans la
réponse immunitaire est également observée en conditions pathologiques. Dans un
modèle de mélanome, chez des souris immunisées avec de l’ovalbumine, le VEGF-C
induit une tolérance immunitaire vis-à-vis de la tumeur. Il stimule les CEL qui
inhibent les lymphocytes T CD8+ cytotoxiques [43], des cellules qui, avec l’INFγ (interféron
gamma), réduisent la lymphangiogenèse [44]. Les CEL interviennent également sur la maturation des
cellules dendritiques. Elles les empêchent de présenter correctement les antigènes
tumoraux aux lymphocytes T. Elles expriment en effet de façon constitutive des
antigènes du soi, associés au complexe majeur d’histocompatibilité de type I (CMH
I), maintenant ainsi une tolérance immunitaire [45]. Cette présentation antigénique s’effectue
en l’absence des facteurs de costimulation qui sont nécessaires à l’activation des
lymphocytes CD8+, mais en présence de PDL1 (programmed
death-ligand 1), ligand de PD-1, impliqué dans la régulation négative
des lymphocytes, qui est exprimé par les CEL [46]. Des taux élevés de VEGF-C sont inversement
corrélés au nombre de cellules dendritiques et à l’agressivité des tumeurs [47].
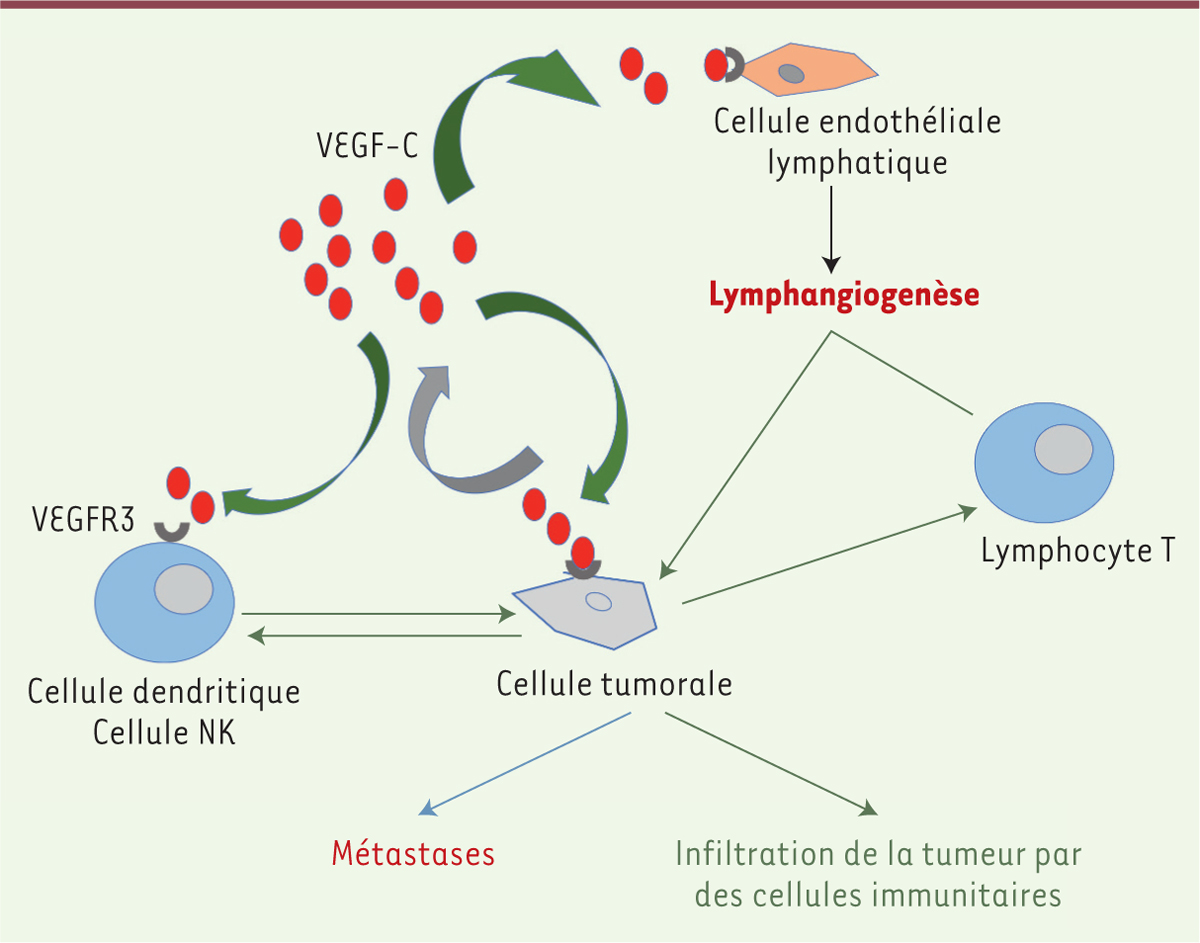
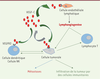 | Figure 3. Effets du VEGFC sur les cellules du microenvironnement tumoral. Le
récepteur du VEGF-C, VEGFR3, est exprimé par différentes cellules du
microenvironnement tumoral. Grâce au développement de vaisseaux
lymphatiques, il favorise l’infiltration des tumeurs primitives par les
cellules immunitaires. En induisant une tolérance immunitaire et en
stimulant la formation d’un réseau lymphatique secondaire, il promeut
les processus métastatiques. NK : natural killer. |
Une fois installée, la tumeur détournera donc des voies de signalisation
physiologiques à son avantage. La fonction immunomodulatrice des CEL qui, en
conditions normales, sont des cellules en contact permanent avec les cellules
immunitaires contre lesquelles elles se protègent, est ainsi utilisée par la tumeur.
VEGF-C et lymphangiogenèse tumorale représentent donc des cibles pour des
traitements antitumoraux. Cependant, VEGF-C et CEL peuvent également, dans certains
cas, avoir une action bénéfique pour le patient. Leur activité nécessite donc d’être
régulée, mais ne doit pas être bloquée. |
Le rôle émergeant du VEGF-C et du système lymphatique En oncologie, VEGF-C et système lymphatique sont préférentiellement associés à la
dissémination métastatique. Un lien entre ce système et l’inflammation a également
été mis en évidence : le VEGF-C est en effet à l’origine d’une tolérance des
cellules dendritiques et des cellules NK (natural killer). Cette
activité du système lymphatique sur la tolérance immunitaire apparaît cependant
ambiguë : une fonction bénéfique de ce système a en effet été décrite récemment (le
processus inflammatoire est favorable lors des premières étapes du développement
tumoral). Dans des mélanomes expérimentaux réalisés chez la souris, le VEGF-C
provoque l’infiltration au sein de la tumeur de cellules immunitaires (Figures 2, 3), potentialisant ainsi l’effet anti-tumoral des anticorps
inhibiteurs de points de contrôle immunitaires, notamment l’anti-PDL1 [48]. Dans les modèles de
cancer du sein, des composés anti-lymphangiogéniques inhibent la translocation de
cellules dendritiques vers les ganglions lymphatiques et diminuent le nombre de
lymphocytes T CD8+ infiltrant les tumeurs [49]. En parallèle, le VEGF-C, exprimé par les
cellules tumorales, est à l’origine d’une néo-lymphangiogenèse dans le
microenvironnement tumoral, permettant aux lymphocytes T naïfs, exprimant CCR7,
d’envahir la tumeur, attirés par CCL21 produite par les CEL. Dans les phases
précoces du développement tumoral des cancers du rein à cellules claires, le VEGF-C
joue un rôle anti-tumoral qui est associé à une activité immunitaire (Ndiaye P, en
cours de publication). Dans les phases tardives du développement de ces tumeurs, le
VEGF-C joue alors un rôle péjoratif en stimulant notamment la dissémination
métastatique comme cela a été décrit pour d’autres tumeurs de grade élevé. |
Le système lymphatique, connu depuis très longtemps, a retrouvé un regain d’intérêt
ces 20 dernières années grâce à la découverte de marqueurs spécifiques qui
permettent de différencier ses vaisseaux des vaisseaux sanguins. Dans les cancers,
ce système a été préférentiellement associé à la dissémination métastatique. En
parallèle, la lymphangiogenèse a été reliée à l’inflammation. La rencontre de
l’oncologie et de l’immunologie a permis de révéler le rôle du système lymphatique
dans la réponse immunitaire anti-tumorale. Dans des tumeurs de haut grade, le
VEGF-C, l’un des principaux facteurs lymphangiogéniques, et son récepteur, le
VEGFR3, sont à l’origine d’une tolérance immunitaire vis-à-vis de la tumeur. Le
VEGF-C potentialise néanmoins l’effet des immunothérapies anti-PDL1. Selon la
progression de la tumeur, le réseau lymphatique est donc soit initialement
pourvoyeur de cellules immunitaires anti-tumorales et contrôlant alors le
développement de la tumeur, soit facilitateur d’une tolérance immunitaire, les
cellules tumorales produisant également le VEGF-C, à l’origine de la création de
nouveaux vaisseaux lymphatiques, stimulant ainsi la dissémination métastatique
(Figure 2). Ces
observations, qui apparaissent contradictoires, révèlent en fait notre compréhension
limitée du rôle que joue le système lymphatique au cours du développement tumoral.
Les traitements ciblant le VEGF-C, ou son récepteur (VEGFR3) et corécepteur (NRP2),
nécessiteront donc d’être utilisés avec prudence. Ils ne devront surtout pas être
prescrits lors des étapes précoces du développement tumoral : l’inhibition de
l’immunité anti-tumorale qui en découlerait pourrait en effet accélérer la
propagation métastatique. La définition de marqueurs pertinents permettant de
prédire l’efficacité de ces traitements reste donc un enjeu thérapeutique
majeur. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Pour leur soutien : à l’Association pour la recherche contre le cancer (ARC), à
l’Institut national du cancer (contrat : VEGFIL et SunitRES), à la Fondation de
France, au Framework Program 7 of the European Commission-Marie Curie Intra-European
grant (Contrat : VELYMPH), à la Fondation François Xavier Mora, à la Société IRIS
Pharma et à La Ligue Nationale Contre le Cancer-Équipe Labellisée LIGUE 2019.
|
Footnotes |
1. Leu
AJ,
Berk
DA,
Lymboussaki
A, et al.
Absence of functional lymphatics within a murine sarcoma: a
molecular and functional evaluation . Cancer
Res.
2000; ; 60 :
:4324.–4327. 2. Shayan
R,
Inder
R,
Karnezis
T, et al.
Tumor location and nature of lymphatic vessels are key
determinants of cancer metastasis . Clin Exp
Metastasis.
2013; ; 30 :
:345.–356. 3. Sabin
FR. On the origin of
the lymphatic system from the veins and the development of the lymph hearts
and thoracic duct in the pig . Am J Anat.
1902: :367.–389. 4. Huntington
G,
McClure
C. The, anatomy and
development of the jugular lymph sacs in the domestic cat (felis
domestica) . Am J Anat.
1910; ; 10 :
:178.–310. 5. Wigle
JT,
Harvey
N,
Detmar
M, et al.
An essential role for Prox1 in the induction of the lymphatic
endothelial cell phenotype . EMBO J.
2002; ; 21 :
:1505.–1513. 6. Wigle
JT,
Oliver
G. Prox1 function is
required for the development of the murine lymphatic system .
Cell.
1999; ; 98 :
:769.–778. 7. Wilting
J,
Papoutsi
M,
Schneider
M,
Christ
B. The lymphatic
endothelium of the avian wing is of somitic origin .
Dev Dyn.
2000; ; 217 :
:271.–278. 8. Ny
A,
Koch
M,
Schneider
M, et al.
A genetic Xenopus laevis tadpole model to study
lymphangiogenesis . Nat Med.
2005; ; 11 :
:998.–1004. 9. Yaniv
K,
Isogai
S,
Castranova
D, et al.
Live imaging of lymphatic development in the
zebrafish . Nat Med.
2006; ; 12 :
:711.–716. 10. Srinivasan
RS,
Dillard
ME,
Lagutin
OV, et al.
Lineage tracing demonstrates the venous origin of the mammalian
lymphatic vasculature . Genes Dev.
2007; ; 21 :
:2422.–2432. 11. Srinivasan
RS,
Oliver
G. Prox1 dosage
controls the number of lymphatic endothelial cell progenitors and the
formation of the lymphovenous valves . Genes
Dev.
2011; ; 25 :
:2187.–2197. 12. Religa
P,
Cao
R,
Bjorndahl
M, et al.
Presence of bone marrow-derived circulating progenitor
endothelial cells in the newly formed lymphatic vessels .
Blood.
2005; ; 106 :
:4184.–4190. 13. Irrthum
A,
Devriendt
K,
Chitayat
D, et al.
Mutations in the transcription factor gene SOX18 underlie
recessive and dominant forms of
hypotrichosis-lymphedema-telangiectasia . Am J Hum
Genet.
2003; ; 72 :
:1470.–1478. 14. You
LR,
Lin
FJ,
Lee
CT, et al.
Suppression of Notch signalling by the COUP-TFII transcription
factor regulates vein identity . Nature.
2005; ; 435 :
:98.–104. 15. Lin
FJ,
Chen
X,
Qin
J, et al.
Direct transcriptional regulation of neuropilin-2 by COUP-TFII
modulates multiple steps in murine lymphatic vessel
development . J Clin Invest.
2010; ; 120 :
:1694.–1707. 16. Yamazaki
T,
Yoshimatsu
Y,
Morishita
Y, et al.
COUP-TFII regulates the functions of Prox1 in lymphatic
endothelial cells through direct interaction . Genes
Cells.
2009; ; 14 :
:425.–434. 17. Dumont
DJ,
Jussila
L,
Taipale
J, et al.
Cardiovascular failure in mouse embryos deficient in VEGF
receptor-3 . Science.
1998; ; 282 :
:946.–949. 18. Srinivasan
RS,
Escobedo
N,
Yang
Y, et al.
The Prox1-Vegfr3 feedback loop maintains the identity and the
number of lymphatic endothelial cell progenitors .
Genes Dev.
2014; ; 28 :
:2175.–2187. 19. Karkkainen
MJ,
Haiko
P,
Sainio
K, et al.
Vascular endothelial growth factor C is required for sprouting of
the first lymphatic vessels from embryonic veins .
Nat Immunol.
2004; ; 5 :
:74.–80. 20. Bower
NI,
Vogrin
AJ, Le
Guen
L, et al.
Vegfd modulates both angiogenesis and lymphangiogenesis during
zebrafish embryonic development .
Development.
2017; ; 144 :
:507.–518. 21. Duong
T,
Koltowska
K,
Pichol-Thievend
C, et al.
VEGFD regulates blood vascular development by modulating SOX18
activity . Blood.
2014; ; 123 :
:1102.–1112. 22. Koltowska
K,
Paterson
S,
Bower
NI, et al.
Mafba is a downstream transcriptional effector of Vegfc signaling
essential for embryonic lymphangiogenesis in zebrafish .
Genes Dev.
2015; ; 29 :
:1618.–1630. 23. Bos
FL,
Caunt
M,
Peterson-Maduro
J, et al.
CCBE1 is essential for mammalian lymphatic vascular development
and enhances the lymphangiogenic effect of vascular endothelial growth
factor-C in vivo . Circ Res.
2011; ; 109 :
:486.–491. 24. Gordon
EJ,
Gale
NW,
Harvey
NL. Expression of
the hyaluronan receptor LYVE-1 is not restricted to the lymphatic
vasculature; LYVE-1 is also expressed on embryonic blood
vessels . Dev Dyn.
2008; ; 237 :
:1901.–1909. 25. Gale
NW,
Prevo
R,
Espinosa
J, et al.
Normal lymphatic development and function in mice deficient for
the lymphatic hyaluronan receptor LYVE-1 . Mol Cell
Biol.
2007; ; 27 :
:595.–604. 26. Pan
Y,
Xia
L. Emerging roles of
podoplanin in vascular development and homeostasis .
Front Med.
2015; ; 9 :
:421.–430. 27. Yang
Y,
Garcia-Verdugo
JM,
Soriano-Navarro
M, et al.
Lymphatic endothelial progenitors bud from the cardinal vein and
intersomitic vessels in mammalian embryos .
Blood.
2012; ; 120 :
:2340.–2348. 28. Pan
Y,
Wang
WD,
Yago
T. Transcriptional
regulation of podoplanin expression by Prox1 in lymphatic endothelial
cells . Microvasc Res.
2014; ; 94 :
:96.–102. 29. Bertozzi
CC,
Schmaier
AA,
Mericko
P, et al.
Platelets regulate lymphatic vascular development through
CLEC-2-SLP-76 signaling . Blood.
2010; ; 116 :
:661.–670. 30. Hess
PR,
Rawnsley
DR,
Jakus
Z, et al.
Platelets mediate lymphovenous hemostasis to maintain
blood-lymphatic separation throughout life . J Clin
Invest.
2014; ; 124 :
:273.–284. 31. He
Y,
Rajantie
I,
Ilmonen
M, et al.
Preexisting lymphatic endothelium but not endothelial progenitor
cells are essential for tumor lymphangiogenesis and lymphatic
metastasis . Cancer Res.
2004; ; 64 :
:3737.–3740. 32. Alitalo
A,
Detmar
M. Interaction of
tumor cells and lymphatic vessels in cancer progression .
Oncogene.
2012; ; 31 :
:4499.–4508. 33. Saharinen
P,
Tammela
T,
Karkkainen
MJ,
Alitalo
K. Lymphatic
vasculature: development, molecular regulation and role in tumor metastasis
and inflammation . Trends Immunol.
2004; ; 25 :
:387.–395. 34. Farnsworth
RH,
Achen
MG,
Stacker
SA. Lymphatic
endothelium: an important interactive surface for malignant
cells . Pulm Pharmacol Ther.
2006; ; 19 :
:51.–60. 35. Dadras
SS,
Paul
T,
Bertoncini
J, et al.
Tumor lymphangiogenesis: a novel prognostic indicator for
cutaneous melanoma metastasis and survival . Am J
Pathol.
2003; ; 162 :
:1951.–1960. 36. Zhang
XH,
Huang
DP,
Guo
GL, et al.
Coexpression of VEGF-C and COX-2 and its association with
lymphangiogenesis in human breast cancer . BMC
Cancer.
2008; ; 8 : :4.. 37. Su
JL,
Shih
JY,
Yen
ML, et al.
Cyclooxygenase-2 induces EP1- and HER-2/Neu-dependent vascular
endothelial growth factor-C up-regulation: a novel mechanism of
lymphangiogenesis in lung adenocarcinoma . Cancer
Res.
2004; ; 64 :
:554.–564. 38. Su
JL,
Yen
CJ,
Chen
PS, et al.
The role of the VEGF-C/VEGFR-3 axis in cancer
progression . Br J Cancer.
2007; ; 96 :
:541.–545. 39. Niederleithner
H,
Heinz
M,
Tauber
S, et al.
Wnt1 is anti-lymphangiogenic in a melanoma mouse
model . J Invest Dermatol.
2012; ; 132 :
:2235.–2244. 40. Caunt
M,
Mak
J,
Liang
WC, et al.
Blocking neuropilin-2 function inhibits tumor cell
metastasis . Cancer Cell.
2008; ; 13 :
:331.–342. 41. Patel
V,
Marsh
CA,
Dorsam
RT, et al.
Decreased lymphangiogenesis and lymph node metastasis by mTOR
inhibition in head and neck cancer . Cancer
Res.
2011; ; 71 :
:7103.–7112. 42. Cao
R,
Ji
H,
Feng
N, et al.
Collaborative interplay between FGF-2 and VEGF-C promotes
lymphangiogenesis and metastasis . Proc Natl Acad Sci
USA.
2012; ; 109 :
:15894.–15899. 43. Lund
AW,
Duraes
FV,
Hirosue
S, et al.
VEGF-C promotes immune tolerance in B16 melanomas and
cross-presentation of tumor antigen by lymph node
lymphatics . Cell Rep.
2012; ; 1 :
:191.–199. 44. Kataru
RP,
Kim
H,
Jang
C, et al.
T lymphocytes negatively regulate lymph node lymphatic vessel
formation . Immunity.
2011; ; 34 :
:96.–107. 45. Fletcher
AL,
Malhotra
D,
Turley
SJ. Lymph node
stroma broaden the peripheral tolerance paradigm .
Trends Immunol.
2011; ; 32 :
:12.–18. 46. Tewalt
EF,
Cohen
JN,
Rouhani
SJ, et al.
Lymphatic endothelial cells induce tolerance via PD-L1 and lack
of costimulation leading to high-level PD-1 expression on CD8 T
cells . Blood.
2012; ; 120 :
:4772.–4782. 47. Takahashi
A,
Kono
K,
Itakura
J, et al.
Correlation of vascular endothelial growth factor-C expression
with tumor-infiltrating dendritic cells in gastric cancer .
Oncology.
2002; ; 62 :
:121.–127. 48. Fankhauser
M,
Broggi
MAS,
Potin
L, et al.
Tumor lymphangiogenesis promotes T cell infiltration and
potentiates immunotherapy in melanoma . Sci Transl
Med.
2017;; 9. 49. Muchowicz
A,
Wachowska
M,
Stachura
J, et al.
Inhibition of lymphangiogenesis impairs antitumour effects of
photodynamic therapy and checkpoint inhibitors in mice .
Eur J Cancer.
2017; ; 83 :
:19.–27. 50. Jaffredo
T.. Origine veineuse
des vaisseaux lymphatiques chez les mammifères : l’hypothèse de Sabin
vérifiée . Med Sci (Paris).
2008; ; 24 :
:567.–569. |