Fibromyalgie
2020
| ANALYSE |
12-
Neuro-imagerie
et neuro-modulation non invasive
dans le syndrome fibromyalgique
 ; Walitt et coll., 2015
; Walitt et coll., 2015 ). Si des pistes émergent quant aux mécanismes à l’origine de la douleur diffuse chronique dans la fibromyalgie (FM) comme souligné dans le chapitre « Neurobiologie de la douleur chronique dans la fibromyalgie et biomarqueurs », les mécanismes physiopathologiques à l’origine de syndrome restent très mal compris. Avec le développement de méthodes non invasives d’analyse du fonctionnement du cerveau en neuro-imagerie, de nouvelles pistes se sont ouvertes quant à l’exploration des bases cérébrales de la douleur (pour revues voir Kupers et Kehlet, 2006
). Si des pistes émergent quant aux mécanismes à l’origine de la douleur diffuse chronique dans la fibromyalgie (FM) comme souligné dans le chapitre « Neurobiologie de la douleur chronique dans la fibromyalgie et biomarqueurs », les mécanismes physiopathologiques à l’origine de syndrome restent très mal compris. Avec le développement de méthodes non invasives d’analyse du fonctionnement du cerveau en neuro-imagerie, de nouvelles pistes se sont ouvertes quant à l’exploration des bases cérébrales de la douleur (pour revues voir Kupers et Kehlet, 2006 ; Apkarian, 2010
; Apkarian, 2010 ; Tracey 2011
; Tracey 2011 ; Garcia-Larrea et Peyron, 2013
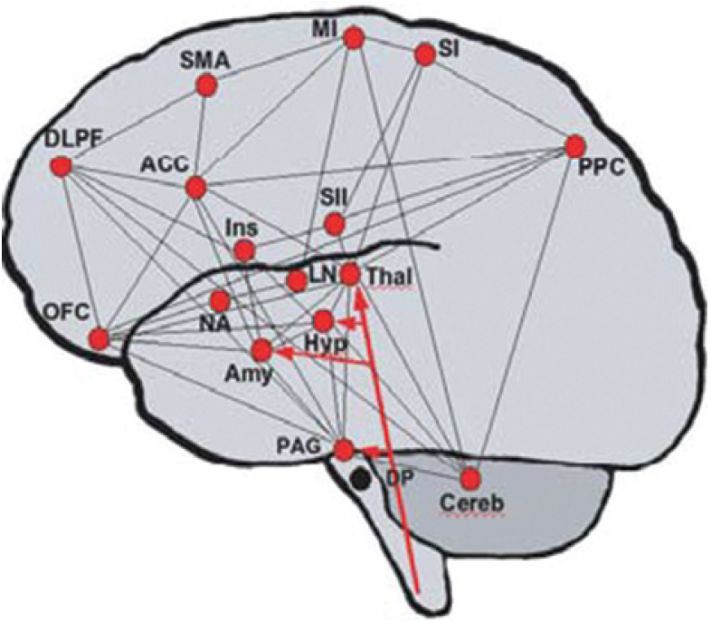
; Garcia-Larrea et Peyron, 2013 ). Les travaux utilisant ces techniques d’analyse ont montré que l’application d’un stimulus nociceptif induisait l’activation d’un ensemble d’aires corticales et sous-corticales appelé matrice de la douleur. Au niveau cortical, cet ensemble inclut le cortex somatosensoriel primaire (SI), le cortex somatosensoriel secondaire (SII), le cortex postérieur pariétal (PPC), l’insula, le cortex cingulaire antérieur (ACC), la partie rostrale (subgénual) de l’ACC (rACC), le cortex préfrontal dorsolatéral (DL-PFC) et orbitofrontal (OrbitofrC) ainsi que le cortex moteur supplémentaire (SMA). Les structures sous-corticales qui sont classiquement liées à la matrice de la douleur sont le thalamus, l’amygdale, la substance grise périaqueducale (PAG) et les noyaux accumbens (NAccumb). Quelques remarques s’imposent ici. Toutes ces zones ne sont pas nécessairement activées dans leur ensemble en réponse à une stimulation douloureuse. De plus, il n’y a pas de réel consensus quant au nombre minimal de structures considérées comme devant être activées pour générer une sensation de douleur. Ensuite, les zones de la matrice de la douleur ne sont pas exclusivement activées par des stimuli nociceptifs : elles peuvent l’être par des stimulations non douloureuses comme par exemple le toucher, la chaleur, les caresses ou encore par des stimuli intéroceptifs comme la faim, la soif ou la conscience du battement du cœur. Certains auteurs ont suggéré que le concept de matrice de la douleur était trop aspécifique et que la plus grande partie des réponses des zones la composant reflétait l’activité des processus attentionnels ou cognitifs et non des réponses spécifiques à la douleur (Mouraux et coll., 2011
). Les travaux utilisant ces techniques d’analyse ont montré que l’application d’un stimulus nociceptif induisait l’activation d’un ensemble d’aires corticales et sous-corticales appelé matrice de la douleur. Au niveau cortical, cet ensemble inclut le cortex somatosensoriel primaire (SI), le cortex somatosensoriel secondaire (SII), le cortex postérieur pariétal (PPC), l’insula, le cortex cingulaire antérieur (ACC), la partie rostrale (subgénual) de l’ACC (rACC), le cortex préfrontal dorsolatéral (DL-PFC) et orbitofrontal (OrbitofrC) ainsi que le cortex moteur supplémentaire (SMA). Les structures sous-corticales qui sont classiquement liées à la matrice de la douleur sont le thalamus, l’amygdale, la substance grise périaqueducale (PAG) et les noyaux accumbens (NAccumb). Quelques remarques s’imposent ici. Toutes ces zones ne sont pas nécessairement activées dans leur ensemble en réponse à une stimulation douloureuse. De plus, il n’y a pas de réel consensus quant au nombre minimal de structures considérées comme devant être activées pour générer une sensation de douleur. Ensuite, les zones de la matrice de la douleur ne sont pas exclusivement activées par des stimuli nociceptifs : elles peuvent l’être par des stimulations non douloureuses comme par exemple le toucher, la chaleur, les caresses ou encore par des stimuli intéroceptifs comme la faim, la soif ou la conscience du battement du cœur. Certains auteurs ont suggéré que le concept de matrice de la douleur était trop aspécifique et que la plus grande partie des réponses des zones la composant reflétait l’activité des processus attentionnels ou cognitifs et non des réponses spécifiques à la douleur (Mouraux et coll., 2011 ; Mouraux et Iannetti, 2018
; Mouraux et Iannetti, 2018 ). Sur la base des travaux de Melzack et Wall, il est possible de regrouper les zones de la matrice de la douleur selon les fonctions spécifiques qu’elles jouent dans les mécanismes et la modulation de la douleur (Melzack et Wall, 1965
). Sur la base des travaux de Melzack et Wall, il est possible de regrouper les zones de la matrice de la douleur selon les fonctions spécifiques qu’elles jouent dans les mécanismes et la modulation de la douleur (Melzack et Wall, 1965 ). La figure 12.1
). La figure 12.1 illustre ces zones cérébrales qui font partie de la matrice de la douleur. Les structures faisant partie du système ascendant latéral spinothalamique, comme les noyaux ventro-postérieurs du thalamus, le SI, SII et l’insula postérieure, seraient davantage impliquées dans l’aspect sensori-discriminatif de la douleur. L’insula antérieure, l’ACC et les zones qui font partie du système spinothalamique médian, comme le tronc cérébral, les noyaux ventro-médians du thalamus, le système limbique et le cortex orbitofrontal, seraient quant à eux davantage impliqués dans les aspects affectifs et motivationnels de la douleur. Le troisième sous-circuit, qui inclut le cortex inférieur pariétal, est impliqué dans des fonctions associatives de la douleur. Enfin, le PAG, le rACC et le DL-PFC sont impliqués dans la modulation de la douleur (Garcia-Larrea et Peyron, 2013
illustre ces zones cérébrales qui font partie de la matrice de la douleur. Les structures faisant partie du système ascendant latéral spinothalamique, comme les noyaux ventro-postérieurs du thalamus, le SI, SII et l’insula postérieure, seraient davantage impliquées dans l’aspect sensori-discriminatif de la douleur. L’insula antérieure, l’ACC et les zones qui font partie du système spinothalamique médian, comme le tronc cérébral, les noyaux ventro-médians du thalamus, le système limbique et le cortex orbitofrontal, seraient quant à eux davantage impliqués dans les aspects affectifs et motivationnels de la douleur. Le troisième sous-circuit, qui inclut le cortex inférieur pariétal, est impliqué dans des fonctions associatives de la douleur. Enfin, le PAG, le rACC et le DL-PFC sont impliqués dans la modulation de la douleur (Garcia-Larrea et Peyron, 2013 ).
). | Figure 12.1 Représentation schématique latérale d’un cerveau et localisation de la matrice de la douleur (adaptée de Kupers et Kehlet, 2006 ) ) |
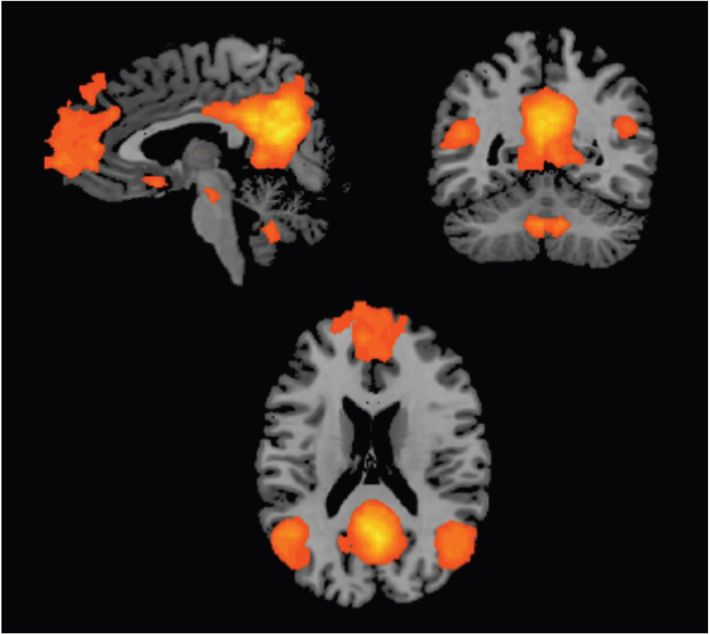
 ). Les structures cérébrales qui font partie du DMN sont le cortex cingulaire postérieur et le precuneus, le cortex médial préfrontal ventral et dorsal, le cortex latéral temporal, le lobule inférieur pariétal et le complexe hippocampique (figure 12.2
). Les structures cérébrales qui font partie du DMN sont le cortex cingulaire postérieur et le precuneus, le cortex médial préfrontal ventral et dorsal, le cortex latéral temporal, le lobule inférieur pariétal et le complexe hippocampique (figure 12.2 ). Ce réseau est fortement activé lorsque la personne est dans un état de « vagabondage d’esprit » ou de rêvasserie. Le DMN est également actif lorsque la personne pense aux autres, pense à elle-même, se souvient du passé et planifie pour l’avenir.
). Ce réseau est fortement activé lorsque la personne est dans un état de « vagabondage d’esprit » ou de rêvasserie. Le DMN est également actif lorsque la personne pense aux autres, pense à elle-même, se souvient du passé et planifie pour l’avenir. ) et dans des situations de douleurs chroniques (Baliki et coll., 2008
) et dans des situations de douleurs chroniques (Baliki et coll., 2008 ). L’activité du DMN et sa connexion avec la matrice de la douleur sont de plus en plus utilisées pour mieux comprendre les mécanismes centraux qui sous-tendent la sensation chronique de douleur (Baliki et coll., 2014
). L’activité du DMN et sa connexion avec la matrice de la douleur sont de plus en plus utilisées pour mieux comprendre les mécanismes centraux qui sous-tendent la sensation chronique de douleur (Baliki et coll., 2014 ).
). ).
).Neuro-imagerie dans le syndrome fibromyalgique
Études menées en imagerie fonctionnelle
Altérations des réponses aux stimuli douloureux évoqués
 ; Burgmer et coll., 2009
; Burgmer et coll., 2009
 ; Jensen et coll., 2009a
; Jensen et coll., 2009a ; Pujol et coll., 2009
; Pujol et coll., 2009 ; Burgmer et coll., 2010
; Burgmer et coll., 2010 ; Diers et coll., 2011
; Diers et coll., 2011 ; Duschek et coll., 2012
; Duschek et coll., 2012 ; Jensen et coll., 2012b
; Jensen et coll., 2012b ; Staud et coll., 2012 ; Fallon et coll., 2013
; Staud et coll., 2012 ; Fallon et coll., 2013 ; Maestu et coll., 2013
; Maestu et coll., 2013 ; López-Solá et coll., 2014
; López-Solá et coll., 2014 ; Uceyler et coll., 2015
; Uceyler et coll., 2015 ; Kosek et coll., 2016
; Kosek et coll., 2016 ; Montoro et coll., 2016
; Montoro et coll., 2016 ; López-Solá et coll., 2017
; López-Solá et coll., 2017 ). L’âge moyen des patients était de 48 ± 7 ans et 99 % des participants étaient des femmes (tableau 12.I
). L’âge moyen des patients était de 48 ± 7 ans et 99 % des participants étaient des femmes (tableau 12.I ). La durée moyenne de la FM était de 11 ± 7 années (de 5 à 24 ans). La vaste majorité des études utilise de l’imagerie à résonance magnétique fonctionnelle ou IRMf (n = 11), alors que l’échographie Doppler (n = 2), la magnétoencéphalographie (MEG, n = 1), l’imagerie spectroscopique proche infrarouge (Near-Infrared Spectroscopy ou NIRS ; n = 1) et l’électroencéphalogramme (EEG, n = 1) sont plus rarement utilisés. Deux de ces études comprennent un deuxième groupe contrôle composé de patients atteints de polyarthrite rhumatoïde (PR) (Burgmer et coll., 2010
). La durée moyenne de la FM était de 11 ± 7 années (de 5 à 24 ans). La vaste majorité des études utilise de l’imagerie à résonance magnétique fonctionnelle ou IRMf (n = 11), alors que l’échographie Doppler (n = 2), la magnétoencéphalographie (MEG, n = 1), l’imagerie spectroscopique proche infrarouge (Near-Infrared Spectroscopy ou NIRS ; n = 1) et l’électroencéphalogramme (EEG, n = 1) sont plus rarement utilisés. Deux de ces études comprennent un deuxième groupe contrôle composé de patients atteints de polyarthrite rhumatoïde (PR) (Burgmer et coll., 2010 ) ou de dépression majeure (Uceyler et coll., 2015
) ou de dépression majeure (Uceyler et coll., 2015 ). Les stimulations nociceptives utilisées sont une pression mécanique (souvent sur l’ongle du pouce) (n = 9), une incision de la peau (n = 3) et la potentialisation progressive des réponses évoquées des fibres C (C-fibre wind-up) en utilisant des stimuli thermiques douloureux (n = 2). La chaleur douloureuse, la brosse et l’injection de prostaglandines ne sont utilisées qu’une seule fois. Le nombre de patients inclus dans les études est en moyenne de 18 (de 6 à 37).
). Les stimulations nociceptives utilisées sont une pression mécanique (souvent sur l’ongle du pouce) (n = 9), une incision de la peau (n = 3) et la potentialisation progressive des réponses évoquées des fibres C (C-fibre wind-up) en utilisant des stimuli thermiques douloureux (n = 2). La chaleur douloureuse, la brosse et l’injection de prostaglandines ne sont utilisées qu’une seule fois. Le nombre de patients inclus dans les études est en moyenne de 18 (de 6 à 37).Tableau 12.I Quelques caractéristiques des études menées en imagerie cérébrale sur des patients atteints de fibromyalgie
|
Patients atteints de fibromyalgie
|
Sujets contrôles
|
|||||||||
|
Approches
|
Nombre d’études
|
N
|
X
|
Âge
|
% F
|
Durée de la FM (ans)
|
N
|
X
|
Âge
|
% F
|
|
Imagerie fonctionnelle de la douleur, hyperalgésie
|
16
|
324
|
18
|
48
|
99
|
11±7
|
276
|
19
|
43
|
99
|
|
Imagerie fonctionnelle, réseau au repos (resting state networks)
|
12
|
223
|
21
|
43
|
97
|
243
|
19
|
42
|
93
|
|
|
Imagerie fonctionnelle, processus cognitifs
|
17
|
438
|
26
|
47
|
94
|
244
|
19
|
44
|
93
|
|
|
Imagerie fonctionnelle, procédures interventionnelles
|
16
|
289
|
18
|
45
|
92
|
134
|
15
|
43
|
95
|
|
|
Études d’imagerie cérébrale structurale
|
13
|
302
|
20
|
47
|
99
|
14 ± 7
|
291
|
21
|
45
|
98
|
|
Études de liaison des neurorécepteurs
|
8
|
125
|
16
|
44
|
99
|
110
|
14
|
44
|
99
|
|
|
Études combinées IRM-spectroscopie
|
10
|
145
|
15
|
40
|
93
|
125
|
14
|
39
|
93
|
|
|
Perfusion
|
3
|
62
|
21
|
47
|
94
|
53
|
18
|
49
|
93
|
|
|
Ensemble des études
|
95
|
1 908
|
19
|
45
|
96
|
1 476
|
17
|
44
|
95
|
|
N : nombre total de patients ou contrôles ; X : nombre moyen de patients ou de contrôles par étude ; % F : pourcentage de femmes étudiées.
• Imagerie en résonance magnétique fonctionnelle (IRMf)

 , 2010
, 2010 , 2012
, 2012 ) ont utilisé l’IRMf pour mesurer les réponses cérébrales à une incision de la peau sur 4 mm, un modèle de douleur aiguë que les auteurs considèrent le plus approprié pour étudier ce type de douleur dans le SFM. Comparés aux contrôles, le cortex fronto-cingulaire, le cortex moteur supplémentaire et le thalamus des patients sont activés plus fortement, bien que les foyers d’activation augmentés en réponse à cette douleur induite soient de petite taille. Les auteurs concluent que « le système de douleur médian » est plus fortement activé chez ces patients. Dans l’étude suivante, les auteurs ont évalué la spécificité de cette réponse cérébrale en incluant un groupe contrôle constitué de patients atteints de PR (Burgmer et coll., 2010
) ont utilisé l’IRMf pour mesurer les réponses cérébrales à une incision de la peau sur 4 mm, un modèle de douleur aiguë que les auteurs considèrent le plus approprié pour étudier ce type de douleur dans le SFM. Comparés aux contrôles, le cortex fronto-cingulaire, le cortex moteur supplémentaire et le thalamus des patients sont activés plus fortement, bien que les foyers d’activation augmentés en réponse à cette douleur induite soient de petite taille. Les auteurs concluent que « le système de douleur médian » est plus fortement activé chez ces patients. Dans l’étude suivante, les auteurs ont évalué la spécificité de cette réponse cérébrale en incluant un groupe contrôle constitué de patients atteints de PR (Burgmer et coll., 2010 ). Les résultats montrent que les 17 patients atteints de SFM se distinguaient des 16 patients atteints de PR par des moindres réponses du cortex médian préfrontal et du thalamus. Cependant, les auteurs n’ont pas reproduit les résultats précédents, à savoir une activation plus forte du système de douleur médian (Burgmer et coll., 2009a
). Les résultats montrent que les 17 patients atteints de SFM se distinguaient des 16 patients atteints de PR par des moindres réponses du cortex médian préfrontal et du thalamus. Cependant, les auteurs n’ont pas reproduit les résultats précédents, à savoir une activation plus forte du système de douleur médian (Burgmer et coll., 2009a ). D’autre part, les patients atteints de SFM présentaient une corrélation négative entre l’activité de base dans des aires préfrontales (cortex cingulaire antérieur, gyrus précentral et SMA) et la douleur rapportée en réponse à une incision de la peau, alors que la corrélation était positive chez les patients atteints de PR. Dans leur 3e étude, ce groupe a examiné les réponses cérébrales liées à l’hyperalgésie causée par une stimulation mécanique de la peau autour de l’incision (Burgmer et coll., 2012
). D’autre part, les patients atteints de SFM présentaient une corrélation négative entre l’activité de base dans des aires préfrontales (cortex cingulaire antérieur, gyrus précentral et SMA) et la douleur rapportée en réponse à une incision de la peau, alors que la corrélation était positive chez les patients atteints de PR. Dans leur 3e étude, ce groupe a examiné les réponses cérébrales liées à l’hyperalgésie causée par une stimulation mécanique de la peau autour de l’incision (Burgmer et coll., 2012 ). Alors que les sujets contrôles montraient une corrélation négative entre l’activité du cortex préfrontal dorsolatéral et l’amplitude de l’hyperalgésie secondaire, la corrélation était positive chez les 17 patientes atteintes de SFM évaluées.
). Alors que les sujets contrôles montraient une corrélation négative entre l’activité du cortex préfrontal dorsolatéral et l’amplitude de l’hyperalgésie secondaire, la corrélation était positive chez les 17 patientes atteintes de SFM évaluées. ; Craggs et coll., 2012
; Craggs et coll., 2012 ). Dans leur 1re étude, les auteurs montrent que la température nécessaire pour provoquer un même niveau de douleur est plus basse chez les 14 patientes atteintes de SFM évaluées comparées aux contrôles (Staud et coll., 2008
). Dans leur 1re étude, les auteurs montrent que la température nécessaire pour provoquer un même niveau de douleur est plus basse chez les 14 patientes atteintes de SFM évaluées comparées aux contrôles (Staud et coll., 2008 ). En utilisant des températures qui provoquent la même intensité de douleur chez les 2 groupes, les auteurs ne trouvent pas de différence dans les réponses cérébrales entre patientes et contrôles. Les mêmes données d’imagerie ont été utilisées dans leur 2de étude, dans laquelle les auteurs ont caractérisé la connectivité effective entre des régions définies a priori comme impliquées dans le traitement d’un signal douloureux (Craggs et coll., 2012
). En utilisant des températures qui provoquent la même intensité de douleur chez les 2 groupes, les auteurs ne trouvent pas de différence dans les réponses cérébrales entre patientes et contrôles. Les mêmes données d’imagerie ont été utilisées dans leur 2de étude, dans laquelle les auteurs ont caractérisé la connectivité effective entre des régions définies a priori comme impliquées dans le traitement d’un signal douloureux (Craggs et coll., 2012 ). Les résultats montrent que, malgré des ressemblances, les patientes présentent des changements dans la connectivité entre SI, SII et l’insula postérieure comparées aux contrôles. Il n’y avait pas de corrélation entre ces changements et les niveaux de douleur.
). Les résultats montrent que, malgré des ressemblances, les patientes présentent des changements dans la connectivité entre SI, SII et l’insula postérieure comparées aux contrôles. Il n’y avait pas de corrélation entre ces changements et les niveaux de douleur. ), 83 patientes atteintes de SFM et 16 femmes contrôles ont été soumises à une stimulation mécanique induisant une douleur identique. Si la pression nécessaire pour induire la même intensité de douleur était moins élevée chez les patientes, aucune zone cérébrale n’était activée plus fortement comparées aux contrôles. Au contraire, 2 zones fortement impliquées dans la modulation endogène de la douleur, le rACC et le tronc cérébral, étaient significativement moins activées chez les patientes. Ces résultats suggèrent un dysfonctionnement des mécanismes endogènes de modulation de la douleur chez ces dernières. Dans une seconde étude suivante, le même groupe a examiné la connectivité fonctionnelle du rACC et du thalamus en réponse à une douleur mécanique (Jensen et coll., 2012b
), 83 patientes atteintes de SFM et 16 femmes contrôles ont été soumises à une stimulation mécanique induisant une douleur identique. Si la pression nécessaire pour induire la même intensité de douleur était moins élevée chez les patientes, aucune zone cérébrale n’était activée plus fortement comparées aux contrôles. Au contraire, 2 zones fortement impliquées dans la modulation endogène de la douleur, le rACC et le tronc cérébral, étaient significativement moins activées chez les patientes. Ces résultats suggèrent un dysfonctionnement des mécanismes endogènes de modulation de la douleur chez ces dernières. Dans une seconde étude suivante, le même groupe a examiné la connectivité fonctionnelle du rACC et du thalamus en réponse à une douleur mécanique (Jensen et coll., 2012b ). Les résultats montrent une connectivité réduite entre le rACC et l’amygdale, l’hippocampe et le tronc cérébral, et le thalamus et le cortex orbitofrontal chez les 28 patientes atteintes de FM étudiées comparées aux 14 contrôles. Aucune zone ne montrait une connectivité augmentée avec le thalamus ou le rACC chez les patientes. Au contraire, une connectivité réduite dans le réseau inhibiteur de la douleur pendant une stimulation douloureuse externe a été observée, qui pourrait être à la base de la permanence de la douleur dans la FM.
). Les résultats montrent une connectivité réduite entre le rACC et l’amygdale, l’hippocampe et le tronc cérébral, et le thalamus et le cortex orbitofrontal chez les 28 patientes atteintes de FM étudiées comparées aux 14 contrôles. Aucune zone ne montrait une connectivité augmentée avec le thalamus ou le rACC chez les patientes. Au contraire, une connectivité réduite dans le réseau inhibiteur de la douleur pendant une stimulation douloureuse externe a été observée, qui pourrait être à la base de la permanence de la douleur dans la FM. ) ont également utilisé l’IRMf pour étudier les réponses cérébrales à une stimulation mécanique exercée sur l’ongle du pouce. Ces auteurs ont comparé un groupe de 9 patientes à 2 groupes de 9 contrôles, l’un recevant la même intensité de stimulation mécanique (donc apparié pour le stimulus), et le second recevant un stimulus d’intensité variable permettant de ressentir une douleur de même intensité (donc apparié pour l’intensité de la douleur). Comme dans les études précédentes, les patientes avaient un seuil de douleur plus bas que les contrôles. Quand le même stimulus en termes d’intensité a été utilisé dans les 2 groupes, la matrice de douleur était activée chez les patientes mais pas chez les contrôles. En appliquant chez les patientes une stimulation d’intensité moins forte que chez les contrôles pour reproduire la même intensité de douleur, les auteurs ont observé une activité BOLD3
plus forte dans l’insula antérieure, le cortex cingulaire antérieur et les noyaux sous-corticaux que chez les contrôles. Ces résultats confirment de nouveau l’existence d’une activité accrue chez les patientes atteintes de FM dans des régions de la matrice de la douleur, surtout celles qui sont impliquées dans les aspects émotionnels de cette dernière, comparées à des contrôles.
) ont également utilisé l’IRMf pour étudier les réponses cérébrales à une stimulation mécanique exercée sur l’ongle du pouce. Ces auteurs ont comparé un groupe de 9 patientes à 2 groupes de 9 contrôles, l’un recevant la même intensité de stimulation mécanique (donc apparié pour le stimulus), et le second recevant un stimulus d’intensité variable permettant de ressentir une douleur de même intensité (donc apparié pour l’intensité de la douleur). Comme dans les études précédentes, les patientes avaient un seuil de douleur plus bas que les contrôles. Quand le même stimulus en termes d’intensité a été utilisé dans les 2 groupes, la matrice de douleur était activée chez les patientes mais pas chez les contrôles. En appliquant chez les patientes une stimulation d’intensité moins forte que chez les contrôles pour reproduire la même intensité de douleur, les auteurs ont observé une activité BOLD3
plus forte dans l’insula antérieure, le cortex cingulaire antérieur et les noyaux sous-corticaux que chez les contrôles. Ces résultats confirment de nouveau l’existence d’une activité accrue chez les patientes atteintes de FM dans des régions de la matrice de la douleur, surtout celles qui sont impliquées dans les aspects émotionnels de cette dernière, comparées à des contrôles. ) qui compare des réponses BOLD à une stimulation mécanique douloureuse (pression sur l’ongle du pouce droit) entre un large échantillon de patientes atteintes de FM (n = 37, critères ACR 1990) et un groupe contrôle de 35 femmes en bonne santé. Les auteurs ont utilisé à la fois des tests de douleur mécanique et des réponses à différentes stimulations sensorielles non-douloureuses (visuelles, auditives et motrices) pour 1) caractériser les altérations du traitement sensoriel propres à la FM ; et 2) pour établir des relations entre ces caractéristiques physiopathologiques et les symptômes des patientes. Les auteurs ont appliqué des algorithmes d’apprentissage automatique développés par Wager et coll. (2013
) qui compare des réponses BOLD à une stimulation mécanique douloureuse (pression sur l’ongle du pouce droit) entre un large échantillon de patientes atteintes de FM (n = 37, critères ACR 1990) et un groupe contrôle de 35 femmes en bonne santé. Les auteurs ont utilisé à la fois des tests de douleur mécanique et des réponses à différentes stimulations sensorielles non-douloureuses (visuelles, auditives et motrices) pour 1) caractériser les altérations du traitement sensoriel propres à la FM ; et 2) pour établir des relations entre ces caractéristiques physiopathologiques et les symptômes des patientes. Les auteurs ont appliqué des algorithmes d’apprentissage automatique développés par Wager et coll. (2013 ) pour différencier les patientes des contrôles sains en fonction de leurs réponses cérébrales à une douleur à la pression combinée à une stimulation motrice, visuelle, auditive ou tactile non douloureuse. Pour mener leurs analyses, les auteurs ont distingué les réponses en signature neurologique de la douleur (SND) positive ou négative selon que la douleur induisait respectivement une augmentation ou une diminution du signal BOLD. Des zones SND positives typiques sont le thalamus, SI, SII, insula, et ACC, tandis que le pgACC et le PCC sont des zones SND négatives typiques. Quand les patientes et les contrôles ont été soumises à un stimulus de même intensité, une activité plus élevée a été observée dans des régions SND positives et SDN négatives chez les patientes. Quand le niveau de douleur ressentie était identique entre les patientes et les contrôles, les différences entre les deux groupes disparaissaient. Les chercheurs ont ainsi proposé un modèle de classification « douleur fibromyalgique », qui permet de distinguer les patientes atteintes de FM des contrôles avec une précision de 70 % dans leur échantillon. Ils ont également proposé un modèle de classification « multisensoriel, non-douloureux », qui distingue les patientes atteintes de FM des contrôles. Ce dernier modèle repose sur une activité accrue des régions hétéromodales associées à une intégration multisensorielle (insula/operculum) et des régions du DMN (comprenant le cortex cingulaire postérieur (CCP)/précuneus et le cortex préfrontal dorsomédian) chez les patientes atteintes de FM. En revanche, une activité réduite chez les patientes atteintes de FM apparaitrait dans les zones sensorielles primaires et secondaires, qui sont associées au traitement des informations visuelles et auditives, respectivement. Appliqué à de nouveaux participants, le modèle multisensoriel a permis de distinguer les patients atteints de FM des contrôles avec une précision de 89 %. Enfin, l’utilisation combinée des modèles SND, « douleur fibromyalgique » et « multisensoriel, non douloureux » a permis de distinguer des patientes avec FM de témoins avec une sensibilité de 92 % et une spécificité de 94 % dans un échantillon indépendant (López-Solá et coll., 2017
) pour différencier les patientes des contrôles sains en fonction de leurs réponses cérébrales à une douleur à la pression combinée à une stimulation motrice, visuelle, auditive ou tactile non douloureuse. Pour mener leurs analyses, les auteurs ont distingué les réponses en signature neurologique de la douleur (SND) positive ou négative selon que la douleur induisait respectivement une augmentation ou une diminution du signal BOLD. Des zones SND positives typiques sont le thalamus, SI, SII, insula, et ACC, tandis que le pgACC et le PCC sont des zones SND négatives typiques. Quand les patientes et les contrôles ont été soumises à un stimulus de même intensité, une activité plus élevée a été observée dans des régions SND positives et SDN négatives chez les patientes. Quand le niveau de douleur ressentie était identique entre les patientes et les contrôles, les différences entre les deux groupes disparaissaient. Les chercheurs ont ainsi proposé un modèle de classification « douleur fibromyalgique », qui permet de distinguer les patientes atteintes de FM des contrôles avec une précision de 70 % dans leur échantillon. Ils ont également proposé un modèle de classification « multisensoriel, non-douloureux », qui distingue les patientes atteintes de FM des contrôles. Ce dernier modèle repose sur une activité accrue des régions hétéromodales associées à une intégration multisensorielle (insula/operculum) et des régions du DMN (comprenant le cortex cingulaire postérieur (CCP)/précuneus et le cortex préfrontal dorsomédian) chez les patientes atteintes de FM. En revanche, une activité réduite chez les patientes atteintes de FM apparaitrait dans les zones sensorielles primaires et secondaires, qui sont associées au traitement des informations visuelles et auditives, respectivement. Appliqué à de nouveaux participants, le modèle multisensoriel a permis de distinguer les patients atteints de FM des contrôles avec une précision de 89 %. Enfin, l’utilisation combinée des modèles SND, « douleur fibromyalgique » et « multisensoriel, non douloureux » a permis de distinguer des patientes avec FM de témoins avec une sensibilité de 92 % et une spécificité de 94 % dans un échantillon indépendant (López-Solá et coll., 2017 ). Ces résultats confirment des résultats précédents selon lesquels les patients atteints de FM ont une hypersensibilité de leur matrice de douleur (Pujol et coll., 2009
). Ces résultats confirment des résultats précédents selon lesquels les patients atteints de FM ont une hypersensibilité de leur matrice de douleur (Pujol et coll., 2009 ). De plus, ils suggèrent que les patients se distinguent des contrôles par leurs réactions aux stimulations sensorielles non-nociceptives. L’utilisation des modèles d’activation cérébrale proposés par cette équipe pourrait constituer un outil de diagnostic de FM d’une grande spécificité s’ils étaient confirmés par d’autres, ce qui n’est pas le cas à ce jour.
). De plus, ils suggèrent que les patients se distinguent des contrôles par leurs réactions aux stimulations sensorielles non-nociceptives. L’utilisation des modèles d’activation cérébrale proposés par cette équipe pourrait constituer un outil de diagnostic de FM d’une grande spécificité s’ils étaient confirmés par d’autres, ce qui n’est pas le cas à ce jour. ) ont étudié la corrélation entre un polymorphisme génétique fonctionnel dans le gène codant la protéine TSPO (pour translocator protein 18 kDa)4
et l’activité cérébrale en réponse à une douleur générée par une pression calibrée individuellement. Ils ont ainsi montré dans un groupe de 24 patients atteints de FM une corrélation entre le génotype « liaisons d’affinité TSPO élevées », une sévérité de la douleur et des symptômes plus sévères, et une connectivité fonctionnelle plus prononcée entre la zone préfrontale dorsolatérale et le cortex pariétal droit. Cette étude montre qu’il peut être également important de prendre en compte des facteurs génétiques dans l’interprétation des résultats.
) ont étudié la corrélation entre un polymorphisme génétique fonctionnel dans le gène codant la protéine TSPO (pour translocator protein 18 kDa)4
et l’activité cérébrale en réponse à une douleur générée par une pression calibrée individuellement. Ils ont ainsi montré dans un groupe de 24 patients atteints de FM une corrélation entre le génotype « liaisons d’affinité TSPO élevées », une sévérité de la douleur et des symptômes plus sévères, et une connectivité fonctionnelle plus prononcée entre la zone préfrontale dorsolatérale et le cortex pariétal droit. Cette étude montre qu’il peut être également important de prendre en compte des facteurs génétiques dans l’interprétation des résultats.• Imageries fonctionnelles autres que l’IRMf
 ; Uceyler et coll., 2015
; Uceyler et coll., 2015 ; Montoro et coll., 2016
; Montoro et coll., 2016 ). En utilisant la fNIRS, Uceyler et coll. (2015
). En utilisant la fNIRS, Uceyler et coll. (2015 ) ont étudié les réponses cérébrales à une stimulation mécanique douloureuse de l’avant-bras chez 25 patients atteints de FM (93 % de femmes), des sujets contrôles et des patients sans douleur mais souffrant d’un épisode dépressif majeur unipolaire. Comme dans les autres études, les patients atteints de FM avaient un seuil de douleur plus faible que les autres groupes. De plus, la stimulation douloureuse induisait une activation corticale bilatérale. Enfin, le cortex préfrontal dorsolatéral des patients avec FM était plus fortement activé comparé aux patients souffrant d’un épisode dépressif majeur.
) ont étudié les réponses cérébrales à une stimulation mécanique douloureuse de l’avant-bras chez 25 patients atteints de FM (93 % de femmes), des sujets contrôles et des patients sans douleur mais souffrant d’un épisode dépressif majeur unipolaire. Comme dans les autres études, les patients atteints de FM avaient un seuil de douleur plus faible que les autres groupes. De plus, la stimulation douloureuse induisait une activation corticale bilatérale. Enfin, le cortex préfrontal dorsolatéral des patients avec FM était plus fortement activé comparé aux patients souffrant d’un épisode dépressif majeur. ). Deux niveaux de stimulation ont été appliqués : une pression fixe et une pression calibrée évoquant la même douleur chez tous les participants. Les réponses cérébrales ont été enregistrées avant la stimulation (phase anticipative) et pendant celle-ci. Une réponse anticipative était mesurable seulement dans le groupe FM et spécifiquement dans l’artère cérébrale antérieure (ACA) qui irrigue des régions médianes-antérieures du cerveau. Le groupe FM montrait également une forte augmentation du signal échographique pendant la phase initiale post-stimulation dans la condition pression fixe. Les auteurs ont aussi observé une corrélation entre sévérité de la douleur clinique et les réponses dans l’artère cérébrale médiane qui irrigue des régions latérales impliquées dans les aspects sensoriels de la douleur. Ces résultats renforcent l’hypothèse de l’implication des structures antéro-médianes, telles que l’ACC et le cortex préfrontal ventromédian, dans le traitement anticipatif de la douleur. La réponse cérébrale anticipative chez les patients peut être liée à divers mécanismes cognitifs, émotionnels ou comportementaux qui sont impliqués dans la chronologie de la survenue de la sensation douloureuse.
). Deux niveaux de stimulation ont été appliqués : une pression fixe et une pression calibrée évoquant la même douleur chez tous les participants. Les réponses cérébrales ont été enregistrées avant la stimulation (phase anticipative) et pendant celle-ci. Une réponse anticipative était mesurable seulement dans le groupe FM et spécifiquement dans l’artère cérébrale antérieure (ACA) qui irrigue des régions médianes-antérieures du cerveau. Le groupe FM montrait également une forte augmentation du signal échographique pendant la phase initiale post-stimulation dans la condition pression fixe. Les auteurs ont aussi observé une corrélation entre sévérité de la douleur clinique et les réponses dans l’artère cérébrale médiane qui irrigue des régions latérales impliquées dans les aspects sensoriels de la douleur. Ces résultats renforcent l’hypothèse de l’implication des structures antéro-médianes, telles que l’ACC et le cortex préfrontal ventromédian, dans le traitement anticipatif de la douleur. La réponse cérébrale anticipative chez les patients peut être liée à divers mécanismes cognitifs, émotionnels ou comportementaux qui sont impliqués dans la chronologie de la survenue de la sensation douloureuse.• Conclusion des études d’imagerie fonctionnelle en réponse
à une douleur évoquée
Altérations dans les réseaux de repos
 ; Kim et coll., 2013
; Kim et coll., 2013 ; Flodin et coll., 2014
; Flodin et coll., 2014 ; Ichesco et coll., 2014
; Ichesco et coll., 2014 ; Pujol et coll., 2014
; Pujol et coll., 2014 ; Kim et coll., 2015
; Kim et coll., 2015 ; Fallon et coll., 2016
; Fallon et coll., 2016 ; Ichesco et coll., 2016
; Ichesco et coll., 2016 ; Truini et coll., 2016
; Truini et coll., 2016 ; Hsiao et coll., 2017
; Hsiao et coll., 2017 ; Kutch et coll., 2017
; Kutch et coll., 2017 ; Basu et coll., 2018
; Basu et coll., 2018 ). Ces études ont inclus un total de 223 patients et 243 contrôles. Le nombre moyen de patients par étude s’élève à 21. Quatre études n’incluent pas plus de 20 patients et le plus grand nombre de patients par étude est de 40. L’âge moyen des patients est de 43 ± 4 ans et 97 % des participants sont des femmes.
). Ces études ont inclus un total de 223 patients et 243 contrôles. Le nombre moyen de patients par étude s’élève à 21. Quatre études n’incluent pas plus de 20 patients et le plus grand nombre de patients par étude est de 40. L’âge moyen des patients est de 43 ± 4 ans et 97 % des participants sont des femmes. ) ont évalué les éventuels changements des connectivités fonctionnelles (CF) cérébrales entre la substance grise périaqueducale (PAG, une structure cruciale dans la modulation endogène de la douleur) et le cortex somatosensoriel, en particulier le SII. Ils ont observé une CF réduite entre la PAG et l’insula antérieure d’une part, et entre SII (et SI) et les cortex visuel et auditif d’autre part, chez les patients atteints de FM. En revanche, les patients ont une CF augmentée entre le SII et le DMN6
d’une part, et entre le SII, le cortex cingulaire postérieur et l’insula ventrale d’autre part. Le niveau de douleur spontanée est positivement corrélé aux mesures de CF entre le SII et le PCC, l’ACC et le cortex préfrontal. Ces résultats indiquent que la baisse de CF dans la FM s’étend au-delà du domaine somatosensoriel et implique d’autres modalités sensorielles. Les auteurs suggèrent qu’un affaiblissement général de l’intégration sensorielle est à l’origine de la douleur clinique dans la FM.
) ont évalué les éventuels changements des connectivités fonctionnelles (CF) cérébrales entre la substance grise périaqueducale (PAG, une structure cruciale dans la modulation endogène de la douleur) et le cortex somatosensoriel, en particulier le SII. Ils ont observé une CF réduite entre la PAG et l’insula antérieure d’une part, et entre SII (et SI) et les cortex visuel et auditif d’autre part, chez les patients atteints de FM. En revanche, les patients ont une CF augmentée entre le SII et le DMN6
d’une part, et entre le SII, le cortex cingulaire postérieur et l’insula ventrale d’autre part. Le niveau de douleur spontanée est positivement corrélé aux mesures de CF entre le SII et le PCC, l’ACC et le cortex préfrontal. Ces résultats indiquent que la baisse de CF dans la FM s’étend au-delà du domaine somatosensoriel et implique d’autres modalités sensorielles. Les auteurs suggèrent qu’un affaiblissement général de l’intégration sensorielle est à l’origine de la douleur clinique dans la FM. ), alors que l’autre rapporte une diminution de CF entre DMN et insula (Hsiao et coll., 2017
), alors que l’autre rapporte une diminution de CF entre DMN et insula (Hsiao et coll., 2017 ). Après une stimulation mécanique tonique de la jambe dans 2 études, Ichesco et coll. ont décrit des combinaisons complexes d’augmentations et de diminutions de CF entre insula et cortex cingulaire (Ichesco et coll., 2014
). Après une stimulation mécanique tonique de la jambe dans 2 études, Ichesco et coll. ont décrit des combinaisons complexes d’augmentations et de diminutions de CF entre insula et cortex cingulaire (Ichesco et coll., 2014 ), tandis que l’autre mentionne une augmentation de CF entre insula et ACC d’une part, et insula et hippocampe d’autre part (Ichesco et coll., 2016
), tandis que l’autre mentionne une augmentation de CF entre insula et ACC d’une part, et insula et hippocampe d’autre part (Ichesco et coll., 2016 ).
). ). Une autre étude, effectuée sur un très petit nombre de patients (9 comparés à 11 contrôles), rapporte une dizaine de zones de la matrice de la douleur avec une CF augmentée, et autant de zones avec une CF réduite chez les patients comparés aux contrôles (Cifré et coll., 2012
). Une autre étude, effectuée sur un très petit nombre de patients (9 comparés à 11 contrôles), rapporte une dizaine de zones de la matrice de la douleur avec une CF augmentée, et autant de zones avec une CF réduite chez les patients comparés aux contrôles (Cifré et coll., 2012 ). Les résultats de l’étude de Truini et coll. (2016
). Les résultats de l’étude de Truini et coll. (2016 ) sont moins ambigus. Ces auteurs ont exploré les changements de CF entre la PAG et d’autres régions cérébrales chez 20 patients comparés à 15 sujets contrôles. Ils montrent une augmentation de CF entre PAG et insula, PAG et ACC, et PAG et cortex préfrontal. Les modifications de CF sont corrélées à l’intensité de la douleur et la présence d’une dépression. Finalement, une étude effectuée chez 35 patients comparés à 14 contrôles a exploré la CF du SI (Kim et coll., 2015
) sont moins ambigus. Ces auteurs ont exploré les changements de CF entre la PAG et d’autres régions cérébrales chez 20 patients comparés à 15 sujets contrôles. Ils montrent une augmentation de CF entre PAG et insula, PAG et ACC, et PAG et cortex préfrontal. Les modifications de CF sont corrélées à l’intensité de la douleur et la présence d’une dépression. Finalement, une étude effectuée chez 35 patients comparés à 14 contrôles a exploré la CF du SI (Kim et coll., 2015 ). Les auteurs ont défini 12 régions d’intérêt (ROI) dans l’aire SI, basées sur la représentation somatique de différentes parties du corps. Au repos, les patients ont une CF réduite entre les différentes sous-régions de SI comparés aux contrôles. En réponse à une stimulation douloureuse mécanique et tonique de la jambe, la CF entre SI et l’insula antérieure augmente plus dans le groupe FM comparé au groupe contrôle. Cette augmentation était corrélée à l’intensité de la douleur chronique dans le groupe FM.
). Les auteurs ont défini 12 régions d’intérêt (ROI) dans l’aire SI, basées sur la représentation somatique de différentes parties du corps. Au repos, les patients ont une CF réduite entre les différentes sous-régions de SI comparés aux contrôles. En réponse à une stimulation douloureuse mécanique et tonique de la jambe, la CF entre SI et l’insula antérieure augmente plus dans le groupe FM comparé au groupe contrôle. Cette augmentation était corrélée à l’intensité de la douleur chronique dans le groupe FM. ). Les patients atteints d’UCPPS avec douleur généralisée avaient une CF entre le réseau de saillance7
(salience network) et un cluster dans les structures SI/MI (somatosensory/primary motor cortex) plus importante, comparés à des patients atteints d’UCPPS dont la douleur était plus focalisée. Une même corrélation entre localisation de la douleur et importance de la CF entre le réseau de saillance et les structures SI/MI a été retrouvée chez les patients atteints de FM. De plus, un total de 37 paires de régions cérébrales montrait une CF augmentée dans le cas « douleur largement répandue » comparé à « douleur focalisée », à la fois dans le groupe UCPPS et dans le groupe FM. Enfin, les auteurs ont observé une corrélation entre l’étendue corporelle de la douleur et le volume de matière grise du cortex moteur supplémentaire droit et bilatéral dans les structures SI/MI.
). Les patients atteints d’UCPPS avec douleur généralisée avaient une CF entre le réseau de saillance7
(salience network) et un cluster dans les structures SI/MI (somatosensory/primary motor cortex) plus importante, comparés à des patients atteints d’UCPPS dont la douleur était plus focalisée. Une même corrélation entre localisation de la douleur et importance de la CF entre le réseau de saillance et les structures SI/MI a été retrouvée chez les patients atteints de FM. De plus, un total de 37 paires de régions cérébrales montrait une CF augmentée dans le cas « douleur largement répandue » comparé à « douleur focalisée », à la fois dans le groupe UCPPS et dans le groupe FM. Enfin, les auteurs ont observé une corrélation entre l’étendue corporelle de la douleur et le volume de matière grise du cortex moteur supplémentaire droit et bilatéral dans les structures SI/MI.Processus cognitifs dans la fibromyalgie
 ; Jensen et coll., 2010
; Jensen et coll., 2010 ; Burgmer et coll., 2011
; Burgmer et coll., 2011 ; Glass et coll., 2011
; Glass et coll., 2011 ; Seo et coll., 2012
; Seo et coll., 2012 ; Lee et coll., 2013
; Lee et coll., 2013 ; Brown et coll., 2014
; Brown et coll., 2014 ; Fallon et coll., 2015
; Fallon et coll., 2015 ; Loggia et coll., 2015
; Loggia et coll., 2015 ; Montoro et coll., 2015
; Montoro et coll., 2015 ; Rahm et coll., 2015
; Rahm et coll., 2015 ; Reyes del Paso et coll., 2015
; Reyes del Paso et coll., 2015 ; González-Roldán et coll., 2016
; González-Roldán et coll., 2016 ; Chou et coll., 2018
; Chou et coll., 2018 ; Lee et coll., 2018
; Lee et coll., 2018 ; Martinsen et coll., 2018
; Martinsen et coll., 2018 ; Martucci et coll., 2018
; Martucci et coll., 2018 ). Ces études ont inclus un total de 438 patients et 244 sujets contrôles. L’âge moyen des patients était de 47 ± 4 ans, et 94 % des participants étaient des femmes. Le nombre moyen de patients s’élève à 26 (médiane : 19) et celui de contrôles à 19. Huit études incluent plus de 20 patients. Trois études évaluent l’anticipation d’une stimulation douloureuse, 4 l’effet du catastrophisme, 4 les fonctions exécutives, 2 l’empathie pour la douleur et 2 la mémoire de travail.
). Ces études ont inclus un total de 438 patients et 244 sujets contrôles. L’âge moyen des patients était de 47 ± 4 ans, et 94 % des participants étaient des femmes. Le nombre moyen de patients s’élève à 26 (médiane : 19) et celui de contrôles à 19. Huit études incluent plus de 20 patients. Trois études évaluent l’anticipation d’une stimulation douloureuse, 4 l’effet du catastrophisme, 4 les fonctions exécutives, 2 l’empathie pour la douleur et 2 la mémoire de travail. ) rapportent une activité augmentée dans l’hippocampe chez les patients atteints de FM comparés aux contrôles, alors que Burgmer et coll. (2011
) rapportent une activité augmentée dans l’hippocampe chez les patients atteints de FM comparés aux contrôles, alors que Burgmer et coll. (2011 ) rapportent une augmentation dans le cortex dorsolatéral préfrontal, la PAG et le cortex pariétal postérieur. Une 3e étude, menée en EEG, rapporte quant à elle une augmentation dans l’insula et une diminution dans le cortex dorsolatéral préfrontal (Brown et coll., 2014
) rapportent une augmentation dans le cortex dorsolatéral préfrontal, la PAG et le cortex pariétal postérieur. Une 3e étude, menée en EEG, rapporte quant à elle une augmentation dans l’insula et une diminution dans le cortex dorsolatéral préfrontal (Brown et coll., 2014 ).
). ) ont exploré l’effet de l’anxiété et du catastrophisme chez 83 patients atteints de FM, mais sans inclure de groupe contrôle. Il est important de noter que les données exploitées dans ce travail viennent du bras placebo d’une étude pharmacologique soutenue financièrement par une compagnie pharmaceutique. Les participants de cette étude ont été classés en 4 groupes en fonction de leur niveau de dépression, allant d’absente à sévère. De façon surprenante, les auteurs ne trouvent pas de différences d’activation corticale entre les patients avec un haut ou un faible niveau de dépression, ni entre patients présentant des niveaux différents de catastrophisme ou d’anxiété. Une étude antérieure, réalisée chez 29 patients atteints de FM, montrait au contraire qu’un haut niveau de catastrophisme était associé à une activité unilatérale plus importante dans le SII et l’ACC et à une activité bilatérale du nucleus lentiforme bilatéral (Gracely et coll., 2004
) ont exploré l’effet de l’anxiété et du catastrophisme chez 83 patients atteints de FM, mais sans inclure de groupe contrôle. Il est important de noter que les données exploitées dans ce travail viennent du bras placebo d’une étude pharmacologique soutenue financièrement par une compagnie pharmaceutique. Les participants de cette étude ont été classés en 4 groupes en fonction de leur niveau de dépression, allant d’absente à sévère. De façon surprenante, les auteurs ne trouvent pas de différences d’activation corticale entre les patients avec un haut ou un faible niveau de dépression, ni entre patients présentant des niveaux différents de catastrophisme ou d’anxiété. Une étude antérieure, réalisée chez 29 patients atteints de FM, montrait au contraire qu’un haut niveau de catastrophisme était associé à une activité unilatérale plus importante dans le SII et l’ACC et à une activité bilatérale du nucleus lentiforme bilatéral (Gracely et coll., 2004 ). Une étude plus récente a mesuré l’activité cérébrale pendant la période d’anticipation d’une stimulation douloureuse dans un groupe de 31 patients (Loggia et coll., 2015
). Une étude plus récente a mesuré l’activité cérébrale pendant la période d’anticipation d’une stimulation douloureuse dans un groupe de 31 patients (Loggia et coll., 2015 ). Ces auteurs rapportent que le niveau d’activité dans le cortex latéral préfrontal, le cortex pariétal supérieur et le precuneus est corrélé au niveau de catastrophisme. De plus, ils montrent que l’activité dans le cortex latéral préfrontal sous-tend l’association entre catastrophisme et intensité de la douleur.
). Ces auteurs rapportent que le niveau d’activité dans le cortex latéral préfrontal, le cortex pariétal supérieur et le precuneus est corrélé au niveau de catastrophisme. De plus, ils montrent que l’activité dans le cortex latéral préfrontal sous-tend l’association entre catastrophisme et intensité de la douleur. ) ne rapportent pas de différence entre les performances des 28 patients évalués et celles des contrôles, alors que l’activité du DMN était plus importante chez les patients pendant la tâche. Seo et coll. (2012
) ne rapportent pas de différence entre les performances des 28 patients évalués et celles des contrôles, alors que l’activité du DMN était plus importante chez les patients pendant la tâche. Seo et coll. (2012 ) trouvent quant à eux une baisse de la performance chez les patients, qui est associée à une réduction de la réponse BOLD au niveau du cortex ventrolatéral préfrontal, du thalamus, et du cortex infrapariétal, associées à un niveau élevé de symptômes dépressifs et d’anxiété. Rappelons que dans l’étude de Jensen et coll. (2010
) trouvent quant à eux une baisse de la performance chez les patients, qui est associée à une réduction de la réponse BOLD au niveau du cortex ventrolatéral préfrontal, du thalamus, et du cortex infrapariétal, associées à un niveau élevé de symptômes dépressifs et d’anxiété. Rappelons que dans l’étude de Jensen et coll. (2010 ), ces deux facteurs n’ont pas d’effet sur le signal BOLD.
), ces deux facteurs n’ont pas d’effet sur le signal BOLD. ) ont exploré par échographie Doppler transcrânienne 45 patients contre 32 sujets sains lors de la réalisation d’une tâche de calcul mental. Les auteurs rapportent l’absence de réponse cérébrale précoce au niveau de l’artère cérébrale moyenne (MCA) et l’artère cérébrale antérieure (ACA) dans le groupe FM, alors qu’une telle réponse apparaît chez les sujets normaux immédiatement après un signal d’avertissement indiquant que la tâche va suivre. L’ACA irrigue les régions cérébrales médio-antérieures associées à la douleur et à la cognition (ACC, cortex préfrontal médian), alors que la MCA alimente les zones cérébrales latérales associées à la composante sensorielle de la douleur (SI, lobule pariétal, etc.). Une seconde étude ayant utilisé le paradigme du temps de réaction avec amorçage (cued reaction time) rapporte que les patients ont un déficit dans la composante de vigilance de l’attention, à la fois au niveau comportemental, de la perfusion cérébrale sanguine et de la réponse autonome (mesure du rythme cardiaque montrant une bradycardie) (Reyes Del Paso et coll., 2015
) ont exploré par échographie Doppler transcrânienne 45 patients contre 32 sujets sains lors de la réalisation d’une tâche de calcul mental. Les auteurs rapportent l’absence de réponse cérébrale précoce au niveau de l’artère cérébrale moyenne (MCA) et l’artère cérébrale antérieure (ACA) dans le groupe FM, alors qu’une telle réponse apparaît chez les sujets normaux immédiatement après un signal d’avertissement indiquant que la tâche va suivre. L’ACA irrigue les régions cérébrales médio-antérieures associées à la douleur et à la cognition (ACC, cortex préfrontal médian), alors que la MCA alimente les zones cérébrales latérales associées à la composante sensorielle de la douleur (SI, lobule pariétal, etc.). Une seconde étude ayant utilisé le paradigme du temps de réaction avec amorçage (cued reaction time) rapporte que les patients ont un déficit dans la composante de vigilance de l’attention, à la fois au niveau comportemental, de la perfusion cérébrale sanguine et de la réponse autonome (mesure du rythme cardiaque montrant une bradycardie) (Reyes Del Paso et coll., 2015 ). Ces résultats peuvent être interprétés comme étant dus à une activation cérébrale moindre pendant une tâche cognitive chez les patients comparés aux contrôles.
). Ces résultats peuvent être interprétés comme étant dus à une activation cérébrale moindre pendant une tâche cognitive chez les patients comparés aux contrôles. ) rapporte une augmentation du composant tardif du potentiel évoqué aux images douloureuses et neutres chez des patients atteints de FM, celle de Lee et coll. (2013
) rapporte une augmentation du composant tardif du potentiel évoqué aux images douloureuses et neutres chez des patients atteints de FM, celle de Lee et coll. (2013 ) observe une diminution de la réponse cérébrale dans plusieurs zones de la matrice de la douleur (Lee et coll., 2013
) observe une diminution de la réponse cérébrale dans plusieurs zones de la matrice de la douleur (Lee et coll., 2013 ).
).Évaluation en imagerie fonctionnelle de l’effet d’interventions thérapeutiques
 ; Jensen et coll., 2012a
; Jensen et coll., 2012a ; Napadow et coll., 2012
; Napadow et coll., 2012 ; Harris et coll., 2013
; Harris et coll., 2013 ; Kamping et coll., 2013
; Kamping et coll., 2013 ; Schmidt-Wilcke et coll., 2014
; Schmidt-Wilcke et coll., 2014 ; Schmidt-Wilcke et coll., 2014
; Schmidt-Wilcke et coll., 2014 ; Efrati et coll., 2015
; Efrati et coll., 2015 ; Flodin et coll., 2015
; Flodin et coll., 2015 ; Rahm et coll., 2015
; Rahm et coll., 2015 ; Ellingson et coll., 2016
; Ellingson et coll., 2016 ; Derbyshire et coll., 2017
; Derbyshire et coll., 2017 ; Lazaridou et coll., 2017
; Lazaridou et coll., 2017 ; Ahmed et coll., 2018
; Ahmed et coll., 2018 ; Goldway et coll., 2018
; Goldway et coll., 2018 ; Martinsen et coll., 2018
; Martinsen et coll., 2018 ). La plupart de ces études ont examiné l’effet d’une intervention cognitive (n = 6), celui d’agents pharmacologiques ou d’une activité physique (n = 3 pour chacun). Ces études ont inclus un total de 289 patients et 134 sujets contrôles. L’âge moyen des patients était de 45 ± 5 ans et 92 % des participants étaient des femmes. Le nombre moyen de patients par étude s’élève à 18 et celui de contrôles sains à 15. Quatre études incluent plus de 20 patients. Pour la plupart des études, il manque une intervention de type « contrôle », ce qui rend l’interprétation des résultats problématique. Parmi les 3 études explorant l’effet d’une intervention pharmacologique, 2 ont été soutenues par l’industrie pharmaceutique.
). La plupart de ces études ont examiné l’effet d’une intervention cognitive (n = 6), celui d’agents pharmacologiques ou d’une activité physique (n = 3 pour chacun). Ces études ont inclus un total de 289 patients et 134 sujets contrôles. L’âge moyen des patients était de 45 ± 5 ans et 92 % des participants étaient des femmes. Le nombre moyen de patients par étude s’élève à 18 et celui de contrôles sains à 15. Quatre études incluent plus de 20 patients. Pour la plupart des études, il manque une intervention de type « contrôle », ce qui rend l’interprétation des résultats problématique. Parmi les 3 études explorant l’effet d’une intervention pharmacologique, 2 ont été soutenues par l’industrie pharmaceutique. ) comparent l’effet d’un programme de thérapie cognitive-comportementale (TCC) à un programme éducatif de 4 semaines (informations sur la FM) dans un groupe de 16 patients. À la fin de l’essai, les patients du programme TCC avaient des seuils de douleur et des niveaux de catastrophisme plus réduits comparé au groupe contrôle, associés à une diminution de la CF entre l’insula et le SI. Une autre étude rapporte qu’un traitement de 2 semaines avec de la prégabaline réduisait la douleur et était associé à une diminution de la CF entre l’insula postérieure et les structures du DMN (Harris et coll., 2013
) comparent l’effet d’un programme de thérapie cognitive-comportementale (TCC) à un programme éducatif de 4 semaines (informations sur la FM) dans un groupe de 16 patients. À la fin de l’essai, les patients du programme TCC avaient des seuils de douleur et des niveaux de catastrophisme plus réduits comparé au groupe contrôle, associés à une diminution de la CF entre l’insula et le SI. Une autre étude rapporte qu’un traitement de 2 semaines avec de la prégabaline réduisait la douleur et était associé à une diminution de la CF entre l’insula postérieure et les structures du DMN (Harris et coll., 2013 ).
). ) mérite d’être détaillée en raison de la qualité de leur méthodologie. Ces auteurs ont testé l’effet d’une neuromodulation volontaire (neurofeedback) de l’activité de l’amygdale sur la douleur, la dépression, la fatigue et la qualité du sommeil. Trente-quatre patients ont été répartis de façon aléatoire entre « traitement par neuromodulation volontaire » ou « traitement par une procédure thérapeutique simulée (sham) ». Deux sessions de neuromodulation par semaine ont eu lieu sur 5 semaines. Les auteurs ont mesuré l’effet immédiat du traitement et à 3 ans. Parmi les sujets qui ont suivi le programme de neuromodulation volontaire, 13 ont été classés comme de bons modulateurs et 12 comme de mauvais modulateurs. La latence du sommeil paradoxal et l’index objectif de la qualité du sommeil étaient en nette amélioration uniquement dans le groupe « neuromodulation volontaire », et plus particulièrement chez les bons modulateurs. L’évaluation à 3 ans révélait une amélioration de la douleur chronique et de la qualité du sommeil mesurée de manière subjective dans le groupe « neuromodulation volontaire ». Les effets cliniques sur la douleur étaient prédits par les améliorations immédiates du sommeil (évaluation objective) et des mesures affectives (évaluation subjective).
) mérite d’être détaillée en raison de la qualité de leur méthodologie. Ces auteurs ont testé l’effet d’une neuromodulation volontaire (neurofeedback) de l’activité de l’amygdale sur la douleur, la dépression, la fatigue et la qualité du sommeil. Trente-quatre patients ont été répartis de façon aléatoire entre « traitement par neuromodulation volontaire » ou « traitement par une procédure thérapeutique simulée (sham) ». Deux sessions de neuromodulation par semaine ont eu lieu sur 5 semaines. Les auteurs ont mesuré l’effet immédiat du traitement et à 3 ans. Parmi les sujets qui ont suivi le programme de neuromodulation volontaire, 13 ont été classés comme de bons modulateurs et 12 comme de mauvais modulateurs. La latence du sommeil paradoxal et l’index objectif de la qualité du sommeil étaient en nette amélioration uniquement dans le groupe « neuromodulation volontaire », et plus particulièrement chez les bons modulateurs. L’évaluation à 3 ans révélait une amélioration de la douleur chronique et de la qualité du sommeil mesurée de manière subjective dans le groupe « neuromodulation volontaire ». Les effets cliniques sur la douleur étaient prédits par les améliorations immédiates du sommeil (évaluation objective) et des mesures affectives (évaluation subjective).Études en imagerie structurale
 ; Schmidt-Wilcke et coll., 2007
; Schmidt-Wilcke et coll., 2007 ; Lutz et coll., 2008
; Lutz et coll., 2008 ; Burgmer et coll., 2009b
; Burgmer et coll., 2009b ; Hsu et coll., 2009
; Hsu et coll., 2009 ; Puri et coll., 2010
; Puri et coll., 2010 ; Robinson et coll., 2011
; Robinson et coll., 2011 ; Ceko et coll., 2013
; Ceko et coll., 2013 ; Jensen et coll., 2013
; Jensen et coll., 2013 ; Kim et coll., 2014
; Kim et coll., 2014 ; Kim et coll., 2015
; Kim et coll., 2015 ; Diaz-Piedra et coll., 2016
; Diaz-Piedra et coll., 2016 ; Puiu et coll., 2016
; Puiu et coll., 2016 ; Pomares et coll., 2017
; Pomares et coll., 2017 ). Elles ont inclus un total de 302 patients et 291 sujets contrôles. L’âge moyen des patients est de 47 ± 7 ans et 99 % des participants sont des femmes. La durée moyenne des symptômes est de 14 ± 7 années. Le nombre moyen par étude est de 20 patients et 21 contrôles.
). Elles ont inclus un total de 302 patients et 291 sujets contrôles. L’âge moyen des patients est de 47 ± 7 ans et 99 % des participants sont des femmes. La durée moyenne des symptômes est de 14 ± 7 années. Le nombre moyen par étude est de 20 patients et 21 contrôles.Morphométrie basée sur le voxel et imagerie DTI
 ) sont parmi les premiers auteurs à avoir recherché des modifications structurelles dans le cerveau de patients atteints de FM. Ils rapportent une diminution de l’ensemble du volume de la substance grise avec l’âge qui serait 3 fois plus importante chez 10 patients comparés aux contrôles. Ils rapportent également des diminutions régionales de la substance grise dans le cortex cingulaire postérieur, l’insula gauche, le parahippocampe et le cortex médian frontal. Burgmer et coll. (2009
) sont parmi les premiers auteurs à avoir recherché des modifications structurelles dans le cerveau de patients atteints de FM. Ils rapportent une diminution de l’ensemble du volume de la substance grise avec l’âge qui serait 3 fois plus importante chez 10 patients comparés aux contrôles. Ils rapportent également des diminutions régionales de la substance grise dans le cortex cingulaire postérieur, l’insula gauche, le parahippocampe et le cortex médian frontal. Burgmer et coll. (2009
 ) n’ont pas confirmé cette diminution volumétrique chez 14 patients comparé à 14 contrôles et rapportent des diminutions de la substance grise dans des régions différentes de l’étude précédente (amygdale, cortex cingulaire antérieur et cortex préfrontal latéral). Hsu et coll. (2009
) n’ont pas confirmé cette diminution volumétrique chez 14 patients comparé à 14 contrôles et rapportent des diminutions de la substance grise dans des régions différentes de l’étude précédente (amygdale, cortex cingulaire antérieur et cortex préfrontal latéral). Hsu et coll. (2009 ) ne trouvent également pas de diminution de l’ensemble du volume de la substance grise dans 2 échantillons de patients (chacun composé de 29 patients, dont un avec épisode dépressif, comparés à 29 contrôles). Une analyse en ROI indique cependant une diminution du volume de la substance grise dans l’insula gauche chez les patients atteints de FM et de dépression, corrélée au niveau d’anxiété. Une diminution volumétrique de l’insula est également rapportée dans l’étude de Robinson et coll. (2011
) ne trouvent également pas de diminution de l’ensemble du volume de la substance grise dans 2 échantillons de patients (chacun composé de 29 patients, dont un avec épisode dépressif, comparés à 29 contrôles). Une analyse en ROI indique cependant une diminution du volume de la substance grise dans l’insula gauche chez les patients atteints de FM et de dépression, corrélée au niveau d’anxiété. Une diminution volumétrique de l’insula est également rapportée dans l’étude de Robinson et coll. (2011 ). Ces derniers auteurs rapportent également des diminutions dans la partie médiane et rostrale du cortex cingulaire, mais aucun de ces changements morphométriques n’était associé aux scores de dépression (Robinson et coll., 2011
). Ces derniers auteurs rapportent également des diminutions dans la partie médiane et rostrale du cortex cingulaire, mais aucun de ces changements morphométriques n’était associé aux scores de dépression (Robinson et coll., 2011 ). Ceci contraste avec l’étude menée par Diaz-Piedra et coll. (2016
). Ceci contraste avec l’étude menée par Diaz-Piedra et coll. (2016 ) qui rapporte une perte globale de la substance grise chez des patients atteints de FM qui serait attribuable pour plus d’un tiers à de l’anxiété, de la détresse, de la consommation d’antalgiques ou à des troubles du sommeil. Ces auteurs rapportent de plus une association particulière d’augmentation et de diminution de la substance grise dans plusieurs régions cérébrales chez les patients atteints de FM.
) qui rapporte une perte globale de la substance grise chez des patients atteints de FM qui serait attribuable pour plus d’un tiers à de l’anxiété, de la détresse, de la consommation d’antalgiques ou à des troubles du sommeil. Ces auteurs rapportent de plus une association particulière d’augmentation et de diminution de la substance grise dans plusieurs régions cérébrales chez les patients atteints de FM. ) ont évalué l’effet de la durée de la FM sur les changements morphométriques cérébraux. Ils ont divisé leur échantillon de 28 participants en 2 groupes : patients « jeunes » (29 à 49 ans, âge moyen de 43 ans) et « âgés » (51 à 60 ans, âge moyen de 55 ans). Les auteurs rapportent des différences importantes entre les 2 groupes, les patients « âgés » ayant exclusivement des diminutions de substance grise (ACC, cortex préfrontal médian et dorsolatéral et cortex cingulaire postérieur), alors que les patients « jeunes » ont des augmentations (insula, putamen, nucleus accumbens, globus pallidus et cortex préfrontal ventrolatéral). Alors que les diminutions de substance grise dans le cortex cingulaire postérieur étaient liées à une augmentation du seuil de douleur expérimentale chez les patients âgés, l’augmentation de la substance grise au niveau de l’insula chez les patients jeunes était corrélée à un seuil de douleur plus bas, ce qui suggére l’implication de mécanismes endogènes de modulation de la douleur.
) ont évalué l’effet de la durée de la FM sur les changements morphométriques cérébraux. Ils ont divisé leur échantillon de 28 participants en 2 groupes : patients « jeunes » (29 à 49 ans, âge moyen de 43 ans) et « âgés » (51 à 60 ans, âge moyen de 55 ans). Les auteurs rapportent des différences importantes entre les 2 groupes, les patients « âgés » ayant exclusivement des diminutions de substance grise (ACC, cortex préfrontal médian et dorsolatéral et cortex cingulaire postérieur), alors que les patients « jeunes » ont des augmentations (insula, putamen, nucleus accumbens, globus pallidus et cortex préfrontal ventrolatéral). Alors que les diminutions de substance grise dans le cortex cingulaire postérieur étaient liées à une augmentation du seuil de douleur expérimentale chez les patients âgés, l’augmentation de la substance grise au niveau de l’insula chez les patients jeunes était corrélée à un seuil de douleur plus bas, ce qui suggére l’implication de mécanismes endogènes de modulation de la douleur. ) rapportent une diminution de l’anisotropie fractionnelle (FA pour Fractional Anisotropy) au niveau du corps calleux, reliant les SMI des deux hémisphères cérébraux, chez 19 patients comparés à 21 contrôles.
) rapportent une diminution de l’anisotropie fractionnelle (FA pour Fractional Anisotropy) au niveau du corps calleux, reliant les SMI des deux hémisphères cérébraux, chez 19 patients comparés à 21 contrôles.Analyses par imagerie multimodale
 ), qui inclut 30 patients atteints de FM et 30 contrôles, les auteurs ont combiné la DTI au VBM. Une réduction volumétrique de la substance grise et une diminution de la FA ont été observées dans le SI, l’ACC, l’amygdale, l’hippocampe et le gyrus frontal supérieur. Une diminution de la FA a été observée dans le thalamus, l’insula et les voies thalamocorticales. Plusieurs mesures DTI étaient corrélées à des symptômes tels que la douleur, la fatigue ou le déconditionnement physique, mais aucune de ces corrélations n’a été retrouvée avec les mesures en VBM. Une seconde étude multimodale incluant 42 patients et 63 contrôles a combiné le VBM à la DTI, cette fois pour réaliser une analyse du type « structural covariance network analysis » qui permet d’estimer la manière dont le volume de substance grise dans une région cérébrale varie avec celui d’autres régions (Kim et coll., 2015
), qui inclut 30 patients atteints de FM et 30 contrôles, les auteurs ont combiné la DTI au VBM. Une réduction volumétrique de la substance grise et une diminution de la FA ont été observées dans le SI, l’ACC, l’amygdale, l’hippocampe et le gyrus frontal supérieur. Une diminution de la FA a été observée dans le thalamus, l’insula et les voies thalamocorticales. Plusieurs mesures DTI étaient corrélées à des symptômes tels que la douleur, la fatigue ou le déconditionnement physique, mais aucune de ces corrélations n’a été retrouvée avec les mesures en VBM. Une seconde étude multimodale incluant 42 patients et 63 contrôles a combiné le VBM à la DTI, cette fois pour réaliser une analyse du type « structural covariance network analysis » qui permet d’estimer la manière dont le volume de substance grise dans une région cérébrale varie avec celui d’autres régions (Kim et coll., 2015 ). Cette analyse a montré que les patients atteints de FM avaient plus de connexions dans le cervelet, alors que les contrôles en avaient plus dans le cortex préfrontal. Un sous-module distinct a été identifié chez les patients : ce sous-module, dont le volume de substance grise corrélé avec le niveau de dépression, contenait des connexions cérébelleuses aux lobes pariétaux médian préfrontaux, temporaux et inférieurs. Le volume d’un autre sous-module englobant les cortex latéraux orbitofrontaux, frontaux, post-centraux, temporaux latéraux et insulaires corrélait avec le niveau de douleur évoquée.
). Cette analyse a montré que les patients atteints de FM avaient plus de connexions dans le cervelet, alors que les contrôles en avaient plus dans le cortex préfrontal. Un sous-module distinct a été identifié chez les patients : ce sous-module, dont le volume de substance grise corrélé avec le niveau de dépression, contenait des connexions cérébelleuses aux lobes pariétaux médian préfrontaux, temporaux et inférieurs. Le volume d’un autre sous-module englobant les cortex latéraux orbitofrontaux, frontaux, post-centraux, temporaux latéraux et insulaires corrélait avec le niveau de douleur évoquée. ) ont conduit une étude de très grande envergure incluant la VBM, la spectroscopie de résonance magnétique du proton (H-MRS), la tomographie par émission de positons (TEP)10
avec le marqueur [18F] flumazénil pour mesurer la concentration des récepteurs GABAA, et la relaxométrie basée sur le voxel. Les 3 dernières mesures permettent d’explorer les bases neuropathologiques de modifications volumétriques. Les résultats en VBM ont montré des réductions de substance grise dans le cortex insulaire, cingulaire antérieur et postérieur, et précentral et le precuneus dans l’échantillon de 26 patientes atteintes de FM (âgées de 50 à 75 ans) comparées à 25 contrôles. Cependant, les diminutions régionales de la substance grise observées chez ces patientes pourraient ne pas être le reflet d’une atteinte de l’intégrité neuronale, dont le marqueur indirect est ici la concentration du récepteur GABAA. En effet, elles pourraient également résulter du temps de relaxation T1 dans la susbtance grise, qui est une mesure indirecte du contenu en eau du tissu. De plus, le N-acétylaspartate (NAA, mesuré par H-MRS) qui est un marqueur de la viabilité neuronale, ne différait pas entre les patientes et les contrôles. Ces résultats suggèrent que la réduction de volume de substance grise n’est pas le résultat d’une atteinte de l’intégrité neuronale.
) ont conduit une étude de très grande envergure incluant la VBM, la spectroscopie de résonance magnétique du proton (H-MRS), la tomographie par émission de positons (TEP)10
avec le marqueur [18F] flumazénil pour mesurer la concentration des récepteurs GABAA, et la relaxométrie basée sur le voxel. Les 3 dernières mesures permettent d’explorer les bases neuropathologiques de modifications volumétriques. Les résultats en VBM ont montré des réductions de substance grise dans le cortex insulaire, cingulaire antérieur et postérieur, et précentral et le precuneus dans l’échantillon de 26 patientes atteintes de FM (âgées de 50 à 75 ans) comparées à 25 contrôles. Cependant, les diminutions régionales de la substance grise observées chez ces patientes pourraient ne pas être le reflet d’une atteinte de l’intégrité neuronale, dont le marqueur indirect est ici la concentration du récepteur GABAA. En effet, elles pourraient également résulter du temps de relaxation T1 dans la susbtance grise, qui est une mesure indirecte du contenu en eau du tissu. De plus, le N-acétylaspartate (NAA, mesuré par H-MRS) qui est un marqueur de la viabilité neuronale, ne différait pas entre les patientes et les contrôles. Ces résultats suggèrent que la réduction de volume de substance grise n’est pas le résultat d’une atteinte de l’intégrité neuronale.Conclusion
Étude des neurotransmetteurs par imagerie
Considérations générales
 ). Plus récemment, des ligands sélectifs ont été développés pour mesurer la neuroinflammation (Narayanaswami, et coll., 2018
). Plus récemment, des ligands sélectifs ont été développés pour mesurer la neuroinflammation (Narayanaswami, et coll., 2018 ).
).Études menées dans la fibromyalgie
 ; Wood et coll., 2007
; Wood et coll., 2007 ; Wood et coll., 2007
; Wood et coll., 2007 ; Wood et coll., 2009
; Wood et coll., 2009 ; Albrecht et coll., 2016
; Albrecht et coll., 2016 ; Kosek et coll., 2016
; Kosek et coll., 2016 ; Ledermann et coll., 2016
; Ledermann et coll., 2016 ; Schrepf et coll., 2016
; Schrepf et coll., 2016 ). Ces études ont inclus un total de 125 patients (dont 99 % de femmes) et 110 contrôles ayant un âge moyen de 44 ± 8 ans (tableau 12.I
). Ces études ont inclus un total de 125 patients (dont 99 % de femmes) et 110 contrôles ayant un âge moyen de 44 ± 8 ans (tableau 12.I ). Le nombre moyen par étude était de 16 patients et 14 contrôles (6 à 31 patients). Deux études incluaient plus de 20 patients. Cinq études ont investigué le système dopaminergique, deux le système opioïdergique et deux autres la neuro-inflammation corticale. Comme peu d’études ont utilisé les mêmes traceurs, il n’est pas possible de comparer les résultats obtenus entre ces études.
). Le nombre moyen par étude était de 16 patients et 14 contrôles (6 à 31 patients). Deux études incluaient plus de 20 patients. Cinq études ont investigué le système dopaminergique, deux le système opioïdergique et deux autres la neuro-inflammation corticale. Comme peu d’études ont utilisé les mêmes traceurs, il n’est pas possible de comparer les résultats obtenus entre ces études. ) ont examiné le système opioïdergique en utilisant le traceur [11C] carfentanil, qui se lie au récepteur opioïde du type mu (mu-opioid binding), chez 17 patients et 17 contrôles. Les résultats indiquent des diminutions dans la fixation au récepteur opioïde mu dans plusieurs zones de la matrice de la douleur comme la partie dorsale de l’ACC, l’amygdale et le nucleus accumbens. Le potentiel de fixation du carfentanil dans le nucleus accumbens corrélait négativement avec les scores de la composante affective de la douleur. Schrepf et coll. (2016
) ont examiné le système opioïdergique en utilisant le traceur [11C] carfentanil, qui se lie au récepteur opioïde du type mu (mu-opioid binding), chez 17 patients et 17 contrôles. Les résultats indiquent des diminutions dans la fixation au récepteur opioïde mu dans plusieurs zones de la matrice de la douleur comme la partie dorsale de l’ACC, l’amygdale et le nucleus accumbens. Le potentiel de fixation du carfentanil dans le nucleus accumbens corrélait négativement avec les scores de la composante affective de la douleur. Schrepf et coll. (2016 ) ont combiné leurs données TEP avec celles d’IRMf obtenues chez les mêmes sujets et ont montré que dans le cortex préfrontal dorsolatéral et l’ACC (zones qui jouent un rôle anti-nociceptif), une disponibilité réduite des récepteurs opioïdes du type mu était associée à une diminution de l’activité neurale évoquée par la douleur. La disponibilité réduite des récepteurs opioïdes du type mu dans le nucleus accumbens était aussi associée à une activation cérébrale plus faible de cette structure par des stimuli douloureux. Ces résultats suggèrent qu’une dérégulation du système opioïde endogène dans la FM pourrait conduire à une moindre excitation des régions cérébrales anti-nociceptives par une stimulation nociceptive, entraînant une hyperalgésie et une allodynie (voir également chapitre « Neurobiologie de la douleur chronique dans la fibromyalgie et biomarqueurs »).
) ont combiné leurs données TEP avec celles d’IRMf obtenues chez les mêmes sujets et ont montré que dans le cortex préfrontal dorsolatéral et l’ACC (zones qui jouent un rôle anti-nociceptif), une disponibilité réduite des récepteurs opioïdes du type mu était associée à une diminution de l’activité neurale évoquée par la douleur. La disponibilité réduite des récepteurs opioïdes du type mu dans le nucleus accumbens était aussi associée à une activation cérébrale plus faible de cette structure par des stimuli douloureux. Ces résultats suggèrent qu’une dérégulation du système opioïde endogène dans la FM pourrait conduire à une moindre excitation des régions cérébrales anti-nociceptives par une stimulation nociceptive, entraînant une hyperalgésie et une allodynie (voir également chapitre « Neurobiologie de la douleur chronique dans la fibromyalgie et biomarqueurs »).
 ) ont examiné des changements dans le système dopaminergique chez des patients atteints de FM. Dans une de ces études, les auteurs ont induit une douleur tonique en injectant de l’eau hypertonique dans un muscle chez 11 patients atteints de FM et 11 contrôles, douleur qui était ressentie plus fortement par les patients. Alors que chez les sujets contrôles, une libération de dopamine était manifeste après injection, ce n’était pas le cas chez les patients. Dans une étude suivante, les mêmes auteurs ont corrélé la réduction du métabolisme dopaminergique observée à des diminutions de la substance grise (Wood et coll., 2009
) ont examiné des changements dans le système dopaminergique chez des patients atteints de FM. Dans une de ces études, les auteurs ont induit une douleur tonique en injectant de l’eau hypertonique dans un muscle chez 11 patients atteints de FM et 11 contrôles, douleur qui était ressentie plus fortement par les patients. Alors que chez les sujets contrôles, une libération de dopamine était manifeste après injection, ce n’était pas le cas chez les patients. Dans une étude suivante, les mêmes auteurs ont corrélé la réduction du métabolisme dopaminergique observée à des diminutions de la substance grise (Wood et coll., 2009
 ).
). ) a comparé la fixation de la dopamine (utilisation de raclopride11
) dans le striatum chez 3 groupes de sujets : patients atteints de FM avec dépression (FM+), patients sans dépression (FM-) et groupe contrôle. Des différences ont été observées entre les 3 groupes : alors que le groupe FM- a un potentiel de fixation du raclopride plus élevé dans le striatum ventral gauche, celui du groupe FM+ est réduit dans le noyau caudé gauche. Comparés aux contrôles, les 2 groupes FM ont un potentiel de fixation du raclopride réduit dans le nucleus accumbens gauche. Chez les FM-, le potentiel de fixation dans le noyau caudé gauche est corrélé négativement avec le seuil de détection de la douleur thermique, alors que cette corrélation négative a été observée dans le noyau caudé droit chez les FM+. Cela suggère un dysfonctionnement dopaminergique dans le cerveau ventral préfrontal chez les patients atteints de FM. La réactivité dopaminergique réduite chez les patients pourrait être un facteur critique de la douleur et de l’inconfort généralisés : en effet, la dopamine joue un rôle central dans la modulation de la douleur et de l’analgésie dans les aires comme l’insula, le thalamus, les ganglions basaux, le cortex cingulaire antérieur et le gris périaqueductal. Un faible niveau de dopamine ou une neurotransmission dopaminergique anormale sont également associés aux symptômes douloureux dans la maladie de Parkinson, le syndrome de la bouche brûlante et la neuropathie diabétique douloureuse (Wood, 2008
) a comparé la fixation de la dopamine (utilisation de raclopride11
) dans le striatum chez 3 groupes de sujets : patients atteints de FM avec dépression (FM+), patients sans dépression (FM-) et groupe contrôle. Des différences ont été observées entre les 3 groupes : alors que le groupe FM- a un potentiel de fixation du raclopride plus élevé dans le striatum ventral gauche, celui du groupe FM+ est réduit dans le noyau caudé gauche. Comparés aux contrôles, les 2 groupes FM ont un potentiel de fixation du raclopride réduit dans le nucleus accumbens gauche. Chez les FM-, le potentiel de fixation dans le noyau caudé gauche est corrélé négativement avec le seuil de détection de la douleur thermique, alors que cette corrélation négative a été observée dans le noyau caudé droit chez les FM+. Cela suggère un dysfonctionnement dopaminergique dans le cerveau ventral préfrontal chez les patients atteints de FM. La réactivité dopaminergique réduite chez les patients pourrait être un facteur critique de la douleur et de l’inconfort généralisés : en effet, la dopamine joue un rôle central dans la modulation de la douleur et de l’analgésie dans les aires comme l’insula, le thalamus, les ganglions basaux, le cortex cingulaire antérieur et le gris périaqueductal. Un faible niveau de dopamine ou une neurotransmission dopaminergique anormale sont également associés aux symptômes douloureux dans la maladie de Parkinson, le syndrome de la bouche brûlante et la neuropathie diabétique douloureuse (Wood, 2008 ).
).Conclusion
Études en spectroscopie
 ; Harris et coll., 2008
; Harris et coll., 2008 ; Petrou et coll., 2008
; Petrou et coll., 2008 ; Harris et coll., 2009
; Harris et coll., 2009 ; Wood et coll., 2009
; Wood et coll., 2009
 ; Fayed et coll., 2010
; Fayed et coll., 2010 ; Feraco et coll., 2011
; Feraco et coll., 2011 ; Fayed et coll., 2012
; Fayed et coll., 2012 ; Foerster et coll., 2012
; Foerster et coll., 2012 ; Harris et coll., 2013
; Harris et coll., 2013 ). Six études ont mesuré le taux de glutamate, 3 le NAA et 1 le GABA. Ces études ont inclus un total de 145 patients (9 à 21 patients par étude, 93 % de femmes) et 125 contrôles avec un âge moyen de 40 ± 3 années (tableau 12.I
). Six études ont mesuré le taux de glutamate, 3 le NAA et 1 le GABA. Ces études ont inclus un total de 145 patients (9 à 21 patients par étude, 93 % de femmes) et 125 contrôles avec un âge moyen de 40 ± 3 années (tableau 12.I ). Le nombre moyen par étude était de 16 patients et 14 contrôles. Seule une étude inclut plus de 20 patients. Quatre études ont effectué leurs mesures dans l’insula, 3 dans l’hippocampe, 2 dans la matrice de la douleur, 1 dans le cortex cingulaire postérieur et 1 dans le thalamus et le cortex préfrontal ventrolatéral.
). Le nombre moyen par étude était de 16 patients et 14 contrôles. Seule une étude inclut plus de 20 patients. Quatre études ont effectué leurs mesures dans l’insula, 3 dans l’hippocampe, 2 dans la matrice de la douleur, 1 dans le cortex cingulaire postérieur et 1 dans le thalamus et le cortex préfrontal ventrolatéral.Évaluation du niveau de glutamate
 ) ont mesuré des changements dans les concentrations de glutamate dans l’insula pendant une stimulation mécanique douloureuse. Ils ont ainsi montré qu’une stimulation douloureuse augmentait la concentration de glutamate dans l’insula postérieure, mais pas dans l’insula antérieure et que cette augmentation était associée à des seuils de douleur plus bas chez les patients. Dans une autre étude du même groupe (Harris et coll., 2008
) ont mesuré des changements dans les concentrations de glutamate dans l’insula pendant une stimulation mécanique douloureuse. Ils ont ainsi montré qu’une stimulation douloureuse augmentait la concentration de glutamate dans l’insula postérieure, mais pas dans l’insula antérieure et que cette augmentation était associée à des seuils de douleur plus bas chez les patients. Dans une autre étude du même groupe (Harris et coll., 2008 ), les auteurs ont mesuré les concentrations de glutamate dans l’insula avant et après intervention thérapeutique « acupuncture ». Ils rapportent une diminution de la concentration de glutamate dans l’insula après traitement chez les patients qui est corrélée à l’augmentation du seuil de la douleur et de la réponse BOLD de la même zone en réponse à une stimulation douloureuse. Fayed et coll. (2010
), les auteurs ont mesuré les concentrations de glutamate dans l’insula avant et après intervention thérapeutique « acupuncture ». Ils rapportent une diminution de la concentration de glutamate dans l’insula après traitement chez les patients qui est corrélée à l’augmentation du seuil de la douleur et de la réponse BOLD de la même zone en réponse à une stimulation douloureuse. Fayed et coll. (2010 , 2012
, 2012 ) ont quant à eux mesuré les concentrations de glutamate et d’autres métabolites au repos chez des patients et des contrôles. Bien que ces auteurs ne trouvent pas de différence entre les 2 groupes concernant les concentrations de glutamate dans l’insula contrairement au groupe précédent, ils rapportent une augmentation de glutamate dans le precuneus/cortex cingulaire postérieur corrélée à de moins bons scores cliniques (Fibromyalgia Impact Questionnaire ou FIQ), de dépression (Hospital Anxiety Depression Scale) ou de catastrophisme. Petrou et coll. (2008
) ont quant à eux mesuré les concentrations de glutamate et d’autres métabolites au repos chez des patients et des contrôles. Bien que ces auteurs ne trouvent pas de différence entre les 2 groupes concernant les concentrations de glutamate dans l’insula contrairement au groupe précédent, ils rapportent une augmentation de glutamate dans le precuneus/cortex cingulaire postérieur corrélée à de moins bons scores cliniques (Fibromyalgia Impact Questionnaire ou FIQ), de dépression (Hospital Anxiety Depression Scale) ou de catastrophisme. Petrou et coll. (2008 ), au contraire, n’ont pas trouvé de différences dans les concentrations de glutamate au repos dans la matrice de la douleur chez 21 patients comparés à 27 contrôles.
), au contraire, n’ont pas trouvé de différences dans les concentrations de glutamate au repos dans la matrice de la douleur chez 21 patients comparés à 27 contrôles.Évaluation du niveau de GABA
 ). S’il n’y avait pas de changement dans les concentrations de GABA dans l’insula postérieure droite, les niveaux de GABA dans cette zone corrélaient avec les seuils de douleur à la pression mécanique chez les patients.
). S’il n’y avait pas de changement dans les concentrations de GABA dans l’insula postérieure droite, les niveaux de GABA dans cette zone corrélaient avec les seuils de douleur à la pression mécanique chez les patients.Rapport N-acétylaspartate sur créatine (NAA/Cr)
 ). Comme décrit plus haut, certaines études structurelles ont démontré des changements volumétriques dans cette zone dans la FM. Wood et coll. (2009
). Comme décrit plus haut, certaines études structurelles ont démontré des changements volumétriques dans cette zone dans la FM. Wood et coll. (2009
 ) ont donc examiné des changements métaboliques dans l’hippocampe chez un groupe de 16 patients atteints de FM et 8 sujets contrôles. Ils montrent une réduction significative du rapport NAA sur créatine (NAA/Cr) chez les patients comparés aux contrôles dans l’hippocampe droit. Le rapport NAA/Cr étant considéré comme un marqueur métabolique reflétant le statut fonctionnel des neurones et des axones dans le cerveau, une diminution indiquerait une perte ou un dysfonctionnement neuronal. L’analyse de corrélation a mis en évidence une corrélation négative significative entre le rapport NAA/Cr dans l’hippocampe droit et les scores au FIQ. Cette diminution du rapport NAA/Cr dans l’hippocampe a été confirmée dans une étude indépendante menée par Ehmad et coll. (2008
) ont donc examiné des changements métaboliques dans l’hippocampe chez un groupe de 16 patients atteints de FM et 8 sujets contrôles. Ils montrent une réduction significative du rapport NAA sur créatine (NAA/Cr) chez les patients comparés aux contrôles dans l’hippocampe droit. Le rapport NAA/Cr étant considéré comme un marqueur métabolique reflétant le statut fonctionnel des neurones et des axones dans le cerveau, une diminution indiquerait une perte ou un dysfonctionnement neuronal. L’analyse de corrélation a mis en évidence une corrélation négative significative entre le rapport NAA/Cr dans l’hippocampe droit et les scores au FIQ. Cette diminution du rapport NAA/Cr dans l’hippocampe a été confirmée dans une étude indépendante menée par Ehmad et coll. (2008 ). Dans cette dernière, le rapport NAA/Cr était réduit dans l’hippocampe droit et gauche. En contradiction avec l’étude de Wood et coll. (2009
). Dans cette dernière, le rapport NAA/Cr était réduit dans l’hippocampe droit et gauche. En contradiction avec l’étude de Wood et coll. (2009
 ), aucune corrélation n’a été observée entre le rapport NAA/Cr et les scores FIQ.
), aucune corrélation n’a été observée entre le rapport NAA/Cr et les scores FIQ.Conclusion
Utilisation de la neuromodulation non invasive
dans la fibromyalgie
 ). La STCC produit non seulement des effets pendant l’application mais aussi à plus long terme en fonction de la durée de la stimulation et de l’intensité du courant appliqués (Nitsche et Paulus, 2001
). La STCC produit non seulement des effets pendant l’application mais aussi à plus long terme en fonction de la durée de la stimulation et de l’intensité du courant appliqués (Nitsche et Paulus, 2001 ). Bien que ses mécanismes d’action ne soient pas encore élucidés, une récente étude en spectroscopie par résonance magnétique a montré que la réduction de la douleur liée à la STCC du cortex moteur primaire est associée à des augmentations des rapports Glx/Cr et NAA/Cr dans le cortex cingulaire antérieur (Auvichayapat et coll., 2018
). Bien que ses mécanismes d’action ne soient pas encore élucidés, une récente étude en spectroscopie par résonance magnétique a montré que la réduction de la douleur liée à la STCC du cortex moteur primaire est associée à des augmentations des rapports Glx/Cr et NAA/Cr dans le cortex cingulaire antérieur (Auvichayapat et coll., 2018 ).
).Stimulation magnétique transcrânienne (SMTr)
 ; Carretero et coll., 2009
; Carretero et coll., 2009 ; Mhalla et coll., 2011
; Mhalla et coll., 2011 ; Short et coll., 2011
; Short et coll., 2011 ; Baudic et coll., 2013
; Baudic et coll., 2013 ; Boyer et coll., 2014
; Boyer et coll., 2014 ; Fitzgibbon et coll., 2018
; Fitzgibbon et coll., 2018 ) (tableau 12.II
) (tableau 12.II ). Dans 4 études, la cible était le cortex moteur primaire gauche, le cortex dorsolatéral préfrontal droit dans deux, et le cortex dorsolatéral préfrontal gauche dans une autre. Le choix de ces 2 régions corticales, qu’on retrouvera aussi dans les études en STCC (voir paragraphe ci-dessous), s’explique comme suit. Le cortex moteur primaire est une cible classique pour le traitement de la douleur neuropathique, qui utilise des méthodes invasives avec des électrodes implantées dans le cerveau (Peyron et coll., 2007
). Dans 4 études, la cible était le cortex moteur primaire gauche, le cortex dorsolatéral préfrontal droit dans deux, et le cortex dorsolatéral préfrontal gauche dans une autre. Le choix de ces 2 régions corticales, qu’on retrouvera aussi dans les études en STCC (voir paragraphe ci-dessous), s’explique comme suit. Le cortex moteur primaire est une cible classique pour le traitement de la douleur neuropathique, qui utilise des méthodes invasives avec des électrodes implantées dans le cerveau (Peyron et coll., 2007 ). Le cortex dorsolatéral est une région importante du cerveau pour le traitement des émotions et la réduction de conditions affectives comme la douleur. Il joue également un rôle important dans plusieurs processus cognitifs comme la flexibilité cognitive, la mémoire de travail et la planification (Barbey et coll., 2013
). Le cortex dorsolatéral est une région importante du cerveau pour le traitement des émotions et la réduction de conditions affectives comme la douleur. Il joue également un rôle important dans plusieurs processus cognitifs comme la flexibilité cognitive, la mémoire de travail et la planification (Barbey et coll., 2013 ). Enfin, cette zone joue un rôle important dans la modulation endogène de la douleur (Seminowicz et Moayedi, 2017
). Enfin, cette zone joue un rôle important dans la modulation endogène de la douleur (Seminowicz et Moayedi, 2017 ).
).Tableau 12.II Résumés de quelques caractéristiques des études menées sur la neuromodulation cérébrale dans la fibromyalgie
|
Traitement actif
|
Traitement Sham
|
|||||||||
|
Approche
|
Nombre d’études
|
N
|
X
|
Âge
|
% F
|
Durée de la FM (ans)
|
N
|
X
|
Âge
|
% F
|
|
SMTr
|
7
|
112
|
16
|
50
|
98
|
10±5
|
106
|
15
|
50
|
93
|
|
STCC
|
11
|
157
|
20
|
49
|
96
|
10±6
|
157
|
14
|
48
|
96
|
|
Ensemble des études
|
18
|
269
|
18
|
50
|
97
|
263
|
14
|
49
|
94
|
|
SMTr : stimulation magnétique transcrânienne répétitive ; STCC : stimulation transcrânienne à courant continu ; N : nombre total de patients ou contrôles ; X : nombre moyen de patients ou de contrôles par étude ; % F : pourcentage de femmes étudiées.
 ) rapportent des effets positifs de 10 sessions SMTr au niveau du cortex moteur primaire gauche sur 2 semaines en utilisant une intensité (80 % du RMT) à haute fréquence (10 Hz). Un effet significatif sur les scores de douleur a été observé, qui commençait dès la 5e journée de traitement. Cet effet antalgique restait présent jusqu’au lendemain de la dernière session (jour 15) mais avait disparu aux jours 30 et 60. Les scores douleur au questionnaire McGill (MPQ-sensory) suivaient le même profil pendant que les scores affectifs restaient différents jusqu’à 15 jours après la fin de l’intervention SMTr. Ces résultats suggèrent des effets différentiels sur les structures cérébrales impliquées dans les aspects sensoriels et affectifs de la douleur. En dehors de cet effet sur la douleur, la SMTr améliorait aussi plusieurs aspects de la qualité de vie, y compris la fatigue, l’activité générale et le sommeil pendant un maximum de 2 semaines après la fin du traitement.
) rapportent des effets positifs de 10 sessions SMTr au niveau du cortex moteur primaire gauche sur 2 semaines en utilisant une intensité (80 % du RMT) à haute fréquence (10 Hz). Un effet significatif sur les scores de douleur a été observé, qui commençait dès la 5e journée de traitement. Cet effet antalgique restait présent jusqu’au lendemain de la dernière session (jour 15) mais avait disparu aux jours 30 et 60. Les scores douleur au questionnaire McGill (MPQ-sensory) suivaient le même profil pendant que les scores affectifs restaient différents jusqu’à 15 jours après la fin de l’intervention SMTr. Ces résultats suggèrent des effets différentiels sur les structures cérébrales impliquées dans les aspects sensoriels et affectifs de la douleur. En dehors de cet effet sur la douleur, la SMTr améliorait aussi plusieurs aspects de la qualité de vie, y compris la fatigue, l’activité générale et le sommeil pendant un maximum de 2 semaines après la fin du traitement. ) ont évalué les effets du maintien à long terme de l’analgésie induite par la SMTr. Trente patients atteints de FM ont été assignés à une condition de 14 sessions de SMTr active (n = 16) ou fictive (n = 14). Le protocole de stimulation a commencé par une phase « d’induction » de 5 séances quotidiennes, suivie d’une phase « d’entretien » de 3 séances par semaine, 3 séances par quinzaine et 3 séances par mois (25 semaines de traitement). La SMTr active a significativement réduit l’intensité de la douleur du jour 5 à la semaine 25, avec une légère diminution de la taille de l’effet pendant la période de stimulations mensuelles. À la fin de l’essai, une différence moyenne d’un point sur une échelle d’évaluation de la douleur de 10 a été observée entre les 2 conditions. Les effets analgésiques de ce protocole de TMS étaient associés à une amélioration à long terme des éléments liés à la qualité de vie comme la fatigue matinale, l’activité générale, la marche et le sommeil, et étaient directement corrélés aux changements de l’inhibition intracorticale.
) ont évalué les effets du maintien à long terme de l’analgésie induite par la SMTr. Trente patients atteints de FM ont été assignés à une condition de 14 sessions de SMTr active (n = 16) ou fictive (n = 14). Le protocole de stimulation a commencé par une phase « d’induction » de 5 séances quotidiennes, suivie d’une phase « d’entretien » de 3 séances par semaine, 3 séances par quinzaine et 3 séances par mois (25 semaines de traitement). La SMTr active a significativement réduit l’intensité de la douleur du jour 5 à la semaine 25, avec une légère diminution de la taille de l’effet pendant la période de stimulations mensuelles. À la fin de l’essai, une différence moyenne d’un point sur une échelle d’évaluation de la douleur de 10 a été observée entre les 2 conditions. Les effets analgésiques de ce protocole de TMS étaient associés à une amélioration à long terme des éléments liés à la qualité de vie comme la fatigue matinale, l’activité générale, la marche et le sommeil, et étaient directement corrélés aux changements de l’inhibition intracorticale. ) ont comparé l’effet de 10 sessions de SMTr étalées sur 2 semaines au niveau du cortex dorsolatéral préfrontal gauche (n = 10) avec la stimulation simulée (n = 10). À noter que l’un des auteurs a reçu des subventions de recherche du fabricant de l’instrument et détient des brevets pour la technologie SMT. Dans cette étude, les auteurs ont utilisé un nombre de stimuli SMT beaucoup plus élevé par session (4 000) par rapport aux autres études (2 200 en moyenne). La SMTr préfrontale a induit un effet antalgique significatif qui était présent dès la seconde semaine de stimulation et qui se maintenait jusqu’à deux semaines après la fin des sessions. La réduction de la douleur était de 29 % à la fin du traitement, un effet qui durait jusqu’à 2 semaines après l’intervention. Deux semaines après le traitement, les auteurs observaient aussi une amélioration significative des symptômes dépressifs.
) ont comparé l’effet de 10 sessions de SMTr étalées sur 2 semaines au niveau du cortex dorsolatéral préfrontal gauche (n = 10) avec la stimulation simulée (n = 10). À noter que l’un des auteurs a reçu des subventions de recherche du fabricant de l’instrument et détient des brevets pour la technologie SMT. Dans cette étude, les auteurs ont utilisé un nombre de stimuli SMT beaucoup plus élevé par session (4 000) par rapport aux autres études (2 200 en moyenne). La SMTr préfrontale a induit un effet antalgique significatif qui était présent dès la seconde semaine de stimulation et qui se maintenait jusqu’à deux semaines après la fin des sessions. La réduction de la douleur était de 29 % à la fin du traitement, un effet qui durait jusqu’à 2 semaines après l’intervention. Deux semaines après le traitement, les auteurs observaient aussi une amélioration significative des symptômes dépressifs. ) a utilisé un protocole de SMTr du cortex moteur primaire gauche semblable à celui de Passard et coll. (2007
) a utilisé un protocole de SMTr du cortex moteur primaire gauche semblable à celui de Passard et coll. (2007 ) sur une durée et une période plus longues (15 sessions sur 10 semaines). En dehors des mesures cliniques, les auteurs ont mesuré l’effet de la SMTr sur le métabolisme cortical en utilisant la TEP au [18F]flurodéoxyglucose. Les résultats ont montré une amélioration significative de la SMTr sur la qualité de vie (FIQ et SF-36) après les 15 sessions. L’analyse TEP a montré une augmentation significative de l’absorption de glucose dans le lobe temporal médian, incluant l’hippocampe et le parahippocampe droits après 2 semaines, c’est-à-dire avant l’amélioration des mesures de qualité de vie. Cet effet devenait plus important à la fin de l’intervention SMTr. Par ailleurs, l’augmentation du métabolisme dans le lobe temporal médian entre sa mesure de base (avant la SMTr) et en semaine 11 corrélait positivement avec l’augmentation du niveau de qualité de vie mesuré aux mêmes moments. Il faut cependant souligner deux points particuliers : l’absence d’une augmentation du métabolisme au niveau du cortex moteur primaire stimulé est surprenante d’une part et d’autre part les effets métaboliques de la SMTr impliquaient des structures cérébrales controlatérales.
) sur une durée et une période plus longues (15 sessions sur 10 semaines). En dehors des mesures cliniques, les auteurs ont mesuré l’effet de la SMTr sur le métabolisme cortical en utilisant la TEP au [18F]flurodéoxyglucose. Les résultats ont montré une amélioration significative de la SMTr sur la qualité de vie (FIQ et SF-36) après les 15 sessions. L’analyse TEP a montré une augmentation significative de l’absorption de glucose dans le lobe temporal médian, incluant l’hippocampe et le parahippocampe droits après 2 semaines, c’est-à-dire avant l’amélioration des mesures de qualité de vie. Cet effet devenait plus important à la fin de l’intervention SMTr. Par ailleurs, l’augmentation du métabolisme dans le lobe temporal médian entre sa mesure de base (avant la SMTr) et en semaine 11 corrélait positivement avec l’augmentation du niveau de qualité de vie mesuré aux mêmes moments. Il faut cependant souligner deux points particuliers : l’absence d’une augmentation du métabolisme au niveau du cortex moteur primaire stimulé est surprenante d’une part et d’autre part les effets métaboliques de la SMTr impliquaient des structures cérébrales controlatérales. ) ont testé si un protocole de SMTr de plusieurs semaines avait des effets sur les fonctions cognitives de patients atteints de FM. Utilisant un essai randomisé et contrôlé, les patients ont été assignés aux 11 séances de SMTr actives (n = 20) ou fictives (n = 18). La SMTr a été appliquée sur le cortex moteur gauche (10 Hz à 80 % du seuil moteur au repos). Les tests neuropsychologiques ont évalué la mémoire épisodique, l’attention sélective et divisée, et les fonctions exécutives avant le traitement et 3 et 7 semaines après sa mise en place. Aucune différence dans la performance cognitive globale par rapport au niveau de référence n’a été observée entre les deux groupes, bien que les patients du groupe SMTr aient montré une amélioration légère mais statistiquement significative pour certaines mesures de la fonction attentionnelle et exécutive (Symbol Digit Modalities Test et Stroop Color Word Test).
) ont testé si un protocole de SMTr de plusieurs semaines avait des effets sur les fonctions cognitives de patients atteints de FM. Utilisant un essai randomisé et contrôlé, les patients ont été assignés aux 11 séances de SMTr actives (n = 20) ou fictives (n = 18). La SMTr a été appliquée sur le cortex moteur gauche (10 Hz à 80 % du seuil moteur au repos). Les tests neuropsychologiques ont évalué la mémoire épisodique, l’attention sélective et divisée, et les fonctions exécutives avant le traitement et 3 et 7 semaines après sa mise en place. Aucune différence dans la performance cognitive globale par rapport au niveau de référence n’a été observée entre les deux groupes, bien que les patients du groupe SMTr aient montré une amélioration légère mais statistiquement significative pour certaines mesures de la fonction attentionnelle et exécutive (Symbol Digit Modalities Test et Stroop Color Word Test). ; Fitzgibbon et coll., 2018
; Fitzgibbon et coll., 2018 ). Dans l’étude menée par Carretero et coll. (2009
). Dans l’étude menée par Carretero et coll. (2009 ), 28 patients atteints de FM et de dépression majeure ont reçu 20 séances de SMTr réelle ou simulée dans le cortex préfrontal dorsolatéral droit à basse fréquence. Les auteurs n’ont pas trouvé de différences significatives entre les groupes avec et sans dépression majeure, ni dans les scores de douleur ni au niveau de la fatigue. Dans leur étude plus récente, Fitzgibbon et coll. (2018
), 28 patients atteints de FM et de dépression majeure ont reçu 20 séances de SMTr réelle ou simulée dans le cortex préfrontal dorsolatéral droit à basse fréquence. Les auteurs n’ont pas trouvé de différences significatives entre les groupes avec et sans dépression majeure, ni dans les scores de douleur ni au niveau de la fatigue. Dans leur étude plus récente, Fitzgibbon et coll. (2018 ) ont testé l’effet de SMTr (une séance par jour sur 5 jours pendant 4 semaines) au niveau du cortex préfrontal dorsolatéral gauche sur la douleur (critère principal d’évaluation, évaluée à l’aide du short-form McGill Pain Questionnaire, du short form of the Brief Pain Inventory et du Numerical Pain Rating Scale), sur la qualité du sommeil et sur la qualité de vie chez 14 patients atteints de FM (critères ACR 2010 confirmés à l’aide des critères ACR 2016) comparés à 12 patients chez lesquels le traitement STMr a été simulé. Les auteurs n’ont pas trouvé d’effet de la SMTr sur la douleur. Cependant, les patients du groupe actif présentaient une amélioration significativement plus importante dans les échelles de fatigue physique et générale (questionnaire Multidimensional Fatigue Inventory-20) à un mois de suivi. Il est important de remarquer que sur les 40 patients initialement prévus, seuls 26 ont été finalement inclus dans l’analyse et que l’étude a été soutenue par un fabricant d’appareils SMT.
) ont testé l’effet de SMTr (une séance par jour sur 5 jours pendant 4 semaines) au niveau du cortex préfrontal dorsolatéral gauche sur la douleur (critère principal d’évaluation, évaluée à l’aide du short-form McGill Pain Questionnaire, du short form of the Brief Pain Inventory et du Numerical Pain Rating Scale), sur la qualité du sommeil et sur la qualité de vie chez 14 patients atteints de FM (critères ACR 2010 confirmés à l’aide des critères ACR 2016) comparés à 12 patients chez lesquels le traitement STMr a été simulé. Les auteurs n’ont pas trouvé d’effet de la SMTr sur la douleur. Cependant, les patients du groupe actif présentaient une amélioration significativement plus importante dans les échelles de fatigue physique et générale (questionnaire Multidimensional Fatigue Inventory-20) à un mois de suivi. Il est important de remarquer que sur les 40 patients initialement prévus, seuls 26 ont été finalement inclus dans l’analyse et que l’étude a été soutenue par un fabricant d’appareils SMT.La stimulation transcrânienne à courant continu (STCC)
 ; Valle et coll., 2009
; Valle et coll., 2009 ; Mendonca et coll., 2011
; Mendonca et coll., 2011 ; Riberto et coll., 2011
; Riberto et coll., 2011 ; Villamar et coll., 2013
; Villamar et coll., 2013 ; Fagerlund et coll., 2015
; Fagerlund et coll., 2015 ; Castillo-Saavedra et coll., 2016
; Castillo-Saavedra et coll., 2016 ; Mendonca et coll., 2016
; Mendonca et coll., 2016 ; Khedr et coll., 2017
; Khedr et coll., 2017 ; Silva et coll., 2017
; Silva et coll., 2017 ; Santos et coll., 2018
; Santos et coll., 2018 ; tableau 12.II
; tableau 12.II ). Dans 5 d’entre elles, la cible était le cortex moteur primaire gauche, dans 2 le cortex préfrontal dorsolatéral gauche, dans 2 le cortex moteur primaire gauche et le cortex préfrontal dorsolatéral gauche, et dans la dernière le cortex moteur primaire gauche et le cortex préfrontal dorsolatéral droit. Les études ont inclus un total de 214 patients soumis à un traitement STCC (de 11 à 30 patients par étude, 97 % de femmes) et 157 patients soumis à une intervention simulée. L’âge moyen des patients était de 49 ± 7 ans. La durée moyenne des symptômes était de 10 ± 6 années. Le nombre moyen par étude était de 21 ± 6 patients en STCC et 14 ± 7 en simulation. Cinq études incluaient plus de 20 participants. À l’exception d’une seule étude dans laquelle une intensité de 1 mA a été utilisée, toutes ont utilisé une intensité de 2 mA pendant 20 minutes. Huit des 11 études utilisaient des sessions multiples avec une moyenne de 14 ± 5 sessions sur une période moyenne de 3 semaines (de 1 à 10 semaines). Dans 3 études, la STCC a été utilisée en combinaison avec une autre intervention thérapeutique comme des exercices physiques aérobie (Mendonca et coll., 2016
). Dans 5 d’entre elles, la cible était le cortex moteur primaire gauche, dans 2 le cortex préfrontal dorsolatéral gauche, dans 2 le cortex moteur primaire gauche et le cortex préfrontal dorsolatéral gauche, et dans la dernière le cortex moteur primaire gauche et le cortex préfrontal dorsolatéral droit. Les études ont inclus un total de 214 patients soumis à un traitement STCC (de 11 à 30 patients par étude, 97 % de femmes) et 157 patients soumis à une intervention simulée. L’âge moyen des patients était de 49 ± 7 ans. La durée moyenne des symptômes était de 10 ± 6 années. Le nombre moyen par étude était de 21 ± 6 patients en STCC et 14 ± 7 en simulation. Cinq études incluaient plus de 20 participants. À l’exception d’une seule étude dans laquelle une intensité de 1 mA a été utilisée, toutes ont utilisé une intensité de 2 mA pendant 20 minutes. Huit des 11 études utilisaient des sessions multiples avec une moyenne de 14 ± 5 sessions sur une période moyenne de 3 semaines (de 1 à 10 semaines). Dans 3 études, la STCC a été utilisée en combinaison avec une autre intervention thérapeutique comme des exercices physiques aérobie (Mendonca et coll., 2016 ), un programme de réhabilitation multidisciplinaire (Riberto et coll., 2011
), un programme de réhabilitation multidisciplinaire (Riberto et coll., 2011 ) ou une tâche de mémoire de travail (Santos et coll., 2018
) ou une tâche de mémoire de travail (Santos et coll., 2018 ). Des 10 études, 8 ont considéré la réduction de la douleur comme critère principal d’évaluation, les autres ont considéré l’amélioration des fonctions cognitives.
). Des 10 études, 8 ont considéré la réduction de la douleur comme critère principal d’évaluation, les autres ont considéré l’amélioration des fonctions cognitives. ). L’âge moyen des participants de cette étude était le plus élevé (58 ± 12 ans) et la fréquence des sessions STCC était la plus basse (1 session par semaine). Les 7 autres études rapportaient une diminution de la douleur variant de 14 à 44 %. Fagerlund et coll. (2015
). L’âge moyen des participants de cette étude était le plus élevé (58 ± 12 ans) et la fréquence des sessions STCC était la plus basse (1 session par semaine). Les 7 autres études rapportaient une diminution de la douleur variant de 14 à 44 %. Fagerlund et coll. (2015 ) ont étudié les effets de 5 séances consécutives de 20 minutes de STCC (2 mA anodale) dirigée vers le cortex moteur primaire chez 48 patients atteints de FM. Les auteurs ont rapporté une réduction modeste de l’intensité de la douleur (14 %) à partir du 4e jour de STCC, un effet perdurait 1 mois plus tard. Fregni et coll. (2006
) ont étudié les effets de 5 séances consécutives de 20 minutes de STCC (2 mA anodale) dirigée vers le cortex moteur primaire chez 48 patients atteints de FM. Les auteurs ont rapporté une réduction modeste de l’intensité de la douleur (14 %) à partir du 4e jour de STCC, un effet perdurait 1 mois plus tard. Fregni et coll. (2006 ) ont comparé les effets de 5 sessions consécutives de STCC du cortex moteur primaire gauche avec ceux du cortex préfrontal dorsolatéral. La stimulation du cortex moteur primaire gauche a induit une diminution de la douleur dès le lendemain de la première session de stimulation pour atteindre 38 % après le 5e jour de STCC. L’effet analgésique était encore présent 2 semaines plus tard. Dans la même étude, les auteurs n’ont pas observé d’effet antalgique en stimulant le cortex préfrontal dorsolatéral gauche. Des résultats opposés ont été cependant rapportés par Mendonca et coll. (2011
) ont comparé les effets de 5 sessions consécutives de STCC du cortex moteur primaire gauche avec ceux du cortex préfrontal dorsolatéral. La stimulation du cortex moteur primaire gauche a induit une diminution de la douleur dès le lendemain de la première session de stimulation pour atteindre 38 % après le 5e jour de STCC. L’effet analgésique était encore présent 2 semaines plus tard. Dans la même étude, les auteurs n’ont pas observé d’effet antalgique en stimulant le cortex préfrontal dorsolatéral gauche. Des résultats opposés ont été cependant rapportés par Mendonca et coll. (2011 ). Ces auteurs rapportent un effet antalgique d’une seule session de STCC du cortex préfrontal dorsolatéral droit (diminution de 44 %) mais pas du cortex moteur primaire gauche. Une 3e étude qui a comparé l’effet thérapeutique de ces 2 cibles rapporte quant à elle que la STCC du cortex moteur primaire gauche et du cortex préfrontal dorsolatéral gauche induit un effet antalgique proche de 30 % (Valle et coll., 2009
). Ces auteurs rapportent un effet antalgique d’une seule session de STCC du cortex préfrontal dorsolatéral droit (diminution de 44 %) mais pas du cortex moteur primaire gauche. Une 3e étude qui a comparé l’effet thérapeutique de ces 2 cibles rapporte quant à elle que la STCC du cortex moteur primaire gauche et du cortex préfrontal dorsolatéral gauche induit un effet antalgique proche de 30 % (Valle et coll., 2009 ). La seule différence entre les deux groupes était que l’effet thérapeutique de la stimulation du cortex moteur primaire gauche persistait jusqu’à 2 mois après la fin de la thérapie, ce qui n’était pas le cas pour la stimulation du cortex préfrontal dorsolatéral gauche. En utilisant les mêmes paramètres que Fregni et coll. (2006
). La seule différence entre les deux groupes était que l’effet thérapeutique de la stimulation du cortex moteur primaire gauche persistait jusqu’à 2 mois après la fin de la thérapie, ce qui n’était pas le cas pour la stimulation du cortex préfrontal dorsolatéral gauche. En utilisant les mêmes paramètres que Fregni et coll. (2006 ), Fagerlund et coll. (2015
), Fagerlund et coll. (2015 ) rapportent une diminution de la douleur après stimulation du cortex moteur primaire de seulement 14 % contre 38 % pour Fregni et coll. (2006
) rapportent une diminution de la douleur après stimulation du cortex moteur primaire de seulement 14 % contre 38 % pour Fregni et coll. (2006 ). Bien que la plupart des auteurs n’aient utilisé que la stimulation anodique parce que cette forme de stimulation est censée augmenter l’excitabilité neuronale corticale, Villamar et coll. (2013
). Bien que la plupart des auteurs n’aient utilisé que la stimulation anodique parce que cette forme de stimulation est censée augmenter l’excitabilité neuronale corticale, Villamar et coll. (2013 ) indiquent que les effets antalgiques de la stimulation cathodique et anodique sont très semblables.
) indiquent que les effets antalgiques de la stimulation cathodique et anodique sont très semblables. ). La STCC augmentait aussi le seuil de la douleur et la tolérance à la douleur thermique. Dans une étude plus récente menée par Santos et coll. (2018
). La STCC augmentait aussi le seuil de la douleur et la tolérance à la douleur thermique. Dans une étude plus récente menée par Santos et coll. (2018 ), la STCC a été utilisée en combinaison avec un entraînement dans une tâche de mémoire de travail. Les résultats montrent que la STCC active, combinée avec l’entraînement de la mémoire de travail, augmente les fonctions cognitives spécifiques liées à la mémoire épisodique à court et à long terme et les fonctions exécutives.
), la STCC a été utilisée en combinaison avec un entraînement dans une tâche de mémoire de travail. Les résultats montrent que la STCC active, combinée avec l’entraînement de la mémoire de travail, augmente les fonctions cognitives spécifiques liées à la mémoire épisodique à court et à long terme et les fonctions exécutives.Conclusion
 ). Sur la base d’une synthèse narrative de données probantes, il a été formulé « des recommandations faibles » pour l’utilisation de la SMTr dans la FM. Les conclusions d’une récente revue Cochrane sur l’utilité de la SMTr et de la STCC dans la douleur chronique sont similaires (O’Connell et coll., 2018
). Sur la base d’une synthèse narrative de données probantes, il a été formulé « des recommandations faibles » pour l’utilisation de la SMTr dans la FM. Les conclusions d’une récente revue Cochrane sur l’utilité de la SMTr et de la STCC dans la douleur chronique sont similaires (O’Connell et coll., 2018 ). Les auteurs ont conclu que seules des données de très faible qualité suggèrent que la STCC puisse avoir des effets bénéfiques à court terme sur la douleur chronique, et que ces effets peuvent être exagérés par les faibles effectifs et autres sources de biais. En raison de cette incertitude, ils concluent que l’application clinique de techniques non invasives de stimulation cérébrale serait pour le moment plus appropriée dans un contexte de recherche clinique que dans un cadre de soins.
). Les auteurs ont conclu que seules des données de très faible qualité suggèrent que la STCC puisse avoir des effets bénéfiques à court terme sur la douleur chronique, et que ces effets peuvent être exagérés par les faibles effectifs et autres sources de biais. En raison de cette incertitude, ils concluent que l’application clinique de techniques non invasives de stimulation cérébrale serait pour le moment plus appropriée dans un contexte de recherche clinique que dans un cadre de soins.Conclusion générale
Références




































































































































→ Aller vers SYNTHESE