Fibromyalgie
2020
| ANALYSE |
17-
Neurobiologie de la douleur
chronique dans la fibromyalgie
et biomarqueurs
Un nombre considérable d’études ont été consacrées à la physiopathologie de la fibromyalgie (FM) au cours des vingt dernières années, ce qui a conduit à une évolution majeure de notre conceptualisation de ce syndrome douloureux chronique1
. Jusqu’aux années 1990, c’était surtout l’absence d’identification de lésion ou de dysfonctions objectivables, renvoyant au caractère « idiopathique » ou « médicalement non expliqué » des symptômes, qui était mise en avant. Les hypothèses physiopathologiques ont depuis largement évolué et peuvent être schématiquement divisées en deux grandes catégories qui ne sont pas mutuellement exclusives. La première fait de la FM une pathologie du système nerveux central, liée en particulier à des dysfonctionnements des systèmes nociceptifs et/ou de la réponse au stress physique ou psychologique. La seconde catégorie d’hypothèses met davantage en avant le rôle des anomalies concernant le système nerveux périphérique ou les muscles squelettiques. Les hypothèses privilégiant l’origine centrale des symptômes ont largement dominé les débats au cours des quinze dernières années, car elles visaient à expliquer non seulement les douleurs diffuses, mais également les nombreux symptômes associés (fatigue, troubles du sommeil, anxiété, dépression, troubles cognitifs, etc.) difficilement explicables uniquement par des mécanismes périphériques. Cependant, la recherche de mécanismes périphériques a connu un regain d’intérêt certain au cours des cinq dernières années. L’utilisation de techniques modernes a permis en effet de mettre en évidence des anomalies musculaires et surtout des modifications des fibres nerveuses périphériques, qui pourraient jouer un rôle physiopathologique important, au moins chez un sous-groupe de patients.
Beaucoup d’études physiopathologiques résumées ici ont débouché sur des tentatives d’identification de marqueurs biologiques ou fonctionnels permettant de faire reposer le diagnostic ou l’évaluation de la FM sur des critères plus objectifs. Ces tentatives n’ont pas encore permis la mise au point d’un test utilisable en clinique, mais ces études indiquent qu’il existe un grand nombre de biomarqueurs potentiels pour la FM que nous aborderons brièvement ici.
Il est important de souligner d’emblée certaines limites générales des travaux à visée physiopathologique concernant la FM. La très grande majorité des travaux publiés s’étant appuyés sur les critères ACR 1990, on ne peut exclure que des résultats différents auraient été observés avec les critères les plus récents. En outre, il n’est pas possible d’analyser les éventuelles différences liées au sexe dans la mesure où la quasi-totalité des études ont été réalisées uniquement chez des femmes. On peut également ajouter le fait que toutes les études ayant été réalisées chez l’adulte, nous ne disposons aujourd’hui d’aucune donnée consistante concernant l’enfant ou l’adolescent. Compte-tenu de la quantité des études publiées sur les potentiels mécanismes de la FM et de la divergence des résultats obtenus à cause entre autres de la variabilité qualitative importante entre ces études, nous renvoyons fréquemment dans ce chapitre à des revues récentes pour appuyer notre analyse, référençant elles-mêmes les travaux appuyant les hypothèses évoquées.
Mécanismes centraux potentiellement à l’origine
du syndrome de fibromyalgie
Hyperexcitabilité des systèmes nociceptifs centraux
La FM se caractérise au premier chef par des douleurs diffuses intéressant notamment les muscles squelettiques, les articulations et les tendons, qui sont exacerbées par la pression ou le contact. En l’absence d’arguments en faveur d’une atteinte périphérique, les chercheurs ont envisagé dès les années 1980 que cette hypersensibilité généralisée pouvait être le reflet d’une hyperexcitabilité pathologique des systèmes nociceptifs centraux. Cette hypothèse a été confortée par une série d’études cliniques confirmant l’existence d’une hypersensibilité diffuse à la douleur chez ces patients. C’est en particulier le cas d’études reposant sur les méthodes d’évaluation quantifiée de la sensibilité. Ces méthodes dérivées de la psychophysique visent à quantifier les sensations, notamment la douleur, évoquées par des stimulations sensorielles de diverses natures (thermique, mécanique) dont l’intensité est contrôlée (Backonja et coll., 2013 ). En pratique, elles consistent en la mesure des seuils de détection et de douleur, c’est-à-dire la plus petite intensité de stimulation nécessaire pour évoquer une simple sensation (seuil de détection) ou une douleur (seuil de douleur). On peut ainsi évaluer les différentes modalités sensorielles, notamment la sensibilité thermique au chaud et au froid, ainsi que la sensibilité mécanique (sensibilité à la pression ou la piqûre) et mettre en évidence, soit un déficit sensoriel caractérisé par une augmentation des seuils de détection et/ou de douleur, soit, à l’inverse, une hypersensibilité caractérisée par une diminution de ces seuils. Rappelons qu’une diminution des seuils de douleur correspond par définition à une allodynie, qu’il est possible d’identifier et de quantifier grâce à ces techniques. Ces méthodes permettent également d’évaluer la réponse à des stimulations supraliminaires (dont l’intensité est supérieure au seuil de douleur) pour mettre en évidence et quantifier les phénomènes d’hyperalgésie, correspondant à une réponse exagérée à des stimulations normalement peu douloureuses.
). En pratique, elles consistent en la mesure des seuils de détection et de douleur, c’est-à-dire la plus petite intensité de stimulation nécessaire pour évoquer une simple sensation (seuil de détection) ou une douleur (seuil de douleur). On peut ainsi évaluer les différentes modalités sensorielles, notamment la sensibilité thermique au chaud et au froid, ainsi que la sensibilité mécanique (sensibilité à la pression ou la piqûre) et mettre en évidence, soit un déficit sensoriel caractérisé par une augmentation des seuils de détection et/ou de douleur, soit, à l’inverse, une hypersensibilité caractérisée par une diminution de ces seuils. Rappelons qu’une diminution des seuils de douleur correspond par définition à une allodynie, qu’il est possible d’identifier et de quantifier grâce à ces techniques. Ces méthodes permettent également d’évaluer la réponse à des stimulations supraliminaires (dont l’intensité est supérieure au seuil de douleur) pour mettre en évidence et quantifier les phénomènes d’hyperalgésie, correspondant à une réponse exagérée à des stimulations normalement peu douloureuses.
 ). En pratique, elles consistent en la mesure des seuils de détection et de douleur, c’est-à-dire la plus petite intensité de stimulation nécessaire pour évoquer une simple sensation (seuil de détection) ou une douleur (seuil de douleur). On peut ainsi évaluer les différentes modalités sensorielles, notamment la sensibilité thermique au chaud et au froid, ainsi que la sensibilité mécanique (sensibilité à la pression ou la piqûre) et mettre en évidence, soit un déficit sensoriel caractérisé par une augmentation des seuils de détection et/ou de douleur, soit, à l’inverse, une hypersensibilité caractérisée par une diminution de ces seuils. Rappelons qu’une diminution des seuils de douleur correspond par définition à une allodynie, qu’il est possible d’identifier et de quantifier grâce à ces techniques. Ces méthodes permettent également d’évaluer la réponse à des stimulations supraliminaires (dont l’intensité est supérieure au seuil de douleur) pour mettre en évidence et quantifier les phénomènes d’hyperalgésie, correspondant à une réponse exagérée à des stimulations normalement peu douloureuses.
). En pratique, elles consistent en la mesure des seuils de détection et de douleur, c’est-à-dire la plus petite intensité de stimulation nécessaire pour évoquer une simple sensation (seuil de détection) ou une douleur (seuil de douleur). On peut ainsi évaluer les différentes modalités sensorielles, notamment la sensibilité thermique au chaud et au froid, ainsi que la sensibilité mécanique (sensibilité à la pression ou la piqûre) et mettre en évidence, soit un déficit sensoriel caractérisé par une augmentation des seuils de détection et/ou de douleur, soit, à l’inverse, une hypersensibilité caractérisée par une diminution de ces seuils. Rappelons qu’une diminution des seuils de douleur correspond par définition à une allodynie, qu’il est possible d’identifier et de quantifier grâce à ces techniques. Ces méthodes permettent également d’évaluer la réponse à des stimulations supraliminaires (dont l’intensité est supérieure au seuil de douleur) pour mettre en évidence et quantifier les phénomènes d’hyperalgésie, correspondant à une réponse exagérée à des stimulations normalement peu douloureuses.L’application de ces techniques a permis de confirmer que la FM était associée à une hypersensibilité à la douleur, non limitée aux points douloureux, mais concernant l’ensemble du corps y compris les viscères (Smythe, 1986 ; Lautenbacher et coll., 1994
; Lautenbacher et coll., 1994 ; Kosek et coll., 1995
; Kosek et coll., 1995 ). Ces études ont en effet mis en évidence une diminution des seuils de douleur, qui dans la plupart des cas concernait autant la sensibilité à la pression que la sensibilité au chaud et au froid, ainsi qu’une augmentation des réponses à des stimulations supraliminaires (Kosek et coll., 1996a
). Ces études ont en effet mis en évidence une diminution des seuils de douleur, qui dans la plupart des cas concernait autant la sensibilité à la pression que la sensibilité au chaud et au froid, ainsi qu’une augmentation des réponses à des stimulations supraliminaires (Kosek et coll., 1996a et b
et b ; Kosek et Hansson, 1997
; Kosek et Hansson, 1997 ; Sörensen et coll., 1998
; Sörensen et coll., 1998 ; Carli et coll., 2002
; Carli et coll., 2002 ; Petzke et coll., 2003
; Petzke et coll., 2003 ). Cette hypersensibilité pourrait ne pas être limitée à la douleur, mais concerner l’ensemble des systèmes sensoriels, notamment l’audition (Gerster et coll., 1984
). Cette hypersensibilité pourrait ne pas être limitée à la douleur, mais concerner l’ensemble des systèmes sensoriels, notamment l’audition (Gerster et coll., 1984 ; Dohrenbusch et coll., 1997
; Dohrenbusch et coll., 1997 ; Geisser et coll., 2008
; Geisser et coll., 2008 ). La FM, mais également d’autres troubles dysfonctionnels comme le syndrome de l’intestin irritable, pourrait ainsi correspondre à un syndrome d’amplification sensitive liée à une augmentation du « gain » de l’ensemble des processus sensoriels (Yunus, 2015
). La FM, mais également d’autres troubles dysfonctionnels comme le syndrome de l’intestin irritable, pourrait ainsi correspondre à un syndrome d’amplification sensitive liée à une augmentation du « gain » de l’ensemble des processus sensoriels (Yunus, 2015 ).
).
 ; Lautenbacher et coll., 1994
; Lautenbacher et coll., 1994 ; Kosek et coll., 1995
; Kosek et coll., 1995 ). Ces études ont en effet mis en évidence une diminution des seuils de douleur, qui dans la plupart des cas concernait autant la sensibilité à la pression que la sensibilité au chaud et au froid, ainsi qu’une augmentation des réponses à des stimulations supraliminaires (Kosek et coll., 1996a
). Ces études ont en effet mis en évidence une diminution des seuils de douleur, qui dans la plupart des cas concernait autant la sensibilité à la pression que la sensibilité au chaud et au froid, ainsi qu’une augmentation des réponses à des stimulations supraliminaires (Kosek et coll., 1996a et b
et b ; Kosek et Hansson, 1997
; Kosek et Hansson, 1997 ; Sörensen et coll., 1998
; Sörensen et coll., 1998 ; Carli et coll., 2002
; Carli et coll., 2002 ; Petzke et coll., 2003
; Petzke et coll., 2003 ). Cette hypersensibilité pourrait ne pas être limitée à la douleur, mais concerner l’ensemble des systèmes sensoriels, notamment l’audition (Gerster et coll., 1984
). Cette hypersensibilité pourrait ne pas être limitée à la douleur, mais concerner l’ensemble des systèmes sensoriels, notamment l’audition (Gerster et coll., 1984 ; Dohrenbusch et coll., 1997
; Dohrenbusch et coll., 1997 ; Geisser et coll., 2008
; Geisser et coll., 2008 ). La FM, mais également d’autres troubles dysfonctionnels comme le syndrome de l’intestin irritable, pourrait ainsi correspondre à un syndrome d’amplification sensitive liée à une augmentation du « gain » de l’ensemble des processus sensoriels (Yunus, 2015
). La FM, mais également d’autres troubles dysfonctionnels comme le syndrome de l’intestin irritable, pourrait ainsi correspondre à un syndrome d’amplification sensitive liée à une augmentation du « gain » de l’ensemble des processus sensoriels (Yunus, 2015 ).
).D’autres méthodes ont permis de confirmer l’hyperexcitabilité des systèmes nociceptifs centraux. C’est le cas notamment des enregistrements électrophysiologiques du réflexe RIII, un réflexe nociceptif considéré comme l’équivalent des réflexes de retrait couramment utilisés dans les études sur la nociception chez l’animal (Sandrini et coll., 2005 ). Ce réflexe peut être déclenché par la stimulation électrique d’un nerf sensitif (usuellement le nerf sural au niveau de la cheville) et être enregistré au moyen de méthodes électrophysiologiques classiques au niveau d’un muscle fléchisseur (usuellement le biceps fémoral). Le seuil d’apparition du réflexe et son amplitude sont directement corrélés au seuil et à l’intensité de la douleur évoquée par la stimulation du nerf. Ce réflexe est considéré comme un index objectif et quantifiable de la transmission des messages nociceptifs au niveau de la moelle épinière. Il a été utilisé dans un très grand nombre d’études visant à analyser les mécanismes médullaires de la douleur chez des volontaires sains ou des patients douloureux chroniques (Sandrini et coll., 2005
). Ce réflexe peut être déclenché par la stimulation électrique d’un nerf sensitif (usuellement le nerf sural au niveau de la cheville) et être enregistré au moyen de méthodes électrophysiologiques classiques au niveau d’un muscle fléchisseur (usuellement le biceps fémoral). Le seuil d’apparition du réflexe et son amplitude sont directement corrélés au seuil et à l’intensité de la douleur évoquée par la stimulation du nerf. Ce réflexe est considéré comme un index objectif et quantifiable de la transmission des messages nociceptifs au niveau de la moelle épinière. Il a été utilisé dans un très grand nombre d’études visant à analyser les mécanismes médullaires de la douleur chez des volontaires sains ou des patients douloureux chroniques (Sandrini et coll., 2005 ). Il a ainsi été montré que le seuil du réflexe RIII était significativement réduit chez les patients atteints de FM, ce qui tend à confirmer l’hyperexcitabilité des systèmes nociceptifs centraux (Desmeules et coll., 2003
). Il a ainsi été montré que le seuil du réflexe RIII était significativement réduit chez les patients atteints de FM, ce qui tend à confirmer l’hyperexcitabilité des systèmes nociceptifs centraux (Desmeules et coll., 2003 , 2014
, 2014 ; Banic et coll., 2004
; Banic et coll., 2004 ).
).
 ). Ce réflexe peut être déclenché par la stimulation électrique d’un nerf sensitif (usuellement le nerf sural au niveau de la cheville) et être enregistré au moyen de méthodes électrophysiologiques classiques au niveau d’un muscle fléchisseur (usuellement le biceps fémoral). Le seuil d’apparition du réflexe et son amplitude sont directement corrélés au seuil et à l’intensité de la douleur évoquée par la stimulation du nerf. Ce réflexe est considéré comme un index objectif et quantifiable de la transmission des messages nociceptifs au niveau de la moelle épinière. Il a été utilisé dans un très grand nombre d’études visant à analyser les mécanismes médullaires de la douleur chez des volontaires sains ou des patients douloureux chroniques (Sandrini et coll., 2005
). Ce réflexe peut être déclenché par la stimulation électrique d’un nerf sensitif (usuellement le nerf sural au niveau de la cheville) et être enregistré au moyen de méthodes électrophysiologiques classiques au niveau d’un muscle fléchisseur (usuellement le biceps fémoral). Le seuil d’apparition du réflexe et son amplitude sont directement corrélés au seuil et à l’intensité de la douleur évoquée par la stimulation du nerf. Ce réflexe est considéré comme un index objectif et quantifiable de la transmission des messages nociceptifs au niveau de la moelle épinière. Il a été utilisé dans un très grand nombre d’études visant à analyser les mécanismes médullaires de la douleur chez des volontaires sains ou des patients douloureux chroniques (Sandrini et coll., 2005 ). Il a ainsi été montré que le seuil du réflexe RIII était significativement réduit chez les patients atteints de FM, ce qui tend à confirmer l’hyperexcitabilité des systèmes nociceptifs centraux (Desmeules et coll., 2003
). Il a ainsi été montré que le seuil du réflexe RIII était significativement réduit chez les patients atteints de FM, ce qui tend à confirmer l’hyperexcitabilité des systèmes nociceptifs centraux (Desmeules et coll., 2003 , 2014
, 2014 ; Banic et coll., 2004
; Banic et coll., 2004 ).
).Ces données ont été corroborées par celles d’études s’appuyant sur une autre méthode électrophysiologique, l’enregistrement des potentiels évoqués par des stimulations cutanées au moyen d’un laser. Ce type de stimulations permet d’activer de façon très sélective les nocicepteurs, c’est-à-dire les fibres de petit diamètre peu ou pas myélinisées, les fibres Aδ et C, qui transmettent les messages nociceptifs vers la moelle épinière (Valeriani et coll., 2012 ). L’enregistrement des potentiels corticaux évoqués par ce type de stimulation fournit donc un moyen objectif d’analyse de la transmission des messages nociceptifs depuis la périphérie jusqu’au cortex cérébral. Plusieurs études ont mis en évidence une augmentation de l’amplitude ou une réduction de la latence des potentiels évoqués laser dans la FM (Lorenz et coll., 1996
). L’enregistrement des potentiels corticaux évoqués par ce type de stimulation fournit donc un moyen objectif d’analyse de la transmission des messages nociceptifs depuis la périphérie jusqu’au cortex cérébral. Plusieurs études ont mis en évidence une augmentation de l’amplitude ou une réduction de la latence des potentiels évoqués laser dans la FM (Lorenz et coll., 1996 ; Lorenz, 1998
; Lorenz, 1998 ; De Tommaso et coll., 2014
; De Tommaso et coll., 2014 ; Truini et coll., 2015
; Truini et coll., 2015 ). Même si ces résultats n’ont pas toujours été confirmés (De Tommaso et coll., 2017
). Même si ces résultats n’ont pas toujours été confirmés (De Tommaso et coll., 2017 ), ils sont eux aussi compatibles avec la notion d’une hyperexcitabilité des systèmes nociceptifs chez ces patients. Les données de la neuroimagerie fonctionnelle ont, de façon générale, elles aussi montré une hyperactivation des réseaux cérébraux impliqués dans la perception de la douleur chez ces patients lors de l’application de stimulations douloureuses expérimentales.
), ils sont eux aussi compatibles avec la notion d’une hyperexcitabilité des systèmes nociceptifs chez ces patients. Les données de la neuroimagerie fonctionnelle ont, de façon générale, elles aussi montré une hyperactivation des réseaux cérébraux impliqués dans la perception de la douleur chez ces patients lors de l’application de stimulations douloureuses expérimentales.
 ). L’enregistrement des potentiels corticaux évoqués par ce type de stimulation fournit donc un moyen objectif d’analyse de la transmission des messages nociceptifs depuis la périphérie jusqu’au cortex cérébral. Plusieurs études ont mis en évidence une augmentation de l’amplitude ou une réduction de la latence des potentiels évoqués laser dans la FM (Lorenz et coll., 1996
). L’enregistrement des potentiels corticaux évoqués par ce type de stimulation fournit donc un moyen objectif d’analyse de la transmission des messages nociceptifs depuis la périphérie jusqu’au cortex cérébral. Plusieurs études ont mis en évidence une augmentation de l’amplitude ou une réduction de la latence des potentiels évoqués laser dans la FM (Lorenz et coll., 1996 ; Lorenz, 1998
; Lorenz, 1998 ; De Tommaso et coll., 2014
; De Tommaso et coll., 2014 ; Truini et coll., 2015
; Truini et coll., 2015 ). Même si ces résultats n’ont pas toujours été confirmés (De Tommaso et coll., 2017
). Même si ces résultats n’ont pas toujours été confirmés (De Tommaso et coll., 2017 ), ils sont eux aussi compatibles avec la notion d’une hyperexcitabilité des systèmes nociceptifs chez ces patients. Les données de la neuroimagerie fonctionnelle ont, de façon générale, elles aussi montré une hyperactivation des réseaux cérébraux impliqués dans la perception de la douleur chez ces patients lors de l’application de stimulations douloureuses expérimentales.
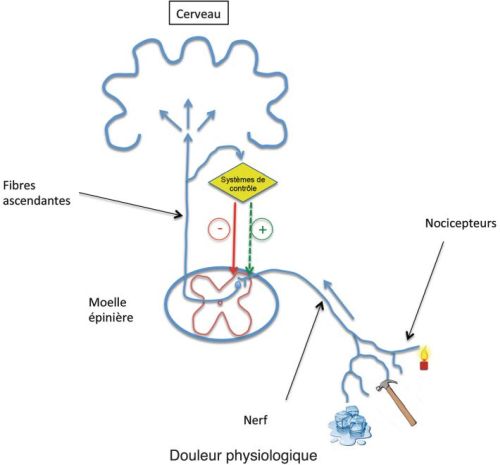
), ils sont eux aussi compatibles avec la notion d’une hyperexcitabilité des systèmes nociceptifs chez ces patients. Les données de la neuroimagerie fonctionnelle ont, de façon générale, elles aussi montré une hyperactivation des réseaux cérébraux impliqués dans la perception de la douleur chez ces patients lors de l’application de stimulations douloureuses expérimentales.Si ces travaux confortent l’hypothèse d’une l’hyperexcitabilité des systèmes nociceptifs chez les patients atteints d’une FM, ils ne fournissent pas d’indications sur les mécanismes qui la sous-tendent. Deux principaux types de mécanismes ont été envisagés (figure 17.1A et 17.1B
et 17.1B ). Le premier est l’altération des systèmes endogènes de modulation de la douleur. Le second est la sensibilisation centrale. Il est important de souligner d’emblée que ces deux mécanismes physiopathologiques ne sont en aucun cas mutuellement exclusifs et, qu’en réalité, ils sont même synergiques.
). Le premier est l’altération des systèmes endogènes de modulation de la douleur. Le second est la sensibilisation centrale. Il est important de souligner d’emblée que ces deux mécanismes physiopathologiques ne sont en aucun cas mutuellement exclusifs et, qu’en réalité, ils sont même synergiques.
 et 17.1B
et 17.1B ). Le premier est l’altération des systèmes endogènes de modulation de la douleur. Le second est la sensibilisation centrale. Il est important de souligner d’emblée que ces deux mécanismes physiopathologiques ne sont en aucun cas mutuellement exclusifs et, qu’en réalité, ils sont même synergiques.
). Le premier est l’altération des systèmes endogènes de modulation de la douleur. Le second est la sensibilisation centrale. Il est important de souligner d’emblée que ces deux mécanismes physiopathologiques ne sont en aucun cas mutuellement exclusifs et, qu’en réalité, ils sont même synergiques.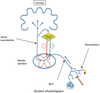 | Figure 17.1 Hypothèses des mécanismes biologiques à l’origine des douleurs diffuses chroniques dans le syndrome fibromyalgique - A |
 | Figure 17.2 Hypothèses des mécanismes biologiques à l’origine des douleurs diffuses chroniques dans le syndrome fibromyalgique - B |
Altération des systèmes endogènes de modulation de la douleur
Il est établi, au moins depuis les années 1960, que la transmission des messages nociceptifs est fortement modulée dans le système nerveux central. Des mécanismes dits segmentaires interviennent d’abord dans la moelle épinière où l’activité des neurones nociceptifs est modulée par l’interaction entre les messages afférents non nociceptifs, véhiculés par les fibres de gros calibre, et les messages nociceptifs véhiculés par les fibres de petit diamètre. Ces données sont à la base de la classique théorie du portillon (ou gate control theory) proposée en 1965 (Melzack et Wall, 1965 ). Quelques années plus tard, on a découvert que la transmission médullaire des messages nociceptifs était également fortement modulée par des systèmes trouvant leur origine dans le cerveau, principalement au niveau du tronc cérébral. Il a d’abord été montré chez l’animal que la stimulation électrique de certaines structures comme la substance grise périaqueducale ou le noyau du raphé, entraînait une analgésie très puissante en agissant directement sur les neurones nociceptifs médullaires grâce à des projections descendant du tronc cérébral vers la corne postérieure de la moelle épinière (Basbaum et Fields, 1984
). Quelques années plus tard, on a découvert que la transmission médullaire des messages nociceptifs était également fortement modulée par des systèmes trouvant leur origine dans le cerveau, principalement au niveau du tronc cérébral. Il a d’abord été montré chez l’animal que la stimulation électrique de certaines structures comme la substance grise périaqueducale ou le noyau du raphé, entraînait une analgésie très puissante en agissant directement sur les neurones nociceptifs médullaires grâce à des projections descendant du tronc cérébral vers la corne postérieure de la moelle épinière (Basbaum et Fields, 1984 ; Le Bars et coll., 1992
; Le Bars et coll., 1992 ; Le Bars, 2002
; Le Bars, 2002 ). De très nombreux travaux ont ensuite été consacrés à la caractérisation de ces contrôles dits « descendants » de la transmission nociceptive (Millan, 2002
). De très nombreux travaux ont ensuite été consacrés à la caractérisation de ces contrôles dits « descendants » de la transmission nociceptive (Millan, 2002 ; Ossipov et coll., 2014
; Ossipov et coll., 2014 ). On a montré qu’ils mettaient notamment en jeu les opioïdes endogènes ainsi que les systèmes noradrénergiques et sérotoninergiques. Outre les systèmes inhibiteurs, des mécanismes facilitateurs de la douleur, trouvant eux aussi leur origine dans le tronc cérébral, ont également été mis en évidence (Porreca et coll., 2002
). On a montré qu’ils mettaient notamment en jeu les opioïdes endogènes ainsi que les systèmes noradrénergiques et sérotoninergiques. Outre les systèmes inhibiteurs, des mécanismes facilitateurs de la douleur, trouvant eux aussi leur origine dans le tronc cérébral, ont également été mis en évidence (Porreca et coll., 2002 ). De fait, on considère aujourd’hui que la transmission médullaire des messages nociceptifs est la résultante de l’interaction entre les afférences périphériques et ces systèmes modulateurs inhibiteurs et facilitateurs au niveau des neurones de la corne postérieure de la moelle (Porreca et coll., 2002
). De fait, on considère aujourd’hui que la transmission médullaire des messages nociceptifs est la résultante de l’interaction entre les afférences périphériques et ces systèmes modulateurs inhibiteurs et facilitateurs au niveau des neurones de la corne postérieure de la moelle (Porreca et coll., 2002 ; Ossipov et coll., 2014
; Ossipov et coll., 2014 ).
).
 ). Quelques années plus tard, on a découvert que la transmission médullaire des messages nociceptifs était également fortement modulée par des systèmes trouvant leur origine dans le cerveau, principalement au niveau du tronc cérébral. Il a d’abord été montré chez l’animal que la stimulation électrique de certaines structures comme la substance grise périaqueducale ou le noyau du raphé, entraînait une analgésie très puissante en agissant directement sur les neurones nociceptifs médullaires grâce à des projections descendant du tronc cérébral vers la corne postérieure de la moelle épinière (Basbaum et Fields, 1984
). Quelques années plus tard, on a découvert que la transmission médullaire des messages nociceptifs était également fortement modulée par des systèmes trouvant leur origine dans le cerveau, principalement au niveau du tronc cérébral. Il a d’abord été montré chez l’animal que la stimulation électrique de certaines structures comme la substance grise périaqueducale ou le noyau du raphé, entraînait une analgésie très puissante en agissant directement sur les neurones nociceptifs médullaires grâce à des projections descendant du tronc cérébral vers la corne postérieure de la moelle épinière (Basbaum et Fields, 1984 ; Le Bars et coll., 1992
; Le Bars et coll., 1992 ; Le Bars, 2002
; Le Bars, 2002 ). De très nombreux travaux ont ensuite été consacrés à la caractérisation de ces contrôles dits « descendants » de la transmission nociceptive (Millan, 2002
). De très nombreux travaux ont ensuite été consacrés à la caractérisation de ces contrôles dits « descendants » de la transmission nociceptive (Millan, 2002 ; Ossipov et coll., 2014
; Ossipov et coll., 2014 ). On a montré qu’ils mettaient notamment en jeu les opioïdes endogènes ainsi que les systèmes noradrénergiques et sérotoninergiques. Outre les systèmes inhibiteurs, des mécanismes facilitateurs de la douleur, trouvant eux aussi leur origine dans le tronc cérébral, ont également été mis en évidence (Porreca et coll., 2002
). On a montré qu’ils mettaient notamment en jeu les opioïdes endogènes ainsi que les systèmes noradrénergiques et sérotoninergiques. Outre les systèmes inhibiteurs, des mécanismes facilitateurs de la douleur, trouvant eux aussi leur origine dans le tronc cérébral, ont également été mis en évidence (Porreca et coll., 2002 ). De fait, on considère aujourd’hui que la transmission médullaire des messages nociceptifs est la résultante de l’interaction entre les afférences périphériques et ces systèmes modulateurs inhibiteurs et facilitateurs au niveau des neurones de la corne postérieure de la moelle (Porreca et coll., 2002
). De fait, on considère aujourd’hui que la transmission médullaire des messages nociceptifs est la résultante de l’interaction entre les afférences périphériques et ces systèmes modulateurs inhibiteurs et facilitateurs au niveau des neurones de la corne postérieure de la moelle (Porreca et coll., 2002 ; Ossipov et coll., 2014
; Ossipov et coll., 2014 ).
).Ces travaux ont eu un impact considérable dans le domaine de la douleur. Ils ont fourni une base neurophysiologique à certains phénomènes bien connus des cliniciens, comme la très forte modulation de la douleur par les facteurs psychologiques (attention et stress par exemple) ou encore par l’effet placebo (De Felice et Ossipov, 2016 ). En outre, ils ont permis de renouveler les hypothèses physiopathologiques dans la mesure où des altérations de ces puissants systèmes de régulation et de contrôle de la transmission des messages nociceptifs pouvaient rendre compte de nombreuses douleurs pathologiques, dont celles de la FM. Enfin, ils ont conduit au développement de nouvelles stratégies thérapeutiques dites de neuromodulation visant non pas à bloquer le transfert des messages nociceptifs, mais à activer ou restaurer des systèmes de modulation défaillants à l’aide de méthodes non invasives comme les stimulations magnétiques transcrâniennes qui ont fait la preuve d’une certaine efficacité dans la FM (Passard et coll., 2007
). En outre, ils ont permis de renouveler les hypothèses physiopathologiques dans la mesure où des altérations de ces puissants systèmes de régulation et de contrôle de la transmission des messages nociceptifs pouvaient rendre compte de nombreuses douleurs pathologiques, dont celles de la FM. Enfin, ils ont conduit au développement de nouvelles stratégies thérapeutiques dites de neuromodulation visant non pas à bloquer le transfert des messages nociceptifs, mais à activer ou restaurer des systèmes de modulation défaillants à l’aide de méthodes non invasives comme les stimulations magnétiques transcrâniennes qui ont fait la preuve d’une certaine efficacité dans la FM (Passard et coll., 2007 ; Mhalla et coll., 2011
; Mhalla et coll., 2011 ).
).
 ). En outre, ils ont permis de renouveler les hypothèses physiopathologiques dans la mesure où des altérations de ces puissants systèmes de régulation et de contrôle de la transmission des messages nociceptifs pouvaient rendre compte de nombreuses douleurs pathologiques, dont celles de la FM. Enfin, ils ont conduit au développement de nouvelles stratégies thérapeutiques dites de neuromodulation visant non pas à bloquer le transfert des messages nociceptifs, mais à activer ou restaurer des systèmes de modulation défaillants à l’aide de méthodes non invasives comme les stimulations magnétiques transcrâniennes qui ont fait la preuve d’une certaine efficacité dans la FM (Passard et coll., 2007
). En outre, ils ont permis de renouveler les hypothèses physiopathologiques dans la mesure où des altérations de ces puissants systèmes de régulation et de contrôle de la transmission des messages nociceptifs pouvaient rendre compte de nombreuses douleurs pathologiques, dont celles de la FM. Enfin, ils ont conduit au développement de nouvelles stratégies thérapeutiques dites de neuromodulation visant non pas à bloquer le transfert des messages nociceptifs, mais à activer ou restaurer des systèmes de modulation défaillants à l’aide de méthodes non invasives comme les stimulations magnétiques transcrâniennes qui ont fait la preuve d’une certaine efficacité dans la FM (Passard et coll., 2007 ; Mhalla et coll., 2011
; Mhalla et coll., 2011 ).
).Le mécanisme de modulation de la douleur le mieux connu, tant chez l’animal que chez l’homme, est le système des Contrôles Inhibiteurs Diffus induits par stimulations Nociceptives ou CIDN (Le Bars et Villanueva, 1988 ; Le Bars et coll., 1992
; Le Bars et coll., 1992 ; Le Bars 2002
; Le Bars 2002 ). Les CIDN reposent sur la mise en jeu d’une boucle anatomique partant de la moelle pour aller vers le bulbe rachidien puis redescendre vers la moelle pour y inhiber l’activité des neurones nociceptifs. Ces mécanismes inhibiteurs mettent en jeu des systèmes opioïdergiques, noradrénergiques et sérotoninergiques (Le Bars et coll., 1992
). Les CIDN reposent sur la mise en jeu d’une boucle anatomique partant de la moelle pour aller vers le bulbe rachidien puis redescendre vers la moelle pour y inhiber l’activité des neurones nociceptifs. Ces mécanismes inhibiteurs mettent en jeu des systèmes opioïdergiques, noradrénergiques et sérotoninergiques (Le Bars et coll., 1992 ). Les CIDN peuvent facilement être étudiés chez l’animal et chez l’homme en appliquant de façon simultanée deux stimulations nociceptives sur deux parties distinctes du corps (stimulations dites hétérotopiques). Ils représentent le substrat physiologique du classique phénomène d’inhibition d’une douleur par une autre douleur : la douleur la plus forte inhibe la plus faible (Le Bars, 2002
). Les CIDN peuvent facilement être étudiés chez l’animal et chez l’homme en appliquant de façon simultanée deux stimulations nociceptives sur deux parties distinctes du corps (stimulations dites hétérotopiques). Ils représentent le substrat physiologique du classique phénomène d’inhibition d’une douleur par une autre douleur : la douleur la plus forte inhibe la plus faible (Le Bars, 2002 ).
).
 ; Le Bars et coll., 1992
; Le Bars et coll., 1992 ; Le Bars 2002
; Le Bars 2002 ). Les CIDN reposent sur la mise en jeu d’une boucle anatomique partant de la moelle pour aller vers le bulbe rachidien puis redescendre vers la moelle pour y inhiber l’activité des neurones nociceptifs. Ces mécanismes inhibiteurs mettent en jeu des systèmes opioïdergiques, noradrénergiques et sérotoninergiques (Le Bars et coll., 1992
). Les CIDN reposent sur la mise en jeu d’une boucle anatomique partant de la moelle pour aller vers le bulbe rachidien puis redescendre vers la moelle pour y inhiber l’activité des neurones nociceptifs. Ces mécanismes inhibiteurs mettent en jeu des systèmes opioïdergiques, noradrénergiques et sérotoninergiques (Le Bars et coll., 1992 ). Les CIDN peuvent facilement être étudiés chez l’animal et chez l’homme en appliquant de façon simultanée deux stimulations nociceptives sur deux parties distinctes du corps (stimulations dites hétérotopiques). Ils représentent le substrat physiologique du classique phénomène d’inhibition d’une douleur par une autre douleur : la douleur la plus forte inhibe la plus faible (Le Bars, 2002
). Les CIDN peuvent facilement être étudiés chez l’animal et chez l’homme en appliquant de façon simultanée deux stimulations nociceptives sur deux parties distinctes du corps (stimulations dites hétérotopiques). Ils représentent le substrat physiologique du classique phénomène d’inhibition d’une douleur par une autre douleur : la douleur la plus forte inhibe la plus faible (Le Bars, 2002 ).
).En utilisant ce paradigme expérimental simple, plusieurs études ont montré que ces mécanismes inhibiteurs étaient défaillants chez les patients atteints de FM (Kosek et coll., 1996b ; Kosek et Hansson, 1997
; Kosek et Hansson, 1997 ; Lautenbacher et Rollman, 1997
; Lautenbacher et Rollman, 1997 ; Staud et coll., 2003
; Staud et coll., 2003 ; Potvin et coll., 2009
; Potvin et coll., 2009 ; Lannersten et Kosek, 2010
; Lannersten et Kosek, 2010 ; Paul-Savoie et coll., 2012
; Paul-Savoie et coll., 2012 ; Hilgenberg-Syndey et coll., 2016
; Hilgenberg-Syndey et coll., 2016 ; Potvin et Marchand, 2016
; Potvin et Marchand, 2016 ; O’Brien et coll., 2018
; O’Brien et coll., 2018 ). Dans une méta-analyse récente menée sur 23 études (625 femmes et 23 hommes atteints de FM contre 591 femmes et 81 hommes contrôles), un effet de taille de 0,53 (IC 95 % 0,23 à 0,83) correspondant à une différence relative de 68 % a été observée pour la sommation temporelle (14 études) ; la modulation conditionnée de la douleur (12 études) montrait quant à elle une différence relative de 65 % avec un effet de taille de -0,57 (IC 95 % -0,88 à -0,26 ; O’Brien et coll., 2018
). Dans une méta-analyse récente menée sur 23 études (625 femmes et 23 hommes atteints de FM contre 591 femmes et 81 hommes contrôles), un effet de taille de 0,53 (IC 95 % 0,23 à 0,83) correspondant à une différence relative de 68 % a été observée pour la sommation temporelle (14 études) ; la modulation conditionnée de la douleur (12 études) montrait quant à elle une différence relative de 65 % avec un effet de taille de -0,57 (IC 95 % -0,88 à -0,26 ; O’Brien et coll., 2018 ). Les mécanismes conduisant à cette réduction des CIDN ne sont pas connus, mais elle pourrait être liée à la diminution de concentration dans le système nerveux central de la noradrénaline et de ces métabolites, ainsi que celle de la sérotonine et de ses précurseurs, mesurées dans le liquide céphalo-rachidien (LCR) des patients atteints de FM (Russell et coll., 1992
). Les mécanismes conduisant à cette réduction des CIDN ne sont pas connus, mais elle pourrait être liée à la diminution de concentration dans le système nerveux central de la noradrénaline et de ces métabolites, ainsi que celle de la sérotonine et de ses précurseurs, mesurées dans le liquide céphalo-rachidien (LCR) des patients atteints de FM (Russell et coll., 1992 ; Russell, 1998
; Russell, 1998 ).
).
 ; Kosek et Hansson, 1997
; Kosek et Hansson, 1997 ; Lautenbacher et Rollman, 1997
; Lautenbacher et Rollman, 1997 ; Staud et coll., 2003
; Staud et coll., 2003 ; Potvin et coll., 2009
; Potvin et coll., 2009 ; Lannersten et Kosek, 2010
; Lannersten et Kosek, 2010 ; Paul-Savoie et coll., 2012
; Paul-Savoie et coll., 2012 ; Hilgenberg-Syndey et coll., 2016
; Hilgenberg-Syndey et coll., 2016 ; Potvin et Marchand, 2016
; Potvin et Marchand, 2016 ; O’Brien et coll., 2018
; O’Brien et coll., 2018 ). Dans une méta-analyse récente menée sur 23 études (625 femmes et 23 hommes atteints de FM contre 591 femmes et 81 hommes contrôles), un effet de taille de 0,53 (IC 95 % 0,23 à 0,83) correspondant à une différence relative de 68 % a été observée pour la sommation temporelle (14 études) ; la modulation conditionnée de la douleur (12 études) montrait quant à elle une différence relative de 65 % avec un effet de taille de -0,57 (IC 95 % -0,88 à -0,26 ; O’Brien et coll., 2018
). Dans une méta-analyse récente menée sur 23 études (625 femmes et 23 hommes atteints de FM contre 591 femmes et 81 hommes contrôles), un effet de taille de 0,53 (IC 95 % 0,23 à 0,83) correspondant à une différence relative de 68 % a été observée pour la sommation temporelle (14 études) ; la modulation conditionnée de la douleur (12 études) montrait quant à elle une différence relative de 65 % avec un effet de taille de -0,57 (IC 95 % -0,88 à -0,26 ; O’Brien et coll., 2018 ). Les mécanismes conduisant à cette réduction des CIDN ne sont pas connus, mais elle pourrait être liée à la diminution de concentration dans le système nerveux central de la noradrénaline et de ces métabolites, ainsi que celle de la sérotonine et de ses précurseurs, mesurées dans le liquide céphalo-rachidien (LCR) des patients atteints de FM (Russell et coll., 1992
). Les mécanismes conduisant à cette réduction des CIDN ne sont pas connus, mais elle pourrait être liée à la diminution de concentration dans le système nerveux central de la noradrénaline et de ces métabolites, ainsi que celle de la sérotonine et de ses précurseurs, mesurées dans le liquide céphalo-rachidien (LCR) des patients atteints de FM (Russell et coll., 1992 ; Russell, 1998
; Russell, 1998 ).
).Quoi qu’il en soit, comme nous le verrons pour d’autres mécanismes physiopathologiques proposés, la diminution des CIDN n’est pas spécifique de la FM puisqu’elle est également observée dans d’autres troubles somatiques fonctionnels douloureux comme le syndrome de l’intestin irritable, les syndromes douloureux de l’articulation temporo-mandibulaire ou encore certaines céphalées chroniques (Mayer et Gebhart, 1994 ; Wilder-Smith et Robert-Yap, 2007
; Wilder-Smith et Robert-Yap, 2007 ; Staud, 2012
; Staud, 2012 ; Yarnitzky, 2015
; Yarnitzky, 2015 ; Moana-Filho et coll., 2018
; Moana-Filho et coll., 2018 ). Ceci souligne les similitudes physiopathologiques entre ces différents syndromes douloureux qui sont d’ailleurs souvent associés chez un même patient (voir chapitre « Épidémiologie du syndrome fibromyalgique »).
). Ceci souligne les similitudes physiopathologiques entre ces différents syndromes douloureux qui sont d’ailleurs souvent associés chez un même patient (voir chapitre « Épidémiologie du syndrome fibromyalgique »).
 ; Wilder-Smith et Robert-Yap, 2007
; Wilder-Smith et Robert-Yap, 2007 ; Staud, 2012
; Staud, 2012 ; Yarnitzky, 2015
; Yarnitzky, 2015 ; Moana-Filho et coll., 2018
; Moana-Filho et coll., 2018 ). Ceci souligne les similitudes physiopathologiques entre ces différents syndromes douloureux qui sont d’ailleurs souvent associés chez un même patient (voir chapitre « Épidémiologie du syndrome fibromyalgique »).
). Ceci souligne les similitudes physiopathologiques entre ces différents syndromes douloureux qui sont d’ailleurs souvent associés chez un même patient (voir chapitre « Épidémiologie du syndrome fibromyalgique »).Sensibilisation centrale
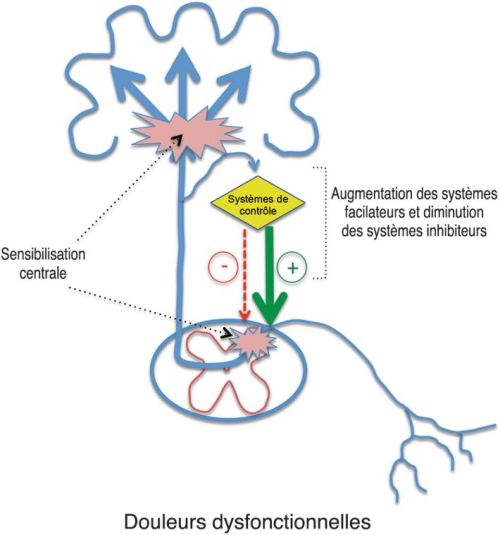
La sensibilisation centrale est une notion issue d’études électrophysiologiques menées chez l’animal qui ont montré que dans des conditions pathologiques de type inflammation ou lésion nerveuse, se développait un état d’hyperexcitabilité durable et pathologique des neurones nociceptifs (notamment au niveau de la moelle), lié à des modifications directes de leurs propriétés électrophysiologiques (Woolf, 2011 ). Ces dernières consistent non seulement en des réponses accrues à des stimulations normalement nociceptives, mais également en l’apparition d’une activité spontanée, en une augmentation des réponses à des stimulations non nociceptives et en une augmentation de la taille de leur champ récepteur excitateur, c’est-à-dire de la région cutanée dont la stimulation entraîne leur activation. On considère aujourd’hui que ce phénomène, qui peut contribuer à amplifier et pérenniser la douleur, joue un rôle majeur dans la physiopathologie de nombreuses douleurs chroniques (Arendt-Nielsen et coll., 2018
). Ces dernières consistent non seulement en des réponses accrues à des stimulations normalement nociceptives, mais également en l’apparition d’une activité spontanée, en une augmentation des réponses à des stimulations non nociceptives et en une augmentation de la taille de leur champ récepteur excitateur, c’est-à-dire de la région cutanée dont la stimulation entraîne leur activation. On considère aujourd’hui que ce phénomène, qui peut contribuer à amplifier et pérenniser la douleur, joue un rôle majeur dans la physiopathologie de nombreuses douleurs chroniques (Arendt-Nielsen et coll., 2018 ). La plupart des travaux ont concerné les douleurs inflammatoires ou neuropathiques. Dans ces cas on considère que le développement de la sensibilisation centrale est dépendant, au moins au stade initial, d’une hyperactivité des nocicepteurs (récepteurs de la douleur) liée soit aux processus inflammatoires responsables de leur sensibilisation, soit à une lésion neurologique avec l’apparition d’activités anormales dites ectopiques au niveau des fibres lésées.
). La plupart des travaux ont concerné les douleurs inflammatoires ou neuropathiques. Dans ces cas on considère que le développement de la sensibilisation centrale est dépendant, au moins au stade initial, d’une hyperactivité des nocicepteurs (récepteurs de la douleur) liée soit aux processus inflammatoires responsables de leur sensibilisation, soit à une lésion neurologique avec l’apparition d’activités anormales dites ectopiques au niveau des fibres lésées.
 ). Ces dernières consistent non seulement en des réponses accrues à des stimulations normalement nociceptives, mais également en l’apparition d’une activité spontanée, en une augmentation des réponses à des stimulations non nociceptives et en une augmentation de la taille de leur champ récepteur excitateur, c’est-à-dire de la région cutanée dont la stimulation entraîne leur activation. On considère aujourd’hui que ce phénomène, qui peut contribuer à amplifier et pérenniser la douleur, joue un rôle majeur dans la physiopathologie de nombreuses douleurs chroniques (Arendt-Nielsen et coll., 2018
). Ces dernières consistent non seulement en des réponses accrues à des stimulations normalement nociceptives, mais également en l’apparition d’une activité spontanée, en une augmentation des réponses à des stimulations non nociceptives et en une augmentation de la taille de leur champ récepteur excitateur, c’est-à-dire de la région cutanée dont la stimulation entraîne leur activation. On considère aujourd’hui que ce phénomène, qui peut contribuer à amplifier et pérenniser la douleur, joue un rôle majeur dans la physiopathologie de nombreuses douleurs chroniques (Arendt-Nielsen et coll., 2018 ). La plupart des travaux ont concerné les douleurs inflammatoires ou neuropathiques. Dans ces cas on considère que le développement de la sensibilisation centrale est dépendant, au moins au stade initial, d’une hyperactivité des nocicepteurs (récepteurs de la douleur) liée soit aux processus inflammatoires responsables de leur sensibilisation, soit à une lésion neurologique avec l’apparition d’activités anormales dites ectopiques au niveau des fibres lésées.
). La plupart des travaux ont concerné les douleurs inflammatoires ou neuropathiques. Dans ces cas on considère que le développement de la sensibilisation centrale est dépendant, au moins au stade initial, d’une hyperactivité des nocicepteurs (récepteurs de la douleur) liée soit aux processus inflammatoires responsables de leur sensibilisation, soit à une lésion neurologique avec l’apparition d’activités anormales dites ectopiques au niveau des fibres lésées.Les mécanismes cellulaires et moléculaires susceptibles de conduire à la sensibilisation des neurones de la corne postérieure de la moelle ont fait l’objet de multiples investigations au cours des vingt dernières années (Latremolière et Woolf, 2009 ; Woolf, 2011
; Woolf, 2011 ). Il est bien établi en particulier que les acides aminés excitateurs, notamment le glutamate, jouent un rôle essentiel dans l’initiation de ces processus via l’activation des récepteurs NMDA (Dickenson et Sullivan, 1987
). Il est bien établi en particulier que les acides aminés excitateurs, notamment le glutamate, jouent un rôle essentiel dans l’initiation de ces processus via l’activation des récepteurs NMDA (Dickenson et Sullivan, 1987 ; Latremolière et Woolf, 2009
; Latremolière et Woolf, 2009 ). Après avoir été initiés par les afférences périphériques, les mécanismes de sensibilisation pourraient s’autonomiser, c’est-à-dire que ces processus d’amplification de la douleur pourraient évoluer pour leur propre compte et se maintenir indépendamment des afférents périphériques (Woolf, 2011
). Après avoir été initiés par les afférences périphériques, les mécanismes de sensibilisation pourraient s’autonomiser, c’est-à-dire que ces processus d’amplification de la douleur pourraient évoluer pour leur propre compte et se maintenir indépendamment des afférents périphériques (Woolf, 2011 ). Parmi les nombreux mécanismes susceptibles de contribuer au maintien de la sensibilisation centrale, on compte l’altération des systèmes endogènes de modulation de la douleur que nous avons décrits plus haut (Yarnitsky, 2015
). Parmi les nombreux mécanismes susceptibles de contribuer au maintien de la sensibilisation centrale, on compte l’altération des systèmes endogènes de modulation de la douleur que nous avons décrits plus haut (Yarnitsky, 2015 ; Arendt-Nielsen et coll., 2018
; Arendt-Nielsen et coll., 2018 ).
).
 ; Woolf, 2011
; Woolf, 2011 ). Il est bien établi en particulier que les acides aminés excitateurs, notamment le glutamate, jouent un rôle essentiel dans l’initiation de ces processus via l’activation des récepteurs NMDA (Dickenson et Sullivan, 1987
). Il est bien établi en particulier que les acides aminés excitateurs, notamment le glutamate, jouent un rôle essentiel dans l’initiation de ces processus via l’activation des récepteurs NMDA (Dickenson et Sullivan, 1987 ; Latremolière et Woolf, 2009
; Latremolière et Woolf, 2009 ). Après avoir été initiés par les afférences périphériques, les mécanismes de sensibilisation pourraient s’autonomiser, c’est-à-dire que ces processus d’amplification de la douleur pourraient évoluer pour leur propre compte et se maintenir indépendamment des afférents périphériques (Woolf, 2011
). Après avoir été initiés par les afférences périphériques, les mécanismes de sensibilisation pourraient s’autonomiser, c’est-à-dire que ces processus d’amplification de la douleur pourraient évoluer pour leur propre compte et se maintenir indépendamment des afférents périphériques (Woolf, 2011 ). Parmi les nombreux mécanismes susceptibles de contribuer au maintien de la sensibilisation centrale, on compte l’altération des systèmes endogènes de modulation de la douleur que nous avons décrits plus haut (Yarnitsky, 2015
). Parmi les nombreux mécanismes susceptibles de contribuer au maintien de la sensibilisation centrale, on compte l’altération des systèmes endogènes de modulation de la douleur que nous avons décrits plus haut (Yarnitsky, 2015 ; Arendt-Nielsen et coll., 2018
; Arendt-Nielsen et coll., 2018 ).
).L’hypersensibilité à la douleur caractérisant la FM pourrait résulter de phénomènes de sensibilisation centrale. En l’absence d’arguments en faveur de mécanismes périphériques susceptibles d’entraîner une augmentation des afférences nociceptives, il a été proposé que la sensibilisation centrale pourrait résulter d’altérations des systèmes modulateurs, même si l’origine (acquise ou développementale) de ces altérations restait à être déterminée. Une diminution des contrôles inhibiteurs, une augmentation de contrôles facilitateurs ou encore les deux phénomènes à la fois pourraient ainsi être à l’origine d’une sensibilisation centrale (Staud et coll., 2012 ). Ce mécanisme de sensibilisation centrale ne serait pas spécifique à la FM puisqu’il pourrait également intervenir dans d’autres troubles somatiques fonctionnels douloureux comme le syndrome de l’intestin irritable, syndromes douloureux de l’articulation temporo-mandibulaire et certaines céphalées chroniques (Staud et coll., 2012
). Ce mécanisme de sensibilisation centrale ne serait pas spécifique à la FM puisqu’il pourrait également intervenir dans d’autres troubles somatiques fonctionnels douloureux comme le syndrome de l’intestin irritable, syndromes douloureux de l’articulation temporo-mandibulaire et certaines céphalées chroniques (Staud et coll., 2012 ; Arendt-Nielsen et coll., 2018
; Arendt-Nielsen et coll., 2018 ). Comme nous l’avons déjà souligné, le fait que ces syndromes partagent des mécanismes physiopathologiques pourrait expliquer leur comorbidité.
). Comme nous l’avons déjà souligné, le fait que ces syndromes partagent des mécanismes physiopathologiques pourrait expliquer leur comorbidité.
 ). Ce mécanisme de sensibilisation centrale ne serait pas spécifique à la FM puisqu’il pourrait également intervenir dans d’autres troubles somatiques fonctionnels douloureux comme le syndrome de l’intestin irritable, syndromes douloureux de l’articulation temporo-mandibulaire et certaines céphalées chroniques (Staud et coll., 2012
). Ce mécanisme de sensibilisation centrale ne serait pas spécifique à la FM puisqu’il pourrait également intervenir dans d’autres troubles somatiques fonctionnels douloureux comme le syndrome de l’intestin irritable, syndromes douloureux de l’articulation temporo-mandibulaire et certaines céphalées chroniques (Staud et coll., 2012 ; Arendt-Nielsen et coll., 2018
; Arendt-Nielsen et coll., 2018 ). Comme nous l’avons déjà souligné, le fait que ces syndromes partagent des mécanismes physiopathologiques pourrait expliquer leur comorbidité.
). Comme nous l’avons déjà souligné, le fait que ces syndromes partagent des mécanismes physiopathologiques pourrait expliquer leur comorbidité.Il n’est pas possible d’étudier directement la sensibilisation centrale chez l’Homme, mais on peut le faire de façon indirecte en analysant les réponses à des stimulations douloureuses expérimentales répétées à fréquence rapide. L’application de stimulations à fréquence relativement élevée (par exemple une dizaine de stimulations mécaniques ou thermiques à la fréquence d’une stimulation par seconde) produit une augmentation progressive de la douleur alors que l’intensité de la stimulation n’a pas changé. Cette augmentation de la douleur liée à la sommation temporelle des messages nociceptifs est considérée comme un équivalent du phénomène de wind up, décrit au niveau des neurones nociceptifs de la moelle chez l’animal (Woolf, 2011 ). Cette augmentation progressive de la douleur liée à la sommation temporelle chez l’Homme et le wind up de l’activité neuronale chez l’animal, seraient un reflet de la sensibilisation centrale (Arendt-Nielsen et coll., 2018
). Cette augmentation progressive de la douleur liée à la sommation temporelle chez l’Homme et le wind up de l’activité neuronale chez l’animal, seraient un reflet de la sensibilisation centrale (Arendt-Nielsen et coll., 2018 ; O’Brien et coll., 2018
; O’Brien et coll., 2018 ). Un des arguments en ce sens est que les deux phénomènes sont spécifiquement inhibés par les antagonistes des récepteurs NMDA (Dickenson et Sullivan, 1987
). Un des arguments en ce sens est que les deux phénomènes sont spécifiquement inhibés par les antagonistes des récepteurs NMDA (Dickenson et Sullivan, 1987 ). Il est donc possible d’utiliser ce modèle expérimental simple de la sommation temporelle des stimulations nociceptives pour analyser la sensibilisation centrale chez les patients. Les études s’appuyant sur ce modèle expérimental ont montré que les effets de la sommation temporelle étaient exacerbés chez les patients atteints de FM, ce qui est compatible avec l’hypothèse de la sensibilisation centrale (Price et coll., 2002
). Il est donc possible d’utiliser ce modèle expérimental simple de la sommation temporelle des stimulations nociceptives pour analyser la sensibilisation centrale chez les patients. Les études s’appuyant sur ce modèle expérimental ont montré que les effets de la sommation temporelle étaient exacerbés chez les patients atteints de FM, ce qui est compatible avec l’hypothèse de la sensibilisation centrale (Price et coll., 2002 ; Staud et coll., 2003
; Staud et coll., 2003 , 2008
, 2008 ; Potvin et coll., 2012
; Potvin et coll., 2012 ; Coppieters et coll., 2015
; Coppieters et coll., 2015 ; Hilgenberg-Sydney et coll., 2016
; Hilgenberg-Sydney et coll., 2016 ). Une méta-analyse récente incluant 12 études (370 patients atteints de FM contre 355 contrôles) a ainsi montré un effet de taille de 0,53 pour la sommation temporelle dans le groupe FM (IC 95 % 0,23 à 0,83) correspondant à une différence relative de 68 % avec le groupe contrôle (O’Brien et coll., 2018
). Une méta-analyse récente incluant 12 études (370 patients atteints de FM contre 355 contrôles) a ainsi montré un effet de taille de 0,53 pour la sommation temporelle dans le groupe FM (IC 95 % 0,23 à 0,83) correspondant à une différence relative de 68 % avec le groupe contrôle (O’Brien et coll., 2018 ).
).
 ). Cette augmentation progressive de la douleur liée à la sommation temporelle chez l’Homme et le wind up de l’activité neuronale chez l’animal, seraient un reflet de la sensibilisation centrale (Arendt-Nielsen et coll., 2018
). Cette augmentation progressive de la douleur liée à la sommation temporelle chez l’Homme et le wind up de l’activité neuronale chez l’animal, seraient un reflet de la sensibilisation centrale (Arendt-Nielsen et coll., 2018 ; O’Brien et coll., 2018
; O’Brien et coll., 2018 ). Un des arguments en ce sens est que les deux phénomènes sont spécifiquement inhibés par les antagonistes des récepteurs NMDA (Dickenson et Sullivan, 1987
). Un des arguments en ce sens est que les deux phénomènes sont spécifiquement inhibés par les antagonistes des récepteurs NMDA (Dickenson et Sullivan, 1987 ). Il est donc possible d’utiliser ce modèle expérimental simple de la sommation temporelle des stimulations nociceptives pour analyser la sensibilisation centrale chez les patients. Les études s’appuyant sur ce modèle expérimental ont montré que les effets de la sommation temporelle étaient exacerbés chez les patients atteints de FM, ce qui est compatible avec l’hypothèse de la sensibilisation centrale (Price et coll., 2002
). Il est donc possible d’utiliser ce modèle expérimental simple de la sommation temporelle des stimulations nociceptives pour analyser la sensibilisation centrale chez les patients. Les études s’appuyant sur ce modèle expérimental ont montré que les effets de la sommation temporelle étaient exacerbés chez les patients atteints de FM, ce qui est compatible avec l’hypothèse de la sensibilisation centrale (Price et coll., 2002 ; Staud et coll., 2003
; Staud et coll., 2003 , 2008
, 2008 ; Potvin et coll., 2012
; Potvin et coll., 2012 ; Coppieters et coll., 2015
; Coppieters et coll., 2015 ; Hilgenberg-Sydney et coll., 2016
; Hilgenberg-Sydney et coll., 2016 ). Une méta-analyse récente incluant 12 études (370 patients atteints de FM contre 355 contrôles) a ainsi montré un effet de taille de 0,53 pour la sommation temporelle dans le groupe FM (IC 95 % 0,23 à 0,83) correspondant à une différence relative de 68 % avec le groupe contrôle (O’Brien et coll., 2018
). Une méta-analyse récente incluant 12 études (370 patients atteints de FM contre 355 contrôles) a ainsi montré un effet de taille de 0,53 pour la sommation temporelle dans le groupe FM (IC 95 % 0,23 à 0,83) correspondant à une différence relative de 68 % avec le groupe contrôle (O’Brien et coll., 2018 ).
).D’autres arguments indirects en faveur de cette hypothèse reposent sur des études utilisant la spectroscopie cérébrale par résonance magnétique – une technique permettant d’analyser les modifications de concentrations locales de certains composés biochimiques – qui ont montré une augmentation de la concentration en glutamate (dont on a déjà mentionné le rôle dans le développement de la sensibilisation centrale) dans plusieurs régions cérébrales chez les patients atteints de FM (Harris et coll., 2009 ; Fayed et coll., 2010
; Fayed et coll., 2010 ; Harris et Clauw, 2012
; Harris et Clauw, 2012 ; Pyke et coll., 2017
; Pyke et coll., 2017 ). Une revue systématique de la littérature menée sur 8 études (472 participants dont 203 patients [181 femmes] atteints de FM) fait ainsi état de 7 études sur 8 montrant une corrélation positive (gyrus cingulaire postérieur, cortex insulaire postérieur, cortex préfrontal ventrolatéral, amygdale) contre 1 détectant une diminution du niveau de glutamate dans la région hippocampique (Pyke et coll., 2017
). Une revue systématique de la littérature menée sur 8 études (472 participants dont 203 patients [181 femmes] atteints de FM) fait ainsi état de 7 études sur 8 montrant une corrélation positive (gyrus cingulaire postérieur, cortex insulaire postérieur, cortex préfrontal ventrolatéral, amygdale) contre 1 détectant une diminution du niveau de glutamate dans la région hippocampique (Pyke et coll., 2017 ). Une augmentation de la concentration en glutamate a également été mise en évidence dans le LCR de 20 patients dont 17 femmes (Sarchielli et coll., 2007
). Une augmentation de la concentration en glutamate a également été mise en évidence dans le LCR de 20 patients dont 17 femmes (Sarchielli et coll., 2007 ). Des données pharmacologiques concernant les effets positifs d’antagonistes des récepteurs NMDA comme la kétamine (Graven-Nielsen et coll., 2000
). Des données pharmacologiques concernant les effets positifs d’antagonistes des récepteurs NMDA comme la kétamine (Graven-Nielsen et coll., 2000 ; Staud et coll., 2005
; Staud et coll., 2005 ; Cohen et coll., 2006
; Cohen et coll., 2006 ; Olivan-Blázquez et coll., 2014
; Olivan-Blázquez et coll., 2014 ) tendent elles aussi à confirmer le rôle de la sensibilisation centrale dans la FM (voir chapitre « Prise en charge médicamenteuse du syndrome fibromyalgique »). On peut également citer ici un travail mené sur 30 patients atteints de FM et de syndrome de l’intestin irritable suggérant qu’un régime pauvre en glutamate (mené sur une période de 4 semaines) a eu un effet bénéfique (diminution de 30 % des symptômes) pour 84 % d’entre eux (Holton et coll., 2012
) tendent elles aussi à confirmer le rôle de la sensibilisation centrale dans la FM (voir chapitre « Prise en charge médicamenteuse du syndrome fibromyalgique »). On peut également citer ici un travail mené sur 30 patients atteints de FM et de syndrome de l’intestin irritable suggérant qu’un régime pauvre en glutamate (mené sur une période de 4 semaines) a eu un effet bénéfique (diminution de 30 % des symptômes) pour 84 % d’entre eux (Holton et coll., 2012 ).
).
 ; Fayed et coll., 2010
; Fayed et coll., 2010 ; Harris et Clauw, 2012
; Harris et Clauw, 2012 ; Pyke et coll., 2017
; Pyke et coll., 2017 ). Une revue systématique de la littérature menée sur 8 études (472 participants dont 203 patients [181 femmes] atteints de FM) fait ainsi état de 7 études sur 8 montrant une corrélation positive (gyrus cingulaire postérieur, cortex insulaire postérieur, cortex préfrontal ventrolatéral, amygdale) contre 1 détectant une diminution du niveau de glutamate dans la région hippocampique (Pyke et coll., 2017
). Une revue systématique de la littérature menée sur 8 études (472 participants dont 203 patients [181 femmes] atteints de FM) fait ainsi état de 7 études sur 8 montrant une corrélation positive (gyrus cingulaire postérieur, cortex insulaire postérieur, cortex préfrontal ventrolatéral, amygdale) contre 1 détectant une diminution du niveau de glutamate dans la région hippocampique (Pyke et coll., 2017 ). Une augmentation de la concentration en glutamate a également été mise en évidence dans le LCR de 20 patients dont 17 femmes (Sarchielli et coll., 2007
). Une augmentation de la concentration en glutamate a également été mise en évidence dans le LCR de 20 patients dont 17 femmes (Sarchielli et coll., 2007 ). Des données pharmacologiques concernant les effets positifs d’antagonistes des récepteurs NMDA comme la kétamine (Graven-Nielsen et coll., 2000
). Des données pharmacologiques concernant les effets positifs d’antagonistes des récepteurs NMDA comme la kétamine (Graven-Nielsen et coll., 2000 ; Staud et coll., 2005
; Staud et coll., 2005 ; Cohen et coll., 2006
; Cohen et coll., 2006 ; Olivan-Blázquez et coll., 2014
; Olivan-Blázquez et coll., 2014 ) tendent elles aussi à confirmer le rôle de la sensibilisation centrale dans la FM (voir chapitre « Prise en charge médicamenteuse du syndrome fibromyalgique »). On peut également citer ici un travail mené sur 30 patients atteints de FM et de syndrome de l’intestin irritable suggérant qu’un régime pauvre en glutamate (mené sur une période de 4 semaines) a eu un effet bénéfique (diminution de 30 % des symptômes) pour 84 % d’entre eux (Holton et coll., 2012
) tendent elles aussi à confirmer le rôle de la sensibilisation centrale dans la FM (voir chapitre « Prise en charge médicamenteuse du syndrome fibromyalgique »). On peut également citer ici un travail mené sur 30 patients atteints de FM et de syndrome de l’intestin irritable suggérant qu’un régime pauvre en glutamate (mené sur une période de 4 semaines) a eu un effet bénéfique (diminution de 30 % des symptômes) pour 84 % d’entre eux (Holton et coll., 2012 ).
).On a longtemps considéré que seuls des mécanismes centraux intervenaient dans la FM, mais des données récentes tendent à remettre en cause cette notion (voir paragraphe « mécanismes périphériques » ci-dessous). De fait, on ne peut exclure aujourd’hui que, comme dans d’autres syndromes douloureux chroniques d’origine inflammatoire ou neuropathique (Woolf, 2011 ; Arendt-Nielsen et coll., 2018
; Arendt-Nielsen et coll., 2018 ), des anomalies périphériques d’origine musculaire ou neuronale interviennent également dans le développement et le maintien de la sensibilisation centrale dans la FM.
), des anomalies périphériques d’origine musculaire ou neuronale interviennent également dans le développement et le maintien de la sensibilisation centrale dans la FM.
 ; Arendt-Nielsen et coll., 2018
; Arendt-Nielsen et coll., 2018 ), des anomalies périphériques d’origine musculaire ou neuronale interviennent également dans le développement et le maintien de la sensibilisation centrale dans la FM.
), des anomalies périphériques d’origine musculaire ou neuronale interviennent également dans le développement et le maintien de la sensibilisation centrale dans la FM.Les anomalies de la réponse au stress
De façon parallèle aux travaux concernant les modifications fonctionnelles des systèmes nociceptifs centraux résumés ci-dessus, de très nombreuses études ont été consacrées aux altérations des mécanismes de la réponse au stress chez les patients atteints de FM. Ces travaux visaient non seulement à fournir une base physiopathologique à la douleur diffuse dont souffrent ces patients, mais également aux nombreux autres symptômes associés comme la fatigue, les troubles du sommeil ou encore l’anxiété.
Le stress peut être défini comme un état de perturbation aiguë ou chronique de l’homéostasie de l’organisme lié à des événements divers (maladies, infections, traumatismes physiques ou psychologiques), qui, en réponse, déclenche un ensemble de processus physiologiques adaptifs visant à rétablir l’homéostasie. Si ces mécanismes adaptatifs ont a priori un rôle protecteur, ils peuvent dysfonctionner soit par excès, soit par défaut et devenir pathologiques (Chrousos et coll., 1992 ; Martinez-Lavin, 2007
; Martinez-Lavin, 2007 )2
.
)2
.
 ; Martinez-Lavin, 2007
; Martinez-Lavin, 2007 )2
.
)2
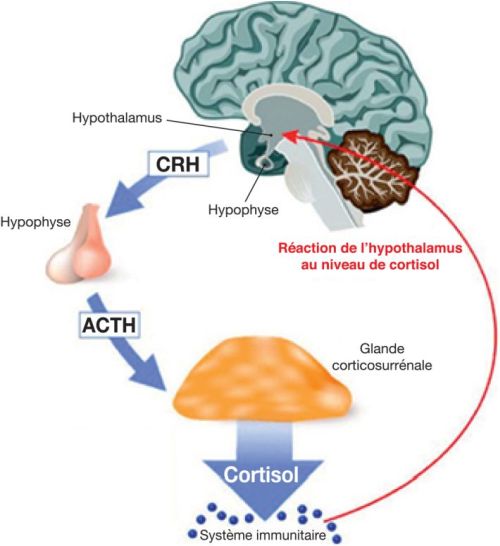
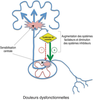
.Les mécanismes physiologiques de la réponse au stress sont relativement bien connus. On sait en effet de longue date qu’ils font intervenir deux grands systèmes qui, il est important de le souligner, sont interconnectés de façon très forte. Le premier est l’axe hypothalamo-hypophyso-surrénalien (HHS). Classiquement, on considère que la libération de CRH (pour Corticotropin-Releasing Hormone ou corticolibérine) par l’hypothalamus (au sein du sous-noyau paraventriculaire) agit au niveau de l’hypophyse pour induire la libération dans la circulation de l’ACTH (hormone adrénocorticotrope) (figure 17.2 ). L’ACTH agit elle-même au niveau de la glande cortico-surrénale en entraînant une augmentation de la sécrétion de cortisol, qui intervient dans la régulation de nombreuses fonctions métaboliques et immunitaires notamment. Le cortisol exerce en outre un rétrocontrôle négatif de la libération de CRH par l’hypothalamus. Le second grand effecteur de la réponse au stress est le système sympathique via notamment une interaction entre l’hypothalamus et le locus coeruleus, le principal noyau noradrénergique du tronc cérébral et un élément majeur du système sympathique. Rappelons que les systèmes autonomes (également appelés végétatifs) sont un ensemble de systèmes qui régulent de façon automatique toutes les grandes fonctions physiologiques (cardiovasculaires, respiratoires, digestives, thermorégulatrices, sexuelles, etc.). Les deux grands sous-systèmes de régulations autonomes que sont le système sympathique et le système parasympathique ont, de façon générale, des actions opposées, le premier étant plutôt excitateur et le second inhibiteur.
). L’ACTH agit elle-même au niveau de la glande cortico-surrénale en entraînant une augmentation de la sécrétion de cortisol, qui intervient dans la régulation de nombreuses fonctions métaboliques et immunitaires notamment. Le cortisol exerce en outre un rétrocontrôle négatif de la libération de CRH par l’hypothalamus. Le second grand effecteur de la réponse au stress est le système sympathique via notamment une interaction entre l’hypothalamus et le locus coeruleus, le principal noyau noradrénergique du tronc cérébral et un élément majeur du système sympathique. Rappelons que les systèmes autonomes (également appelés végétatifs) sont un ensemble de systèmes qui régulent de façon automatique toutes les grandes fonctions physiologiques (cardiovasculaires, respiratoires, digestives, thermorégulatrices, sexuelles, etc.). Les deux grands sous-systèmes de régulations autonomes que sont le système sympathique et le système parasympathique ont, de façon générale, des actions opposées, le premier étant plutôt excitateur et le second inhibiteur.
 ). L’ACTH agit elle-même au niveau de la glande cortico-surrénale en entraînant une augmentation de la sécrétion de cortisol, qui intervient dans la régulation de nombreuses fonctions métaboliques et immunitaires notamment. Le cortisol exerce en outre un rétrocontrôle négatif de la libération de CRH par l’hypothalamus. Le second grand effecteur de la réponse au stress est le système sympathique via notamment une interaction entre l’hypothalamus et le locus coeruleus, le principal noyau noradrénergique du tronc cérébral et un élément majeur du système sympathique. Rappelons que les systèmes autonomes (également appelés végétatifs) sont un ensemble de systèmes qui régulent de façon automatique toutes les grandes fonctions physiologiques (cardiovasculaires, respiratoires, digestives, thermorégulatrices, sexuelles, etc.). Les deux grands sous-systèmes de régulations autonomes que sont le système sympathique et le système parasympathique ont, de façon générale, des actions opposées, le premier étant plutôt excitateur et le second inhibiteur.
). L’ACTH agit elle-même au niveau de la glande cortico-surrénale en entraînant une augmentation de la sécrétion de cortisol, qui intervient dans la régulation de nombreuses fonctions métaboliques et immunitaires notamment. Le cortisol exerce en outre un rétrocontrôle négatif de la libération de CRH par l’hypothalamus. Le second grand effecteur de la réponse au stress est le système sympathique via notamment une interaction entre l’hypothalamus et le locus coeruleus, le principal noyau noradrénergique du tronc cérébral et un élément majeur du système sympathique. Rappelons que les systèmes autonomes (également appelés végétatifs) sont un ensemble de systèmes qui régulent de façon automatique toutes les grandes fonctions physiologiques (cardiovasculaires, respiratoires, digestives, thermorégulatrices, sexuelles, etc.). Les deux grands sous-systèmes de régulations autonomes que sont le système sympathique et le système parasympathique ont, de façon générale, des actions opposées, le premier étant plutôt excitateur et le second inhibiteur.Le rôle potentiel des perturbations de l’axe du stress dans la FM a été envisagé à partir des observations cliniques faisant état d’une fréquence élevée d’antécédents traumatiques, remontant souvent jusqu’à l’enfance, chez ces patients (Lee, 2010 ; Low et Schweinhardt, 2012
; Low et Schweinhardt, 2012 ; voir également le chapitre « Épidémiologie du syndrome fibromyalgique »). Or, la répétition des expériences traumatisantes et stressantes, qu’elles soient liées à des traumatismes physiques (accidents domestiques ou de la voie publique, hospitalisations répétées, maladies chroniques, etc.) ou psychologiques (maltraitance dans l’enfance et abus sexuels notamment), peut entraîner des perturbations des systèmes de réponse au stress, via notamment les nombreuses connexions qui existent entre l’hypothalamus et l’amygdale, l’hippocampe ou le cortex préfrontal (Martinez-Lavin, 2007
; voir également le chapitre « Épidémiologie du syndrome fibromyalgique »). Or, la répétition des expériences traumatisantes et stressantes, qu’elles soient liées à des traumatismes physiques (accidents domestiques ou de la voie publique, hospitalisations répétées, maladies chroniques, etc.) ou psychologiques (maltraitance dans l’enfance et abus sexuels notamment), peut entraîner des perturbations des systèmes de réponse au stress, via notamment les nombreuses connexions qui existent entre l’hypothalamus et l’amygdale, l’hippocampe ou le cortex préfrontal (Martinez-Lavin, 2007 ; Schmidt-Wilcke et Clauw, 2011
; Schmidt-Wilcke et Clauw, 2011 ; Eller-Smith et coll., 2018
; Eller-Smith et coll., 2018 ). Du fait du caractère très ubiquitaire des systèmes HHS et sympathique, des anomalies de la réponse aux stress peuvent a priori avoir des répercussions sur de nombreuses fonctions de l’organisme et pourraient ainsi rendre compte de plusieurs symptômes fibromyalgiques comme la douleur, la fatigue, les troubles du sommeil, l’anxiété ou encore les symptômes de dépression (Martinez-Lavin, 2007
). Du fait du caractère très ubiquitaire des systèmes HHS et sympathique, des anomalies de la réponse aux stress peuvent a priori avoir des répercussions sur de nombreuses fonctions de l’organisme et pourraient ainsi rendre compte de plusieurs symptômes fibromyalgiques comme la douleur, la fatigue, les troubles du sommeil, l’anxiété ou encore les symptômes de dépression (Martinez-Lavin, 2007 ; Sarzi-Puttini et coll., 2010
; Sarzi-Puttini et coll., 2010 ). Ces anomalies seraient encore amplifiées chez des patients ayant une prédisposition génétique les rendant moins aptes à répondre aux situations stressantes (Eller-Smith et coll., 2018
). Ces anomalies seraient encore amplifiées chez des patients ayant une prédisposition génétique les rendant moins aptes à répondre aux situations stressantes (Eller-Smith et coll., 2018 ). Dans ce contexte, il devenait important d’analyser la fonction de l’axe du stress dans la FM.
). Dans ce contexte, il devenait important d’analyser la fonction de l’axe du stress dans la FM.
 ; Low et Schweinhardt, 2012
; Low et Schweinhardt, 2012 ; voir également le chapitre « Épidémiologie du syndrome fibromyalgique »). Or, la répétition des expériences traumatisantes et stressantes, qu’elles soient liées à des traumatismes physiques (accidents domestiques ou de la voie publique, hospitalisations répétées, maladies chroniques, etc.) ou psychologiques (maltraitance dans l’enfance et abus sexuels notamment), peut entraîner des perturbations des systèmes de réponse au stress, via notamment les nombreuses connexions qui existent entre l’hypothalamus et l’amygdale, l’hippocampe ou le cortex préfrontal (Martinez-Lavin, 2007
; voir également le chapitre « Épidémiologie du syndrome fibromyalgique »). Or, la répétition des expériences traumatisantes et stressantes, qu’elles soient liées à des traumatismes physiques (accidents domestiques ou de la voie publique, hospitalisations répétées, maladies chroniques, etc.) ou psychologiques (maltraitance dans l’enfance et abus sexuels notamment), peut entraîner des perturbations des systèmes de réponse au stress, via notamment les nombreuses connexions qui existent entre l’hypothalamus et l’amygdale, l’hippocampe ou le cortex préfrontal (Martinez-Lavin, 2007 ; Schmidt-Wilcke et Clauw, 2011
; Schmidt-Wilcke et Clauw, 2011 ; Eller-Smith et coll., 2018
; Eller-Smith et coll., 2018 ). Du fait du caractère très ubiquitaire des systèmes HHS et sympathique, des anomalies de la réponse aux stress peuvent a priori avoir des répercussions sur de nombreuses fonctions de l’organisme et pourraient ainsi rendre compte de plusieurs symptômes fibromyalgiques comme la douleur, la fatigue, les troubles du sommeil, l’anxiété ou encore les symptômes de dépression (Martinez-Lavin, 2007
). Du fait du caractère très ubiquitaire des systèmes HHS et sympathique, des anomalies de la réponse aux stress peuvent a priori avoir des répercussions sur de nombreuses fonctions de l’organisme et pourraient ainsi rendre compte de plusieurs symptômes fibromyalgiques comme la douleur, la fatigue, les troubles du sommeil, l’anxiété ou encore les symptômes de dépression (Martinez-Lavin, 2007 ; Sarzi-Puttini et coll., 2010
; Sarzi-Puttini et coll., 2010 ). Ces anomalies seraient encore amplifiées chez des patients ayant une prédisposition génétique les rendant moins aptes à répondre aux situations stressantes (Eller-Smith et coll., 2018
). Ces anomalies seraient encore amplifiées chez des patients ayant une prédisposition génétique les rendant moins aptes à répondre aux situations stressantes (Eller-Smith et coll., 2018 ). Dans ce contexte, il devenait important d’analyser la fonction de l’axe du stress dans la FM.
). Dans ce contexte, il devenait important d’analyser la fonction de l’axe du stress dans la FM.Anomalies du système hypothalamo-hypophyso-surrénalien (HHS)
La méthode la plus utilisée pour évaluer l’axe HHS a été la mesure du cortisol, qui peut être facilement dosé dans la salive, le plasma, les urines ou encore le LCR. Près de 30 études ont été réalisées dans ce domaine au cours des 20 dernières années dans la FM. La plupart ont conclu que la FM était associée à un hypocortisolisme, mais des résultats inverses ont également été publiés (Tak et Rosmalen, 2010 ; Tak et coll., 2011
; Tak et coll., 2011 ). Cependant, du fait de leur très grande variabilité, la fiabilité des mesures de cortisol à l’état basal est considérée comme modeste (Tanriverdi et coll., 2007
). Cependant, du fait de leur très grande variabilité, la fiabilité des mesures de cortisol à l’état basal est considérée comme modeste (Tanriverdi et coll., 2007 ). D’autres travaux ont montré une perte des fluctuations nycthémérales du cortisol et une moindre réponse aux tests de stimulation de la libération de cortisol, comme le test au synacthène (ACTH), le test au CRH ou encore le test à l’insuline, qui permettent d’évaluer la fonctionnalité des différentes parties de l’axe HHS (Tanriverdi et coll., 2007
). D’autres travaux ont montré une perte des fluctuations nycthémérales du cortisol et une moindre réponse aux tests de stimulation de la libération de cortisol, comme le test au synacthène (ACTH), le test au CRH ou encore le test à l’insuline, qui permettent d’évaluer la fonctionnalité des différentes parties de l’axe HHS (Tanriverdi et coll., 2007 ). Ces tests dynamiques, qui sont sans doute plus sensibles que les dosages de cortisol basal, n’ont été utilisés que dans peu d’études qui, de façon générale, ont mis en évidence une moindre réactivité de l’axe HHS dans la FM.
). Ces tests dynamiques, qui sont sans doute plus sensibles que les dosages de cortisol basal, n’ont été utilisés que dans peu d’études qui, de façon générale, ont mis en évidence une moindre réactivité de l’axe HHS dans la FM.
 ; Tak et coll., 2011
; Tak et coll., 2011 ). Cependant, du fait de leur très grande variabilité, la fiabilité des mesures de cortisol à l’état basal est considérée comme modeste (Tanriverdi et coll., 2007
). Cependant, du fait de leur très grande variabilité, la fiabilité des mesures de cortisol à l’état basal est considérée comme modeste (Tanriverdi et coll., 2007 ). D’autres travaux ont montré une perte des fluctuations nycthémérales du cortisol et une moindre réponse aux tests de stimulation de la libération de cortisol, comme le test au synacthène (ACTH), le test au CRH ou encore le test à l’insuline, qui permettent d’évaluer la fonctionnalité des différentes parties de l’axe HHS (Tanriverdi et coll., 2007
). D’autres travaux ont montré une perte des fluctuations nycthémérales du cortisol et une moindre réponse aux tests de stimulation de la libération de cortisol, comme le test au synacthène (ACTH), le test au CRH ou encore le test à l’insuline, qui permettent d’évaluer la fonctionnalité des différentes parties de l’axe HHS (Tanriverdi et coll., 2007 ). Ces tests dynamiques, qui sont sans doute plus sensibles que les dosages de cortisol basal, n’ont été utilisés que dans peu d’études qui, de façon générale, ont mis en évidence une moindre réactivité de l’axe HHS dans la FM.
). Ces tests dynamiques, qui sont sans doute plus sensibles que les dosages de cortisol basal, n’ont été utilisés que dans peu d’études qui, de façon générale, ont mis en évidence une moindre réactivité de l’axe HHS dans la FM.Ces anomalies ne sont encore une fois en rien spécifiques de la FM. Elles sont présentes dans d’autres troubles somatiques fonctionnels (syndrome de fatigue chronique, par exemple) ainsi que dans divers autres syndromes douloureux chroniques ou encore dans la dépression (Tak et coll., 2011 ). On peut également ajouter que les modifications observées sont en réalité de très faible amplitude avec un fort recouvrement des résultats observés chez les contrôles et chez les patients atteints de FM (Tak et Rosmalen, 2010
). On peut également ajouter que les modifications observées sont en réalité de très faible amplitude avec un fort recouvrement des résultats observés chez les contrôles et chez les patients atteints de FM (Tak et Rosmalen, 2010 ; Tak et coll., 2011
; Tak et coll., 2011 ). Cette faible spécificité est liée à de nombreux facteurs confondants, parmi lesquels on peut citer le déconditionnement à l’effort, l’obésité, les troubles du sommeil, les comorbidités psychiatriques (dépression et anxiété) ou encore les antécédents de maltraitance infantile, qui peuvent, en dehors de tout contexte de FM, entraîner le même type d’anomalies de l’axe HHS (Tak et coll., 2011
). Cette faible spécificité est liée à de nombreux facteurs confondants, parmi lesquels on peut citer le déconditionnement à l’effort, l’obésité, les troubles du sommeil, les comorbidités psychiatriques (dépression et anxiété) ou encore les antécédents de maltraitance infantile, qui peuvent, en dehors de tout contexte de FM, entraîner le même type d’anomalies de l’axe HHS (Tak et coll., 2011 ; Hassett et Clauw, 2011
; Hassett et Clauw, 2011 ). De fait, il n’est pas possible aujourd’hui d’envisager l’utilisation de ce type de mesures pour diagnostiquer ou évaluer la sévérité de la pathologie. En outre, les mécanismes sous-tendant les effets de ces perturbations de l’axe HHS sur la perception de la douleur ne sont pas bien connus. Ils pourraient être médiés par des mécanismes neuro-immuns dans la mesure où la corticolibérine active les mastocytes présents dans de nombreux tissus, dont la peau, et ainsi entraîner la libération de substances pronociceptives comme les cytokines capables de sensibiliser les nocicepteurs (Eller-Smith et coll., 2018
). De fait, il n’est pas possible aujourd’hui d’envisager l’utilisation de ce type de mesures pour diagnostiquer ou évaluer la sévérité de la pathologie. En outre, les mécanismes sous-tendant les effets de ces perturbations de l’axe HHS sur la perception de la douleur ne sont pas bien connus. Ils pourraient être médiés par des mécanismes neuro-immuns dans la mesure où la corticolibérine active les mastocytes présents dans de nombreux tissus, dont la peau, et ainsi entraîner la libération de substances pronociceptives comme les cytokines capables de sensibiliser les nocicepteurs (Eller-Smith et coll., 2018 ).
).
 ). On peut également ajouter que les modifications observées sont en réalité de très faible amplitude avec un fort recouvrement des résultats observés chez les contrôles et chez les patients atteints de FM (Tak et Rosmalen, 2010
). On peut également ajouter que les modifications observées sont en réalité de très faible amplitude avec un fort recouvrement des résultats observés chez les contrôles et chez les patients atteints de FM (Tak et Rosmalen, 2010 ; Tak et coll., 2011
; Tak et coll., 2011 ). Cette faible spécificité est liée à de nombreux facteurs confondants, parmi lesquels on peut citer le déconditionnement à l’effort, l’obésité, les troubles du sommeil, les comorbidités psychiatriques (dépression et anxiété) ou encore les antécédents de maltraitance infantile, qui peuvent, en dehors de tout contexte de FM, entraîner le même type d’anomalies de l’axe HHS (Tak et coll., 2011
). Cette faible spécificité est liée à de nombreux facteurs confondants, parmi lesquels on peut citer le déconditionnement à l’effort, l’obésité, les troubles du sommeil, les comorbidités psychiatriques (dépression et anxiété) ou encore les antécédents de maltraitance infantile, qui peuvent, en dehors de tout contexte de FM, entraîner le même type d’anomalies de l’axe HHS (Tak et coll., 2011 ; Hassett et Clauw, 2011
; Hassett et Clauw, 2011 ). De fait, il n’est pas possible aujourd’hui d’envisager l’utilisation de ce type de mesures pour diagnostiquer ou évaluer la sévérité de la pathologie. En outre, les mécanismes sous-tendant les effets de ces perturbations de l’axe HHS sur la perception de la douleur ne sont pas bien connus. Ils pourraient être médiés par des mécanismes neuro-immuns dans la mesure où la corticolibérine active les mastocytes présents dans de nombreux tissus, dont la peau, et ainsi entraîner la libération de substances pronociceptives comme les cytokines capables de sensibiliser les nocicepteurs (Eller-Smith et coll., 2018
). De fait, il n’est pas possible aujourd’hui d’envisager l’utilisation de ce type de mesures pour diagnostiquer ou évaluer la sévérité de la pathologie. En outre, les mécanismes sous-tendant les effets de ces perturbations de l’axe HHS sur la perception de la douleur ne sont pas bien connus. Ils pourraient être médiés par des mécanismes neuro-immuns dans la mesure où la corticolibérine active les mastocytes présents dans de nombreux tissus, dont la peau, et ainsi entraîner la libération de substances pronociceptives comme les cytokines capables de sensibiliser les nocicepteurs (Eller-Smith et coll., 2018 ).
).Anomalies du système nerveux sympathique
Au cours des vingt dernières années, plus de 80 études ont concerné l’autre grand effecteur de la réponse au stress qu’est le système nerveux sympathique3
. Ces travaux se sont appuyés sur diverses techniques comme la mesure de la variabilité de la fréquence cardiaque, la réponse à l’orthostatisme contrôlé (test d’inclinaison) et la réponse électrodermale (Martinez-Lavin, 2007 ; Kulshreshta et Deepak, 2013
; Kulshreshta et Deepak, 2013 ). Les résultats de ces études sont relativement homogènes dans la mesure où plus de 60 % montrent que la FM est associée à une augmentation du tonus sympathique basal qui pourrait notamment intervenir dans les troubles du sommeil, la fatigue, les troubles digestifs ou encore l’anxiété associés (Tak et coll., 2009
). Les résultats de ces études sont relativement homogènes dans la mesure où plus de 60 % montrent que la FM est associée à une augmentation du tonus sympathique basal qui pourrait notamment intervenir dans les troubles du sommeil, la fatigue, les troubles digestifs ou encore l’anxiété associés (Tak et coll., 2009 ; Martínez-Martínez et coll., 2014
; Martínez-Martínez et coll., 2014 ). Cette augmentation du tonus basal du système nerveux sympathique est associée à une diminution de sa réponse lors des épreuves de stimulation par des stress expérimentaux, qu’ils soient physiques ou psychologiques (Martinez-Lavin, 2007
). Cette augmentation du tonus basal du système nerveux sympathique est associée à une diminution de sa réponse lors des épreuves de stimulation par des stress expérimentaux, qu’ils soient physiques ou psychologiques (Martinez-Lavin, 2007 ; Kulshreshta et Deepak, 2013
; Kulshreshta et Deepak, 2013 ). Ces résultats a priori paradoxaux pourraient s’expliquer par une désensibilisation progressive suivie d’une véritable diminution de la densité des récepteurs β adrénergiques, liées à leur stimulation chronique et excessive par la noradrénaline (Martinez-Lavin, 2007
). Ces résultats a priori paradoxaux pourraient s’expliquer par une désensibilisation progressive suivie d’une véritable diminution de la densité des récepteurs β adrénergiques, liées à leur stimulation chronique et excessive par la noradrénaline (Martinez-Lavin, 2007 ). D’autres données vont également, bien que de façon indirecte, dans le sens d’une dysfonction des systèmes noradrénergiques chez les patients atteints de FM, en particulier la mise en évidence de certains polymorphismes génétiques qui seraient plus fréquents dans la FM, dont le variant faux sens p.Val158Met de l’enzyme catechol-O-méthyl transférase (COMT), conduisant à une diminution de l’activité de cette enzyme majeure du catabolisme des catécholamines comme la noradrénaline, principal neuromédiateur du système sympathique (Gürsoy et coll., 2003
). D’autres données vont également, bien que de façon indirecte, dans le sens d’une dysfonction des systèmes noradrénergiques chez les patients atteints de FM, en particulier la mise en évidence de certains polymorphismes génétiques qui seraient plus fréquents dans la FM, dont le variant faux sens p.Val158Met de l’enzyme catechol-O-méthyl transférase (COMT), conduisant à une diminution de l’activité de cette enzyme majeure du catabolisme des catécholamines comme la noradrénaline, principal neuromédiateur du système sympathique (Gürsoy et coll., 2003 ; Desmeules et coll., 2012
; Desmeules et coll., 2012 ; Lee et coll., 2015
; Lee et coll., 2015 ; Estévez-López et coll., 2018
; Estévez-López et coll., 2018 ). Il ressort de ces travaux que la FM se caractérise par un système nerveux sympathique hyperactif à l’état basal, mais hyporéactif au stress. Ces données doivent, là encore, être interprétées avec prudence, car il existe un important recouvrement entre les résultats observés chez les patients atteints de FM et ceux obtenus dans la population contrôle. Toutefois, on ne peut exclure l’existence d’altérations plus marquées dans un ou plusieurs sous-groupes de patients, qui pourraient ainsi être identifiés et définis sur des critères biologiques objectifs (Martinez-Lavin, 2007
). Il ressort de ces travaux que la FM se caractérise par un système nerveux sympathique hyperactif à l’état basal, mais hyporéactif au stress. Ces données doivent, là encore, être interprétées avec prudence, car il existe un important recouvrement entre les résultats observés chez les patients atteints de FM et ceux obtenus dans la population contrôle. Toutefois, on ne peut exclure l’existence d’altérations plus marquées dans un ou plusieurs sous-groupes de patients, qui pourraient ainsi être identifiés et définis sur des critères biologiques objectifs (Martinez-Lavin, 2007 ; Tak et Rosmalen, 2010
; Tak et Rosmalen, 2010 ; Martínez-Martínez et coll., 2014
; Martínez-Martínez et coll., 2014 ).
).
 ; Kulshreshta et Deepak, 2013
; Kulshreshta et Deepak, 2013 ). Les résultats de ces études sont relativement homogènes dans la mesure où plus de 60 % montrent que la FM est associée à une augmentation du tonus sympathique basal qui pourrait notamment intervenir dans les troubles du sommeil, la fatigue, les troubles digestifs ou encore l’anxiété associés (Tak et coll., 2009
). Les résultats de ces études sont relativement homogènes dans la mesure où plus de 60 % montrent que la FM est associée à une augmentation du tonus sympathique basal qui pourrait notamment intervenir dans les troubles du sommeil, la fatigue, les troubles digestifs ou encore l’anxiété associés (Tak et coll., 2009 ; Martínez-Martínez et coll., 2014
; Martínez-Martínez et coll., 2014 ). Cette augmentation du tonus basal du système nerveux sympathique est associée à une diminution de sa réponse lors des épreuves de stimulation par des stress expérimentaux, qu’ils soient physiques ou psychologiques (Martinez-Lavin, 2007
). Cette augmentation du tonus basal du système nerveux sympathique est associée à une diminution de sa réponse lors des épreuves de stimulation par des stress expérimentaux, qu’ils soient physiques ou psychologiques (Martinez-Lavin, 2007 ; Kulshreshta et Deepak, 2013
; Kulshreshta et Deepak, 2013 ). Ces résultats a priori paradoxaux pourraient s’expliquer par une désensibilisation progressive suivie d’une véritable diminution de la densité des récepteurs β adrénergiques, liées à leur stimulation chronique et excessive par la noradrénaline (Martinez-Lavin, 2007
). Ces résultats a priori paradoxaux pourraient s’expliquer par une désensibilisation progressive suivie d’une véritable diminution de la densité des récepteurs β adrénergiques, liées à leur stimulation chronique et excessive par la noradrénaline (Martinez-Lavin, 2007 ). D’autres données vont également, bien que de façon indirecte, dans le sens d’une dysfonction des systèmes noradrénergiques chez les patients atteints de FM, en particulier la mise en évidence de certains polymorphismes génétiques qui seraient plus fréquents dans la FM, dont le variant faux sens p.Val158Met de l’enzyme catechol-O-méthyl transférase (COMT), conduisant à une diminution de l’activité de cette enzyme majeure du catabolisme des catécholamines comme la noradrénaline, principal neuromédiateur du système sympathique (Gürsoy et coll., 2003
). D’autres données vont également, bien que de façon indirecte, dans le sens d’une dysfonction des systèmes noradrénergiques chez les patients atteints de FM, en particulier la mise en évidence de certains polymorphismes génétiques qui seraient plus fréquents dans la FM, dont le variant faux sens p.Val158Met de l’enzyme catechol-O-méthyl transférase (COMT), conduisant à une diminution de l’activité de cette enzyme majeure du catabolisme des catécholamines comme la noradrénaline, principal neuromédiateur du système sympathique (Gürsoy et coll., 2003 ; Desmeules et coll., 2012
; Desmeules et coll., 2012 ; Lee et coll., 2015
; Lee et coll., 2015 ; Estévez-López et coll., 2018
; Estévez-López et coll., 2018 ). Il ressort de ces travaux que la FM se caractérise par un système nerveux sympathique hyperactif à l’état basal, mais hyporéactif au stress. Ces données doivent, là encore, être interprétées avec prudence, car il existe un important recouvrement entre les résultats observés chez les patients atteints de FM et ceux obtenus dans la population contrôle. Toutefois, on ne peut exclure l’existence d’altérations plus marquées dans un ou plusieurs sous-groupes de patients, qui pourraient ainsi être identifiés et définis sur des critères biologiques objectifs (Martinez-Lavin, 2007
). Il ressort de ces travaux que la FM se caractérise par un système nerveux sympathique hyperactif à l’état basal, mais hyporéactif au stress. Ces données doivent, là encore, être interprétées avec prudence, car il existe un important recouvrement entre les résultats observés chez les patients atteints de FM et ceux obtenus dans la population contrôle. Toutefois, on ne peut exclure l’existence d’altérations plus marquées dans un ou plusieurs sous-groupes de patients, qui pourraient ainsi être identifiés et définis sur des critères biologiques objectifs (Martinez-Lavin, 2007 ; Tak et Rosmalen, 2010
; Tak et Rosmalen, 2010 ; Martínez-Martínez et coll., 2014
; Martínez-Martínez et coll., 2014 ).
).Si les résultats résumés ci-dessus tendent, de façon générale, à confirmer l’existence d’un lien entre anomalies de la réponse au stress et FM, leur interprétation reste difficile. En effet, il s’agit, pour l’essentiel, de données issues d’études transversales faites à un moment T sur une population de patients sélectionnés le plus souvent dans des centres très spécialisés, pas forcément représentatifs de l’ensemble des patients atteints de FM. Ces données ne permettent donc pas de conclure quant à l’existence d’une relation de cause à effet entre les anomalies observées et les symptômes de la pathologie, en particulier la douleur. Les relations entre stress et douleur étant bidirectionnelles, on ne peut pas exclure que les perturbations de l’axe du stress observées dans ces études soient en réalité davantage une conséquence qu’une cause de la douleur. Seules des études prospectives longitudinales permettraient d’apporter des éléments de réponse à cette question cruciale du rôle causal des mécanismes identifiés dans la symptomatologie. De façon intéressante, une étude prospective de ce type, réalisée en Grande-Bretagne sur un échantillon composé de 267 personnes représentatif de la population générale (de 25 à 65 ans, 67 % de femmes) tend à confirmer que des anomalies de l’axe HHS non seulement précèdent, mais seraient prédictives du développement de douleurs chroniques diffuses, indépendamment notamment des facteurs psychologiques (McBeth et coll., 2007 ). Ces derniers résultats, qui devront être vérifiés par d’autres études, ne concernent certes pas directement la FM mais confortent l’implication de dysfonctions de l’axe du stress dans le déterminisme de douleurs chroniques observées dans cette dernière.
). Ces derniers résultats, qui devront être vérifiés par d’autres études, ne concernent certes pas directement la FM mais confortent l’implication de dysfonctions de l’axe du stress dans le déterminisme de douleurs chroniques observées dans cette dernière.
 ). Ces derniers résultats, qui devront être vérifiés par d’autres études, ne concernent certes pas directement la FM mais confortent l’implication de dysfonctions de l’axe du stress dans le déterminisme de douleurs chroniques observées dans cette dernière.
). Ces derniers résultats, qui devront être vérifiés par d’autres études, ne concernent certes pas directement la FM mais confortent l’implication de dysfonctions de l’axe du stress dans le déterminisme de douleurs chroniques observées dans cette dernière.Les mécanismes périphériques
Une série de travaux récents ont conduit à remettre en cause les hypothèses physiopathologiques reposant uniquement sur des mécanismes centraux. Des modifications périphériques intéressant les muscles squelettiques et surtout les nerfs ont été identifiées et pourraient, au moins chez certains patients, jouer un rôle physiopathologique important. Néanmoins, la plupart de ces données sont encore fragiles et le lien de causalité entre ces anomalies et la symptomatologie reste débattu.
Anomalies musculaires
La recherche d’altérations de la fonction ou de la structure des muscles susceptibles de rendre compte des symptômes cardinaux de la FM que sont les douleurs musculaires, la raideur matinale ou encore la fatigue, a initialement été le plus souvent négative (Geel, 1994 ; Simms, 1998
; Simms, 1998 ). Certaines études réalisées dans les années 1980-1990 avaient suggéré diverses altérations structurelles concernant les fibres nerveuses, les mitochondries ou encore les processus oxydatifs (Yunus et coll., 1986
). Certaines études réalisées dans les années 1980-1990 avaient suggéré diverses altérations structurelles concernant les fibres nerveuses, les mitochondries ou encore les processus oxydatifs (Yunus et coll., 1986 ; Drewes et coll., 1993
; Drewes et coll., 1993 ; Bennett et Jacobsen, 1994
; Bennett et Jacobsen, 1994 ; Wortmann, 1994
; Wortmann, 1994 ; Vestergaard-Poulsen et coll., 1995
; Vestergaard-Poulsen et coll., 1995 ; Olsen et Park, 1998
; Olsen et Park, 1998 ; Park et coll., 1998
; Park et coll., 1998 ), mais ces résultats, qui reposaient sur de petites populations de patients, n’ont pas été confirmés par la suite.
), mais ces résultats, qui reposaient sur de petites populations de patients, n’ont pas été confirmés par la suite.
 ; Simms, 1998
; Simms, 1998 ). Certaines études réalisées dans les années 1980-1990 avaient suggéré diverses altérations structurelles concernant les fibres nerveuses, les mitochondries ou encore les processus oxydatifs (Yunus et coll., 1986
). Certaines études réalisées dans les années 1980-1990 avaient suggéré diverses altérations structurelles concernant les fibres nerveuses, les mitochondries ou encore les processus oxydatifs (Yunus et coll., 1986 ; Drewes et coll., 1993
; Drewes et coll., 1993 ; Bennett et Jacobsen, 1994
; Bennett et Jacobsen, 1994 ; Wortmann, 1994
; Wortmann, 1994 ; Vestergaard-Poulsen et coll., 1995
; Vestergaard-Poulsen et coll., 1995 ; Olsen et Park, 1998
; Olsen et Park, 1998 ; Park et coll., 1998
; Park et coll., 1998 ), mais ces résultats, qui reposaient sur de petites populations de patients, n’ont pas été confirmés par la suite.
), mais ces résultats, qui reposaient sur de petites populations de patients, n’ont pas été confirmés par la suite.Le rôle potentiel des anomalies musculaires a été analysé dans plusieurs études récentes s’appuyant sur des techniques plus modernes. Ces travaux tendent à confirmer l’existence d’anomalies biochimiques musculaires comme une augmentation des concentrations locales en pyruvate, lactate ou glutamate ou encore des modifications de la microcirculation, consistant notamment en une diminution de la densité des capillaires pouvant engendrer un défaut d’oxygénation musculaire (Shang et coll., 2012 ; Srikuea et coll., 2013
; Srikuea et coll., 2013 ; Gerdle et coll., 2016
; Gerdle et coll., 2016 ). Ces altérations pourraient être à l’origine de phénomènes ischémiques impliqués dans la douleur musculaire ou la fatigue associées à la FM. Cependant, comme nous l’avons vu pour d’autres mécanismes physiopathologiques, le rôle causal des anomalies musculaires dans le déclenchement de la symptomatologie est remis en question, car on ne peut exclure que les anomalies observées soient en réalité secondaires au déconditionnement à l’effort associé à la FM (Schmidt-Wilcke et Clauw, 2011
). Ces altérations pourraient être à l’origine de phénomènes ischémiques impliqués dans la douleur musculaire ou la fatigue associées à la FM. Cependant, comme nous l’avons vu pour d’autres mécanismes physiopathologiques, le rôle causal des anomalies musculaires dans le déclenchement de la symptomatologie est remis en question, car on ne peut exclure que les anomalies observées soient en réalité secondaires au déconditionnement à l’effort associé à la FM (Schmidt-Wilcke et Clauw, 2011 ). S’il paraît légitime de discuter le rôle causal de ces mécanismes musculaires, on ne peut exclure qu’ils contribuent au maintien, voire à l’amplification de la douleur une fois celle-ci installée par des mécanismes initiateurs autres, tels que ceux qui interviennent au niveau central cités précédemment.
). S’il paraît légitime de discuter le rôle causal de ces mécanismes musculaires, on ne peut exclure qu’ils contribuent au maintien, voire à l’amplification de la douleur une fois celle-ci installée par des mécanismes initiateurs autres, tels que ceux qui interviennent au niveau central cités précédemment.
 ; Srikuea et coll., 2013
; Srikuea et coll., 2013 ; Gerdle et coll., 2016
; Gerdle et coll., 2016 ). Ces altérations pourraient être à l’origine de phénomènes ischémiques impliqués dans la douleur musculaire ou la fatigue associées à la FM. Cependant, comme nous l’avons vu pour d’autres mécanismes physiopathologiques, le rôle causal des anomalies musculaires dans le déclenchement de la symptomatologie est remis en question, car on ne peut exclure que les anomalies observées soient en réalité secondaires au déconditionnement à l’effort associé à la FM (Schmidt-Wilcke et Clauw, 2011
). Ces altérations pourraient être à l’origine de phénomènes ischémiques impliqués dans la douleur musculaire ou la fatigue associées à la FM. Cependant, comme nous l’avons vu pour d’autres mécanismes physiopathologiques, le rôle causal des anomalies musculaires dans le déclenchement de la symptomatologie est remis en question, car on ne peut exclure que les anomalies observées soient en réalité secondaires au déconditionnement à l’effort associé à la FM (Schmidt-Wilcke et Clauw, 2011 ). S’il paraît légitime de discuter le rôle causal de ces mécanismes musculaires, on ne peut exclure qu’ils contribuent au maintien, voire à l’amplification de la douleur une fois celle-ci installée par des mécanismes initiateurs autres, tels que ceux qui interviennent au niveau central cités précédemment.
). S’il paraît légitime de discuter le rôle causal de ces mécanismes musculaires, on ne peut exclure qu’ils contribuent au maintien, voire à l’amplification de la douleur une fois celle-ci installée par des mécanismes initiateurs autres, tels que ceux qui interviennent au niveau central cités précédemment.Anomalies des fibres nerveuses périphériques
Une série de travaux publiés depuis 2013 ont mis en évidence des anomalies des fibres nerveuses de petit diamètre chez 30 % à 50 % des patients atteints de FM étudiés (Oaklander et coll., 2013 ; Uceyler et coll., 2013
; Uceyler et coll., 2013 ; Caro et Winter, 2014
; Caro et Winter, 2014 ; Caro et Winter, 2015
; Caro et Winter, 2015 ; Kosmidis et coll., 2014
; Kosmidis et coll., 2014 ; Lodhal et coll., 2017
; Lodhal et coll., 2017 ; Lawson et coll., 2018
; Lawson et coll., 2018 ). Ces travaux, qui ont surtout utilisé des biopsies cutanées réalisées au niveau des membres inférieurs (Sommer et Lauria, 2007
). Ces travaux, qui ont surtout utilisé des biopsies cutanées réalisées au niveau des membres inférieurs (Sommer et Lauria, 2007 ), ont montré une diminution significative de la densité intra-épidermique en fibres nerveuses de petit diamètre (fibres Aδ et C qui comprennent les nocicepteurs) chez les patients étudiés comparés à une population contrôle de volontaires sains. On peut rappeler que la fonction des fibres nerveuses de petit calibre ne peut pas être étudiée au moyen de l’électromyographie conventionnelle, qui ne permet d’analyser que la fonction des fibres de gros diamètre. Des résultats concordants ont été retrouvés dans d’autres études utilisant la microscopie confocale cornéenne, une technique non invasive de mesure de la densité en petites fibres nerveuses (Ramirez et coll., 2015
), ont montré une diminution significative de la densité intra-épidermique en fibres nerveuses de petit diamètre (fibres Aδ et C qui comprennent les nocicepteurs) chez les patients étudiés comparés à une population contrôle de volontaires sains. On peut rappeler que la fonction des fibres nerveuses de petit calibre ne peut pas être étudiée au moyen de l’électromyographie conventionnelle, qui ne permet d’analyser que la fonction des fibres de gros diamètre. Des résultats concordants ont été retrouvés dans d’autres études utilisant la microscopie confocale cornéenne, une technique non invasive de mesure de la densité en petites fibres nerveuses (Ramirez et coll., 2015 ; Garcia-Martin et coll., 2016
; Garcia-Martin et coll., 2016 ; Oudejans et coll., 2016
; Oudejans et coll., 2016 ). Ces anomalies sont similaires à celles observées chez les patients présentant une neuropathie des petites fibres, dont une des principales étiologies est le diabète, mais qui dans bien des cas sont considérées comme idiopathiques4
(Terkelsen et coll., 2017
). Ces anomalies sont similaires à celles observées chez les patients présentant une neuropathie des petites fibres, dont une des principales étiologies est le diabète, mais qui dans bien des cas sont considérées comme idiopathiques4
(Terkelsen et coll., 2017 ). On peut souligner que les altérations des petites fibres nerveuses ne sont pas spécifiques de la FM car elles ont également été observées dans d’autres syndromes douloureux chroniques ou dans d’autres maladies neurologiques non douloureuses (Sommer et Lauria, 2007
). On peut souligner que les altérations des petites fibres nerveuses ne sont pas spécifiques de la FM car elles ont également été observées dans d’autres syndromes douloureux chroniques ou dans d’autres maladies neurologiques non douloureuses (Sommer et Lauria, 2007 ; Terkelsen et coll., 2017
; Terkelsen et coll., 2017 ).
).
 ; Uceyler et coll., 2013
; Uceyler et coll., 2013 ; Caro et Winter, 2014
; Caro et Winter, 2014 ; Caro et Winter, 2015
; Caro et Winter, 2015 ; Kosmidis et coll., 2014
; Kosmidis et coll., 2014 ; Lodhal et coll., 2017
; Lodhal et coll., 2017 ; Lawson et coll., 2018
; Lawson et coll., 2018 ). Ces travaux, qui ont surtout utilisé des biopsies cutanées réalisées au niveau des membres inférieurs (Sommer et Lauria, 2007
). Ces travaux, qui ont surtout utilisé des biopsies cutanées réalisées au niveau des membres inférieurs (Sommer et Lauria, 2007 ), ont montré une diminution significative de la densité intra-épidermique en fibres nerveuses de petit diamètre (fibres Aδ et C qui comprennent les nocicepteurs) chez les patients étudiés comparés à une population contrôle de volontaires sains. On peut rappeler que la fonction des fibres nerveuses de petit calibre ne peut pas être étudiée au moyen de l’électromyographie conventionnelle, qui ne permet d’analyser que la fonction des fibres de gros diamètre. Des résultats concordants ont été retrouvés dans d’autres études utilisant la microscopie confocale cornéenne, une technique non invasive de mesure de la densité en petites fibres nerveuses (Ramirez et coll., 2015
), ont montré une diminution significative de la densité intra-épidermique en fibres nerveuses de petit diamètre (fibres Aδ et C qui comprennent les nocicepteurs) chez les patients étudiés comparés à une population contrôle de volontaires sains. On peut rappeler que la fonction des fibres nerveuses de petit calibre ne peut pas être étudiée au moyen de l’électromyographie conventionnelle, qui ne permet d’analyser que la fonction des fibres de gros diamètre. Des résultats concordants ont été retrouvés dans d’autres études utilisant la microscopie confocale cornéenne, une technique non invasive de mesure de la densité en petites fibres nerveuses (Ramirez et coll., 2015 ; Garcia-Martin et coll., 2016
; Garcia-Martin et coll., 2016 ; Oudejans et coll., 2016
; Oudejans et coll., 2016 ). Ces anomalies sont similaires à celles observées chez les patients présentant une neuropathie des petites fibres, dont une des principales étiologies est le diabète, mais qui dans bien des cas sont considérées comme idiopathiques4
(Terkelsen et coll., 2017
). Ces anomalies sont similaires à celles observées chez les patients présentant une neuropathie des petites fibres, dont une des principales étiologies est le diabète, mais qui dans bien des cas sont considérées comme idiopathiques4
(Terkelsen et coll., 2017 ). On peut souligner que les altérations des petites fibres nerveuses ne sont pas spécifiques de la FM car elles ont également été observées dans d’autres syndromes douloureux chroniques ou dans d’autres maladies neurologiques non douloureuses (Sommer et Lauria, 2007
). On peut souligner que les altérations des petites fibres nerveuses ne sont pas spécifiques de la FM car elles ont également été observées dans d’autres syndromes douloureux chroniques ou dans d’autres maladies neurologiques non douloureuses (Sommer et Lauria, 2007 ; Terkelsen et coll., 2017
; Terkelsen et coll., 2017 ).
).L’interprétation physiopathologique de ces données fait encore l’objet de discussions et débats (Clauw, 2015 ; Oaklander, 2016
; Oaklander, 2016 ). Doit-on considérer comme certains auteurs (Oaklander et coll., 2013
). Doit-on considérer comme certains auteurs (Oaklander et coll., 2013 ; Caro et Winter, 2014
; Caro et Winter, 2014 ) que nombre de patients diagnostiqués comme atteints de FM présentent en réalité une forme particulière de neuropathie périphérique des petites fibres ? Dans cette hypothèse, les douleurs répondraient à des mécanismes similaires à ceux des autres douleurs neuropathiques. Le fait que la description clinique des douleurs de la FM ressemble à celles des douleurs neuropathiques classiques, avec l’utilisation fréquente de termes comme brûlures, décharges électriques, picotements, etc. milite en faveur de cette hypothèse (Simms et Goldberg, 1988
) que nombre de patients diagnostiqués comme atteints de FM présentent en réalité une forme particulière de neuropathie périphérique des petites fibres ? Dans cette hypothèse, les douleurs répondraient à des mécanismes similaires à ceux des autres douleurs neuropathiques. Le fait que la description clinique des douleurs de la FM ressemble à celles des douleurs neuropathiques classiques, avec l’utilisation fréquente de termes comme brûlures, décharges électriques, picotements, etc. milite en faveur de cette hypothèse (Simms et Goldberg, 1988 ; Koroschetz et coll., 2011
; Koroschetz et coll., 2011 ; Üçeyler et coll., 2013
; Üçeyler et coll., 2013 ). Les données d’une étude reposant sur des enregistrements électrophysiologiques de fibres nerveuses chez 30 femmes atteintes de FM comparées à 17 femmes atteintes de neuropathies à petites fibres et 9 femmes contrôles, au moyen des techniques de microneurographie, sont compatibles avec cette hypothèse (Serra et coll., 2014
). Les données d’une étude reposant sur des enregistrements électrophysiologiques de fibres nerveuses chez 30 femmes atteintes de FM comparées à 17 femmes atteintes de neuropathies à petites fibres et 9 femmes contrôles, au moyen des techniques de microneurographie, sont compatibles avec cette hypothèse (Serra et coll., 2014 ). Ce travail a mis en évidence, chez près de 80 % des femmes diagnostiquées FM âgées de 41 ± 10 ans étudiées (n = 30), une hyperexcitabilité des nocicepteurs dits « silencieux », consistant en l’apparition d’une activité spontanée (31 % des nocicepteurs) et des réponses accrues lors de stimulations nociceptives (24,2 % des nocicepteurs). Ces valeurs étaient similaires à celles observées chez des femmes présentant une forme classique de neuropathie des petites fibres (34 % et 22,7 %, respectivement, n = 17) et supérieures à celles observées dans le groupe contrôle (2,2 % et 3,7 % respectivement, 9 femmes).
). Ce travail a mis en évidence, chez près de 80 % des femmes diagnostiquées FM âgées de 41 ± 10 ans étudiées (n = 30), une hyperexcitabilité des nocicepteurs dits « silencieux », consistant en l’apparition d’une activité spontanée (31 % des nocicepteurs) et des réponses accrues lors de stimulations nociceptives (24,2 % des nocicepteurs). Ces valeurs étaient similaires à celles observées chez des femmes présentant une forme classique de neuropathie des petites fibres (34 % et 22,7 %, respectivement, n = 17) et supérieures à celles observées dans le groupe contrôle (2,2 % et 3,7 % respectivement, 9 femmes).
 ; Oaklander, 2016
; Oaklander, 2016 ). Doit-on considérer comme certains auteurs (Oaklander et coll., 2013
). Doit-on considérer comme certains auteurs (Oaklander et coll., 2013 ; Caro et Winter, 2014
; Caro et Winter, 2014 ) que nombre de patients diagnostiqués comme atteints de FM présentent en réalité une forme particulière de neuropathie périphérique des petites fibres ? Dans cette hypothèse, les douleurs répondraient à des mécanismes similaires à ceux des autres douleurs neuropathiques. Le fait que la description clinique des douleurs de la FM ressemble à celles des douleurs neuropathiques classiques, avec l’utilisation fréquente de termes comme brûlures, décharges électriques, picotements, etc. milite en faveur de cette hypothèse (Simms et Goldberg, 1988
) que nombre de patients diagnostiqués comme atteints de FM présentent en réalité une forme particulière de neuropathie périphérique des petites fibres ? Dans cette hypothèse, les douleurs répondraient à des mécanismes similaires à ceux des autres douleurs neuropathiques. Le fait que la description clinique des douleurs de la FM ressemble à celles des douleurs neuropathiques classiques, avec l’utilisation fréquente de termes comme brûlures, décharges électriques, picotements, etc. milite en faveur de cette hypothèse (Simms et Goldberg, 1988 ; Koroschetz et coll., 2011
; Koroschetz et coll., 2011 ; Üçeyler et coll., 2013
; Üçeyler et coll., 2013 ). Les données d’une étude reposant sur des enregistrements électrophysiologiques de fibres nerveuses chez 30 femmes atteintes de FM comparées à 17 femmes atteintes de neuropathies à petites fibres et 9 femmes contrôles, au moyen des techniques de microneurographie, sont compatibles avec cette hypothèse (Serra et coll., 2014
). Les données d’une étude reposant sur des enregistrements électrophysiologiques de fibres nerveuses chez 30 femmes atteintes de FM comparées à 17 femmes atteintes de neuropathies à petites fibres et 9 femmes contrôles, au moyen des techniques de microneurographie, sont compatibles avec cette hypothèse (Serra et coll., 2014 ). Ce travail a mis en évidence, chez près de 80 % des femmes diagnostiquées FM âgées de 41 ± 10 ans étudiées (n = 30), une hyperexcitabilité des nocicepteurs dits « silencieux », consistant en l’apparition d’une activité spontanée (31 % des nocicepteurs) et des réponses accrues lors de stimulations nociceptives (24,2 % des nocicepteurs). Ces valeurs étaient similaires à celles observées chez des femmes présentant une forme classique de neuropathie des petites fibres (34 % et 22,7 %, respectivement, n = 17) et supérieures à celles observées dans le groupe contrôle (2,2 % et 3,7 % respectivement, 9 femmes).
). Ce travail a mis en évidence, chez près de 80 % des femmes diagnostiquées FM âgées de 41 ± 10 ans étudiées (n = 30), une hyperexcitabilité des nocicepteurs dits « silencieux », consistant en l’apparition d’une activité spontanée (31 % des nocicepteurs) et des réponses accrues lors de stimulations nociceptives (24,2 % des nocicepteurs). Ces valeurs étaient similaires à celles observées chez des femmes présentant une forme classique de neuropathie des petites fibres (34 % et 22,7 %, respectivement, n = 17) et supérieures à celles observées dans le groupe contrôle (2,2 % et 3,7 % respectivement, 9 femmes).Une des difficultés liées à cette interprétation « neuropathique » de la FM est que la symptomatologie des neuropathies des petites fibres classiques est en réalité assez différente de celle de la FM. En particulier, les douleurs associées aux neuropathies ne sont pas diffuses, mais localisées au niveau distal des membres, surtout inférieurs. Cette topographie des symptômes, dite « en chaussettes et en gants », est très caractéristique des polyneuropathies en général (Terkelsen et coll., 2017 ). Elle est liée au fait que l’atteinte nerveuse est le plus souvent longueur dépendante, c’est-à-dire que les fibres les plus longues sont les premières touchées par les processus pathologiques. Ces considérations cliniques ont amené à comparer de façon plus fine les modifications structurelles des fibres nerveuses de petit diamètre dans le cas de la FM par rapport à celles observées dans des neuropathies des petites fibres de cause plus classique comme le diabète. L’analyse comparative de l’ultrastructure de ces fibres par microscopie électronique, réalisée chez 32 patients atteints de FM (28 femmes, 4 hommes) et 15 patients (12 femmes, 3 hommes) présentant une neuropathie des petites fibres, a montré que dans le cas de la FM, au-delà de la réduction du nombre de fibres, il existait d’autres altérations histologiques consistant en une réduction significative du diamètre des fibres restantes et en des modifications des cellules de Schwann, les cellules myélinisantes du système nerveux périphérique (Doppler et coll., 2015
). Elle est liée au fait que l’atteinte nerveuse est le plus souvent longueur dépendante, c’est-à-dire que les fibres les plus longues sont les premières touchées par les processus pathologiques. Ces considérations cliniques ont amené à comparer de façon plus fine les modifications structurelles des fibres nerveuses de petit diamètre dans le cas de la FM par rapport à celles observées dans des neuropathies des petites fibres de cause plus classique comme le diabète. L’analyse comparative de l’ultrastructure de ces fibres par microscopie électronique, réalisée chez 32 patients atteints de FM (28 femmes, 4 hommes) et 15 patients (12 femmes, 3 hommes) présentant une neuropathie des petites fibres, a montré que dans le cas de la FM, au-delà de la réduction du nombre de fibres, il existait d’autres altérations histologiques consistant en une réduction significative du diamètre des fibres restantes et en des modifications des cellules de Schwann, les cellules myélinisantes du système nerveux périphérique (Doppler et coll., 2015 ). Les auteurs suggèrent que ces différences subtiles pourraient être le reflet de mécanismes physiopathologiques distincts susceptibles d’expliquer les différences dans l’expression clinique des douleurs associées entre les deux pathologies. Bien que séduisante, cette hypothèse, qui confèrerait à la FM des mécanismes physiopathologiques spécifiques proches de ceux des douleurs associées aux neuropathies à petites fibres, nécessite d’être confirmée dans des études de plus grande ampleur.
). Les auteurs suggèrent que ces différences subtiles pourraient être le reflet de mécanismes physiopathologiques distincts susceptibles d’expliquer les différences dans l’expression clinique des douleurs associées entre les deux pathologies. Bien que séduisante, cette hypothèse, qui confèrerait à la FM des mécanismes physiopathologiques spécifiques proches de ceux des douleurs associées aux neuropathies à petites fibres, nécessite d’être confirmée dans des études de plus grande ampleur.
 ). Elle est liée au fait que l’atteinte nerveuse est le plus souvent longueur dépendante, c’est-à-dire que les fibres les plus longues sont les premières touchées par les processus pathologiques. Ces considérations cliniques ont amené à comparer de façon plus fine les modifications structurelles des fibres nerveuses de petit diamètre dans le cas de la FM par rapport à celles observées dans des neuropathies des petites fibres de cause plus classique comme le diabète. L’analyse comparative de l’ultrastructure de ces fibres par microscopie électronique, réalisée chez 32 patients atteints de FM (28 femmes, 4 hommes) et 15 patients (12 femmes, 3 hommes) présentant une neuropathie des petites fibres, a montré que dans le cas de la FM, au-delà de la réduction du nombre de fibres, il existait d’autres altérations histologiques consistant en une réduction significative du diamètre des fibres restantes et en des modifications des cellules de Schwann, les cellules myélinisantes du système nerveux périphérique (Doppler et coll., 2015
). Elle est liée au fait que l’atteinte nerveuse est le plus souvent longueur dépendante, c’est-à-dire que les fibres les plus longues sont les premières touchées par les processus pathologiques. Ces considérations cliniques ont amené à comparer de façon plus fine les modifications structurelles des fibres nerveuses de petit diamètre dans le cas de la FM par rapport à celles observées dans des neuropathies des petites fibres de cause plus classique comme le diabète. L’analyse comparative de l’ultrastructure de ces fibres par microscopie électronique, réalisée chez 32 patients atteints de FM (28 femmes, 4 hommes) et 15 patients (12 femmes, 3 hommes) présentant une neuropathie des petites fibres, a montré que dans le cas de la FM, au-delà de la réduction du nombre de fibres, il existait d’autres altérations histologiques consistant en une réduction significative du diamètre des fibres restantes et en des modifications des cellules de Schwann, les cellules myélinisantes du système nerveux périphérique (Doppler et coll., 2015 ). Les auteurs suggèrent que ces différences subtiles pourraient être le reflet de mécanismes physiopathologiques distincts susceptibles d’expliquer les différences dans l’expression clinique des douleurs associées entre les deux pathologies. Bien que séduisante, cette hypothèse, qui confèrerait à la FM des mécanismes physiopathologiques spécifiques proches de ceux des douleurs associées aux neuropathies à petites fibres, nécessite d’être confirmée dans des études de plus grande ampleur.
). Les auteurs suggèrent que ces différences subtiles pourraient être le reflet de mécanismes physiopathologiques distincts susceptibles d’expliquer les différences dans l’expression clinique des douleurs associées entre les deux pathologies. Bien que séduisante, cette hypothèse, qui confèrerait à la FM des mécanismes physiopathologiques spécifiques proches de ceux des douleurs associées aux neuropathies à petites fibres, nécessite d’être confirmée dans des études de plus grande ampleur.Plusieurs éléments tendent à mettre en doute ou à minimiser le rôle physiopathologique de modifications des fibres nerveuses périphériques dans la FM. Il s’agit en particulier du fait que la plupart des études mentionnées ci-dessus n’ont pas mis en évidence de corrélation entre la symptomatologie douloureuse (intensité ou qualité de la douleur) et l’atteinte des petites fibres (Üçeyler et coll., 2013 ; Kosmidis et coll., 2014
; Kosmidis et coll., 2014 ; Clauw, 2015
; Clauw, 2015 ; Lawson et coll., 2018
; Lawson et coll., 2018 ). Les résultats des études psychophysiques et électrophysiologiques que nous avons résumés plus haut (« Mécanismes centraux potentiellement à l’origine du syndrome fibromyalgique ») sont eux aussi difficiles à interpréter dans le cadre d’une hypothèse neuropathique. En effet, ils montrent en général une diminution des seuils de douleur et une augmentation de l’amplitude des potentiels évoqués par stimulation laser chez une large majorité des patients. Or, les neuropathies périphériques se caractérisent par des résultats inverses, à savoir une augmentation des seuils nociceptifs et une diminution de l’amplitude des potentiels évoqués, reflétant le déficit en fibres nerveuses (Terkelsen et coll., 2017
). Les résultats des études psychophysiques et électrophysiologiques que nous avons résumés plus haut (« Mécanismes centraux potentiellement à l’origine du syndrome fibromyalgique ») sont eux aussi difficiles à interpréter dans le cadre d’une hypothèse neuropathique. En effet, ils montrent en général une diminution des seuils de douleur et une augmentation de l’amplitude des potentiels évoqués par stimulation laser chez une large majorité des patients. Or, les neuropathies périphériques se caractérisent par des résultats inverses, à savoir une augmentation des seuils nociceptifs et une diminution de l’amplitude des potentiels évoqués, reflétant le déficit en fibres nerveuses (Terkelsen et coll., 2017 ).
).
 ; Kosmidis et coll., 2014
; Kosmidis et coll., 2014 ; Clauw, 2015
; Clauw, 2015 ; Lawson et coll., 2018
; Lawson et coll., 2018 ). Les résultats des études psychophysiques et électrophysiologiques que nous avons résumés plus haut (« Mécanismes centraux potentiellement à l’origine du syndrome fibromyalgique ») sont eux aussi difficiles à interpréter dans le cadre d’une hypothèse neuropathique. En effet, ils montrent en général une diminution des seuils de douleur et une augmentation de l’amplitude des potentiels évoqués par stimulation laser chez une large majorité des patients. Or, les neuropathies périphériques se caractérisent par des résultats inverses, à savoir une augmentation des seuils nociceptifs et une diminution de l’amplitude des potentiels évoqués, reflétant le déficit en fibres nerveuses (Terkelsen et coll., 2017
). Les résultats des études psychophysiques et électrophysiologiques que nous avons résumés plus haut (« Mécanismes centraux potentiellement à l’origine du syndrome fibromyalgique ») sont eux aussi difficiles à interpréter dans le cadre d’une hypothèse neuropathique. En effet, ils montrent en général une diminution des seuils de douleur et une augmentation de l’amplitude des potentiels évoqués par stimulation laser chez une large majorité des patients. Or, les neuropathies périphériques se caractérisent par des résultats inverses, à savoir une augmentation des seuils nociceptifs et une diminution de l’amplitude des potentiels évoqués, reflétant le déficit en fibres nerveuses (Terkelsen et coll., 2017 ).
).Bien qu’il ne soit pas possible aujourd’hui de conclure quant au rôle physiopathologique de ces anomalies du système nerveux périphérique dans le déterminisme de la symptomatologie de la FM, force est de constater que ces travaux ont eu un fort impact conceptuel. De fait, ils remettent en cause sur la base de données objectives, la prédominance des hypothèses physiopathologiques purement centrales qui ont largement prévalu au cours des quinze à vingt dernières années. Comme nous l’avons déjà mentionné pour d’autres mécanismes physiopathologiques, il semble absolument capital aujourd’hui de réaliser des études prospectives de grande ampleur pour explorer un éventuel lien causal entre ces altérations périphériques et la symptomatologie fibromyalgique. Même si elles étaient avérées, il est vraisemblable que ces anomalies du système nerveux périphérique ne concerneront qu’un sous-groupe de patients, ce qui, encore une fois, conforte l’idée qu’un démembrement de la FM en plusieurs groupes est nécessaire.
Les processus inflammatoires
Une des conséquences des travaux concernant l’intervention de mécanismes neuropathiques résumés ci-dessus a été de remettre au goût du jour le rôle potentiel des processus inflammatoires dans la FM. En effet, un des mécanismes susceptibles d’expliquer ce type d’atteinte neurologique et permettant également de rendre compte de l’hyperexcitabilité des fibres nerveuses est l’intervention de mécanismes immunologiques et inflammatoires médiés notamment par les cytokines (Menzies et Lyon, 2010 ; Rodriguez-Pintó et coll., 2014
; Rodriguez-Pintó et coll., 2014 ; Ernberg et coll., 2018
; Ernberg et coll., 2018 ). De nombreuses études ont analysé les modifications des cytokines pro-inflammatoires (IL1, IL2, IL6, TNFα) ou anti-inflammatoires (IL-4, IL-10 ; Rodriguez Pinto et coll., 2014
). De nombreuses études ont analysé les modifications des cytokines pro-inflammatoires (IL1, IL2, IL6, TNFα) ou anti-inflammatoires (IL-4, IL-10 ; Rodriguez Pinto et coll., 2014 ) dans le sang ou la peau de patients atteints de FM. L’hypothèse de travail principale de ces études était qu’une augmentation de certaines cytokines inflammatoires et/ou une diminution des cytokines anti-inflammatoires pourraient être impliquées notamment dans les mécanismes de la douleur. Cependant, il ressort d’une méta-analyse récente portant sur 25 études, que la qualité méthodologique des travaux dans ce domaine est globalement faible et que les résultats sont trop peu concordants pour permettre des conclusions solides (Üceyler et coll., 2011
) dans le sang ou la peau de patients atteints de FM. L’hypothèse de travail principale de ces études était qu’une augmentation de certaines cytokines inflammatoires et/ou une diminution des cytokines anti-inflammatoires pourraient être impliquées notamment dans les mécanismes de la douleur. Cependant, il ressort d’une méta-analyse récente portant sur 25 études, que la qualité méthodologique des travaux dans ce domaine est globalement faible et que les résultats sont trop peu concordants pour permettre des conclusions solides (Üceyler et coll., 2011 ). Des résultats contradictoires ont également été retrouvés dans des études plus récentes (Xiao et coll., 2013
). Des résultats contradictoires ont également été retrouvés dans des études plus récentes (Xiao et coll., 2013 ; Üceyler et coll., 2014
; Üceyler et coll., 2014 ; Mendieta et coll., 2016
; Mendieta et coll., 2016 ; Ranzolin et coll., 2016
; Ranzolin et coll., 2016 ). En particulier, si une étude assez ancienne avait montré une augmentation de la concentration cutanée en cytokines pro-inflammatoire (IL-1β), IL6 et TNFα chez 53 patients (Salemi et coll., 2003
). En particulier, si une étude assez ancienne avait montré une augmentation de la concentration cutanée en cytokines pro-inflammatoire (IL-1β), IL6 et TNFα chez 53 patients (Salemi et coll., 2003 ), cela n’a pas été reproduit dans une étude plus récente de 25 patients (Üceyler et coll., 2014
), cela n’a pas été reproduit dans une étude plus récente de 25 patients (Üceyler et coll., 2014 ). L’intervention des cytokines dans le développement d’une sensibilisation des nocicepteurs dans la FM ne semble donc pas vérifiée. Les cytokines et, de façon plus générale, des mécanismes inflammatoires ou immunitaires pourraient toutefois intervenir à d’autres niveaux, notamment au niveau central par la mise en jeu de processus neuro-inflammatoires favorisant le développement de la sensibilisation centrale (Gur et Oktayoglu, 2008
). L’intervention des cytokines dans le développement d’une sensibilisation des nocicepteurs dans la FM ne semble donc pas vérifiée. Les cytokines et, de façon plus générale, des mécanismes inflammatoires ou immunitaires pourraient toutefois intervenir à d’autres niveaux, notamment au niveau central par la mise en jeu de processus neuro-inflammatoires favorisant le développement de la sensibilisation centrale (Gur et Oktayoglu, 2008 ; Staud, 2015
; Staud, 2015 ; Kosek et coll., 2015
; Kosek et coll., 2015 ; Littlejohn et Guymer, 2018
; Littlejohn et Guymer, 2018 ).
).
 ; Rodriguez-Pintó et coll., 2014
; Rodriguez-Pintó et coll., 2014 ; Ernberg et coll., 2018
; Ernberg et coll., 2018 ). De nombreuses études ont analysé les modifications des cytokines pro-inflammatoires (IL1, IL2, IL6, TNFα) ou anti-inflammatoires (IL-4, IL-10 ; Rodriguez Pinto et coll., 2014
). De nombreuses études ont analysé les modifications des cytokines pro-inflammatoires (IL1, IL2, IL6, TNFα) ou anti-inflammatoires (IL-4, IL-10 ; Rodriguez Pinto et coll., 2014 ) dans le sang ou la peau de patients atteints de FM. L’hypothèse de travail principale de ces études était qu’une augmentation de certaines cytokines inflammatoires et/ou une diminution des cytokines anti-inflammatoires pourraient être impliquées notamment dans les mécanismes de la douleur. Cependant, il ressort d’une méta-analyse récente portant sur 25 études, que la qualité méthodologique des travaux dans ce domaine est globalement faible et que les résultats sont trop peu concordants pour permettre des conclusions solides (Üceyler et coll., 2011
) dans le sang ou la peau de patients atteints de FM. L’hypothèse de travail principale de ces études était qu’une augmentation de certaines cytokines inflammatoires et/ou une diminution des cytokines anti-inflammatoires pourraient être impliquées notamment dans les mécanismes de la douleur. Cependant, il ressort d’une méta-analyse récente portant sur 25 études, que la qualité méthodologique des travaux dans ce domaine est globalement faible et que les résultats sont trop peu concordants pour permettre des conclusions solides (Üceyler et coll., 2011 ). Des résultats contradictoires ont également été retrouvés dans des études plus récentes (Xiao et coll., 2013
). Des résultats contradictoires ont également été retrouvés dans des études plus récentes (Xiao et coll., 2013 ; Üceyler et coll., 2014
; Üceyler et coll., 2014 ; Mendieta et coll., 2016
; Mendieta et coll., 2016 ; Ranzolin et coll., 2016
; Ranzolin et coll., 2016 ). En particulier, si une étude assez ancienne avait montré une augmentation de la concentration cutanée en cytokines pro-inflammatoire (IL-1β), IL6 et TNFα chez 53 patients (Salemi et coll., 2003
). En particulier, si une étude assez ancienne avait montré une augmentation de la concentration cutanée en cytokines pro-inflammatoire (IL-1β), IL6 et TNFα chez 53 patients (Salemi et coll., 2003 ), cela n’a pas été reproduit dans une étude plus récente de 25 patients (Üceyler et coll., 2014
), cela n’a pas été reproduit dans une étude plus récente de 25 patients (Üceyler et coll., 2014 ). L’intervention des cytokines dans le développement d’une sensibilisation des nocicepteurs dans la FM ne semble donc pas vérifiée. Les cytokines et, de façon plus générale, des mécanismes inflammatoires ou immunitaires pourraient toutefois intervenir à d’autres niveaux, notamment au niveau central par la mise en jeu de processus neuro-inflammatoires favorisant le développement de la sensibilisation centrale (Gur et Oktayoglu, 2008
). L’intervention des cytokines dans le développement d’une sensibilisation des nocicepteurs dans la FM ne semble donc pas vérifiée. Les cytokines et, de façon plus générale, des mécanismes inflammatoires ou immunitaires pourraient toutefois intervenir à d’autres niveaux, notamment au niveau central par la mise en jeu de processus neuro-inflammatoires favorisant le développement de la sensibilisation centrale (Gur et Oktayoglu, 2008 ; Staud, 2015
; Staud, 2015 ; Kosek et coll., 2015
; Kosek et coll., 2015 ; Littlejohn et Guymer, 2018
; Littlejohn et Guymer, 2018 ).
).Biomarqueurs issus des travaux de recherche fondamentaux
Les données et hypothèses issues des études physiopathologiques résumées ci-dessus ont logiquement conduit à des tentatives d’identification de biomarqueurs de la FM pour en faciliter le diagnostic. Nous avons déjà mentionné dans les paragraphes précédents que les multiples anomalies objectivées au niveau de l’axe HHS, du système sympathique, des muscles squelettiques, des nerfs périphériques ou encore des processus inflammatoires, ne sont en rien spécifiques de la FM. Par conséquent, aucun test ou mesure s’appuyant sur ces données ne peut être envisagé dans un but diagnostique. Il en est bien sûr de même des altérations fonctionnelles concernant les seuils de douleurs, les mécanismes de modulation de type CIDN ou encore des modifications fonctionnelles révélées par l’électroencéphalogramme (EEG) ou les potentiels évoqués laser. Parmi les autres pistes explorées au cours des dernières années, nous distinguerons ici principalement les marqueurs génétiques, qui ont fait l’objet de très nombreux travaux, et mentionnerons brièvement les autres biomarqueurs potentiels qui s’appuient sur des méthodes en plein développement comme la protéomique.
Marqueurs génétiques
Des observations cliniques ont suggéré de longue date l’existence d’une prédisposition familiale pour la FM (voir également le chapitre « Épidémiologie du syndrome fibromyalgique »). Arnold et coll. ont ainsi estimé que pour un parent au premier degré d’un patient atteint soit de FM soit de polyarthrite rhumatoïde (PR), le risque de développer la même pathologie était 8 fois plus important pour la FM que pour la PR (IC 95 % 2,8-26, P = 0,0002) en étudiant une population américaine de 78 patients atteints de FM (Arnold et coll., 2004 ). Cependant, cette étude ne faisait pas la part des facteurs environnementaux qui pouvaient, en plus des facteurs génétiques, être à l’origine des résultats. Des études menées en Suède sur le registre national de jumeaux (31 318 jumeaux âgés de 41 à 64 ans dont 3 220 jumeaux monozygotes) ont quant à elles révélé une influence génétique modeste sur la sensibilité à la douleur et le développement de douleurs chroniques diffuses (Kato et coll., 2006a
). Cependant, cette étude ne faisait pas la part des facteurs environnementaux qui pouvaient, en plus des facteurs génétiques, être à l’origine des résultats. Des études menées en Suède sur le registre national de jumeaux (31 318 jumeaux âgés de 41 à 64 ans dont 3 220 jumeaux monozygotes) ont quant à elles révélé une influence génétique modeste sur la sensibilité à la douleur et le développement de douleurs chroniques diffuses (Kato et coll., 2006a , b
, b , 2009
, 2009 ).
).
 ). Cependant, cette étude ne faisait pas la part des facteurs environnementaux qui pouvaient, en plus des facteurs génétiques, être à l’origine des résultats. Des études menées en Suède sur le registre national de jumeaux (31 318 jumeaux âgés de 41 à 64 ans dont 3 220 jumeaux monozygotes) ont quant à elles révélé une influence génétique modeste sur la sensibilité à la douleur et le développement de douleurs chroniques diffuses (Kato et coll., 2006a
). Cependant, cette étude ne faisait pas la part des facteurs environnementaux qui pouvaient, en plus des facteurs génétiques, être à l’origine des résultats. Des études menées en Suède sur le registre national de jumeaux (31 318 jumeaux âgés de 41 à 64 ans dont 3 220 jumeaux monozygotes) ont quant à elles révélé une influence génétique modeste sur la sensibilité à la douleur et le développement de douleurs chroniques diffuses (Kato et coll., 2006a , b
, b , 2009
, 2009 ).
).Les mécanismes génétiques sous-tendant une possible prédisposition à l’hypersensibilité à la douleur ne sont pas encore connus, mais plusieurs polymorphismes de gènes potentiellement impliqués dans la modulation des messages nociceptifs ont été identifiés comme associés à cette hypersensibilité (Ablin et Buskila, 2015 ; Park et Lee, 2017
; Park et Lee, 2017 pour revues). Il s’agit en particulier du gène codant pour la COMT, enzyme impliquée dans le métabolisme des catécholamines, et des gènes codant pour des transporteurs de la sérotonine, dont on connaît également le rôle dans la modulation endogène de la douleur. Cependant, les résultats des études d’association menées dans la FM sont hétérogènes et ne permettent pas de conclure (Offenbaecher et coll., 1999
pour revues). Il s’agit en particulier du gène codant pour la COMT, enzyme impliquée dans le métabolisme des catécholamines, et des gènes codant pour des transporteurs de la sérotonine, dont on connaît également le rôle dans la modulation endogène de la douleur. Cependant, les résultats des études d’association menées dans la FM sont hétérogènes et ne permettent pas de conclure (Offenbaecher et coll., 1999 ; Gürsoy et coll., 2003
; Gürsoy et coll., 2003 ; Hagen et coll., 2006
; Hagen et coll., 2006 ; Vargas-Alarcón et coll., 2007
; Vargas-Alarcón et coll., 2007 ; Tander et coll., 2008
; Tander et coll., 2008 ; Cohen et coll., 2009
; Cohen et coll., 2009 ; Tammimäki et Männistö, 2012
; Tammimäki et Männistö, 2012 ). Des polymorphismes concernant certains sous-types des récepteurs des catécholamines (les récepteurs adrénergiques α et β ; Vargas-Alarcón et coll., 2009
). Des polymorphismes concernant certains sous-types des récepteurs des catécholamines (les récepteurs adrénergiques α et β ; Vargas-Alarcón et coll., 2009 ), des récepteurs de la sérotonine (polymorphisme nucléotidique « T102C » localisé dans le promoteur du gène codant pour le récepteur 5-HT2A ; Bondy et coll., 1999
), des récepteurs de la sérotonine (polymorphisme nucléotidique « T102C » localisé dans le promoteur du gène codant pour le récepteur 5-HT2A ; Bondy et coll., 1999 ; Tander et coll., 2008
; Tander et coll., 2008 ) ou les récepteurs D3 et D4 de la dopamine (Buskila et coll., 2004
) ou les récepteurs D3 et D4 de la dopamine (Buskila et coll., 2004 ; Potvin et coll., 2009
; Potvin et coll., 2009 ), ont également été identifiés comme associés à la FM. Là encore, il n’y a aucune spécificité puisqu’une fréquence plus élevée de certains polymorphismes des gènes COMT ou codant pour le récepteur à la sérotonine 5-HTTLPR a également été observée dans d’autres syndromes douloureux et d’autres pathologies comme la dépression (Andersen et Skorpen, 2009
), ont également été identifiés comme associés à la FM. Là encore, il n’y a aucune spécificité puisqu’une fréquence plus élevée de certains polymorphismes des gènes COMT ou codant pour le récepteur à la sérotonine 5-HTTLPR a également été observée dans d’autres syndromes douloureux et d’autres pathologies comme la dépression (Andersen et Skorpen, 2009 ; Karg et coll., 2011
; Karg et coll., 2011 ). Cependant, même si ces résultats doivent être interprétés avec prudence, ils pourraient indiquer que la FM est potentiellement associée (au moins chez certains patients) à une altération de la synthèse ou de la fonction de neurotransmetteurs comme la noradrénaline, la sérotonine et la dopamine, largement impliqués dans les mécanismes de modulation de la douleur et, pour la noradrénaline, dans les régulations impliquant le système sympathique.
). Cependant, même si ces résultats doivent être interprétés avec prudence, ils pourraient indiquer que la FM est potentiellement associée (au moins chez certains patients) à une altération de la synthèse ou de la fonction de neurotransmetteurs comme la noradrénaline, la sérotonine et la dopamine, largement impliqués dans les mécanismes de modulation de la douleur et, pour la noradrénaline, dans les régulations impliquant le système sympathique.
 ; Park et Lee, 2017
; Park et Lee, 2017 pour revues). Il s’agit en particulier du gène codant pour la COMT, enzyme impliquée dans le métabolisme des catécholamines, et des gènes codant pour des transporteurs de la sérotonine, dont on connaît également le rôle dans la modulation endogène de la douleur. Cependant, les résultats des études d’association menées dans la FM sont hétérogènes et ne permettent pas de conclure (Offenbaecher et coll., 1999
pour revues). Il s’agit en particulier du gène codant pour la COMT, enzyme impliquée dans le métabolisme des catécholamines, et des gènes codant pour des transporteurs de la sérotonine, dont on connaît également le rôle dans la modulation endogène de la douleur. Cependant, les résultats des études d’association menées dans la FM sont hétérogènes et ne permettent pas de conclure (Offenbaecher et coll., 1999 ; Gürsoy et coll., 2003
; Gürsoy et coll., 2003 ; Hagen et coll., 2006
; Hagen et coll., 2006 ; Vargas-Alarcón et coll., 2007
; Vargas-Alarcón et coll., 2007 ; Tander et coll., 2008
; Tander et coll., 2008 ; Cohen et coll., 2009
; Cohen et coll., 2009 ; Tammimäki et Männistö, 2012
; Tammimäki et Männistö, 2012 ). Des polymorphismes concernant certains sous-types des récepteurs des catécholamines (les récepteurs adrénergiques α et β ; Vargas-Alarcón et coll., 2009
). Des polymorphismes concernant certains sous-types des récepteurs des catécholamines (les récepteurs adrénergiques α et β ; Vargas-Alarcón et coll., 2009 ), des récepteurs de la sérotonine (polymorphisme nucléotidique « T102C » localisé dans le promoteur du gène codant pour le récepteur 5-HT2A ; Bondy et coll., 1999
), des récepteurs de la sérotonine (polymorphisme nucléotidique « T102C » localisé dans le promoteur du gène codant pour le récepteur 5-HT2A ; Bondy et coll., 1999 ; Tander et coll., 2008
; Tander et coll., 2008 ) ou les récepteurs D3 et D4 de la dopamine (Buskila et coll., 2004
) ou les récepteurs D3 et D4 de la dopamine (Buskila et coll., 2004 ; Potvin et coll., 2009
; Potvin et coll., 2009 ), ont également été identifiés comme associés à la FM. Là encore, il n’y a aucune spécificité puisqu’une fréquence plus élevée de certains polymorphismes des gènes COMT ou codant pour le récepteur à la sérotonine 5-HTTLPR a également été observée dans d’autres syndromes douloureux et d’autres pathologies comme la dépression (Andersen et Skorpen, 2009
), ont également été identifiés comme associés à la FM. Là encore, il n’y a aucune spécificité puisqu’une fréquence plus élevée de certains polymorphismes des gènes COMT ou codant pour le récepteur à la sérotonine 5-HTTLPR a également été observée dans d’autres syndromes douloureux et d’autres pathologies comme la dépression (Andersen et Skorpen, 2009 ; Karg et coll., 2011
; Karg et coll., 2011 ). Cependant, même si ces résultats doivent être interprétés avec prudence, ils pourraient indiquer que la FM est potentiellement associée (au moins chez certains patients) à une altération de la synthèse ou de la fonction de neurotransmetteurs comme la noradrénaline, la sérotonine et la dopamine, largement impliqués dans les mécanismes de modulation de la douleur et, pour la noradrénaline, dans les régulations impliquant le système sympathique.
). Cependant, même si ces résultats doivent être interprétés avec prudence, ils pourraient indiquer que la FM est potentiellement associée (au moins chez certains patients) à une altération de la synthèse ou de la fonction de neurotransmetteurs comme la noradrénaline, la sérotonine et la dopamine, largement impliqués dans les mécanismes de modulation de la douleur et, pour la noradrénaline, dans les régulations impliquant le système sympathique.Ces résultats peuvent être mis en parallèle avec ceux de plusieurs études que nous avons pour certaines déjà mentionnées montrant une augmentation de la concentration en neurotransmetteurs pronociceptifs comme la substance P (Russell et coll., 1992 ; Russell, 1998
; Russell, 1998 ; Schwarz et coll., 1999
; Schwarz et coll., 1999 ), le glutamate (Sarchielli et coll., 2007
), le glutamate (Sarchielli et coll., 2007 ; Harris et coll., 2009
; Harris et coll., 2009 ; Fayed et coll., 2010
; Fayed et coll., 2010 ) ou encore le NGF (Giovengo et coll., 1999
) ou encore le NGF (Giovengo et coll., 1999 ) dans le LCR ou le cerveau de patients. Selon ces données, une diminution de l’activité des processus inhibiteurs et une augmentation de l’activité des processus facilitateurs de la douleur seraient présentes dans la FM. Il serait maintenant important de vérifier si ces résultats obtenus sur la base de comparaison de groupes peuvent avoir une signification au niveau individuel. Plusieurs autres polymorphismes dans des gènes codant pour des protéines potentiellement impliquées dans la nociception, comme les récepteurs TRPV2 et TRPV3 (Park et coll., 2016
) dans le LCR ou le cerveau de patients. Selon ces données, une diminution de l’activité des processus inhibiteurs et une augmentation de l’activité des processus facilitateurs de la douleur seraient présentes dans la FM. Il serait maintenant important de vérifier si ces résultats obtenus sur la base de comparaison de groupes peuvent avoir une signification au niveau individuel. Plusieurs autres polymorphismes dans des gènes codant pour des protéines potentiellement impliquées dans la nociception, comme les récepteurs TRPV2 et TRPV3 (Park et coll., 2016 ), le canal sodique sensible au voltage Nav1.7 (Vargas-Alarcón et coll., 2012
), le canal sodique sensible au voltage Nav1.7 (Vargas-Alarcón et coll., 2012 ) ou la cyclohydrolase 1 (Kim et coll., 2013
) ou la cyclohydrolase 1 (Kim et coll., 2013 ) ont été également associés à la FM dans une population coréenne (TRPV2 et 3, cyclohydrolase 1) et mexicaine (origine mixte européenne et amérindienne ; Nav1.7). Outre ces études ayant été menées par des approches « gènes candidats », des études d’association pan génomiques ont révélé de nouveaux gènes candidats potentiels, codant pour des protéines dont le rôle est à ce jour inconnu (Docampo et coll., 2014
) ont été également associés à la FM dans une population coréenne (TRPV2 et 3, cyclohydrolase 1) et mexicaine (origine mixte européenne et amérindienne ; Nav1.7). Outre ces études ayant été menées par des approches « gènes candidats », des études d’association pan génomiques ont révélé de nouveaux gènes candidats potentiels, codant pour des protéines dont le rôle est à ce jour inconnu (Docampo et coll., 2014 ; Feng et coll., 2013
; Feng et coll., 2013 ). Si ces études ont indiscutablement ouvert des pistes de recherche très intéressantes, elles n’ont pas abouti à l’identification d’un ou plusieurs biomarqueurs utilisables en clinique en raison de la faible spécificité des associations génétiques identifiées vis-à-vis de la FM.
). Si ces études ont indiscutablement ouvert des pistes de recherche très intéressantes, elles n’ont pas abouti à l’identification d’un ou plusieurs biomarqueurs utilisables en clinique en raison de la faible spécificité des associations génétiques identifiées vis-à-vis de la FM.
 ; Russell, 1998
; Russell, 1998 ; Schwarz et coll., 1999
; Schwarz et coll., 1999 ), le glutamate (Sarchielli et coll., 2007
), le glutamate (Sarchielli et coll., 2007 ; Harris et coll., 2009
; Harris et coll., 2009 ; Fayed et coll., 2010
; Fayed et coll., 2010 ) ou encore le NGF (Giovengo et coll., 1999
) ou encore le NGF (Giovengo et coll., 1999 ) dans le LCR ou le cerveau de patients. Selon ces données, une diminution de l’activité des processus inhibiteurs et une augmentation de l’activité des processus facilitateurs de la douleur seraient présentes dans la FM. Il serait maintenant important de vérifier si ces résultats obtenus sur la base de comparaison de groupes peuvent avoir une signification au niveau individuel. Plusieurs autres polymorphismes dans des gènes codant pour des protéines potentiellement impliquées dans la nociception, comme les récepteurs TRPV2 et TRPV3 (Park et coll., 2016
) dans le LCR ou le cerveau de patients. Selon ces données, une diminution de l’activité des processus inhibiteurs et une augmentation de l’activité des processus facilitateurs de la douleur seraient présentes dans la FM. Il serait maintenant important de vérifier si ces résultats obtenus sur la base de comparaison de groupes peuvent avoir une signification au niveau individuel. Plusieurs autres polymorphismes dans des gènes codant pour des protéines potentiellement impliquées dans la nociception, comme les récepteurs TRPV2 et TRPV3 (Park et coll., 2016 ), le canal sodique sensible au voltage Nav1.7 (Vargas-Alarcón et coll., 2012
), le canal sodique sensible au voltage Nav1.7 (Vargas-Alarcón et coll., 2012 ) ou la cyclohydrolase 1 (Kim et coll., 2013
) ou la cyclohydrolase 1 (Kim et coll., 2013 ) ont été également associés à la FM dans une population coréenne (TRPV2 et 3, cyclohydrolase 1) et mexicaine (origine mixte européenne et amérindienne ; Nav1.7). Outre ces études ayant été menées par des approches « gènes candidats », des études d’association pan génomiques ont révélé de nouveaux gènes candidats potentiels, codant pour des protéines dont le rôle est à ce jour inconnu (Docampo et coll., 2014
) ont été également associés à la FM dans une population coréenne (TRPV2 et 3, cyclohydrolase 1) et mexicaine (origine mixte européenne et amérindienne ; Nav1.7). Outre ces études ayant été menées par des approches « gènes candidats », des études d’association pan génomiques ont révélé de nouveaux gènes candidats potentiels, codant pour des protéines dont le rôle est à ce jour inconnu (Docampo et coll., 2014 ; Feng et coll., 2013
; Feng et coll., 2013 ). Si ces études ont indiscutablement ouvert des pistes de recherche très intéressantes, elles n’ont pas abouti à l’identification d’un ou plusieurs biomarqueurs utilisables en clinique en raison de la faible spécificité des associations génétiques identifiées vis-à-vis de la FM.
). Si ces études ont indiscutablement ouvert des pistes de recherche très intéressantes, elles n’ont pas abouti à l’identification d’un ou plusieurs biomarqueurs utilisables en clinique en raison de la faible spécificité des associations génétiques identifiées vis-à-vis de la FM.D’autres types de marqueurs génétiques que les polymorphismes géniques, et dont l’étude est en plein développement, sont les modifications épigénétiques incluant les micro-ARN et la méthylation du génome5
. Les micro-ARN sont de courts ARN simple-brin et non codants qui jouent un rôle important dans la régulation de l’expression génique. Ils sont présents dans de nombreux tissus et fluides biologiques et leur expression peut être modifiée lors de processus normaux (comme le développement) ou pathologiques. Au cours des dernières années, ils sont devenus une cible majeure pour l’identification de biomarqueurs dans le domaine de la douleur (Andersen et coll., 2014 ). Des modifications d’expression de plusieurs micro-ARN ont ainsi été mises en évidence dans la FM (Bjersing et coll., 2013
). Des modifications d’expression de plusieurs micro-ARN ont ainsi été mises en évidence dans la FM (Bjersing et coll., 2013 ; Cerda-Olmedo et coll., 2015
; Cerda-Olmedo et coll., 2015 ; Masotti et coll., 2017
; Masotti et coll., 2017 ), mais les résultats sont peu concordants d’un échantillon étudié à l’autre et de nouvelles études sont nécessaires pour vérifier l’intérêt de ces micro-ARN dans la FM.
), mais les résultats sont peu concordants d’un échantillon étudié à l’autre et de nouvelles études sont nécessaires pour vérifier l’intérêt de ces micro-ARN dans la FM.
 ). Des modifications d’expression de plusieurs micro-ARN ont ainsi été mises en évidence dans la FM (Bjersing et coll., 2013
). Des modifications d’expression de plusieurs micro-ARN ont ainsi été mises en évidence dans la FM (Bjersing et coll., 2013 ; Cerda-Olmedo et coll., 2015
; Cerda-Olmedo et coll., 2015 ; Masotti et coll., 2017
; Masotti et coll., 2017 ), mais les résultats sont peu concordants d’un échantillon étudié à l’autre et de nouvelles études sont nécessaires pour vérifier l’intérêt de ces micro-ARN dans la FM.
), mais les résultats sont peu concordants d’un échantillon étudié à l’autre et de nouvelles études sont nécessaires pour vérifier l’intérêt de ces micro-ARN dans la FM.Il en est de même pour l’analyse des modifications du génome liées, non pas à la séquence nucléotidique de l’ADN, mais à sa méthylation dans des régions spécifiques en réponse à des facteurs environnementaux. Ces modifications par méthylation régulent l’expression des gènes qu’elles touchent, sont stables dans un même organisme et peuvent être transmises d’une génération à l’autre. Tout comme les micro-ARN, la méthylation génomique varie en réponse à des processus normaux ou pathologiques. Des études récentes ont suggéré que la FM était associée à une hypométhylation de plusieurs gènes impliqués dans des processus cellulaires neurobiologiques généraux comme la transduction des signaux, les interactions ligands-récepteurs, mais également de gènes impliqués dans la réponse au stress (Menzies et coll., 2013 ; Ciampi de Andrade et coll., 2017
; Ciampi de Andrade et coll., 2017 ). Ciampi de Andrade et coll. ont par exemple récemment identifié 1 610 régions du génome différentiellement méthylées (69 % hypométhylées) dans l’ADN (cellules sanguines) de 24 patientes atteintes de FM (critères ACR2010) comparées à 24 contrôles. Dans cet échantillon, une corrélation a été observée entre niveau de méthylation et excitabilité corticale mesurée par stimulation transcrânnienne (Ciampi de Andrade et coll., 2017
). Ciampi de Andrade et coll. ont par exemple récemment identifié 1 610 régions du génome différentiellement méthylées (69 % hypométhylées) dans l’ADN (cellules sanguines) de 24 patientes atteintes de FM (critères ACR2010) comparées à 24 contrôles. Dans cet échantillon, une corrélation a été observée entre niveau de méthylation et excitabilité corticale mesurée par stimulation transcrânnienne (Ciampi de Andrade et coll., 2017 ). Il s’agit là encore de résultats intéressants et encourageants sur un plan fondamental, mais qui doivent être confirmés par d’autres. Il est donc trop tôt pour envisager l’utilisation de ce type de méthodes dans un but diagnostique.
). Il s’agit là encore de résultats intéressants et encourageants sur un plan fondamental, mais qui doivent être confirmés par d’autres. Il est donc trop tôt pour envisager l’utilisation de ce type de méthodes dans un but diagnostique.
 ; Ciampi de Andrade et coll., 2017
; Ciampi de Andrade et coll., 2017 ). Ciampi de Andrade et coll. ont par exemple récemment identifié 1 610 régions du génome différentiellement méthylées (69 % hypométhylées) dans l’ADN (cellules sanguines) de 24 patientes atteintes de FM (critères ACR2010) comparées à 24 contrôles. Dans cet échantillon, une corrélation a été observée entre niveau de méthylation et excitabilité corticale mesurée par stimulation transcrânnienne (Ciampi de Andrade et coll., 2017
). Ciampi de Andrade et coll. ont par exemple récemment identifié 1 610 régions du génome différentiellement méthylées (69 % hypométhylées) dans l’ADN (cellules sanguines) de 24 patientes atteintes de FM (critères ACR2010) comparées à 24 contrôles. Dans cet échantillon, une corrélation a été observée entre niveau de méthylation et excitabilité corticale mesurée par stimulation transcrânnienne (Ciampi de Andrade et coll., 2017 ). Il s’agit là encore de résultats intéressants et encourageants sur un plan fondamental, mais qui doivent être confirmés par d’autres. Il est donc trop tôt pour envisager l’utilisation de ce type de méthodes dans un but diagnostique.
). Il s’agit là encore de résultats intéressants et encourageants sur un plan fondamental, mais qui doivent être confirmés par d’autres. Il est donc trop tôt pour envisager l’utilisation de ce type de méthodes dans un but diagnostique.Autres biomarqueurs
Les développements technologiques récents, issus de la physique, de la chimie ou de la biologie moléculaire, ont fourni de nouveaux moyens d’exploration clinique très puissants et complémentaires des analyses génétiques. C’est le cas des analyses transcriptomiques, protéomiques ou métabolomiques, ces deux dernières s’appuyant notamment sur la spectrométrie de masse, qui permettent une exploration globale des protéines ou des métabolites primaires et secondaires présents dans un tissu ou un organisme. Il est ainsi possible d’établir des profils transcriptomiques (ARN exprimés), protéiques ou métaboliques à partir de prélèvements sanguins, salivaires, urinaires ou de LCR de patients et de les comparer entre eux pour établir des profils communs et avec des groupes contrôles pour caractériser les pathologies. Ces techniques ont été utilisées dans plusieurs études récentes pour identifier un ou des profils caractéristiques de la FM (Caboni et coll., 2014 ; Malataji et coll., 2017
; Malataji et coll., 2017 ; Ciregia et coll., 2019
; Ciregia et coll., 2019 ; Khoonsari et coll., 2019a
; Khoonsari et coll., 2019a , b
, b ). Malgré des résultats prometteurs, ces travaux sont encore trop préliminaires pour véritablement évaluer leur intérêt dans l’identification de biomarqueurs.
). Malgré des résultats prometteurs, ces travaux sont encore trop préliminaires pour véritablement évaluer leur intérêt dans l’identification de biomarqueurs.
 ; Malataji et coll., 2017
; Malataji et coll., 2017 ; Ciregia et coll., 2019
; Ciregia et coll., 2019 ; Khoonsari et coll., 2019a
; Khoonsari et coll., 2019a , b
, b ). Malgré des résultats prometteurs, ces travaux sont encore trop préliminaires pour véritablement évaluer leur intérêt dans l’identification de biomarqueurs.
). Malgré des résultats prometteurs, ces travaux sont encore trop préliminaires pour véritablement évaluer leur intérêt dans l’identification de biomarqueurs.Conclusion
Nous avons assisté au cours des dernières années à une véritable explosion des études physiopathologiques dans le domaine de la FM. Alors que jusqu’aux années 1980 cette pathologie se caractérisait surtout par l’absence de base physiopathologique, nous sommes, à l’inverse, confrontés aujourd’hui à une pléthore de mécanismes potentiels et d’hypothèses physiopathologiques non mutuellement exclusives. De fait, de très nombreuses anomalies physiologiques, biochimiques ou histologiques ont été mises en évidence, tant au niveau périphérique que central, chez ces patients, de telle sorte qu’on peut considérer que la très riche symptomatologie associée à cette pathologie dépend probablement de plusieurs types de mécanismes (développementaux, périphériques, centraux, susceptibilité génétique, épigénétique, etc.) qui s’additionnent les uns aux autres pour aboutir à une fibromyalgie comme c’est le cas pour d’autres formes de douleurs chroniques (Denk et coll., 2014 ). Toutefois, une des difficultés majeures liées à l’interprétation des données actuelles est l’établissement d’un lien de causalité entre les anomalies observées, pas toujours reproductibles d’une étude à l’autre, et les symptômes de la FM. En d’autres termes, ces anomalies sont-elles la cause ou la conséquence de la pathologie ? Il est toujours très difficile de répondre à ce type de question dans le contexte de la recherche clinique. Cependant, des études prospectives visant à comparer l’évolution dans le temps des symptômes à celle des mécanismes physiopathologiques pourraient sans doute apporter des éléments de réponse à cette question capitale. Quoi qu’il en soit, il ressort des données disponibles aujourd’hui que la FM est hétérogène sur le plan physiopathologique. Les travaux futurs devront donc viser, non pas à une explication unique de la pathologie, mais plutôt à identifier des groupes de patients répondant à des mécanismes physiopathologiques distincts et spécifiques. Il paraît donc absolument capital de poursuivre et d’encourager les recherches dans ce domaine.
). Toutefois, une des difficultés majeures liées à l’interprétation des données actuelles est l’établissement d’un lien de causalité entre les anomalies observées, pas toujours reproductibles d’une étude à l’autre, et les symptômes de la FM. En d’autres termes, ces anomalies sont-elles la cause ou la conséquence de la pathologie ? Il est toujours très difficile de répondre à ce type de question dans le contexte de la recherche clinique. Cependant, des études prospectives visant à comparer l’évolution dans le temps des symptômes à celle des mécanismes physiopathologiques pourraient sans doute apporter des éléments de réponse à cette question capitale. Quoi qu’il en soit, il ressort des données disponibles aujourd’hui que la FM est hétérogène sur le plan physiopathologique. Les travaux futurs devront donc viser, non pas à une explication unique de la pathologie, mais plutôt à identifier des groupes de patients répondant à des mécanismes physiopathologiques distincts et spécifiques. Il paraît donc absolument capital de poursuivre et d’encourager les recherches dans ce domaine.
 ). Toutefois, une des difficultés majeures liées à l’interprétation des données actuelles est l’établissement d’un lien de causalité entre les anomalies observées, pas toujours reproductibles d’une étude à l’autre, et les symptômes de la FM. En d’autres termes, ces anomalies sont-elles la cause ou la conséquence de la pathologie ? Il est toujours très difficile de répondre à ce type de question dans le contexte de la recherche clinique. Cependant, des études prospectives visant à comparer l’évolution dans le temps des symptômes à celle des mécanismes physiopathologiques pourraient sans doute apporter des éléments de réponse à cette question capitale. Quoi qu’il en soit, il ressort des données disponibles aujourd’hui que la FM est hétérogène sur le plan physiopathologique. Les travaux futurs devront donc viser, non pas à une explication unique de la pathologie, mais plutôt à identifier des groupes de patients répondant à des mécanismes physiopathologiques distincts et spécifiques. Il paraît donc absolument capital de poursuivre et d’encourager les recherches dans ce domaine.
). Toutefois, une des difficultés majeures liées à l’interprétation des données actuelles est l’établissement d’un lien de causalité entre les anomalies observées, pas toujours reproductibles d’une étude à l’autre, et les symptômes de la FM. En d’autres termes, ces anomalies sont-elles la cause ou la conséquence de la pathologie ? Il est toujours très difficile de répondre à ce type de question dans le contexte de la recherche clinique. Cependant, des études prospectives visant à comparer l’évolution dans le temps des symptômes à celle des mécanismes physiopathologiques pourraient sans doute apporter des éléments de réponse à cette question capitale. Quoi qu’il en soit, il ressort des données disponibles aujourd’hui que la FM est hétérogène sur le plan physiopathologique. Les travaux futurs devront donc viser, non pas à une explication unique de la pathologie, mais plutôt à identifier des groupes de patients répondant à des mécanismes physiopathologiques distincts et spécifiques. Il paraît donc absolument capital de poursuivre et d’encourager les recherches dans ce domaine.La mise au point de biomarqueurs susceptibles d’aider au diagnostic doit aussi rester un des objectifs majeurs des recherches futures. Compte tenu de la multiplicité des mécanismes physiopathologiques potentiels, on peut penser qu’on n’identifiera non pas un, mais plusieurs biomarqueurs. Le développement et la validation de nouveaux tests diagnostiques s’appuyant sur ces marqueurs pourraient donc conduire à un démembrement de la FM en plusieurs groupes sur des bases physiopathologiques.
Références
[1] Ablin JN, Buskila D. Update on the genetics of the fibromyalgia syndrome.
Best Pract Res Clin Rheumatol. 2015;
29:20- 8

[2] Andersen S, Skorpen F. Variation in the COMT gene: implications for pain perception and pain treatment.
Pharmacogenomics. 2009;
10:669- 84

[3] Andersen HH, Duroux M, Gazerani P. MicroRNAs as modulators and biomarkers of inflammatory and neuropathic pain conditions.
C Neurobiol Dis. 2014;
71:159- 68

[4] Arendt-Nielsen L, Morlion B, Perrot S, Dahan A, et al . Assessment and manifestation of central sensitisation across different chronic pain conditions.
Eur J Pain. 2018;
22:216- 41

[5] Arnold LM, Hudson JI, Hess EV, et al . Family study of fibromyalgia.
Arthritis Rheum. 2004;
50:944- 52

[6] Backonja MM, Attal N, Baron R, et al . Value of quantitative sensory testing in neurological and pain disorders: NeuPSIG consensus.
Pain. 2013;
154:1807- 19

[7] Banic B, Petersen-Felix S, Andersen OK, et al . Evidence for spinal cord hypersensitivity in chronic pain after whiplash injury and in fibromyalgia.
Pain. 2004;
107:7- 15

[8] Basbaum AI, Fields HL. Endogenous pain control systems: brainstem spinal pathways and endorphin circuitry.
Annu Rev Neurosci. 1984;
7:309- 38

[9] Bennett RM, Jacobsen S. Muscle function and origin of pain in fibromyalgia.
Baillieres Clin Rheumatol. 1994;
8:721- 46

[10] Bjersing JL, Lundborg C, Bokarewa MI, Mannerkorpi K. Profile of cerebrospinal microRNAs in fibromyalgia.
PLoS One. 2013;
8: e78762p. 

[11] Bondy B, Spaeth M, Offenbaecher M, et al . The T102C polymorphism of the 5-HT2A-receptor gene in fibromyalgia.
Neurobiol Dis. 1999;
6:433- 9

[12] Buskila D, Cohen H, Neumann L, Ebstein RP. An association between fibromyalgia and the dopamine D4 receptor exon III repeat polymorphism and relationship to novelty seeking personality traits.
Mol Psychiatry. 2004;
9:730- 1

[13] Caboni P, Liori B, Kumar A, et al . Metabolomics analysis and modeling suggest a lysophosphocholines-PAF receptor interaction in fibromyalgia.
PLoS One. 2014;
9: e107626p. 

[14] Carli G, Suman AL, Biasi G, Marcolongo R. Reactivity to superficial and deep stimuli in patients with chronic musculoskeletal pain.
Pain. 2002;
100:259- 69

[15] Caro XJ, Winter EF. Evidence of abnormal epidermal nerve fiber density in fibromyalgia: clinical and immunologic implications.
Arthritis Rheumatol. 2014;
66:1945- 54

[16] Caro XJ, Winter EF. The role and importance of small fiber neuropathy in fibromyalgia pain.
Curr Pain Headache Rep. 2015;
19: 55p. 

[17] Cerdá-Olmedo G, Mena-Durán AV, Monsalve V, Oltra E. Identification of a microRNA signature for the diagnosis of fibromyalgia.
PLoS One. 2015;
10: e0121903p. 

[18] Chrousos GP, Gold PW. The concepts of stress and stress system disorders. Overview of physical and behavioral homeostasis.
JAMA. 1992;
267:1244- 52

[19] Ciampi de Andrade D, Maschietto M, Galhardoni R, et al . Epigenetics insights into chronic pain: DNA hypomethylation in fibromyalgia-a controlled pilot-study.
Pain. 2017;
158:1473- 80

[20] Ciregia F, Giacomelli C, Giusti L, et al . Putative salivary biomarkers useful to differentiate patients with fibromyalgia.
J Proteomics. 2019;
190:44- 54

[21] Clauw DJ. What is the meaning of « small fiber neuropathy » in fibromyalgia?.
Pain. 2015;
156:2115- 6

[22] Cohen H, Neumann L, Glazer Y, et al . The relationship between a common catechol-O-methyltransferase (COMT) polymorphism Val(158)Met and fibromyalgia.
Clin Exp Rheumatol. 2009;
27(5 Suppl 56):S51- 6

[23] Cohen SP, Verdolin MH, Chang AS, et al . The intravenous ketamine test predicts subsequent response to an oral dextromethorphan treatment regimen in fibromyalgia patients.
J Pain. 2006;
7:391- 8

[24] Coppieters I, Ickmans K, Cagnie B, et al . Cognitive performance is related to central sensitization and health-related quality of life in patients with chronic whiplash-associated disorders and fibromyalgia.
Pain Physician. 2015;
18:E389- 401

[25] De Felice M, Ossipov MH. Cortical and subcortical modulation of pain.
Pain Manag. 2016;
6:111- 20

[26] de Tommaso M, Nolano M, Iannone F, et al . Update on laser-evoked potential findings in fibromyalgia patients in light of clinical and skin biopsy features.
J Neurol. 2014;
261:461- 72

[27] de Tommaso M, Ricci K, Libro G, et al . Pain processing and vegetative dysfunction in fibromyalgia: a study by sympathetic skin response and laser evoked potentials.
Pain Res Treat. 2017;
2017: 9747148p. 

[28] Denk F, McMahon SB, Tracey I. Pain vulnerability: a neurobiological perspective.
Nature Neurosci. 2014;
17:192- 200

[29] Desmeules JA, Cedraschi C, Rapiti E, et al . Neurophysiologic evidence for a central sensitization in patients with fibromyalgia.
Arthritis Rheum. 2003;
48:1420- 9

[30] Desmeules J, Piguet V, Besson M, et al . Psychological distress in fibromyalgia patients: a role for catechol-O-methyl-transferase Val158met polymorphism.
Health Psychol. 2012;
31:242- 9

[31] Desmeules J, Chabert J, Rebsamen M, et al . Central pain sensitization, COMT Val158Met polymorphism, and emotional factors in fibromyalgia.
J Pain. 2014;
15:129- 35

[32] Dickenson AH, Sullivan AF. Evidence for a role of the NMDA receptor in the frequency dependent potentiation of deep rat dorsal horn nociceptive neurones following C fibre stimulation.
Neuropharmacology. 1987;
26:1235- 8

[33] Docampo E, Escaramís G, Gratacòs M, et al . Genome-wide analysis of single nucleotide polymorphisms and copy number variants in fibromyalgia suggest a role for the central nervous system.
Pain. 2014;
155:1102- 9

[34] Dohrenbusch R, Sodhi H, Lamprecht J, Genth E. Fibromyalgia as a disorder of perceptual organization? An analysis of acoustic stimulus processing in patients with widespread pain.
Z Rheumatol. 1997;
56:334- 41

[35] Doppler K, Rittner HL, Deckart M, Sommer C. Reduced dermal nerve fiber diameter in skin biopsies of patients with fibromyalgia.
Pain. 2015;
156:2319- 25

[36] Drewes AM, Andreasen A, Schrøder HD, et al . Pathology of skeletal muscle in fibromyalgia: a histo-immuno-chemical and ultrastructural study.
Br J Rheumatol. 1993;
32:479- 83

[37] Eller-Smith OC, Nicol AL, Christianson JA. Potential mechanisms underlying centralized pain and emerging therapeutic interventions.
Front Cell Neurosci. 2018;
12: 35p. 

[38] Ernberg M, Christidis N, Ghafouri B, Bileviciute-Ljungar I, Löfgren M, Bjersing J, et al . Plasma cytokine levels in fibromyalgia and their response to 15 weeks of progressive resistance exercise or relaxation therapy.
Mediators Inflamm. 2018;
2018: 3985154p. 

[39] Estévez-López F, Camiletti-Moirón D, Aparicio VA, et al . Identification of candidate genes associated with fibromyalgia susceptibility in southern Spanish women: the al-Ándalus project.
J Transl Med. 2018;
16: 43p. 

[40] Fayed N, Garcia-Campayo J, Magallón R, et al . Localized 1H-NMR spectroscopy in patients with fibromyalgia: a controlled study of changes in cerebral glutamate/glutamine, inositol, choline, and N-acetylaspartate.
Arthritis Res Ther. 2010;
12: R134p. 

[41] Feng J, Zhang Z, Wu X, et al . Discovery of potential new gene variants and inflammatory cytokine associations with fibromyalgia syndrome by whole exome sequencing.
PLoS One. 2013;
8: e65033p. 

[42] Garcia-Martin E, Garcia-Campayo J, Puebla-Guedea M, et al . Fibromyalgia is correlated with retinal nerve fiber layer thinning.
PLoS One. 2016;
11: e0161574p. 

[43] Geel SE. The fibromyalgia syndrome: musculoskeletal pathophysiology.
Semin Arthritis Rheum. 1994;
23:347- 53

[44] Geisser ME, Glass JM, Rajcevska LD, et al . A psychophysical study of auditory and pressure sensitivity in patients with fibromyalgia and healthy controls.
J Pain. 2008;
9:417- 22

[45] Gerdle B, Ernberg M, Mannerkorpi K, et al . Increased interstitial concentrations of glutamate and pyruvate in vastus lateralis of women with fibromyalgia syndrome are normalized after an exercise intervention – a case-control study.
PLoS One. 2016;
11: e0162010p. 

[46] Gerster JC, Hadj-Djilani A. Hearing and vestibular abnormalities in primary fibrositis syndrome.
J Rheumatol. 1984;
11:678- 80

[47] Giovengo SL, Russell IJ, Larson AA. Increased concentrations of nerve growth factor in cerebrospinal fluid of patients with fibromyalgia.
J Rheumatol. 1999;
26:1564- 9

[48] Graven-Nielsen T, Aspegren Kendall S, Henriksson KG, et al . Ketamine reduces muscle pain, temporal summation, and referred pain in fibromyalgia patients.
Pain. 2000;
85:483- 91

[49] Gur A, Oktayoglu P. Status of immune mediators in fibromyalgia.
Curr Pain Headache Rep. 2008;
12:175- 81

[50] Gürsoy S, Erdal E, Herken H, et al . Significance of catechol-O-methyltransferase gene polymorphism in fibromyalgia syndrome.
Rheumatol Int. 2003;
23:104- 7

[51] Hagen K, Pettersen E, Stovner LJ, et al . No association between chronic musculoskeletal complaints and Val158Met polymorphism in the Catechol-O-methyltransferase gene. The HUNT study.
BMC Musculoskelet Disord. 2006;
7: 40p. 

[52] Harris RE, Sundgren PC, Craig AD, et al . Elevated insular glutamate in fibromyalgia is associated with experimental pain.
Arthritis Rheum. 2009;
60:3146- 52

[53] Harris RE, Clauw DJ. Imaging central neurochemical alterations in chronic pain with proton magnetic resonance spectroscopy.
Neurosci Lett. 2012;
520:192- 6

[54] Hassett AL, Clauw DJ. Does psychological stress cause chronic pain?.
Psychiatr Clin North Am. 2011;
34:579- 94

[55] Hilgenberg-Sydney PB, Kowacs PA, Conti PC. Somatosensory evaluation in dysfunctional syndrome patients.
J Oral Rehabil. 2016;
43:89- 95

[56] Holton KF, Taren DL, Thomson CA, et al . The effect of dietary glutamate on fibromyalgia and irritable bowel symptoms.
Clin Exp Rheumatol. 2012;
30:10- 7

[57] Karg K, Burmeister M, Shedden K, Sen S. The serotonin transporter promoter variant (5-HTTLPR), stress, and depression meta-analysis revisited: evidence of genetic moderation.
Arch Gen Psychiatry. 2011;
68(5):444- 54

[58] Kato K, Sullivan PF, Evengård B, Pedersen NL. Chronic widespread pain and its comorbidities: a population-based study.
Arch Intern Med. 2006a;
166:1649- 54

[59] Kato K, Sullivan PF, Evengård B, Pedersen NL. Importance of genetic influences on chronic widespread pain.
Arthritis Rheum. 2006b;
54:1682- 6

[60] Kato K, Sullivan PF, Evengård B, Pedersen NL. A population-based twin study of functional somatic syndromes.
Psychol Med. 2009;
39:497- 505

[61] Khoonsari PE, Musunri S, Herman S, et al . Systematic analysis of the cerebrospinal fluid proteome of fibromyalgia patients.
J Proteomics. 2019a;
190:35- 43

[62] Khoonsari PE, Ossipova E, Lengqvist J, et al . The human CSF pain proteome.
J Proteomics. 2019b;
190:67- 76

[63] Kim SK, Kim SH, Nah SS, et al . Association of guanosine triphosphate cyclohydrolase 1 gene polymorphisms with fibromyalgia syndrome in a Korean population.
J Rheumatol. 2013;
40:316- 22

[64] Koroschetz J, Rehm SE, Gockel U, et al . Fibromyalgia and neuropathic pain – differences and similarities. A comparison of 3 057 patients with diabetic painful neuropathy and fibromyalgia.
BMC Neurol. 2011;
11: 55p. 

[65] Kosek E, Altawil R, Kadetoff D, et al . Evidence of different mediators of central inflammation in dysfunctional and inflammatory pain – interleukin-8 in fibromyalgia and interleukin-1β in rheumatoid arthritis.
J Neuroimmunol. 2015;
280:49- 55

[66] Kosek E, Ekholm J, Hansson P. Increased pressure pain sensibility in fibromyalgia patients is located deep to the skin but not restricted to muscle tissue.
Pain. 1995;
63:335- 9

[67] Kosek E, Ekholm J, Hansson P. Modulation of pressure pain thresholds during and following isometric contraction in patients with fibromyalgia and in healthy controls.
Pain. 1996a;
64:415- 23

[68] Kosek E, Ekholm J, Hansson P. Sensory dysfunction in fibromyalgia patients with implications for pathogenic mechanisms.
Pain. 1996b;
68:375- 83

[69] Kosek E, Hansson P. Modulatory influence on somatosensory perception from vibration and heterotopic noxious conditioning stimulation (HNCS) in fibromyalgia patients and healthy subjects.
Pain. 1997;
70:41- 51

[70] Kosmidis ML, Koutsogeorgopoulou L, Alexopoulos H, et al . Reduction of intraepidermal nerve fiber density (ienfd) in the skin biopsies of patients with fibromyalgia: a controlled study.
J Neurol Sci. 2014;
347:143- 7

[71] Kulshreshtha P, Deepak KK. Autonomic nervous system profile in fibromyalgia patients and its modulation by exercise: a mini review.
Clin Physiol Funct Imaging. 2013;
33:83- 91

[72] Lannersten L, Kosek E. Dysfunction of endogenous pain inhibition during exercise with painful muscles in patients with shoulder myalgia and fibromyalgia.
Pain. 2010;
151:77- 86

[73] Latremoliere A, Woolf CJ. Central sensitization: a generator of pain hypersensitivity by central neural plasticity.
J Pain. 2009;
10:895- 926

[74] Lautenbacher S, Rollman GB, McCain GA. Multi-method assessment of experimental and clinical pain in patients with fibromyalgia.
Pain. 1994;
59:45- 53

[75] Lautenbacher S, Rollman GB. Possible deficiencies of pain modulation in fibromyalgia.
Clin J Pain. 1997;
13:189- 96

[76] Lawson VH, Grewal J, Hackshaw KV, et al . Fibromyalgia syndrome and small fiber, early or mild sensory polyneuropathy.
Muscle Nerve. 2018;
58:625- 30

[77] Le Bars D. The whole body receptive field of dorsal horn multireceptive neurones.
Brain Res Brain Res Rev. 2002;
40:29- 44

[78] Le Bars D, Villanueva L, Bouhassira D, Willer JC. Diffuse noxious inhibitory controls (DNIC) in animals and in man.
Patol Fiziol Eksp Ter. 1992;
4:55- 65

[79] Le Bars D, Villanueva L. Electrophysiological evidence for the activation of descending inhibitory controls by nociceptive afferent pathways.
Prog Brain Res. 1988;
77:275- 99

[80] Lee YR. Fibromyalgia and childhood abuse: exploration of stress reactivity as a developmental mediator.
Develop Rev. 2010;
30:294- 307

[81] Lee YH, Kim JH, Song GG. Association between the COMT Val158Met polymorphism and fibromyalgia susceptibility and fibromyalgia impact questionnaire score: a meta-analysis.
Rheumatol Int. 2015;
35:159- 66

[82] Littlejohn G, Guymer E. Neurogenic inflammation in fibromyalgia.
Semin Immunopathol. 2018;
40:291- 300

[83] Lodahl M, Treister R, Oaklander AL. Specific symptoms may discriminate between fibromyalgia patients with versus without objective test evidence of small-fiber polyneuropathy.
Pain Rep. 2017;
3: e633p. 

[84] Lorenz J. Hyperalgesia or hypervigilance? An evoked potential approach to the study of fibromyalgia syndrome.
Z Rheumatol. 1998;
57(Suppl 2):19- 22

[85] Lorenz J, Grasedyck K, Bromm B. Middle and long latency somatosensory evoked potentials after painful laser stimulation in patients with fibromyalgia syndrome.
Electroencephalogr Clin Neurophysiol. 1996;
100:165- 8

[86] Low LA, Schweinhardt P. Early life adversity as a risk factor for fibromyalgia in later life.
Pain Res Treat. 2012;
2012: 140832p. 

[87] Malatji BG, Meyer H, Mason S, et al . A diagnostic biomarker profile for fibromyalgia syndrome based on an NMR metabolomics study of selected patients and controls.
BMC Neurol. 2017;
17: 88p. 

[88] Martinez-Lavin M. Biology and therapy of fibromyalgia. Stress, the stress response system, and fibromyalgia.
Arthritis Res Ther. 2007;
9: 216p. 

[89] Martínez-Martínez LA, Mora T, Vargas A, et al . Sympathetic nervous system dysfunction in fibromyalgia, chronic fatigue syndrome, irritable bowel syndrome, and interstitial cystitis: a review of case-control studies.
J Clin Rheumatol. 2014;
20:146- 50

[90] Masotti A, Baldassarre A, Guzzo MP, et al . Circulating microrna profiles as liquid biopsies for the characterization and diagnosis of fibromyalgia syndrome.
Mol Neurobiol. 2017;
54:7129- 36

[91] Mayer EA, Gebhart GF. Basic and clinical aspects of visceral hyperalgesia.
Gastroenterology. 1994;
107:271- 93

[92] McBeth J, Silman AJ, Gupta A, et al . Moderation of psychosocial risk factors through dysfunction of the hypothalamic-pituitary-adrenal stress axis in the onset of chronic widespread musculoskeletal pain: findings of a population-based prospective cohort study.
Arthritis Rheum. 2007;
56:360- 71

[94] Mendieta D, De la Cruz-Aguilera DL, Barrera-Villalpando MI, et al . IL-8 and IL-6 primarily mediate the inflammatory response in fibromyalgia patients.
J Neuroimmunol. 2016;
290:22- 5

[95] Menzies V, Lyon DE, Archer KJ, et al . Epigenetic alterations and an increased frequency of micronuclei in women with fibromyalgia.
Nurs Res Pract. 2013;
2013: 795784p. 

[96] Menzies V, Lyon DE. Integrated review of the association of cytokines with fibromyalgia and fibromyalgia core symptoms.
Biol Res Nurs. 2010;
11:387- 94

[97] Mhalla A, Baudic S, Ciampi de Andrade D, et al . Long-term maintenance of the analgesic effects of transcranial magnetic stimulation in fibromyalgia.
Pain. 2011;
152:1478- 85

[99] Moana-Filho EJ, Herrero Babiloni A, Theis-Mahon NR. Endogenous pain modulation in chronic orofacial pain: a systematic review and meta-analysis.
Pain. 2018;
159:1441- 55

[100] O’Brien AT, Deitos A, Triñanes Pego Y, et al . Defective endogenous pain modulation in fibromyalgia: a meta-analysis of temporal summation and conditioned pain modulation paradigms.
J Pain. 2018;
19:819- 36

[101] Oaklander AL, Herzog ZD, Downs HM, Klein MM. Objective evidence that small-fiber polyneuropathy underlies some illnesses currently labeled as fibromyalgia.
Pain. 2013;
154:2310- 6

[102] Oaklander AL. What is the meaning of « small-fiber polyneuropathy » in fibromyalgia? An alternate answer.
Pain. 2016;
157:1366- 7

[103] Offenbaecher M, Bondy B, de Jonge S, et al . Possible association of fibromyalgia with a polymorphism in the serotonin transporter gene regulatory region.
Arthritis Rheum. 1999;
42:2482- 8

[104] Olivan-Blázquez B, Herrera-Mercadal P, Puebla-Guedea M, et al . Efficacy of memantine in the treatment of fibromyalgia: a double-blind, randomised, controlled trial with 6-month follow-up.
Pain. 2014;
155:2517- 25

[105] Olsen NJ, Park JH. Skeletal muscle abnormalities in patients with fibromyalgia.
Am J Med Sci. 1998;
315:351- 8

[106] Ossipov MH, Morimura K, Porreca F. Descending pain modulation and chronification of pain.
Curr Opin Support Palliat Care. 2014;
8:143- 51

[107] Oudejans L, He X, Niesters M, et al . Cornea nerve fiber quantification and construction of phenotypes in patients with fibromyalgia.
Sci Rep. 2016;
6: 23573p. 

[108] Passard A, Attal N, Benadhira R, et al . Effects of unilateral repetitive transcranial magnetic stimulation of the motor cortex on chronic widespread pain in fibromyalgia.
Brain. 2007;
130:2661- 70

[109] Park DJ, Kim SH, Nah SS, et al . Polymorphisms of the TRPV2 and TRPV3 genes associated with fibromyalgia in a Korean population.
Rheumatology (Oxford). 2016;
55:1518- 27

[110] Park DJ, Lee SS. New insights into the genetics of fibromyalgia.
Korean J Intern Med. 2017;
32:984- 995

[111] Park JH, Phothimat P, Oates CT, et al . Use of P-31 magnetic resonance spectroscopy to detect metabolic abnormalities in muscles of patients with fibromyalgia.
Arthritis Rheum. 1998;
41:406- 13

[112] Paul-Savoie E, Marchand S, Morin M, Bourgault P, Brissette N, Rattanavong V, et al . Is the deficit in pain inhibition in fibromyalgia influenced by sleep impairments?.
Open Rheumatol J. 2012;
6:296- 302

[113] Petzke F, Clauw DJ, Ambrose K, et al . Increased pain sensitivity in fibromyalgia: effects of stimulus type and mode of presentation.
Pain. 2003;
105:403- 13

[114] Porreca F, Ossipov MH, Gebhart GF. Chronic pain and medullary descending facilitation.
Trends Neurosci. 2002;
25:319- 25

[115] Potvin S, Larouche A, Normand E, et al . DRD3 Ser9Gly polymorphism is related to thermal pain perception and modulation in chronic widespread pain patients and healthy controls.
J Pain. 2009;
10:969- 75

[116] Potvin S, Paul-Savoie E, Morin M, et al . Temporal summation of pain is not amplified in a large proportion of fibromyalgia patients.
Pain Res Treat. 2012;
938595p. 

[117] Potvin S, Marchand S. Pain facilitation and pain inhibition during conditioned pain modulation in fibromyalgia and in healthy controls.
Pain. 2016;
157:1704- 10

[118] Price DD, Staud R, Robinson ME, et al . Enhanced temporal summation of second pain and its central modulation in fibromyalgia patients.
Pain. 2002;
99:49- 59

[119] Pyke TL, Osmotherly PG, Baines S. Measuring glutamate levels in the brains of fibromyalgia patients and a potential role for glutamate in the pathophysiology of fibromyalgia symptoms: a systematic review.
Clin J Pain. 2017;
33:944- 54

[120] Ramírez M, Martínez-Martínez LA, Hernández-Quintela E, et al . Small fiber neuropathy in women with fibromyalgia. An in vivo assessment using corneal confocal bio-microscopy.
Semin Arthritis Rheum. 2015;
45:214- 9

[121] Ranzolin A, Duarte AL, Bredemeier M, et al . Evaluation of cytokines, oxidative stress markers and brain-derived neurotrophic factor in patients with fibromyalgia – A controlled cross-sectional study.
Cytokine. 2016;
84:25- 8

[122] Rodriguez-Pintó I, Agmon-Levin N, Howard A, Shoenfeld Y. Fibromyalgia and cytokines.
Immunol Lett. 2014;
161:200- 3

[124] Russell IJ, Vaeroy H, Javors M, Nyberg F. Cerebrospinal fluid biogenic amine metabolites in fibromyalgia/fibrositis syndrome and rheumatoid arthritis.
Arthritis Rheum. 1992;
35:550- 6

[125] Salemi S, Rethage J, Wollina U, et al . Detection of interleukin 1beta (IL-1beta), IL-6, and tumor necrosis factor-alpha in skin of patients with fibromyalgia.
J Rheumatol. 2003;
30:146- 50

[126] Sandrini G, Serrao M, Rossi P, et al . The lower limb flexion reflex in humans.
Prog Neurobiol. 2005;
77:353- 95

[127] Sarchielli P, Di Filippo M, Nardi K, Calabresi P. Sensitization, glutamate, and the link between migraine and fibromyalgia.
Curr Pain Headache Rep. 2007;
11:343- 51

[128] Sarzi-Puttini P, Atzeni F, Cazzola M. Neuroendocrine therapy of fibromyalgia syndrome: an update.
Ann N Y Acad Sci. 2010;
1193:91- 7

[129] Schmidt-Wilcke T, Clauw DJ. Fibromyalgia: from pathophysiology to therapy.
Nat Rev Rheumatol. 2011;
7:518- 27

[130] Schwarz MJ, Späth M, Müller-Bardorff H, et al . Relationship of substance P, 5-hydroxyindole acetic acid and tryptophan in serum of fibromyalgia patients.
Neurosci Lett. 1999;
259:196- 8

[131] Serra J, Collado A, Solà R, et al . Hyperexcitable C nociceptors in fibromyalgia.
Ann Neurol. 2014;
75:196- 208

[132] Shang Y, Gurley K, Symons B, et al . Noninvasive optical characterization of muscle blood flow, oxygenation, and metabolism in women with fibromyalgia.
Arthritis Res Ther. 2012;
14: R236p. 

[133] Simms RW, Goldenberg DL. Symptoms mimicking neurologic disorders in fibromyalgia syndrome.
J Rheumatol. 1988;
15:1271- 3

[135] Smythe H. Tender points: evolution of concepts of the fibrositis/fibromyalgia syndrome.
Am J Med. 1986;
81:2- 6

[136] Sommer C, Lauria G. Skin biopsy in the management of peripheral neuropathy.
Lancet Neurol. 2007;
6:632- 42

[137] Sörensen J, Graven-Nielsen T, Henriksson KG, Bengtsson M, Arendt-Nielsen L. Hyperexcitability in fibromyalgia.
J Rheumatol. 1998;
25:152- 5

[138] Srikuea R, Symons TB, Long DE, et al . Association of fibromyalgia with altered skeletal muscle characteristics which may contribute to postexertional fatigue in postmenopausal women.
Arthritis Rheum. 2013;
65:519- 28

[139] Staud R. Abnormal endogenous pain modulation is a shared characteristic of many chronic pain conditions.
Expert Rev Neurother. 2012;
12:577- 85

[140] Staud R. Cytokine and immune system abnormalities in fibromyalgia and other central sensitivity syndromes.
Curr Rheumatol Rev. 2015;
11:109- 15

[141] Staud R, Robinson ME, Vierck CJ Jr, Price DD. Diffuse noxious inhibitory controls (DNIC) attenuate temporal summation of second pain in normal males but not in normal females or fibromyalgia patients.
Pain. 2003;
101:167- 74

[142] Staud R, Vierck CJ, Robinson ME, Price DD. Effects of the N-methyl-D-aspartate receptor antagonist dextromethorphan on temporal summation of pain are similar in fibromyalgia patients and normal control subjects.
J Pain. 2005;
6:323- 32

[143] Staud R, Bovee CE, Robinson ME, Price DD. Cutaneous C-fiber pain abnormalities of fibromyalgia patients are specifically related to temporal summation.
Pain. 2008;
139:315- 23

[144] Tak LM, Rosmalen JG. Dysfunction of stress responsive systems as a risk factor for functional somatic syndromes.
J Psychosom Res. 2010;
68:461- 8

[145] Tak LM, Riese H, de Bock GH, et al . As good as it gets? A meta-analysis and systematic review of methodological quality of heart rate variability studies in functional somatic disorders.
Biol Psychol. 2009;
82:101- 10

[146] Tak LM, Cleare AJ, Ormel J, et al . Meta-analysis and meta-regression of hypothalamic-pituitary-adrenal axis activity in functional somatic disorders.
Biol Psychol. 2011;
87:183- 94

[147] Tammimäki A, Männistö PT. Catechol-O-methyltransferase gene polymorphism and chronic human pain: a systematic review and meta-analysis.
Pharmacogenet Genomics. 2012;
22:673- 91

[148] Tander B, Gunes S, Boke O, et al . Polymorphisms of the serotonin-2A receptor and catechol-O-methyltransferase genes: a study on fibromyalgia susceptibility.
Rheumatol Int. 2008;
28:685- 91

[149] Tanriverdi F, Karaca Z, Unluhizarci K, Kelestimur F. The hypothalamo-pituitary-adrenal axis in chronic fatigue syndrome and fibromyalgia syndrome.
Stress. 2007;
10:13- 25

[150] Terkelsen AJ, Karlsson P, Lauria G, et al . The diagnostic challenge of small fibre neuropathy: clinical presentations, evaluations, and causes.
Lancet Neurol. 2017;
16:934- 44

[151] Truini A, Gerardi MC, Di Stefano G, et al . Hyperexcitability in pain matrices in patients with fibromyalgia.
Clin Exp Rheumatol. 2015;
33:S68- 72

[152] Üçeyler N, Häuser W, Sommer C. Systematic review with meta-analysis: cytokines in fibromyalgia syndrome.
BMC Musculoskelet Disord. 2011;
12: 245p. 

[153] Üçeyler N, Zeller D, Kahn AK, et al . Small fibre pathology in patients with fibromyalgia syndrome.
Brain. 2013;
136:1857- 67

[154] Üçeyler N, Kewenig S, Kafke W, et al . Skin cytokine expression in patients with fibromyalgia syndrome is not different from controls.
BMC Neurol. 2014;
14: 185p. 

[155] Valeriani M, Pazzaglia C, Cruccu G, Truini A. Clinical usefulness of laser evoked potentials.
Neurophysiol Clin. 2012;
42:345- 53

[156] Vargas-Alarcón G, Fragoso JM, Cruz-Robles D, et al . Catechol-O-methyltransferase gene haplotypes in Mexican and Spanish patients with fibromyalgia.
Arthritis Res Ther. 2007;
9: R110p. 

[157] Vargas-Alarcón G, Fragoso JM, Cruz-Robles D, et al . Association of adrenergic receptor gene polymorphisms with different fibromyalgia syndrome domains.
Arthritis Rheum. 2009;
60:2169- 73

[158] Vargas-Alarcón G, Alvarez-Leon E, Fragoso JM, et al . A SCN9A gene-encoded dorsal root ganglia sodium channel polymorphism associated with severe fibromyalgia.
BMC Musculoskelet Disord. 2012;
13: 23p. 

[159] Vestergaard-Poulsen P, Thomsen C, Nørregaard J, et al . 31P NMR spectroscopy and electromyography during exercise and recovery in patients with fibromyalgia.
J Rheumatol. 1995;
22:1544- 51

[160] Wilder-Smith CH, Robert-Yap J. Abnormal endogenous pain modulation and somatic and visceral hypersensitivity in female patients with irritable bowel syndrome.
World J Gastroenterol. 2007;
13:3699- 704

[161] Woolf CJ. Central sensitization: implications for the diagnosis and treatment of pain.
Pain. 2011;
152(3 Suppl):S2- 15

[162] Wortmann RL. Searching for the cause of fibromyalgia: is there a defect in energy metabolism?.
Arthritis Rheum. 1994;
37:790- 3

[163] Xiao Y, Haynes WL, Michalek JE, Russell IJ. Elevated serum high-sensitivity C-reactive protein levels in fibromyalgia syndrome patients correlate with body mass index, interleukin-6, interleukin-8, erythrocyte sedimentation rate.
Rheumatol Int. 2013;
33:1259- 64

[164] Yarnitsky D. Role of endogenous pain modulation in chronic pain mechanisms and treatment.
Pain. 2015;
156Suppl 1:S24- 31

[165] Yunus MB. Editorial review: an update on central sensitivity syndromes and the issues of nosology and psychobiology.
Curr Rheumatol Rev. 2015;
11:70- 85

[166] Yunus MB, Kalyan-Raman UP, Kalyan-Raman K, Masi AT. Pathologic changes in muscle in primary fibromyalgia syndrome.
Am J Med. 1986;
81:38- 42

→ Aller vers SYNTHESE