Fibromyalgie
2020
4-
Épidémiologie du syndrome
fibromyalgique
De nombreuses informations sur le syndrome fibromyalgique (SFM) sont issues d’études cliniques réalisées auprès de patients souffrant de ce syndrome ayant consulté en milieu de soins, notamment dans les centres de traitement de la douleur. Ce type d’études en milieu de soins spécialisés expose à des phénomènes de sélection des patients liés notamment à leurs comportements à l’égard des soins ainsi qu’aux modalités de recrutement parfois sélectives de ces centres (Walitt et coll., 2015

).
L’approche épidémiologique permet d’étudier le SFM dans de larges populations en cherchant à limiter les effets de sélection observés dans les séries cliniques. Les études épidémiologiques permettent de préciser la prévalence (fréquence à un instant t) et l’incidence (fréquence des nouveaux cas sur une période p) du SFM dans la population, ainsi que ses facteurs de risque et la fréquence des comorbidités associées.
Afin de tenir compte des limites méthodologiques de nombreuses études consacrées au SFM, exposées ci-dessous, nous privilégierons dans ce chapitre les données issues des revues systématiques et méta-analyses récentes des études de prévalence de la douleur chronique diffuse ou étendue (Clauw et Crofford, 2003

; Kim et coll., 2011

; Fayaz et coll., 2016

; Mansfield et coll., 2016

; Andrews et coll., 2018

) et du SFM chez l’adulte (Queiroz, 2013

; Kudlow et coll., 2015

; Heidari et coll., 2017

), ainsi que des études épidémiologiques méthodologiquement de bonne qualité (Weir et coll., 2006

; Kim et coll., 2011

; Perrot et coll., 2011

; Kudlow et coll., 2015

; Walitt et coll., 2015

; Fayaz et coll., 2016

).
Limites méthodologiques des données de la littérature
De nombreuses études épidémiologiques visant à déterminer la prévalence et les déterminants de la douleur chronique diffuse (CWP pour
Chronic Widespread Pain)
1
Le terme douleur chronique diffuse (CWP) sera utilisé dans le reste du texte comme synonyme de syndrome douloureux chronique étendu, douleur diffuse ou douleur multisite parfois utilisés dans la littérature épidémiologique.
et du SFM ont été publiées depuis une trentaine d’années. Néanmoins, un grand nombre d’études référencées dans les bases de données biomédicales présentent des limites méthodologiques liées au design des études, aux biais de sélection des échantillons étudiés, aux limites des instruments d’évaluation clinique et à l’évolution des critères de classification ou de diagnostic de la CWP et du SFM depuis sa description par Smythe et Moldofsky en 1977 (Wolfe et Häuser, 2011

) (voir chapitre « Critères diagnostiques, diagnostics différentiels, comorbidités et sous-groupes »).
Limites méthodologiques liées aux définitions de la douleur chronique étendue et au syndrome fibromyalgique
Le SFM est une forme particulière de CWP caractérisée par des douleurs diffuses chroniques associées à une fatigue souvent intense, des troubles du sommeil, et d’autres manifestations variées (troubles cognitifs, troubles de l’humeur, et diverses manifestations somatiques)
2
. Une CWP se définit comme une douleur évoluant depuis plus de 3 mois, étendue dans plusieurs régions corporelles, associée à plusieurs autres symptômes comme de la fatigue, des troubles de la concentration, et une détresse psychologique. La douleur chronique est le symptôme majeur de la fibromyalgie, dans laquelle la douleur s’étend corporellement à la fois axialement (rachis cervical, thoracique postérieur et antérieur, et lombaire), au-dessus et en dessous de la ceinture pelvienne, et sur les zones latérales droite et gauche du corps (Wolfe et coll., 1990

). En 2010, l’ACR a modifié les critères déterminant l’étendue de la douleur dans la fibromyalgie en proposant un index de douleur diffuse prenant en compte 19 zones corporelles. Cet index est considéré comme positif lorsque le patient a ressenti la douleur dans au moins 7 zones au cours de la dernière semaine (ACR 2010).
Les critères de l’ACR publiés successivement en 1990, 2010, 2011 et 2016 (tableau 4.I

) sont communément utilisés pour classifier le SFM et établir sa prévalence et ses facteurs de risque dans la population (Wolfe et Häuser, 2011

; Ablin et Wolfe, 2017

). Ces critères ont évolué et modifié la conception du SFM initialement caractérisé par une douleur chronique diffuse avec existence de points douloureux à la pression vers un syndrome douloureux multisite associé à un cortège de symptômes fonctionnels. Le SFM s’inscrit par conséquent dans un continuum de la douleur (Jones et coll., 2015

) associée à des symptômes fonctionnels variés parfois difficiles à délimiter sur le plan épidémiologique en raison de l’existence de pathologies de chevauchement (Fitzcharles et coll., 2013b

; Arnold et coll., 2016

). Ainsi, les critères ACR de classification ou de diagnostic du SFM influencent diversement la mesure de sa fréquence, les caractéristiques socio-démographiques des personnes concernées, la fréquence des comorbidités et probablement ses facteurs de risque (Arnold et coll., 2016

).
Tableau 4.I Évolution des critères de classification de la douleur chronique diffuse et du syndrome fibromyalgique
|
Douleur chronique diffuse (Chronic Widespread Pain ou CWP)
ACR 1990 : douleur durant 3 mois ou plus ET localisée axialement (rachis cervical, thoracique postérieur et antérieur et lombaire), au-dessus et en dessous de la ceinture, et sur les zones latérales droite et gauche du corps
ACR 2010 : douleur musculaire durant 3 mois ou plus ET index de douleur diffuse ≥ 7 (nombre de zones où le patient a ressenti la douleur au cours de la dernière semaine ; 0-19) (Wolfe et coll., 2010  )
|
|
Syndrome fibromyalgique (SFM)
ACR 90 : CWP +≥ 11/18 points douloureux à la pression (Wolfe et coll., 1990  )
ACR préliminaires 2010 : CWP + symptômes somatiques (type, sévérité) + exclusion autre pathologie (Wolfe et coll., 2010  )
ACR 2011 : remplacement des symptômes somatiques par évaluation de la présence dans les 6 derniers mois de maux de tête, douleurs ou crampes abdominales, dépression (Wolfe et coll., 2011  )
ACR révisés 2016 : douleur d’au moins quatre des cinq régions supérieure droite, supérieure gauche, inférieure droite, inférieure gauche et axiale, suppression de l’exclusion des patients qui ont une pathologie pouvant expliquer les douleurs (Wolfe et coll., 2016  )
|
La pluralité des définitions du SFM, pour lequel le terme de CWP est quelquefois utilisé dans la littérature (Mansfield et coll., 2017

), doit être prise en considération dans l’interprétation des études de sa prévalence car elle modifie sensiblement le profil des patients retenus. Ainsi, Jones et coll., étudiant 4 600 sujets de 25 ans ou plus présentant une CWP, ont montré que les critères de classification successifs du SFM (ACR 1990, ACR 2010, ACR 2010 modifiés) n’identifient pas les mêmes patients, d’une part. D’autre part, seulement 1 patient sur 8 était classé comme souffrant de SFM par les trois jeux de critères ACR (Jones et coll., 2015

). La prévalence du SFM était plus élevée avec les critères ACR modifiés 2010 (2011 ; 5,4 % [IC 95 % 4,7-6,1]) qu’avec les critères ACR 1990 (1,7 % [IC 95 % 0,7-2,8]) ou ACR 2010 (1,2 % [IC 95 % 0,3-2,1]). Point important, la distribution du SFM selon le genre variait considérablement en fonction des critères utilisés (tableau 4.II

). Alors que la prépondérance féminine était une caractéristique importante du SFM selon les critères ACR 1990 (sex-ratio F/H de 13,7/1), celle-ci était moins nette avec les critères ACR 2010 (sex-ratio F/H de 4,8/1, soit une diminution de 64 % de la prédominance féminine) et encore moins avec les critères ACR modifiés 2010 (2011) (sex-ratio F/H 2,3/1, soit une diminution de plus de 83 % de la prédominance féminine). Il en est probablement de même avec les ACR 2016 (non pris en compte dans cette étude). L’existence de comorbidité rhumatologique variait également de manière importante selon les critères adoptés : respectivement 55 %, 28 % et 45 % pour les critères ACR 1990, ACR 2010, et ACR modifiés 2010 (2011).
Tableau 4.II Modification de prévalence et de sex ratio femme/homme en fonction des critères de classification ACR utilisés (d’après Jones et coll., 2015 )
)
| |
ACR 1990
|
ACR 2010 préliminaires
|
ACR 2011 (2010 modifiés)
|
|
Prévalence (%)
|
5,4 [4,7-6,1]
|
1,7 [0,7-2,8]
|
1,2 [0,3-2,1]
|
|
Sex-ratio
|
13,7/1
|
4,8/1
|
2,3/1
|
|
Comorbidités rhumatologiques (%)
|
55
|
28
|
45
|
L’intervalle de confiance (IC) à 95 % est indiqué entre crochets.
La difficulté d’estimer la prévalence du SFM, qui est liée à la définition retenue, est illustrée par la grande enquête épidémiologique américaine intitulée «
National Health Interview Study 2012 » montrant que les trois-quarts des répondants rapportant un diagnostic de SFM effectué par leur médecin ne remplissaient pas les critères ACR évalués par auto-questionnaire en raison de symptômes insuffisamment sévères (Walitt et coll., 2016

). L’évolution des critères de classification du SFM nécessite donc d’interpréter avec prudence les données de prévalence et les facteurs associés au SFM compte tenu des profils cliniques et sociodémographiques différents induits par ces critères. Ainsi, certaines comorbidités et facteurs associés au SFM définis selon les critères ACR 1990 ont progressivement été inclus dans les critères ultérieurs. Ce point critique doit être pris en compte dans les méta-analyses d’études pouvant reposer sur différentes générations de critères de SFM. Il complique également grandement l’interprétation des données épidémiologiques sur les facteurs prédisposant au SFM.
Limites méthodologiques liées aux caractéristiques
des études épidémiologiques
La majorité des études épidémiologiques disponibles sur le SFM sont des études descriptives transversales réalisées dans la population générale ou des populations spécifiques, comme des populations hospitalières ou des groupes sociaux, ethniques ou professionnels (Cobankara et coll., 2011

; Kim et coll., 2011

; Cabo-Meseguer et coll., 2017

). Il existe peu d’études sur de grandes populations représentatives de la population générale (Walitt et coll., 2015

). De nombreuses études portent sur des échantillons limités de la population générale ou de la population cible, qui sont probablement non représentatifs du fait de phénomènes de sélection. Il existe également très peu d’études longitudinales de bonne qualité si bien que les revues systématiques incluent principalement des études transversales ou, plus rarement, cas-témoins (Forseth et coll., 1997

; Weir et coll., 2006

; Queiroz, 2013

; Mansfield et coll., 2016

; Heidari et coll., 2017

; Andrews et coll., 2018

), ce qui limite les études des facteurs de risque du SFM.
L’absence de codage systématique du SFM lors des activités de consultation et même d’hospitalisation dans la plupart des pays ne permet pas de disposer de données de surveillance épidémiologique fiables. Ainsi en France, le code CIM-10 M79.9
3
Maladies du système ostéo-articulaire, des muscles et du tissu conjonctif. Affection des tissus mous, sans précision.
permettant de coder les cas de SFM est exceptionnellement utilisé par les médecins rhumatologues ou internistes en pratique courante d’hospitalisation ou de consultation
4
Audition du Dr I Grémy, procès-verbal de la séance du mardi 31 mai 2016. Assemblée nationale, no 4110, Rapport fait au nom de la commission d’enquête sur la fibromyalgie, octobre 2016.
, ce qui ne permet pas d’utiliser les bases de données médico-administratives (de type Système national de données de santé ou SNDS) pour la surveillance épidémiologique du SFM en France.
Les études disponibles ont été conduites en population générale ou dans des sous-groupes de la population générale selon le genre, la classe d’âge, le niveau de revenu ou la catégorie socio-professionnelle (Heidari et coll., 2017

). D’autres études reposent sur des populations ciblées concernant des patients atteints de SFM ou de comorbidités qui sont recrutées dans des services de rhumatologie ou des centres de lutte contre la douleur. Ces dernières études sont caractérisées par des biais de sélection importants favorisant les cas les plus sévères ou associés à des comorbidités spécifiques dont il faut tenir compte dans l’analyse des données de prévalence ou d’association à des facteurs de risque. Ainsi, il est observé une plus forte prévalence du SFM chez les personnes recrutées dans des centres de rhumatologie ou de lutte contre la douleur spécialisés, et pour lesquelles des comorbidités sont plus souvent diagnostiquées (Heidari et coll., 2017

).
Limites méthodologiques liées aux outils d’évaluation
de la fibromyalgie, des comorbidités et des facteurs de risque
Il n’existe pas d’outil diagnostique du SFM consensuel au niveau international. La majorité des études reposent sur les critères de classification ACR 1990 ou la passation de questionnaires validés de dépistage ou d’évaluation du SFM comme le
Fibromyalgia Impact Questionnaire (FIQ), le
London Fibromyalgia Epidemiology Study Screening Questionnaire (LFES-SQ), ou encore le
Fibromyalgia Rapid Screening Tool (FIRST) (voir chapitre « Critères diagnostiques, diagnostics différentiels, comorbidités et sous-groupes »). Certaines études reposent sur des questionnaires
ad hoc présentant des limites méthodologiques quant à leur validation et leurs propriétés métrologiques. Les modalités de passation sont variables d’une étude à l’autre : questionnaire postal, téléphonique ou en face à face. Certaines études complètent le recueil de données par un examen clinique standardisé. La majorité des études de prévalence incluses dans les méta-analyses récentes utilisent les critères de classification ACR 1990 (26 sur 44 retenues dans Heidari et coll., 2017

) et plus rarement les questionnaires FIQ (4) et LFES-SQ (4) (Heidari et coll., 2017

). Il en résulte que le SFM est considéré comme sous-diagnostiqué par certains tandis que d’autres considèrent qu’il est sur-diagnostiqué (Wolfe et Häuser, 2011

; Wolfe et coll., 2014

; Borchers et Gershwin, 2015

).
Concernant les facteurs de risque, la plupart des études sont transversales ou de type cas-témoins, ce qui ne permet pas de jugement de causalité. Il existe peu d’études prospectives et de méta-analyses portant sur un grand nombre d’études de bonne qualité méthodologique. De plus, l’étude des facteurs associés au SFM se heurte au manque de standardisation des outils diagnostiques et d’évaluation de la sévérité ou de l’intensité des facteurs de risque potentiels (par exemple abus sexuels ou traumatisme cervical).
Prévalence et incidence du syndrome fibromyalgique
Prévalence des douleurs chroniques étendues
Prévalence générale
La prévalence de la CWP (définie selon les critères ACR 1990) dans la population générale mondiale a été estimée par une méta-analyse de bonne qualité méthodologique de 25 études publiées entre 1990 et 2013 (Mansfield et coll., 2016

). La prévalence moyenne de la CWP est estimée à 10,6 % [IC 95 % 8,6-12,9] pour l’ensemble des études et à 11,8 % [IC 95 % 10,3-13,2] lorsque la méta-analyse est restreinte aux 6 études comportant le moins de biais méthodologiques (Mansfield et coll., 2016

). La mise à jour des données par une seconde méta-analyse des études publiées entre 1990 et 2017 donne une estimation de la prévalence de la CWP du même ordre : 9,6 % [IC 95 % 8,0-11,2] (Andrews et coll., 2018

).
Prévalence selon le genre
La prévalence de la CWP est plus élevée chez les femmes (prévalences moyennes comprises entre 3,5 et 20,7 %) que chez les hommes (prévalences moyennes comprises entre 1,8 et 14,0 %). Le ratio de prévalence femmes/hommes est compris entre 1,6 et 4,8 pour les 14 études ayant pris en compte le genre, la majorité des études rapportant une prévalence double chez les femmes (Mansfield et coll., 2016

).
Prévalence selon l’âge, les caractéristiques géographiques
et socio-économiques
L’âge est pris en compte par 14 études montrant pour la majorité une augmentation de la prévalence jusqu’à 40-50 ans pour atteindre des valeurs moyennes comprises entre 20 et 25 %. Au-delà de 40-50 ans, on observe soit une évolution en plateau, soit une poursuite de l’augmentation pour atteindre des valeurs supérieures à 30 % pour les classes d’âge les plus élevées (supérieures à 60-65 ans) (Mansfield et coll., 2016

; Andrews et coll., 2018

).
Il existe également des variations selon les caractéristiques géographiques : les prévalences, comprises entre 10 et 14 %, sont légèrement plus élevées en Europe qu’en Amérique du Nord ou dans d’autres régions, mais les estimations sont moins précises en dehors de l’Europe compte-tenu du faible nombre d’études de bonne qualité.
Enfin, la prévalence des CWP varie en fonction des caractéristiques socio-culturelles et socio-économiques des populations étudiées, avec des prévalences généralement plus élevées pour les catégories socio-culturelles et socio-économiques les moins favorisées (Mansfield et coll., 2016

; Andrews et coll., 2018

).
Prévalence du syndrome fibromyalgique
Prévalence générale
Des études conduites dans les années 1990-2000 estimaient la prévalence moyenne du SFM (identifié sur la base des critères ACR 1990) dans la population générale entre environ 2 et 4 % (Wolfe et coll., 1995

; Clauw et Crofford, 2003

; Gran, 2003

; Yunus, 2012

; Fitzcharles et coll., 2013b

; Wolfe et coll., 2013

; Borchers et Gershwin, 2015

). Des estimations plus récentes de prévalence du SFM, reposant majoritairement sur les critères ACR 1990, menées par méta-analyses conduisent de manière concordante à des valeurs comparables. Une méta-analyse récente a considéré 44 études publiées avant 2015 concernant plus de 3,6 millions de personnes recrutées dans la population générale ou des sous-populations spécifiques de plusieurs pays. Dans l’étude d’Heidari et coll. (2017

), la prévalence moyenne du SFM toutes populations et âges confondus était estimée à 1,78 % [1,65-1,92] (tableau 4.III

; Heidari et coll., 2017

). En raison de la sélection des patients, des valeurs nettement plus élevées étaient observées dans des sous-populations spécifiques, comme celles recrutées dans les services de rhumatologie ou de médecine interne (15,2 % [13,6-16,9]) ou des patients présentant une comorbidité telle qu’une colopathie fonctionnelle (12,9 % [12,7-13,1]), une insuffisance rénale requérant une hémodialyse (6,3 % [4,6-7,9]) ou un diabète de type 2 (14,8 % [11,1-18,4] ; Heidari et coll., 2017

). Une méta-analyse publiée en 2013 a estimé la prévalence mondiale toutes populations et âges confondus du SFM dans un même ordre de grandeur : 2,7 % (IC 95 % non calculé ; Queiroz, 2013

).
Tableau 4.III Prévalence du syndrome fibromyalgique en fonction du genre, de la zone géographique et des critères de diagnostic (d’après Heidari et coll., 2017 )
)
| |
Prévalence (%) [IC 95 %]
|
|
Genre
| |
|
Hommes
|
0,01 [-0,04-0,06]
|
|
Femmes
|
3,98 [2,79-5,17]
|
|
Zone géographique (OMS)
| |
|
Europe
|
2,64 [2,10-3,18]
|
|
Amériques
|
2,41 [1,69-3,13]
|
|
Pacifique
|
1,62 [1,00-2,24]
|
|
Méditerranée orientale
|
4,43 [-3,00-11,86]
|
|
Critères de diagnostic
| |
|
ACR
|
2,32 [1,85-2,79]
|
|
LFESSQ
|
2,94 [0,29-5,59]
|
|
FIQ
|
4,82 [3,63-6,00]
|
|
Interview
|
0,71 (0,59-0,84)
|
|
Physical examination
|
4,34 [2,74-5,94]
|
FIQ : Fibromyalgia Impact Questionnaire ; LFESSQ : London Fibromyalgia Epidemiology Study Screening Questionnaire (se reporter au chapitre « Critères diagnostiques, diagnostics différentiels, comorbidités et sous-groupes »).
La grande enquête épidémiologique américaine intitulée
National Health Interview Study (NHIS) 2012 a estimé la prévalence du SFM, identifié sur la base des critères ACR 2010 modifiés, à 1,75 % [1,42-2,07] (Walitt et coll., 2015

). Les estimations sont du même ordre de grandeur pour la population générale française. L’étude DEFI utilisant une procédure diagnostique multi-étape (questionnaire LFES-SQ et examen clinique mené par un rhumatologue) auprès d’un échantillon représentatif de foyers français a estimé la prévalence du SFM à 1,6 % [1,2-2,0] (Perrot et coll., 2011

). Une étude plus ancienne réalisée auprès d’un échantillon représentatif de 1 014 Français utilisant le questionnaire LFES-SQ à 4 ou 6 items complété par un examen clinique mené par un rhumatologue (critères ACR 1990) a estimé la prévalence française du SFM à 2,2 % [1,3-3,1] sur la base du questionnaire LFES-SQ à 4 items et à 1,4 % [0,7-0,7] sur la base du questionnaire LFES-SQ à 6 items (Bannwarth et coll., 2009

). Une étude similaire menée dans 5 pays européens estimait la prévalence du SFM pour l’ensemble des pays à 4,7 % [4,0-3,4] sur la base du questionnaire LFES-SQ à 4 items et à 2,9 % [2,4-3,4] sur la base du questionnaire LFES-SQ à 6 items (Branco et coll., 2010

). Comme le montre le tableau 4.IV

, la prévalence était systématiquement plus élevée chez les femmes, et il existait des variations en fonction de la zone géographique.
Les données des études conduites dans les années 2000 et 2010 ont confirmé les données des études des années 1990 en estimant la prévalence du SFM à environ 2 % de la population générale de la plupart des pays étudiés en utilisant dans la majorité des cas les critères de classification ACR de 1990 (tableau 4.IV

).
Tableau 4.IV Prévalences calculées du syndrome fibromyalgique
Cinq pays européens (Branco et coll., 2010  )
|
|
Population
|
Critères
|
Ensemble
(% [IC 95 %])
|
Hommes
(% [IC 95 %])
|
Femmes
(% [IC 95 %])
|
|
5 pays
|
LFESSQ-6
|
2,9 [2,4-3,4]
|
2,1 [2,0-2,2]
|
3,6 [3,5-3,7]
|
|
France
|
LFESSQ-6
|
1,4 [0,7-2,1]
|
0,7 [0,7-0,7]
|
2,0 [1,7-2,3]
|
|
Portugal
|
LFESSQ-6
|
3,6 [2,0-5,2]
|
1,8 [1,6-2,0]
|
5,2 [4,9-5,5]
|
|
Espagne
|
LFESSQ-6
|
2,3 [1,4-3,2]
|
1,3 [1,2-1,4]
|
3,3 [3,2-3,4]
|
|
Allemagne
|
LFESSQ-6
|
3,2 [2,1-4,3]
|
2,5 [2,4-2,6]
|
3,9 [3,7-4,1]
|
|
Italie
|
LFESSQ-6
|
3,7 [2,6-4,8]
|
1,6[1,5-1,7]
|
5,5 [5,3-5,7]
|
|
Population générale
|
|
Référence
|
Population
|
Population générale
(% [IC95 %])
|
Hommes
(% [IC95 %])
|
Femmes
(% [IC95 %])
|
Heidari et coll., 2017 
|
Mondiale
|
1,78 [1,65-1,92]*
|
-
|
3,98 [2,80-5,20]
|
Queiroz, 2013 
|
Mondiale
|
2,7*
|
1,4
|
4,1
|
Walitt et coll., 2015 
|
États-Unis
|
1,75 [1,42-2,07]†
|
1,06 [0,71-1,41]
|
2,38 [1,85-2,92]
|
Perrot et coll., 2011 
|
France
|
1,6 [1,2-2,0]‡
|
-
|
-
|
* Critères ACR 1990 majoritairement ; † ACR 2010 modifiés ; ‡ procédure diagnostique étagée.
Prévalence selon le genre
La plupart des séries cliniques de SFM portant sur des patients recrutés en milieu de soins montrent une prédominance féminine (Borchers et Gershwin, 2015

). Comme le montre l’étude de Jones et coll. décrite plus haut, le ratio femmes/hommes est plus élevé lorsque l’on utilise les critères de classification ACR 1990 (ratio F/H de 13,7/1) que les versions ultérieures (ratio F/H de 2,3-4,8/1 ; Jones et coll., 2015

).
Les enquêtes descriptives en population confirment l’existence d’une prévalence du SFM plus élevée chez les femmes. Cependant, le ratio femmes/hommes est généralement entre 2 et 4 (tableaux 4.IV

et 4.V

; Bannwarth et coll., 2009

; Queiroz, 2013

; Vincent et coll., 2013

; Walitt et coll., 2015

; Heidari et coll., 2017

). Ces ratios de prévalence selon le genre sont proches de ceux observés pour la CWP (Mansfield et coll., 2016

). La plus forte prévalence du SFM chez les femmes peut refléter des différences physiologiques, telles qu’une plus forte sensibilité à la pression cutanée (évoquée pour les études reposant sur les critères ACR 1990 ; Jones et coll., 2015

), mais aussi psychologiques et socio-culturelles, telles qu’une demande de soins plus aisément effectuée par les femmes ou une moindre tendance des médecins à diagnostiquer un SFM chez les hommes (voir pour revues Gran, 2003

; Borchers et Gershwin, 2015

). Compte tenu de la multiplicité des facteurs en cause, la prépondérance féminine observée dans les études de prévalence ne permet pas de conclure avec certitude à une prédisposition physiologique (Borchers et Gershwin, 2015

).
Tableau 4.V Ratio de prévalence femmes/hommes du syndrome fibromyalgique dans la population générale
|
Référence
|
Population
|
Ratio prévalence Femmes/Hommes
|
Heidari et coll., 2017 
|
Mondiale
|
> 4*
|
Queiroz, 2013 
|
Mondiale
|
2,9*
|
Walitt et coll., 2015 
|
États-Unis
|
2,2†
|
Branco et coll., 2010 
|
Europe
|
1,7‡
|
Bannwarth et coll., 2009 
|
France
|
2,9‡
|
* Critères ACR 1990 majoritairement ; † ACR 2010 modifiés ; ‡ LFESSQ-6.
Prévalence selon l’âge
Comme observé pour la CWP, la prévalence du SFM augmente avec l’âge pour atteindre un maximum selon les études soit pour les classes d’âge moyen (30-50 ans), soit après 50 ans (Gran, 2003

; Bannwarth et coll., 2009

; Branco et coll., 2010

; Queiroz, 2013

; Walitt et coll., 2015

). La plupart des études montrent que la prévalence du SFM est faible (≤ 1 %) chez les jeunes adultes (moins de 25-30 ans). Ainsi, l’enquête épidémiologique NIHS 2012 a montré une prévalence du SFM de moins de 1 % (0,8 %) chez les moins de 30 ans, une augmentation continue avec l’âge jusqu’à une valeur plateau de 2,4 % pour la classe d’âge 50-59 ans suivie d’une décroissance progressive jusqu’à 85 ans (Walitt et coll., 2015

). Par contre, si l’étude du SFM dans 5 pays européens montrait une prévalence globale inférieure à 1 % pour les moins de 25 ans, elle observait une augmentation progressive de la prévalence jusqu’à 8 % pour la classe d’âge 75-84 ans, cette augmentation continue avec l’âge étant observée pour les deux sexes (Branco et coll., 2010

). Certaines études n’ont pas observé d’augmentation de la prévalence de la FM avec l’âge, sans que les auteurs n’apportent d’explications autres que méthodologiques à cette différence (Perrot et coll., 2011

).
Incidence du syndrome fibromyalgique
Très peu de données d’incidence du SFM sont disponibles dans la littérature (Borchers et Gershwin, 2015

; Heidari et coll., 2017

). L’incidence du SFM défini par les critères ACR 1990 a été estimée à 580 nouveaux cas pour 100 000 personnes par année en 1995 dans une population féminine norvégienne (Forseth et coll., 1997

). L’étude des bases de données d’assurance américaines de bonne qualité méthodologique a permis d’estimer, à l’aide des codes CIM-10, l’incidence du SFM au sein d’une cohorte rétrospective de grande taille (151 344 hommes et 154 822 femmes) à respectivement 688 et 1 128 nouveaux cas pour 100 000 personnes par année chez les hommes et les femmes (Weir et coll., 2006

). Le risque de développer un SFM chez les femmes était 1,64 fois plus élevé (1,59-1,69) que chez les hommes. L’incidence du SFM augmentait avec l’âge pour les deux sexes avant d’atteindre un plateau à partir de 40 ans chez les hommes (environ 1 200 cas pour 100 000 entre 40 et 65 ans) et 45 ans chez les femmes (environ 2 100 cas pour 100 000 entre 40 et 65 ans).
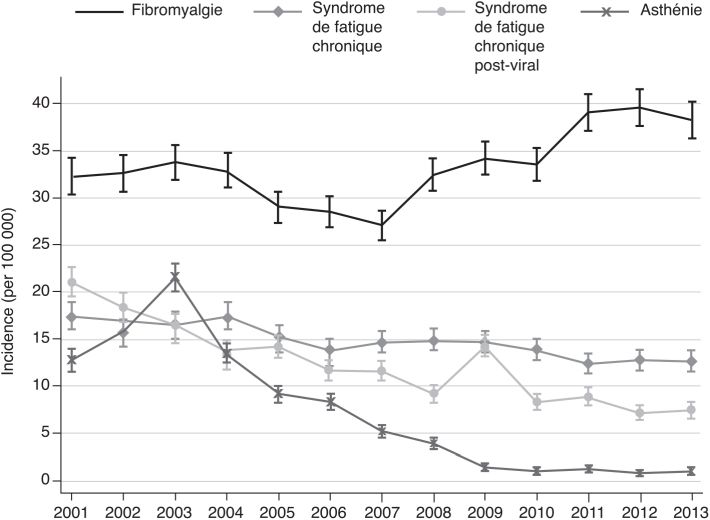
L’étude des bases de données médico-administratives de soins primaires du système de santé britannique (NHS) pour la période 2001-2013 a montré une incidence moyenne du SFM plus faible que les précédentes en Grande-Bretagne : 33,3 (32,8-33,8) SFM pour 100 000 personnes (Collin et coll., 2017

) (figure 4.1

). L’incidence du SFM pour 100 000 personnes a globalement augmenté au cours de la période 2001–2011, passant de 32,3 (30,4-34,3) en 2001 à 38,2 (36,3-40,1) en 2013. Les femmes britanniques avaient une incidence 6 fois plus élevée que celle des hommes, avec un pic observé pour la classe d’âge 40-49 ans (Collin et coll., 2017

).
Comorbidités et facteurs associés au syndrome fibromyalgique
Le SFM est par définition caractérisé par des symptômes chroniques, d’intensité modérée à sévère, incluant des douleurs diffuses associées à de la fatigue, des troubles du sommeil, des troubles cognitifs et de nombreuses plaintes somatiques (Fitzcharles et coll., 2013b

; Wolfe et coll., 2016

). Ces symptômes sont distribués selon un continuum allant de peu à beaucoup et de léger à sévère au sein de la population générale, le SFM représentant pour certains le versant « sévère » de ce continuum (Arnold et coll., 2016

).
Les symptômes caractéristiques du SFM peuvent s’accompagner de nombreuses manifestations fonctionnelles concomitantes et de comorbidités. Celles-ci peuvent être considérées comme des pathologies de chevauchement, des pathologies associées ou des variantes phénotypiques du SFM selon les cas, traduisant le caractère polymorphe du SFM (figure 4.2

) (Borchers et Gershwin, 2015

; Arnold et coll., 2016

; Perrot et coll., 2017

; Fitzcharles et coll., 2018

). Les comorbidités sont importantes à prendre en compte en raison de leur impact parfois important sur la qualité de vie et le pronostic fonctionnel du SFM, et de la possibilité voire la nécessité suivant leur sévérité, pour certaines comorbidités, de les traiter spécifiquement.
Le SFM est une affection multifactorielle dont les mécanismes physiopathologiques restent méconnus même si des hypothèse émergent (voir chapitre « Neurobiologie de la douleur chronique dans la fibromyalgie et biomarqueurs ») (Clauw et coll., 2018

). Il est souvent fait état dans la littérature de facteurs de risque de SFM sans qu’il soit toujours possible de généraliser les résultats à l’ensemble du SFM compte tenu du caractère hétérogène de sa présentation clinique, de son association avec des comorbidités et probablement de ses facteurs de risque (Borchers et Gershwin, 2015

). La complexité et la variabilité de l’expression phénotypique du SFM suggèrent l’existence de nombreux déterminants, qu’ils soient biologiques, psychologiques ou sociaux, dont certains seraient plus marqués dans tel ou tel sous-groupe de patients. De nombreux facteurs de risque ne sont pas spécifiques du SFM mais s’observent dans la plupart des syndromes douloureux chroniques, tels que les lombalgies ou la CWP, cette dernière présentant de nombreuses caractéristiques communes avec le SFM (Borchers et Gershwin, 2015

).
Les études épidémiologiques sur le SFM sont le plus souvent transversales ou de type cas-témoins et souffrent pour la plupart de biais de sélection comme souligné au début de ce chapitre. Il existe peu d’études épidémiologiques prospectives de bonne qualité méthodologique sur le SFM. En conséquence, les études incluses dans les méta-analyses sont en nombre limité et fortement hétérogènes, ce qui limite la portée des résultats. Le terme de facteurs de risque est souvent impropre compte tenu du design des études publiées sur le SFM, qui ne permet pas de jugement de causalité ni même de prendre en considération la chronologie entre l’exposition aux facteurs considérés et l’apparition ou l’aggravation du SFM. Il peut s’agir de facteurs prédisposants qui augmentent la probabilité de survenue du SFM, de facteurs précipitants ou déclenchants, et de facteurs d’entretien ou encore de sévérité. On parlera par conséquent ici de facteurs associés au SFM plutôt que de facteurs de risque ou de facteurs étiologiques (Wolfe et coll., 2014

). D’une manière générale, les données de la littérature suggèrent l’existence de sous-groupes de patients souffrant de SFM associés à des comorbidités (par exemple troubles psychiatriques, cervicalgies) ou à des facteurs « spécifiques » à certains sous-groupes (abus sexuels dans l’enfance ou traumatisme cervical par exemple) plutôt que communs à l’ensemble des patients.
Symptômes fibromyalgiques, comorbidités
Troubles du sommeil
La majorité des patients (entre 70 et plus de 90 %) atteints d’un SFM rapportent l’existence de troubles du sommeil (Wolfe et coll., 1990

; Neumann et Buskila, 2003

; Borchers et Gershwin, 2015

; Wu et coll., 2017

) (voir aussi chapitre « Perturbations du sommeil et troubles psychiatriques dans le syndrome fibromyalgique »). Une méta-analyse récente (Wu et coll., 2017

) ayant inclus 25 études cas-témoins portant sur 2 086 personnes, confirme l’importance des troubles du sommeil dans le SFM, et ce quelle que soit la méthode d’analyse du sommeil utilisée (polysomnographie, questionnaire de qualité du sommeil...). Les résultats concernant l’association entre SFM et apnée du sommeil étaient discordants, certaines études rapportant des prévalences élevées (> 20 %) et d’autres faibles (< 5 %, tableau 4.VI

, Fitzcharles et coll., 2018

).
Une étude prospective norvégienne en population active (HUNT2, 1995–97 et HUNT3, 2006–08) portant sur 24 715 personnes a montré que l’insomnie est associée à un risque accru de SFM 11 ans après l’inclusion avec un rapport des chances (
odds ratio ou OR) de 2,05 (IC 95 % : 1,51–2,79) (Sivertsen et coll., 2014

). Cependant, il existe probablement une relation bidirectionnelle entre SFM et troubles du sommeil, car si la douleur majore les troubles du sommeil, les troubles du sommeil peuvent aggraver la symptomatologie douloureuse au cours du SFM, comme cela est observé pour la CWP (Borchers et Gershwin, 2015

; Choy, 2015

; Andrade et coll., 2018

).
Tableau 4.VI Prévalence de fibromyalgie chez des patients avec troubles du sommeil, de l’humeur ou psychiatriques (dépression ; d’après Fitzcharles et coll., 2018 )
)
|
Référence
|
Pays
|
Troubles
|
Fréquence SFM en pourcentage (critères)
|
|
Troubles du sommeil
| | | |
Donald et coll., 1996 
|
Canada
|
Troubles
|
2,7 (ACR 1990)
|
Germanowicz et coll., 2006 
|
Brésil
|
Apnées du sommeil
|
22 (ACR 1990)
|
Plantamura et coll., 1995 
|
France
|
Apnée du sommeil
Sommeil pauvre sans apnée du sommeil
Pas de troubles de sommeil
|
3,4 (ACR 1990)
4,7 (ACR 1990)
3,2 (ACR 1990)
|
|
Troubles psychologiques ou psychiatriques
| | | |
Amir et coll., 1997 
|
Israël
|
Trouble de stress post-traumatique
|
21 (ACR 2010)
|
Arnson et coll., 2007 
|
Israël
|
Trouble de stress post-traumatique
|
10 (ACR 1990)
|
Häuser et coll., 2010  
|
Allemagne
|
Troubles dépressifs
|
38 (questionnaire d’auto-évaluation)
|
Vishne et coll., 2008 
|
Israël
|
Dépression majeure
|
26 (ACR 1990)
|
Troubles de l’humeur et troubles psychiatriques
La douleur peut être associée à des troubles de l’humeur et une plus grande sensibilité aux stress d’origine psychologique dans le SFM (tableau 4.VI

) (voir aussi chapitre « Perturbations du sommeil et troubles psychiatriques dans le syndrome fibromyalgique »). Ceci est confirmé par de nombreuses études rapportant la coexistence du SFM avec des états de stress post-traumatiques chroniques, des troubles psychologiques et de santé mentale de type anxiété ou dépression (Thieme et coll., 2004

; Häuser et coll., 2013

; Cuevas-Toro et coll., 2014

; Brown et coll., 2016

; Bondesson et coll., 2018

). Néanmoins, la forte prévalence de comorbidités psychiatriques chez les patients atteints de SFM s’observe plus dans les études en milieu de soins qu’en population, ce qui peut s’expliquer par des phénomènes de sélection (Raphael et coll., 2006

).
De nombreuses études montrent une fréquence élevée de troubles anxio-dépressifs chez les patients atteints de SFM (prévalences comprises entre 28 et 70 %) (Kurtze et Svebak, 2001

; Thieme et coll., 2004

; Arnold et coll., 2006

; Fuller-Thomson et coll., 2011

; Häuser et coll., 2013

; Cuevas-Toro et coll., 2014

; Brown et coll., 2016

; Bondesson et coll., 2018

). Cependant, d’autres études ont observé des prévalences comparables à ce qui est observé dans d’autres pathologies, comme la polyarthrite rhumatoïde (PR) (Borchers et Gershwin, 2015

). De plus, les résultats divergent selon le lieu de recrutement des personnes souffrant de SFM et l’existence de phénomènes de sélection des patients sur leur état de santé, mais aussi du fait de l’hétérogénéité du SFM (Thieme et coll., 2004

; Raphael et coll., 2006

).
Il existe de nombreux points communs entre dépression et SFM. Cependant, si la possibilité de liens bidirectionnels entre dépression et SFM n’est pas exclue (Chang et coll., 2015

; Bondesson et coll., 2018

), il est probable que, comme pour la douleur chronique, il existe plusieurs sous-groupes de SFM (Thieme et coll., 2004

; Borchers et Gershwin, 2015

). Les plus importants, en termes de nombre de patients, sont probablement les sous-groupes associés à une dépression probablement plutôt réactionnelle à la douleur, insomnie, etc. que primitive, une dépression caractérisée pouvant conduire à une amplification des symptômes fibromyalgiques (Jain et coll., 2003

; Borchers et Gershwin, 2015

; Gota et coll., 2017

).
Une association entre SFM et troubles bipolaires est évoquée par plusieurs études (Gota et coll., 2017

). Ainsi, la méta-analyse de 8 études de qualité variable a montré que la prévalence des troubles bipolaires dans le SFM était voisine de 20 % mais avec de larges variations selon les études (0-70 %). Sur la base de 4 études cas-témoins portant sur 268 patients SFM et 413 témoins, il existait une association forte entre troubles bipolaires et SFM (OR égal à 7,6 [3,9-14,6]) (Kudlow et coll., 2015

).
Comorbidités rhumatologiques
Elles concerneraient 20 à 30 % des patients souffrant d’un SFM (tableau 4.VII

) (Wolfe et coll., 1990

; Duffield et coll., 2018

; Fitzcharles et coll., 2018

). Au sein de la cohorte de la
National American Database incluant 6 000 patients, un SFM était présent chez 21 % des patients ayant un diagnostic de PR et 17 % ayant un diagnostic d’arthrose (Wolfe et coll., 2011

; Fitzcharles et coll., 2018

). Des chiffres similaires de comorbidité rhumatologique ont été observés chez des patients français, avec une prévalence de SFM comprise entre 19 et 22 % pour les patients souffrant de PR dans une étude conduite dans quatre hôpitaux universitaires en utilisant comme critère de classification le questionnaire FiRST, les critères ACR 1990 ou ACR modifiés 2010 (2011) (Perrot et coll., 2017

). Selon une méta-analyse récente de 40 articles, la prévalence du SFM dans les PR serait comprise entre 4,9 et 52,4 % avec une prévalence moyenne pondérée de 20 %. Elle serait comprise entre 9,6 et 27,2 % (moyenne pondérée de 13 %) dans la spondylarthrite ankylosante et entre 4,1 et 25,2 % (moyenne pondérée de 13 %) dans le rhumatisme psoriasique (Duffield et coll., 2018

). Ces formes associées sont plus actives et plus invalidantes pour le patient (Brikman et coll., 2016

; Perrot et coll., 2017

; Duffield et coll., 2018

; Fitzcharles et coll., 2018

).
Tableau 4.VII Prévalence de fibromyalgie chez des patients avec pathologies rhumatologiques (d’après Fitzcharles et coll., 2018 )
)
|
Référence
|
Pays
|
Pathologie
|
Fréquence de SFM (%, critères)
|
Brummett et coll., 2015 
|
États-Unis
|
Ostéoarthrite
|
6 (ACR 2011)
|
Curtis et coll., 2017 
|
États-Unis
|
Polyarthrite rhumatoïde
|
43 (phénotype « somatisation »)
|
Fan et coll., 2017 
|
France
|
Polyarthrite rhumatoïde
|
5/8 (rhumatologue/ACR 1990)
|
| | |
Spondyloarthrite axiale
|
11/18 (rhumatologue/ACR 1990)
|
| | |
Maladie du tissu conjonctif
|
11/28 (rhumatologue/ACR 1990)
|
Haliloglu et coll., 2014 
|
Turquie
|
Polyarthrite rhumatoïde
|
7 (ACR 1990)
|
| | |
Lupus systémique érythémateux
|
13 (ACR 1990)
|
| | |
Spondylosis ankylosante
|
13 (ACR 1990)
|
| | |
Ostéoarthrite
|
10 (ACR 1990)
|
| | |
Maladie du tissu conjonctif
|
6-25 (ACR 1990)
|
Moltó et coll., 2018 
|
France
|
Spondyloarthrite axiale
|
38 (FiRST)/16 (ACR 1990)
|
Perrot et coll., 2017 
|
France
|
Polyarthrite rhumatoïde
|
23 (FiRST)/22 (ACR 1990)/19 (ACR 2011)
|
| | |
Sclérodermie
|
28 (FiRST)/30 (ACR 1990)/24 (ACR 2011)
|
Viniol et coll., 2013 
|
Allemagne
|
Lombalgie chronique
|
25 (critères CWP)
|
Le SFM est également fréquemment associé à des rhumatismes non inflammatoires, tels que l’arthrose, ou des troubles musculo-squelettiques tels que les cervicalgies ou les lombalgies chroniques ou encore une hyperlaxité articulaire (Sendur et coll., 2007

; Cakit et coll., 2010

; Fitzcharles et coll., 2018

). Des associations entre SFM et lupus érythémateux disséminé (LED), sclérodermie et syndrome de Gougerot-Sjögren sont également fréquentes (Wolfe et coll., 2009

; Wolfe et coll., 2011

; Yunus, 2012

; Perrot et coll., 2017

; Fitzcharles et coll., 2018

). Selon une étude française, la prévalence du SFM serait comprise entre 24 et 30 % chez les patients avec sclérodermie (n = 122) (Perrot et coll., 2017

).
Comorbidités neurologiques
Les données épidémiologiques sur les comorbidités neurologiques sont plus rares, qu’il s’agisse de la sclérose en plaques, des séquelles de poliomyélite, ou de douleurs neuropathiques (tableau 4.VIII

; Rehm et coll., 2010

; Koroschetz et coll., 2011

; Clemenzi et coll., 2014

). Une étude de la population canadienne de bonne qualité méthodologique a montré une prévalence du SFM double dans la population atteinte de sclérose en plaques comparée à la population générale : 6,82 % (IC 95 % : 5,91-7,72)
vs 3,04 % (IC 95 % : 2,77-3,32). Après ajustement sur l’âge, le sexe et l’année, l’incidence du SFM était plus élevée de 44 % en cas de sclérose en plaques (ratio d’incidence : 1,44 (IC 95 % : 1,01-2,07) (Marrie et coll., 2012

).
Tableau 4.VIII Prévalence de fibromyalgie chez des patients avec pathologies neurologiques, gastro-intestinales, douloureuses chroniques, endocriniennes, cardiaques ou autres (d’après Fitzcharles et coll., 2018 )
)
|
Référence
|
Pays
|
Comorbidité
|
Fréquence de SFM en pour cent (critères)
|
|
Pathologies neurologiques
|
Trojan et Cashman, 1995 
|
Canada
|
Syndrome post-polio
|
10 (ACR 1990)
|
Marrie et coll., 2012 
|
Canada
|
Sclérose en plaques
|
7*
|
Yilmaz et coll., 2015 
|
États-Unis
|
Neuropathie héréditaire sensible à la pression
|
28 (ACR 1990)
|
|
Pathologies gastro-intestinales
|
Barton et coll., 1999 
|
Royaume-Uni
|
Syndrome de l’intestin irritable vs contrôle
|
25 vs 11 (ACR 1990)
|
|
Buskila et coll., 1999
|
Israël
|
Colite ulcéreuse
|
19
|
| | |
Maladie de Crohn
|
40
|
Erbasan et coll., 2017 
|
Pakistan
|
Syndrome de l’intestin irritable
|
16,9 (ACR 2010)
|
Lubrano et coll., 2001 
|
Italie
|
Syndrome de l’intestin irritable
|
20 (ACR 1990)
|
|
Douleurs chroniques
|
Cho et coll., 2017 
|
États-Unis
|
Migraine chronique
|
27,7 (ACR 2010)
|
| | |
Céphalées de tension
|
66,9 (ACR 2010)
|
Fan et coll., 2014 
|
Taïwan
|
Cystite interstitielle et syndrome de la vessie hypersensible
|
23,5 (ACR 1990)
|
|
Pathologies endocriniennes
|
Dias et coll., 2017 
| |
Obésité
|
34 (ACR 1990), 45 (ACR 2011)
|
Haliloglu et coll., 2017 
|
Turquie
|
Thyroïdites
|
62 (ACR 2010)
|
|
Autres
|
Bartin et coll., 2017 
|
États-Unis
|
Immunodéficit primaire
|
20 (ACR 1990 ou 2010)
|
Gist et coll., 2017 
|
Australie
|
Pathologie cardiaque
|
23 (ACR 2011)
|
* 3 % dans la population générale
Pathologies gastro-intestinales
Elles peuvent être associées avec un SFM, notamment la maladie cœliaque (García-Leiva et coll., 2015

; Fitzcharles et coll., 2018

). Une étude italienne a ainsi montré une prévalence élevée du SFM (11,4 %) et de la CWP (14,9 %) chez des patients (n = 114) recrutés dans un service de gastro-entérologie spécialisé (Tovoli et coll., 2013

). Les colopathies fonctionnelles représentent une pathologie de chevauchement (Weir et coll., 2006

; Jeffery et coll., 2014

). Des prévalences très élevées, comprises entre 15 et 32 % ont été rapportées chez les patients avec FM (Fitzcharles et coll., 2018

). Par contre, les résultats concernant les maladies inflammatoires du colon sont discordants, certaines études rapportant des prévalences élevée (30 %) et d’autres non (3,5 %) chez les patients atteints de SFM (tableau 4.VIII

; Fitzcharles et coll., 2018

).
Douleurs chroniques autres
Le SFM est fréquemment associé à des troubles fonctionnels douloureux autres que des douleurs diffuses, tels que les céphalées et les migraines (prévalences du SFM allant de 20 à 65 % ; Gran, 2003

; Neumann et Buskila, 2003

; de Tommaso et coll., 2009

, 2011

; Yunus, 2012

; Küçükşen et coll., 2013

; Cho et coll., 2017

), les douleurs temporo-mandibulaires (prévalences du SFM allant de 13 à 50 % ; Balasubramaniam et coll., 2007

; Yunus, 2012

; Fitzcharles et coll., 2018

), le syndrome des jambes sans repos (prévalence de 30 à 50 % dans le SFM ; Stehlik et coll., 2009

; Yunus, 2012

; Civelek et coll., 2014

; Fitzcharles et coll., 2018

) ou les syndromes fonctionnels urogénitaux (syndrome de la vessie irritable avec des prévalences du SFM allant de 12 à 20 %, vulvodynies ; Yunus, 2012

; Chung et coll., 2013

; Fitzcharles et coll., 2018

).
Comorbidités endocriniennes ou cardiaques
Ces comorbidités sont également fréquentes comme le montre le tableau 4.VIII

. C’est notamment le cas pour les affections thyroïdiennes, qui peuvent représenter des pathologies de chevauchement, telles que les thyroïdites auto-immunes et les hyper-parathyroïdies (Bazzichi et coll., 2007

; Costa et coll., 2016

; Haliloglu et coll., 2017

). Plusieurs études ont montré une prévalence élevée du SFM en cas de diabète de type 1 ou de type 2 (comprise entre 17 et 18 %) (Tishler et coll., 2003

; Yanmaz et coll., 2011

; Okifuji et Hare, 2015

; Kaleth et coll., 2017

).
Des comorbidités cardiovasculaires (hypertension artérielle, cardiopathies ischémiques) ont été mises en évidence de manière inconstante dans la littérature (tableau 4.VIII

) (Su et coll., 2015

; Tsai et coll., 2015

; Fitzcharles et coll., 2018

).
Fibromyalgie, surpoids et obésité
L’obésité est associée à un risque accru de douleur chronique, qu’il s’agisse de douleurs localisées ou de CWP, ainsi qu’à un risque accru de sévérité des symptômes et d’altération de la qualité de vie (Kim et coll., 2012

; Arreghini et coll., 2014

; Okifuji et Hare, 2015

; Koçyiğit et Okyay, 2018

). Les études concernant les liens entre l’indice de masse corporelle et le SFM ont confirmé ces données. Ainsi, l’étude de Yunus et coll. a montré que plus de 60 % des femmes atteintes de SFM présentaient un surpoids et 32 % une obésité (Yunus et coll., 2002

). Une étude de 100 patientes avec FM tirées au sort parmi 550 patientes recrutées dans une clinique rhumatologique israélienne a observé une prévalence élevée de surpoids (28 %) et d’obésité (45 % ; Neumann et coll., 2008

). La sévérité des symptômes (questionnaire FIQ) et l’impact sur la qualité de vie (questionnaire SF36) est plus élevée pour les femmes atteintes de SFM obèses. La prévalence du SFM est très élevée chez les patients obèses : 34 à 45 % chez des patients recrutés dans un centre de chirurgie bariatrique (Dias
et al., 2017

). Globalement, les études de prévalence montrent que 32 à 50 % des patients avec SFM sont obèses, 21 à 28 % sont en surpoids, et qu’il y a une plus forte sévérité des symptômes en cas d’obésité (Okifuji et coll., 2009

; Okifuji et coll., 2010

).
Une étude prospective norvégienne de bonne qualité méthodologique portant sur 15 990 femmes indemnes de SFM a montré un risque accru de 60-70 % de SFM au suivi à 11 ans en cas d’obésité (Mork et coll., 2010

). Cette étude montre un risque accru de SFM lorsque le surpoids était associé à une absence ou un manque d’activités physiques régulières. Bien que leur mise en pratique soit parfois difficile chez les patients (Arnold et Clauw, 2017

), la pratique régulière d’activité physique adaptée et la lutte contre le surpoids sont recommandées dans la FM comme dans les autres formes de douleurs chroniques par de nombreux auteurs et sociétés savantes (Häuser et coll., 2010


; Mork et coll., 2010

; Fitzcharles et coll., 2013a

; Borchers et Gershwin, 2015

; Ericsson et coll., 2016

; Bidonde et coll., 2017

; Macfarlane et coll., 2017

; voir chapitre « Activités physiques et thérapie multidisciplinaire dans le syndrome fibromyalgique »).
Concomitance ou comorbidités ?
Une concomitance du SFM est observée avec de nombreuses pathologies chroniques, avec une prévalence variable selon les pathologies, mais aussi pour une même pathologie selon les études. Cette variabilité traduit non seulement la grande hétérogénéité du SFM, mais reflète aussi des modalités différentes de recrutement de patients souffrant de SFM en soins primaires ou dans des centres spécialisés en rhumatologie, médecine interne ou pour le traitement de la douleur.
De grandes études en population permettant de limiter ces phénomènes de sélection ont confirmé la prévalence élevée des comorbidités dans le SFM. Ainsi, la NHIS 2012 a montré chez les patients avec SFM une prévalence élevée (par rapport à la population générale) de PR (15,3 %), de lupus érythémateux disséminé (1,4 %), de lombalgies (21,7 %), mais aussi de dépression (5,8 %), de « phobies » (8,3 %), de troubles bipolaires (9,0 %) et de troubles psychiatriques divers (10,4 %, tableau 4.IX

, Walitt et coll., 2015

). Il en est de même pour le diabète (23,3 %), l’hypertension artérielle (2,7 %) et les cardiopathies ischémiques (4,5 %).
Tableau 4.IX Prévalence de 10 comorbidités rapportées le plus fréquemment dans la fibromyalgie aux États-Unis dans les données issues de la 2012 National Health Interview Survey (d’après Walitt et coll., 2015 )
)
|
Comorbidité
|
Pourcentage dans la population/FM
|
Prévalence dans la FM
|
OR (IC 95 %)
|
|
Infarctus du myocarde
|
2,9/8,6
|
4,47
|
2,88 (1,31-3,64)
|
|
Pathologie hépatique
|
1,1/6,1
|
7,43
|
5,07 (2,11-12,21)
|
|
Pathologies rénales
|
1,6/6,8
|
6,23
|
4,16 (1,97-8,81)
|
|
Ulcère de l’estomac
|
6,46/26,2
|
5,38
|
4,15 (2,59-6,66)
|
|
Polyarthrite rhumatoïde
|
2,3/15,3
|
7,72
|
5,73 (3,25-10,12)
|
|
Migraine
|
14,2/56,2
|
6,26
|
7,68 (4,70-12,53)
|
|
Dépression
|
14,2/62,7
|
5,84
|
7,9 (4,94-12,65)
|
|
Phobies
|
5,3/32,9
|
8,32
|
7,62 (4,84-11,99
|
|
Troubles bipolaires
|
2,5/17,1
|
9,01
|
7,03 (3,21-15,39)
|
|
Autres troubles psychiatriques
|
4,0/26,6
|
10,35
|
9,40 (5,39-16,41)
|
Facteurs associés au syndrome fibromyalgique
Facteurs socio-économiques et culturels
Outre les variations de la prévalence du SFM liées à l’âge et au genre détaillées plus haut, on observe une variation de sa prévalence en fonction des zones géographiques, mais aussi des catégories socio-culturelles et socio-économiques des populations étudiées (Assumpção et coll., 2009

; Branco et coll., 2010

; Queiroz, 2013

; Heidari et coll., 2017

). D’une manière générale, il existe des résultats concordants en faveur d’une plus forte prévalence du SFM dans les populations économiquement défavorisées et moins éduquées (Henriksson et coll., 2005

; Mas et coll., 2008

; Queiroz, 2013

). L’enquête NHIS 2012 a ainsi montré que le risque de souffrir d’un SFM varie selon la catégorie socio-professionnelle évaluée par le niveau de diplôme : elle est presque triple pour les personnes dotées d’un faible diplôme initial par rapport aux personnes plus éduquées (Walitt et coll., 2015

).
Peu d’études utilisent des méthodologies similaires permettant de comparer la prévalence du SFM entre groupes géographiques ou ethniques (Borchers et Gershwin, 2015

). C’est pourquoi, la plus forte prévalence du SFM en Europe et aux États-Unis que dans des pays ou zones géographiques d’Europe centrale, du Moyen-Orient ou de l’Asie rapportée est difficile à interpréter en termes socio-culturels ou de différences de développement socio-économiques entre les pays.
Facteurs génétiques et environnementaux
Un grand nombre de travaux ont exploré le rôle des facteurs familiaux, qu’ils soient génétiques ou liés à l’environnement familial et social (facteurs dits environnementaux), dans la survenue du SFM. D’une manière générale, la plupart des études souffrent des mêmes limites méthodologiques que les études de prévalence, notamment celles liées aux critères de classification/diagnostic utilisés, à la taille de la population étudiée et parfois aux facteurs associés investigués (traumatismes dans l’enfance).
L’existence d’une prévalence élevée de SFM dans certaines familles (appelée « agrégat de cas ») pose la question d’une prédisposition génétique, d’une exposition environnementale ou comportementale familiale commune (Ablin et Buskila, 2015

; Borchers et Gershwin, 2015

). Une étude américaine de l’agrégation familiale du SFM a été réalisée auprès des proches au 1
er degré ou plus de 78 patients souffrant de SFM (533 proches) et de 40 patients souffrant de PR (272 proches) pris comme témoins. Elle a montré l’existence d’un risque 8,5 fois plus élevé (risque relatif RR de 8,5 [IC 95 % 2,8-28]) d’avoir la même pathologie que son proche pour le SFM comparé à la PR. Ces données plaident en faveur d’une agrégation familiale du SFM sans qu’il soit possible de faire la part de ce qui relève de la prédisposition génétique et d’une exposition commune à des facteurs familiaux ou sociaux prédisposants (Arnold et coll., 2004

).
Des études de cohortes de jumeaux ont tenté de distinguer la part des facteurs génétiques et des facteurs environnementaux dans l’agrégation familiale du SFM (ou de la CWP) et de ses symptômes/comorbidités en comparant leur fréquence de survenue chez des jumeaux monozygotes et dizygotes
5
Les jumeaux monozygotes ont le même patrimoine génétique contrairement aux jumeaux dizygotes. Les comparaisons de jumeaux aident à déterminer les rôles respectifs de l’environnement et de la génétique dans le trait étudié comme une susceptibilité à développer une pathologie donnée.
. Une étude basée sur le registre des jumeaux suédois âgés de plus de 42 ans (
Swedish Twin registry, n = 44 897) a par exemple étudié la prévalence de la CWP et des symptômes associés entre jumeaux monozygotes (4 170)
versus dizygotes (5 881 de même sexe et 5 755 de sexe différent). Dans cette cohorte, la prévalence de la CWP, évaluée selon les critères ACR 1990 de classification du SFM (à l’exclusion du comptage des points douloureux et d’une évaluation par un clinicien) par interview téléphonique assisté par ordinateur (CATI), était de 4,1 %, avec un ratio femmes/hommes de 3,3 pour 1 (Kato et coll., 2006

). Ils ont ainsi montré l’influence mixte de facteurs génétiques et environnementaux, qui reste complexe à évaluer car plus ou moins importante selon le symptôme/la comorbidité évaluée. Par exemple, une influence de facteurs génétiques, non identifiés, semble importante pour la survenue de troubles de l’humeur ou de troubles psychiatriques, et non significative pour d’autres symptômes comme la fatigue ou des migraines (Kato et coll., 2006

).
Une étude similaire de jumeaux a été menée en Finlande (
Finnish Twin Cohort, n = 12 502) sur des personnes d’âge actif nées entre 1930 et 1957 (Markkula et coll., 2009

). Les résultats sont basés sur le suivi de 10 608 jumeaux et de 49 patients témoins avec un diagnostic de SFM ayant répondu à un même questionnaire. Une analyse en classes latentes a permis de mettre en évidence des groupes cliniques homogènes de jumeaux en fonction des symptômes fibromyalgiques présents, alors que des analyses par paire de jumeaux ont permis de tester l’influence de facteurs génétiques sur la survenue de ces symptômes. La prévalence estimée du SFM était comparable pour les jumeaux des deux sexes (12 % des hommes et 13 % des femmes). Selon cette étude, l’influence de facteurs génétiques dans la survenue du SFM était élevée (51 % [IC 95 % 45-56 %]). Néanmoins, l’exposition aux facteurs environnementaux familiaux au cours et après le développement n’était pas strictement contrôlée dans cette étude. L’analyse secondaire des données pour les 8 343 personnes ayant répondu aux questionnaires en 1975, 1981 et 1990 a montré que des facteurs prédictifs de la survenue d’un SFM au sein de cette cohorte étaient l’existence de fréquents maux de tête, de lombalgies et de cervicalgies chroniques (Markkula et coll., 2016

).
L’existence d’une héritabilité
6
Probabilité pour qu’un trait étudié soit hérité, c’est-à-dire sous l’influence de facteurs génétiques dans sa survenue.
des symptômes n’est pas spécifique de la SFM et a été observée pour d’autres douleurs chroniques, comme les cervicalgies et les lombalgies (Holliday et McBeth, 2011

). Certains facteurs potentiellement prédisposants au SFM, comme l’obésité, les symptômes fonctionnels (céphalées, colopathies fonctionnelles...) ou les douleurs chroniques, peuvent également être partiellement dépendants de facteurs génétiques dans leur survenue. C’est pourquoi, si les études de jumeaux suggèrent l’influence d’une composante génétique dans le SFM, l’héritabilité observée du SFM peut également s’expliquer – au moins pour partie – par des facteurs environnementaux qui joueraient le rôle de tiers facteurs (Markkula et coll., 2016

; Stone et Wilson, 2016

).
Devant l’hypothèse d’une composante génétique dans le SFM, des études dites « gènes candidats » ont recherché des associations entre le SFM (ou CWP) via l’étude de polymorphismes de gènes impliqués dans des mécanismes potentiellement en cause dans leur survenue (Holliday et McBeth, 2011

). Il s’agit le plus souvent d’études de faible puissance statistique comparant la fréquence d’un polymorphisme génétique de type
Single Nucleotide Polymorphism (SNP) d’intérêt entre des cas et des témoins, ce qui expose à un biais de sélection des populations étudiées (Holliday et McBeth, 2011

).
La plupart des gènes candidats étudiés concernent des gènes impliqués dans la douleur chronique et notamment dans les voies adrénergiques, dopaminergiques et sérotoninergiques, tels que le gène COMT codant la catéchol-O-méthyltransferase, le gène ADRB2 codant les récepteurs β2 adrénergiques, le gène OPRM1 codant les récepteurs µ-opioïdes ou encore le gène GCH1 codant les GTP cyclohydrolases. D’autres gènes candidats, comme le gène SCN9A codant le canal sodique sensible au voltage Nav1.7 exprimé dans les ganglions spinaux, ont également été étudiés pour déterminer s’ils étaient associés aux SFM. Ces études ont abouti à des résultats divergents, comme indiqué dans le chapitre « Neurobiologie de la douleur chronique dans la fibromyalgie et biomarqueurs ».
Plusieurs méta-analyses récentes montrent des associations entre SFM et certains gènes candidats, mais on observe des résultats différents en fonction des populations étudiées et des gènes candidats analysés, divergence due à la qualité et la puissance statistique des études (Holliday et McBeth, 2011

; Lee et coll., 2012

, 2015

; Zhang et coll., 2014

). Ainsi, la méta-analyse menée par Lee et coll. a analysé et comparé 18 études de qualité satisfaisante correspondant à 17 gènes candidats et 35 polymorphismes (Lee et coll., 2012

). Cette méta-analyse a exclu une association entre SFM et le gène codant pour le transporteur à la sérotonine 5-HTT (allèle L du polymorphisme de répétition 5-HTTLPR présent dans la région promotrice du gène), celui codant pour la catéchol-O-méthyltransferase ou COMT (rs4680 correspondant à la variation p.Val158Met) et celui codant pour le récepteur de la sérotonine 5-hydroxytryptamine 2A (variant rs6313, c.T102C). Une association significative était toujours observée pour les gènes ADRB2 (haplotype AC), ADRA1A (rs1383914), DRD4 (
Variant Nucleotidic Tandem Repetition ou VNTR dans l’exon 3 du gène), MAO-A (allèle 3) et COMT (rs4818 et non p.Val158Met) (Lee et coll., 2012

).
Une méta-analyse de 8 études cas-témoins incluant 589 patients atteints de SFM et 527 témoins, publiée en 2014 par Zhang et coll., est en accord avec la précédente lorsqu’elle conclut à l’absence de lien entre les SFM et le polymorphisme p.Val158Met de la COMT (Zhang et coll., 2014

). Lee et coll. ont réalisé une seconde méta-analyse en étudiant l’association potentielle entre le variant p.Val158Met de COMT et un risque accru de souffrir d’un SFM ou de présenter une sévérité plus importante, évaluée à l’aide du FIQ (Lee et coll., 2015

). Un total de 993 patients et 778 témoins ont été inclus à partir de 10 études. Une association entre SFM et le variant p.158Met (génotypes homozygote Met/Met ou hétérozygote Val/Met) a été observée (OR = 1,6 [IC 95 % 1,0-2,6]). Cependant, cette association n’était plus significative dans les populations européennes et turques après stratification sur l’origine ethnique. La méta-analyse montre également que le score FIQ était significativement plus élevé chez les individus homozygotes p.158Met que chez les individus homozygotes p.158Val et hétérozygotes p.158Val/p.158Met. Contrairement à la précédente, cette méta-analyse a permis de confirmer une association entre le risque de souffrir de SFM et un score élevé FIQ, et l’allèle p.158Met. Cependant, d’autres études de plus forte puissance restent nécessaires pour confirmer cette association selon les ethnies.
Plusieurs études pan-génomiques de type GWAS (
Genome-Wide Association Studies), qui consiste à étudier tout le génome chez chaque individu afin d’identifier des régions génomiques impliquées dans la susceptibilité génétique à développer un SFM (ou une CWP) n’ont pas obtenu de résultats concordants (Holliday et McBeth, 2011

; Arnold et coll., 2013

; Peters et coll., 2013

; Docampo et coll., 2014

; Borchers et Gershwin, 2015

). Il en est de même des études d’épigénétique recherchant des variations géniques particulières en réponse à des facteurs développementaux ou environnementaux chez les patients souffrant d’un SFM (Menzies et coll., 2013

; Borchers et Gershwin, 2015

).
Le SFM est un syndrome multifactoriel faisant probablement intervenir des facteurs de prédisposition génétique et des facteurs familiaux d’exposition environnementale et comportementale pouvant être communs au sein des fratries. Ceci suggère que si le SFM comporte une composante génétique, il est probable qu’elle soit hétérogène, concerne plusieurs gènes et que chacun joue individuellement un rôle limité dans la survenue du SFM (Borchers et Gershwin, 2015

).
Traumatismes physiques
Le rôle des traumatismes physiques comme facteurs déclenchant le SFM reste controversé malgré le grand nombre d’études et le concept répandu d’une origine traumatique du SFM chez certains patients (tableau 4.X

; White et coll., 2000

; Buskila et Mader, 2011

; Hadler, 2013

; Wolfe et coll., 2014

). Une série clinique relativement ancienne de 127 patients souffrant de SFM a ainsi montré que près d’un quart des patients rapportaient un antécédent de traumatisme physique, de chirurgie ou d’affections médicales douloureuses (Greenfield et coll., 1992

). Il peut s’agir de traumatismes dans la vie quotidienne, d’accidents de voiture, notamment de traumatisme cervical (coup du lapin) ou d’accidents du travail (Buskila et Mader, 2011

; Wolfe et coll., 2014

).
Concernant les accidents de la route, des cas cliniques ont été rapportés, mais les résultats des séries de cas sont discordants, ce qui peut s’expliquer par des biais méthodologiques (White et coll., 2000

; Wolfe et coll., 2014

; Yavne et coll., 2018

). Il existe une littérature assez abondante sur les liens entre traumatismes cervicaux et SFM. Par exemple, une étude contrôlée de faible qualité méthodologique menée sur 102 patients souffrant de traumatisme cervical et 59 patients souffrant d’une fracture du membre inférieur (témoins) a montré une prévalence de SFM « post-traumatique » de 21,6 % dans le groupe traumatisme cervical et de 1,7 % dans le groupe fracture du membre inférieur, soit 13 fois plus (Buskila et coll., 1997

). Les symptômes de SFM apparaissaient en moyenne 3,2 mois après le traumatisme. Néanmoins, les études disponibles dans la littérature souffrent de biais méthodologiques si bien que le niveau de preuve du rôle déclenchant des traumatismes (accidents de la route, traumatismes cervicaux) est classé comme faible par plusieurs revues systématiques (White et coll., 2000

; Buskila et Mader, 2011

; Wolfe et coll., 2014

; Yavne et coll., 2018

) et par les recommandations canadiennes sur la FM (Jain et coll., 2003

).
Tableau 4.X Études évaluant l’association entre traumatismes physiques et fibromyalgie (1992-2015 ; d’après Yavne et coll., 2018 )
)
|
Référence
|
Taille échantillon
|
Critères diagnostic
|
Fréquence FM post-traumatique (%)
|
Greenfield et coll., 1992 
|
127 patients avec FM
|
Douleurs diffuses depuis plus de 3 mois
|
19,6
|
Magnusson, 1994 
|
38 patients avec coup
du lapin
|
ACR 1990
|
10,5
|
Aaron et coll., 1997 
|
109 patients avec FM
|
ACR 1990
|
15
|
|
Buskila, 2009
|
102 patients avec traumatisme cervical
|
ACR 1990
|
21,6
|
Gallinaro et coll., 2001 
|
34 travailleurs avec microtraumatismes répétés
|
ACR 1990
|
58,8
|
Al-Allaf et coll., 2002 
|
136 patients avec FM
|
ACR 1990
|
39
|
Des cas cliniques de SFM « post-traumatisme en milieu de travail » ont été publiés, mais il s’agit encore ici d’études de faible qualité méthodologique portant sur un nombre limité de cas (Wolfe, 1994

; White et coll., 2000

; Buskila et Mader, 2011

; Hadler, 2013

). Ces cas survenant « en milieu de travail » suscitent des enjeux médico-légaux et assurantiels importants, notamment en Amérique du Nord (Fitzcharles et coll., 2013

) alors que l’origine professionnelle du SFM n’est pas établie (Hadler, 2013

; Wolfe et coll., 2014

). En effet, si le rôle des microtraumatismes d’origine professionnelle est bien établi dans la survenue de troubles musculo-squelettiques, il reste controversé concernant le SFM, l’hypersollicitation biomécanique et les facteurs psychosociaux d’origine professionnelle semblant plus jouer un rôle pronostique qu’étiologique dans le cas du SFM (voir chapitre « Syndrome fibromyalgique et travail ») (Hagberg et coll., 1995

; McBeth et coll., 2003

; Henriksson et coll., 2005

; Fitzcharles et coll., 2016

).
Traumatismes psychiques, abus sexuels, violence,
stress post-traumatiques et troubles de santé mentale
Le SFM, à l’instar de la CWP, s’inscrit plus aisément dans un modèle bio-psycho-social que dans un modèle biomédical classique. Le modèle biopsychosocial de la santé de Engel (figure 4.3

) repose sur une approche globale et intégrée de l’être humain dans laquelle les « facteurs biologiques, psychologiques et sociaux sont considérés comme participant simultanément au maintien de la santé ou au développement de la maladie » (Engel, 1997

). Dans ce cadre, des facteurs autres que biologiques ont été étudiés.
Les patients atteints de SFM rapportent fréquemment que leurs douleurs ont été déclenchées ou aggravées par un traumatisme psychique (Borchers et Gershwin, 2015

) (voir aussi chapitre « Dimension psychologique du syndrome fibromyalgique »). Des études épidémiologiques de qualité méthodologique variable rapportant l’existence d’antécédents de type stress émotionnel intense et détresse psychologique chez les patients souffrant de SFM suggèrent que des traumatismes psychiques puissent jouer le rôle de facteurs prédisposant, déclenchant ou perpétuant les SFM (Häuser et coll., 2013

; Nicol et coll., 2016

). Il en est de même pour les violences physiques ou sexuelles dans l’enfance ou à l’âge adulte, qui sont rapportées par un grand nombre de patients à l’âge adulte (tableau 4.XI

; Ruiz-Pérez et coll., 2009

; Lee, 2010

; Häuser et coll., 2011

; Min et coll., 2013

; Fitzcharles et coll., 2018

; Yavne et coll., 2018

).
Une étude rétrospective récente de 197 patientes souffrant de SFM (154 patientes), de dyspepsie fonctionnelle
7
Trouble chronique de la sensation et du mouvement du tube digestif supérieur.
(83 patientes) et d’achalasie
8
Trouble moteur primitif de l’œsophage.
(53 patientes) a confirmé ces résultats (Coppens et coll., 2017

). Elle montrait une prévalence significativement plus élevée d’abus sexuels dans l’enfance chez les patientes atteintes de SFM (49 %) que chez celles souffrant d’achalasie (24 %), la différence n’étant pas significative avec celles souffrant de dyspepsie fonctionnelle (23 %). La prévalence d’un état de trouble de stress post-traumatique était plus élevée chez les patientes souffrant de SFM (26 %) que chez les patientes souffrant de dyspepsie fonctionnelle (5 %) et d’achalasie (12 %). Les patientes atteintes de SFM ayant des antécédents d’abus sexuels dans l’enfance avait également une prévalence de troubles de stress post-traumatique plus élevée que les patientes atteintes de SFM sans antécédents (34 %
vs 18 %) (Coppens et coll., 2017

).
Tableau 4.XI Études évaluant l’association entre antécédents de traumatismes psychiques et fibromyalgie (1995-2017 ; d’après Yavne et coll., 2018 )
)
|
Référence
|
Taille échantillon
|
Critères diagnostic
|
OR
|
Boisset-Pioro et coll., 1995 
|
83 patients avec FM contre 161 contrôles
|
Diagnostic de FM émis par un rhumatologue
|
4,8 (P < 0,001)
|
Taylor et coll., 1995 
|
40 patientes avec FM contre 42 contrôles
|
ACR 1990
|
1,6 (P = 0,24)
|
Walker et coll., 1997b 
|
36 patients contre 33 contrôles avec PR
|
ACR 1990
|
7,15 (P = 0,01)
|
Ciccone et coll., 2005 
|
52 patientes contre 53 contrôles
|
ACR 1990
|
3,1 (P = 0,038)
|
Naring et coll., 2007 
|
28 patients avec FM contre 51 contrôles avec PR
|
ACR 1990
|
2,9 (P = 0,051)
|
Haviland et coll., 2010 
|
372 patients FM contre 9 868 contrôles
|
Questionnaire oui/non
|
1,38
|
Ablin et coll., 2010 
|
1 024 habitants de villes bombardées contre 1 006 habitants de villes voisines
|
Douleurs diffuses
|
1,37 (P = 0,038)
|
Häuser et coll., 2011 
|
Méta-analyse (18 études)
| |
3,07
|
Haüser et coll., 2012 
|
153 patients avec FM contre 153 contrôles appariés en âge et en genre
|
ACR 1990
|
2,57 (P = 0,04)
|
Afari et coll., 2014 
|
Méta-analyse de 21 études
|
-
|
2,52 (P < 0,001)
|
Une méta-analyse de 23 études (4 640 sujets ayant subi des abus sexuels dans l’enfance) étudiant les effets des abus sexuels sur la survenue au cours de la vie entière de douleurs chroniques et de troubles fonctionnels n’a pas observé d’excès de risque significatif de souffrir d’un SFM (OR = 1,61 [IC 95 % 0,85-3,07], 4 études de cette méta-analyse), contrairement aux troubles fonctionnels gastro-intestinaux, aux douleurs chroniques non spécifiques et aux douleurs pelviennes chroniques (tableau 4.XII

). Par contre, lorsque seuls sont considérés les antécédents de viol, une association significative est observée avec la survenue d’un SFM au cours de la vie entière (OR = 3,35 [IC 95 % 1,51-7,46], 4 études), ainsi qu’avec la survenue de troubles fonctionnels gastro-intestinaux et de douleurs pelviennes chroniques (Paras et coll., 2009). Une seconde méta-analyse de 18 études cas-témoins portant sur un plus grand nombre de sujets que la précédente (13 095) a montré que si la majorité des études utilisaient les critères ACR 1990 pour définir les patients souffrant de SFM, les critères d’évaluation des antécédents de violence physique ou d’abus sexuel dans l’enfance ou à l’âge adulte variaient selon les études, ce qui expose à des biais d’information importants. Les résultats montraient l’existence d’association entre SFM et abus sexuels dans l’enfance (OR = 1,94 [IC 95 % 1,36-2,75], 10 études), entre SFM et l’existence d’abus sexuels à l’âge adulte (OR = 2,24 [IC 95 % 1,07-4,70], 4 études) mais aussi entre SFM et violences physiques dans l’enfance (OR = 2,49 [IC 95 % 1,81-3,42], 9 études) ou bien à l’âge adulte (OR = 3,07 [IC 95 % 1,01-9,39], 3 études). Par contre, il n’y avait pas d’association entre traumatismes émotionnels (de type insultes, humiliation...) dans l’enfance ou à l’âge adulte et les SFM (Häuser et coll., 2011

).
Tableau 4.XII Rapports de chances (Odds Ratio) calculés évaluant le degré de dépendance entre abus sexuel dans l’enfance et survenue de douleurs chroniques ou de fibromyalgie au cours de la vie entière d’après la méta-analyse de Paras et coll. (2009 )
)
|
Référence
|
Échantillon (Patients/Contrôles)
|
Odds Ratio (IC 95 %)
|
|
Abus sexuel
|
| |
Douleur chronique
| | |
| |
Raphael et coll., 2001 
|
-
|
2,20 (1,54-3,15)
|
| |
Fibromyalgie
| | |
| |
Boisset-Pioro et coll., 1995 
|
107/137
|
1,51 (0,89-2,58)
|
| |
Ciccone et coll., 2005 
|
52/53
|
1,12 (0,52-2,42)
|
| |
Taylor et coll., 1995 
|
48/32
|
1,52 (0,62-3,74)
|
| |
Walker et coll., 1997a 
|
16/53
|
3,63 (1,03-12,71)
|
| |
TOTAL
| |
1,61 (0,85-3,07)
|
|
Viol
|
| |
Fibromyalgie
| | |
| |
Ciccone et coll., 2005 
|
52/43
|
3,18 (1,12-8,99)
|
| |
Walker et coll., 1997a 
|
16/53
|
3,63 (1,03-12,71)
|
| |
TOTAL
| |
3,35 (1,51-7,46)
|
| |
Douleurs gastro-intestinales
| | |
| |
Delvaux et coll., 1997 
|
29/686
|
4,01 (1,88-8,57)
|
| |
Douleurs pelviennes
| | |
| |
Collett et coll., 1998 
|
30/60
|
3,27 (1,02-10,53)
|
Un antécédent de troubles de stress post-traumatique est fréquemment rapporté par les patients souffrant de SFM, avec des prévalences d’antécédents comprises entre 15 et 60 % selon les études (tableau 4.XIII

; Fietta et coll., 2007

; Häuser et coll., 2011

; Yavne et coll., 2018

). Néanmoins, les études souffrent souvent de limites méthodologiques importantes, notamment de biais de mémorisation (Yavne et coll., 2018

). Pour certains, l’existence de stress post-traumatique pourrait jouer un rôle médiateur entre expérience traumatique et développement d’un SFM en tant que marqueur d’une susceptibilité accrue au stress, qui favoriserait la survenue de CWP ou de SFM en cas d’exposition ultérieure à un traumatisme psychique ou physique (figure 4.4

) (Häuser et coll., 2013

). Il n’est pas précisé si cette association est spécifique du SFM ou concerne les douleurs chroniques en général.
Tableau 4.XIII Études évaluant l’association entre troubles de stress post-traumatique et fibromyalgie (1997-2013 ; d’après Yavne et coll., 2018 )
)
|
Référence
|
Échantillon (patients/contrôles ; critères de classification FM)
|
Résultats
|
Amir et coll., 1997 
|
29 patients avec troubles < 37 contrôles (ACR 1990)
|
21 % de FM dans groupe avec contre 0 % dans groupe sans
|
Sherman et coll., 2000 
|
93 patients (ACR 1990)
|
56 % des patients avec troubles
|
Roy-Byrne et coll., 2004 
|
268 patients (ACR 1990)
|
OR 2,8 (IC 95 % 1,6-4,8)
|
Dobie et coll., 2004 
|
266 vétérans F avec troubles /993 vétérans F contrôles (déclaratif)
|
3 (IC 95 % 1,98-4,45)
|
Seng et coll., 2006 
|
2 133 patients avec troubles contre 14 998 contrôles (ICD-9)
|
OR ajustée 1,9 (FM dans troubles)
|
Jamil et coll., 2006 
|
19 Iraquiens avec troubles / 13 sans (déclaratif ou douleur journalière depuis plus de 3 mois)
|
68,8 % du groupe avec trouble avec FM comparé à 61,5 % des contrôles (non significatif)
|
Amital et coll., 2006 
|
55 patients M avec troubles / 49 contrôles M (ACR 1990)
|
49 % de FM dans groupe avec contre 0 % dans groupe sans
|
Häuser et coll., 2013 
|
395 patients avec FM contre 395 contrôles
|
OR 26,45 (IC 95 % 14,4-48,57 ; troubles dans FM)
|
FM : fibromyalgie ; M : masculin ; F : féminin, OR : odds ratio.
Infections
Des douleurs chroniques ou une fatigue caractérisent certains patients porteurs d’infections virales ou bactériennes chroniques, notamment l’hépatite C et les infections par le virus de l’immunodéficience humaine (VIH) (Buskila et coll., 2008

; Cassisi et coll., 2011

). Compte-tenu de la similarité des tableaux cliniques, la maladie de Lyme dans une forme chronique, dont l’existence reste controversée, peut mimer un tableau de CWP ou de SFM sans qu’il soit établi à ce jour un lien de causalité entre ces deux affections (Sigal et Hassett, 2002

; Cairns et Godwin, 2005

; Cassisi et coll., 2011

; Wormser et coll., 2015

; Häuser et coll., 2017

).
Des cas cliniques d’associations chronologiques entre infections virales ou bactériennes et SFM ont été rapportés pour les infections par les virus de l’hépatite C, l’hépatite B et HIV (Buskila et coll., 2008

). Une prévalence élevée de douleur chronique ou de SFM a été retrouvée de manière inconstante chez des patients porteurs d’une infection à HIV ou HVC et plus rarement HVP, HTLV1 ou parvovirus B19 (Buskila et coll., 2008

; Cassisi et coll., 2011

; Fox et Walker-Bone, 2015

). Il s’agit le plus souvent de séries de cas ou d’études transversales de faible puissance présentant de nombreux biais méthodologiques ne permettant pas de jugement de causalité. C’est pourquoi la revue systématique réalisée par Cassini et coll. conclut à l’absence de preuve d’association entre SFM et infections aiguës ou chroniques, qu’elles soient bactériennes ou virales (Cassisi et coll., 2011

).
Vaccinations
Il existe également une similarité entre les symptômes des réactions post-vaccinales (myalgies, douleur, fatigue...) et ceux du SFM et des cas anecdotiques de douleurs chroniques pouvant évoquer un SFM ont été rapportés dans la littérature (Buskila et coll., 2008

, pour revue). Le vaccin contre la rubéole effectué de manière préventive à l’âge adulte chez des femmes avec un projet de maternité et non immunisées a été incriminé, mais un essai contrôlé de bonne qualité méthodologique n’a pas montré d’augmentation des arthralgies et myalgies chroniques après vaccination (Tingle et coll., 1997

). De même, le risque de développement d’un SFM après vaccination à l’âge adulte ou chez l’enfant contre l’hépatite B, ou des vaccins polyvalents (hépatite B, diphtérie, tétanos, poliomyélite) n’a pas été établi même si des cas isolés ont été rapportés dans la littérature (Cassisi et coll., 2011

).
Conclusion
Le SFM est une affection fréquente qui touche environ 2 à 4 % de la population générale, avec une prépondérance féminine dont la valeur varie en fonction des critères de classification ou de diagnostic utilisés. Le SFM est associé à un cortège de symptômes fonctionnels et à de nombreuses comorbidités, de prévalence variable selon les comorbidités, mais aussi pour une même comorbidité selon les séries cliniques, ce qui traduit sa grande hétérogénéité.
Le SFM est un syndrome multifactoriel répondant à un modèle bio-psycho-social. La complexité et la variabilité de son expression phénotypique suggèrent l’existence de nombreux déterminants, qu’ils soient biologiques, génétiques, psychologiques et sociaux, dont certains seraient plus marqués dans tel ou tel sous-groupe de patients souffrant d’une forme phénotypique particulière du SFM.
De nombreux facteurs de risque ne sont pas spécifiques du SFM mais s’observent dans la plupart des syndromes douloureux chroniques, tels que les lombalgies ou les CWP, ces dernières présentant de nombreuses caractéristiques communes avec le SFM.
Des efforts de recherche restent nécessaires, notamment la mise en œuvre d’études prospectives de forte puissance statistique reposant sur des définitions standardisées du SFM, des comorbidités et des facteurs de prédisposition potentiels.
Références
[1] Aaron LA, Bradley LA, Alarcón GS, et al . Perceived physical and emotional trauma as precipitating events in fibromyalgia. Associations with health care seeking and disability status but not pain severity.
Arthritis Rheum. 1997;
40:453
-60

[2] Ablin JN, Buskila D. Update on the genetics of the fibromyalgia syndrome.
Best Pract Res Clin Rheumatol. 2015;
29:20
-8

[3] Ablin JN, Odes L, Neumann L, et al . The Hebrew version of the FibroFatigue scale: validation of a questionnaire for assessment of fibromyalgia and chronic fatigue syndrome.
Rheumatol Int. 2010;
30:1173
-6

[4] Ablin JN, Wolfe F. A Comparative Evaluation of the 2011 and 2016 Criteria for Fibromyalgia.
J Rheumatol. 2017;
44:1271
-6

[5] Afari N, Ahumada SM, Wright LJ, et al . Psychological trauma and functional somatic syndromes: a systematic review and meta-analysis.
Psychosom Med. 2014;
76: 2p.

[6] Al Allaf AW, Dunbar KL, Hallum NS, et al . A case-control study examining the role of physical trauma in the onset of fibromyalgia syndrome.
Rheumatology. 2002;
41:450
-3

[7] Amir M, Kaplan Z, Neumann L, et al . Posttraumatic stress disorder, tenderness and fibromyalgia.
J Psychosom Res. 1997;
42:607
-13

[8] Amital D, Fostick L, Polliack ML, et al . Posttraumatic stress disorder, tenderness, and fibromyalgia syndrome: are they different entities?.
J Psychosom Res. 2006;
61:663
-9

[9] Andrade A, Vilarino GT, Sieczkowska SM, et al . The relationship between sleep quality and fibromyalgia symptoms.
J Health Psychol. 2018;
135910531775161.

[10] Andrews P, Steultjens M, Riskowski J. Chronic widespread pain prevalence in the general population: a systematic review.
Eur J Pain. 2018;
22:5
-18

[11] Arnold LM, Choy E, Clauw DJ, et al . Fibromyalgia and chronic pain syndromes: a white paper detailing current challenges in the field.
Clin J Pain. 2016;
32:737
-46

[12] Arnold LM, Clauw DJ. Challenges of implementing fibromyalgia treatment guidelines in current clinical practice.
Postgrad Med. 2017;
129:709
-14

[13] Arnold LM, Fan J, Russell IJ, et al . The fibromyalgia family study: a genome-wide linkage scan study: susceptibility loci for fibromyalgia.
Arthritis Rheum. 2013;
65:1122
-8

[14] Arnold LM, Hudson JI, Hess EV, et al . Family study of fibromyalgia.
Arthritis Rheum. 2004;
50:944
-52

[15] Arnold LM, Hudson JI, Keck PE, et al . Comorbidity of fibromyalgia and psychiatric disorders.
J Clin Psychiatry. 2006;
67:1219
-25

[16] Arnson Y, Amital D, Fostick L, et al . Physical activity protects male patients with post-traumatic stress disorder from developing severe fibromyalgia.
Clin Exp Rheumatol. 2007;
25: 529p.

[17] Arreghini M, Manzoni GM, Castelnuovo G, et al . Impact of fibromyalgia on functioning in obese patients undergoing comprehensive rehabilitation.
PLoS One. 2014;
9: e91392p.

[18] Assumpção A, Cavalcante AB, Capela CE, et al . Prevalence of fibromyalgia in a low socioeconomic status population.
BMC Musculoskelet Disord. 2009;
10:

[19] Balasubramaniam R, Leeuw R de, Zhu H, et al . Prevalence of temporomandibular disorders in fibromyalgia and failed back syndrome patients: A blinded prospective comparison study.
Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2007;
104:204
-16

[20] Bannwarth B, Blotman F, Roué-Le Lay K, et al . Étude de la prévalence de la fibromyalgie dans la population française.
Revue du Rhumatisme. 2009;
76:274
-8

[21] Bannwarth B, Blotman F, Roué-Le Lay K, et al . Fibromyalgia syndrome in the general population of France: a prevalence study.
Joint Bone Spine. 2009;
76:184
-7

[22] Barton JC, Bertoli LF, Acton RT. Fibromyalgia in 300 adult index patients with primary immunodeficiency.
Clin Exp Rheumatol. 2017;
35:68
-73

[23] Barton A, Pal B, Whorwell PJ, et al . Increased prevalence of sicca complex and fibromyalgia in patients with irritable bowel syndrome.
Am J Gastroenterol. 1999;
94: 1898p.

[24] Bazzichi L, Rossi A, Giuliano T, et al . Association between thyroid autoimmunity and fibromyalgic disease severity.
Clin Rheumatol. 2007;
26:2115
-20

[25] Bidonde J, Busch AJ, Schachter CL, et al . Aerobic exercise training for adults with fibromyalgia.
Cochrane Database Syst Rev. 2017;

[26] Boisset Pioro MH, Esdaile JM, Fitzcharles M-A. Sexual and physical abuse in women with fibromyalgia syndrome.
Arthritis Rheum. 1995;
38:235
-41

[27] Bondesson E, Larrosa Pardo F, Stigmar K, et al . Comorbidity between pain and mental illness–Evidence of a bidirectional relationship.
Eur J Pain. 2018;
22:1304
-11

[28] Borchers AT, Gershwin ME. Fibromyalgia: a critical and comprehensive review.
Clin Rev Allergy Immunol. 2015;
49:100
-51

[29] Branco JC, Bannwarth B, Failde I, et al . Prevalence of fibromyalgia: a survey in five european countries.
Semin Arthritis Rheum. 2010;
39:448
-53

[30] Brikman S, v. Furer , Wollman J, et al . The effect of the presence of fibromyalgia on common clinical disease activity indices in patients with psoriatic arthritis: a cross-sectional study.
J Rheumatol. 2016;
43:1749
-54

[31] Brown D, Mulvey M, Cordingley L, et al . The relationship between psychological distress and multiple tender points across the adult lifespan.
Arch Gerontol Geriatr. 2016;
63:102
-7

[32] Brummett CM, Urquhart AG, Hassett AL, et al . Characteristics of fibromyalgia independently predict poorer long-term analgesic outcomes following total knee and hip arthroplasty.
Arthritis Rheumatol. 2015;
67:1386
-94

[33] Buskila D, Atzeni F, Sarzi-Puttini P. Etiology of fibromyalgia: the possible role of infection and vaccination.
Autoimmun Rev. 2008;
8:41
-3

[34] Buskila D, Mader R. Trauma and work-related pain syndromes: risk factors, clinical picture, insurance and law interventions.
Best Pract Res Clin Rheumatol. 2011;
25:199
-207

[35] Buskila D, Neumann L, Vaisberg G, et al . Increased rates of fibromyalgia following cervical spine injury. A controlled study of 161 cases of traumatic injury.
Arthritis Rheum. 1997;
40:446
-52

[36] Cabo-Meseguer A, Cerdá-Olmedo G, Trillo-Mata JL. Fibromyalgia: prevalence, epidemiologic profiles and economic costs.
Med Clin (Barc). 2017;
149:441
-8

[37] Cairns V, Godwin J. Post-Lyme borreliosis syndrome: a meta-analysis of reported symptoms.
Int J Epidemiol. 2005;
34:1340
-5

[38] Cakit BD, Taskin S, Nacir B, et al . Comorbidity of fibromyalgia and cervical myofascial pain syndrome.
Clin Rheumatol. 2010;
29:405
-11

[39] Cassisi G, Sarzi-Puttini P, Cazzola M. Chronic widespread pain and fibromyalgia: could there be some relationships with infections and vaccinations?.
Clin Exp Rheumatol. 2011;
29:S118
-126

[40] Chang M-H, Hsu J-W, Huang K-L, et al . Bidirectional association between depression and fibromyalgia syndrome: a nationwide longitudinal study.
J Pain. 2015;
16:895
-902

[41] Cho S-J, Sohn J-H, Bae JS, et al . Fibromyalgia among patients with chronic migraine and chronic tension-type headache: a multicenter prospective cross-sectional study.
Headache. 2017;
57:1583
-92

[42] Choy EHS. The role of sleep in pain and fibromyalgia.
Nat Rev Rheumatol. 2015;
11:513
-20

[43] Chung JH, Kim SA, Choi BY, et al . The association between overactive bladder and fibromyalgia syndrome: a community survey.
Neurourol Urodyn. 2013;
32:66
-9

[44] Ciccone DS, Elliott DK, Chandler HK, et al . Sexual and physical abuse in women with fibromyalgia syndrome: a test of the trauma hypothesis.
Clin J Pain. 2005;
21:378
-86

[45] Civelek GM, Ciftkaya PO, Karatas M. Evaluation of restless legs syndrome in fibromyalgia syndrome: an analysis of quality of sleep and life.
J Back Musculoskelet Rehabil. 2014;
27:537
-44

[46] Clauw DJ, Crofford LJ. Chronic widespread pain and fibromyalgia: what we know, and what we need to know.
Best Pract Res Clin Rheumatol. 2003;
17:685
-701

[47] Clauw DJ, D’Arcy Y, Gebke K, et al . Normalizing fibromyalgia as a chronic illness.
Postgrad Med. 2018;
130:9
-18

[48] Clemenzi A, Pompa A, Casillo P, et al . Chronic pain in multiple sclerosis: Is there also fibromyalgia? An observational study.
Med Sci Monit. 2014;
20: 758p.

[49] Cobankara V, Unal UO, Kaya A, et al . The prevalence of fibromyalgia among textile workers in the city of Denizli in Turkey: The prevalence of fibromyalgia among textile workers.
Int J Rheum Dis. 2011;
14:390
-4

[50] Collett BJ, Cordle CJ, Stewart CR, et al . A comparative study of women with chronic pelvic pain, chronic nonpelvic pain and those with no history of pain attending general practitioners.
BJOG. 1998;
105:87
-92

[51] Collin SM, Bakken IJ, Nazareth I, et al . Trends in the incidence of chronic fatigue syndrome and fibromyalgia in the UK, 2001–2013 : a Clinical Practice Research Datalink study.
JR Soc Med. 2017;
110:231
-44

[52] Coppens E, van Wambeke P, Morlion B, et al . Prevalence and impact of childhood adversities and post-traumatic stress disorder in women with fibromyalgia and chronic widespread pain.
Eur J Pain. 2017;
21:1582
-90

[53] Costa JM, Ranzolin A, da Costa Neto , Cláudio Antônio , et al . High frequency of asymptomatic hyperparathyroidism in patients with fibromyalgia: random association or misdiagnosis ?.
Rev Bras Reumatol Engl Ed. 2016;
56:391
-7

[54] Cuevas-Toro AM, López-Torrecillas F, Díaz-Batanero MC, et al . Neuropsychological function, anxiety, depression and pain impact in fibromyalgia patients.
Span J Psychol. 2014;
17p.

[55] Curtis JR, Herrem C, Ndlovu MN, et al . A somatization comorbidity phenotype impacts response to therapy in rheumatoid arthritis: post-hoc results from the certolizumab pegol phase 4 PREDICT trial.
Arthritis Res Ther. 2017;
19: 215p.

[56] Delvaux M, Denis P, Allemand H. Sexual abuse is more frequently reported by IBS patients than by patients with organic digestive diseases or controls. Results of a multicentre inquiry. French Club of Digestive Motility.
Eur J Gastroenterol Hepatol. 1997;
9:345
-52

[57] Dias DNG, Marques MAA, Bettini SC, et al . Prevalence of fibromyalgia in patients treated at the bariatric surgery outpatient clinic of Hospital de Clínicas do Paraná-Curitiba.
Rev Bras Reumatol Engl Ed. 2017;
57:425
-30

[58] Dobie DJ, Kivlahan DR, Maynard C, et al . Posttraumatic stress disorder in female veterans: association with self-reported health problems and functional impairment.
Arch Intern Med. 2004;
164:394
-400

[59] Docampo E, Escaramís G, Gratacòs M, et al . Genome-wide analysis of single nucleotide polymorphisms and copy number variants in fibromyalgia suggest a role for the central nervous system.
Pain. 2014;
155:1102
-9

[60] Donald F, Esdaile JM, Kimoff JR, et al . Musculoskeletal complaints and fibromyalgia in patients attending a respiratory sleep disorders clinic.
J Rheumatol. 1996;
23:1612
-6

[61] Duffield SJ, Miller N, Zhao S, et al . Concomitant fibromyalgia complicating chronic inflammatory arthritis: a systematic review and meta-analysis.
Rheumatology. 2018;

[62] Engel GL. The biopsychosocial model and medical education: who are to be the teachers?.
N Engl J Med. 1982;
306:802
-5

[63] Engel GL. From biomedical to biopsychosocial. Being scientific in the human domain.
Psychosomatics. 1997;
38:521
-8

[64] Erbasan F, Cekin Y, Coban DT, et al . The frequency of primary Sjogren’s syndrome and fibromyalgia in irritable bowel syndrome.
Pak J Med Sci. 2017;
33: 137p.

[65] Ericsson A, Palstam A, Larsson A, et al . Resistance exercise improves physical fatigue in women with fibromyalgia: a randomized controlled trial.
Arthritis Res Ther. 2016;
18p.

[66] Fan Y-H, Lin ATL, Lu S-H, et al . Non-bladder conditions in female Taiwanese patients with interstitial cystitis/hypersensitive bladder syndrome.
Int J Urol. 2014;
21:805
-9

[67] Fan A, Pereira B, Tournadre A, et al . Frequency of concomitant fibromyalgia in rheumatic diseases: monocentric study of 691 patients.
Semin Arthritis Rheum. 2017;
47:129
-32

[68] Fayaz A, Croft P, Langford RM, et al . Prevalence of chronic pain in the UK: a systematic review and meta-analysis of population studies.
BMJ Open. 2016;
6: e010364p.

[69] Fietta P, Fietta P, Manganelli P. Fibromyalgia and psychiatric disorders.
Acta Biomed. 2007;
78:88
-95

[70] Fitzcharles M-A, Perrot S, Häuser W. Comorbid fibromyalgia: a qualitative review of prevalence and importance.
Eur J Pain. 2018;
22:1565
-76

[71] Fitzcharles M-A, Ste-Marie PA, Goldenberg DL, et al . 2012 Canadian Guidelines for the diagnosis and management of fibromyalgia syndrome: executive summary.
Pain Res Manag. 2013;
18:119
-26

[72] Fitzcharles M-A, Ste-Marie PA, SHIR Y. A medicolegal analysis of worker appeals for fibromyalgia as a compensable condition following workplace soft-tissue injury.
J Rheumatol. 2013;
40:323
-8

[73] Fitzcharles M-A, Ste-Marie PA, Pereira JX. Fibromyalgia: evolving concepts over the past 2 decades.
Can Med Assoc J. 2013;
185:E645
-E651

[74] Fitzcharles M-A, Ste-Marie PA, Rampakakis E, et al . Disability in fibromyalgia associates with symptom severity and occupation characteristics.
J Rheumatol. 2016;
43:931
-6

[75] Forseth KO, Gran JT, Husby G. A population study of the incidence of fibromyalgia among women aged 26-55 yr.
Br J Rheumatol. 1997;
36:1318
-23

[76] Fox C, Walker-Bone K. Evolving spectrum of HIV-associated rheumatic syndromes.
Best Pract Res Clin Rheumatol. 2015;
29:244
-58

[77] Fuller-Thomson E, Nimigon-Young J, Brennenstuhl S. Individuals with fibromyalgia and depression: findings from a nationally representative Canadian survey.
Rheumatol Int. 2011;
32:853
-62

[78] Gallinaro AL, Feldman D, Natour J. An evaluation of the association between fibromyalgia and repetitive strain injuries in metalworkers of an industry in Guarulhos, Brazil.
Joint Bone Spine. 2001;
68:59
-64

[79] García-Leiva JM, Carrasco JLO, Slim M, et al . Celiac symptoms in patients with fibromyalgia: a cross-sectional study.
Rheumatol Int. 2015;
35:561
-7

[80] Germanowicz D, Lumertz MS, Martinez D, et al . Sleep disordered breathing concomitant with fibromyalgia syndrome.
J Bras Pneumol. 2006;
32:333
-8

[81] Gist AC, Guymer EK, Ajani AE, et al . Fibromyalgia has a high prevalence and impact in cardiac failure patients.
Eur J Rheumatol. 2017;
4: 245p.

[82] Gota CE, Kaouk S, Wilke WS. The impact of depressive and bipolar symptoms on socioeconomic status, core symptoms, function and severity of fibromyalgia.
Int J Rheum Dis. 2017;
20:326
-39

[83] Gran JT. The epidemiology of chronic generalized musculoskeletal pain.
Best Pract Res Clin Rheumatol. 2003;
17:547
-61

[84] Greenfield S, Fitzcharles MA, Esdaile JM. Reactive fibromyalgia syndrome.
Arthritis Rheum. 1992;
35:678
-81

[85] Hadler NM. Workers’ compensation, fibromyalgia, and kafka.
J Rheumatol. 2013;
40:216
-8

[86] Hagberg M, Silverstein B, Wells R, et al . Work related musculoskeletal disorders (WMSDs): a reference book for prevention.
London:1995;

[87] Haliloglu S, Carlioglu A, Akdeniz D, et al . Fibromyalgia in patients with other rheumatic diseases: prevalence and relationship with disease activity.
Rheumatol Int. 2014;
34:1275
-80

[88] Haliloglu S, Ekinci B, Uzkeser H, et al . Fibromyalgia in patients with thyroid autoimmunity: prevalence and relationship with disease activity.
Clin Rheumatol. 2017;
36:1617
-21

[89] Häuser W, Bohn D, Kühn-Becker H, et al . Is the association of self-reported childhood maltreatments and adult fibromyalgia syndrome attributable to depression? A case control study.
Clin Exp Rheumatol. 2012;
30:59
-64

[90] Häuser W, Galek A, Erbslöh-Möller B, et al . Posttraumatic stress disorder in fibromyalgia syndrome: prevalence, temporal relationship between posttraumatic stress and fibromyalgia symptoms, and impact on clinical outcome.
Pain. 2013;
154:1216
-23

[91] Häuser W, Klose P, Langhorst J, et al . Efficacy of different types of aerobic exercise in fibromyalgia syndrome: a systematic review and meta-analysis of randomised controlled trials.
Arthritis Res Ther. 2010;
12: R79p.

[92] Häuser W, Kosseva M, Üceyler N, et al . Emotional, physical, and sexual abuse in fibromyalgia syndrome: a systematic review with meta-analysis.
Arthritis Care Res (Hoboken). 2011;
63:808
-20

[93] Häuser W, Perrot S, Sommer C, et al . Diagnostic confounders of chronic widespread pain.
Pain Rep. 2017;
2: e598p.

[94] Häuser W, Schild S, Kosseva M, et al . Validation of the German version of the Regional Pain Scale for the diagnosis of fibromyalgia syndrome.
Schmerz. 2010;
24:226
-35

[95] Haviland MG, Morton KR, Oda K, et al . Traumatic experiences, major life stressors, and self-reporting a physician-given fibromyalgia diagnosis.
Psychiatry Res. 2010;
177:335
-41

[96] Heidari F, Afshari M, Moosazadeh M. Prevalence of fibromyalgia in general population and patients, a systematic review and meta-analysis.
Rheumatol Int. 2017;
37:1527
-39

[97] Henriksson CM, Liedberg GM, Gerdle B. Women with fibromyalgia: work and rehabilitation.
Disabil Rehabil. 2005;
27:685
-94

[98] Holliday KL, McBeth J. Recent advances in the understanding of genetic susceptibility to chronic pain and somatic symptoms.
Curr Rheumatol Rep. 2011;
13:521
-7

[99] Jain AK, Carruthers BM, van de Sande MI, et al . Fibromyalgia syndrome: Canadian clinical working case definition, diagnostic and treatment protocols – a consensus document.
J Musculoskelet Pain. 2003;
11:3
-107

[100] Jamil H, Nassar-McMillan SC, Salman WA, et al . Iraqi Gulf War veteran refugees in the US: PTSD and physical symptoms.
Soc Work Health Care. 2006;
43:85
-98

[101] Jeffery D, Bulathsinhala L, Kroc M, et al . Prevalence, health care utilization, and costs of fibromyalgia, irritable bowel, and chronic fatigue syndromes in the military health system, 2006-2010.
Mil Med. 2014;
179:1021
-9

[102] Jones GT, Atzeni F, Beasley M, et al . The prevalence of fibromyalgia in the general population: a comparison of the American College of Rheumatology 1990, 2010, and modified 2010 classification criteria.
Arthritis Rheumatol. 2015;
67:568
-75

[103] Kaleth AS, Slaven JE, Ang DC. Obesity moderates the effects of motivational interviewing treatment outcomes in fibromyalgia.
Clin J Pain. 2017;
1:

[104] Kato K, Sullivan PF, Evengård B, et al . Importance of genetic influences on chronic widespread pain.
Arthritis Rheum. 2006;
54:1682
-6

[105] Kim C, Kim H, Kim J. Prevalence of chronic widespread pain and fibromyalgia syndrome: a Korean hospital-based study.
Rheumatol Int. 2011;
32:3435
-42

[106] Kim C-H, Luedtke CA, Vincent A, et al . Association of body mass index with symptom severity and quality of life in patients with fibromyalgia.
Arthritis Care Res (Hoboken). 2012;
64:222
-8

[107] Koçyiğit BF, Okyay RA. The relationship between body mass index and pain, disease activity, depression and anxiety in women with fibromyalgia.
Peer J. 2018;
6: e4917p.

[108] Koroschetz J, Rehm SE, Gockel U, et al . Fibromyalgia and neuropathic pain – differences and similarities. A comparison of 3,057 patients with diabetic painful neuropathy and fibromyalgia.
BMC Neurol. 2011;
11: 55p.

[109] Küçükşen S, Genç E, Yιmaz H, et al . The prevalence of fibromyalgia and its relation with headache characteristics in episodic migraine.
Clin Rheumatol. 2013;
32:983
-90

[110] Kudlow PA, Rosenblat JD, Weissman CR, et al . Prevalence of fibromyalgia and co-morbid bipolar disorder: A systematic review and meta-analysis.
J Affect Disord. 2015;
188:134
-42

[111] Kurtze N, Svebak S. Fatigue and patterns of pain in fibromyalgia: correlations with anxiety, depression and co-morbidity in a female county sample.
Br J Med Psychol. 2001;
74:523
-37

[112] Lee Y-R. Fibromyalgia and childhood abuse: exploration of stress reactivity as a developmental mediator.
Dev Rev. 2010;
30:294
-307

[113] Lee YH, Choi SJ, Ji JD, et al . Candidate gene studies of fibromyalgia: a systematic review and meta-analysis.
Rheumatol Int. 2012;
32:417
-26

[114] Lee YH, Kim J-H, Song GG. Association between the COMT Val158Met polymorphism and fibromyalgia susceptibility and fibromyalgia impact questionnaire score: a meta-analysis.
Rheumatol Int. 2015;
35:159
-66

[115] Lubrano E, Iovino P, Tremolaterra F, et al . Fibromyalgia in patients with irritable bowel syndrome. An association with the severity of the intestinal disorder.
Int J Colorectal Dis. 2001;
16:211
-5

[116] Macfarlane GJ, Kronisch C, Dean LE, et al . EULAR revised recommendations for the management of fibromyalgia.
Ann Rheum Dis. 2017;
76:318
-28

[117] Magnusson T. Extracervical symptoms after whiplash trauma.
Cephalalgia. 1994;
14:223
-37

[118] Mansfield KE, Sim J, Jordan JL, et al . A systematic review and meta-analysis of the prevalence of chronic widespread pain in the general population.
Pain. 2016;
157:55
-64

[119] Mansfield KE, Sim J, Croft P, et al . Identifying patients with chronic widespread pain in primary care.
Pain. 2017;
158: 110p.

[120] Markkula R, Järvinen P, Leino-Arjas P, et al . Clustering of symptoms associated with fibromyalgia in a Finnish twin cohort.
Eur J Pain. 2009;
13:744
-50

[121] Markkula RA, Kalso EA, Kaprio JA. Predictors of fibromyalgia: a population-based twin cohort study.
BMC Musculoskelet Disord. 2016;
17: 29p.

[122] Marrie RA, Yu BN, Leung S, et al . The incidence and prevalence of fibromyalgia are higher in multiple sclerosis than the general population: a population-based study.
Mult Scler Relat Disord. 2012;
1:162
-7

[123] Mas AJ, Carmona L, Valverde M, et al . Prevalence and impact of fibromyalgia on function and quality of life in individuals from the general population: results from a nationwide study in Spain.
Clin Exp Rheumatol. 2008;
26:519
-26

[124] McBeth J, Harkness EF, Silman AJ, et al . The role of workplace low-level mechanical trauma, posture and environment in the onset of chronic widespread pain.
Rheumatology (Oxford). 2003;
42:1486
-94

[125] Menzies V, Lyon DE, Archer KJ, et al . Epigenetic alterations and an increased frequency of micronuclei in women with fibromyalgia.
Nurs Res Pract. 2013;
2013:795784.

[126] Min MO, Minnes S, Kim H, et al . Pathways linking childhood maltreatment and adult physical health.
Child Abuse Negl. 2013;
37:361
-73

[127] Moltó A, Etcheto A, Gossec L, et al . Evaluation of the impact of concomitant fibromyalgia on TNF alpha blockers’ effectiveness in axial spondyloarthritis: results of a prospective, multicentre study.
Ann Rheum Dis. 2018;
77:533
-40

[128] Mork PJ, Vasseljen O, Nilsen TIL. Association between physical exercise, body mass index, and risk of fibromyalgia: longitudinal data from the Norwegian Nord-Trøndelag Health Study.
Arthritis Care Res (Hoboken). 2010;
62:611
-7

[129] Näring GWB, van Lankveld W, Geenen R. Somatoform dissociation and traumatic experiences in patients with rheumatoid arthritis and fibromyalgia.
Clin Exp Rheumatol. 2007;
25:872
-7

[130] Neumann L, Buskila D. Epidemiology of fibromyalgia.
Curr Pain Headache Rep. 2003;
7:362
-8

[131] Neumann L, Lerner E, Glazer Y, et al . A cross-sectional study of the relationship between body mass index and clinical characteristics, tenderness measures, quality of life, and physical functioning in fibromyalgia patients.
Clin Rheumatol. 2008;
27:1543
-7

[132] Nicol AL, Sieberg CB, Clauw DJ, et al . The association between a history of lifetime traumatic events and pain severity, physical function, and affective distress in patients with chronic pain.
J Pain. 2016;
17:1334
-48

[133] Nunes FR, Ferreira JM, Bahamondes L. Prevalence of fibromyalgia and quality of life in women with and without endometriosis.
Gynecol Endocrinol. 2014;
30:307
-10

[134] Okifuji A, Bradshaw DH, Olson C. Evaluating obesity in fibromyalgia : neuroendocrine biomarkers, symptoms, and functions.
Clin Rheumatol. 2009;
28:475
-8

[135] Okifuji A, Donaldson GW, Barck L, et al . Relationship between fibromyalgia and obesity in pain, function, mood, and sleep.
J Pain. 2010;
11:1329
-37

[136] Okifuji A, Hare BD. The association between chronic pain and obesity.
J Pain Res. 2015;
8:399
-408

[137] Paras ML, Murad MH, Chen LP, et al . Sexual abuse and lifetime diagnosis of somatic disorders: a systematic review and meta-analysis.
JAMA. 2009;
302:550
-61

[138] Perrot S, Peixoto M, Dieudé P, et al . Patient phenotypes in fibromyalgia comorbid with systemic sclerosis or rheumatoid arthritis: influence of diagnostic and screening tests. Screening with the FiRST questionnaire, diagnosis with the ACR 1990 and revised ACR 2010 criteria.
Clin Exp Rheumatol. 2017;
35Suppl 105:35
-42

[139] Perrot S, Vicaut E, Servant D, et al . Prevalence of fibromyalgia in France: a multi-step study research combining national screening and clinical confirmation: The DEFI study (Determination of Epidemiology of FIbromyalgia).
BMC Musculoskelet Disord. 2011;
12: 224p.

[140] Peters MJ, Broer L, Willemen , Hanneke LDM, et al . Genome-wide association study meta-analysis of chronic widespread pain: evidence for involvement of the 5p15.2 region.
Ann Rheum Dis. 2013;
72:427
-36

[141] Plantamura A, Steinbauer J, Eisinger J. Sleep apnea and fibromyalgia: the absence of correlation does not indicate an exclusive central hypothesis.
Rev Med Interne. 1995;
16:662
-5

[142] Queiroz LP. Worldwide epidemiology of fibromyalgia.
Curr Pain Headache Rep. 2013;
17: 356p.

[143] Raphael KG, Janal MN, Nayak S, et al . Psychiatric comorbidities in a community sample of women with fibromyalgia.
Pain. 2006;
124:117
-25

[144] Raphael KG, Widom CS, Lange G. Childhood victimization and pain in adulthood: a prospective investigation.
Pain. 2001;
92:283
-93

[145] Rehm SE, Koroschetz J, Gockel U, et al . A cross-sectional survey of 3035 patients with fibromyalgia: subgroups of patients with typical comorbidities and sensory symptom profiles.
Rheumatology. 2010;
49:1146
-52

[146] Roy-Byrne P, Smith WR, Goldberg J, et al . Post-traumatic stress disorder among patients with chronic pain and chronic fatigue.
Psychol Med. 2004;
34:363
-8

[147] Ruiz-Pérez I, Plazaola-Castaño J, Cáliz-Cáliz R, et al . Risk factors for fibromyalgia: the role of violence against women.
Clin Rheumatol. 2009;
28:777
-86

[148] Sendur OF, Gurer G, Bozbas GT. The frequency of hypermobility and its relationship with clinical findings of fibromyalgia patients.
Clin Rheumatol. 2007;
26:485
-7

[149] Seng JS, Clark MK, McCarthy AM, et al . PTSD and physical comorbidity among women receiving Medicaid: results from service-use data.
J Trauma Stress. 2006;
19:45
-56

[150] Sherman JJ, Turk DC, Okifuji A. Prevalence and impact of posttraumatic stress disorder-like symptoms on patients with fibromyalgia syndrome.
Clin J Pain. 2000;
16:127
-34

[151] Sigal LH, Hassett AL. Contributions of societal and geographical environments to « chronic Lyme disease »: the psychopathogenesis and aporology of a new « medically unexplained symptoms » syndrome.
Environ Health Perspect. 2002;
110; Suppl 4:607
-11

[152] Sivertsen B, Lallukka T, Salo P, et al . Insomnia as a risk factor for ill health: results from the large population-based prospective HUNT Study in Norway.
J Sleep Res. 2014;
23:124
-32

[153] Stehlik R, Arvidsson L, Ulfberg J. Restless legs syndrome is common among female patients with fibromyalgia.
Eur Neurol. 2009;
61:107
-11

[154] Stone AL, Wilson AC. Transmission of risk from parents with chronic pain to offspring: an integrative conceptual model.
Pain. 2016;
157:2628
-39

[155] Su C-H, Chen J-H, Lan J-L, et al . Increased risk of coronary heart disease in patients with primary fibromyalgia and those with concomitant comorbidity-A Taiwanese population-based cohort study.
PLoS One. 2015;
10: e0137137p.

[156] Taylor ML, Trotter DR, Csuka ME. The prevalence of sexual abuse in women with fibromyalgia.
Arthritis Rheum. 1995;
38:229
-34

[157] Thieme K, Turk DC, Flor H. Comorbid depression and anxiety in fibromyalgia syndrome: relationship to somatic and psychosocial variables.
Psychosomatic Medicine. 2004;
66:837
-44

[158] Tingle AJ, Mitchell LA, Grace M, et al . Randomised double-blind placebo-controlled study on adverse effects of rubella immunisation in seronegative women.
Lancet. 1997;
349:1277
-81

[159] Tishler M, Smorodin T, Vazina-Amit M, et al . Fibromyalgia in diabetes mellitus.
Rheumatol Int. 2003;
23:171
-3

[160] Tommaso M de, Federici A, Serpino C, et al . Clinical features of headache patients with fibromyalgia comorbidity.
J Headache Pain. 2011;
12:629
-38

[161] Tommaso M de, Sardaro M, Serpino C, et al . Fibromyalgia comorbidity in primary headaches.
Cephalalgia. 2009;
29:453
-64

[162] Tovoli F, Giampaolo L, Caio G, et al . Fibromyalgia and coeliac disease: a media hype or an emerging clinical problem?.
Clin Exp Rheumatol. 2013;
31:S50
-52

[163] Trojan DA, Cashman NR. Fibromyalgia is common in a postpoliomyelitis clinic.
Arch. Neurol. 1995;
52:620
-4

[164] Tsai P-S, Fan Y-C, Huang C-J. Fibromyalgia is associated with coronary heart disease.
Reg Anesth Pain Med. 2015;
40:37
-42

[165] Vincent A, Lahr BD, Wolfe F, et al . Prevalence of fibromyalgia: a population-based study in Olmsted County, Minnesota, utilizing the Rochester Epidemiology Project.
Arthritis Care Res (Hoboken). 2013;
65:786
-92

[166] Viniol A, Jegan N, Leonhardt C, et al . Differences between patients with chronic widespread pain and local chronic low back pain in primary care-a comparative cross-sectional analysis.
BMC Musculoskelet Disord. 2013;
14: 351p.

[167] Vishne T, Fostick L, Silberman A, et al . Fibromyalgia among major depression disorder females compared to males.
Rheumatol Int. 2008;
28:831
-6

[168] Walitt B, Katz RS, Bergman MJ, et al . Three-quarters of persons in the US population reporting a clinical diagnosis of fibromyalgia do not satisfy fibromyalgia criteria: the 2012 National Health Interview Survey.
PLoS One. 2016;
11: e0157235p.

[169] Walitt B, Nahin RL, Katz RS, et al . The prevalence and characteristics of fibromyalgia in the 2012 National Health Interview Survey.
PLoS One. 2015;
10: e0138024p.

[170] Walker E, Keegan D, Gardner G, et al . Psychosocial factors in fibromyalgia compared with rheumatoid arthritis: II. Sexual, physical, and emotional abuse and neglect.
Psychosom Med. 1997;
59:572
-7

[171] Weir PT, Harlan GA, Nkoy FL, et al . The incidence of fibromyalgia and its associated comorbidities: a population-based retrospective cohort study based on International Classification of Diseases, 9th Revision codes.
J Clin Rheumatol. 2006;
12:124
-8

[172] White KP, Carette S, Harth M, et al . Trauma and fibromyalgia: is there an association and what does it mean?.
Semin Arthritis Rheum. 2000;
29:200
-16

[173] Wolfe F. Post-traumatic fibromyalgia: a case report narrated by the patient.
Arthritis Care Res. 1994;
7:161
-5

[174] Wolfe F, Häuser W. Fibromyalgia diagnosis and diagnostic criteria.
Ann Med. 2011;
43:495
-502

[175] Wolfe F, Brähler E, Hinz A, et al . Fibromyalgia prevalence, somatic symptom reporting, and the dimensionality of polysymptomatic distress: results from a survey of the general population.
Arthritis Care Res (Hoboken). 2013;
65:777
-85

[176] Wolfe F, Clauw DJ, Fitzcharles M-A, et al . The American College of Rheumatology preliminary diagnostic criteria for fibromyalgia and measurement of symptom severity.
Arthritis Care Res (Hoboken). 2010;
62:600
-10

[177] Wolfe F, Clauw DJ, Fitzcharles M-A, et al . Fibromyalgia criteria and severity scales for clinical and epidemiological studies: a modification of the ACR preliminary diagnostic criteria for fibromyalgia.
J Rheumatol. 2011;
38:1113
-22

[178] Wolfe F, Clauw DJ, Fitzcharles M-A, et al . 2016 Revisions to the 2010/2011 fibromyalgia diagnostic criteria.
Semin Arthritis Rheum. 2016;
46:319
-29

[179] Wolfe F, Haüser W, Walitt BT, et al . Fibromyalgia and physical trauma: the concepts we invent.
J Rheumatol. 2014;
41:1737
-45

[180] Wolfe F, Petri M, Alarcón GS, et al . Fibromyalgia, systemic lupus erythematosus (SLE), and evaluation of SLE activity.
J Rheumatol. 2009;
36:82
-8

[181] Wolfe F, Ross K, Anderson J, et al . The prevalence and characteristics of fibromyalgia in the general population.
Arthritis Rheum. 1995;
38:19
-28

[182] Wolfe F, Smythe HA, Yunus MB, et al . The American College of Rheumatology 1990 Criteria for the classification of fibromyalgia. Report of the Multicenter Criteria Committee.
Arthritis Rheum. 1990;
33:160
-72

[183] Wormser GP, Weitzner E, McKenna D, et al . Long-term assessment of fibromyalgia in patients with culture-confirmed Lyme disease.
Arthritis Rheumatol. 2015;
67:837
-9

[184] Wu Y-L, Chang L-Y, Lee H-C, et al . Sleep disturbances in fibromyalgia: A meta-analysis of case-control studies.
J Psychosom Res. 2017;
96:89
-97

[185] Yanmaz MN, Mert M, Korkmaz M. The prevalence of fibromyalgia syndrome in a group of patients with diabetes mellitus.
Rheumatol Int. 2011;
32:871
-4

[186] Yavne Y, Amital D, Watad A, et al . A systematic review of precipitating physical and psychological traumatic events in the development of fibromyalgia.
Semin Arthritis Rheum. 2018;
48:121
-33

[187] Yilmaz U, Bird TT, Carter GT, et al . Pain in hereditary neuropathy with liability to pressure palsy: an association with fibromyalgia syndrome?.
Muscle Nerve. 2015;
51:385
-90

[188] Yunus MB. The prevalence of fibromyalgia in other chronic pain conditions.
Pain Res Treat. 2012;
2012:1
-8

[189] Yunus MB, Arslan S, Aldag JC. Relationship between body mass index and fibromyalgia features.
Scand. J. Rheumatol. 2002;
31:27
-31

[190] Zhang L, Zhu J, Chen Y, et al . Meta-analysis reveals a lack of association between a common catechol-O-methyltransferase (COMT) polymorphism val
158 met and fibromyalgia.
Int J Clin Exp Pathol. 2014;
7:8489
-97

→ Aller vers SYNTHESE
 ).
). ; Kim et coll., 2011
; Kim et coll., 2011 ; Fayaz et coll., 2016
; Fayaz et coll., 2016 ; Mansfield et coll., 2016
; Mansfield et coll., 2016 ; Andrews et coll., 2018
; Andrews et coll., 2018 ) et du SFM chez l’adulte (Queiroz, 2013
) et du SFM chez l’adulte (Queiroz, 2013 ; Kudlow et coll., 2015
; Kudlow et coll., 2015 ; Heidari et coll., 2017
; Heidari et coll., 2017 ), ainsi que des études épidémiologiques méthodologiquement de bonne qualité (Weir et coll., 2006
), ainsi que des études épidémiologiques méthodologiquement de bonne qualité (Weir et coll., 2006 ; Kim et coll., 2011
; Kim et coll., 2011 ; Perrot et coll., 2011
; Perrot et coll., 2011 ; Kudlow et coll., 2015
; Kudlow et coll., 2015 ; Walitt et coll., 2015
; Walitt et coll., 2015 ; Fayaz et coll., 2016
; Fayaz et coll., 2016 ).
). ) (voir chapitre « Critères diagnostiques, diagnostics différentiels, comorbidités et sous-groupes »).
) (voir chapitre « Critères diagnostiques, diagnostics différentiels, comorbidités et sous-groupes »). ). En 2010, l’ACR a modifié les critères déterminant l’étendue de la douleur dans la fibromyalgie en proposant un index de douleur diffuse prenant en compte 19 zones corporelles. Cet index est considéré comme positif lorsque le patient a ressenti la douleur dans au moins 7 zones au cours de la dernière semaine (ACR 2010).
). En 2010, l’ACR a modifié les critères déterminant l’étendue de la douleur dans la fibromyalgie en proposant un index de douleur diffuse prenant en compte 19 zones corporelles. Cet index est considéré comme positif lorsque le patient a ressenti la douleur dans au moins 7 zones au cours de la dernière semaine (ACR 2010). ) sont communément utilisés pour classifier le SFM et établir sa prévalence et ses facteurs de risque dans la population (Wolfe et Häuser, 2011
) sont communément utilisés pour classifier le SFM et établir sa prévalence et ses facteurs de risque dans la population (Wolfe et Häuser, 2011 ; Ablin et Wolfe, 2017
; Ablin et Wolfe, 2017 ). Ces critères ont évolué et modifié la conception du SFM initialement caractérisé par une douleur chronique diffuse avec existence de points douloureux à la pression vers un syndrome douloureux multisite associé à un cortège de symptômes fonctionnels. Le SFM s’inscrit par conséquent dans un continuum de la douleur (Jones et coll., 2015
). Ces critères ont évolué et modifié la conception du SFM initialement caractérisé par une douleur chronique diffuse avec existence de points douloureux à la pression vers un syndrome douloureux multisite associé à un cortège de symptômes fonctionnels. Le SFM s’inscrit par conséquent dans un continuum de la douleur (Jones et coll., 2015 ) associée à des symptômes fonctionnels variés parfois difficiles à délimiter sur le plan épidémiologique en raison de l’existence de pathologies de chevauchement (Fitzcharles et coll., 2013b
) associée à des symptômes fonctionnels variés parfois difficiles à délimiter sur le plan épidémiologique en raison de l’existence de pathologies de chevauchement (Fitzcharles et coll., 2013b ; Arnold et coll., 2016
; Arnold et coll., 2016 ). Ainsi, les critères ACR de classification ou de diagnostic du SFM influencent diversement la mesure de sa fréquence, les caractéristiques socio-démographiques des personnes concernées, la fréquence des comorbidités et probablement ses facteurs de risque (Arnold et coll., 2016
). Ainsi, les critères ACR de classification ou de diagnostic du SFM influencent diversement la mesure de sa fréquence, les caractéristiques socio-démographiques des personnes concernées, la fréquence des comorbidités et probablement ses facteurs de risque (Arnold et coll., 2016 ).
). ), doit être prise en considération dans l’interprétation des études de sa prévalence car elle modifie sensiblement le profil des patients retenus. Ainsi, Jones et coll., étudiant 4 600 sujets de 25 ans ou plus présentant une CWP, ont montré que les critères de classification successifs du SFM (ACR 1990, ACR 2010, ACR 2010 modifiés) n’identifient pas les mêmes patients, d’une part. D’autre part, seulement 1 patient sur 8 était classé comme souffrant de SFM par les trois jeux de critères ACR (Jones et coll., 2015
), doit être prise en considération dans l’interprétation des études de sa prévalence car elle modifie sensiblement le profil des patients retenus. Ainsi, Jones et coll., étudiant 4 600 sujets de 25 ans ou plus présentant une CWP, ont montré que les critères de classification successifs du SFM (ACR 1990, ACR 2010, ACR 2010 modifiés) n’identifient pas les mêmes patients, d’une part. D’autre part, seulement 1 patient sur 8 était classé comme souffrant de SFM par les trois jeux de critères ACR (Jones et coll., 2015 ). La prévalence du SFM était plus élevée avec les critères ACR modifiés 2010 (2011 ; 5,4 % [IC 95 % 4,7-6,1]) qu’avec les critères ACR 1990 (1,7 % [IC 95 % 0,7-2,8]) ou ACR 2010 (1,2 % [IC 95 % 0,3-2,1]). Point important, la distribution du SFM selon le genre variait considérablement en fonction des critères utilisés (tableau 4.II
). La prévalence du SFM était plus élevée avec les critères ACR modifiés 2010 (2011 ; 5,4 % [IC 95 % 4,7-6,1]) qu’avec les critères ACR 1990 (1,7 % [IC 95 % 0,7-2,8]) ou ACR 2010 (1,2 % [IC 95 % 0,3-2,1]). Point important, la distribution du SFM selon le genre variait considérablement en fonction des critères utilisés (tableau 4.II ). Alors que la prépondérance féminine était une caractéristique importante du SFM selon les critères ACR 1990 (sex-ratio F/H de 13,7/1), celle-ci était moins nette avec les critères ACR 2010 (sex-ratio F/H de 4,8/1, soit une diminution de 64 % de la prédominance féminine) et encore moins avec les critères ACR modifiés 2010 (2011) (sex-ratio F/H 2,3/1, soit une diminution de plus de 83 % de la prédominance féminine). Il en est probablement de même avec les ACR 2016 (non pris en compte dans cette étude). L’existence de comorbidité rhumatologique variait également de manière importante selon les critères adoptés : respectivement 55 %, 28 % et 45 % pour les critères ACR 1990, ACR 2010, et ACR modifiés 2010 (2011).
). Alors que la prépondérance féminine était une caractéristique importante du SFM selon les critères ACR 1990 (sex-ratio F/H de 13,7/1), celle-ci était moins nette avec les critères ACR 2010 (sex-ratio F/H de 4,8/1, soit une diminution de 64 % de la prédominance féminine) et encore moins avec les critères ACR modifiés 2010 (2011) (sex-ratio F/H 2,3/1, soit une diminution de plus de 83 % de la prédominance féminine). Il en est probablement de même avec les ACR 2016 (non pris en compte dans cette étude). L’existence de comorbidité rhumatologique variait également de manière importante selon les critères adoptés : respectivement 55 %, 28 % et 45 % pour les critères ACR 1990, ACR 2010, et ACR modifiés 2010 (2011). )
) ). L’évolution des critères de classification du SFM nécessite donc d’interpréter avec prudence les données de prévalence et les facteurs associés au SFM compte tenu des profils cliniques et sociodémographiques différents induits par ces critères. Ainsi, certaines comorbidités et facteurs associés au SFM définis selon les critères ACR 1990 ont progressivement été inclus dans les critères ultérieurs. Ce point critique doit être pris en compte dans les méta-analyses d’études pouvant reposer sur différentes générations de critères de SFM. Il complique également grandement l’interprétation des données épidémiologiques sur les facteurs prédisposant au SFM.
). L’évolution des critères de classification du SFM nécessite donc d’interpréter avec prudence les données de prévalence et les facteurs associés au SFM compte tenu des profils cliniques et sociodémographiques différents induits par ces critères. Ainsi, certaines comorbidités et facteurs associés au SFM définis selon les critères ACR 1990 ont progressivement été inclus dans les critères ultérieurs. Ce point critique doit être pris en compte dans les méta-analyses d’études pouvant reposer sur différentes générations de critères de SFM. Il complique également grandement l’interprétation des données épidémiologiques sur les facteurs prédisposant au SFM. ; Kim et coll., 2011
; Kim et coll., 2011 ; Cabo-Meseguer et coll., 2017
; Cabo-Meseguer et coll., 2017 ). Il existe peu d’études sur de grandes populations représentatives de la population générale (Walitt et coll., 2015
). Il existe peu d’études sur de grandes populations représentatives de la population générale (Walitt et coll., 2015 ). De nombreuses études portent sur des échantillons limités de la population générale ou de la population cible, qui sont probablement non représentatifs du fait de phénomènes de sélection. Il existe également très peu d’études longitudinales de bonne qualité si bien que les revues systématiques incluent principalement des études transversales ou, plus rarement, cas-témoins (Forseth et coll., 1997
). De nombreuses études portent sur des échantillons limités de la population générale ou de la population cible, qui sont probablement non représentatifs du fait de phénomènes de sélection. Il existe également très peu d’études longitudinales de bonne qualité si bien que les revues systématiques incluent principalement des études transversales ou, plus rarement, cas-témoins (Forseth et coll., 1997 ; Weir et coll., 2006
; Weir et coll., 2006 ; Queiroz, 2013
; Queiroz, 2013 ; Mansfield et coll., 2016
; Mansfield et coll., 2016 ; Heidari et coll., 2017
; Heidari et coll., 2017 ; Andrews et coll., 2018
; Andrews et coll., 2018 ), ce qui limite les études des facteurs de risque du SFM.
), ce qui limite les études des facteurs de risque du SFM. ). D’autres études reposent sur des populations ciblées concernant des patients atteints de SFM ou de comorbidités qui sont recrutées dans des services de rhumatologie ou des centres de lutte contre la douleur. Ces dernières études sont caractérisées par des biais de sélection importants favorisant les cas les plus sévères ou associés à des comorbidités spécifiques dont il faut tenir compte dans l’analyse des données de prévalence ou d’association à des facteurs de risque. Ainsi, il est observé une plus forte prévalence du SFM chez les personnes recrutées dans des centres de rhumatologie ou de lutte contre la douleur spécialisés, et pour lesquelles des comorbidités sont plus souvent diagnostiquées (Heidari et coll., 2017
). D’autres études reposent sur des populations ciblées concernant des patients atteints de SFM ou de comorbidités qui sont recrutées dans des services de rhumatologie ou des centres de lutte contre la douleur. Ces dernières études sont caractérisées par des biais de sélection importants favorisant les cas les plus sévères ou associés à des comorbidités spécifiques dont il faut tenir compte dans l’analyse des données de prévalence ou d’association à des facteurs de risque. Ainsi, il est observé une plus forte prévalence du SFM chez les personnes recrutées dans des centres de rhumatologie ou de lutte contre la douleur spécialisés, et pour lesquelles des comorbidités sont plus souvent diagnostiquées (Heidari et coll., 2017 ).
). ) et plus rarement les questionnaires FIQ (4) et LFES-SQ (4) (Heidari et coll., 2017
) et plus rarement les questionnaires FIQ (4) et LFES-SQ (4) (Heidari et coll., 2017 ). Il en résulte que le SFM est considéré comme sous-diagnostiqué par certains tandis que d’autres considèrent qu’il est sur-diagnostiqué (Wolfe et Häuser, 2011
). Il en résulte que le SFM est considéré comme sous-diagnostiqué par certains tandis que d’autres considèrent qu’il est sur-diagnostiqué (Wolfe et Häuser, 2011 ; Wolfe et coll., 2014
; Wolfe et coll., 2014 ; Borchers et Gershwin, 2015
; Borchers et Gershwin, 2015 ).
). ). La prévalence moyenne de la CWP est estimée à 10,6 % [IC 95 % 8,6-12,9] pour l’ensemble des études et à 11,8 % [IC 95 % 10,3-13,2] lorsque la méta-analyse est restreinte aux 6 études comportant le moins de biais méthodologiques (Mansfield et coll., 2016
). La prévalence moyenne de la CWP est estimée à 10,6 % [IC 95 % 8,6-12,9] pour l’ensemble des études et à 11,8 % [IC 95 % 10,3-13,2] lorsque la méta-analyse est restreinte aux 6 études comportant le moins de biais méthodologiques (Mansfield et coll., 2016 ). La mise à jour des données par une seconde méta-analyse des études publiées entre 1990 et 2017 donne une estimation de la prévalence de la CWP du même ordre : 9,6 % [IC 95 % 8,0-11,2] (Andrews et coll., 2018
). La mise à jour des données par une seconde méta-analyse des études publiées entre 1990 et 2017 donne une estimation de la prévalence de la CWP du même ordre : 9,6 % [IC 95 % 8,0-11,2] (Andrews et coll., 2018 ).
). ).
). ; Andrews et coll., 2018
; Andrews et coll., 2018 ).
). ; Andrews et coll., 2018
; Andrews et coll., 2018 ).
). ; Clauw et Crofford, 2003
; Clauw et Crofford, 2003 ; Gran, 2003
; Gran, 2003 ; Yunus, 2012
; Yunus, 2012 ; Fitzcharles et coll., 2013b
; Fitzcharles et coll., 2013b ; Wolfe et coll., 2013
; Wolfe et coll., 2013 ; Borchers et Gershwin, 2015
; Borchers et Gershwin, 2015 ). Des estimations plus récentes de prévalence du SFM, reposant majoritairement sur les critères ACR 1990, menées par méta-analyses conduisent de manière concordante à des valeurs comparables. Une méta-analyse récente a considéré 44 études publiées avant 2015 concernant plus de 3,6 millions de personnes recrutées dans la population générale ou des sous-populations spécifiques de plusieurs pays. Dans l’étude d’Heidari et coll. (2017
). Des estimations plus récentes de prévalence du SFM, reposant majoritairement sur les critères ACR 1990, menées par méta-analyses conduisent de manière concordante à des valeurs comparables. Une méta-analyse récente a considéré 44 études publiées avant 2015 concernant plus de 3,6 millions de personnes recrutées dans la population générale ou des sous-populations spécifiques de plusieurs pays. Dans l’étude d’Heidari et coll. (2017 ), la prévalence moyenne du SFM toutes populations et âges confondus était estimée à 1,78 % [1,65-1,92] (tableau 4.III
), la prévalence moyenne du SFM toutes populations et âges confondus était estimée à 1,78 % [1,65-1,92] (tableau 4.III ; Heidari et coll., 2017
; Heidari et coll., 2017 ). En raison de la sélection des patients, des valeurs nettement plus élevées étaient observées dans des sous-populations spécifiques, comme celles recrutées dans les services de rhumatologie ou de médecine interne (15,2 % [13,6-16,9]) ou des patients présentant une comorbidité telle qu’une colopathie fonctionnelle (12,9 % [12,7-13,1]), une insuffisance rénale requérant une hémodialyse (6,3 % [4,6-7,9]) ou un diabète de type 2 (14,8 % [11,1-18,4] ; Heidari et coll., 2017
). En raison de la sélection des patients, des valeurs nettement plus élevées étaient observées dans des sous-populations spécifiques, comme celles recrutées dans les services de rhumatologie ou de médecine interne (15,2 % [13,6-16,9]) ou des patients présentant une comorbidité telle qu’une colopathie fonctionnelle (12,9 % [12,7-13,1]), une insuffisance rénale requérant une hémodialyse (6,3 % [4,6-7,9]) ou un diabète de type 2 (14,8 % [11,1-18,4] ; Heidari et coll., 2017 ). Une méta-analyse publiée en 2013 a estimé la prévalence mondiale toutes populations et âges confondus du SFM dans un même ordre de grandeur : 2,7 % (IC 95 % non calculé ; Queiroz, 2013
). Une méta-analyse publiée en 2013 a estimé la prévalence mondiale toutes populations et âges confondus du SFM dans un même ordre de grandeur : 2,7 % (IC 95 % non calculé ; Queiroz, 2013 ).
). )
) ). Les estimations sont du même ordre de grandeur pour la population générale française. L’étude DEFI utilisant une procédure diagnostique multi-étape (questionnaire LFES-SQ et examen clinique mené par un rhumatologue) auprès d’un échantillon représentatif de foyers français a estimé la prévalence du SFM à 1,6 % [1,2-2,0] (Perrot et coll., 2011
). Les estimations sont du même ordre de grandeur pour la population générale française. L’étude DEFI utilisant une procédure diagnostique multi-étape (questionnaire LFES-SQ et examen clinique mené par un rhumatologue) auprès d’un échantillon représentatif de foyers français a estimé la prévalence du SFM à 1,6 % [1,2-2,0] (Perrot et coll., 2011 ). Une étude plus ancienne réalisée auprès d’un échantillon représentatif de 1 014 Français utilisant le questionnaire LFES-SQ à 4 ou 6 items complété par un examen clinique mené par un rhumatologue (critères ACR 1990) a estimé la prévalence française du SFM à 2,2 % [1,3-3,1] sur la base du questionnaire LFES-SQ à 4 items et à 1,4 % [0,7-0,7] sur la base du questionnaire LFES-SQ à 6 items (Bannwarth et coll., 2009
). Une étude plus ancienne réalisée auprès d’un échantillon représentatif de 1 014 Français utilisant le questionnaire LFES-SQ à 4 ou 6 items complété par un examen clinique mené par un rhumatologue (critères ACR 1990) a estimé la prévalence française du SFM à 2,2 % [1,3-3,1] sur la base du questionnaire LFES-SQ à 4 items et à 1,4 % [0,7-0,7] sur la base du questionnaire LFES-SQ à 6 items (Bannwarth et coll., 2009 ). Une étude similaire menée dans 5 pays européens estimait la prévalence du SFM pour l’ensemble des pays à 4,7 % [4,0-3,4] sur la base du questionnaire LFES-SQ à 4 items et à 2,9 % [2,4-3,4] sur la base du questionnaire LFES-SQ à 6 items (Branco et coll., 2010
). Une étude similaire menée dans 5 pays européens estimait la prévalence du SFM pour l’ensemble des pays à 4,7 % [4,0-3,4] sur la base du questionnaire LFES-SQ à 4 items et à 2,9 % [2,4-3,4] sur la base du questionnaire LFES-SQ à 6 items (Branco et coll., 2010 ). Comme le montre le tableau 4.IV
). Comme le montre le tableau 4.IV , la prévalence était systématiquement plus élevée chez les femmes, et il existait des variations en fonction de la zone géographique.
, la prévalence était systématiquement plus élevée chez les femmes, et il existait des variations en fonction de la zone géographique. ).
). ). Comme le montre l’étude de Jones et coll. décrite plus haut, le ratio femmes/hommes est plus élevé lorsque l’on utilise les critères de classification ACR 1990 (ratio F/H de 13,7/1) que les versions ultérieures (ratio F/H de 2,3-4,8/1 ; Jones et coll., 2015
). Comme le montre l’étude de Jones et coll. décrite plus haut, le ratio femmes/hommes est plus élevé lorsque l’on utilise les critères de classification ACR 1990 (ratio F/H de 13,7/1) que les versions ultérieures (ratio F/H de 2,3-4,8/1 ; Jones et coll., 2015 ).
). et 4.V
et 4.V ; Bannwarth et coll., 2009
; Bannwarth et coll., 2009 ; Queiroz, 2013
; Queiroz, 2013 ; Vincent et coll., 2013
; Vincent et coll., 2013 ; Walitt et coll., 2015
; Walitt et coll., 2015 ; Heidari et coll., 2017
; Heidari et coll., 2017 ). Ces ratios de prévalence selon le genre sont proches de ceux observés pour la CWP (Mansfield et coll., 2016
). Ces ratios de prévalence selon le genre sont proches de ceux observés pour la CWP (Mansfield et coll., 2016 ). La plus forte prévalence du SFM chez les femmes peut refléter des différences physiologiques, telles qu’une plus forte sensibilité à la pression cutanée (évoquée pour les études reposant sur les critères ACR 1990 ; Jones et coll., 2015
). La plus forte prévalence du SFM chez les femmes peut refléter des différences physiologiques, telles qu’une plus forte sensibilité à la pression cutanée (évoquée pour les études reposant sur les critères ACR 1990 ; Jones et coll., 2015 ), mais aussi psychologiques et socio-culturelles, telles qu’une demande de soins plus aisément effectuée par les femmes ou une moindre tendance des médecins à diagnostiquer un SFM chez les hommes (voir pour revues Gran, 2003
), mais aussi psychologiques et socio-culturelles, telles qu’une demande de soins plus aisément effectuée par les femmes ou une moindre tendance des médecins à diagnostiquer un SFM chez les hommes (voir pour revues Gran, 2003 ; Borchers et Gershwin, 2015
; Borchers et Gershwin, 2015 ). Compte tenu de la multiplicité des facteurs en cause, la prépondérance féminine observée dans les études de prévalence ne permet pas de conclure avec certitude à une prédisposition physiologique (Borchers et Gershwin, 2015
). Compte tenu de la multiplicité des facteurs en cause, la prépondérance féminine observée dans les études de prévalence ne permet pas de conclure avec certitude à une prédisposition physiologique (Borchers et Gershwin, 2015 ).
). ; Bannwarth et coll., 2009
; Bannwarth et coll., 2009 ; Branco et coll., 2010
; Branco et coll., 2010 ; Queiroz, 2013
; Queiroz, 2013 ; Walitt et coll., 2015
; Walitt et coll., 2015 ). La plupart des études montrent que la prévalence du SFM est faible (≤ 1 %) chez les jeunes adultes (moins de 25-30 ans). Ainsi, l’enquête épidémiologique NIHS 2012 a montré une prévalence du SFM de moins de 1 % (0,8 %) chez les moins de 30 ans, une augmentation continue avec l’âge jusqu’à une valeur plateau de 2,4 % pour la classe d’âge 50-59 ans suivie d’une décroissance progressive jusqu’à 85 ans (Walitt et coll., 2015
). La plupart des études montrent que la prévalence du SFM est faible (≤ 1 %) chez les jeunes adultes (moins de 25-30 ans). Ainsi, l’enquête épidémiologique NIHS 2012 a montré une prévalence du SFM de moins de 1 % (0,8 %) chez les moins de 30 ans, une augmentation continue avec l’âge jusqu’à une valeur plateau de 2,4 % pour la classe d’âge 50-59 ans suivie d’une décroissance progressive jusqu’à 85 ans (Walitt et coll., 2015 ). Par contre, si l’étude du SFM dans 5 pays européens montrait une prévalence globale inférieure à 1 % pour les moins de 25 ans, elle observait une augmentation progressive de la prévalence jusqu’à 8 % pour la classe d’âge 75-84 ans, cette augmentation continue avec l’âge étant observée pour les deux sexes (Branco et coll., 2010
). Par contre, si l’étude du SFM dans 5 pays européens montrait une prévalence globale inférieure à 1 % pour les moins de 25 ans, elle observait une augmentation progressive de la prévalence jusqu’à 8 % pour la classe d’âge 75-84 ans, cette augmentation continue avec l’âge étant observée pour les deux sexes (Branco et coll., 2010 ). Certaines études n’ont pas observé d’augmentation de la prévalence de la FM avec l’âge, sans que les auteurs n’apportent d’explications autres que méthodologiques à cette différence (Perrot et coll., 2011
). Certaines études n’ont pas observé d’augmentation de la prévalence de la FM avec l’âge, sans que les auteurs n’apportent d’explications autres que méthodologiques à cette différence (Perrot et coll., 2011 ).
). ; Heidari et coll., 2017
; Heidari et coll., 2017 ). L’incidence du SFM défini par les critères ACR 1990 a été estimée à 580 nouveaux cas pour 100 000 personnes par année en 1995 dans une population féminine norvégienne (Forseth et coll., 1997
). L’incidence du SFM défini par les critères ACR 1990 a été estimée à 580 nouveaux cas pour 100 000 personnes par année en 1995 dans une population féminine norvégienne (Forseth et coll., 1997 ). L’étude des bases de données d’assurance américaines de bonne qualité méthodologique a permis d’estimer, à l’aide des codes CIM-10, l’incidence du SFM au sein d’une cohorte rétrospective de grande taille (151 344 hommes et 154 822 femmes) à respectivement 688 et 1 128 nouveaux cas pour 100 000 personnes par année chez les hommes et les femmes (Weir et coll., 2006
). L’étude des bases de données d’assurance américaines de bonne qualité méthodologique a permis d’estimer, à l’aide des codes CIM-10, l’incidence du SFM au sein d’une cohorte rétrospective de grande taille (151 344 hommes et 154 822 femmes) à respectivement 688 et 1 128 nouveaux cas pour 100 000 personnes par année chez les hommes et les femmes (Weir et coll., 2006 ). Le risque de développer un SFM chez les femmes était 1,64 fois plus élevé (1,59-1,69) que chez les hommes. L’incidence du SFM augmentait avec l’âge pour les deux sexes avant d’atteindre un plateau à partir de 40 ans chez les hommes (environ 1 200 cas pour 100 000 entre 40 et 65 ans) et 45 ans chez les femmes (environ 2 100 cas pour 100 000 entre 40 et 65 ans).
). Le risque de développer un SFM chez les femmes était 1,64 fois plus élevé (1,59-1,69) que chez les hommes. L’incidence du SFM augmentait avec l’âge pour les deux sexes avant d’atteindre un plateau à partir de 40 ans chez les hommes (environ 1 200 cas pour 100 000 entre 40 et 65 ans) et 45 ans chez les femmes (environ 2 100 cas pour 100 000 entre 40 et 65 ans). ) (figure 4.1
) (figure 4.1 ). L’incidence du SFM pour 100 000 personnes a globalement augmenté au cours de la période 2001–2011, passant de 32,3 (30,4-34,3) en 2001 à 38,2 (36,3-40,1) en 2013. Les femmes britanniques avaient une incidence 6 fois plus élevée que celle des hommes, avec un pic observé pour la classe d’âge 40-49 ans (Collin et coll., 2017
). L’incidence du SFM pour 100 000 personnes a globalement augmenté au cours de la période 2001–2011, passant de 32,3 (30,4-34,3) en 2001 à 38,2 (36,3-40,1) en 2013. Les femmes britanniques avaient une incidence 6 fois plus élevée que celle des hommes, avec un pic observé pour la classe d’âge 40-49 ans (Collin et coll., 2017 ).
).
 )
) ; Wolfe et coll., 2016
; Wolfe et coll., 2016 ). Ces symptômes sont distribués selon un continuum allant de peu à beaucoup et de léger à sévère au sein de la population générale, le SFM représentant pour certains le versant « sévère » de ce continuum (Arnold et coll., 2016
). Ces symptômes sont distribués selon un continuum allant de peu à beaucoup et de léger à sévère au sein de la population générale, le SFM représentant pour certains le versant « sévère » de ce continuum (Arnold et coll., 2016 ).
). ) (Borchers et Gershwin, 2015
) (Borchers et Gershwin, 2015 ; Arnold et coll., 2016
; Arnold et coll., 2016 ; Perrot et coll., 2017
; Perrot et coll., 2017 ; Fitzcharles et coll., 2018
; Fitzcharles et coll., 2018 ). Les comorbidités sont importantes à prendre en compte en raison de leur impact parfois important sur la qualité de vie et le pronostic fonctionnel du SFM, et de la possibilité voire la nécessité suivant leur sévérité, pour certaines comorbidités, de les traiter spécifiquement.
). Les comorbidités sont importantes à prendre en compte en raison de leur impact parfois important sur la qualité de vie et le pronostic fonctionnel du SFM, et de la possibilité voire la nécessité suivant leur sévérité, pour certaines comorbidités, de les traiter spécifiquement. ). Il est souvent fait état dans la littérature de facteurs de risque de SFM sans qu’il soit toujours possible de généraliser les résultats à l’ensemble du SFM compte tenu du caractère hétérogène de sa présentation clinique, de son association avec des comorbidités et probablement de ses facteurs de risque (Borchers et Gershwin, 2015
). Il est souvent fait état dans la littérature de facteurs de risque de SFM sans qu’il soit toujours possible de généraliser les résultats à l’ensemble du SFM compte tenu du caractère hétérogène de sa présentation clinique, de son association avec des comorbidités et probablement de ses facteurs de risque (Borchers et Gershwin, 2015 ). La complexité et la variabilité de l’expression phénotypique du SFM suggèrent l’existence de nombreux déterminants, qu’ils soient biologiques, psychologiques ou sociaux, dont certains seraient plus marqués dans tel ou tel sous-groupe de patients. De nombreux facteurs de risque ne sont pas spécifiques du SFM mais s’observent dans la plupart des syndromes douloureux chroniques, tels que les lombalgies ou la CWP, cette dernière présentant de nombreuses caractéristiques communes avec le SFM (Borchers et Gershwin, 2015
). La complexité et la variabilité de l’expression phénotypique du SFM suggèrent l’existence de nombreux déterminants, qu’ils soient biologiques, psychologiques ou sociaux, dont certains seraient plus marqués dans tel ou tel sous-groupe de patients. De nombreux facteurs de risque ne sont pas spécifiques du SFM mais s’observent dans la plupart des syndromes douloureux chroniques, tels que les lombalgies ou la CWP, cette dernière présentant de nombreuses caractéristiques communes avec le SFM (Borchers et Gershwin, 2015 ).
). ). D’une manière générale, les données de la littérature suggèrent l’existence de sous-groupes de patients souffrant de SFM associés à des comorbidités (par exemple troubles psychiatriques, cervicalgies) ou à des facteurs « spécifiques » à certains sous-groupes (abus sexuels dans l’enfance ou traumatisme cervical par exemple) plutôt que communs à l’ensemble des patients.
). D’une manière générale, les données de la littérature suggèrent l’existence de sous-groupes de patients souffrant de SFM associés à des comorbidités (par exemple troubles psychiatriques, cervicalgies) ou à des facteurs « spécifiques » à certains sous-groupes (abus sexuels dans l’enfance ou traumatisme cervical par exemple) plutôt que communs à l’ensemble des patients. ; Neumann et Buskila, 2003
; Neumann et Buskila, 2003 ; Borchers et Gershwin, 2015
; Borchers et Gershwin, 2015 ; Wu et coll., 2017
; Wu et coll., 2017 ) (voir aussi chapitre « Perturbations du sommeil et troubles psychiatriques dans le syndrome fibromyalgique »). Une méta-analyse récente (Wu et coll., 2017
) (voir aussi chapitre « Perturbations du sommeil et troubles psychiatriques dans le syndrome fibromyalgique »). Une méta-analyse récente (Wu et coll., 2017 ) ayant inclus 25 études cas-témoins portant sur 2 086 personnes, confirme l’importance des troubles du sommeil dans le SFM, et ce quelle que soit la méthode d’analyse du sommeil utilisée (polysomnographie, questionnaire de qualité du sommeil...). Les résultats concernant l’association entre SFM et apnée du sommeil étaient discordants, certaines études rapportant des prévalences élevées (> 20 %) et d’autres faibles (< 5 %, tableau 4.VI
) ayant inclus 25 études cas-témoins portant sur 2 086 personnes, confirme l’importance des troubles du sommeil dans le SFM, et ce quelle que soit la méthode d’analyse du sommeil utilisée (polysomnographie, questionnaire de qualité du sommeil...). Les résultats concernant l’association entre SFM et apnée du sommeil étaient discordants, certaines études rapportant des prévalences élevées (> 20 %) et d’autres faibles (< 5 %, tableau 4.VI , Fitzcharles et coll., 2018
, Fitzcharles et coll., 2018 ).
). ). Cependant, il existe probablement une relation bidirectionnelle entre SFM et troubles du sommeil, car si la douleur majore les troubles du sommeil, les troubles du sommeil peuvent aggraver la symptomatologie douloureuse au cours du SFM, comme cela est observé pour la CWP (Borchers et Gershwin, 2015
). Cependant, il existe probablement une relation bidirectionnelle entre SFM et troubles du sommeil, car si la douleur majore les troubles du sommeil, les troubles du sommeil peuvent aggraver la symptomatologie douloureuse au cours du SFM, comme cela est observé pour la CWP (Borchers et Gershwin, 2015 ; Choy, 2015
; Choy, 2015 ; Andrade et coll., 2018
; Andrade et coll., 2018 ).
). )
) ) (voir aussi chapitre « Perturbations du sommeil et troubles psychiatriques dans le syndrome fibromyalgique »). Ceci est confirmé par de nombreuses études rapportant la coexistence du SFM avec des états de stress post-traumatiques chroniques, des troubles psychologiques et de santé mentale de type anxiété ou dépression (Thieme et coll., 2004
) (voir aussi chapitre « Perturbations du sommeil et troubles psychiatriques dans le syndrome fibromyalgique »). Ceci est confirmé par de nombreuses études rapportant la coexistence du SFM avec des états de stress post-traumatiques chroniques, des troubles psychologiques et de santé mentale de type anxiété ou dépression (Thieme et coll., 2004 ; Häuser et coll., 2013
; Häuser et coll., 2013 ; Cuevas-Toro et coll., 2014
; Cuevas-Toro et coll., 2014 ; Brown et coll., 2016
; Brown et coll., 2016 ; Bondesson et coll., 2018
; Bondesson et coll., 2018 ). Néanmoins, la forte prévalence de comorbidités psychiatriques chez les patients atteints de SFM s’observe plus dans les études en milieu de soins qu’en population, ce qui peut s’expliquer par des phénomènes de sélection (Raphael et coll., 2006
). Néanmoins, la forte prévalence de comorbidités psychiatriques chez les patients atteints de SFM s’observe plus dans les études en milieu de soins qu’en population, ce qui peut s’expliquer par des phénomènes de sélection (Raphael et coll., 2006 ).
). ; Thieme et coll., 2004
; Thieme et coll., 2004 ; Arnold et coll., 2006
; Arnold et coll., 2006 ; Fuller-Thomson et coll., 2011
; Fuller-Thomson et coll., 2011 ; Häuser et coll., 2013
; Häuser et coll., 2013 ; Cuevas-Toro et coll., 2014
; Cuevas-Toro et coll., 2014 ; Brown et coll., 2016
; Brown et coll., 2016 ; Bondesson et coll., 2018
; Bondesson et coll., 2018 ). Cependant, d’autres études ont observé des prévalences comparables à ce qui est observé dans d’autres pathologies, comme la polyarthrite rhumatoïde (PR) (Borchers et Gershwin, 2015
). Cependant, d’autres études ont observé des prévalences comparables à ce qui est observé dans d’autres pathologies, comme la polyarthrite rhumatoïde (PR) (Borchers et Gershwin, 2015 ). De plus, les résultats divergent selon le lieu de recrutement des personnes souffrant de SFM et l’existence de phénomènes de sélection des patients sur leur état de santé, mais aussi du fait de l’hétérogénéité du SFM (Thieme et coll., 2004
). De plus, les résultats divergent selon le lieu de recrutement des personnes souffrant de SFM et l’existence de phénomènes de sélection des patients sur leur état de santé, mais aussi du fait de l’hétérogénéité du SFM (Thieme et coll., 2004 ; Raphael et coll., 2006
; Raphael et coll., 2006 ).
). ; Bondesson et coll., 2018
; Bondesson et coll., 2018 ), il est probable que, comme pour la douleur chronique, il existe plusieurs sous-groupes de SFM (Thieme et coll., 2004
), il est probable que, comme pour la douleur chronique, il existe plusieurs sous-groupes de SFM (Thieme et coll., 2004 ; Borchers et Gershwin, 2015
; Borchers et Gershwin, 2015 ). Les plus importants, en termes de nombre de patients, sont probablement les sous-groupes associés à une dépression probablement plutôt réactionnelle à la douleur, insomnie, etc. que primitive, une dépression caractérisée pouvant conduire à une amplification des symptômes fibromyalgiques (Jain et coll., 2003
). Les plus importants, en termes de nombre de patients, sont probablement les sous-groupes associés à une dépression probablement plutôt réactionnelle à la douleur, insomnie, etc. que primitive, une dépression caractérisée pouvant conduire à une amplification des symptômes fibromyalgiques (Jain et coll., 2003 ; Borchers et Gershwin, 2015
; Borchers et Gershwin, 2015 ; Gota et coll., 2017
; Gota et coll., 2017 ).
). ). Ainsi, la méta-analyse de 8 études de qualité variable a montré que la prévalence des troubles bipolaires dans le SFM était voisine de 20 % mais avec de larges variations selon les études (0-70 %). Sur la base de 4 études cas-témoins portant sur 268 patients SFM et 413 témoins, il existait une association forte entre troubles bipolaires et SFM (OR égal à 7,6 [3,9-14,6]) (Kudlow et coll., 2015
). Ainsi, la méta-analyse de 8 études de qualité variable a montré que la prévalence des troubles bipolaires dans le SFM était voisine de 20 % mais avec de larges variations selon les études (0-70 %). Sur la base de 4 études cas-témoins portant sur 268 patients SFM et 413 témoins, il existait une association forte entre troubles bipolaires et SFM (OR égal à 7,6 [3,9-14,6]) (Kudlow et coll., 2015 ).
). ) (Wolfe et coll., 1990
) (Wolfe et coll., 1990 ; Duffield et coll., 2018
; Duffield et coll., 2018 ; Fitzcharles et coll., 2018
; Fitzcharles et coll., 2018 ). Au sein de la cohorte de la National American Database incluant 6 000 patients, un SFM était présent chez 21 % des patients ayant un diagnostic de PR et 17 % ayant un diagnostic d’arthrose (Wolfe et coll., 2011
). Au sein de la cohorte de la National American Database incluant 6 000 patients, un SFM était présent chez 21 % des patients ayant un diagnostic de PR et 17 % ayant un diagnostic d’arthrose (Wolfe et coll., 2011 ; Fitzcharles et coll., 2018
; Fitzcharles et coll., 2018 ). Des chiffres similaires de comorbidité rhumatologique ont été observés chez des patients français, avec une prévalence de SFM comprise entre 19 et 22 % pour les patients souffrant de PR dans une étude conduite dans quatre hôpitaux universitaires en utilisant comme critère de classification le questionnaire FiRST, les critères ACR 1990 ou ACR modifiés 2010 (2011) (Perrot et coll., 2017
). Des chiffres similaires de comorbidité rhumatologique ont été observés chez des patients français, avec une prévalence de SFM comprise entre 19 et 22 % pour les patients souffrant de PR dans une étude conduite dans quatre hôpitaux universitaires en utilisant comme critère de classification le questionnaire FiRST, les critères ACR 1990 ou ACR modifiés 2010 (2011) (Perrot et coll., 2017 ). Selon une méta-analyse récente de 40 articles, la prévalence du SFM dans les PR serait comprise entre 4,9 et 52,4 % avec une prévalence moyenne pondérée de 20 %. Elle serait comprise entre 9,6 et 27,2 % (moyenne pondérée de 13 %) dans la spondylarthrite ankylosante et entre 4,1 et 25,2 % (moyenne pondérée de 13 %) dans le rhumatisme psoriasique (Duffield et coll., 2018
). Selon une méta-analyse récente de 40 articles, la prévalence du SFM dans les PR serait comprise entre 4,9 et 52,4 % avec une prévalence moyenne pondérée de 20 %. Elle serait comprise entre 9,6 et 27,2 % (moyenne pondérée de 13 %) dans la spondylarthrite ankylosante et entre 4,1 et 25,2 % (moyenne pondérée de 13 %) dans le rhumatisme psoriasique (Duffield et coll., 2018 ). Ces formes associées sont plus actives et plus invalidantes pour le patient (Brikman et coll., 2016
). Ces formes associées sont plus actives et plus invalidantes pour le patient (Brikman et coll., 2016 ; Perrot et coll., 2017
; Perrot et coll., 2017 ; Duffield et coll., 2018
; Duffield et coll., 2018 ; Fitzcharles et coll., 2018
; Fitzcharles et coll., 2018 ).
). )
) ; Cakit et coll., 2010
; Cakit et coll., 2010 ; Fitzcharles et coll., 2018
; Fitzcharles et coll., 2018 ). Des associations entre SFM et lupus érythémateux disséminé (LED), sclérodermie et syndrome de Gougerot-Sjögren sont également fréquentes (Wolfe et coll., 2009
). Des associations entre SFM et lupus érythémateux disséminé (LED), sclérodermie et syndrome de Gougerot-Sjögren sont également fréquentes (Wolfe et coll., 2009 ; Wolfe et coll., 2011
; Wolfe et coll., 2011 ; Yunus, 2012
; Yunus, 2012 ; Perrot et coll., 2017
; Perrot et coll., 2017 ; Fitzcharles et coll., 2018
; Fitzcharles et coll., 2018 ). Selon une étude française, la prévalence du SFM serait comprise entre 24 et 30 % chez les patients avec sclérodermie (n = 122) (Perrot et coll., 2017
). Selon une étude française, la prévalence du SFM serait comprise entre 24 et 30 % chez les patients avec sclérodermie (n = 122) (Perrot et coll., 2017 ).
). ; Rehm et coll., 2010
; Rehm et coll., 2010 ; Koroschetz et coll., 2011
; Koroschetz et coll., 2011 ; Clemenzi et coll., 2014
; Clemenzi et coll., 2014 ). Une étude de la population canadienne de bonne qualité méthodologique a montré une prévalence du SFM double dans la population atteinte de sclérose en plaques comparée à la population générale : 6,82 % (IC 95 % : 5,91-7,72) vs 3,04 % (IC 95 % : 2,77-3,32). Après ajustement sur l’âge, le sexe et l’année, l’incidence du SFM était plus élevée de 44 % en cas de sclérose en plaques (ratio d’incidence : 1,44 (IC 95 % : 1,01-2,07) (Marrie et coll., 2012
). Une étude de la population canadienne de bonne qualité méthodologique a montré une prévalence du SFM double dans la population atteinte de sclérose en plaques comparée à la population générale : 6,82 % (IC 95 % : 5,91-7,72) vs 3,04 % (IC 95 % : 2,77-3,32). Après ajustement sur l’âge, le sexe et l’année, l’incidence du SFM était plus élevée de 44 % en cas de sclérose en plaques (ratio d’incidence : 1,44 (IC 95 % : 1,01-2,07) (Marrie et coll., 2012 ).
). )
) ; Fitzcharles et coll., 2018
; Fitzcharles et coll., 2018 ). Une étude italienne a ainsi montré une prévalence élevée du SFM (11,4 %) et de la CWP (14,9 %) chez des patients (n = 114) recrutés dans un service de gastro-entérologie spécialisé (Tovoli et coll., 2013
). Une étude italienne a ainsi montré une prévalence élevée du SFM (11,4 %) et de la CWP (14,9 %) chez des patients (n = 114) recrutés dans un service de gastro-entérologie spécialisé (Tovoli et coll., 2013 ). Les colopathies fonctionnelles représentent une pathologie de chevauchement (Weir et coll., 2006
). Les colopathies fonctionnelles représentent une pathologie de chevauchement (Weir et coll., 2006 ; Jeffery et coll., 2014
; Jeffery et coll., 2014 ). Des prévalences très élevées, comprises entre 15 et 32 % ont été rapportées chez les patients avec FM (Fitzcharles et coll., 2018
). Des prévalences très élevées, comprises entre 15 et 32 % ont été rapportées chez les patients avec FM (Fitzcharles et coll., 2018 ). Par contre, les résultats concernant les maladies inflammatoires du colon sont discordants, certaines études rapportant des prévalences élevée (30 %) et d’autres non (3,5 %) chez les patients atteints de SFM (tableau 4.VIII
). Par contre, les résultats concernant les maladies inflammatoires du colon sont discordants, certaines études rapportant des prévalences élevée (30 %) et d’autres non (3,5 %) chez les patients atteints de SFM (tableau 4.VIII ; Fitzcharles et coll., 2018
; Fitzcharles et coll., 2018 ).
). ; Neumann et Buskila, 2003
; Neumann et Buskila, 2003 ; de Tommaso et coll., 2009
; de Tommaso et coll., 2009 , 2011
, 2011 ; Yunus, 2012
; Yunus, 2012 ; Küçükşen et coll., 2013
; Küçükşen et coll., 2013 ; Cho et coll., 2017
; Cho et coll., 2017 ), les douleurs temporo-mandibulaires (prévalences du SFM allant de 13 à 50 % ; Balasubramaniam et coll., 2007
), les douleurs temporo-mandibulaires (prévalences du SFM allant de 13 à 50 % ; Balasubramaniam et coll., 2007 ; Yunus, 2012
; Yunus, 2012 ; Fitzcharles et coll., 2018
; Fitzcharles et coll., 2018 ), le syndrome des jambes sans repos (prévalence de 30 à 50 % dans le SFM ; Stehlik et coll., 2009
), le syndrome des jambes sans repos (prévalence de 30 à 50 % dans le SFM ; Stehlik et coll., 2009 ; Yunus, 2012
; Yunus, 2012 ; Civelek et coll., 2014
; Civelek et coll., 2014 ; Fitzcharles et coll., 2018
; Fitzcharles et coll., 2018 ) ou les syndromes fonctionnels urogénitaux (syndrome de la vessie irritable avec des prévalences du SFM allant de 12 à 20 %, vulvodynies ; Yunus, 2012
) ou les syndromes fonctionnels urogénitaux (syndrome de la vessie irritable avec des prévalences du SFM allant de 12 à 20 %, vulvodynies ; Yunus, 2012 ; Chung et coll., 2013
; Chung et coll., 2013 ; Fitzcharles et coll., 2018
; Fitzcharles et coll., 2018 ).
). . C’est notamment le cas pour les affections thyroïdiennes, qui peuvent représenter des pathologies de chevauchement, telles que les thyroïdites auto-immunes et les hyper-parathyroïdies (Bazzichi et coll., 2007
. C’est notamment le cas pour les affections thyroïdiennes, qui peuvent représenter des pathologies de chevauchement, telles que les thyroïdites auto-immunes et les hyper-parathyroïdies (Bazzichi et coll., 2007 ; Costa et coll., 2016
; Costa et coll., 2016 ; Haliloglu et coll., 2017
; Haliloglu et coll., 2017 ). Plusieurs études ont montré une prévalence élevée du SFM en cas de diabète de type 1 ou de type 2 (comprise entre 17 et 18 %) (Tishler et coll., 2003
). Plusieurs études ont montré une prévalence élevée du SFM en cas de diabète de type 1 ou de type 2 (comprise entre 17 et 18 %) (Tishler et coll., 2003 ; Yanmaz et coll., 2011
; Yanmaz et coll., 2011 ; Okifuji et Hare, 2015
; Okifuji et Hare, 2015 ; Kaleth et coll., 2017
; Kaleth et coll., 2017 ).
). ) (Su et coll., 2015
) (Su et coll., 2015 ; Tsai et coll., 2015
; Tsai et coll., 2015 ; Fitzcharles et coll., 2018
; Fitzcharles et coll., 2018 ).
). ; Arreghini et coll., 2014
; Arreghini et coll., 2014 ; Okifuji et Hare, 2015
; Okifuji et Hare, 2015 ; Koçyiğit et Okyay, 2018
; Koçyiğit et Okyay, 2018 ). Les études concernant les liens entre l’indice de masse corporelle et le SFM ont confirmé ces données. Ainsi, l’étude de Yunus et coll. a montré que plus de 60 % des femmes atteintes de SFM présentaient un surpoids et 32 % une obésité (Yunus et coll., 2002
). Les études concernant les liens entre l’indice de masse corporelle et le SFM ont confirmé ces données. Ainsi, l’étude de Yunus et coll. a montré que plus de 60 % des femmes atteintes de SFM présentaient un surpoids et 32 % une obésité (Yunus et coll., 2002 ). Une étude de 100 patientes avec FM tirées au sort parmi 550 patientes recrutées dans une clinique rhumatologique israélienne a observé une prévalence élevée de surpoids (28 %) et d’obésité (45 % ; Neumann et coll., 2008
). Une étude de 100 patientes avec FM tirées au sort parmi 550 patientes recrutées dans une clinique rhumatologique israélienne a observé une prévalence élevée de surpoids (28 %) et d’obésité (45 % ; Neumann et coll., 2008 ). La sévérité des symptômes (questionnaire FIQ) et l’impact sur la qualité de vie (questionnaire SF36) est plus élevée pour les femmes atteintes de SFM obèses. La prévalence du SFM est très élevée chez les patients obèses : 34 à 45 % chez des patients recrutés dans un centre de chirurgie bariatrique (Dias et al., 2017
). La sévérité des symptômes (questionnaire FIQ) et l’impact sur la qualité de vie (questionnaire SF36) est plus élevée pour les femmes atteintes de SFM obèses. La prévalence du SFM est très élevée chez les patients obèses : 34 à 45 % chez des patients recrutés dans un centre de chirurgie bariatrique (Dias et al., 2017 ). Globalement, les études de prévalence montrent que 32 à 50 % des patients avec SFM sont obèses, 21 à 28 % sont en surpoids, et qu’il y a une plus forte sévérité des symptômes en cas d’obésité (Okifuji et coll., 2009
). Globalement, les études de prévalence montrent que 32 à 50 % des patients avec SFM sont obèses, 21 à 28 % sont en surpoids, et qu’il y a une plus forte sévérité des symptômes en cas d’obésité (Okifuji et coll., 2009 ; Okifuji et coll., 2010
; Okifuji et coll., 2010 ).
). ). Cette étude montre un risque accru de SFM lorsque le surpoids était associé à une absence ou un manque d’activités physiques régulières. Bien que leur mise en pratique soit parfois difficile chez les patients (Arnold et Clauw, 2017
). Cette étude montre un risque accru de SFM lorsque le surpoids était associé à une absence ou un manque d’activités physiques régulières. Bien que leur mise en pratique soit parfois difficile chez les patients (Arnold et Clauw, 2017 ), la pratique régulière d’activité physique adaptée et la lutte contre le surpoids sont recommandées dans la FM comme dans les autres formes de douleurs chroniques par de nombreux auteurs et sociétés savantes (Häuser et coll., 2010
), la pratique régulière d’activité physique adaptée et la lutte contre le surpoids sont recommandées dans la FM comme dans les autres formes de douleurs chroniques par de nombreux auteurs et sociétés savantes (Häuser et coll., 2010
 ; Mork et coll., 2010
; Mork et coll., 2010 ; Fitzcharles et coll., 2013a
; Fitzcharles et coll., 2013a ; Borchers et Gershwin, 2015
; Borchers et Gershwin, 2015 ; Ericsson et coll., 2016
; Ericsson et coll., 2016 ; Bidonde et coll., 2017
; Bidonde et coll., 2017 ; Macfarlane et coll., 2017
; Macfarlane et coll., 2017 ; voir chapitre « Activités physiques et thérapie multidisciplinaire dans le syndrome fibromyalgique »).
; voir chapitre « Activités physiques et thérapie multidisciplinaire dans le syndrome fibromyalgique »). , Walitt et coll., 2015
, Walitt et coll., 2015 ). Il en est de même pour le diabète (23,3 %), l’hypertension artérielle (2,7 %) et les cardiopathies ischémiques (4,5 %).
). Il en est de même pour le diabète (23,3 %), l’hypertension artérielle (2,7 %) et les cardiopathies ischémiques (4,5 %). )
) ; Branco et coll., 2010
; Branco et coll., 2010 ; Queiroz, 2013
; Queiroz, 2013 ; Heidari et coll., 2017
; Heidari et coll., 2017 ). D’une manière générale, il existe des résultats concordants en faveur d’une plus forte prévalence du SFM dans les populations économiquement défavorisées et moins éduquées (Henriksson et coll., 2005
). D’une manière générale, il existe des résultats concordants en faveur d’une plus forte prévalence du SFM dans les populations économiquement défavorisées et moins éduquées (Henriksson et coll., 2005 ; Mas et coll., 2008
; Mas et coll., 2008 ; Queiroz, 2013
; Queiroz, 2013 ). L’enquête NHIS 2012 a ainsi montré que le risque de souffrir d’un SFM varie selon la catégorie socio-professionnelle évaluée par le niveau de diplôme : elle est presque triple pour les personnes dotées d’un faible diplôme initial par rapport aux personnes plus éduquées (Walitt et coll., 2015
). L’enquête NHIS 2012 a ainsi montré que le risque de souffrir d’un SFM varie selon la catégorie socio-professionnelle évaluée par le niveau de diplôme : elle est presque triple pour les personnes dotées d’un faible diplôme initial par rapport aux personnes plus éduquées (Walitt et coll., 2015 ).
). ). C’est pourquoi, la plus forte prévalence du SFM en Europe et aux États-Unis que dans des pays ou zones géographiques d’Europe centrale, du Moyen-Orient ou de l’Asie rapportée est difficile à interpréter en termes socio-culturels ou de différences de développement socio-économiques entre les pays.
). C’est pourquoi, la plus forte prévalence du SFM en Europe et aux États-Unis que dans des pays ou zones géographiques d’Europe centrale, du Moyen-Orient ou de l’Asie rapportée est difficile à interpréter en termes socio-culturels ou de différences de développement socio-économiques entre les pays. ; Borchers et Gershwin, 2015
; Borchers et Gershwin, 2015 ). Une étude américaine de l’agrégation familiale du SFM a été réalisée auprès des proches au 1er degré ou plus de 78 patients souffrant de SFM (533 proches) et de 40 patients souffrant de PR (272 proches) pris comme témoins. Elle a montré l’existence d’un risque 8,5 fois plus élevé (risque relatif RR de 8,5 [IC 95 % 2,8-28]) d’avoir la même pathologie que son proche pour le SFM comparé à la PR. Ces données plaident en faveur d’une agrégation familiale du SFM sans qu’il soit possible de faire la part de ce qui relève de la prédisposition génétique et d’une exposition commune à des facteurs familiaux ou sociaux prédisposants (Arnold et coll., 2004
). Une étude américaine de l’agrégation familiale du SFM a été réalisée auprès des proches au 1er degré ou plus de 78 patients souffrant de SFM (533 proches) et de 40 patients souffrant de PR (272 proches) pris comme témoins. Elle a montré l’existence d’un risque 8,5 fois plus élevé (risque relatif RR de 8,5 [IC 95 % 2,8-28]) d’avoir la même pathologie que son proche pour le SFM comparé à la PR. Ces données plaident en faveur d’une agrégation familiale du SFM sans qu’il soit possible de faire la part de ce qui relève de la prédisposition génétique et d’une exposition commune à des facteurs familiaux ou sociaux prédisposants (Arnold et coll., 2004 ).
). ). Ils ont ainsi montré l’influence mixte de facteurs génétiques et environnementaux, qui reste complexe à évaluer car plus ou moins importante selon le symptôme/la comorbidité évaluée. Par exemple, une influence de facteurs génétiques, non identifiés, semble importante pour la survenue de troubles de l’humeur ou de troubles psychiatriques, et non significative pour d’autres symptômes comme la fatigue ou des migraines (Kato et coll., 2006
). Ils ont ainsi montré l’influence mixte de facteurs génétiques et environnementaux, qui reste complexe à évaluer car plus ou moins importante selon le symptôme/la comorbidité évaluée. Par exemple, une influence de facteurs génétiques, non identifiés, semble importante pour la survenue de troubles de l’humeur ou de troubles psychiatriques, et non significative pour d’autres symptômes comme la fatigue ou des migraines (Kato et coll., 2006 ).
). ). Les résultats sont basés sur le suivi de 10 608 jumeaux et de 49 patients témoins avec un diagnostic de SFM ayant répondu à un même questionnaire. Une analyse en classes latentes a permis de mettre en évidence des groupes cliniques homogènes de jumeaux en fonction des symptômes fibromyalgiques présents, alors que des analyses par paire de jumeaux ont permis de tester l’influence de facteurs génétiques sur la survenue de ces symptômes. La prévalence estimée du SFM était comparable pour les jumeaux des deux sexes (12 % des hommes et 13 % des femmes). Selon cette étude, l’influence de facteurs génétiques dans la survenue du SFM était élevée (51 % [IC 95 % 45-56 %]). Néanmoins, l’exposition aux facteurs environnementaux familiaux au cours et après le développement n’était pas strictement contrôlée dans cette étude. L’analyse secondaire des données pour les 8 343 personnes ayant répondu aux questionnaires en 1975, 1981 et 1990 a montré que des facteurs prédictifs de la survenue d’un SFM au sein de cette cohorte étaient l’existence de fréquents maux de tête, de lombalgies et de cervicalgies chroniques (Markkula et coll., 2016
). Les résultats sont basés sur le suivi de 10 608 jumeaux et de 49 patients témoins avec un diagnostic de SFM ayant répondu à un même questionnaire. Une analyse en classes latentes a permis de mettre en évidence des groupes cliniques homogènes de jumeaux en fonction des symptômes fibromyalgiques présents, alors que des analyses par paire de jumeaux ont permis de tester l’influence de facteurs génétiques sur la survenue de ces symptômes. La prévalence estimée du SFM était comparable pour les jumeaux des deux sexes (12 % des hommes et 13 % des femmes). Selon cette étude, l’influence de facteurs génétiques dans la survenue du SFM était élevée (51 % [IC 95 % 45-56 %]). Néanmoins, l’exposition aux facteurs environnementaux familiaux au cours et après le développement n’était pas strictement contrôlée dans cette étude. L’analyse secondaire des données pour les 8 343 personnes ayant répondu aux questionnaires en 1975, 1981 et 1990 a montré que des facteurs prédictifs de la survenue d’un SFM au sein de cette cohorte étaient l’existence de fréquents maux de tête, de lombalgies et de cervicalgies chroniques (Markkula et coll., 2016 ).
). ). Certains facteurs potentiellement prédisposants au SFM, comme l’obésité, les symptômes fonctionnels (céphalées, colopathies fonctionnelles...) ou les douleurs chroniques, peuvent également être partiellement dépendants de facteurs génétiques dans leur survenue. C’est pourquoi, si les études de jumeaux suggèrent l’influence d’une composante génétique dans le SFM, l’héritabilité observée du SFM peut également s’expliquer – au moins pour partie – par des facteurs environnementaux qui joueraient le rôle de tiers facteurs (Markkula et coll., 2016
). Certains facteurs potentiellement prédisposants au SFM, comme l’obésité, les symptômes fonctionnels (céphalées, colopathies fonctionnelles...) ou les douleurs chroniques, peuvent également être partiellement dépendants de facteurs génétiques dans leur survenue. C’est pourquoi, si les études de jumeaux suggèrent l’influence d’une composante génétique dans le SFM, l’héritabilité observée du SFM peut également s’expliquer – au moins pour partie – par des facteurs environnementaux qui joueraient le rôle de tiers facteurs (Markkula et coll., 2016 ; Stone et Wilson, 2016
; Stone et Wilson, 2016 ).
). ). Il s’agit le plus souvent d’études de faible puissance statistique comparant la fréquence d’un polymorphisme génétique de type Single Nucleotide Polymorphism (SNP) d’intérêt entre des cas et des témoins, ce qui expose à un biais de sélection des populations étudiées (Holliday et McBeth, 2011
). Il s’agit le plus souvent d’études de faible puissance statistique comparant la fréquence d’un polymorphisme génétique de type Single Nucleotide Polymorphism (SNP) d’intérêt entre des cas et des témoins, ce qui expose à un biais de sélection des populations étudiées (Holliday et McBeth, 2011 ).
). ; Lee et coll., 2012
; Lee et coll., 2012 , 2015
, 2015 ; Zhang et coll., 2014
; Zhang et coll., 2014 ). Ainsi, la méta-analyse menée par Lee et coll. a analysé et comparé 18 études de qualité satisfaisante correspondant à 17 gènes candidats et 35 polymorphismes (Lee et coll., 2012
). Ainsi, la méta-analyse menée par Lee et coll. a analysé et comparé 18 études de qualité satisfaisante correspondant à 17 gènes candidats et 35 polymorphismes (Lee et coll., 2012 ). Cette méta-analyse a exclu une association entre SFM et le gène codant pour le transporteur à la sérotonine 5-HTT (allèle L du polymorphisme de répétition 5-HTTLPR présent dans la région promotrice du gène), celui codant pour la catéchol-O-méthyltransferase ou COMT (rs4680 correspondant à la variation p.Val158Met) et celui codant pour le récepteur de la sérotonine 5-hydroxytryptamine 2A (variant rs6313, c.T102C). Une association significative était toujours observée pour les gènes ADRB2 (haplotype AC), ADRA1A (rs1383914), DRD4 (Variant Nucleotidic Tandem Repetition ou VNTR dans l’exon 3 du gène), MAO-A (allèle 3) et COMT (rs4818 et non p.Val158Met) (Lee et coll., 2012
). Cette méta-analyse a exclu une association entre SFM et le gène codant pour le transporteur à la sérotonine 5-HTT (allèle L du polymorphisme de répétition 5-HTTLPR présent dans la région promotrice du gène), celui codant pour la catéchol-O-méthyltransferase ou COMT (rs4680 correspondant à la variation p.Val158Met) et celui codant pour le récepteur de la sérotonine 5-hydroxytryptamine 2A (variant rs6313, c.T102C). Une association significative était toujours observée pour les gènes ADRB2 (haplotype AC), ADRA1A (rs1383914), DRD4 (Variant Nucleotidic Tandem Repetition ou VNTR dans l’exon 3 du gène), MAO-A (allèle 3) et COMT (rs4818 et non p.Val158Met) (Lee et coll., 2012 ).
). ). Lee et coll. ont réalisé une seconde méta-analyse en étudiant l’association potentielle entre le variant p.Val158Met de COMT et un risque accru de souffrir d’un SFM ou de présenter une sévérité plus importante, évaluée à l’aide du FIQ (Lee et coll., 2015
). Lee et coll. ont réalisé une seconde méta-analyse en étudiant l’association potentielle entre le variant p.Val158Met de COMT et un risque accru de souffrir d’un SFM ou de présenter une sévérité plus importante, évaluée à l’aide du FIQ (Lee et coll., 2015 ). Un total de 993 patients et 778 témoins ont été inclus à partir de 10 études. Une association entre SFM et le variant p.158Met (génotypes homozygote Met/Met ou hétérozygote Val/Met) a été observée (OR = 1,6 [IC 95 % 1,0-2,6]). Cependant, cette association n’était plus significative dans les populations européennes et turques après stratification sur l’origine ethnique. La méta-analyse montre également que le score FIQ était significativement plus élevé chez les individus homozygotes p.158Met que chez les individus homozygotes p.158Val et hétérozygotes p.158Val/p.158Met. Contrairement à la précédente, cette méta-analyse a permis de confirmer une association entre le risque de souffrir de SFM et un score élevé FIQ, et l’allèle p.158Met. Cependant, d’autres études de plus forte puissance restent nécessaires pour confirmer cette association selon les ethnies.
). Un total de 993 patients et 778 témoins ont été inclus à partir de 10 études. Une association entre SFM et le variant p.158Met (génotypes homozygote Met/Met ou hétérozygote Val/Met) a été observée (OR = 1,6 [IC 95 % 1,0-2,6]). Cependant, cette association n’était plus significative dans les populations européennes et turques après stratification sur l’origine ethnique. La méta-analyse montre également que le score FIQ était significativement plus élevé chez les individus homozygotes p.158Met que chez les individus homozygotes p.158Val et hétérozygotes p.158Val/p.158Met. Contrairement à la précédente, cette méta-analyse a permis de confirmer une association entre le risque de souffrir de SFM et un score élevé FIQ, et l’allèle p.158Met. Cependant, d’autres études de plus forte puissance restent nécessaires pour confirmer cette association selon les ethnies. ; Arnold et coll., 2013
; Arnold et coll., 2013 ; Peters et coll., 2013
; Peters et coll., 2013 ; Docampo et coll., 2014
; Docampo et coll., 2014 ; Borchers et Gershwin, 2015
; Borchers et Gershwin, 2015 ). Il en est de même des études d’épigénétique recherchant des variations géniques particulières en réponse à des facteurs développementaux ou environnementaux chez les patients souffrant d’un SFM (Menzies et coll., 2013
). Il en est de même des études d’épigénétique recherchant des variations géniques particulières en réponse à des facteurs développementaux ou environnementaux chez les patients souffrant d’un SFM (Menzies et coll., 2013 ; Borchers et Gershwin, 2015
; Borchers et Gershwin, 2015 ).
). ).
). ; White et coll., 2000
; White et coll., 2000 ; Buskila et Mader, 2011
; Buskila et Mader, 2011 ; Hadler, 2013
; Hadler, 2013 ; Wolfe et coll., 2014
; Wolfe et coll., 2014 ). Une série clinique relativement ancienne de 127 patients souffrant de SFM a ainsi montré que près d’un quart des patients rapportaient un antécédent de traumatisme physique, de chirurgie ou d’affections médicales douloureuses (Greenfield et coll., 1992
). Une série clinique relativement ancienne de 127 patients souffrant de SFM a ainsi montré que près d’un quart des patients rapportaient un antécédent de traumatisme physique, de chirurgie ou d’affections médicales douloureuses (Greenfield et coll., 1992 ). Il peut s’agir de traumatismes dans la vie quotidienne, d’accidents de voiture, notamment de traumatisme cervical (coup du lapin) ou d’accidents du travail (Buskila et Mader, 2011
). Il peut s’agir de traumatismes dans la vie quotidienne, d’accidents de voiture, notamment de traumatisme cervical (coup du lapin) ou d’accidents du travail (Buskila et Mader, 2011 ; Wolfe et coll., 2014
; Wolfe et coll., 2014 ).
). ; Wolfe et coll., 2014
; Wolfe et coll., 2014 ; Yavne et coll., 2018
; Yavne et coll., 2018 ). Il existe une littérature assez abondante sur les liens entre traumatismes cervicaux et SFM. Par exemple, une étude contrôlée de faible qualité méthodologique menée sur 102 patients souffrant de traumatisme cervical et 59 patients souffrant d’une fracture du membre inférieur (témoins) a montré une prévalence de SFM « post-traumatique » de 21,6 % dans le groupe traumatisme cervical et de 1,7 % dans le groupe fracture du membre inférieur, soit 13 fois plus (Buskila et coll., 1997
). Il existe une littérature assez abondante sur les liens entre traumatismes cervicaux et SFM. Par exemple, une étude contrôlée de faible qualité méthodologique menée sur 102 patients souffrant de traumatisme cervical et 59 patients souffrant d’une fracture du membre inférieur (témoins) a montré une prévalence de SFM « post-traumatique » de 21,6 % dans le groupe traumatisme cervical et de 1,7 % dans le groupe fracture du membre inférieur, soit 13 fois plus (Buskila et coll., 1997 ). Les symptômes de SFM apparaissaient en moyenne 3,2 mois après le traumatisme. Néanmoins, les études disponibles dans la littérature souffrent de biais méthodologiques si bien que le niveau de preuve du rôle déclenchant des traumatismes (accidents de la route, traumatismes cervicaux) est classé comme faible par plusieurs revues systématiques (White et coll., 2000
). Les symptômes de SFM apparaissaient en moyenne 3,2 mois après le traumatisme. Néanmoins, les études disponibles dans la littérature souffrent de biais méthodologiques si bien que le niveau de preuve du rôle déclenchant des traumatismes (accidents de la route, traumatismes cervicaux) est classé comme faible par plusieurs revues systématiques (White et coll., 2000 ; Buskila et Mader, 2011
; Buskila et Mader, 2011 ; Wolfe et coll., 2014
; Wolfe et coll., 2014 ; Yavne et coll., 2018
; Yavne et coll., 2018 ) et par les recommandations canadiennes sur la FM (Jain et coll., 2003
) et par les recommandations canadiennes sur la FM (Jain et coll., 2003 ).
). )
) ; White et coll., 2000
; White et coll., 2000 ; Buskila et Mader, 2011
; Buskila et Mader, 2011 ; Hadler, 2013
; Hadler, 2013 ). Ces cas survenant « en milieu de travail » suscitent des enjeux médico-légaux et assurantiels importants, notamment en Amérique du Nord (Fitzcharles et coll., 2013
). Ces cas survenant « en milieu de travail » suscitent des enjeux médico-légaux et assurantiels importants, notamment en Amérique du Nord (Fitzcharles et coll., 2013 ) alors que l’origine professionnelle du SFM n’est pas établie (Hadler, 2013
) alors que l’origine professionnelle du SFM n’est pas établie (Hadler, 2013 ; Wolfe et coll., 2014
; Wolfe et coll., 2014 ). En effet, si le rôle des microtraumatismes d’origine professionnelle est bien établi dans la survenue de troubles musculo-squelettiques, il reste controversé concernant le SFM, l’hypersollicitation biomécanique et les facteurs psychosociaux d’origine professionnelle semblant plus jouer un rôle pronostique qu’étiologique dans le cas du SFM (voir chapitre « Syndrome fibromyalgique et travail ») (Hagberg et coll., 1995
). En effet, si le rôle des microtraumatismes d’origine professionnelle est bien établi dans la survenue de troubles musculo-squelettiques, il reste controversé concernant le SFM, l’hypersollicitation biomécanique et les facteurs psychosociaux d’origine professionnelle semblant plus jouer un rôle pronostique qu’étiologique dans le cas du SFM (voir chapitre « Syndrome fibromyalgique et travail ») (Hagberg et coll., 1995 ; McBeth et coll., 2003
; McBeth et coll., 2003 ; Henriksson et coll., 2005
; Henriksson et coll., 2005 ; Fitzcharles et coll., 2016
; Fitzcharles et coll., 2016 ).
). ) repose sur une approche globale et intégrée de l’être humain dans laquelle les « facteurs biologiques, psychologiques et sociaux sont considérés comme participant simultanément au maintien de la santé ou au développement de la maladie » (Engel, 1997
) repose sur une approche globale et intégrée de l’être humain dans laquelle les « facteurs biologiques, psychologiques et sociaux sont considérés comme participant simultanément au maintien de la santé ou au développement de la maladie » (Engel, 1997 ). Dans ce cadre, des facteurs autres que biologiques ont été étudiés.
). Dans ce cadre, des facteurs autres que biologiques ont été étudiés. ) (voir aussi chapitre « Dimension psychologique du syndrome fibromyalgique »). Des études épidémiologiques de qualité méthodologique variable rapportant l’existence d’antécédents de type stress émotionnel intense et détresse psychologique chez les patients souffrant de SFM suggèrent que des traumatismes psychiques puissent jouer le rôle de facteurs prédisposant, déclenchant ou perpétuant les SFM (Häuser et coll., 2013
) (voir aussi chapitre « Dimension psychologique du syndrome fibromyalgique »). Des études épidémiologiques de qualité méthodologique variable rapportant l’existence d’antécédents de type stress émotionnel intense et détresse psychologique chez les patients souffrant de SFM suggèrent que des traumatismes psychiques puissent jouer le rôle de facteurs prédisposant, déclenchant ou perpétuant les SFM (Häuser et coll., 2013 ; Nicol et coll., 2016
; Nicol et coll., 2016 ). Il en est de même pour les violences physiques ou sexuelles dans l’enfance ou à l’âge adulte, qui sont rapportées par un grand nombre de patients à l’âge adulte (tableau 4.XI
). Il en est de même pour les violences physiques ou sexuelles dans l’enfance ou à l’âge adulte, qui sont rapportées par un grand nombre de patients à l’âge adulte (tableau 4.XI ; Ruiz-Pérez et coll., 2009
; Ruiz-Pérez et coll., 2009 ; Lee, 2010
; Lee, 2010 ; Häuser et coll., 2011
; Häuser et coll., 2011 ; Min et coll., 2013
; Min et coll., 2013 ; Fitzcharles et coll., 2018
; Fitzcharles et coll., 2018 ; Yavne et coll., 2018
; Yavne et coll., 2018 ).
). ). Elle montrait une prévalence significativement plus élevée d’abus sexuels dans l’enfance chez les patientes atteintes de SFM (49 %) que chez celles souffrant d’achalasie (24 %), la différence n’étant pas significative avec celles souffrant de dyspepsie fonctionnelle (23 %). La prévalence d’un état de trouble de stress post-traumatique était plus élevée chez les patientes souffrant de SFM (26 %) que chez les patientes souffrant de dyspepsie fonctionnelle (5 %) et d’achalasie (12 %). Les patientes atteintes de SFM ayant des antécédents d’abus sexuels dans l’enfance avait également une prévalence de troubles de stress post-traumatique plus élevée que les patientes atteintes de SFM sans antécédents (34 % vs 18 %) (Coppens et coll., 2017
). Elle montrait une prévalence significativement plus élevée d’abus sexuels dans l’enfance chez les patientes atteintes de SFM (49 %) que chez celles souffrant d’achalasie (24 %), la différence n’étant pas significative avec celles souffrant de dyspepsie fonctionnelle (23 %). La prévalence d’un état de trouble de stress post-traumatique était plus élevée chez les patientes souffrant de SFM (26 %) que chez les patientes souffrant de dyspepsie fonctionnelle (5 %) et d’achalasie (12 %). Les patientes atteintes de SFM ayant des antécédents d’abus sexuels dans l’enfance avait également une prévalence de troubles de stress post-traumatique plus élevée que les patientes atteintes de SFM sans antécédents (34 % vs 18 %) (Coppens et coll., 2017 ).
). )
) ). Par contre, lorsque seuls sont considérés les antécédents de viol, une association significative est observée avec la survenue d’un SFM au cours de la vie entière (OR = 3,35 [IC 95 % 1,51-7,46], 4 études), ainsi qu’avec la survenue de troubles fonctionnels gastro-intestinaux et de douleurs pelviennes chroniques (Paras et coll., 2009). Une seconde méta-analyse de 18 études cas-témoins portant sur un plus grand nombre de sujets que la précédente (13 095) a montré que si la majorité des études utilisaient les critères ACR 1990 pour définir les patients souffrant de SFM, les critères d’évaluation des antécédents de violence physique ou d’abus sexuel dans l’enfance ou à l’âge adulte variaient selon les études, ce qui expose à des biais d’information importants. Les résultats montraient l’existence d’association entre SFM et abus sexuels dans l’enfance (OR = 1,94 [IC 95 % 1,36-2,75], 10 études), entre SFM et l’existence d’abus sexuels à l’âge adulte (OR = 2,24 [IC 95 % 1,07-4,70], 4 études) mais aussi entre SFM et violences physiques dans l’enfance (OR = 2,49 [IC 95 % 1,81-3,42], 9 études) ou bien à l’âge adulte (OR = 3,07 [IC 95 % 1,01-9,39], 3 études). Par contre, il n’y avait pas d’association entre traumatismes émotionnels (de type insultes, humiliation...) dans l’enfance ou à l’âge adulte et les SFM (Häuser et coll., 2011
). Par contre, lorsque seuls sont considérés les antécédents de viol, une association significative est observée avec la survenue d’un SFM au cours de la vie entière (OR = 3,35 [IC 95 % 1,51-7,46], 4 études), ainsi qu’avec la survenue de troubles fonctionnels gastro-intestinaux et de douleurs pelviennes chroniques (Paras et coll., 2009). Une seconde méta-analyse de 18 études cas-témoins portant sur un plus grand nombre de sujets que la précédente (13 095) a montré que si la majorité des études utilisaient les critères ACR 1990 pour définir les patients souffrant de SFM, les critères d’évaluation des antécédents de violence physique ou d’abus sexuel dans l’enfance ou à l’âge adulte variaient selon les études, ce qui expose à des biais d’information importants. Les résultats montraient l’existence d’association entre SFM et abus sexuels dans l’enfance (OR = 1,94 [IC 95 % 1,36-2,75], 10 études), entre SFM et l’existence d’abus sexuels à l’âge adulte (OR = 2,24 [IC 95 % 1,07-4,70], 4 études) mais aussi entre SFM et violences physiques dans l’enfance (OR = 2,49 [IC 95 % 1,81-3,42], 9 études) ou bien à l’âge adulte (OR = 3,07 [IC 95 % 1,01-9,39], 3 études). Par contre, il n’y avait pas d’association entre traumatismes émotionnels (de type insultes, humiliation...) dans l’enfance ou à l’âge adulte et les SFM (Häuser et coll., 2011 ).
). )
) ; Fietta et coll., 2007
; Fietta et coll., 2007 ; Häuser et coll., 2011
; Häuser et coll., 2011 ; Yavne et coll., 2018
; Yavne et coll., 2018 ). Néanmoins, les études souffrent souvent de limites méthodologiques importantes, notamment de biais de mémorisation (Yavne et coll., 2018
). Néanmoins, les études souffrent souvent de limites méthodologiques importantes, notamment de biais de mémorisation (Yavne et coll., 2018 ). Pour certains, l’existence de stress post-traumatique pourrait jouer un rôle médiateur entre expérience traumatique et développement d’un SFM en tant que marqueur d’une susceptibilité accrue au stress, qui favoriserait la survenue de CWP ou de SFM en cas d’exposition ultérieure à un traumatisme psychique ou physique (figure 4.4
). Pour certains, l’existence de stress post-traumatique pourrait jouer un rôle médiateur entre expérience traumatique et développement d’un SFM en tant que marqueur d’une susceptibilité accrue au stress, qui favoriserait la survenue de CWP ou de SFM en cas d’exposition ultérieure à un traumatisme psychique ou physique (figure 4.4 ) (Häuser et coll., 2013
) (Häuser et coll., 2013 ). Il n’est pas précisé si cette association est spécifique du SFM ou concerne les douleurs chroniques en général.
). Il n’est pas précisé si cette association est spécifique du SFM ou concerne les douleurs chroniques en général. )
) ; Cassisi et coll., 2011
; Cassisi et coll., 2011 ). Compte-tenu de la similarité des tableaux cliniques, la maladie de Lyme dans une forme chronique, dont l’existence reste controversée, peut mimer un tableau de CWP ou de SFM sans qu’il soit établi à ce jour un lien de causalité entre ces deux affections (Sigal et Hassett, 2002
). Compte-tenu de la similarité des tableaux cliniques, la maladie de Lyme dans une forme chronique, dont l’existence reste controversée, peut mimer un tableau de CWP ou de SFM sans qu’il soit établi à ce jour un lien de causalité entre ces deux affections (Sigal et Hassett, 2002 ; Cairns et Godwin, 2005
; Cairns et Godwin, 2005 ; Cassisi et coll., 2011
; Cassisi et coll., 2011 ; Wormser et coll., 2015
; Wormser et coll., 2015 ; Häuser et coll., 2017
; Häuser et coll., 2017 ).
). ). Une prévalence élevée de douleur chronique ou de SFM a été retrouvée de manière inconstante chez des patients porteurs d’une infection à HIV ou HVC et plus rarement HVP, HTLV1 ou parvovirus B19 (Buskila et coll., 2008
). Une prévalence élevée de douleur chronique ou de SFM a été retrouvée de manière inconstante chez des patients porteurs d’une infection à HIV ou HVC et plus rarement HVP, HTLV1 ou parvovirus B19 (Buskila et coll., 2008 ; Cassisi et coll., 2011
; Cassisi et coll., 2011 ; Fox et Walker-Bone, 2015
; Fox et Walker-Bone, 2015 ). Il s’agit le plus souvent de séries de cas ou d’études transversales de faible puissance présentant de nombreux biais méthodologiques ne permettant pas de jugement de causalité. C’est pourquoi la revue systématique réalisée par Cassini et coll. conclut à l’absence de preuve d’association entre SFM et infections aiguës ou chroniques, qu’elles soient bactériennes ou virales (Cassisi et coll., 2011
). Il s’agit le plus souvent de séries de cas ou d’études transversales de faible puissance présentant de nombreux biais méthodologiques ne permettant pas de jugement de causalité. C’est pourquoi la revue systématique réalisée par Cassini et coll. conclut à l’absence de preuve d’association entre SFM et infections aiguës ou chroniques, qu’elles soient bactériennes ou virales (Cassisi et coll., 2011 ).
). , pour revue). Le vaccin contre la rubéole effectué de manière préventive à l’âge adulte chez des femmes avec un projet de maternité et non immunisées a été incriminé, mais un essai contrôlé de bonne qualité méthodologique n’a pas montré d’augmentation des arthralgies et myalgies chroniques après vaccination (Tingle et coll., 1997
, pour revue). Le vaccin contre la rubéole effectué de manière préventive à l’âge adulte chez des femmes avec un projet de maternité et non immunisées a été incriminé, mais un essai contrôlé de bonne qualité méthodologique n’a pas montré d’augmentation des arthralgies et myalgies chroniques après vaccination (Tingle et coll., 1997 ). De même, le risque de développement d’un SFM après vaccination à l’âge adulte ou chez l’enfant contre l’hépatite B, ou des vaccins polyvalents (hépatite B, diphtérie, tétanos, poliomyélite) n’a pas été établi même si des cas isolés ont été rapportés dans la littérature (Cassisi et coll., 2011
). De même, le risque de développement d’un SFM après vaccination à l’âge adulte ou chez l’enfant contre l’hépatite B, ou des vaccins polyvalents (hépatite B, diphtérie, tétanos, poliomyélite) n’a pas été établi même si des cas isolés ont été rapportés dans la littérature (Cassisi et coll., 2011 ).
).