Essais nucléaires et santé : Conséquences en Polynésie française
2021
→ Aller vers ANALYSE
Durant la période 1966-1996, 193 essais nucléaires ont été conduits par la France en Polynésie française
1
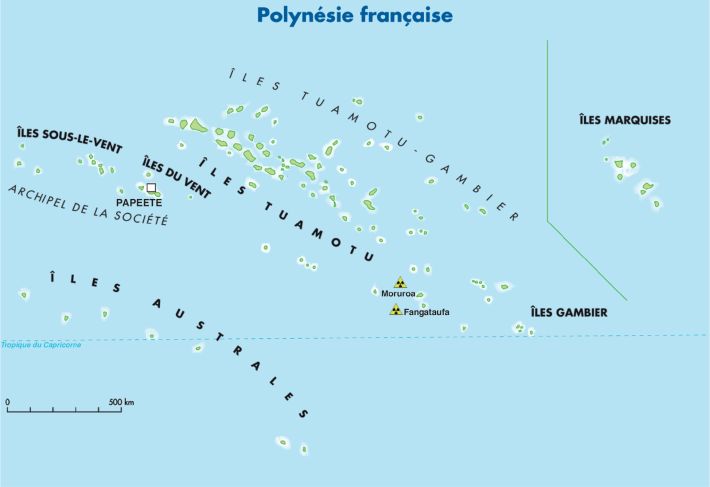
Collectivité d’Outre-mer localisée dans le sud de l’océan Pacifique, la Polynésie française est composée de cinq archipels (îles Marquises, îles-du-Vent, îles Tuamotu-Gambier, îles Australes et îles Sous-le-Vent) regroupant 118 îles.
, dont 46 essais atmosphériques réalisés entre 1966 et 1974, puis 147 essais souterrains entre 1975 et 1996
2
Dont 5 essais de sécurité réalisés dans l’atmosphère et 10 essais de sécurité souterrains (Ministère de la Défense. La dimension radiologique des essais nucléaires français en Polynésie. À l’épreuve des faits. 2006), ce type d’essais étant destiné à vérifier que la bombe ne s’amorce pas d’elle-même pendant le transport ou le stockage. En général, les rapports et les études mentionnent 41 essais nucléaires atmosphériques (les 5 essais de sécurité réalisés dans l’atmosphère ne sont pas inclus).
, avec l’appui logistique du Centre d’expérimentation du Pacifique (CEP) qui était en charge de la réalisation des essais nucléaires (figure 1

). Durant toute cette période, et plus précisément dès le début des années 1960, la Polynésie française a connu de profonds changements d’ordre économique, sanitaire, et concernant les modes de vie, en partie liés à l’implantation du CEP. Suite au démantèlement du CEP en 1996, la société polynésienne aborde une nouvelle transition sociodémographique, tandis que la prise de conscience collective quant aux conséquences potentielles des retombées radioactives sur la santé de la population polynésienne et du personnel civil et militaire suscite des inquiétudes croissantes et motive une demande de reconnaissance en vue d’obtenir réparation.
Lors d’un essai nucléaire atmosphérique, les explosions ont pour conséquence le rejet et la dissémination de matières radioactives dans l’environnement. Les populations locales sont alors confrontées à deux types d’exposition :
• les expositions externes liées à l’immersion dans le panache radioactif et aux dépôts sur le sol ;
• les expositions internes liées à l’inhalation de l’air contenant des particules radioactives et à l’ingestion d’eau et de produits alimentaires contaminés. La contamination de la chaîne alimentaire par un radionucléide
3
Les « radionucléides » ou « radioisotopes » correspondent à des atomes possédant des noyaux instables radioactifs. La radioactivité est le phénomène par lequel les noyaux d’atomes instables expulsent de l’énergie sous forme de rayonnements pour retrouver un état stable.
dépend de sa concentration, de sa durée de vie, de sa mobilité dans les sols et de la capacité d’absorption et de rétention des organismes vivants.
La surveillance radiologique de l’environnement en Polynésie française a été mise en place dès 1962, à l’époque des essais nucléaires atmosphériques effectués par les grandes puissances militaires, avant même l’ouverture du CEP.
Comme dans d’autres pays où ont été réalisés des essais nucléaires ou qui ont connu des accidents nucléaires, des membres de la population civile et militaire de Polynésie française ont fait l’objet d’investigations visant à estimer leur niveau d’exposition par des approches de reconstruction dosimétrique.
Cette synthèse présente les principaux résultats issus de l’analyse critique de la littérature scientifique réalisée par le groupe d’experts sur les conséquences sanitaires des essais nucléaires menés par la France en Polynésie française ; compte tenu du peu de littérature scientifique disponible sur la Polynésie française, le groupe d’experts a élargi son analyse aux conséquences sanitaires des essais nucléaires réalisés par d’autres pays, aux effets sanitaires causés par d’autres types d’exposition aux radiations ionisantes, et à un champ plus fondamental, celui des effets des radiations ionisantes à l’échelle cellulaire et moléculaire. La synthèse se décline en six parties. La première partie est consacrée au contexte socio-politique de la question des conséquences sanitaires des essais nucléaires en Polynésie française. Sont ensuite présentées les données relatives à la surveillance de la santé de la population de Polynésie française. La troisième partie présente les données de surveillance radiologique de l’environnement polynésien
4
Les données de surveillance radiologique de l’environnement en Polynésie française ont fait l’objet de l’audition par le groupe d’experts d’un intervenant de l’IRSN (Institut de Radioprotection et de Sûreté Nucléaire).
et les estimations des doses reçues par les populations en Polynésie française ; par ailleurs, cette troisième partie aborde les approches méthodologiques destinées à l’estimation d’une exposition aux rayonnements ionisants. S’ensuit un bilan des études épidémiologiques menées en Polynésie française et sur différents sites d’essais nucléaires réalisés par d’autres pays (États-Unis, Royaume-Uni, ex Union soviétique), afin d’identifier des éléments de comparaison utiles à la situation en Polynésie française. La cinquième partie s’attache aux effets de différents types d’exposition aux rayonnements ionisants sur le développement, la reproduction et la descendance. Enfin, la sixième partie décrit les éléments de connaissance sur les mécanismes cellulaires et moléculaires impliqués dans la réponse aux rayonnements ionisants.
Au fil des parties, la synthèse inclut une mise en perspective des principaux constats de l’expertise.
I. Contexte socio-politique de la question des conséquences sanitaires des essais nucléaires en Polynésie française
Si la question des conséquences sanitaires des essais nucléaires français a régulièrement été posée, elle a acquis une nouvelle visibilité publique au tournant des années 2000 avec la création d’associations regroupant des anciens militaires et des travailleurs ayant directement participé aux expérimentations atomiques. Certains d’entre eux souffrent aujourd’hui de pathologies qu’ils estiment directement liées à leur passé nucléaire et exigent des indemnisations de la part de l’État. Il en va de même au sein de la population polynésienne qui, par la voix de ses représentants, réclame une réparation pour les préjudices subis du fait des retombées radioactives associées aux essais.
Obtenir la reconnaissance d’un statut de victime des essais nucléaires n’est cependant pas simple. La difficulté principale consiste à apporter la preuve que la pathologie est bien liée à une exposition radioactive. Or, cette preuve est d’autant plus difficile à fournir que les maladies en question ne sont pas « signées » comme étant spécifiques d’une exposition aux rayonnements ionisants et qu’elles peuvent par conséquent résulter d’une multitude d’autres facteurs. En outre, il est parfois difficile, faute de données fiables ou de modèles acquis de façon prospective lors des essais, de connaître la nature exacte de l’exposition subie par ces personnes, qu’il s’agisse des vétérans des essais nucléaires ou de la population polynésienne.
C’est la raison pour laquelle, depuis leur création, les associations réclament l’application d’un « principe de présomption de causalité » au sujet des conséquences sanitaires des essais nucléaires. Pour les personnes concernées, l’intérêt d’un tel principe est de pouvoir contourner l’obstacle de la preuve scientifique du lien de causalité. En vertu du principe de présomption, il suffit en effet qu’un certain nombre de conditions soient remplies, tant en ce qui concerne l’exposition que le dommage, pour qu’un lien entre les deux soit admis et qu’un droit à l’indemnisation soit reconnu. C’est ce type de dispositif qui a été adopté par le Sénat des États-Unis en 1988 dans le cadre de l’indemnisation des militaires de l’armée américaine ayant participé aux expérimentations atomiques menées dans le Pacifique et dans le désert du Nevada (Radiation Exposed Veterans Compensation Act). À la suite notamment de plusieurs procès intentés contre le gouvernement des État-Unis, ce dispositif a été élargi en 1990 pour ouvrir la possibilité d’une indemnisation aux personnes civiles ayant été exposées aux retombées des essais atmosphériques (les « downwinders »). Ce dispositif, connu sous le nom de Radiation Exposure Compensation Act (RECA), repose sur le principe d’une présomption de causalité, même s’il est assorti d’un certain nombre de restrictions complexes selon chaque maladie considérée (par exemple, selon le type de pathologie, l’âge de la personne au moment du diagnostic ou encore la durée séparant le moment de l’exposition et celui du diagnostic).
Au terme d’un combat juridique et politique de plusieurs années, les associations de vétérans des essais nucléaires français ont obtenu, en janvier 2010, le vote d’une loi fondée sur le principe de la présomption de causalité.
La loi du 5 janvier 2010 « relative à la reconnaissance et l’indemnisation des victimes des essais nucléaires français », dite « loi Morin », n’a cependant pas mis fin à la controverse. Le dispositif d’indemnisation instauré par cette loi souffre d’une ambiguïté majeure. En effet, d’un côté, c’est bien un principe de présomption de causalité qui est reconnu puisque le demandeur, pour obtenir réparation, devra seulement justifier qu’il a résidé ou séjourné dans certaines zones durant des périodes précises et qu’il souffre d’une pathologie figurant dans une liste fixée par décret. Mais, d’un autre côté, l’article 4 de la loi précise que « l’intéressé bénéficie d’une présomption de causalité à moins qu’au regard de sa maladie et des conditions de son exposition le risque attribuable aux essais nucléaires puisse être considéré comme négligeable ». Or, dans la plupart des cas soumis à leur examen au cours des années suivantes, les experts du Comité d’indemnisation des victimes des essais nucléaires (CIVEN) mis en place par la loi ont estimé que le risque attribuable aux essais nucléaires était « négligeable » : à la fin de l’année 2013, soit trois ans après le vote de la loi, un rapport parlementaire révèle que seulement 11 vétérans ont été indemnisés grâce à ce dispositif législatif, sur un total de 840 dossiers examinés. En 2017, ils ne sont qu’une vingtaine à avoir bénéficié d’une reconnaissance. Qualifié de véritable « nid à contentieux » par les auteurs du rapport parlementaire de 2013
5
Bouchoux C, Lenoir J-C. Rapport d’information fait au nom de la commission sénatoriale pour le contrôle de l’application des lois sur la mise en œuvre de la loi no 2010-2 du 5 janvier 2010 relative à la reconnaissance et l’indemnisation des victimes des essais nucléaires français. 2013
, l’article 4 de la loi Morin est finalement modifié en février 2017, par le biais d’un amendement déposé par des élus polynésiens dans le cadre des discussions relatives à la loi pour l’égalité réelle des Outre-mer qui supprime la référence au risque négligeable.
Mais si la loi Morin n’a pas mis fin à la controverse sur les conséquences sanitaires des essais nucléaires français, c’est aussi que le débat s’est déplacé sur les conditions permettant de bénéficier de la présomption de causalité afin d’obtenir une indemnisation. Une première modification de la loi Morin est intervenue avec le vote de la loi de finances 2013, qui a ouvert la possibilité d’une indemnisation à toute personne ayant résidé en Polynésie française au moment des essais, sans qu’aucune zone précise ne soit requise comme c’était le cas auparavant. Une seconde modification a porté sur les pathologies pouvant faire l’objet d’une indemnisation : la liste initiale de 18 pathologies reconnues comme étant potentiellement indemnisables a été étendue à 21 par un décret du 30 avril 2012, puis à 23 à l’occasion du décret du 27 mai 2019.
Le contexte socio-politique actuel est marqué par deux éléments. D’une part, en Polynésie, tandis que de vives revendications s’expriment en faveur d’une extension du périmètre de la loi afin d’en faire bénéficier le plus grand nombre, une plainte pour crimes contre l’humanité a été déposée le 2 octobre 2018 contre la France devant la Cour pénale internationale. D’autre part, une grande incertitude règne au sujet des conséquences de la modification de la loi Morin intervenue en 2017 : la loi Égalité réelle Outre-mer (Erom) a mis en place une commission chargée de « formuler des recommandations à l’attention du gouvernement » afin que l’indemnisation soit « réservée aux personnes dont la maladie est causée par les essais ». Le rapport de cette commission, initialement attendu en février 2018, a été remis au Premier ministre le 20 novembre 2018. De son côté, et dans l’attente des conclusions de ce rapport, le CIVEN avait modifié la méthodologie jusqu’ici suivie dans l’examen des dossiers : seule la preuve de l’absence d’une exposition aux rayonnements ionisants due aux essais nucléaires (absence retenue dès lors que la dose de rayonnements ionisants reçue est inférieure à 1 millisievert [mSv]
6
Le Sievert (Sv) est une unité qui sert à quantifier l’effet des rayonnements sur un organisme vivant.
par an) pouvait désormais conduire à refuser une indemnisation. La loi Morin a finalement été révisée en ce sens le 20 décembre 2018, grâce à un amendement introduit dans la loi de finances 2019.
Aujourd’hui, les associations revendiquent que soient pris en considération d’autres types de cancer ainsi que certaines pathologies non cancéreuses, comme les maladies cardiovasculaires, afin de les inclure dans la liste des pathologies indemnisables.
II. Données de surveillance de la santé de la population
en Polynésie française
Le bilan sur l’état de santé de la population de Polynésie française présenté dans le cadre de cette partie repose sur les données de surveillance disponibles depuis les années 1960 ; il s’agit principalement de données institutionnelles. Cette partie n’aborde pas les études relatives à l’influence de l’exposition aux radiations ionisantes issues des essais nucléaires atmosphériques sur la santé des polynésiens ; ces études sont décrites dans la partie consacrée aux données épidémiologiques sur les conséquences sanitaires d’une exposition aux radiations ionisantes.
La population de la Polynésie française a plus que triplé depuis les années 1960 et a beaucoup vieilli, passant d’un âge médian de 18 à 31 ans. Cette population reste pourtant jeune par rapport à celle de la métropole. Au fil des années, la natalité a nettement baissé, l’espérance de vie à la naissance a fortement augmenté mais reste inférieure à celle de la métropole, de la Réunion et de la Guadeloupe. La mortalité a beaucoup diminué jusque dans les années 1990, pour ensuite se stabiliser. Des modifications rapides du mode de vie ont notamment résulté de l’installation du Centre d’expérimentation du Pacifique en 1962.
Jusqu’à la fin des années 1950, les pathologies rencontrées et la mortalité élevée étaient principalement dues à des maladies transmissibles. Par la suite, la situation a évolué et les maladies non transmissibles, en particulier celles du système cardiovasculaire et les cancers, sont devenues prépondérantes, comme c’est le cas dans les pays industrialisés. Par ailleurs, la Polynésie française, du fait du développement de ses infrastructures hospitalières et du système de protection sociale français, se classe parmi les territoires du Pacifique ayant le système de santé le plus développé.
Causes de décès
Entre 1984 et 2010, les causes principales de décès étaient liées à des maladies de l’appareil circulatoire, avec une baisse conséquente durant cette période. Viennent ensuite les décès par cancers, avec une légère augmentation sur la période d’étude, passant de 125,4 décès pour 100 000 habitants en 1984 à 132 en 2010. Ces taux sont similaires à ceux de métropole pour les hommes et sont plus élevés pour les femmes. La mortalité par cancer du poumon chez les femmes était nettement supérieure à celle de métropole et celle par cancer du sein en était assez proche. Ensuite, les décès étaient principalement liés aux maladies du système respiratoire et aux causes externes (accidents, suicides...), qui ont également baissé. Les décès liés aux maladies endocriniennes, nutritionnelles et métaboliques ont parallèlement augmenté sur cette période. En raison de la faible population dans certains archipels, les analyses d’évolution géographique des causes de décès sont délicates à interpréter. Sur la période 2005-2010, la mortalité prématurée (avant 65 ans) pour les hommes est liée à des causes externes de blessure pour 23 %, des maladies de l’appareil circulatoire pour 22 % et des cancers pour 21 %. Pour les femmes, elle est liée à des cancers pour 31 %, des maladies de l’appareil circulatoire pour 21 % et des causes externes pour 12 %.
Principaux facteurs de risque et maladies chroniques
Certains facteurs de risque de maladies chroniques directement associés aux modes de vie présentent un niveau élevé en Polynésie française. Il est estimé qu’environ 40 % des plus de 18 ans sont fumeurs. Ce pourcentage est supérieur chez les femmes et chez les jeunes. Par ailleurs, la prévalence du tabagisme a augmenté entre 1995 et 2010 et est plus élevée qu’en métropole ; comparée aux autres pays du Pacifique, cette prévalence est parmi les plus hautes pour les femmes. La consommation d’alcool, tout comme en France métropolitaine, est très importante, y compris chez les femmes. Elle est parmi les plus élevées de la zone Pacifique, tout en étant inférieure à celle de la Nouvelle-Calédonie. Une majorité des Polynésiens (59 %) ont un niveau élevé d’activité physique. Mais la culture polynésienne valorise les fortes corpulences alors que l’alimentation traditionnelle a été rapidement remplacée par une alimentation importée et transformée, laquelle représentait 90 % de la nourriture disponible en 2009. La consommation d’aliments gras et de protéines animales a beaucoup augmenté, tandis que les Polynésiens consomment assez peu de fruits et légumes, en raison de leur faible disponibilité et de leur prix élevé. Le surpoids et l’obésité, notamment chez les enfants, constituent actuellement un problème de santé publique, même si le niveau atteint reste inférieur à celui des autres îles du Pacifique.
En conséquence de ces niveaux élevés de facteurs de risque, parfois combinés, la prévalence et l’incidence de certaines maladies circulatoires, endocriniennes, nutritionnelles et métaboliques sont en augmentation. Globalement, la part des maladies du système cardiovasculaire dans les arrêts de travail pour affections de longue durée est massive. En 2010, la prévalence de l’hypertension artérielle était de 27 % alors qu’elle était évaluée à 18 % en 1995 et on estime que 74 % des personnes hypertendues ne sont pas traitées. En 1995, la prévalence du diabète était estimée à 18 % alors qu’elle était de 4 % en métropole. Cette estimation n’a pas pu être faite en 2010 mais on observe que la part des affections de longue durée pour diabète de type 2 est passée de 12 % en 1995 à 16 % en 2017. Une augmentation importante de la prévalence des affections de longue durée pour maladies pulmonaires est aussi observée, passant de 4 % à 12 % sur la même période et la prévalence de l’asthme chez les enfants et adolescents est également en augmentation.
Cancers
Les données validées et disponibles sur l’incidence des cancers en Polynésie française sont anciennes et portent principalement sur la période 1985-2006, avec des doutes sur leur exhaustivité à partir de 2002. Sur cette période, l’incidence tous cancers standardisée sur la population mondiale semble être en légère augmentation chez les hommes, principalement en raison d’une augmentation de l’incidence du cancer de la prostate, et stable chez les femmes. L’incidence du cancer en Polynésie française est nettement inférieure à celle de la métropole, en particulier chez les hommes. Elle est également inférieure, dans une moindre mesure, à celle des Maoris de Nouvelle-Zélande, population la plus proche de celle de Polynésie française, et à celle des Hawaïens de Hawaï
7
Ces deux populations indigènes d’autres îles du Pacifique sont considérées génétiquement et culturellement proches aux Polynésiens.
. Les localisations principales de cancer en Polynésie française pour les hommes sont le cancer du poumon, de la prostate, du côlon et du foie. Pour les femmes, il s’agit du cancer du sein, de la thyroïde, du poumon et de l’utérus, en particulier le cancer du col de l’utérus en début de période puis celui du corps de l’utérus en fin de période. Le cancer du poumon était en nette baisse chez les hommes et en baisse plus modérée chez les femmes ; il était plus élevé qu’en métropole, et était particulièrement élevé chez les femmes dans les années 1980. Le cancer de la prostate chez les hommes, bien qu’inférieur au taux de métropole, est en constante augmentation laquelle peut être, comme en métropole, liée à des pratiques de dépistage précoce. Avec un niveau qui reste plus faible qu’en métropole, le cancer du sein chez la femme augmente mais de façon plus progressive. Le cancer du côlon, qui était plutôt élevé chez les hommes, reste stable sur la période et nettement inférieur à la métropole.
L’incidence du cancer de la thyroïde, en particulier chez les femmes, est, sur l’ensemble de la période 1985-2010, beaucoup plus importante en Polynésie française qu’en métropole et que dans les autres territoires du Pacifique, à l’exception de la Nouvelle-Calédonie. Sur la période 1998-2002, elle est même la plus élevée au monde, avec celle de la Nouvelle-Calédonie. La variation temporelle de l’incidence de ce cancer en Polynésie française est cependant difficile à étudier à partir des données disponibles car leur exhaustivité est variable au cours du temps. Il semble que pour les femmes, une incidence particulièrement élevée a été observée entre 1999 et 2002, et qui semble baisser ensuite. Des données plus récentes et validées sont indispensables pour analyser ces variations temporelles. Par ailleurs, il serait nécessaire d’étudier l’influence des pratiques diagnostiques sur ces évolutions. Enfin, il a été également observé une incidence particulièrement élevée de leucémie myéloïde pour les femmes sur la période 1998-2002.
De nombreuses maladies transmissibles persistent en Polynésie française, à un niveau très élevé pour un pays développé, et ceci serait lié à l’inconstance et au manque de maintien des systèmes de prévention. On peut citer les pathologies principales : le rhumatisme articulaire aigu, la filariose lymphatique, la dengue, la tuberculose et la leptospirose. Par ailleurs, la Polynésie française est très sensible aux épidémies nouvelles, comme celle liée à l’infection par le virus Chikungunya qui a eu lieu en 2014-2015 et celle liée à l’émergence d’un arbovirus rare, celui du Zika en 2013, transmis comme celui de la dengue. Certaines de ces maladies peuvent entraîner des complications sévères affectant l’état de santé général, voire même des décès.
Il est très difficile d’étudier précisément l’évolution de l’état de santé de la population polynésienne depuis les années 1960, en raison du manque de données fiables avant les années 1980 et de données fiables sur le cancer depuis 2006. Par ailleurs, plusieurs études et tentatives d’enregistrements exhaustifs ont été mises en place, mais leur qualité reste inégale et inconstante au cours du temps. Toutefois, les indicateurs les plus récents montrent que l’état de santé de la population de Polynésie française est globalement meilleur que dans les autres États de Polynésie et de Mélanésie, mais moins bon qu’en métropole et aux Antilles. Les pathologies chroniques comme le diabète, l’hypertension artérielle et les maladies cardiovasculaires, qui sont principalement liées à des consommations importantes de tabac, d’alcool, ainsi qu’à une alimentation riche et sucrée, sont à des niveaux de prévalence et d’incidence préoccupants par rapport à la métropole. Concernant le cancer, les taux de mortalité tous cancers confondus sont similaires à ceux de métropole pour les hommes et plus élevés pour les femmes ; l’incidence tous cancers est inférieure à celle de la métropole, en particulier chez les hommes. Certaines localisations de cancer présentent des niveaux élevés, en particulier chez les femmes, comme c’est le cas pour la thyroïde avec l’une des incidences les plus élevées au monde, l’utérus et certaines formes de leucémies.
Perspectives : Surveillance de la santé
L’amélioration, le développement et la pérennisation du système de surveillance sanitaire des pathologies non transmissibles en Polynésie française s’avèrent nécessaires.
Le besoin de développement porte en premier lieu sur le registre des cancers (voir les précisions apportées ci-après), qui doit atteindre puis maintenir un niveau de qualité équivalent à celui des autres registres du territoire français (registres de métropole et registres des départements et régions d’Outre-mer). La création d’un registre des maladies cardiovasculaires et d’un registre des anomalies congénitales serait hautement souhaitable. Le besoin de développer de tels registres se justifie d’autant plus dans le contexte d’une exposition des populations locales aux rayonnements ionisants lors des essais nucléaires atmosphériques menés par la France sur la période 1966-1974 (voir infra les perspectives relatives aux études épidémiologiques).
Il importe également de disposer de bases de données de santé de qualité, exploitables, accessibles et appariables les unes aux autres (Assurance maladie, données médicales et hospitalières, etc.) pour permettre une surveillance régulière des principales pathologies, et de leurs évolutions temporelles et spatiales. Par ailleurs, il est aussi nécessaire de réaliser régulièrement des enquêtes pour connaître les évolutions des principaux facteurs de risque des différentes pathologies, ainsi que les inégalités territoriales et sociales de santé.
Ce recueil de données doit être réalisé en toute indépendance et les résultats doivent être rendus accessibles, en particulier aux acteurs de la recherche.
Enfin, au-delà du besoin d’améliorer la surveillance des pathologies non transmissibles, il apparaît nécessaire de développer des programmes de prévention adaptés et basés sur des interventions évaluées et probantes étant donné l’augmentation de l’incidence de ces pathologies et de leurs facteurs de risque.
Focus concernant le Registre des cancers
Il est indispensable que la Polynésie française se dote d’un état des lieux exhaustif, fiable et pérenne du nombre de cas de cancer de ses résidents, avec une description spatiale et temporelle précise par localisation de cancer. Le registre des cancers doit donc rapidement réobtenir puis maintenir au cours du temps sa qualification auprès des instances nationales (telles que le Comité d’évaluation des registres, ou CER). Cela suppose qu’il puisse avoir accès à toutes les sources de données existantes pour permettre des notifications exhaustives des cas et leur confirmation histologique, et qu’il dispose des ressources humaines suffisantes, associant médecins épidémiologistes, enquêteurs, data-managers et statisticiens. Par ailleurs, le registre des cancers doit :
• suivre les guidelines françaises et internationales ;
• collaborer étroitement avec le réseau Francim
8
Francim : France Cancer Incidence et Mortalité
, qui rassemble l’ensemble des registres de cancer du territoire français, et le CIRC
9
CIRC : Centre International de Recherche sur le Cancer
;
• publier ses résultats dans des revues scientifiques à comité de lecture ;
• effectuer des comparaisons nationales et internationales en participant à des projets de recherche et de surveillance, collaborer avec les registres internationaux de la zone Pacifique.
Un tel registre des cancers pourra permettre la mise en place d’études étiologiques.
Un tel dispositif ne peut s’obtenir que si le registre peut travailler en toute transparence et indépendance : il est nécessaire qu’il se dote d’un conseil scientifique indépendant, apte à valider et orienter ses travaux. À noter que la Polynésie française est maintenant le seul territoire d’Outre-mer qui ne dispose pas d’un registre de cancer qualifié, à l’exception de Mayotte (et des territoires comme Wallis-et-Futuna et Saint-Pierre-et-Miquelon).
III. Données de surveillance radiologique de l’environnement en Polynésie française, estimation des doses reçues
par les populations et connaissances sur les méthodes
de dosimétrie
Données de surveillance radiologique de l’environnement
en Polynésie française
Les données de surveillance radiologique de l’environnement en Polynésie française présentées dans cette partie ont fait l’objet de l’audition par le groupe d’experts d’un intervenant de l’IRSN
10
IRSN : Institut de Radioprotection et de Sûreté Nucléaire
. Ces données sont détaillées dans la communication intitulée « Éléments de connaissance de l’IRSN concernant les retombées des essais nucléaires atmosphériques français sur la Polynésie », présentée en fin du rapport d’expertise collective.
La surveillance radiologique de l’environnement polynésien, hors les sites d’expérimentations de Moruroa et Fangataufa, a commencé dès 1962 et s’est plus particulièrement intéressée aux retombées des 41 essais atmosphériques réalisés par la France entre 1966 et 1974
11
À ces essais s’ajoutent les 5 essais de sécurité réalisés dans l’atmosphère (Ministère de la Défense. La dimension radiologique des essais nucléaires français en Polynésie. À l’épreuve des faits. 2006) ; ce type d’essais est destiné à vérifier que la bombe ne s’amorce pas d’elle-même pendant le transport ou le stockage.
. Cette surveillance, réalisée depuis l’origine par le Laboratoire d’étude et de suivi de l’environnement (LESE) (CEA/IPSN/LESE jusqu’en 2002, IRSN/LESE depuis), consiste en un suivi des activités radioactives atmosphériques, des eaux de rivières et de mer, et de denrées alimentaires. Les données disponibles concernent des campagnes de mesures
12
Les rayonnements ionisants sont des particules émises par des noyaux avec une grande énergie. Les rayons alpha (α) sont des noyaux légers d’hélium, les rayons bêta (β) des électrons négatifs ou positifs et les rayons gamma (γ) des photons de grande énergie, analogues aux rayons X.
du rayonnement gamma et bêta global dans les biotopes (atmosphère, géosphère, hydrosphère) et la biocénose (échantillons terrestres et marins de produits de consommation, de sédiments, coraux, plancton, etc.). Depuis 1966, un rapport annuel sur les mesures environnementales est transmis par la France à l’UNSCEAR (
United Nations Scientific Committee on the Effects of Atomic Radiation).
La distribution spatiale des retombées d’une explosion nucléaire se compose :
• des retombées locales : les particules les plus lourdes se déposent dans un rayon de quelques dizaines à quelques centaines de kilomètres autour du site de tir ;
• des retombées troposphériques dans la zone atmosphérique la plus basse où les produits séjournent jusqu’à 30 jours et sont transportés sur des milliers de kilomètres avant de se déposer au sol ;
• des retombées stratosphériques dans la seconde couche de l’atmosphère terrestre : les particules libérées dans la stratosphère redescendent par gravité dans la troposphère en 2 à 24 mois selon les caractéristiques climatiques de la région considérée.
De façon générale, parmi les très nombreux radionucléides produits lors d’un essai nucléaire, une vingtaine sont à considérer pour estimer les conséquences radiologiques sur l’environnement et les populations :
• les radionucléides à période
13
La période radioactive ou demi-vie correspond au temps que met une substance radioactive pour perdre la moitié de sa radioactivité : la moitié des atomes se sont désintégrés et sont devenus stables.
courte (inférieure à 1 an) : l’iode-131, le barium-140, le zirconium-95, le manganèse-54 ou encore le zinc-65 ;
• les radionucléides à période moyenne (1 à 10 ans) : le cobalt-60 ;
• les radionucléides à période longue (supérieure à 10 ans) : le tritium, le carbone-14, le césium-137, le strontium-90, les isotopes 238, 239, 240 et 241 du plutonium et l’américium-241 qui sont encore présents en quantités mesurables dans les différentes composantes de l’environnement.
Une part de ces radionucléides se retrouve dans l’air sous forme d’aérosols difficilement détectables. La majorité est présente dans les sols et peut alors contribuer à une exposition externe de la population. Ces radionucléides sont ensuite incorporés dans les denrées issues de la culture ou de la pêche locale et constituent ainsi une source de contamination interne par ingestion.
Sur les 41 essais nucléaires atmosphériques réalisés par la France en Polynésie française, six ont été répertoriés comme ayant donné lieu à des retombées radioactives localement très supérieures à celles ayant affecté l’ensemble de l’hémisphère sud, suite à des évènements de retours anticycloniques (tableau I

). Pour les autres essais, les retombées globales (troposphériques et stratosphériques) sur Tahiti, et de manière plus générale sur la Polynésie française, ont été similaires à celles observées sur l’ensemble de l’hémisphère sud.
Actuellement, sur la base des mesures réalisées par l’IRSN, validées par l’Agence internationale pour l’énergie atomique (AIEA), la radioactivité artificielle résiduelle liée aux essais nucléaires contribue de manière extrêmement faible à l’exposition des populations. La surveillance radiologique de l’environnement est cependant maintenue.
Tableau I Liste des essais ayant conduit à une augmentation de l’activité volumique de l’air supérieure aux niveaux caractéristiques des retombées régionales ou mondiales pour les îles et atolls polynésiens (Ministère de la Défense, 2006*)
|
Essai
|
Date de l’essai
|
Îles
|
|
Aldébaran
|
2 juillet 1966
|
Gambier
|
|
Rigel
|
24 septembre 1966
|
Tureia
Gambier
|
|
Arcturus
|
2 juillet 1967
|
Tureia
|
|
Encelade
|
12 juin 1971
|
Tureia
|
|
Phoebé
|
8 août 1971
|
Gambier
|
|
Centaure
|
17 juillet 1974
|
Tahiti
|
* Ministère de la Défense. La dimension radiologique des essais nucléaires français en Polynésie. À l’épreuve des faits. 2006.
À titre d’exemple concernant les niveaux de radioactivité actuels de l’environnement de Polynésie française, le césium-137 est le seul radionucléide artificiel présent en quantité mesurable dans l’air. Dans l’air de Tahiti, l’activité moyenne du césium-137 rémanent des retombées des essais nucléaires est extrêmement faible
14
Il n’existe pas de limite spécifique à laquelle le niveau d’activité du césium-137 pourrait être comparé. Toutefois, des niveaux maximaux admissibles dans les denrées alimentaires ont été déterminés pour gérer les conséquences des accidents de Tchernobyl et de Fukushima, et des valeurs guides sont proposées dans le Codex Alimentarius de l’Organisation mondiale de la santé. Pour le césium-137 comme pour les isotopes du plutonium, les valeurs limites correspondantes sont de l’ordre de 100 à plus de 1 000 fois supérieures à celles mesurées ces dernières années en Polynésie.
(0,06 μBq/m
3)
15
Le Becquerel (Bq) mesure l’activité d’une source radioactive et correspond au nombre de transformations d’atomes par seconde. Un Becquerel équivaut à une désintégration par seconde.
et stable depuis plusieurs années. Cette valeur est inférieure à la moyenne métropolitaine (0,1 μBq/m
3). Dans les eaux douces, le césium-137 n’a été que très rarement détecté ces dernières années ; son activité est de l’ordre de 0,1 mBq/L. La diminution de sa concentration dans les eaux marines se poursuit. Pour l’ensemble des denrées alimentaires, les concentrations en césium-137 sont extrêmement faibles, souvent inférieures à 0,1 Bq/kg frais.
Les estimations de doses de radiations ionisantes reçues par la population en Polynésie française ainsi que par les personnels civil et militaire suite aux retombées des essais nucléaires sont abordées dans la partie suivante, consacrée à la dosimétrie.
Estimation des doses reçues par les populations en Polynésie française suite aux essais nucléaires
La dosimétrie consiste à déterminer, par mesure ou par calcul, la quantité de rayonnement déposée dans un environnement ou reçue par un organisme vivant. Plusieurs concepts et unités de mesure sont employés :
• la dose absorbée (en Gray, Gy) correspond au dépôt d’énergie cédée par un rayonnement dans un tissu ou un organe ;
• la dose équivalente (en Sievert, Sv), relative à un tissu ou un organe exposé, correspond au produit de la dose absorbée par un facteur de pondération qui prend en compte le type et la nocivité du rayonnement ;
• la dose efficace, également en Sievert (Sv), est relative à l’organisme entier : elle correspond à la somme des doses équivalentes des différents tissus et organes affectés, chacune des doses étant pondérée par un facteur tissulaire qui prend en compte la nature et la sensibilité du tissu ou organe exposé au rayonnement.
Principes de la reconstruction dosimétrique suite à une exposition
aux retombées des essais nucléaires
La reconstruction ou reconstitution des doses reçues par les populations peut s’inscrire dans différents contextes. Il peut s’agir, dans le cadre d’études épidémiologiques, d’estimer les doses le plus précisément possible afin d’évaluer les risques sanitaires associés à l’exposition ou il peut s’agir d’estimer les doses dans le cadre d’un programme qui vise à l’indemnisation des personnes exposées.
La reconstruction des doses reçues par les populations (civile et militaire) suite aux essais nucléaires doit prendre en compte l’ensemble des voies d’exposition. La qualité de la reconstruction dosimétrique dépend des données disponibles, des méthodes et modèles utilisés. Les différents modèles et hypothèses considérés dans chaque reconstruction sont basés sur les données disponibles et varient d’une étude à l’autre.
La dose efficace (en Sv) est un concept dosimétrique de radioprotection qui permet de prendre en compte, pour l’ensemble des types de rayonnements impliqués, les doses absorbées par les organes sensibles à l’induction des effets stochastiques
16
Les effets stochastiques apparaissent de manière aléatoire à long terme après irradiation. Par opposition, les effets déterministes se produisent de manière certaine au-delà d’un certain seuil de dose et plus précocement. Les effets stochastiques dépendent de nombreux facteurs : dose, nature du rayonnement (particules alpha, rayonnements bêta, gamma, X, neutrons), faible/fort transfert d’énergie linéique, voie d’exposition (inhalation, ingestion, irradiation externe), débit de dose (dose unique, fractionnée, chronique), partie du corps irradiée (corps entier, sensibilité, latence selon l’organe), facteurs individuels (sexe, âge, comportements tels que le tabagisme).
, pondérées par un facteur représentant la contribution respective de ces organes au détriment global associé aux effets stochastiques radio-induits. Dans le cadre des études épidémiologiques visant à estimer les risques de maladies liées aux rayonnements, et qui peuvent concerner certains organes spécifiquement, ce sont les doses absorbées par les organes correspondants qui sont utilisées, notamment la dose absorbée par la thyroïde (en Gy) quand on s’intéresse au cancer de la thyroïde. Dans les études publiées par le ministère de la Défense et le CEA, les doses à la thyroïde sont fournies en termes de doses équivalentes qui intègrent les facteurs de pondération par type de rayonnement et sont exprimées en Sv. Dans le cas des rayonnements β, prédominants dans les contaminations par l´iode-131, le facteur de pondération étant égal à 1, les doses absorbées et équivalentes sont ainsi numériquement équivalentes.
Les voies d’exposition considérées pour la reconstruction dosimétrique diffèrent selon le type de population exposée : les populations locales, non impliquées dans la réalisation des essais ; le personnel (civil et militaire) impliqué dans la réalisation des essais.
Pour les populations locales
Concernant les populations locales, les voies d’exposition considérées suite aux essais nucléaires atmosphériques sont :
• les expositions externes liées à l’immersion dans le panache et au dépôt sur le sol (associé aux retombées suite au passage du panache radioactif) ;
• les contaminations internes liées à l’inhalation dans le panache et à l’ingestion d’eau et de produits alimentaires.
Pour une estimation complète des doses reçues par la population, il convient de considérer les retombées immédiates sur les zones affectées (dans les heures qui ont suivi l’explosion) ainsi que les retombées tardives (plusieurs jours ou semaines après) qui affectent des régions plus vastes.
Les radionucléides libérés lors des essais nucléaires sont les matières nucléaires non consommées (environ 10 % de la matière fissile sont en général consommés par la réaction nucléaire), les traceurs de réaction, les produits des réactions de fission, les produits des réactions d’activation des composants technologiques (engins, structures) et les produits d’activation des composants naturels de l’environnement : air, sol et eau. Tous ces éléments se retrouvent dans l’environnement dans des proportions qui dépendent du mélange initial, des conditions de l’explosion et des conditions météorologiques. Les reconstructions de doses sont réalisées à partir de mesures de radioactivité dans l’environnement (atmosphère, géosphère, hydrosphère et biocénose). En ayant connaissance du mélange initial et des conditions météorologiques, des modèles permettent d’estimer les contributions respectives des différents radionucléides dans le panache, le dépôt au sol et la contamination des différents produits alimentaires, en fonction du temps. Pour estimer les doses de contamination interne, ces données sont combinées avec les paramètres qui caractérisent les personnes exposées : débit respiratoire par catégorie d’âge, temps passé à l’extérieur, facteur d’atténuation par les abris, et régime alimentaire (dépendant également de l’âge) obtenu le plus souvent par questionnaire. Le processus de reconstruction de doses choisi par les autorités françaises est fondé sur les mesures de dépôt au sol (Bq.m-2) en rayonnement bêta global qui nécessite l’utilisation de modèles et d’hypothèses.
Pour le personnel civil et militaire
Concernant le personnel impliqué dans les essais nucléaires, les voies d’exposition prédominantes considérées sont :
• l’exposition externe due aux rayonnements à l’instant de l’explosion, aux produits d’activation et aux retombées radioactives ;
• la contamination interne par inhalation ou ingestion d’éléments radioactifs.
Le personnel exposé aux rayonnements ionisants est tenu de porter des dosimètres qui permettent de connaître l’exposition externe aux rayonnements. À l’époque des essais nucléaires français, les films dosimétriques étaient utilisés pour mesurer les doses d’exposition externe qui devaient être enregistrées dans le registre individuel des doses. Les estimations de dose du personnel sont donc basées sur ces enregistrements quand ils sont mis à disposition. Les dosimètres n’étaient pas nécessairement attribués à l’ensemble du personnel. Ainsi, la reconstruction des doses d’exposition externe nécessite de définir des groupes de travailleurs pour attribuer les doses des dosimètres « témoins » à l’ensemble des travailleurs du même groupe. La reconstruction de doses d’exposition interne suit une méthode similaire à celle mise en œuvre pour les populations sur la base des mesures réalisées au moment des essais nucléaires. Pendant toute la période des essais nucléaires, la recherche d’une éventuelle exposition interne consécutive à l’inhalation ou à l’ingestion d’éléments radioactifs s’est appuyée sur les résultats des mesures anthropogammamétriques
17
Les mesures anthropogammamétriques permettent de déterminer le spectre et l’activité des radionucléides émetteurs gamma incorporés dans l’organisme.
et des mesures de l’activité des radionucléides présents dans les urines, les fèces et les prélèvements narinaires.
Reconstructions dosimétriques dans les études sur les essais nucléaires menés en Polynésie française : doses reçues par les populations
Estimation des doses reçues par les populations
• Période 1966-1974
Les reconstructions de doses ont porté sur les populations des îles Gambier, Tureia et Tahiti, zones les plus affectées par les retombées radioactives suite aux six essais nucléaires (Aldébaran, Rigel, Arcturus, Encelade, Phoebe, Centaure) répertoriés comme ayant donné lieu aux retombées les plus élevées (ministère de la Défense, 2006)
18
Ministère de la Défense. La dimension radiologique des essais nucléaires français en Polynésie. À l’épreuve des faits. 2006.
.
Les estimations de doses disponibles sont celles réalisées par les autorités françaises et celles effectuées dans le cadre d’une étude épidémiologique menée par l’Inserm
19
Drozdovitch V, Bouville A, Doyon F, et coll. Reconstruction of individual radiation doses for a case-control study of thyroid cancer in French Polynesia. Health Phys 2008 ; 94 : 418-33. de Vathaire F, Drozdovitch V, Brindel P, et coll. Thyroid cancer following nuclear tests in French Polynesia. Br J Cancer 2010 ; 103 : 1115-21.En février 2020, Drozdovitch et coll. ont publié une étude portant sur le dépôt au sol des radionucléides en Polynésie française, à partir de données de rapports déclassifiés en 2013 (Drozdovitch V, de Vathaire F, Bouville A. Ground deposition of radionuclides in French Polynesia resulting from atmospheric nuclear weapons tests at Mururoa and Fangataufa atolls. J Environ Radioact 2020 ; 214-215 : 106176). Dans cette étude, Drozdovitch et coll. font référence à leur publication portant sur de nouvelles estimations des doses à la thyroïde dans la population de Polynésie française (Drozdovitch V, Bouville A, Taquet M, et al. Thyroid doses to french polynesians resulting from atmospheric nuclear weapons tests : estimates based on radiation measurements and population lifestyle data. Health Phys 2020, sous presse). Les résultats de ces deux études sont présentés dans la communication « Dose assessment methods used to evaluate the radiation exposures from nuclear testing in the atmosphere, with emphasis on the tests conducted in French Polynesia », en fin du rapport d’expertise.
. Les rapports publiés par les autorités françaises, présentant le système de surveillance et les doses estimées sur chacun des sites, ont fait l’objet d’une évaluation par un groupe d’experts indépendants mandatés par l’Agence internationale pour l’énergie atomique (AIEA). L’analyse de l’expertise collective porte sur les rapports publiés par les autorités françaises en 2006, le rapport de l’AIEA (2010)
20
AIEA (Agence internationale pour l’énergie atomique), CEA (Commissariat à l’énergie atomique et aux énergies alternatives). Rapport sur l’examen par des experts internationaux de l’exposition du public aux radiations en Polynésie française suite aux essais atmosphériques nucléaires français. Septembre 2009 – Juillet 2010. AIEA, 2010.
et le rapport du CEA (2014)
21
CEA (Commissariat à l’énergie atomique et aux énergies alternatives). Bilan des doses délivrées aux populations polynésiennes pendant la période des essais nucléaires atmosphériques. Calcul des doses. Rapport CEA, 2014.
publié en réponse à l’analyse de l’AIEA (2010). Les doses publiées par les autorités françaises sont également comparées avec celles de l’étude réalisée par l’Inserm en 2008.
La reconstruction initiale de doses réalisée par les autorités françaises en 2006 porte sur une estimation des doses associées aux principales voies d’exposition par les retombées immédiates : les expositions externes liées à l’immersion dans le panache et au dépôt sur le sol ainsi que les contaminations internes liées à l’inhalation dans le panache et à l’ingestion d’eau et de produits alimentaires.
La méthode de calcul choisie est fondée sur les mesures de dépôt au sol (Bq.m-2) en rayonnement bêta global, à partir desquelles l’activité volumétrique, intégrée sur le temps (Bq.s.m-3), des aérosols présents dans le panache est estimée, par isotope, en fonction de sa vitesse de dépôt (Vd). Ainsi, la dose efficace et la dose à la thyroïde, issues des expositions externes (panache et dépôt), et les doses de contamination par inhalation peuvent être estimées. Les activités mesurées sur les produits de consommation sont utilisées pour estimer la dose efficace et la dose à la thyroïde issues d’ingestion de produits contaminés.
Les tableaux II

et III

présentent les voies prédominantes d’exposition pour les six essais nucléaires considérés et les populations adultes ou enfants, respectivement en termes de dose efficace ou de dose à la thyroïde.
Tableau II Voies prédominantes d’exposition et doses efficaces associées (en mSv) pour les six essais nucléaires considérés et populations adultes concernées (d’après AIEA et CEA, 2010)
| |
Voies d’exposition prédominantes (dose efficace en mSv)
|
|
Essai nucléaire
(Année)
|
Population
|
Externe
|
Inhalation
|
Contamination interne
|
|
Dépôt
|
Panache
|
Produits mer
|
Légumes
|
Eau
|
|
Acturus (1967)
|
Tureia
|
0,7
| |
0,03-2,4
| | |
|
Encelade (1971)
|
Tureia
|
1,1
| | | | |
|
Aldébaran (1966)
|
Gambier
|
2,9
| | | | |
|
Centaure (1974)
|
Hitiaa
|
1,2
| | | | |
| |
Taravao
| |
1,1
|
1,9
| | |
| |
Pirae
| | |
0,11
|
0,15
| |
|
Rigel (1966)
|
Tureia
| | |
0,002-0,074
| | |
| |
Gambier
| | | | |
0,1-0,17
|
|
Phoebe (1971)
|
Gambier
| | | | |
0,1-1,8
|
Tableau III Voies prédominantes d’exposition pour les jeunes enfants (1-2 ans) des zones concernées et doses à la thyroïde* associées (en mSv) pour les six essais nucléaires considérés (d’après AIEA et CEA, 2010)
| |
Voies d’exposition prédominantes (dose thyroïde en mSv)
|
|
Essai nucléaire
(Année)
|
Population
|
Inhalation
|
Contamination interne
|
|
Panache
|
Produits mer
|
Légumes
|
Viande
|
Lait
|
Eau
|
|
Acturus (1967)
|
Tureia
| |
0,56-34,6
| | | | |
|
Encelade (1971)
|
Tureia
| | | | | |
3,0-21,1
|
|
Aldébaran (1966)
|
Gambier
|
3-30
|
0,02-22,8
|
1,3-19
| | | |
|
Centaure (1974)
|
Hitiaa
|
6,4
| |
11,9
| |
25
| |
| |
Taravao
|
24
| |
6,9
| |
4,5
| |
| |
Pirae
| |
2,86
|
4,3
|
1,28
|
4,5
| |
|
Rigel (1966)
|
Tureia
| |
0,056-1,1
| | | |
0,52-0,88
|
| |
Gambier
| | | | | |
4,4-7,3
|
|
Phoebe (1971)
|
Gambier
| | | | | |
4,3-88,2
|
* Doses équivalentes à la thyroïde (en mSv) incluant le facteur de pondération du type de rayonnement (ωR).
Lorsque l’ensemble des voies d’exposition sont prises en considération (pas uniquement les voies d’exposition prédominantes présentées ci-dessus), les doses efficaces totales pour la population adulte sont estimées à 0,07-0,15 mSv sur Tureia après l’essai Rigel, à 3,1-6,6 mSv sur les îles Gambier après l’essai Aldébaran.
Ces doses peuvent être comparées avec les doses efficaces estimées dans le cadre de l’étude menée par l’Inserm : la dose efficace associée à l’inhalation dans le panache variait de 0,01 à 0,4 mSv, celle associée à l’exposition externe due au dépôt variait de 0,4 à 3,9 mSv et celle associée à l’ingestion de produits alimentaires variait de 0,013 à 1,9 mSv.
Lorsque l’ensemble des voies d’exposition sont prises en considération, les doses à la thyroïde chez les enfants varient de 0,6 mSv sur Tureia après l’essai Rigel, à 98 mSv sur les îles Gambier après l’essai Phoebe.
Suite à l’analyse du rapport de 2006 par l’AIEA (2010), le rapport du CEA publié en 2014 présente les tableaux nécessaires pour estimer les doses prenant en compte les retombées immédiates et plus tardives qui ont touché des zones habitées plusieurs jours ou semaines après les essais. Les doses de contamination interne (inhalation et ingestion) issues de ces retombées ont été calculées pour l’ensemble de la population d’adultes et d’enfants répartis en cinq classes d’âges entre 1966 et 1974. Le calcul des doses est basé sur les mesures de radioactivité effectuées dans les différents milieux (air, produits alimentaires) en considérant les spectres de 6 radionucléides (137Cs, 90Sr, 65Zn, 95Zr, 60Co, 106Ru) contribuant à l’activité bêta globale. À partir des valeurs de doses présentées dans les tableaux, c’est-à-dire les doses moyennes annuelles efficaces pour chaque île, par voie de contamination (inhalation et ingestion), un individu peut reconstituer la dose qu’il a reçue en fonction de son âge, son lieu de résidence et la durée du séjour.
• Période 1975-1981
Des estimations de doses reçues par la population polynésienne ont été réalisées par l’IRSN dans le cadre d’une étude sollicitée par le CIVEN
22
CIVEN : Comité d’indemnisation des victimes des essais nucléaires
en 2019 et publiée en janvier 2020
23
IRSN. Évaluation de l’exposition radiologique des populations de Tureia, des Gambier et de Tahiti aux retombées des essais atmosphériques d’armes nucléaires entre 1975 et 1981. Rapport IRSN/2019-00498. [Consulté le 15/01/2020 : https://www.irsn.fr/].
. Il s’agit d’une évaluation des doses efficaces consécutives aux retombées des essais atmosphériques, potentiellement reçues par les populations polynésiennes ayant résidé à Tureia, aux îles Gambier et sur quatre communes de Tahiti, entre 1975 et 1981. Cette étude repose d’une part sur l’analyse des données des rapports annuels établis de 1975 à 1981 par le Service mixte de contrôle biologique (SMCB) de la Direction des centres d’expérimentations nucléaires (DIRCEN) pour la surveillance des denrées alimentaires (ces rapports initialement classés Confidentiels Défense ont été déclassifiés par décret en 2013) et, d’autre part, sur des mesures de terrain réalisées en 1982 et entre 2017 et 2018. Les données déclassées donnent les activités des principaux radionucléides permettant ainsi de déterminer de manière plus précise les doses efficaces par rapport à la période antérieure où les estimations sont basées sur des activités globales. Pour la période 1975-81, les nouvelles estimations de doses efficaces annuelles chez les sujets adultes sont comprises entre 0,018 et 0,068 mSv. Pour les enfants, les doses efficaces totales estimées sont pour la plupart très proches de celles des adultes. Pour la classe d’âge des 12-17 ans ayant résidé à Tahiti, les valeurs peuvent être légèrement supérieures à celles des adultes, mais n’excèdent pas 0,049 mSv/an. Après 1981, les doses efficaces annuelles diminuent progressivement pour atteindre au milieu des années 1990 des valeurs inférieures à 0,01 mSv/an, mis à part un effet notable en 1987 des denrées importées de l’hémisphère nord et marquées par les retombées de l’accident de Tchernobyl. Ces valeurs prennent en compte également les retombées de l’ensemble des essais nucléaires atmosphériques, sans pouvoir distinguer leurs contributions respectives. À partir du milieu des années 1980, ces estimations de doses ne sont plus exclusivement liées aux retombées globales des essais nucléaires en Polynésie française, mais aux principaux radionucléides artificiels présents dans les denrées consommées en Polynésie, quelles que soient leurs origines (locales ou importées).
Estimation des doses reçues par le personnel civil et militaire (Ministère
de la Défense, 2006)
24
Ministère de la Défense. La dimension radiologique des essais nucléaires français en Polynésie. À l’épreuve des faits. 2006.
Les doses reçues par le personnel civil et militaire présent sur les sites d’essai sont issues d’expositions externes et internes, les premières étant déterminées principalement par les dosimètres individuels et les secondes estimées par anthropogammamétrie ou par analyses d’échantillons biologiques. Les doses d’expositions externes annuelles les plus élevées (supérieures à 50 mSv) ont été enregistrées pour le personnel de l’aviation militaire. Les doses de contamination interne après intervention varient de quelques dizaines de mSv à 30 mSv.
Connaissances sur les méthodes de dosimétrie utilisées
pour estimer les doses reçues par les individus exposés
aux rayonnements ionisants
Techniques de dosimétrie physique rétrospective
Les méthodes de dosimétrie physique reposent sur l’utilisation de phénomènes physiques pour l’analyse des échantillons étudiés et la quantification de la dose absorbée, que ces échantillons soient issus de prélèvements biologiques humains (par exemple émail dentaire) ou de prélèvements réalisés dans l’environnement (par exemple briques et porcelaines). C’est en ce sens que ces méthodes dites physiques se distinguent des méthodes de dosimétrie biologique qui utilisent des processus et des indicateurs biologiques comme par exemple la fréquence de chromosomes dicentriques dans les lymphocytes.
Ces méthodes ont été appliquées dans différents contextes :
• pour les urgences radiologiques, suite à des irradiations à des niveaux de dose entraînant à court terme des effets sur la santé dits déterministes (érythème, aspermie, aplasie...) pouvant nécessiter une prise en charge médicale immédiate. Les données dosimétriques sont utilisées par les équipes médicales pour poser le diagnostic et définir les meilleures stratégies thérapeutiques ;
• pour les études des effets des rayonnements ionisants à faible dose et à long terme, notamment en support des études épidémiologiques pour valider les méthodes de calcul de doses reçues par des populations.
Les techniques plus particulièrement utilisées dans ce dernier contexte ont été :
• la spectroscopie par résonance paramagnétique électronique (RPE) sur l’émail de dents extraites pour raisons médicales ;
• la luminescence stimulée optiquement ou thermiquement sur des matériaux de fabrication humaine (terre cuite et porcelaine), couplée à des mesures de terrain, à des simulations numériques du champ de rayonnement et à des enquêtes auprès des populations sur les habitudes de vie.
L’irradiation induit dans ces matériaux des défauts ou des radicaux en proportion de la dose délivrée. Ces défauts et radicaux étant extrêmement stables, leur quantité totale est considérée comme proportionnelle à la dose accumulée au fil des années depuis la période de formation de l’émail dentaire ou de fabrication des matériaux. Comme les techniques susmentionnées permettent de quantifier les défauts ou radicaux, par un étalonnage approprié, il est possible à partir de ces données d’estimer la dose absorbée dans les matériaux considérés.
La RPE, principale technique utilisée, a été appliquée pour estimer les doses reçues par les survivants des bombardements atomiques d’Hiroshima et Nagasaki et pour valider les méthodes d’estimation de dose pour les études des effets de rayonnements ionisants sur les populations exposées aux retombées des accidents nucléaires de Tchernobyl et de Mayak (Russie) ou des essais nucléaires atmosphériques réalisés sur le polygone de tir de Semipalatinsk (Kazakhstan). Des études ont également été réalisées en Inde et en Russie sur des populations non exposées à des retombées radioactives pour estimer leur niveau d’exposition externe. La RPE n’a pas été appliquée pour l’estimation des doses reçues par la population en Polynésie française ou plus largement dans le cadre des études de population dans le Pacifique. Du fait de ses principes de mesure, elle n’est applicable que pour les expositions externes et permet d’estimer une dose intégrée depuis la formation des dents et au mieux des excès de dose de l’ordre de quelques dizaines de mGy.
Techniques de dosimétrie biologique
L’estimation de la dose de rayonnement ionisant absorbée par un individu suite à une exposition repose sur l’utilisation d’une courbe dose-effet entre les doses reçues et les indicateurs biologiques étudiés. Ces courbes de référence sont établies après irradiation in vitro d’échantillons sanguins à des doses connues.
Il existe de nombreux indicateurs biologiques de l’exposition aux rayonnements tels que les mutations, l’expression génique, la cytogénétique, les protéines spécifiques telles que γ-H2AX (un marqueur de la réparation de l’ADN), les intermédiaires métaboliques et ceux résultant d’une approche protéomique. Les biomarqueurs cytogénétiques sont considérés comme les plus sensibles et les plus fiables parmi les divers indicateurs biologiques utilisés pour quantifier la dose de rayonnement absorbée. L’exposition des cellules peut induire des cassures de brins d’ADN sur les chromosomes, lesquels sont ensuite réparés par les systèmes de réparation de l’ADN dont dispose la cellule. Des cassures mal réparées peuvent entraîner des structures chromosomiques anormales. Différents types de chromosomes anormaux peuvent être identifiés et dénombrés. Le type et la fréquence des aberrations chromosomiques radio-induites sont liés à la nature de la source d’irradiation, à la durée de l’exposition et au débit de dose
25
Le débit de dose détermine l’intensité d’irradiation (énergie absorbée par la matière par unité de masse et de temps). Il se mesure en Gray par seconde (Gy/s).
.
Les principaux tests utilisés en dosimétrie biologique sont les suivants :
• le test du chromosome dicentrique habituellement réalisé sur les lymphocytes circulants après mise en culture et dont la sensibilité est de l’ordre de 0,1 Gy ;
• le test des micronoyaux formés à partir des anomalies chromosomiques instables. Il s’agit d’un test simple à réaliser mais sa sensibilité ne va pas en dessous de 0,25 Gy en raison d’une fréquence spontanée de micronoyaux de 0,002-0,036/cellule, ce taux de base présentant de fortes variations individuelles ;
• le test du chromosome condensé prématurément qui permet une évaluation des fragments chromosomiques excédentaires dans les 2 heures suivant l’exposition en s’affranchissant de la nécessité d’une stimulation mitogénique préalable des lymphocytes. Sa sensibilité est de 0,05 Gy.
Techniques de dosimétrie biologique rétrospective
La dosimétrie biologique rétrospective permet d’évaluer à long terme (entre 6 mois et 50 ans) une dose reçue et doit donc utiliser des biomarqueurs très stables dans le temps. Elle doit dans l’idéal répondre à trois impératifs : produire une estimation de dose individuelle fiable pour des organes ou des tissus et spécifier la durée d’exposition pour des expositions prolongées ; elle ne doit pas présenter de biais et doit déterminer l’incertitude dosimétrique.
Techniques utilisant l’hybridation in situ en fluorescence
La méthode standard de dosimétrie biologique post-irradiation repose sur l’analyse des chromosomes dicentriques dans les lymphocytes en culture après induction de la métaphase. Toutefois, en raison de la demi-vie des lymphocytes, estimée à quelques mois voire quelques années, cette technique ne permet pas d’estimer la dose absorbée dans un contexte rétrospectif car ces aberrations instables diminuent de moitié à chaque division cellulaire. De ce fait, d’autres techniques de biodosimétrie basées sur le dénombrement d’aberrations chromosomiques stables, telles que l’hybridation in situ en fluorescence (FISH) tricolore, ont été développées pour estimer une dose reçue plusieurs mois voire plusieurs années après l’exposition à des radiations. La Multiplex-FISH (M-FISH) peut aussi permettre la détection de translocations impliquant n’importe quel chromosome mais cette technique est longue et coûteuse. Certaines approches sont axées sur la détection des inversions radio-induites, les aberrations chromosomiques les plus stables, en utilisant la FISH (RxFISH) ou l’hybridation génomique dirigée.
La méthode aujourd’hui la plus répandue est l’analyse des translocations chromosomiques (aberrations stables) par différentes stratégies de coloration des chromosomes par hybridation in situ (FISH 2/3 couleurs/PAINT translocation ou multi-FISH). Elle permet d’estimer une dose jusqu’à plus de 40 ans après l’exposition. La technique consiste à réaliser des colorations souvent partielles des chromosomes puis à dénombrer les translocations dans les cellules dites sans aberrations instables. La technique de détection des translocations, même si elle est plus robuste, semble moins sensible que les autres, avec une limite de détection de l’ordre de 300 mGy. Ce défaut de sensibilité peut s’expliquer par la variabilité individuelle du taux de translocations spontanées. Il a été suggéré que cette approche est plus efficace pour l’évaluation d’une dose unique plutôt que d’une dose faible et chronique pendant laquelle des phénomènes adaptatifs peuvent se mettre en place et entraîner une sous-estimation. Une augmentation faussement positive peut être liée à la présence de populations clonales (dénombrement de la même anomalie transmise dans la descendance cellulaire de cellules progénitrices). Enfin, le nombre de translocations semble augmenter avec l’âge et ce paramètre doit être considéré pour ajuster l’estimation.
Autres techniques
Des techniques ont été développées comme la technique de comptage des micronoyaux dans les lymphocytes bloqués en cytokinèse qui permet d’évaluer une dose a posteriori. L’avantage de ce test est la rapidité de son analyse et la possibilité de la rendre automatique ; toutefois les micronoyaux ne sont pas spécifiques de l’irradiation.
Enfin d’autres méthodes de biodosimétrie rétrospective existent comme l’hybridation génomique directionnelle qui vise à détecter une inversion chromosomique via une hybridation in situ de chromosome (avec une limite de détection estimée à 200 mGy), la recherche de mutation somatique dont la plus répandue est l’analyse des mutations du gène de la glycophorine A. Ce système de dosage de la glycophorine A a été proposé comme un dosimètre cumulatif des expositions passées aux rayonnements (post Hiroshima). Mais il est soumis à de fortes variations individuelles qui rendent délicate l’estimation de la dose.
Applications des techniques de dosimétrie biologique
De nombreuses études ont utilisé la dosimétrie biologique rétrospective dans le but d’évaluer le niveau d’exposition ou pour le suivi de populations exposées. Cela concerne différentes sources d’exposition : essais nucléaires, bombe atomique, accidents nucléaires, contamination environnementale industrielle...
En résumé, les différentes stratégies de coloration des chromosomes par FISH sont les plus efficaces et fiables pour quantifier des aberrations chromosomiques stables (de type translocations ou inversions) et ainsi déterminer une dose d’irradiation reçue, alors que l’évaluation rétrospective par marquage Giemsa des aberrations chromosomiques instables (chromosomes dicentriques et anneaux) sous-estime la dose dans la mesure où ce taux décroît rapidement avec le temps et que l’incertitude, associée aux fortes doses, est importante. Le marquage FISH est considéré comme très fiable car, même cinquante années après exposition, le taux d’anomalies chromosomiques est supérieur au taux de base. Toutefois, la détection des translocations présente quelques limites. D’une part, la sensibilité de la détection des translocations et des inversions par FISH serait moindre que celle du test des dicentriques : certains n’accordent à la technique qu’une sensibilité se situant au-dessus de 300 mGy pour les translocations et au-dessus de 200 mGy pour les inversions. Une autre limite réside dans le fait que la méthode est essentiellement validée dans le cas d’exposition externe aux rayons γ de façon uniforme et relativement modérée. Dans le cas d’exposition interne aux radionucléides ou encore d’irradiation partielle, la dosimétrie biologique n’est donc pas suffisamment calibrée. L’utilisation d’approches de dosimétrie biologique pour des expositions inférieures à une centaine de mGy n’est pas informative.
Perspectives : Reconstructions dosimétriques
Au vu de l’analyse de la littérature sur la reconstruction dosimétrique, l’accès à l’ensemble des mesures de surveillance radiologique environnementale, après un inventaire systématisé des données, via une base de données centralisée serait un atout d’une part pour parfaire les hypothèses et les calculs des modèles de reconstruction dosimétrique et d’autre part pour affiner les estimations du degré d’exposition, tant au niveau des populations locales que des personnels civils et militaires.
S’agissant de la surveillance radiologique environnementale, disposer de mesures d’activité par isotope devrait permettre une estimation plus précise des doses que l’utilisation des mesures de dépôt au sol (Bq.m
-2) en rayonnement bêta global. De plus, il pourrait être envisagé de réaliser de nouvelles mesures de radionucléides à vie longue (césium, strontium...) dans les biotopes (sols...) et la biocénose (coquilles de bénitiers...) de différentes zones géographiques afin d’effectuer une reconstitution plus fine de la contamination environnementale associée aux essais nucléaires et des doses reçues par les populations. Suite à la déclassification en 2013 de rapports sur les mesures de la radioactivité environnementale faites en Polynésie française durant la période des essais nucléaires atmosphériques, les données de ces rapports pourraient être analysées dans le cadre de nouvelles études de dosimétrie afin d’améliorer les estimations initiales des doses reçues par les populations
26
Au début de l’année 2020, plusieurs travaux – précédemment cités dans la synthèse – ont été publiés à partir de données déclassifiées en 2013 :- IRSN. Évaluation de l’exposition radiologique des populations de Tureia, des Gambier et de Tahiti aux retombées des essais atmosphériques d’armes nucléaire entre 1975 et 1981. Rapport IRSN/2019-00498 [Consulté le 15/01/2020 : https://www.irsn.fr/]- Drozdovitch V, de Vathaire F, Bouville A. Ground deposition of radionuclides in French Polynesia resulting from atmospheric nuclear weapons tests at Mururoa and Fangataufa atolls. J Environ Radioact 2020 ; 214-215 : 106176.- Drozdovitch V, Bouville A, Taquet M, et al. Thyroid doses to french polynesians resulting from atmospheric nuclear weapons tests : estimates based on radiation measurements and population lifestyle data. Health Phys 2020, sous presse.
. S’agissant du personnel ayant participé aux essais nucléaires, de nouvelles études prenant en compte les doses mesurées sur les dosimètres films ainsi que les résultats des anthropogammamétries seraient souhaitables.
Les doses reçues par les populations polynésiennes étant principalement dues à une exposition interne et les niveaux de doses estimés étant faibles (de l’ordre du mSv pour la dose efficace, et de l’ordre de quelques mGy à quelques dizaines de mGy pour la dose à la thyroïde), il semble logique qu’une technique de dosimétrie physique (la spectroscopie par résonance paramagnétique électronique [RPE] sur l’émail dentaire) n’ait pas été utilisée dans le contexte polynésien car elle n’est applicable que pour les expositions externes et permet d’estimer une dose cumulée depuis l’éruption des dents et au mieux des excès de dose de l’ordre de quelques dizaines de mGy. Pour autant, aucune considération technique majeure n’empêche de réaliser une étude de la dose externe cumulée sur toute la période des essais nucléaires atmosphériques, reçue par la population (tout au moins pour les îles les plus affectées par les retombées radioactives). Une dosimétrie biologique ne serait informative qu’en complément de modèles de calcul de dose qui prédiraient que certains individus aient pu avoir été exposés à des doses supérieures à 200 mGy. Par ailleurs, il pourrait être pertinent d’entreprendre une reconstitution des doses aux gonades des populations exposées, en raison notamment de la préoccupation exprimée en Polynésie française au sujet de possibles effets sur la descendance, suite à une exposition aux rayonnements ionisants.
Enfin, la surveillance radiologique environnementale pourrait être assortie d’une surveillance de la qualité des milieux vis-à-vis des contaminants chimiques afin de disposer de données sur l’exposition des populations par l’air, l’eau et les aliments.
IV. Données épidémiologiques sur les conséquences sanitaires d’une exposition aux rayonnements ionisants
Cette partie expose tout d’abord l’approche épidémiologique générale des études relatives aux conséquences sanitaires d’une exposition aux radiations ionisantes. Elle présente ensuite les études épidémiologiques relatives aux conséquences sanitaires des essais nucléaires réalisés par plusieurs pays dans le monde.
Impact de l’exposition aux rayonnements ionisants
sur la santé des populations : approche épidémiologique générale
Les études épidémiologiques permettent d’estimer de façon directe, dans les populations humaines, le risque sanitaire lié à leur exposition aux rayonnements ionisants. Lorsqu’elles sont de qualité suffisante (en termes de puissance des études, reconstitution précise et individuelle de l’exposition, prise en compte de facteurs de confusion, précision des données sanitaires...) et dès lors que les résultats sont convergents, ces études épidémiologiques contribuent pour une part déterminante à fonder un jugement de causalité entre une exposition et la survenue des pathologies observées
27
Les études sur les mécanismes cellulaires et moléculaires contribuent également à établir une relation de causalité (voir la partie VI dédiée aux mécanismes dans cette synthèse).
. De plus, les études épidémiologiques analytiques permettent d’estimer l’ampleur et la forme de la relation exposition-risque. Les résultats de telles analyses peuvent contribuer à l’évaluation du niveau des conséquences sanitaires potentiellement liées à une exposition aux rayonnements ionisants.
Pathologies associées à l’exposition aux rayonnements ionisants
Cancer
L’exposition aux rayonnements ionisants est une cause établie de risque de différents cancers. De manière dépendante de l’âge lors de l’irradiation, de la dose et de son débit, ainsi que de la latence propre à chaque tissu, l’irradiation peut augmenter le risque de presque tous les types de cancer. Toutefois, en l’état actuel des connaissances, il existe un certain nombre de types et localisations de cancers dont il n’est pas avéré qu’ils peuvent résulter d’une exposition aux radiations. C’est le cas notamment des cancers du rectum, de la prostate, du pancréas et du col utérin, ainsi que du lymphome de Hodgkin et de la leucémie lymphocytaire chronique. Il est toutefois possible qu’une relation causale entre la survenue de ces cancers et une exposition aux rayonnements ionisants n’ait pas encore été prouvée du fait d’un temps de latence (entre l’irradiation et l’apparition d’un cancer radio-induit) qui pourrait être très long. Il faut également tenir compte du fait que l’excès de risque de cancers attribué aux rayonnements ionisants ne peut être détecté si le taux d’incidence est très bas surtout aux jeunes âges.
L’effet de l’exposition aux rayonnements ionisants sur le risque de cancers s’explique par différents mécanismes (par exemple : mutations induites dans l’ADN, qui peuvent concerner des gènes impliqués dans la genèse de cancers) qui sont développés dans la partie dédiée aux effets cellulaires et moléculaires d’une exposition aux rayonnements ionisants.
Maladies cardiovasculaires
Des études portant sur des populations diverses (survivants des bombardements atomiques d’Hiroshima et Nagasaki, travailleurs de la filière nucléaire, « liquidateurs » de Tchernobyl, riverains de la rivière Techa et travailleurs du complexe nucléaire Mayak dans l’Oural) concluent à un risque de maladie cardiovasculaire associé à l’exposition aux radiations ionisantes. Des observations allant dans le même sens ont été rapportées à partir de patients atteints de cancer traités par radiothérapie, mais elles sont plus difficiles à généraliser en raison de l’existence même de la maladie qui a nécessité un tel traitement, lequel implique le plus souvent de fortes doses d’irradiation. L’association entre l’exposition aux radiations ionisantes et les maladies cardiovasculaires est moins bien établie que pour le cancer car les mécanismes biologiques ne sont pas encore bien compris, en particulier pour les faibles doses
28
Il est désormais communément admis que le domaine des « faibles doses » est défini par des doses inférieures ou égales à 100 mSv (voir notamment : UNSCEAR. Biological mechanisms of radiation action at low doses. A white paper to guide the scientific Committee’s future programme of work. 2012).
.
Cataractes
Différentes études portant sur des populations variées, avec des circonstances d’exposition comprenant tant les expositions instantanées que les expositions prolongées à faibles débits de dose, ont rapporté une association entre l’exposition aux rayonnements ionisants et le risque de cataractes (au stade précoce), y compris à des doses de l’ordre de 100-250 mGy (aucune étude n’a montré d’effets en deçà de 100 mGy).
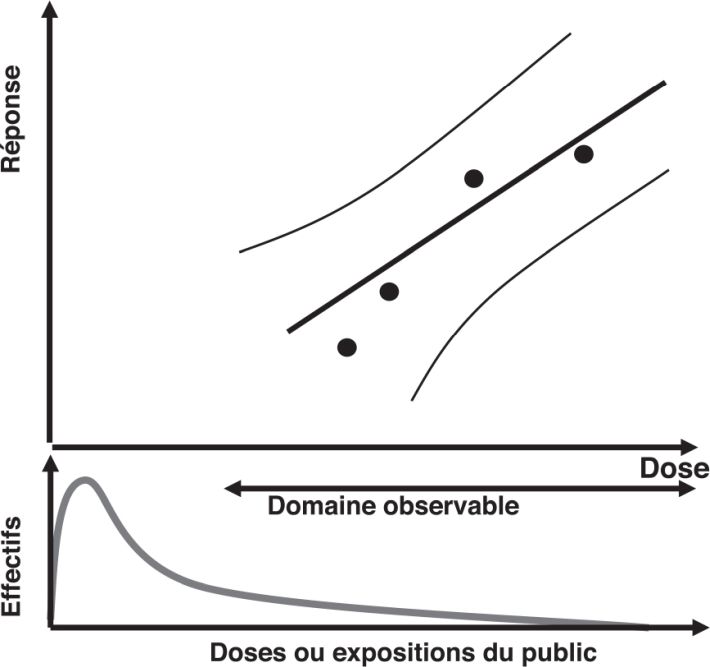
Relation dose-réponse
Une difficulté de l’estimation du risque est que l’impact sanitaire principal des expositions est en règle générale le produit de faibles expositions ou doses reçues par une large population, les fortes doses ne concernant qu’une partie très restreinte de la population à risque. L’impact en population des fortes doses est limité en comparaison de celui des faibles doses (figure 2

). La connaissance de l’allure de la relation dose-réponse aux faibles doses constitue donc un enjeu important
29
Les effets aux faibles doses étant ténus, ils ne sont pas observables. Il s’agit donc d’extrapoler à partir des données du domaine observable ce qui est susceptible de se produire dans le domaine non observable. Différents modèles mathématiques d’extrapolation s’ajustent de manière satisfaisante aux données dans le domaine observable. La qualité de cet ajustement est jugée sur la base d’un test statistique d’adéquation.
.
Les études épidémiologiques récentes sur les cinq types de populations mentionnés précédemment (survivants des bombardements atomiques de d’Hiroshima et Nagasaki, travailleurs de la filière nucléaire, « liquidateurs » de Tchernobyl, riverains de la rivière Techa et travailleurs du complexe nucléaire Mayak, dans l’Oural) permettent d’approcher au mieux ce qui se passe à faible ou relativement faible dose. Il s’agit d’études de cohortes, donc un protocole adapté, suivies sur de longues durées, dont les effectifs sont importants et qui disposent d’estimations individuelles sur les doses reçues et sur d’autres facteurs de risque pouvant influencer la survenue de cancers et de maladies cardiovasculaires.
Cancer
En dépit de circonstances d’exposition différentes (doses reçues instantanément lors de bombardements atomiques ou de manière prolongée chez les travailleurs du nucléaire, les riverains de la Techa ou pour les « liquidateurs » de Tchernobyl), l’excès de risque relatif estimé de décès par cancer solide pour une vie entière se situe dans les différentes cohortes autour de 50 % par Gy. Le risque est modulé par l’âge au moment de l’exposition : à dose égale, il est d’autant plus marqué que l’individu a été exposé jeune. L’allure de la relation dose-réponse pour ces cancers est également très similaire d’une cohorte à l’autre, y compris à très faible dose
30
L’UNSCEAR a établi une échelle des valeurs de doses reçues dans le contexte d’une exposition globale aiguë (c’est-à-dire une dose reçue par le corps entier lors d’une irradiation unique). Dans cette échelle, les « très faibles doses » sont comprises entre 0 et 20 mSV.
.
Pour la plupart des types de leucémie, le pic d’incidence et le pic de mortalité surviennent une dizaine d’années après l’exposition et diminuent par la suite, contrairement aux cancers solides en général. Comme pour ces derniers, l’excès de risque de leucémie est très largement dépendant de l’âge à l’exposition. Le modèle de relation dose-réponse linéaire-quadratique permet d’estimer que l’excès de risque relatif de survenue de leucémie chez un survivant d’Hiroshima et de Nagasaki de 70 ans exposé à l’âge de 30 ans est de 79 % par Gy. L’étude d’une cohorte internationale de travailleurs du nucléaire (INWORKS) conclut pour sa part à un risque de leucémie (hors leucémie lymphoïde chronique) multiplié par un facteur d’environ 4 pour une dose reçue à la moelle osseuse de 1 Gy en considérant un délai de latence minimal de deux ans entre exposition et expression du risque. Les expositions des personnes de cette cohorte étaient étalées dans le temps, contrairement à l’exposition instantanée à Hiroshima et Nagasaki.
Quels que soient les types de cancer radio-induits, les études épidémiologiques récentes suggèrent une relation dose-réponse sans seuil
31
Afin d’éviter tout risque de confusion pour le lecteur, précisons que dans le cas où des seuils de dose sont observés en épidémiologie, ces seuils ne sont pas forcément les mêmes en toxicologie (expérimentations animales, cellules...). Précisons également que ces seuils ne doivent pas être confondus avec les seuils de détectabilité.
. Si l’on retient cette hypothèse, toute dose, même minime, est porteuse d’excès de risque. Les recommandations de gestion du risque radiologique par la Commission Internationale de Protection Radiologique sont fondées sur ce principe. Le jeune âge à l’irradiation majore le risque de cancer.
Maladies cardiovasculaires
Dans les cohortes précitées, il existe une association entre les faibles doses et les faibles débits de doses de rayonnements ionisants et le risque de cardiopathie ischémique. Pour les autres atteintes cardiovasculaires (telles que l’accident vasculaire cérébral), l’association est moins certaine.
Les estimations d’excès de risque de décès suite à l’exposition aux rayonnements ionisants pour les maladies cardiovasculaires sont très voisines de celles obtenues pour les cancers. Les données disponibles à l’heure actuelle ne permettent pas de trancher quant à l’existence ou non d’un seuil pour la survenue des maladies cardiovasculaires.
Fraction de risque attribuable
La fraction de risque attribuable est une estimation du pourcentage de cas de pathologie évités en l’absence d’exposition. Par exemple, chez les survivants des bombardements atomiques d’Hiroshima et Nagasaki, le pourcentage de cas de cancers solides attribuable à l’exposition aux rayonnements ionisants pour l’ensemble des doses au-dessus de 0,005 Gy est de 10 % pour les deux sexes, plus marqué chez les femmes (13 %) que chez les hommes (6 %). Pour les leucémies, la fraction de décès attribuable décroît de 67 % (décennie initiale de suivi : 1950-1960) à 34 % (décennie 1991-2000).
Le risque de mortalité attribuable pour ce groupe de doses est estimé à 1 % pour les maladies cardiovasculaires dans leur ensemble, et à 1,5 % pour l’infarctus du myocarde.
Études épidémiologiques sur les conséquences sanitaires
des essais nucléaires sur les populations
Entre 1946 et 1980, les États-Unis, l’ex Union soviétique, le Royaume-Uni, la France et la Chine ont effectué 543 essais nucléaires atmosphériques totalisant une puissance équivalente à celle de 440 mégatonnes de TNT (Trinitrotoluène)
32
Selon les publications, le nombre d’essais rapportés ainsi que la puissance des tirs peuvent varier légèrement.
. Ces essais ont eu lieu quasiment exclusivement sur 16 sites, situés dans neuf pays sur tous les continents. Les sites du Nevada (États-Unis) et de Semipalatinsk (Kazakhstan) sont ceux où le plus grand nombre d’essais nucléaires ont été réalisés, bien qu’il ne s’agisse pas des plus puissants, lesquels ont été menés dans les îles Marshall (États-Unis) et en Nouvelle Zemble (ex Union soviétique). Selon les études, les doses d’irradiation reçues par les populations n’ont pas toujours été reconstituées. Lorsqu’elles l’ont été, la reconstitution a été faite avec plus ou moins de précision.
Essais nucléaires réalisés en Polynésie française
Études sur les populations
Plusieurs études épidémiologiques sur les conséquences sanitaires des essais nucléaires ont été menées en Polynésie française. Ces études se répartissent en deux catégories :
• les études descriptives sur la mortalité et l’incidence de différentes pathologies (cancer de la thyroïde et autres tumeurs malignes), qui ne prennent pas en compte l’exposition (au total cinq études) ;
• les études analytiques, telles les études cas-témoins ; il s’agit ici d’une seule étude portant sur différents facteurs de risque de survenue d’un cancer de la thyroïde.
L’étude descriptive sur la mortalité par cancer en Polynésie française n’a pas mis en évidence d’excès de mortalité globale dans la population polynésienne par rapport aux populations autochtones maories (Nouvelle-Zélande) et hawaïennes pour la période de 1984 à 1992. Elle a également analysé la mortalité par cancer de la thyroïde et a rapporté qu’elle était plus élevée chez les Polynésiens que chez les Maoris et les Hawaïens. Cependant, les résultats de cette étude sont peu concluants en raison des incertitudes sur les causes de mortalité et du petit nombre de décès observés. De manière générale, les études de mortalité sont peu informatives sur le cancer de la thyroïde car le taux de survie de ce type de cancer est élevé et les patients décèdent le plus souvent d’autres causes. Les études d’incidence permettent de lever cette limite.
Les études descriptives sur l’incidence des cancers en Polynésie française ont porté sur la période 1985-1995 et se sont principalement intéressées au cancer de la thyroïde et aux différentes formes de leucémies car ces types de cancers sont documentés comme particulièrement radio-inductibles. L’incidence globale de cancer était similaire à celle observée chez les Hawaïens, mais 25 % moins élevée que chez les Maoris. L’incidence du cancer de la thyroïde était plus élevée sur la période considérée (avec au total 153 cas) que dans les deux populations de référence (Maoris de Nouvelle-Zélande et Hawaïens). Cependant, les auteurs ont conclu que les taux d’incidence élevés du cancer de la thyroïde étaient difficilement attribuables à l’exposition à l’iode radioactif provoquée par les retombées des essais nucléaires et ne dépendaient pas de l’âge de la population au moment des essais nucléaires. Ces taux d’incidence du cancer de la thyroïde étaient 2,4 fois plus élevés pour les personnes nées avant 1950, qui n’avaient donc pas été exposées à d’éventuelles retombées radioactives pendant leur enfance ou leur adolescence, et 2,2 fois plus élevés pour le groupe de sujets nés après cette date et susceptibles d’avoir subi des retombées pendant leur jeune âge. Les observations les plus récentes sur la période 1998-2002 ont confirmé que l’incidence du cancer de la thyroïde en Polynésie française est l’une des plus élevées au monde. Le taux pour les femmes a été évalué à 37,4/100 000. L’étude sur les leucémies chez les enfants en Polynésie française entre 1990 et 1995 n’a pas mis en évidence d’incidence accrue de ces pathologies par rapport à celle observée chez les Maoris de Nouvelle-Zélande ou chez les Hawaïens. L’incidence de la leucémie aiguë non lymphocytaire était plus élevée entre 1985 et 1989 qu’entre 1990 et 1995. Toutefois, cette observation est basée sur un petit nombre de cas (13 seulement) sur l’ensemble de la période d’étude.
Les résultats de ces études descriptives reposant sur des comparaisons de l’incidence des cancers dans des populations issues de plusieurs pays ne permettent pas de conclure de façon certaine en raison des différences d’accès aux soins médicaux et de la variabilité de l’exhaustivité et de la qualité des Registres. Ils sont basés sur un petit nombre de cas et parfois un temps d’observation court. Le Pacifique est connu comme étant une zone où l’incidence du cancer de la thyroïde est particulièrement élevée. Cependant, des facteurs tels que la consommation alimentaire d’iode par les fruits de mer, une prédisposition génétique, l’excès de poids ou, plus récemment, la surveillance diagnostique accrue du cancer de la thyroïde peuvent expliquer les différences d’incidence observées. Les études descriptives n’incluent pas d’informations individuelles sur certains facteurs de risque présumés, y compris une possible exposition aux rayonnements ionisants, et ne peuvent donc pas permettre d’établir la (ou les) raison(s) de l’augmentation de l’incidence du cancer de la thyroïde en Polynésie française.
Par conséquent, des études analytiques tenant compte d’informations plus ou moins individualisées sur l’exposition aux rayonnements et sur d’autres facteurs susceptibles de contribuer à l’augmentation de l’incidence du cancer de la thyroïde peuvent aider à mieux comprendre l’étiologie du phénomène.
Une seule étude cas-témoins a été menée pour évaluer l’impact potentiel des retombées des essais nucléaires atmosphériques ainsi que d’autres facteurs de risque sur l’incidence élevée du cancer de la thyroïde en Polynésie française. Elle a inclus 229 cas atteints d’un cancer de la thyroïde, diagnostiqués entre 1981 et 2003, c’est-à-dire la plupart des cas diagnostiqués durant cette période et vivants au moment de la réalisation de l’étude, et 373 témoins sélectionnés dans le Registre polynésien de naissance et appariés selon l’âge et le sexe. L’étude a procédé à une reconstruction des doses individuelles liées à l’exposition. La dose moyenne à la thyroïde avant l’âge de 15 ans était d’environ 1,8 mGy, dose qui peut être considérée comme très faible. Malgré ce faible niveau de dose, il a été observé un risque croissant de cancer de la thyroïde avec l’augmentation de la dose thyroïdienne reçue avant l’âge de 15 ans. Cette tendance persistait lorsque les microcarcinomes (principalement associés à une surveillance diagnostique intense) étaient exclus. Comme l’incidence du cancer de la thyroïde est beaucoup plus élevée chez les femmes, il est vraisemblable que les facteurs hormonaux et associés à la grossesse jouent un rôle dans le risque de survenue. L’augmentation du risque par unité de dose de rayonnement thyroïdien s’est avérée plus élevée chez les femmes qui ont eu par la suite plus de quatre grossesses que chez les autres. L’étude présentait certaines limites : les doses reconstituées, plutôt faibles (la dose moyenne sur la vie était de 2,6 mGy), étaient associées à des incertitudes élevées basées sur un nombre limité de mesures disponibles de la contamination environnementale
33
En février 2020, Drozdovitch et coll. ont publié une étude portant sur le dépôt au sol des radionucléides en Polynésie française, à partir de données de rapports déclassifiés en 2013 (Drozdovitch V, de Vathaire F, Bouville A. Ground deposition of radionuclides in French Polynesia resulting from atmospheric nuclear weapons tests at Mururoa and Fangataufa atolls. J Environ Radioact 2020 ; 214-215 : 106176). Dans cette étude, Drozdovitch et coll. font référence à leur publication portant sur de nouvelles estimations des doses à la thyroïde dans la population de Polynésie française (Drozdovitch V, Bouville A, Taquet M, et al. Thyroid doses to french polynesians resulting from atmospheric nuclear weapons tests : estimates based on radiation measurements and population lifestyle data. Health Phys 2020, sous presse).
, impactant la puissance de l’étude.
Parmi les autres facteurs de risque étudiés, le régime alimentaire traditionnel polynésien et la consommation de cassava (aliment goitrogène) et d’aliments provenant de la mer contenant l’iode nécessaire à la production d’hormones thyroïdiennes avaient un effet protecteur sur le risque de cancer de la thyroïde. Le surpoids, en particulier son apparition précoce, une taille élevée, la ménopause naturelle ou artificielle et les antécédents familiaux de cancer de la thyroïde augmentaient le risque de cancer de la thyroïde. La susceptibilité génétique dans la population de Polynésie française a également été étudiée en évaluant la contribution de différentes variations génétiques. Bien qu’un lien clair n’ait pu être établi entre l’incidence élevée et les polymorphismes génétiques
34
Variation entre individus dans la séquence de gènes.
impliqués dans la sensibilité au cancer de la thyroïde différencié
35
Les cancers de la thyroïde différenciés sont constitués par deux types principaux : le carcinome papillaire et le carcinome folliculaire (moins fréquent).
dans d’autres populations, certains polymorphismes semblaient indiquer des profils différents de ceux des populations européennes étudiées.
L’étude comporte les limites méthodologiques des études cas-témoins, en particulier le biais de rappel qui affecte la précision de l’évaluation de l’exposition aux radiations ionisantes.
Différentes conclusions peuvent être tirées :
• des données d’incidence du cancer plus récentes et plus complètes sont nécessaires pour déterminer si les taux d’incidence du cancer de la thyroïde observés en Polynésie française demeurent élevés ;
• l’incidence du cancer thyroïdien en Polynésie est parmi les plus élevées dans le monde. Aussi, il est nécessaire de mieux comprendre l’impact de l’ensemble des facteurs de risque du cancer de la thyroïde, en particulier ceux non évalués jusqu’à présent (impact du dépistage, conditions de surveillance diagnostique...) ;
• davantage d’informations sur les mesures de la radioactivité environnementale effectuées après les essais nucléaires sont nécessaires pour réduire les incertitudes sur les doses estimées ;
• des doses de radioactivité à la thyroïde plus précises pourraient mieux décrire l’association entre la dose et le risque potentiel de cancer de la thyroïde en Polynésie française mais les doses a priori sont très faibles et une telle association est donc très difficile à mettre en évidence, surtout en présence d’une surveillance diagnostique intensive.
Études sur le personnel militaire français
Une étude de mortalité (approche moins sensible qu’une analyse s’appuyant sur les cas de maladie n’entraînant pas forcément de décès) a été réalisée sur une cohorte de 32 550 vétérans présents sur les sites d’expérimentations nucléaires de la France dans le Pacifique (CEP) entre 1966 et 1996 et ayant bénéficié d’une surveillance dosimétrique externe. Cependant, les doses individuelles n’ont pas été reconstituées. La mortalité totale et la mortalité par cause ont été comparées à la mortalité de la population française à l’aide de ratios standardisés de mortalité. Parmi les vétérans disposant d’un enregistrement de surveillance par dosimètre externe, la présence sur les sites du CEP ne constituait pas un facteur d’augmentation de la mortalité par rapport à la population nationale. Cependant, un risque accru de mortalité par hémopathies malignes a été mis en évidence chez les vétérans qui présentaient une dosimétrie non nulle, mais l’absence d’étude de relation dose-effet, due à l’indisponibilité des dosimétries individuelles, limite la portée de cette conclusion.
Une étude de l’incidence des affections de longue durée (ALD) parmi les membres de la cohorte de vétérans a fait suite à cette étude de mortalité. La population concernée était composée de 18 717 vétérans toujours vivants en 2003. Les cancers ont été les premières causes d’ALD, avec 30 % des pathologies prises en charge ; le taux d’incidence d’ALD tous cancers confondus est le même que celui de la population générale. La comparaison des taux d’incidence des ALD effectuée entre les vétérans avec dosimétrie inférieure au seuil de détection et ceux avec dosimétrie supérieure au seuil de détection ne montre pas d’excès sauf pour la sclérose en plaques (présentant un nombre de cas réduit : 8 cas) et le cancer du péritoine et du rétro-péritoine, deux pathologies pour lesquelles le nombre de cas est très réduit. Cette étude n’a inclus que les vétérans toujours vivants au 1er janvier 2003 et ne s’intéressait qu’à une période de suivi limitée (2003-2008) et à distance de l’exposition. En raison de ces limitations, il est possible qu’une éventuelle augmentation de certains types de leucémie ayant une courte période de latence n’ait pas pu être détectée dans cette étude. La taille de la cohorte n’était pas suffisante pour conférer à l’étude une puissance statistique satisfaisante pour détecter de faibles excès de risque. Enfin, l’absence de disponibilité des dosimétries individuelles ne permet qu’une comparaison très brute entre les vétérans qui ont eu au moins une dosimétrie supérieure au seuil de détection et les autres, ce qui est insuffisant dans ce type d’étude.
Essais nucléaires réalisés sur d’autres territoires du Pacifique
Îles Marshall
Entre 1946 et 1958, le territoire des îles Marshall a constitué un des sites d’essais nucléaires menés par les États-Unis. Le 1er mars 1954, l’exposition la plus significative résultait de l’essai nucléaire de la bombe à hydrogène Castle Bravo sur l’atoll de Bikini.
Au cours des premières années, de nombreux programmes de surveillance sanitaire ont été menés, mais seulement 2 études épidémiologiques reposent sur la population exposée lors de l’essai nucléaire Castle Bravo :
• l’étude de cohorte rétrospective de maladie thyroïdienne bénigne menée en 1983-1985 ;
• l’étude transversale de la prévalence de maladie thyroïdienne bénigne et de cancer de la thyroïde entre 1993 et 1997, ciblant une population similaire à celle de la première étude.
La première étude était basée sur 7 266 sujets examinés dont 2 273 avaient été exposés. La distance de l’atoll de Bikini a été utilisée comme indicateur indirect de la dose d’iode radioactif et était inversement associée à un risque accru de nodules thyroïdiens. La deuxième étude visait à déterminer la prévalence du cancer de la thyroïde chez les Marshalliens qui vivaient dans les îles pendant la période des essais nucléaires. Parmi les Marshalliens examinés pour maladie de la thyroïde en 1993-1997, 5 821 étaient éligibles pour inclusion dans l’étude. La prévalence du cancer de la thyroïde était élevée : un homme et deux femmes sur 100 résidents ont fait l’objet d’un diagnostic de cancer de la thyroïde. Les limites de cette étude étaient l’incertitude de la dose à la thyroïde et l’auto-sélection des participants à l’étude (seules les personnes les plus exposées ont accepté de participer à l’étude).
Le National Cancer Institute des États-Unis a estimé que les résidents permanents des atolls du nord avaient reçu des doses externes allant de quelques centaines à plus de 1 000 mGy. Les doses annuelles ont été utilisées pour établir des estimations de risque de cancer pour les résidents permanents ainsi que pour les groupes de population marshalliens qui ont été relogés. Il ne s’agit pas d’une étude épidémiologique d’observation mais d’une estimation (ou de la prévision) du risque de cancer (de la fraction de risque attribuable) sur la base des connaissances disponibles. Par type de cancer, les estimations ponctuelles du risque attribuable variaient selon les zones géographiques, de 12 % à 95 % pour le cancer de la thyroïde, de 2 % à 78 % pour les leucémies et de 1 % à 55 % pour l’ensemble des cancers.
Kiribati
Les îles Christmas et Malden ont été des sites d’essais nucléaires des États-Unis et du Royaume-Uni. Six essais nucléaires ont été réalisés par le Royaume-Uni entre 1957 et 1958 et 24 par les États-Unis en 1962 sur l’île Christmas. Trois essais nucléaires britanniques ont eu lieu près de Malden Island. Selon une évaluation de l’UNSCEAR, les retombées locales auraient été minimes à la suite de ces essais nucléaires. La quantité d’informations disponibles pour ces sites est insuffisante pour fournir une évaluation détaillée des expositions aux rayonnements ou de leurs effets sanitaires sur la population locale.
Monte Bello, Emu et Maralinga (Australie)
Le Royaume-Uni a effectué 12 essais nucléaires entre 1952 et 1957 sur trois sites australiens : les îles Monte Bello, Emu et Maralinga. Ces essais ont abouti à une contamination résiduelle autour des sites d’Emu et Maralinga. Les estimations des expositions externes locales n’ont pas été réalisées pour les premiers essais ; pour les essais de 1956 et 1957, les doses efficaces externes étaient inférieures à 1 mSv. Des estimations des expositions internes ont également été effectuées pour l’ensemble de la population australienne. La dose efficace moyenne était de 70 mSv, dont 83 % étaient dus à des expositions internes. Aucune étude sur les conséquences sur la santé de la population locale n’a été réalisée.
Études sur le personnel militaire d’autres pays exposés dans le Pacifique
Une étude épidémiologique a été mise en place dans les années 1980 sur plus de 20 000 participants britanniques au programme d’essais nucléaires atmosphériques. Cette large cohorte a été établie avec un groupe témoin (non exposé) étroitement apparié. Trois analyses de la mortalité et de l’incidence du cancer ont couvert la période de suivi jusqu’à la fin de 1998. L’un des résultats constants des trois analyses est l’effet dit « effet soldat en bonne santé », selon lequel la mortalité par cause générale est plus faible que dans la population générale, mais semblable à celle observée chez les témoins militaires appariés. Quand l’incidence est considérée, et en distinguant les types de cancers, les études font ressortir un risque plus élevé de leucémies autres que la leucémie lymphoïde chronique chez le personnel exposé.
Une étude portant sur le personnel de la marine royale de Nouvelle-Zélande, 528 hommes ayant participé aux essais nucléaires en 1957 et 1958 aux îles Malden et Christmas (Kiribati) appariés à un groupe témoin composé de 1 504 hommes, a conclu que les marins qui ont participé aux essais nucléaires avaient un risque plus élevé de leucémie et d’autres cancers hématologiques par rapport à ceux qui n’avaient pas participé. Compte tenu du faible effectif observé et de la perte d’environ 10 % d’hommes du suivi, ces conclusions sont incertaines.
Une étude de cohorte rétrospective comprenant 10 983 participants a été réalisée pour analyser la mortalité et l’incidence du cancer des participants australiens à des essais nucléaires menés par le Royaume-Uni en Australie et pour identifier toute association avec l’exposition à des rayonnements ionisants. La dose moyenne cumulée estimée par un groupe de radiophysiciens était de 2,8 mSv. Le taux de mortalité par cancer était de 18 % supérieur au taux de la population générale et le taux d’incidence du cancer était de 23 % supérieur. Il n’y avait pas de tendance à l’augmentation de l’incidence des cancers avec la dose reçue. Toutefois, les niveaux d’exposition attribués aux participants étaient soumis à une grande incertitude qui peut réduire la capacité de l’étude à détecter les effets des rayonnements ionisants.
Plusieurs études ont tenté d’évaluer les risques de mortalité chez le personnel militaire américain ayant participé à des essais nucléaires dans le Pacifique. Une étude des 8 554 anciens combattants de la Marine ayant participé à l’opération « Hardtack » au Centre d’Essais du Pacifique en 1958 a été menée pour déterminer s’ils présentaient un risque de mortalité pour certains cancers plus élevé par rapport à la mortalité de 14 625 anciens combattants de la Marine qui n’ont pas participé aux essais nucléaires. Parmi les 1 094 hommes ayant reçu des doses supérieures à 10 mSv, il a été constaté un excès de risque de mortalité de 42 % pour tous les types de cancer (bien que basé sur un petit nombre de décès). Une autre étude de mortalité par cancer a porté sur les 1 010 anciens combattants américains ayant reçu les doses de rayonnement gamma les plus élevées (≥ 50 mSv) lorsqu’ils participaient à l’opération « Hardtack ». Elle montre que la mortalité toutes causes confondues et la mortalité liée à tous les cancers lymphopoïétiques étaient significativement plus élevées chez les participants les plus exposés par comparaison aux témoins. L’étude portant sur 40 000 participants à l’essai nucléaire Crossroads à l’atoll de Bikini en 1946 a révélé une mortalité légèrement supérieure (de 5 %, p < 0,001) chez les participants par comparaison aux non-participants. De faibles augmentations statistiquement non significatives ont été observées concernant la mortalité des participants pour toutes les tumeurs malignes (1,4 %) et la leucémie (2 %).
La plupart des études sur le personnel militaire partagent le même inconvénient : les données de dosimétrie individuelle sont indisponibles ou de qualité insuffisante pour permettre une évaluation des relations dose-réponse. Nombre de ces études souffrent d’un effectif trop restreint pour détecter les effets de faibles doses. Elles analysent principalement la mortalité ; le caractère incomplet et imprécis des causes de décès ajoute aux faiblesses de ces études et les résultats sont difficiles à interpréter. Néanmoins, une tendance commune à l’augmentation de la mortalité par leucémies et de l’incidence de ces pathologies et d’autres hémopathies malignes a été rapportée.
Essais nucléaires réalisés au Nevada et à Semipalatinsk
Les essais nucléaires atmosphériques réalisés par les États-Unis sur les sites du Nevada, et plus encore ceux réalisés par l’ex Union soviétique sur le site de Semipalatinsk (Kazakhstan), ont exposé certaines populations à des retombées radioactives significatives.
Il peut être considéré comme établi que les essais nucléaires atmosphériques réalisés sur ces deux sites ont augmenté l’incidence des cancers et des nodules de la thyroïde et des leucémies dans les populations des villages contaminés par leurs retombées radioactives. Concernant les essais nucléaires réalisés à Semipalatinsk, il a été estimé que le risque de nodule thyroïdien augmentait significativement avec la dose à la thyroïde ; une étude plus récente (2015) prenant en compte les résultats d’une nouvelle dosimétrie et la nature des incertitudes (partagées ou individuelles) a conduit à réévaluer à la hausse le coefficient de risque pour les nodules thyroïdiens. Les coefficients étaient plus importants pour les cancers que pour les nodules, mais la relation dose-effet n’était pas significative, du fait du faible nombre de cancers thyroïdiens (n = 24).
Pour les autres cancers, il est plus difficile de conclure en ce qui concerne les essais du Nevada car, d’une part, les deux seules études réalisées (en 1984 et 1987) ont conduit à des résultats contradictoires et, d’autre part, les faibles niveaux de doses reçues par les populations des comtés contaminés empêchent de se prononcer de manière catégorique. Des études de cohorte ont rapporté que les retombées des essais de Semipalatinsk ont induit d’autres cancers, en particulier du poumon, de l’estomac et de l’œsophage, mais aussi, vraisemblablement, du sein.
Il n’a pas été réalisé d’études sur d’autres pathologies chroniques que le cancer dans les populations des villages contaminés par les essais nucléaires du Nevada. Ceci s’explique probablement par le fait que les scientifiques ont jugé que les faibles niveaux de doses reçues aux organes autres que la thyroïde ne justifiaient pas la réalisation d’études lourdes et complexes. Il faut cependant noter que la dernière étude épidémiologique portant sur les cancers (autres que celui de la thyroïde) date de 1987, époque où l’étude des effets non cancéreux des radiations ionisantes ne faisait que commencer.
Malgré l’absence de relation dose-effet dans les analyses limitées à certains villages contaminés par les retombées des essais nucléaires du Kazakhstan, il est très probable que l’excès de pathologies cardiaques observées dans les populations de ces villages, par rapport aux villages non contaminés, soit dû à ces retombées ; le risque d’hypertension artérielle essentielle était également fortement augmenté dans ces villages.
Les résultats des études sur les militaires ayant participé aux essais du Nevada sont difficiles à interpréter. Ceux concernant les militaires n’ayant pas participé au test Smoky, le plus contaminant, sont cohérents étant donné les doses reçues de l’ordre de quelques mGy, et conduisent à conclure à une absence d’excès de décès par cancer ou autres pathologies induits par ces essais. Pour les militaires qui ont participé au test Smoky, il est plus difficile de conclure. En effet, d’un côté, l’excès de mortalité par cancer et leucémie observé par rapport à la population générale peut difficilement être attribué à une autre cause que la participation à ces essais. Mais d’autre part, il est étonnant qu’aucune relation dose-effet n’ait été mise en évidence, alors que leur reconstruction dosimétrique, basée sur le port de dosimètres, est de fait plus précise que celles réalisées pour la population générale.
À ce jour, aucune étude n’a été réalisée sur les personnels militaires ayant travaillé sur le site de Semipalatinsk
36
Il n’existe aucune information sur les doses reçues par les soldats de l’armée soviétique, car les archives ont été récupérées par l’armée russe après la fermeture du site d’essai par le Kazakhstan.
, et il est probable qu’avec le temps écoulé depuis la fin des essais atmosphériques sur ce site, une telle étude soit désormais très difficile à réaliser.
Éléments de comparaison entre les différents sites d’essais nucléaires
Soixante-sept essais nucléaires américains ont été réalisés sur les îles Marshall (situées au cœur de l’océan Pacifique) sur la période 1946-1958 ; pour 20 d’entre eux, des populations civiles ont été exposées. Dans une étude récente, les doses ont été estimées pour 26 groupes d’individus habitant sur 23 atolls et îles. Les estimations de doses annuelles entre 1948 et 1970 ont été calculées pour des personnes représentatives de chaque groupe, c’est-à-dire des personnes ayant des habitudes de vie, une alimentation et des caractéristiques anthropomorphiques considérées comme représentatives de leur âge (1 an, 1-2 ans, 3-7 ans, 8-12 ans, 13-17 ans et adultes) et genre. Les doses ont été estimées pour 3 voies d’exposition :
• l’exposition externe due au dépôt au sol ;
• la contamination interne issue des retombées immédiates (63 radionucléides considérés) ;
• la contamination interne chronique issue de la présence des radionucléides à vie longue (55Fe, 60Co, 65Zn, 90Sr et 137Cs).
Les doses totales absorbées par les différents organes sur l’ensemble de la période 1948-1970 varient en fonction de l’année de naissance. Les personnes adultes au moment des essais nucléaires ont reçu des doses beaucoup plus faibles que les jeunes enfants. Les doses à la thyroïde varient de 33 mGy pour les adultes de Majuro à 23 000 mGy pour les enfants de Rongelap. Ainsi, les doses estimées pour la population des îles Marshall apparaissent jusqu’à plus de 100 fois supérieures aux doses estimées pour la population polynésienne.
S’agissant des essais nucléaires atmosphériques réalisés par les États-Unis sur les sites du Nevada et ceux réalisés par l’ex Union soviétique sur le site de Semipalatinsk, il est considéré de manière générale que les doses reçues par les populations contaminées à proximité du site du Nevada, soit de quelques dizaines à quelques centaines de mGy à la thyroïde, et de quelques mSv à quelques dizaines de mSv au reste du corps, sont au moins 10 fois inférieures à celles reçues par leurs homologues au Kazakhstan.
Les études menées pour évaluer l’effet potentiel de l’exposition aux retombées radioactives dans diverses populations ont utilisé différentes approches et ont recherché différents effets potentiels sur la santé, bien que la plupart de ces études ont porté un intérêt particulier aux maladies thyroïdiennes malignes et bénignes chez les personnes exposées durant l’enfance. En raison des doses plus élevées reçues par la thyroïde dans les populations exposées autour du site de Semipalatinsk et aux îles Marshall, les études menées dans ces zones étaient plus susceptibles d’établir une relation dose-réponse. Toutefois, l’étude transversale menée aux îles Marshall a utilisé des évaluations de doses très incertaines, ce qui réduit la crédibilité des résultats. Les estimations de doses plus précises développées pour les îles Marshall ont été utilisées uniquement pour la prévision des risques de cancer de la thyroïde (lesquels étaient assez élevés) qui n’ont jamais été confirmés dans une étude observationnelle. L’étude à Semipalatinsk a montré une relation très claire entre la survenue de nodules thyroïdiens et la dose thyroïdienne, mais était de taille trop faible pour étudier les cancers, plus rares que les nodules thyroïdiens. En Polynésie française, l’impact de faibles doses sur le risque de cancer de la thyroïde est très difficile à mettre en évidence, malgré une étude plus précise que celles effectuées dans les autres pays, qui permettait de contrôler les autres facteurs de risque potentiels, tels que l’alimentation, la taille, le surpoids, des facteurs hormonaux, une activité diagnostique accrue et des polymorphismes génétiques. Il est important de noter que d’une manière générale, les estimations rétrospectives qui ont été réalisées montrent que les doses reçues par les populations polynésiennes exposées aux retombées de l’ensemble des 41 essais nucléaires atmosphériques réalisés par la France
37
À ces essais s’ajoutent les 5 essais de sécurité réalisés dans l’atmosphère (Ministère de la Défense, 2006) ; ce type d’essais est destiné à vérifier que la bombe ne s’amorce pas d’elle-même pendant le transport ou le stockage.
sont de l’ordre du mSv et de l’ordre de quelques mGy à quelques dizaines de mGy pour la dose à la thyroïde, soit environ 10 fois inférieures à celles reçues par les populations exposées aux retombées des essais nucléaires réalisés dans le Nevada par les États-Unis et d’environ 100 fois inférieures à celles reçues par les populations exposées aux retombées des essais nucléaires réalisées par l’ex Union soviétique dans le Kazakhstan.
Perspectives : Études épidémiologiques
En dépit de l’utilité d’études épidémiologiques permettant de répondre à des questions sanitaires précises, en complément de la collecte de données par les systèmes de surveillance, il apparaît qu’en Polynésie française, d’après les données disponibles, les doses reçues estimées sont trop faibles
38
En Polynésie française, les doses sont de l’ordre du mSv et de l’ordre de quelques mGy à quelques dizaines de mGy pour la dose à la thyroïde. Ces doses sont faibles par comparaison aux îles Marshall ou à Semipalatinsk, mais elles sont également incertaines au niveau individuel ou partagé (pour un groupe de personnes présentant des caractéristiques d’exposition similaires), ce qui, dans les études épidémiologiques pourrait masquer la véritable association entre la dose et l’effet, surtout lorsque l’effet est faible.
et la taille de la population exposée est trop restreinte pour permettre d’établir avec certitude, par une étude de cohorte, une éventuelle association entre l’incidence des pathologies et l’exposition aux rayonnements ionisants des populations polynésiennes. Il se pose par ailleurs le problème de l’incertitude des doses reçues et du délai depuis l’exposition.
Par ailleurs, au vu de la littérature scientifique, il est possible que l’augmentation de la durée de suivi de populations exposées aux rayonnements ionisants, comme les survivants des bombardements atomiques d’Hiroshima et Nagasaki
39
La cohorte Life Span Study (ou LSS) suit l’état de santé de 86 600 survivants des bombardements atomiques d’Hiroshima et Nagasaki.
, aboutisse dans l’avenir à caractériser comme pathologies pouvant être radio-induites certains types de cancers ou d’autres pathologies, telles que des maladies cardiovasculaires, en particulier aux faibles doses de radiations ionisantes. Aussi, une veille attentive de la littérature scientifique sur cette problématique apparaît indispensable (voir
supra les perspectives relatives à la surveillance de la santé en Polynésie française), en particulier compte tenu du dispositif d’indemnisation (loi Morin) qui repose sur une liste de pathologies indemnisables fixée par décret et qui comporte désormais 23 maladies.
V. Effets biologiques et sanitaires d’une exposition
aux rayonnements ionisants sur la reproduction,
le développement et la descendance
Effets des rayonnements ionisants sur la reproduction,
le développement, et effets transgénérationnels
Bien que les dommages causés par les radiations ionisantes au niveau des cellules germinales n’affectent pas nécessairement l’individu cliniquement, ils peuvent avoir des conséquences sur sa fonction de reproduction ou sur les générations suivantes. Les conséquences sur ces dernières comprennent des désordres génétiques de différents types et de sévérité variable. Chez l’animal, les conséquences identifiées des radiations sur la reproduction incluent essentiellement les avortements spontanés, la mortinatalité, un changement du rapport mâle/femelle de la progéniture et des malformations congénitales. Les données chez l’Homme dans le domaine de la transmission de maladies et d’anomalies génétiques suite à une exposition aux radiations ionisantes sont rares. De façon générale, les doses de rayonnements ionisants reçues dans les études chez l’Homme sont plus faibles que celles utilisées dans les études expérimentales chez l’animal ; de même, le type de radiations, le mode d’exposition ainsi que le temps séparant la conception de l’exposition diffèrent entre les études chez l’Homme et les études chez l’animal.
Irradiation des cellules germinales et effets sur la reproduction
chez l’animal et l’Homme
Il a été montré par plusieurs études que les radiations ionisantes peuvent induire des dommages à l’ADN des cellules germinales. La sensibilité des cellules germinales aux radiations ionisantes dépend non seulement de la dose reçue mais également du stade de maturation. Chez l’animal, il a été montré que l’exposition des cellules germinales entraîne des aberrations chromosomiques. Chez l’animal et l’Homme, les études ont mis en évidence que l’exposition des gonades entraîne une baisse de la fertilité.
Les données les plus complètes sur les effets des radiations sur la reproduction sont issues des études expérimentales chez l’animal. Les mécanismes responsables de l’effet des radiations sur les cellules germinales comprennent les mutations de gènes, les aberrations du nombre de chromosomes (telles que le gain de chromosomes) et les aberrations chromosomiques structurelles.
Chez l’Homme, les études épidémiologiques sur les survivants des bombardements d’Hiroshima et Nagasaki, de l’accident de Tchernobyl ou sur des travailleurs du secteur nucléaire n’ont pas montré d’effets néfastes (en termes de mortinaissance, malformations, poids, changement du rapport mâle/femelle de la progéniture, mortalité, malformations congénitales et aberrations chromosomiques). Toutefois, différentes études ont rapporté un impact de la radiothérapie sur la fertilité ultérieure (baisse de la fertilité voire infertilité) chez les jeunes femmes.
Irradiation de l’embryon ou du fœtus chez l’animal et effets
sur le développement
Les radiations sur l’embryon ou le fœtus peuvent conduire à une absence d’effets détectables jusqu’au décès prénatal, au décès néonatal, au retard de croissance, aux malformations congénitales et aux néoplasies postnatales.
Concernant les effets des radiations sur le développement de l’embryon et du fœtus chez l’animal
40
Concernant les effets chez l’Homme, voir la partie « Études épidémiologiques sur les effets d’une exposition préconceptionnelle ou in utero aux radiations ionisantes ».
, il convient de les décrire selon les différentes phases du développement gestationnel car les conséquences de l’irradiation y sont liées.
Pendant la phase pré-implantatoire, les études chez l’animal ont généralement montré que les effets d’une exposition aux radiations ionisantes peuvent aller de la survie sans anomalie à la disparition de l’embryon. L’embryon unicellulaire (premier jour de la gestation) est plus sensible qu’aux stades ultérieurs à la mortalité radio-induite, principalement les premières heures suivant la fécondation. La sensibilité de l’embryon aux radiations ionisantes diminue fortement aux stades pluricellulaires étant donné que la perte d’une cellule non encore différenciée peut être compensée. En revanche, une trop grande mortalité cellulaire interdit tout développement embryonnaire. Cependant, certaines données expérimentales chez la souris remettent en cause la loi du « tout ou rien » et n’excluent pas un éventuel effet permanent durant la période pré-implantatoire, et plus particulièrement au stade unicellulaire. Il n’est donc pas impossible qu’un risque semblable existe chez l’Homme sans que l’on puisse le quantifier. Les mécanismes moléculaires impliqués dans les effets des radiations sur l’embryon au stade pré-implantatoire, ne sont pas totalement connus. Toutefois, les études sur certaines lignées de souris suggèrent l’induction d’une instabilité génomique telle que les cassures chromatidiques.
Pendant la phase de l’organogenèse, le risque principal est celui de malformations congénitales. À chaque espèce correspond une période de susceptibilité pour le développement d’une malformation particulière et celle-ci coïncide avec le moment de la différenciation et l’organisation de la structure concernée. L’augmentation de la dose de rayonnements ionisants entraîne l’allongement de la période de susceptibilité et l’augmentation de la survenue de malformations. Il est généralement admis que l’un des mécanismes responsables de l’apparition des malformations est la mort cellulaire qui conduit à l’arrêt du développement de la structure concernée à un stade précoce. L’apparition de malformations est un phénomène lié à la perte d’un certain nombre de cellules endommagées non remplaçables dans la structure en développement et donc à la dose reçue. En plus des malformations congénitales, l’irradiation de l’embryon au stade de l’organogénèse précoce induit un retard de croissance intra-utérin qui se manifeste par un faible poids à la naissance. Ce phénomène résulte d’une mort cellulaire non compensée. Les études expérimentales ont montré que ce phénomène était réversible et que les animaux de petits poids à la naissance pouvaient atteindre un poids normal à l’âge adulte.
Pendant la phase du développement fœtal, les conséquences d’une irradiation sont moins probantes que celles induites pendant la période de l’organogénèse ; néanmoins, elles sont bien présentes et concernent principalement chez la souris un retard de croissance et des altérations fonctionnelles du système nerveux central. Dans le modèle murin, les effets de l’irradiation se manifestent par une microcéphalie, une diminution des facultés d’apprentissage et de mémorisation, ainsi qu’une altération du comportement social. Les mécanismes moléculaires sous-jacents reposeraient sur l’activation de certains gènes dépendants de p53, récemment identifiés et impliqués dans l’activation d’un programme de différenciation neuronale. Le retard de croissance, quant à lui, peut être généralisé ou local, en lien avec une altération du développement des tissus qui est très actif à ce stade. Contrairement à la période de l’organogénèse où le retard de croissance est réversible, il peut être permanent après une exposition pendant la phase du développement fœtal.
Effets transgénérationnels
Les effets délétères des radiations sur la cellule directement exposée sont bien établis. Aujourd’hui un bon nombre d’études in vitro et in vivo ont démontré que les effets néfastes et à long terme des radiations ne se limitent pas seulement à la cellule directement exposée mais s’étendraient aux futures cellules filles non exposées. En effet, l’exposition aux radiations peut induire une instabilité génétique dans les cellules somatiques mères qui se retrouverait dans les cellules filles même après plusieurs divisions. De même, une instabilité génétique peut être créée dans les cellules germinales directement exposées. Des effets liés à ces anomalies génétiques peuvent se manifester dans la descendance (F1) issue de ces cellules germinales ; il s’agit alors d’effets intergénérationnels. Si ces effets persistent à la génération suivante (F2) et sont donc à nouveau transmis par la lignée germinale qui n’a pas été elle-même exposée, on parle alors d’effets transgénérationnels.
Les effets transgénérationnels des radiations peuvent être expliqués par des mécanismes de nature génétique ou épigénétique. Les altérations génétiques incluent les aberrations chromosomiques (fragments, cassures, translocations), la formation de micronoyaux, une augmentation des mutations minisatellites/ESTR
41
ESTR : Expanded Simple Tandem Repeat.
(séquences répétées) et une modification du profil d’expression de gènes. Toutes ces modifications sont des caractéristiques de l’instabilité génomique. Les modifications épigénétiques, quant à elles, induisent des changements d’expression des gènes (transcription, traduction et post-traduction) qui n’impliquent pas de modifications de la séquence d’ADN génomique. Ces processus épigénétiques jouent un rôle important, mais pas encore bien compris, dans le développement du cancer induit par les radiations. Les modifications épigénétiques observées principalement dans la descendance des parents irradiés (humains ou souris), incluent la méthylation de l’ADN, la modification du profil des micro-ARN (miARN), des ADN méthylases et histone acétylases, et la condensation de la chromatine.
Les conséquences transgénérationnelles des radiations ont été bien démontrées chez la souris, en particulier sur la base d’altérations génétiques.
Un rapport diffusé sur internet en 2018 fait état d’un nombre de cas particulièrement élevé de troubles envahissants du développement (TED) associés à des anomalies morphologiques et/ou des retards mentaux chez les petits-enfants d’anciens travailleurs civils ou militaires du CEP ou des habitants des atolls concernés par les essais nucléaires en Polynésie française
42
Sueur C. Les Conséquences génétiques des essais nucléaires français dans le Pacifique, chez les petits-enfants des vétérans du Centre d’Expérimentation du Pacifique et des habitants des Tuamotu Gambier. Rapport, janvier 2018 : 115 p.
. Dans ce rapport, l’auteur tend à relier de façon causale les cas cliniques des enfants souffrant de TED à l’exposition aux radiations de leurs grands-parents. Ce rapport a fait l’objet d’une analyse critique par l’Inserm qui pointe des biais méthodologiques et d’interprétation
43
Inserm. Analyse scientifique du rapport : « Les conséquences génétiques des essais nucléaires français dans le Pacifique, chez les petits-enfants des Vétérans du Centre d’Expérimentation du Pacifique et des habitants des Tuamotu Gambier ». Décembre 2018.
. Aujourd’hui, la littérature scientifique internationale ne mentionne aucune preuve d’effets transgénérationnels pour des doses inférieures au Sv, ce qui réduit drastiquement la probabilité de transmission pour des doses de l’ordre du mSv, comme c’est le cas pour les retombées des essais nucléaires en Polynésie française.
Études épidémiologiques sur les effets d’une exposition préconceptionnelle ou in utero dans différents contextes d’exposition aux rayonnements ionisants
Des études épidémiologiques ont porté sur le lien entre une irradiation préconceptionnelle ou au cours de la vie embryo-fœtale et la survenue potentielle de pathologies durant l’enfance ou la vie adulte. Diverses pathologies (cancers, leucémies, maladies non cancéreuses) et malformations congénitales ont fait l’objet d’études dans différents contextes d’exposition aux radiations ionisantes (bombe atomique, accident nucléaire, irradiation d’origine médicale...). Dans ces études, les doses de rayonnements ionisants reçues par les personnes ne sont pas toujours connues.
Effets d’une exposition préconceptionnelle
Un grand nombre d’études ont porté sur le risque de malformations congénitales et de cancers à la suite d’une exposition préconceptionnelle. Ces études ont principalement été menées sur les descendants de survivants des bombardements d’Hiroshima et Nagasaki, de travailleurs de l’industrie nucléaire, et de survivants d’un cancer traités par radiothérapie. Bien que portant sur des milliers de cancers et de malformations congénitales observés après irradiation, ces études n’ont pas mis en évidence de corrélation entre l’irradiation préconceptionnelle et le risque de survenue de ces pathologies et malformations chez les descendants d’individus exposés. Étant donné le nombre de sujets et le niveau des doses, et par conséquent la puissance statistique, ainsi que la diversité du type d’irradiation dans ces études, ces résultats peuvent être considérés comme fiables.
À titre d’exemple parmi les études représentatives, concernant le risque de décès par cancer, la dernière étude menée par la
Radiation Effects Research Foundation44
Fondation scientifique américano-japonaise ouverte à tous les chercheurs du monde et qui fait office de référence dans la recherche faisant suite aux bombardements d’Hiroshima et Nagasaki.
sur les enfants de survivants des bombardements d’Hiroshima et Nagasaki a porté sur 75 327 descendants, nés entre 1946 et 1984, et suivis jusqu’au 31 décembre 2009. Les participants comptaient 40 736 enfants de parents ayant été exposés et 34 591 de parents non exposés. Les survivants exposés à une dose de rayonnement gonadique non nulle avaient reçu une dose moyenne de 264 mGy. L’âge moyen des 68 689 descendants encore vivants au moment de l’étude était de 53 ans, la durée moyenne du suivi était de 54 ans. Un total de 5 183 participants étaient décédés, parmi lesquels 1 246 de cancer, 3 937 d’une autre pathologie, 1 288 d’une cause externe, et 96 de cause inconnue. Cette étude n’a pas mis en évidence de lien entre l’exposition de la mère aux rayonnements et le risque de décès causé par le cancer. Des résultats similaires ont été trouvés pour l’exposition paternelle. Cette étude a confirmé les conclusions de l’ensemble des études précédentes menées sur les descendants de ces survivants.
À titre d’exemple concernant le risque de cancer chez les enfants de travailleurs de l’industrie nucléaire, une étude réalisée à partir des cas du registre des cancers de l’enfant de Grande-Bretagne et ayant inclus une reconstruction dosimétrique individualisée a montré l’absence de relation entre l’irradiation préconceptionnelle des pères travaillant dans le secteur du nucléaire et le risque de cancer, en particulier de leucémie ou de lymphome malin non hodgkinien chez les enfants.
Concernant les pathologies autres que les cancers, les données sont rares. Les seules études portant sur ces pathologies non cancéreuses ont été réalisées chez les enfants des survivants d’Hiroshima et Nagasaki. Il s’agit d’une étude de mortalité et d’une étude transversale sur environ 11 000 enfants, portant sur 6 maladies polygéniques et multifactorielles courantes : l’hypertension artérielle, l’hypercholestérolémie, le diabète de type 2, l’angine de poitrine, l’infarctus du myocarde et l’accident vasculaire cérébral. Ces deux études ont conclu à une absence de relation entre l’irradiation des parents et le risque de survenue de ces pathologies chez leurs enfants. Cependant, elles ne portent que sur un type d’irradiation, à débit de dose élevé, et doivent être confirmées par d’autres études, en particulier dans des conditions d’exposition chronique.
S’agissant du risque de malformations congénitales, un grand nombre de travaux ont porté sur les descendants des survivants des bombardements d’Hiroshima et Nagasaki. La principale étude a porté sur 71 280 sujets nés entre 1948 et 1954, dont 36 219 considérés comme ayant eu au moins un parent exposé (dose moyenne d’environ 360 mGy). Au moins une malformation congénitale majeure a été observée chez 594 enfants, dont 300 étaient nés d’au moins un parent exposé. Aucune relation n’a été mise en évidence entre la dose de radiation reçue par l’un des parents ou par les deux parents et le risque de malformation congénitale, pris dans son ensemble ou par type de malformation.
Les effets d’une exposition préconceptionnelle ont également été recherchés au niveau du génome. Il existe actuellement une divergence entre les résultats observés dans les études sur l’irradiation environnementale chronique, qui concluent généralement à une augmentation de la fréquence des anomalies chromosomiques, et ceux observés dans les études sur l’irradiation professionnelle chronique ou l’irradiation médicale ou accidentelle (répétée ou non), qui concluent à l’absence de cette augmentation. À ce jour, il n’y a pas d’explication à cette divergence.
Plusieurs études ont conclu à une augmentation des anomalies chromosomiques chez les enfants des sujets irradiés lors de l’accident de Tchernobyl. Les mutations germinales de huit loci minisatellites ont été étudiées chez 252 familles des zones rurales de la région de Kiev et de Zhitomir en Ukraine qui ont été fortement contaminées par l’accident de Tchernobyl. Après ajustement sur l’origine ethnique, les habitudes tabagiques, l’âge de la mère, le travail des parents et le sexe, les enfants nés après l’accident de Tchernobyl, et donc exposés, avaient 1,6 fois plus de mutations sur les loci minisatellites étudiés que ceux nés avant cet accident, et donc non-exposés.
Des études menées sur les populations des villages du Kazakhstan hautement contaminés durant la période des essais nucléaires russes ont également rapporté une augmentation des anomalies chromosomiques, en particulier des translocations, chez les enfants et les petits-enfants (n = 115) des habitants de ces villages.
En revanche, dans une étude ayant porté sur 14 580 descendants de 8 345 sujets guéris d’un cancer durant leur enfance ou adolescence et diagnostiqués avant l’âge de 35 ans, comparés à 40 859 descendants de 19 536 apparentés (frères et sœurs), il n’a pas été mis en évidence d’augmentation du risque d’anomalie chromosomique chez les descendants des individus ayant subi une irradiation des gonades à l’occasion de la radiothérapie (moyenne 0,95 Gy pour les pères et 0,91 Gy pour les mères), par comparaison aux descendants des apparentés.
De même, dans une étude sur les travailleurs de l’industrie nucléaire, les taux de mutations dans les minisatellites de la lignée germinale ont été analysés chez 255 descendants de 162 travailleurs masculins de l’installation nucléaire de Sellafield en Grange-Bretagne. La recherche de mutations a porté sur huit loci minisatellites hypervariables. Aucune différence significative n’a été observée entre le taux de mutations dans les minisatellites d’origine paternelle (5,0 %, 37 mutations pour 736 allèles) chez les 103 descendants des 79 pères considérés comme non exposés et ayant reçu une dose testiculaire préconceptionnelle moyenne de 9 mSv et celui observé chez les 152 descendants des 97 pères exposés à une dose moyenne préconceptionnelle aux testicules de 194 mSv (5,8 %, 66 mutations pour 1 137 allèles).
Effets d’une exposition in utero
Toutes les études disposant d’une puissance statistique suffisante ainsi que les méta-analyses publiées sur le sujet montrent que des doses d’irradiation externe instantanée faibles, de l’ordre d’une dizaine de mGy, reçues in utero augmentent le risque de survenue de cancer et de leucémies de l’enfant, d’un facteur multiplicatif de l’ordre de 2 à 4. Par rapport à une irradiation postnatale durant l’enfance, ce facteur de risque est nettement plus important pour les cancers de l’enfant et du même ordre de grandeur pour les leucémies de l’enfant. La principale incertitude actuelle concerne l’incidence des cancers à l’âge adulte. Les résultats obtenus sur les survivants d’Hiroshima et Nagasaki, qui montrent un risque de survenue de cancer à l’âge adulte plus faible après irradiation in utero qu’après irradiation durant l’enfance sont basés sur peu de cas et doivent être confirmés dans une analyse ultérieure (pour les survivants qui auront dépassé l’âge de 70 ans).
En revanche, les effets des faibles doses d’irradiation chronique sont moins bien documentés et moins consensuels. Les seules études disponibles portent sur les enfants des personnes ayant travaillé dans le complexe nucléaire de Mayak dans l’Oural ou vivant dans les villages proches de la rivière Techa contaminée par ce complexe. Ces études n’ont pas la puissance nécessaire pour analyser l’effet de l’irradiation chronique in utero sur le risque de cancer chez l’enfant, mais seulement sur celui de cancer à l’âge adulte. Les résultats de ces études, à savoir l’absence d’augmentation de risque pour les cancers solides et la faible augmentation du risque pour les leucémies et lymphomes concluent à des risques faibles à l’âge adulte.
Les études portant sur l’incidence des leucémies en Suède, en Grèce et en Allemagne chez les enfants qui étaient in utero au moment de l’accident de Tchernobyl sont difficiles à interpréter car elles portent sur des niveaux de doses très faibles, proches de l’irradiation naturelle. Elles tendent cependant à montrer que ces expositions ont pu contribuer à l’apparition de certaines leucémies chez l’enfant à un âge plus précoce.
Les seules études sur l’incidence des pathologies cardiovasculaires après irradiation in utero ont été réalisées sur les enfants de survivants d’Hiroshima et Nagasaki. La puissance de ces études est cependant très faible, car seulement quelques dizaines de pathologies ont été recensées chez les survivants irradiés in utero. Les résultats de ces études conduisent à des excès de risque compatibles avec ceux observés après irradiation durant l’enfance. Il n’existe pas à ce jour d’étude sur les pathologies cardiovasculaires chez les sujets ayant subi une irradiation chronique in utero.
L’étude des survivants d’Hiroshima et Nagasaki montre que l’irradiation in utero, même à dose modérée, induit des troubles de la croissance, une réduction du périmètre crânien, des troubles du développement cérébral se traduisant par des troubles du langage et des déficits neurocognitifs. Les études réalisées portent cependant sur de faibles effectifs (moins de 1 000) et ne permettent pas de conclure à propos des effets des faibles doses (dans l’étude : doses inférieures à 50 mGy).
Les études concernant les paramètres neurocognitifs chez les survivants d’Hiroshima et Nagasaki montrent que des doses faibles de radiation reçues in utero, de l’ordre d’une centaine de mGy, augmentent le risque de retard mental et que ce risque augmente linéairement avec la dose de radiation pour atteindre des taux très importants, 60 % ou plus pour des doses d’un Gy ou plus. Pour les doses inférieures entre une dizaine et une centaine de mGy, une étude réalisée sur les populations contaminées par l’accident de Tchernobyl a conduit aux mêmes résultats. Cependant, une incertitude existe à propos de l’effet des doses très faibles car le nombre de sujets des études est trop faible.
L’effet de l’irradiation chronique in utero sur le développement cérébral a été évalué dans plusieurs études portant sur les sujets vivant dans les zones contaminées par l’accident de Tchernobyl. Une étude réalisée dans les zones fortement contaminées de Biélorussie a produit des résultats similaires à ceux observés chez les survivants d’Hiroshima et Nagasaki pour les troubles neurocognitifs, à savoir un risque de retard mental, dans une comparaison exposés-non exposés, mais pas de relation avec la dose de radiation reçue in utero. Une autre étude, réalisée en Ukraine, n’a observé aucun effet.
Perspectives : La question des effets transgénérationnels chez l’Homme
Les études actuellement disponibles sur les effets transgénérationnels chez l’Homme ne mettent pas en évidence d’effets décelables. Toutefois, ces études demeurent controversées et non concluantes car les doses sont souvent beaucoup plus faibles que celles testées dans les études chez l’animal, et le type de rayonnements ionisants ainsi que le mode d’exposition sont très différents. À cela s’ajoutent le manque de données en populations humaines et le défaut de suivi approprié de grandes cohortes sur plusieurs générations. Ces limites méthodologiques font qu’aujourd’hui des conséquences transgénérationnelles possibles des rayonnements ionisants n’ont pu être attestées chez l’Homme.
En conséquence, la littérature scientifique sur ce sujet devrait faire l’objet d’une veille particulièrement attentive et rigoureuse.
VI. Effets cellulaires et moléculaires d’une exposition
aux rayonnements ionisants
Alors que la description clinique des différents types de réponses aux radiations ionisantes a progressivement été documentée depuis le début du xxe siècle, la connaissance des mécanismes moléculaires et cellulaires expliquant l’intensité et la fréquence des réponses radio-induites a évolué beaucoup plus lentement, au gré des avancées technologiques et conceptuelles.
Les connaissances encore limitées sur les mécanismes cellulaires et moléculaires radio-induits rendent difficile l’identification de biomarqueurs spécifiques de la réponse individuelle aux radiations ionisantes. Pour ces raisons, si on peut parfois estimer la proportion de cas de pathologies attribuables à l’exposition aux rayonnements ionisants dans un contexte donné, comme pour l’essentiel des autres facteurs environnementaux, il est généralement impossible d’imputer la survenue d’un cas individuel à l’exposition aux rayonnements ionisants.
Mécanismes moléculaires et cellulaires impliqués
dans la réponse aux rayonnements ionisants
Les radiations ionisantes produisent 3 types d’effets biologiques et cliniques :
• les réactions tissulaires (principalement des dermites) associées à la mort cellulaire, regroupées sous le terme de « radiosensibilité » ;
• les cancers radio-induits, regroupés sous le terme de « radiosusceptibilité » ;
• les effets du vieillissement accéléré causé par des expositions à faibles doses et répétées (par exemple : cataractes, effets sur les systèmes cardiovasculaire ou osseux). L’ensemble de ces effets peut être désigné par le terme de « radiodégénérescence ».
La littérature scientifique récente suggère les constats suivants :
• la relation entre la dose et l’effet biologique ou clinique est une fonction mathématique dont la forme dépend de nombreux facteurs comme le facteur individuel (par exemple : survie cellulaire et nombre de cassures de l’ADN en fonction de la dose pour une lignée cellulaire donnée...) ; ce facteur ou statut individuel implique des différences inter-individuelles dans les 3 types d’effets radio-induits (radiosensibilité, radiosusceptibilité, radiodégénérescence). Il faut noter que les règles de radioprotection actuelles ne tiennent pas encore compte de ce facteur individuel
45
Toutefois, récemment, le décret du 8 février 2019 concernant la prise en charge des patients dans le cadre de l’imagerie médicale mentionne pour la première fois le terme « radiosensibilité individuelle ».
, ni de possibles effets de répétition de dose
46
La répétition des doses peut produire des effets supra-additifs mais aussi des effets infra-additifs.
;
• les données précliniques issues des modèles animaux sont utiles pour la compréhension des phénomènes fondamentaux mais la transposition à l’Homme est rendue difficile voire hasardeuse car les échelles de dose entraînant un effet donné peuvent changer drastiquement d’une espèce à l’autre.
Radiosensibilité
Les effets de radiosensibilité sont très documentés mais ne sont observés qu’à partir d’environ 0,5 Gy. Aucun signe de radiosensibilité n’apparaît généralement plus de 4 ans après l’exposition. De nombreux polymorphismes génétiques, qu’ils soient hétérozygotes ou homozygotes, sont connus pour être associés à une forte radiosensibilité. Dans leur grande majorité, ces gènes codent pour des protéines impliquées dans la signalisation ou la réparation des cassures de l’ADN par suture.
Radiosusceptibilité
La transformation cellulaire responsable de la survenue des cancers radio-induits peut être observée à partir de doses seuil de l’ordre de 0,1 Gy (pour les leucémies) à 0,2 Gy (pour les cancers solides). Cependant, la prédiction de la radiosusceptibilité souffre à la fois d’une connaissance encore trop partielle des mécanismes fondamentaux de la cancérogenèse et d’une détectabilité insuffisante pour les effets biologiques aux faibles doses : il n’y a encore aucun consensus sur un biomarqueur fiable de la radiosusceptibilité humaine, même si la qualité de la réparation des cassures de l’ADN reste un critère fondamental. Quelques syndromes génétiques sont connus pour être associés à une forte prédisposition au cancer et au cancer radio-induit. Ils sont généralement causés par des mutations hétérozygotes de gènes impliqués dans le contrôle du cycle cellulaire ou de la réparation de l’ADN par recombinaison.
Radiodégénérescence
Aujourd’hui, il ne fait aucun doute que les radiations ionisantes peuvent produire des effets non létaux, non cancérogènes, qui se traduisent par un vieillissement accéléré de tissus spécifiques. C’est notamment le cas des cataractes et des effets cardiovasculaires radio-induits. Toutefois, la Commission internationale de protection radiologique (CIPR) considère que le caractère radio-induit de ces affections n’est évident que pour des doses supérieures à 0,5 Gy. Comme pour la radiosusceptibilité, l’effet individuel et les phénomènes de répétitions de dose pourraient faire diminuer ce seuil d’observation. Cependant, les statuts génétiques à risque ne sont pas encore définis clairement (seules des données sur les rongeurs sont disponibles) et les modèles mécanistiques sont encore à l’état d’ébauche.
Biomarqueurs de la réponse individuelle aux rayonnements ionisants
Les biomarqueurs de la réponse individuelle aux radiations ionisantes concernent les tissus sains irradiés. L’identification de ces biomarqueurs pour le développement de tests prédictifs des 3 types de réponse (radiosensibilité, radiosusceptibilité et radiodégénérescence) dépend des connaissances que l’on a des phénomènes moléculaires, cellulaires et tissulaires qui surviennent après irradiation. Le fait que la réponse aux radiations soit liée à la dose pose le problème général de la sensibilité et de la spécificité des biomarqueurs à prédire des événements qui sont d’autant plus rares que la dose est faible. Aujourd’hui les biomarqueurs de la radiosensibilité sont les plus nombreux et les plus variés, alors que les biomarqueurs de la radiosusceptibilité font toujours débat quant à leur pertinence biostatistique et les biomarqueurs consensuels de la radiodégénérescence sont encore inexistants.
Biomarqueurs de la radiosensibilité
Tests basés sur la mort cellulaire
La survie clonogénique est le biomarqueur historique de la radiosensibilité. Elle se mesure par le test dit « des colonies »
47
Amas de cellules issus d’une cellule survivante en général après une exposition à 2 Gy.
. Des corrélations quantitatives ont été obtenues entre la survie clonogénique
in vitro et la radiosensibilité clinique des tissus sains ou des tumeurs. Toutefois, ces tests nécessitent un grand savoir-faire technique, un grand nombre de cellules et un temps relativement long (10-15 jours) pour la formation de colonies, ce qui en limite l’application en clinique.
Alors que les différents types de mort cellulaire (mort mitotique, sénescence, apoptose) conditionnent la survie clonogénique, la pertinence des tests basés sur un seul type de mort radio-induite reste fortement dépendante du type de tissu. Ainsi, la mort mitotique (observable après la mitose), quantifiable par les micronoyaux, est l’une des morts les plus fréquentes pour les tissus qui peuvent encore proliférer sous irradiation. Cependant, les seuils de dose pour observer des micronoyaux sont élevés (supérieurs à 0,1 Gy).
La sénescence est un arrêt irréversible des cellules en G1 après irradiation et constitue la mort cellulaire radio-induite la plus fréquente pour des tissus naturellement quiescents. Toutefois, un test de sénescence, souvent basé sur l’expression de la protéine p21, ne peut prédire la radiosensibilité de tissus qui ne meurent pas par sénescence, d’où l’absence de corrélation entre sénescence et radiosensibilité pour de nombreux tissus.
L’apoptose est l’une des voies de mort les plus documentées, mais elle est fortement dépendante des tissus. Par exemple, les lymphocytes meurent fréquemment par apoptose, contrairement aux fibroblastes. Il n’existe pas de corrélation quantitative entre l’apoptose et la radiosensibilité cellulaire.
Tests basés sur la cytogénétique
Ces tests sont également utilisés en dosimétrie biologique. Les tests basés sur les cassures chromosomiques ont permis de prédire, au moins partiellement, la radiosensibilité clinique. Toutefois, les techniques actuelles de cytogénétique sont basées sur des protocoles expérimentaux assez lourds et leur seuil de détectabilité ne dépasse pas les doses inférieures à 0,1 Gy quand moins de 1 000 cellules sont analysées.
Tests basés sur les dommages de l’ADN
Il existe quatre types de techniques basées sur la détection de cassures de l’ADN : la discrimination des fragments d’ADN par leur taille, la condensation/décondensation de la chromatine, l’utilisation de plasmides, et, plus récemment, le suivi par immunofluorescence des protéines de signalisation ou de réparation de l’ADN. Aujourd’hui, on peut considérer que ce dernier type de technique est le plus prometteur. Généralement, les protéines de signalisation et de réparation des cassures double-brin de l’ADN (CDB) se relocalisent sous forme de foci nucléaires, ce qui les rend facilement quantifiables. Il a été montré que les CDB radio-induites pouvaient être quantifiées par la mesure du nombre de foci nucléaires formés par la protéine histone variante H2AX phosphorylée sur sa sérine 139 (γ-H2AX). Comme environ 40 CDB sont induites par Gy et par fibroblaste humain, 1γ-H2AX foci par cellule représente une dose de 25 mGy (1/40e de Gy). Cette technique repousse considérablement le seuil de détectabilité des autres techniques (environ 0,1 Gy). Cependant, elle ne peut pas prédire de façon fiable les cellules associées à une radiosensibilité modérée.
Il a été suggéré que la vitesse de transit de la protéine ATM du cytoplasme au noyau après irradiation pourrait conditionner la réponse clinique aux radiations. La protéine kinase ATM est responsable de la phosphorylation de H2AX et son activation est l’un des événements biochimiques les plus précoces après irradiation. Une corrélation quantitative significative a été établie entre le nombre de foci phospho-ATM et les grades de sévérité CTCAE et RTOG
48
CTCAE (Common Terminology Criteria for Adverse Events) et RTOG (Radiation Therapy Oncology Group) sont des échelles cliniques de toxicité tissulaire.
quantifiant la radiosensibilité clinique.
Tests basés sur la génomique
Les principales protéines requises pour les événements radio-induits précoces comme la reconnaissance ou la réparation des dommages de l’ADN sont nombreuses et leur expression ne varie pas avec la dose. En revanche, certaines protéines en aval de la réponse aux radiations (impliquées dans les arrêts du cycle cellulaire, les différents types de mort cellulaire ou l’inflammation) sont très radio-inductibles. Même si quelques corrélations quantitatives existent entre l’expression de certains gènes et la radiosensibilité, celles-ci ne sont valables que pour une gamme limitée de doses et de radiosensibilité.
Certains polymorphismes à simple nucléotide (SNP,
Single Nucleotide Polymorphism49
Un SNP est une variation de séquence d’un gène observée chez une minorité d’individus qui représente généralement moins de 10 % de l’espèce. Les SNP sont des changements de nucléotides mais qui pour la très grande majorité ne codent pas pour des acides aminés différents et donc ne changent pas la conformation de la protéine produite par le gène en question.
) des protéines ATM, XRCC1, XRCC3, SOD2, RAD21, TGF-B1 et PARP ont été identifiés comme éventuellement associés à une réponse anormale aux radiations. Cependant, aucune corrélation quantitative n’a été observée entre les SNP et la radiosensibilité individuelle.
Des études de séquençage intégral du génome (GWAS, Genome Wide Association Studies) ont été développées pour identifier des variants génétiques communs associés à une radiosensibilité clinique. Jusqu’alors de telles associations ne sont pas prouvées et semblent spécifiques à un site tumoral : ces approches ne permettent donc pas aujourd’hui une évaluation individuelle de la radiosensibilité.
Biomarqueurs de la radiosusceptibilité
Biomarqueurs de mauvaise réparation des cassures de l’ADN
En raison de la confusion entre radiosensibilité et radiosusceptibilité, certains biomarqueurs de radiosensibilité décrits plus haut ont également été utilisés pour estimer la radiosusceptibilité et l’instabilité génomique. Pourtant, certains d’entre eux, comme les tests de survie clonogénique, sont incompatibles avec les deux notions. Par exemple, les tests de survie clonogénique, tests de référence pour la radiosensibilité, ne sont pas pertinents pour évaluer la transformation cellulaire. Il a été suggéré que la prédisposition au cancer est associée à des CDB mal réparées. Au fur et à mesure des avancées technologiques dans les tests de réparation des CDB, un certain nombre de marqueurs d’immunofluorescence ont été testés. Cependant, il n’existe pas encore de consensus sur ces derniers pour refléter la prédisposition au cancer.
Test en G2
La perte de contrôle du cycle cellulaire est l’une des étapes majeures de l’instabilité génomique et de la prédisposition au cancer. Les syndromes associés à une forte prédisposition montrent un défaut du contrôle de l’arrêt en G2/M. Le test en G2 a été développé pour détecter les individus porteurs de gènes prédisposant au risque de cancer. Bien que ce test permette une prédiction fiable de la prédisposition au cancer, son seuil de détectabilité est au-dessus de 0,1-0,2 Gy.
Biomarqueurs génomiques
Bien qu’une expression génique ou une signature de transcriptome permet de discriminer certains cancers sporadiques des cancers de la thyroïde et des sarcomes radio-induits, il n’y a pas encore de biomarqueurs génomiques spécifiques de la radiosusceptibilité.
L’approche génique la plus simple consisterait en la recherche de mutations de gènes de prédisposition au cancer. L’hyper-recombinaison peut aussi conduire à de nombreux réarrangements dans les séquences d’ADN. En particulier, la combinaison de certains SNP pourrait être un signe spécifique d’instabilité génomique. Toutefois, qu’ils soient pris séparément ou ensemble, les SNP n’ont pas encore fourni de preuves solides pour les considérer comme des biomarqueurs de la radiosusceptibilité.
Biomarqueurs de la radiodégénérescence
Les mécanismes à l’origine des affections liées à la radiodégénérescence comme les cataractes ou les maladies cardiovasculaires sont méconnus et les biomarqueurs qui pourraient les prédire ne sont pas encore définis. Des marqueurs liés au stress oxydatif et au vieillissement tels que le raccourcissement des télomères pourraient cependant être utiles. Les biomarqueurs spécifiques des problèmes cardiovasculaires radio-induits pourraient aussi être liés au stress oxydatif et au vieillissement à travers la sénescence et des dysfonctions de la mitochondrie. Des recherches sur des peptides spécifiques dans le plasma comme la troponine T, un indicateur de dommage cardiaque, ont été initiées sans toutefois aboutir à un consensus.
Biomarqueurs associés aux cancers radio-induits
Parallèlement à la recherche sur les biomarqueurs de la réponse individuelle aux radiations, la recherche sur les spécificités des tumeurs radio-induites a ouvert un autre axe d’investigation, celui des signatures radio-induites.
La fréquence des effets stochastiques induits par les rayonnements ionisants est très faible et, à ce jour, il n’est pas possible de distinguer, sur des critères histologiques, les cancers radio-induits de ceux qui se développent spontanément. Les cassures double-brin de l’ADN, induites par l’irradiation et mal réparées, peuvent provoquer de nombreuses altérations dont certaines pourraient être spécifiques et constituer des signatures moléculaires potentielles. Ainsi, de nombreux travaux se sont orientés vers la recherche de signatures moléculaires afin de distinguer un cancer radio-induit d’un cancer spontané.
Deux grands types d’études sont informatives quant à la signature des cancers radio-induits : d’une part, les caractérisations des profils d’expression génique dans un type de cancer donné (biomarqueurs spécifiques d’un cancer radio-induit) et, d’autre part, des modifications du génome, spécifiques de l’exposition aux rayonnements ionisants, indépendamment du type de cancer (biomarqueurs globaux de l’irradiation).
Les travaux de recherche de biomarqueurs moléculaires spécifiques d’un cancer radio-induit ont été menés pour le cancer de la thyroïde ; quelques travaux ont porté sur le cancer du sein. Ces études ont reposé sur différentes analyses (réarrangements chromosomiques, biomarqueurs du cycle cellulaire, altérations génomiques, variation des profils d’expression génique) qui, au cours du temps, ont évolué vers des approches à plus grande échelle. Concernant les profils d’expression génique, très peu de convergences sont actuellement identifiées dans les gènes décrits comme dérégulés dans les tumeurs radio-induites. Les raisons peuvent être multiples, qu’il s’agisse des lots étudiés qui sont issus de tumeurs différentes, des puces utilisées, de l’analyse des données et des techniques de normalisation. Des intercomparaisons sont indispensables pour consolider les signatures moléculaires permettant de conclure à la radio-induction d’une tumeur ou du moins son développement à partir de tissu irradié. De plus, des recherches complémentaires sont nécessaires pour estimer l’impact de la dose/du débit de dose sur l’induction de ces signatures.
Concernant les modifications du génome spécifiques de l’exposition aux radiations ionisantes et indépendantes du type de cancer, les tumeurs radio-induites présentent des spécificités moléculaires communes, suggérant la possibilité d’identifier une signature « générale » des tumeurs se développant à partir de cellules ayant été irradiées, sans exclure la possibilité que ces tumeurs aient pu se développer en dehors de tout phénomène d’irradiation. La recherche porte particulièrement sur deux modifications du génome : l’instabilité chromosomique télomère-induite qui combine la transmission des dommages radio-induits à la descendance des cellules irradiées et la sénescence cellulaire, et la signature mutationnelle.
Perspectives : Études sur les effets cellulaires et moléculaires
Les connaissances actuelles sur les trois grands types d’effets radio-induits (radiosensibilité, radiosusceptibilité, radiodégénérescence) ne sont pas au même degré d’aboutissement. Ces effets concernent inégalement la problématique des essais nucléaires menés en Polynésie française. Pour évaluer leur impact réel, plusieurs conditions sont requises :
• la connaissance de la dose physique précise de rayonnements ionisants et de l’étalement dans le temps des expositions (dosimétrie) ;
• l’existence de biomarqueurs spécifiques pour la détectabilité de l’effet radio-induit ;
• l’estimation précise des sous-populations à risque (facteur individuel) pour lesquelles les doses seuils sont inférieures à la normale. Se pose la question de la prise en compte des différences inter-individuelles de sensibilité dans les trois types d’effets radio-induits (par exemple facteurs génétiques de prédisposition aux cancers).
Concernant la radiosensibilité (réactions tissulaires), très bien caractérisée, elle ne peut concerner les essais nucléaires menés en Polynésie française car les doses de radiation connues à ce jour sont inférieures à 0,5 Gy (seuil à partir duquel sont observés en général les effets de la radiosensibilité).
En ce qui concerne la radiosusceptibilité (cancers radio-induits), les faibles doses de radiation impliquées en Polynésie française sont en-dessous du seuil de détectabilité (0,1-0,2 Gy) de ce type d’effet cellulaire. Toutefois, dans le cas de certains statuts génétiques, les cancers radio-induits sont possibles à des doses seuils inférieures à 100 mSv.
En ce qui concerne la radiodégénérescence (effets non létaux et non cancérogènes se traduisant par un vieillissement accéléré), alors que son impact est plausible, les connaissances actuelles sur les biomarqueurs et les seuils de doses sont encore trop lacunaires pour établir un niveau de preuve suffisant dans le cadre des essais nucléaires en Polynésie française.
Enfin, de nombreuses données montrent que les caractéristiques individuelles influencent la réponse aux rayonnements ionisants pour tous les types de phénomènes radio-induits (radiosensibilité, radiosusceptibilité, radiodégénérescence), et ce à des ordres de grandeur de risque qui peuvent aller de 1 à 10.
Biomarqueurs
L’état des connaissances actuelles et son évolution rapide, en particulier l’utilisation des techniques de séquençage à grande échelle et l’établissement de profils d’expression génique (notamment pour les tumeurs de la thyroïde) qui permettent d’identifier des signatures de l’exposition aux rayonnements ionisants, incitent à préconiser la constitution d’une banque de données biologiques et de biobanques (échantillons tumoraux et échantillons de tissus adjacents), à partir d’un échantillon représentatif de la population (avec si possible une documentation de l’exposition), qui permettraient d’étayer la présomption de radio-induction de la tumeur.
VII. Conclusion
L’objectif de cette expertise collective était d’établir un bilan des connaissances scientifiques internationales disponibles sur les conséquences sanitaires des essais nucléaires atmosphériques menés par la France en Polynésie française, sur la population générale et les anciens travailleurs civils et militaires. Face à la rareté de la littérature scientifique disponible sur la Polynésie française, le bilan des connaissances a été élargi aux conséquences sanitaires des essais nucléaires réalisés par d’autres pays (États-Unis, ex Union soviétique, Royaume-Uni) dans d’autres territoires. L’expertise apporte également des éléments de connaissance scientifique plus fondamentale, utiles à la compréhension de cette problématique, en particulier en dosimétrie et en radiobiologie.
Les rares études épidémiologiques sur la Polynésie française ne mettent pas en évidence d’impact majeur des retombées des essais nucléaires sur la santé des populations polynésiennes. Une étude cas-témoins menée sur la population locale montre une faible augmentation du risque de cancer de la thyroïde en lien avec l’augmentation de la dose reçue à la thyroïde avant l’âge de 15 ans. Une étude de mortalité menée sur le personnel militaire met en évidence une augmentation du risque de mortalité par hémopathies malignes chez les individus qui présentaient une dosimétrie non nulle (mesurée par dosimètre). Les résultats de ces études sont insuffisants pour conclure de façon solide sur les liens entre l’exposition aux rayonnements ionisants issus des retombées des essais nucléaires atmosphériques en Polynésie française et l’occurrence de ces pathologies, mais ils ne permettent pas non plus d’exclure l’existence de conséquences sanitaires qui seraient passées inaperçues jusqu’à présent. Ces résultats et la rareté des données justifient la nécessité d’envisager d’autres approches afin d’évaluer les conséquences sanitaires des retombées des essais nucléaires en Polynésie française.
En premier lieu, il est important de préciser que la réalisation d’une étude épidémiologique de cohorte afin d’évaluer les conséquences sanitaires en Polynésie française apparaît complexe à mettre en œuvre en raison de quatre difficultés majeures : les lacunes de connaissances sur la santé de la population, en particulier sur les pathologies chroniques telles que le cancer ; les niveaux de doses de rayonnements ionisants reçues qui sont de l’ordre des faibles doses ; la taille restreinte de la population polynésienne, disséminée sur un très vaste territoire ; le délai depuis l’exposition. Face à ces difficultés, une telle étude ne permettrait pas d’établir avec certitude une éventuelle association entre l’incidence des pathologies et l’exposition aux rayonnements ionisants des populations polynésiennes.
Si une étude de cohorte n’apparaît donc pas comme une perspective réalisable en Polynésie française, il existe toutefois d’autres perspectives pour l’évaluation des conséquences sanitaires issues des retombées des essais nucléaires. Le groupe d’experts a formulé trois recommandations principales, résumées ici :
• améliorer, développer et pérenniser le système de surveillance sanitaire des pathologies non transmissibles (cancers, maladies cardiovasculaires, anomalies congénitales), en particulier consolider le Registre des cancers tout en le dotant d’un conseil scientifique indépendant, créer d’autres registres de pathologies (maladies cardiovasculaires, anomalies congénitales) ;
• affiner les estimations de doses reçues par les populations locales et par les personnels civils et militaires, en particulier via l’accès à l’ensemble des mesures de surveillance radiologique environnementale et des mesures d’exposition et de contamination effectuées sur les personnels ayant travaillé sur les sites d’expérimentation nucléaire ;
• réaliser une veille attentive et rigoureuse de la littérature scientifique internationale sur la problématique des effets des faibles doses de rayonnements ionisants, en particulier pour certains cancers (à ce jour non reconnus par les instances internationales comme pouvant être radio-induits), les maladies cardiovasculaires et les effets sur la descendance. En effet, au fil de l’avancée des connaissances sur le suivi à long terme de populations exposées à différentes sources de rayonnements ionisants, à des faibles doses, d’autres pathologies que celles connues jusqu’à présent, pourraient être reconnues comme des pathologies pouvant être radio-induites.
Parallèlement à la mise en place de systèmes de surveillance sanitaire et radiologique, des études en sciences humaines et sociales pourraient être envisagées afin d’apporter un éclairage sur l’impact sociétal des essais nucléaires menés par la France en Polynésie française (tel que le rôle du Centre d’expérimentation du Pacifique par exemple), et par là-même mieux appréhender certains problèmes sanitaires.
 ). Durant toute cette période, et plus précisément dès le début des années 1960, la Polynésie française a connu de profonds changements d’ordre économique, sanitaire, et concernant les modes de vie, en partie liés à l’implantation du CEP. Suite au démantèlement du CEP en 1996, la société polynésienne aborde une nouvelle transition sociodémographique, tandis que la prise de conscience collective quant aux conséquences potentielles des retombées radioactives sur la santé de la population polynésienne et du personnel civil et militaire suscite des inquiétudes croissantes et motive une demande de reconnaissance en vue d’obtenir réparation.
). Durant toute cette période, et plus précisément dès le début des années 1960, la Polynésie française a connu de profonds changements d’ordre économique, sanitaire, et concernant les modes de vie, en partie liés à l’implantation du CEP. Suite au démantèlement du CEP en 1996, la société polynésienne aborde une nouvelle transition sociodémographique, tandis que la prise de conscience collective quant aux conséquences potentielles des retombées radioactives sur la santé de la population polynésienne et du personnel civil et militaire suscite des inquiétudes croissantes et motive une demande de reconnaissance en vue d’obtenir réparation.
 ). Pour les autres essais, les retombées globales (troposphériques et stratosphériques) sur Tahiti, et de manière plus générale sur la Polynésie française, ont été similaires à celles observées sur l’ensemble de l’hémisphère sud.
). Pour les autres essais, les retombées globales (troposphériques et stratosphériques) sur Tahiti, et de manière plus générale sur la Polynésie française, ont été similaires à celles observées sur l’ensemble de l’hémisphère sud. et III
et III présentent les voies prédominantes d’exposition pour les six essais nucléaires considérés et les populations adultes ou enfants, respectivement en termes de dose efficace ou de dose à la thyroïde.
présentent les voies prédominantes d’exposition pour les six essais nucléaires considérés et les populations adultes ou enfants, respectivement en termes de dose efficace ou de dose à la thyroïde. ). La connaissance de l’allure de la relation dose-réponse aux faibles doses constitue donc un enjeu important29
.
). La connaissance de l’allure de la relation dose-réponse aux faibles doses constitue donc un enjeu important29
.