Pesticides et effets sur la santé
II. Pathologies cancéreuses
2021
| ANALYSE |
13-
Cancer du sein
Incidence et mortalité
 ). Le cancer du sein est le cancer le plus
fréquent chez la femme. Le taux d’incidence standardisé à l’âge de
la population mondiale (TIS-M) a été estimé à 99,9 cas pour
100 000 personnes-années et progresse selon l’âge à partir de l’âge
de 30 ans pour atteindre un maximum entre 70 et 74 ans. L’incidence
est hétérogène selon les départements. Sur la période 2007-2016, les
TIS-M les plus élevés ont été observés à Paris (111), le Nord (106)
et les Yvelines (104) et les TIS-M les plus bas en Guyane (53 pour
la période 2010-2014), en Martinique (61 pour la période 2007-2014)
et en Guadeloupe (66 pour la période 2008-2014) (Deloumeaux et
coll., 2019
). Le cancer du sein est le cancer le plus
fréquent chez la femme. Le taux d’incidence standardisé à l’âge de
la population mondiale (TIS-M) a été estimé à 99,9 cas pour
100 000 personnes-années et progresse selon l’âge à partir de l’âge
de 30 ans pour atteindre un maximum entre 70 et 74 ans. L’incidence
est hétérogène selon les départements. Sur la période 2007-2016, les
TIS-M les plus élevés ont été observés à Paris (111), le Nord (106)
et les Yvelines (104) et les TIS-M les plus bas en Guyane (53 pour
la période 2010-2014), en Martinique (61 pour la période 2007-2014)
et en Guadeloupe (66 pour la période 2008-2014) (Deloumeaux et
coll., 2019 ).
). ).
Le taux de mortalité standardisé à l’âge de la population mondiale
(TMS-M) est de 14,0 décès pour 100 000 personnes-années. Sur la
période 2007-2014, les TMS-M les plus élevés ont été observés dans
le Pas-de-Calais (21,0), le Nord (20,0) et la Somme (19,0) et les
TMS-M les plus bas en Guyane (11,0), dans les Alpes-Maritimes (13,0)
et la Haute-Garonne, le Var, en Guadeloupe et en Martinique (13,0)
(Deloumeaux et coll., 2019
).
Le taux de mortalité standardisé à l’âge de la population mondiale
(TMS-M) est de 14,0 décès pour 100 000 personnes-années. Sur la
période 2007-2014, les TMS-M les plus élevés ont été observés dans
le Pas-de-Calais (21,0), le Nord (20,0) et la Somme (19,0) et les
TMS-M les plus bas en Guyane (11,0), dans les Alpes-Maritimes (13,0)
et la Haute-Garonne, le Var, en Guadeloupe et en Martinique (13,0)
(Deloumeaux et coll., 2019 ). Globalement, les taux de mortalité
suivent une évolution inverse à ceux de l’incidence, avec une
diminution moyenne annuelle de 1,3 % entre 1990 et 2018. Cette
diminution pourrait être expliquée par l’amélioration des
traitements ainsi que par le dépistage permettant un diagnostic à
des stades plus précoces, et donc curables, de la maladie.
). Globalement, les taux de mortalité
suivent une évolution inverse à ceux de l’incidence, avec une
diminution moyenne annuelle de 1,3 % entre 1990 et 2018. Cette
diminution pourrait être expliquée par l’amélioration des
traitements ainsi que par le dépistage permettant un diagnostic à
des stades plus précoces, et donc curables, de la maladie.Étiologie et facteurs de risque
 ; Colditz et Bohlke,
2014
; Colditz et Bohlke,
2014 ;
Macacu et coll., 2015
;
Macacu et coll., 2015 ; Picon-Ruiz et coll.,
2017
; Picon-Ruiz et coll.,
2017 ).
Le travail de nuit a été classé comme cancérogène probable
(groupe 2A) par le Circ sur la base de données mécanistiques et
expérimentales (Ward et coll., 2019
).
Le travail de nuit a été classé comme cancérogène probable
(groupe 2A) par le Circ sur la base de données mécanistiques et
expérimentales (Ward et coll., 2019 ). Cependant, en dépit de nombreuses
études observationnelles, les conclusions sur un plan
épidémiologique sont encore controversées au regard du risque de
survenue du cancer du sein (Travis et coll.,
2016
). Cependant, en dépit de nombreuses
études observationnelles, les conclusions sur un plan
épidémiologique sont encore controversées au regard du risque de
survenue du cancer du sein (Travis et coll.,
2016 ;
Wegrzyn et coll., 2017
;
Wegrzyn et coll., 2017 ; Cordina-Duverger et coll.,
2018
; Cordina-Duverger et coll.,
2018 ;
Jones et coll., 2019
;
Jones et coll., 2019 ).
).Premières données épidémiologiques
 ).
En utilisant des prélèvements sanguins obtenus entre 1985 et 1991,
les auteurs ont rapporté un risque augmenté de survenue de cancer du
sein chez les femmes les plus exposées au
dichlorodiphényldichloroéthylène (DDE), le principal métabolite du
dichlorodiphényltrichloroéthane (DDT) un insecticide organochloré.
Cependant, dès 1994, une nouvelle étude portant sur 150 cas et
150 témoins nichés au sein d’une cohorte de 57 040 femmes habitant
dans la région de la baie de San Francisco aux États-Unis (pour
lesquelles un prélèvement sanguin avait été obtenu vers la fin des
années 1960 et qui ont fait l’objet d’un suivi jusqu’en 1990) n’a
pas montré d’association entre les niveaux d’exposition au DDE et le
risque de survenue du cancer du sein (Krieger et coll.,
1994
).
En utilisant des prélèvements sanguins obtenus entre 1985 et 1991,
les auteurs ont rapporté un risque augmenté de survenue de cancer du
sein chez les femmes les plus exposées au
dichlorodiphényldichloroéthylène (DDE), le principal métabolite du
dichlorodiphényltrichloroéthane (DDT) un insecticide organochloré.
Cependant, dès 1994, une nouvelle étude portant sur 150 cas et
150 témoins nichés au sein d’une cohorte de 57 040 femmes habitant
dans la région de la baie de San Francisco aux États-Unis (pour
lesquelles un prélèvement sanguin avait été obtenu vers la fin des
années 1960 et qui ont fait l’objet d’un suivi jusqu’en 1990) n’a
pas montré d’association entre les niveaux d’exposition au DDE et le
risque de survenue du cancer du sein (Krieger et coll.,
1994 ).
). ) mais aussi par leur capacité à interagir
avec les récepteurs aux œstrogènes ou aux androgènes, ce qui est
notamment le cas pour le DDE (Kelce et coll.,
1995
) mais aussi par leur capacité à interagir
avec les récepteurs aux œstrogènes ou aux androgènes, ce qui est
notamment le cas pour le DDE (Kelce et coll.,
1995 ).
).Résumé de l’expertise collective Inserm de 2013
Expositions professionnelles
 ; Gardner et coll.,
2002
; Gardner et coll.,
2002 ) soit une diminution de risque (Wiklund et Dich,
1994
) soit une diminution de risque (Wiklund et Dich,
1994 ; Kristensen et coll., 1996
; Kristensen et coll., 1996 ; Settimi et coll.,
1999
; Settimi et coll.,
1999 ; Pukkala et coll., 2009
; Pukkala et coll., 2009 ; Villeneuve et coll.,
2011
; Villeneuve et coll.,
2011 ) par rapport à celui observé dans les populations générales
respectives. L’interprétation de ces résultats par rapport à
l’exposition aux pesticides est difficile, car elle n’est pas
toujours bien documentée mais aussi parce que d’autres facteurs,
tels que l’alimentation, l’activité physique et les modes de vie
peuvent expliquer les différences d’incidence de la maladie.
) par rapport à celui observé dans les populations générales
respectives. L’interprétation de ces résultats par rapport à
l’exposition aux pesticides est difficile, car elle n’est pas
toujours bien documentée mais aussi parce que d’autres facteurs,
tels que l’alimentation, l’activité physique et les modes de vie
peuvent expliquer les différences d’incidence de la maladie. ). Au sein de la cohorte
Agricultural Health Study (AHS) aux États-Unis, les
auteurs ont constaté un risque diminué de survenue du cancer du
sein chez les femmes appliquant des pesticides (sans distinction
de matière active) mais un excès de risque en cas d’application
de l’herbicide 2,4,5-TP (Engel et coll.,
2005
). Au sein de la cohorte
Agricultural Health Study (AHS) aux États-Unis, les
auteurs ont constaté un risque diminué de survenue du cancer du
sein chez les femmes appliquant des pesticides (sans distinction
de matière active) mais un excès de risque en cas d’application
de l’herbicide 2,4,5-TP (Engel et coll.,
2005 ).
). ).
).Expositions environnementales
 ; Calle et coll., 2002
; Calle et coll., 2002 ; López-Cervantes et coll.,
2004
; López-Cervantes et coll.,
2004 ; Khanjani et coll., 2007
; Khanjani et coll., 2007 ). S’agissant des études, bien moins
nombreuses et portant sur des pesticides autres que les
organochlorés, elles ont employé comme indicateur d’exposition
la distance de résidence à des zones d’épandages de pesticides
(Reynolds et coll., 2005
). S’agissant des études, bien moins
nombreuses et portant sur des pesticides autres que les
organochlorés, elles ont employé comme indicateur d’exposition
la distance de résidence à des zones d’épandages de pesticides
(Reynolds et coll., 2005 ) ou les niveaux de contamination des
eaux de consommation à de l’atrazine (McElroy et coll.,
2007
) ou les niveaux de contamination des
eaux de consommation à de l’atrazine (McElroy et coll.,
2007 ) et n’ont pas montré d’association avec le risque de cancer
du sein.
) et n’ont pas montré d’association avec le risque de cancer
du sein. ). Au cours du suivi portant sur 195 cas incidents de cancer
du sein, les auteurs ont montré un excès de risque, à la limite
de la signification statistique, de récidive de la maladie et/ou
de décès par cancer du sein chez les femmes les plus exposées à
la dieldrine, un insecticide organochloré (RR = 2,61 ;
IC 95 % [0,97-7,01] pour le 4e quartile d’exposition
le plus élevé comparé au 1er quartile le plus
faible ; p de tendance < 0,01). Cependant, une étude
ultérieure au sein de cette même cohorte n’a pas montré de lien
entre l’exposition à plusieurs insecticides organochlorés, dont
la dieldrine, et la survie des patientes en fonction du statut
de la tumeur vis-à-vis des récepteurs aux œstrogènes (Hoyer et
coll., 2001
). Au cours du suivi portant sur 195 cas incidents de cancer
du sein, les auteurs ont montré un excès de risque, à la limite
de la signification statistique, de récidive de la maladie et/ou
de décès par cancer du sein chez les femmes les plus exposées à
la dieldrine, un insecticide organochloré (RR = 2,61 ;
IC 95 % [0,97-7,01] pour le 4e quartile d’exposition
le plus élevé comparé au 1er quartile le plus
faible ; p de tendance < 0,01). Cependant, une étude
ultérieure au sein de cette même cohorte n’a pas montré de lien
entre l’exposition à plusieurs insecticides organochlorés, dont
la dieldrine, et la survie des patientes en fonction du statut
de la tumeur vis-à-vis des récepteurs aux œstrogènes (Hoyer et
coll., 2001 ).
). ). Le DDT (isomères o,p’ et p,p’, ce
dernier étant le plus abondant) ainsi que le DDE (isomère p,p’)
ont été dosés dans des prélèvements de sang, obtenus entre 1959
et 1967, chez des jeunes femmes (âge moyen de 26 ans) à
l’occasion d’une de leurs grossesses. Cent vingt-neuf de ces
femmes ayant eu un diagnostic de cancer du sein avant l’âge de
50 ans ont été comparées à 150 femmes de même âge et sans cancer
du sein. Le DDT (isomère p,p’), dans un modèle ajusté aux autres
organochlorés, a été retrouvé associé à un excès de risque de
survenue de cancer du sein (OR = 2,9 ; IC 95 % [1,1-8,0] pour le
3e tercile comparé au 1er). En
fonction de leur âge en 1945, date où l’emploi du DDT a été
généralisé, un excès de risque a été observé chez celles qui
avaient moins de 14 ans à cette date (et moins de 20 ans lorsque
le DDT a atteint son maximum d’utilisation dans le monde au
début des années 1950) (OR = 2,8 ; IC 95 % [1,1-6,8] et
OR = 5,2 ; IC 95 % [1,4-9,1] respectivement pour les
2e et 3e terciles).
). Le DDT (isomères o,p’ et p,p’, ce
dernier étant le plus abondant) ainsi que le DDE (isomère p,p’)
ont été dosés dans des prélèvements de sang, obtenus entre 1959
et 1967, chez des jeunes femmes (âge moyen de 26 ans) à
l’occasion d’une de leurs grossesses. Cent vingt-neuf de ces
femmes ayant eu un diagnostic de cancer du sein avant l’âge de
50 ans ont été comparées à 150 femmes de même âge et sans cancer
du sein. Le DDT (isomère p,p’), dans un modèle ajusté aux autres
organochlorés, a été retrouvé associé à un excès de risque de
survenue de cancer du sein (OR = 2,9 ; IC 95 % [1,1-8,0] pour le
3e tercile comparé au 1er). En
fonction de leur âge en 1945, date où l’emploi du DDT a été
généralisé, un excès de risque a été observé chez celles qui
avaient moins de 14 ans à cette date (et moins de 20 ans lorsque
le DDT a atteint son maximum d’utilisation dans le monde au
début des années 1950) (OR = 2,8 ; IC 95 % [1,1-6,8] et
OR = 5,2 ; IC 95 % [1,4-9,1] respectivement pour les
2e et 3e terciles).Nouvelles données épidémiologiques
Expositions professionnelles
 ; Engel et coll.,
2017
; Engel et coll.,
2017 ; Louis et coll., 2017
; Louis et coll., 2017 ). Lors d’un suivi portant sur
1 059 cas incidents, l’usage d’insecticides organophosphorés a
été retrouvé associé à un risque augmenté de cancer du sein
(RR = 1,20 ; IC 95 % [1,01-1,43]) (Lerro et coll.,
2015
). Lors d’un suivi portant sur
1 059 cas incidents, l’usage d’insecticides organophosphorés a
été retrouvé associé à un risque augmenté de cancer du sein
(RR = 1,20 ; IC 95 % [1,01-1,43]) (Lerro et coll.,
2015 ). Une analyse par matière active a montré que seule
l’utilisation du chlorpyrifos (parmi 8 organophosphorés étudiés)
était associée, à la limite de la signification statistique, à
un risque augmenté de cancer du sein (RR = 1,41 ;
IC 95 % [1,00-1,99]). Une analyse plus approfondie de
l’association avec le chlorpyrifos, en prenant en compte le
statut des récepteurs hormonaux aux œstrogènes (estrogen
receptor ; ER) ou à la progestérone (progesterone
receptor ; PR), a mis en évidence une augmentation de
risque l’association étant plus élevée en cas de tumeur ER-PR-
(RR = 2,26 ; IC 95 % [1,07-4,75]) qu’en cas de tumeur ER+PR+
(RR = 1,37 ; IC 95 % [0,86-2,19]). Un risque augmenté, mais non
statistiquement significatif, a été également constaté en cas
d’utilisation de terbufos (RR = 1,52 ; IC 95 % [0,97-2,36]).
Lors d’un suivi ultérieur portant sur 1 081 cas de cancers du
sein, les auteurs ont rapporté des résultats similaires
concernant le chlorpyrifos (HR = 1,4 ; IC 95 % [1,0-2,0]) et le
terbufos (HR = 1,5 ; IC 95 % [1,0-2,1]) mais aussi un risque
augmenté, non significatif, pour l’usage du coumaphos
(HR = 1,5 ; IC 95 % [0,9-2,5]) (Engel et coll.,
2017
). Une analyse par matière active a montré que seule
l’utilisation du chlorpyrifos (parmi 8 organophosphorés étudiés)
était associée, à la limite de la signification statistique, à
un risque augmenté de cancer du sein (RR = 1,41 ;
IC 95 % [1,00-1,99]). Une analyse plus approfondie de
l’association avec le chlorpyrifos, en prenant en compte le
statut des récepteurs hormonaux aux œstrogènes (estrogen
receptor ; ER) ou à la progestérone (progesterone
receptor ; PR), a mis en évidence une augmentation de
risque l’association étant plus élevée en cas de tumeur ER-PR-
(RR = 2,26 ; IC 95 % [1,07-4,75]) qu’en cas de tumeur ER+PR+
(RR = 1,37 ; IC 95 % [0,86-2,19]). Un risque augmenté, mais non
statistiquement significatif, a été également constaté en cas
d’utilisation de terbufos (RR = 1,52 ; IC 95 % [0,97-2,36]).
Lors d’un suivi ultérieur portant sur 1 081 cas de cancers du
sein, les auteurs ont rapporté des résultats similaires
concernant le chlorpyrifos (HR = 1,4 ; IC 95 % [1,0-2,0]) et le
terbufos (HR = 1,5 ; IC 95 % [1,0-2,1]) mais aussi un risque
augmenté, non significatif, pour l’usage du coumaphos
(HR = 1,5 ; IC 95 % [0,9-2,5]) (Engel et coll.,
2017 ). Au cours d’une étude exclusivement consacrée aux
insecticides organochlorés, aucune association n’a été retrouvée
en lien avec l’utilisation de ces pesticides sauf pour la
dieldrine (Louis et coll., 2017
). Au cours d’une étude exclusivement consacrée aux
insecticides organochlorés, aucune association n’a été retrouvée
en lien avec l’utilisation de ces pesticides sauf pour la
dieldrine (Louis et coll., 2017 ). En effet, parmi les insecticides
organochlorés étudiés (8 au total), seul l’emploi de la
dieldrine est apparu associé à un risque augmenté de cancer du
sein, ce risque étant limité aux femmes porteuses d’une tumeur
ER-PR- (RR = 3,55 ; IC 95 % [1,12-11,18]). À noter que ce
résultat n’a été acquis qu’à partir de 3 cas présentant ces
caractéristiques tumorales.
). En effet, parmi les insecticides
organochlorés étudiés (8 au total), seul l’emploi de la
dieldrine est apparu associé à un risque augmenté de cancer du
sein, ce risque étant limité aux femmes porteuses d’une tumeur
ER-PR- (RR = 3,55 ; IC 95 % [1,12-11,18]). À noter que ce
résultat n’a été acquis qu’à partir de 3 cas présentant ces
caractéristiques tumorales. ). L’activité professionnelle dans le
secteur agricole a été retrouvée associée à un risque augmenté
de survenue du cancer du sein (OR = 1,72 ; IC 95 % [1,04-2,85]).
Cependant, en absence de toute information relative à l’usage de
pesticides, aucune conclusion ne peut en être dérivée s’agissant
de l’impact de ces derniers sur la survenue du cancer du
sein.
). L’activité professionnelle dans le
secteur agricole a été retrouvée associée à un risque augmenté
de survenue du cancer du sein (OR = 1,72 ; IC 95 % [1,04-2,85]).
Cependant, en absence de toute information relative à l’usage de
pesticides, aucune conclusion ne peut en être dérivée s’agissant
de l’impact de ces derniers sur la survenue du cancer du
sein. ). Parmi celles ayant travaillé dans
une exploitation agricole, et à l’aide d’une matrice
emploi-exposition, celles ayant été exposées au parathion-méthyl
présentaient un excès de risque de survenue du cancer du sein
mais limité au 2e tercile d’exposition (OR = 5,28 ;
IC 95 % [1,17-23,7]).
). Parmi celles ayant travaillé dans
une exploitation agricole, et à l’aide d’une matrice
emploi-exposition, celles ayant été exposées au parathion-méthyl
présentaient un excès de risque de survenue du cancer du sein
mais limité au 2e tercile d’exposition (OR = 5,28 ;
IC 95 % [1,17-23,7]).Expositions environnementales
 ). S’agissant des pesticides autres que
les organochlorés, ces mêmes auteurs après examen des 8 études
disponibles dans des circonstances d’exposition non
professionnelles (conjointes d’agriculteurs non applicatrices de
pesticides, résidence à proximité de zones agricoles) estiment
que les études sont encore peu nombreuses et avec des
informations peu spécifiques concernant les matières actives
incriminées pour aboutir à des conclusions significatives dans
un sens ou dans l’autre.
). S’agissant des pesticides autres que
les organochlorés, ces mêmes auteurs après examen des 8 études
disponibles dans des circonstances d’exposition non
professionnelles (conjointes d’agriculteurs non applicatrices de
pesticides, résidence à proximité de zones agricoles) estiment
que les études sont encore peu nombreuses et avec des
informations peu spécifiques concernant les matières actives
incriminées pour aboutir à des conclusions significatives dans
un sens ou dans l’autre. ). Il en est de même pour la
méta-analyse de Ingber et coll. portant sur 46 études publiées
jusqu’en 2013 (mOR = 1,05 ; IC 95 % [0,93-1,18] pour le DDE et
mOR = 1,02 ; IC 95 % [0,92-1,13] pour le DDT) (Ingber et coll.,
2013
). Il en est de même pour la
méta-analyse de Ingber et coll. portant sur 46 études publiées
jusqu’en 2013 (mOR = 1,05 ; IC 95 % [0,93-1,18] pour le DDE et
mOR = 1,02 ; IC 95 % [0,92-1,13] pour le DDT) (Ingber et coll.,
2013 ).
). ). Cette question a été adressée aux femmes ayant résidé
pendant au moins un an à proximité (1 km ou moins) d’une zone
d’activité agricole. Parmi les femmes qui ont déclaré « avoir
déjà remarqué » une dérive de pulvérisation, les auteurs
rapportent un excès de risque de survenue du cancer du sein
(OR = 1,43 ; IC 95 % [1,15-1,78]), et en particulier parmi
celles où cette constatation a été faite avant d’avoir atteint
l’âge de 20 ans (OR = 1,61 ; IC 95 % [1,19,-2,16]). Cette étude
n’apporte aucune information concernant les éventuels pesticides
(familles chimiques ou matière active) concernés et repose sur
une notion de dérive peu précise quant à l’exposition effective
(par exemple, dérive perçue visuellement et/ou par
l’odorat).
). Cette question a été adressée aux femmes ayant résidé
pendant au moins un an à proximité (1 km ou moins) d’une zone
d’activité agricole. Parmi les femmes qui ont déclaré « avoir
déjà remarqué » une dérive de pulvérisation, les auteurs
rapportent un excès de risque de survenue du cancer du sein
(OR = 1,43 ; IC 95 % [1,15-1,78]), et en particulier parmi
celles où cette constatation a été faite avant d’avoir atteint
l’âge de 20 ans (OR = 1,61 ; IC 95 % [1,19,-2,16]). Cette étude
n’apporte aucune information concernant les éventuels pesticides
(familles chimiques ou matière active) concernés et repose sur
une notion de dérive peu précise quant à l’exposition effective
(par exemple, dérive perçue visuellement et/ou par
l’odorat). ). Une étude réalisée en Espagne et portant sur 425 cas
incidents et 1 511 témoins a exploré le lien avec la proximité
de leur domicile à des sites industriels (García-Pérez et coll.,
2018
). Une étude réalisée en Espagne et portant sur 425 cas
incidents et 1 511 témoins a exploré le lien avec la proximité
de leur domicile à des sites industriels (García-Pérez et coll.,
2018 ). Une association positive a été retrouvée en lien avec la
présence de sites industriels situés à moins de 2 km et libérant
des pesticides (sans autre précision) (OR = 2,09 ; IC 95 %
[1,14-3,82]). Au Brésil, une étude comprenant 85 cas incidents
de cancers du sein et 266 témoins a rapporté un excès de risque
de survenue de la maladie chez les femmes résidant à moins de
500 m d’une exploitation agricole ayant recours à des pesticides
(OR = 2,37 ; IC 95 % [1,78-3,16]) (Silva et coll.,
2019
). Une association positive a été retrouvée en lien avec la
présence de sites industriels situés à moins de 2 km et libérant
des pesticides (sans autre précision) (OR = 2,09 ; IC 95 %
[1,14-3,82]). Au Brésil, une étude comprenant 85 cas incidents
de cancers du sein et 266 témoins a rapporté un excès de risque
de survenue de la maladie chez les femmes résidant à moins de
500 m d’une exploitation agricole ayant recours à des pesticides
(OR = 2,37 ; IC 95 % [1,78-3,16]) (Silva et coll.,
2019 ). Une étude réalisée chez 155 cas et 150 témoins en
Californie (comtés de Fresno, Tulare et Kern) a employé comme
indicateur d’exposition l’usage de pesticides agricoles dans un
rayon inférieur à 500 m à leur lieu de résidence (Tayour et
coll., 2019
). Une étude réalisée chez 155 cas et 150 témoins en
Californie (comtés de Fresno, Tulare et Kern) a employé comme
indicateur d’exposition l’usage de pesticides agricoles dans un
rayon inférieur à 500 m à leur lieu de résidence (Tayour et
coll., 2019 ). Une association positive a été
retrouvée avec l’usage du chlorpyrifos (OR = 3,22 ; IC 95 %
[1,38-7,53]) alors qu’une absence d’association a été retrouvée
pour l’usage d’organochlorés (sans autre précision), le diazinon
(un insecticide organophosphoré) et le 1,3 dichloropropène (un
nématicide).
). Une association positive a été
retrouvée avec l’usage du chlorpyrifos (OR = 3,22 ; IC 95 %
[1,38-7,53]) alors qu’une absence d’association a été retrouvée
pour l’usage d’organochlorés (sans autre précision), le diazinon
(un insecticide organophosphoré) et le 1,3 dichloropropène (un
nématicide). ). Au Groenland, Wielsøe et coll. ont rapporté des
concentrations sanguines de DDE plus élevées chez 77 cas de
cancer du sein que chez 84 témoins (Wielsøe et coll.,
2017
). Au Groenland, Wielsøe et coll. ont rapporté des
concentrations sanguines de DDE plus élevées chez 77 cas de
cancer du sein que chez 84 témoins (Wielsøe et coll.,
2017 ). Holmes et coll. en analysant 9 pesticides persistants dans
le sang, n’ont pas trouvé d’associations avec le risque de
survenue du cancer du sein dans une étude comparant 75 cas à
95 témoins en Alaska (Holmes et coll.,
2014
). Holmes et coll. en analysant 9 pesticides persistants dans
le sang, n’ont pas trouvé d’associations avec le risque de
survenue du cancer du sein dans une étude comparant 75 cas à
95 témoins en Alaska (Holmes et coll.,
2014 ). En Tunisie, Arrebola et coll., en comparant les taux
sériques de cinq organochlorés chez 69 cas à 56 témoins, ont mis
en évidence une association entre une concentration élevée de
β-hexachlorocyclohexane (OR = 1,18 ; IC 95 % [1,05-1,34]) et le
risque de cancer du sein (Arrebola et coll.,
2015
). En Tunisie, Arrebola et coll., en comparant les taux
sériques de cinq organochlorés chez 69 cas à 56 témoins, ont mis
en évidence une association entre une concentration élevée de
β-hexachlorocyclohexane (OR = 1,18 ; IC 95 % [1,05-1,34]) et le
risque de cancer du sein (Arrebola et coll.,
2015 ). Dans une étude cas-témoins hospitalière (56 cas et
46 témoins) réalisée en Chine, He et coll. ont mesuré les
concentrations de six pesticides organochlorés dans des
prélèvements de tissus adipeux du sein (He et coll.,
2017
). Dans une étude cas-témoins hospitalière (56 cas et
46 témoins) réalisée en Chine, He et coll. ont mesuré les
concentrations de six pesticides organochlorés dans des
prélèvements de tissus adipeux du sein (He et coll.,
2017 ). Les auteurs concluent à une augmentation du risque de
survenue de cancer du sein alors que les résultats montrent
l’inverse (OR = 0,129 ; IC 95 % [0,031-0,542] pour le DDE). Une
étude réalisée au Pakistan chez 83 cas de cancers (incluant les
cancers du sein) et 32 témoins a rapporté que la moyenne de la
somme de la concentration sanguine de 14 pesticides
organochlorés était plus élevée chez les cas de cancer du sein
(nombre non précisé) que chez les témoins (Attaullah et coll.,
2018
). Les auteurs concluent à une augmentation du risque de
survenue de cancer du sein alors que les résultats montrent
l’inverse (OR = 0,129 ; IC 95 % [0,031-0,542] pour le DDE). Une
étude réalisée au Pakistan chez 83 cas de cancers (incluant les
cancers du sein) et 32 témoins a rapporté que la moyenne de la
somme de la concentration sanguine de 14 pesticides
organochlorés était plus élevée chez les cas de cancer du sein
(nombre non précisé) que chez les témoins (Attaullah et coll.,
2018 ).
). ). L’exposition a été estimée par la
mesure de la concentration sanguine des pesticides à l’occasion
du diagnostic. Après un suivi de 5 et 15 ans, 55 et 189 décès
toutes causes confondues ont été constatés dont 36 et
74 attribuables au cancer du sein. À 5 ans, le tercile le plus
élevé de la concentration en DDT était associé à un excès de
décès toutes causes confondues (HR = 2,19 ; IC 95 %
[1,02-4,67] ; p de tendance = 0,02) et à un excès de décès
spécifique par cancer du sein (HR = 2,72 ; IC 95 % [1,04-7,13] ;
p de tendance = 0,02). Cependant, à 15 ans, aucune association
statistiquement significative n’a été observée. Les mêmes
auteurs, en partant d’une autre population de cas incidents de
cancers invasifs du sein (n = 748) au cours de la période
1993-1996 aux États-Unis, se sont également intéressés à la
survie au terme d’un suivi médian de 20,6 années (Parada Jr et
coll., 2019
). L’exposition a été estimée par la
mesure de la concentration sanguine des pesticides à l’occasion
du diagnostic. Après un suivi de 5 et 15 ans, 55 et 189 décès
toutes causes confondues ont été constatés dont 36 et
74 attribuables au cancer du sein. À 5 ans, le tercile le plus
élevé de la concentration en DDT était associé à un excès de
décès toutes causes confondues (HR = 2,19 ; IC 95 %
[1,02-4,67] ; p de tendance = 0,02) et à un excès de décès
spécifique par cancer du sein (HR = 2,72 ; IC 95 % [1,04-7,13] ;
p de tendance = 0,02). Cependant, à 15 ans, aucune association
statistiquement significative n’a été observée. Les mêmes
auteurs, en partant d’une autre population de cas incidents de
cancers invasifs du sein (n = 748) au cours de la période
1993-1996 aux États-Unis, se sont également intéressés à la
survie au terme d’un suivi médian de 20,6 années (Parada Jr et
coll., 2019 ). L’exposition au DDT et au DDE a été
estimée par la mesure de leur concentration sanguine à
l’occasion du diagnostic. Au terme d’un suivi de 5 ans, ni le
DDT ni le DDE n’ont été retrouvés associés à la mortalité toutes
causes ou à la mortalité spécifique par cancer du sein. En
revanche, au terme d’un suivi à 20 ans, le DDE (HR = 1,95 ;
IC 95 % [1,31-2,92] pour le 3e tercile comparé au
1er) et le DDT (HR = 1,64 ; IC 95 % [1,10-2,44]
pour le quantile le plus élevé comparé au quantile avec des
concentrations en dessous de la limite de détection) ont été
retrouvés associés à un excès de risque de décès toutes causes
confondues. S’agissant de la mortalité spécifique par cancer du
sein après 20 ans de suivi, les concentrations en DDE
supérieures à la médiane (groupe de référence : DDE en dessous
de la médiane) ont été retrouvées associées à une augmentation
de risque de décès (HR = 1,69 ; IC 95 % [1,06-2,68]). Le risque
était plus élevé chez celles qui présentaient une tumeur ER-
(HR = 3,24 ; IC 95 % [1,38-7,58]) comparé à celles qui
présentaient une tumeur ER+ (HR = 1,29 ; IC 95 % [0,73-2,28])
avec une interaction significative (p = 0,03).
). L’exposition au DDT et au DDE a été
estimée par la mesure de leur concentration sanguine à
l’occasion du diagnostic. Au terme d’un suivi de 5 ans, ni le
DDT ni le DDE n’ont été retrouvés associés à la mortalité toutes
causes ou à la mortalité spécifique par cancer du sein. En
revanche, au terme d’un suivi à 20 ans, le DDE (HR = 1,95 ;
IC 95 % [1,31-2,92] pour le 3e tercile comparé au
1er) et le DDT (HR = 1,64 ; IC 95 % [1,10-2,44]
pour le quantile le plus élevé comparé au quantile avec des
concentrations en dessous de la limite de détection) ont été
retrouvés associés à un excès de risque de décès toutes causes
confondues. S’agissant de la mortalité spécifique par cancer du
sein après 20 ans de suivi, les concentrations en DDE
supérieures à la médiane (groupe de référence : DDE en dessous
de la médiane) ont été retrouvées associées à une augmentation
de risque de décès (HR = 1,69 ; IC 95 % [1,06-2,68]). Le risque
était plus élevé chez celles qui présentaient une tumeur ER-
(HR = 3,24 ; IC 95 % [1,38-7,58]) comparé à celles qui
présentaient une tumeur ER+ (HR = 1,29 ; IC 95 % [0,73-2,28])
avec une interaction significative (p = 0,03). ). Cette étude, réalisée au sein de la
Child Health and Development Studies, s’était limitée
à la survenue de ce cancer avant l’âge de 50 ans, c’est-à-dire
avant la ménopause, l’exposition ayant été estimée par la mesure
de la concentration plasmatique en DDT à l’occasion d’une de
leurs grossesses (âge moyen de 26 ans). Les auteurs ont montré
que les concentrations sanguines en DDT étaient associées à un
excès de risque de survenue de cancer du sein, notamment chez
celles qui avaient moins de 14 ans au début des années 1950
(correspondant au maximum d’utilisation du DDT dans le monde).
Ces mêmes auteurs ont, dans une publication récente (Cohn et
coll., 2019
). Cette étude, réalisée au sein de la
Child Health and Development Studies, s’était limitée
à la survenue de ce cancer avant l’âge de 50 ans, c’est-à-dire
avant la ménopause, l’exposition ayant été estimée par la mesure
de la concentration plasmatique en DDT à l’occasion d’une de
leurs grossesses (âge moyen de 26 ans). Les auteurs ont montré
que les concentrations sanguines en DDT étaient associées à un
excès de risque de survenue de cancer du sein, notamment chez
celles qui avaient moins de 14 ans au début des années 1950
(correspondant au maximum d’utilisation du DDT dans le monde).
Ces mêmes auteurs ont, dans une publication récente (Cohn et
coll., 2019 ), étudié le risque de survenue du
cancer du sein pendant la période de transition de la ménopause
(50 à 54 ans). Un excès de risque a été observé (OR pour le
doublement de la concentration en p,p’ DDT = 1,99 ; IC 95 %
[1,48-2,67]). Cependant, tenant compte de l’âge qu’elles avaient
en 1945 (date où l’emploi du DDT a été généralisé), cet excès de
risque n’était observé que chez celles qui avaient plus de 14
ans à cette date (OR pour le doublement de la concentration en
p,p’ DDT = 2,83 ; IC 95 % [1,96-4,10]).
), étudié le risque de survenue du
cancer du sein pendant la période de transition de la ménopause
(50 à 54 ans). Un excès de risque a été observé (OR pour le
doublement de la concentration en p,p’ DDT = 1,99 ; IC 95 %
[1,48-2,67]). Cependant, tenant compte de l’âge qu’elles avaient
en 1945 (date où l’emploi du DDT a été généralisé), cet excès de
risque n’était observé que chez celles qui avaient plus de 14
ans à cette date (OR pour le doublement de la concentration en
p,p’ DDT = 2,83 ; IC 95 % [1,96-4,10]). ). Cent dix-huit cas de cancer du sein
ont ainsi été comparés à 354 témoins appariés à l’âge de
naissance. L’exposition maternelle pendant la grossesse au DDT
(isomère o,p’), dans un modèle ajusté sur les autres
organochlorés, était associée chez les filles à un excès de
risque de survenue de cancer du sein (OR = 3,7 ; IC 95 %
[1,5-9,0] pour le 4e quartile ; p de
tendance = 0,05).
). Cent dix-huit cas de cancer du sein
ont ainsi été comparés à 354 témoins appariés à l’âge de
naissance. L’exposition maternelle pendant la grossesse au DDT
(isomère o,p’), dans un modèle ajusté sur les autres
organochlorés, était associée chez les filles à un excès de
risque de survenue de cancer du sein (OR = 3,7 ; IC 95 %
[1,5-9,0] pour le 4e quartile ; p de
tendance = 0,05). ). Parmi les 50 756 femmes sans cancer du sein incluses au
cours de la période 2003-2009, 2 134 ont développé un cancer du
sein lors d’un suivi moyen de 5 ans à compter de leur date
d’inclusion dans la cohorte. Les informations relatives aux
expositions résidentielles et agricoles aux pesticides ont été
recueillies par questionnaire à l’inclusion dans l’étude. Une
attention particulière a été portée sur le parcours résidentiel
avant l’âge de 14 ans ainsi que sur la nature de leur résidence
au regard d’une activité agricole (exploitation agricole) et de
l’usage de pesticides. Aucune association n’a été observée entre
l’exposition aux pesticides dans l’enfance et l’adolescence
(avant 14 ans) et le risque de survenue du cancer du sein, quel
que soit le statut hormonal de la tumeur. Seules les femmes
âgées de moins de 18 ans lors de l’interdiction du DDT aux
États-Unis en 1972 présentaient un risque augmenté de cancer du
sein, à la limite de la signification statistique (HR = 1,1 ;
IC 95 % [0,99-1,30]).
). Parmi les 50 756 femmes sans cancer du sein incluses au
cours de la période 2003-2009, 2 134 ont développé un cancer du
sein lors d’un suivi moyen de 5 ans à compter de leur date
d’inclusion dans la cohorte. Les informations relatives aux
expositions résidentielles et agricoles aux pesticides ont été
recueillies par questionnaire à l’inclusion dans l’étude. Une
attention particulière a été portée sur le parcours résidentiel
avant l’âge de 14 ans ainsi que sur la nature de leur résidence
au regard d’une activité agricole (exploitation agricole) et de
l’usage de pesticides. Aucune association n’a été observée entre
l’exposition aux pesticides dans l’enfance et l’adolescence
(avant 14 ans) et le risque de survenue du cancer du sein, quel
que soit le statut hormonal de la tumeur. Seules les femmes
âgées de moins de 18 ans lors de l’interdiction du DDT aux
États-Unis en 1972 présentaient un risque augmenté de cancer du
sein, à la limite de la signification statistique (HR = 1,1 ;
IC 95 % [0,99-1,30]). ).
).Cancer du sein chez l’homme
 ). Il est admis que le cancer du sein
chez l’homme correspond à la même entité pathologique que celle
décrite chez la femme (Thomas,
1993
). Il est admis que le cancer du sein
chez l’homme correspond à la même entité pathologique que celle
décrite chez la femme (Thomas,
1993 ). On y observe les mêmes types histologiques, l’expression
des mêmes récepteurs hormonaux (aux œstrogènes notamment) et une
fréquence élevée de mutations des gènes BRCA1 ou
BRCA2 (Stalsberg et coll.,
1993
). On y observe les mêmes types histologiques, l’expression
des mêmes récepteurs hormonaux (aux œstrogènes notamment) et une
fréquence élevée de mutations des gènes BRCA1 ou
BRCA2 (Stalsberg et coll.,
1993 ; Thomas, 1993
; Thomas, 1993 ). L’étiologie est inconnue mais il
est bien établi que les entités nosologiques associées à des
déséquilibres entre androgènes et œstrogènes, notamment le
syndrome de Klinefelter, favorisent la survenue du cancer du
sein (Fentiman, 2018
). L’étiologie est inconnue mais il
est bien établi que les entités nosologiques associées à des
déséquilibres entre androgènes et œstrogènes, notamment le
syndrome de Klinefelter, favorisent la survenue du cancer du
sein (Fentiman, 2018 ). L’exposition à des radiations
ionisantes est un facteur de risque unanimement reconnu. À
l’inverse, le rôle des expositions à des champs
électromagnétiques ou à la chaleur (foyers thermiques radiants)
est encore débattu (Weiss et coll.,
2005
). L’exposition à des radiations
ionisantes est un facteur de risque unanimement reconnu. À
l’inverse, le rôle des expositions à des champs
électromagnétiques ou à la chaleur (foyers thermiques radiants)
est encore débattu (Weiss et coll.,
2005 ; Fentiman et coll., 2006
; Fentiman et coll., 2006 ; Ruddy et Winer,
2013
; Ruddy et Winer,
2013 ). Il existe très peu d’études s’intéressant au rôle des
pesticides dans la survenue du cancer du sein chez l’homme. Une
cohorte historique suédoise comprenant 1 779 646 employés,
entreprise en 1971 et ayant fait l’objet d’un suivi de 19 ans,
n’a pu observer de lien entre des métiers exercés dans le
secteur agricole et le risque de survenue du cancer du sein
(Pollán et coll., 2001
). Il existe très peu d’études s’intéressant au rôle des
pesticides dans la survenue du cancer du sein chez l’homme. Une
cohorte historique suédoise comprenant 1 779 646 employés,
entreprise en 1971 et ayant fait l’objet d’un suivi de 19 ans,
n’a pu observer de lien entre des métiers exercés dans le
secteur agricole et le risque de survenue du cancer du sein
(Pollán et coll., 2001 ). Une étude portant sur 178 cas et
1 041 témoins aux États-Unis n’a pas montré d’associations entre
l’exposition professionnelle aux herbicides ou à d’autres types
de pesticides et le risque de survenue de la maladie (Cocco et
coll., 1998
). Une étude portant sur 178 cas et
1 041 témoins aux États-Unis n’a pas montré d’associations entre
l’exposition professionnelle aux herbicides ou à d’autres types
de pesticides et le risque de survenue de la maladie (Cocco et
coll., 1998 ). En Europe, une étude ayant comparé
104 cas à 1 901 témoins n’a pas montré d’excès de risque chez
les agriculteurs, qu’ils soient exploitants ou salariés
(Villeneuve et coll., 2010
). En Europe, une étude ayant comparé
104 cas à 1 901 témoins n’a pas montré d’excès de risque chez
les agriculteurs, qu’ils soient exploitants ou salariés
(Villeneuve et coll., 2010 ). À ce jour, aucune étude portant
sur des familles chimiques ou matière active et le risque de
cancer du sein chez l’homme n’a été publiée. Cela n’est guère
surprenant tenant compte de la rareté de la maladie. Pour
autant, les quelques études réalisées à ce jour ne soutiennent
pas un rôle important des pesticides dans la genèse du cancer du
sein masculin.
). À ce jour, aucune étude portant
sur des familles chimiques ou matière active et le risque de
cancer du sein chez l’homme n’a été publiée. Cela n’est guère
surprenant tenant compte de la rareté de la maladie. Pour
autant, les quelques études réalisées à ce jour ne soutiennent
pas un rôle important des pesticides dans la genèse du cancer du
sein masculin.Données mécanistiques
Dieldrine, DDT et autres pesticides organochlorés
 ) avec
parfois d’autres organochlorés présentant des propriétés
similaires (ou parfois opposées) sur le plan mécanistique.
) avec
parfois d’autres organochlorés présentant des propriétés
similaires (ou parfois opposées) sur le plan mécanistique. | Figure 13.1 Résumé des effets de la dieldrine en lien avec un effet susceptible de favoriser la survenue du cancer du sein |
 ). Ces effets sont souvent étudiés en
utilisant in vitro le modèle MCF-7, cellule tumorale
mammaire humaine exprimant le ERα dont la croissance est
dépendante d’un stimulus œstrogénique (Verma et coll.,
1997
). Ces effets sont souvent étudiés en
utilisant in vitro le modèle MCF-7, cellule tumorale
mammaire humaine exprimant le ERα dont la croissance est
dépendante d’un stimulus œstrogénique (Verma et coll.,
1997 ; Arcaro et coll., 1998
; Arcaro et coll., 1998 ; Charles et coll.,
2002
; Charles et coll.,
2002 ; Rasmussen et Nielsen, 2002
; Rasmussen et Nielsen, 2002 ; Aube et coll.,
2011
; Aube et coll.,
2011 )
ou in vivo un modèle de croissance utérine chez les
rongeurs (très sensible à l’imprégnation œstrogénique)
(Ramamoorthy et coll., 1997
)
ou in vivo un modèle de croissance utérine chez les
rongeurs (très sensible à l’imprégnation œstrogénique)
(Ramamoorthy et coll., 1997 ; Wade et coll.,
1997
; Wade et coll.,
1997 ). Les effets pro-œstrogéniques observés dans les cellules
MCF-7 ont été confirmés dans d’autres lignées tumorales
mammaires humaines ER+ comme les T47D (Legler et coll.,
1999
). Les effets pro-œstrogéniques observés dans les cellules
MCF-7 ont été confirmés dans d’autres lignées tumorales
mammaires humaines ER+ comme les T47D (Legler et coll.,
1999 ). Les organochlorés ont en général des effets
pro-œstrogéniques pour des concentrations supérieures à 1 µM
(c’est-à-dire relativement élevées) (Andersen et coll.,
2002
). Les organochlorés ont en général des effets
pro-œstrogéniques pour des concentrations supérieures à 1 µM
(c’est-à-dire relativement élevées) (Andersen et coll.,
2002 ). Toutefois, le toxaphène peut être décrit comme faiblement
anti-œstrogénique car il peut réduire la formation de « foci »
de cellules MCF-7 en présence d’œstradiol. Toutefois, il ne
semble pas en mesure de lier le récepteur ERα, il semblerait
donc important de confirmer ce dernier résultat et d’apporter
des éléments mécanistiques pour expliquer la réduction du nombre
de foci, précédemment décrite (Arcaro et coll.,
2000
). Toutefois, le toxaphène peut être décrit comme faiblement
anti-œstrogénique car il peut réduire la formation de « foci »
de cellules MCF-7 en présence d’œstradiol. Toutefois, il ne
semble pas en mesure de lier le récepteur ERα, il semblerait
donc important de confirmer ce dernier résultat et d’apporter
des éléments mécanistiques pour expliquer la réduction du nombre
de foci, précédemment décrite (Arcaro et coll.,
2000 ).
). ). Un traitement pendant 16 h avec les agents à une
concentration de 10 µM provoque l’activation de l’ERα et de
l’ERβ pour cinq des organochlorés testés ; chlordane, o,p’-DDT
(seul et en mélange avec le p,p’-DDT), trans-nonachlore,
toxaphène. Cinq des pesticides organochlorés activaient l’ERα
uniquement ; chlordécone, dieldrine, endosulfan, endrine,
méthoxychlore. Un effet de compétition avec l’œstradiol (ou
antagonisme des organochlorés vis-à-vis de l’œstradiol et du
ERα) a été montré pour le chlordécone, le méthoxychlore,
l’endosulfan, l’endrine, la dieldrine et l’aldrine. On peut
ainsi noter que la dieldrine active l’ERα (considéré comme
pro-tumoral car favorisant la prolifération) et pas l’ERβ
(souvent associé à un bon pronostic après analyse histologique
de tumeurs mammaires).
). Un traitement pendant 16 h avec les agents à une
concentration de 10 µM provoque l’activation de l’ERα et de
l’ERβ pour cinq des organochlorés testés ; chlordane, o,p’-DDT
(seul et en mélange avec le p,p’-DDT), trans-nonachlore,
toxaphène. Cinq des pesticides organochlorés activaient l’ERα
uniquement ; chlordécone, dieldrine, endosulfan, endrine,
méthoxychlore. Un effet de compétition avec l’œstradiol (ou
antagonisme des organochlorés vis-à-vis de l’œstradiol et du
ERα) a été montré pour le chlordécone, le méthoxychlore,
l’endosulfan, l’endrine, la dieldrine et l’aldrine. On peut
ainsi noter que la dieldrine active l’ERα (considéré comme
pro-tumoral car favorisant la prolifération) et pas l’ERβ
(souvent associé à un bon pronostic après analyse histologique
de tumeurs mammaires). ). La rapidité de ces effets, qui ont
été constatés à des concentrations relativement élevées, suggère
l’activation de voies de signalisation non transcriptionnelles.
De même, Cameron et Foster montrent que la dieldrine bloque
l’apoptose de cellules MDA-MB-231 induite par leur détachement
du support de culture (anoïkis2
). Les doses utilisées (0,5-10 µM ou
0,2-3,8 ppm) ont été sélectionnées sur la base d’une
modélisation simple en comparaison des concentrations retrouvées
dans le tissu mammaire (épithélium et adipocytes,
0,17-0,90 ppm). La résistance à l’anoïkis est observée à partir
de 5 µM et est associée avec une diminution de l’expression de
l’effecteur pro-apoptotique Bax (Cameron et Foster,
2008
). La rapidité de ces effets, qui ont
été constatés à des concentrations relativement élevées, suggère
l’activation de voies de signalisation non transcriptionnelles.
De même, Cameron et Foster montrent que la dieldrine bloque
l’apoptose de cellules MDA-MB-231 induite par leur détachement
du support de culture (anoïkis2
). Les doses utilisées (0,5-10 µM ou
0,2-3,8 ppm) ont été sélectionnées sur la base d’une
modélisation simple en comparaison des concentrations retrouvées
dans le tissu mammaire (épithélium et adipocytes,
0,17-0,90 ppm). La résistance à l’anoïkis est observée à partir
de 5 µM et est associée avec une diminution de l’expression de
l’effecteur pro-apoptotique Bax (Cameron et Foster,
2008 ). L’effet est bloqué par un antagoniste du récepteur tyrosine
kinase TrkB, dont l’expression est aussi augmentée in
vivo dans un modèle murin de tumori-genèse mammaire
(Cameron et Foster, 2009
). L’effet est bloqué par un antagoniste du récepteur tyrosine
kinase TrkB, dont l’expression est aussi augmentée in
vivo dans un modèle murin de tumori-genèse mammaire
(Cameron et Foster, 2009 ). Cette action de la dieldrine sur un
récepteur tyrosine kinase est à mettre en parallèle de celle
observée par Buteau-Lozano et coll. qui montrent une
augmentation de sécrétion et production de VEGF (facteur clé
intervenant dans l’angiogenèse) dans une lignée dérivée des
cellules MCF-7 (Buteau-Lozano et coll.,
2008
). Cette action de la dieldrine sur un
récepteur tyrosine kinase est à mettre en parallèle de celle
observée par Buteau-Lozano et coll. qui montrent une
augmentation de sécrétion et production de VEGF (facteur clé
intervenant dans l’angiogenèse) dans une lignée dérivée des
cellules MCF-7 (Buteau-Lozano et coll.,
2008 ).
). ). Le traitement avec un mélange de plusieurs organochlorés
(p,p’-DDD ; p,p’-DDE ; o,p’-DDE ; aldrine ; dieldrine) conduit à
une augmentation de l’expression de plusieurs gènes (sur
94 testés) dont ACVRL1 (inhibition de l’angiogenèse),
KIT et ERBB3 (récepteurs dont l’activation
conduit à une prolifération cellulaire),PDGFRB (récepteur
pro-angiogénique) et ACVR1C (récepteur apparenté à ceux
activés par le TGF-β), aucun d’entre eux n’étant stimulé par
l’œstradiol. Les organochlorés ont été testés à des
concentrations 100 fois supérieures à celles constatées dans le
sérum d’une population générale espagnole (Îles Canaries). De
telles concentrations sont pertinentes dans la mesure où il est
assumé pour de nombreux organochlorés que leurs concentrations
dans les tissus adipeux sont 100 fois supérieures à celles
mesurées dans le sérum. Cette étude suggère l’existence de
mécanismes stimulés par les organochlorés autres que les
récepteurs aux œstrogènes dans les cellules mammaires.
). Le traitement avec un mélange de plusieurs organochlorés
(p,p’-DDD ; p,p’-DDE ; o,p’-DDE ; aldrine ; dieldrine) conduit à
une augmentation de l’expression de plusieurs gènes (sur
94 testés) dont ACVRL1 (inhibition de l’angiogenèse),
KIT et ERBB3 (récepteurs dont l’activation
conduit à une prolifération cellulaire),PDGFRB (récepteur
pro-angiogénique) et ACVR1C (récepteur apparenté à ceux
activés par le TGF-β), aucun d’entre eux n’étant stimulé par
l’œstradiol. Les organochlorés ont été testés à des
concentrations 100 fois supérieures à celles constatées dans le
sérum d’une population générale espagnole (Îles Canaries). De
telles concentrations sont pertinentes dans la mesure où il est
assumé pour de nombreux organochlorés que leurs concentrations
dans les tissus adipeux sont 100 fois supérieures à celles
mesurées dans le sérum. Cette étude suggère l’existence de
mécanismes stimulés par les organochlorés autres que les
récepteurs aux œstrogènes dans les cellules mammaires. ). Néanmoins, l’article soulève un
point intéressant concernant le statut des tumeurs vis-à-vis de
l’expression du ERα, suggérant que la dieldrine soit plutôt
associée aux cancers ER (et ainsi un mode d’action non
œstrogénique). Ces éléments doivent être interprétés avec
prudence car ils peuvent avoir une dimension temporelle ; on
pourrait ainsi poser l’hypothèse que l’antagonisme de la
dieldrine vis-à-vis de l’œstradiol par compétition sur le même
site de liaison sur le ERα, favorise lors de la sélection
clonale, les cellules tumorales pouvant se multiplier sans
dépendance du ERα.
). Néanmoins, l’article soulève un
point intéressant concernant le statut des tumeurs vis-à-vis de
l’expression du ERα, suggérant que la dieldrine soit plutôt
associée aux cancers ER (et ainsi un mode d’action non
œstrogénique). Ces éléments doivent être interprétés avec
prudence car ils peuvent avoir une dimension temporelle ; on
pourrait ainsi poser l’hypothèse que l’antagonisme de la
dieldrine vis-à-vis de l’œstradiol par compétition sur le même
site de liaison sur le ERα, favorise lors de la sélection
clonale, les cellules tumorales pouvant se multiplier sans
dépendance du ERα.Chlorpyrifos
 ). Des expérimentations plus récentes
vont dans ce sens et ne démontrent que de très faibles effets
cytotoxiques, prolifératifs et de la stimulation de l’ER sur
cette même lignée de cellules à des doses élevées (≥ 50 µM)
(Andersen et coll., 2002
). Des expérimentations plus récentes
vont dans ce sens et ne démontrent que de très faibles effets
cytotoxiques, prolifératifs et de la stimulation de l’ER sur
cette même lignée de cellules à des doses élevées (≥ 50 µM)
(Andersen et coll., 2002 ).
). ), un effet cytotoxique a également été démontré par Rich et
coll. sur les cellules MCF-7 traitées avec le CPF à 10 µM (Rich
et coll., 2012
), un effet cytotoxique a également été démontré par Rich et
coll. sur les cellules MCF-7 traitées avec le CPF à 10 µM (Rich
et coll., 2012 ). Ces résultats ont été confirmés
dans une étude subséquente par Ventura et coll. qui montrent que
ce blocage est lié à une altération des défenses anti-oxydantes
(toujours à 50 µM) avec une phosphorylation de ERK1/2 provoquée
par les espèces réactives de l’oxygène
(H2O2) (Ventura et coll.,
2015
). Ces résultats ont été confirmés
dans une étude subséquente par Ventura et coll. qui montrent que
ce blocage est lié à une altération des défenses anti-oxydantes
(toujours à 50 µM) avec une phosphorylation de ERK1/2 provoquée
par les espèces réactives de l’oxygène
(H2O2) (Ventura et coll.,
2015 ). Considérées dans leur ensemble, ces données vont dans le
sens d’une absence d’effet (ou d’un faible effet) du CPF à forte
dose (figure 13.2
). Considérées dans leur ensemble, ces données vont dans le
sens d’une absence d’effet (ou d’un faible effet) du CPF à forte
dose (figure 13.2 ).
). ). Sur de plus courtes périodes de traitement et à des doses
encore plus faibles (10 nM, 48 h), cet effet n’est pas observé
(Rich et coll., 2012
). Sur de plus courtes périodes de traitement et à des doses
encore plus faibles (10 nM, 48 h), cet effet n’est pas observé
(Rich et coll., 2012 ) soulignant que cet effet
pro-œstrogénique du CPF serait observé à de faibles doses mais
aussi sur de longues périodes d’exposition.
) soulignant que cet effet
pro-œstrogénique du CPF serait observé à de faibles doses mais
aussi sur de longues périodes d’exposition. ). Une exposition à des doses encore plus faibles (0,01 et
1 mg/kg pc/j pendant une période doublée de 100 jours) de rates
Sprague-Dawley adultes, révèle également une perturbation de
l’architecture de la glande mammaire, des hyperplasies et au
niveau moléculaire, une expression augmentée du récepteur de la
progestérone et du marqueur de prolifération PCNA
(proliferating cell nuclear antigen) et, à l’inverse,
une réduction de l’expression de corépresseurs des récepteurs
des œstrogènes. Les concentrations sériques de l’œstradiol, de
la progestérone et de l’hormone lutéinisante (LH) sont diminuées
(Ventura et coll., 2016
). Une exposition à des doses encore plus faibles (0,01 et
1 mg/kg pc/j pendant une période doublée de 100 jours) de rates
Sprague-Dawley adultes, révèle également une perturbation de
l’architecture de la glande mammaire, des hyperplasies et au
niveau moléculaire, une expression augmentée du récepteur de la
progestérone et du marqueur de prolifération PCNA
(proliferating cell nuclear antigen) et, à l’inverse,
une réduction de l’expression de corépresseurs des récepteurs
des œstrogènes. Les concentrations sériques de l’œstradiol, de
la progestérone et de l’hormone lutéinisante (LH) sont diminuées
(Ventura et coll., 2016 ). Les mêmes auteurs ont étudié
l’effet de l’exposition chronique au CPF (aux mêmes doses que
précédemment ; 0,01 et 1 mg/kg pc/j) sur l’incidence de tumeurs
induites par le N-nitroso-N-méthylurée ; les deux doses de CPF
provoquent une réduction de la période de latence tumorale
(Ventura et coll., 2019
). Les mêmes auteurs ont étudié
l’effet de l’exposition chronique au CPF (aux mêmes doses que
précédemment ; 0,01 et 1 mg/kg pc/j) sur l’incidence de tumeurs
induites par le N-nitroso-N-méthylurée ; les deux doses de CPF
provoquent une réduction de la période de latence tumorale
(Ventura et coll., 2019 ).
). | Figure 13.2 Résumé des effets du chlorpyrifos en lien avec un effet susceptible de favoriser la survenue du cancer du sein |
Néonicotinoïdes
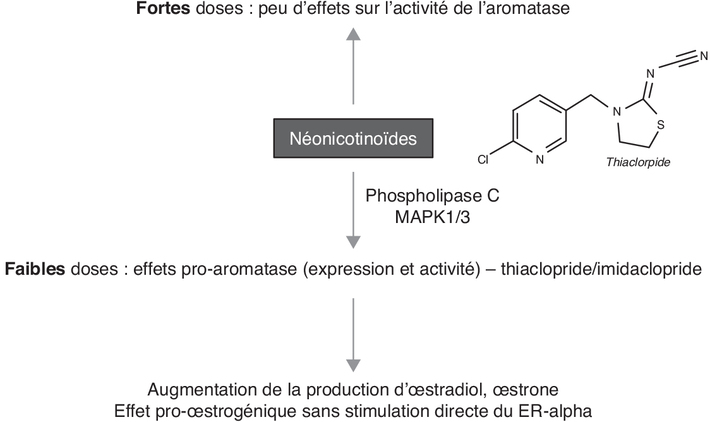
 ). En 2016, Caron-Baudoin et coll.,
partant du fait que certains pesticides comme l’atrazine
(interdite au sein de l’UE en 2003) sont des activateurs de
l’expression de l’aromatase, ont évalué les effets de trois
pesticides de la famille des néonicotinoïdes sur ce système
(Caron-Beaudoin et coll., 2016
). En 2016, Caron-Baudoin et coll.,
partant du fait que certains pesticides comme l’atrazine
(interdite au sein de l’UE en 2003) sont des activateurs de
l’expression de l’aromatase, ont évalué les effets de trois
pesticides de la famille des néonicotinoïdes sur ce système
(Caron-Beaudoin et coll., 2016 ). L’imidaclopride, le thiaclopride,
et le thiaméthoxame ont été testés à des concentrations entre
0,1 et 10 µM sur une lignée cellulaire humaine de carcinome
surrénalien (H295R) et une lignée de cellules endothéliales de
la veine ombilicale humaine (HUVEC). Les résultats sont
intéressants à plus d’un titre (figure 13.3
). L’imidaclopride, le thiaclopride,
et le thiaméthoxame ont été testés à des concentrations entre
0,1 et 10 µM sur une lignée cellulaire humaine de carcinome
surrénalien (H295R) et une lignée de cellules endothéliales de
la veine ombilicale humaine (HUVEC). Les résultats sont
intéressants à plus d’un titre (figure 13.3 ). Le thiaclopride et le thiaméthoxame
présentent un profil activant l’expression de l’aromatase (pour
l’un de ses promoteurs), tandis que l’imidaclopride a un effet
inhibiteur sur les cellules H295R. Les effets sont de nature
non-monotone dans ces mêmes cellules, avec une activation
significative (12,7x) de l’aromatase par le thiaclopride à
0,3 µM ou par le thiaméthoxame à 0,1 µM (12,2x ou 15,7x en
fonction du promoteur considéré) qui n’est plus ou très
faiblement observée à des doses plus élevées. Les auteurs
renforcent leur démonstration par la mesure de la viabilité
cellulaire qui est inchangée à toutes les doses évaluées. La
diminution observée avec le traitement à l’imidaclopride (3 µM)
n’est plus constatée aux doses supérieures. Ces effets sont
cellule-spécifiques car non observés dans les expériences sur
les HUVEC. La mesure d’activité de l’enzyme aromatase dans les
cellules H295R, suit les profils d’expression, détaillés
ci-dessus.
). Le thiaclopride et le thiaméthoxame
présentent un profil activant l’expression de l’aromatase (pour
l’un de ses promoteurs), tandis que l’imidaclopride a un effet
inhibiteur sur les cellules H295R. Les effets sont de nature
non-monotone dans ces mêmes cellules, avec une activation
significative (12,7x) de l’aromatase par le thiaclopride à
0,3 µM ou par le thiaméthoxame à 0,1 µM (12,2x ou 15,7x en
fonction du promoteur considéré) qui n’est plus ou très
faiblement observée à des doses plus élevées. Les auteurs
renforcent leur démonstration par la mesure de la viabilité
cellulaire qui est inchangée à toutes les doses évaluées. La
diminution observée avec le traitement à l’imidaclopride (3 µM)
n’est plus constatée aux doses supérieures. Ces effets sont
cellule-spécifiques car non observés dans les expériences sur
les HUVEC. La mesure d’activité de l’enzyme aromatase dans les
cellules H295R, suit les profils d’expression, détaillés
ci-dessus. ).
). ). Les auteurs ont utilisé des
inhibiteurs pharmacologiques de voies de signalisation afin
d’éclairer les mécanismes potentiellement impliqués : les deux
néonicotinoïdes utilisés stimuleraient la voie de la
phospholipase (le thiaclopride stimulant également la voie
MEK/MAPK 1/3 qui, indépendamment de son effet sur la
transcription de l’aromatase, stimulerait la prolifération
cellulaire). Cette description est importante car l’une des
voies les plus étudiées en première intention pour tester un
effet pro-tumoral dans le contexte du cancer du sein est celle
des récepteurs aux œstrogènes (l’isoforme ERα jouant un rôle
pro-prolifératif). Or, Mesnage et coll. ont récemment évalué le
potentiel œstrogénique de sept néonicotinoïdes les plus utilisés
à travers un test de prolifération des cellules MCF-7 qui a
démontré qu’aucun d’entre eux n’activait le ERα (de même pour le
récepteur aux hormones thyroïdiennes sur des cellules GH3)
(Mesnage et coll., 2018
). Les auteurs ont utilisé des
inhibiteurs pharmacologiques de voies de signalisation afin
d’éclairer les mécanismes potentiellement impliqués : les deux
néonicotinoïdes utilisés stimuleraient la voie de la
phospholipase (le thiaclopride stimulant également la voie
MEK/MAPK 1/3 qui, indépendamment de son effet sur la
transcription de l’aromatase, stimulerait la prolifération
cellulaire). Cette description est importante car l’une des
voies les plus étudiées en première intention pour tester un
effet pro-tumoral dans le contexte du cancer du sein est celle
des récepteurs aux œstrogènes (l’isoforme ERα jouant un rôle
pro-prolifératif). Or, Mesnage et coll. ont récemment évalué le
potentiel œstrogénique de sept néonicotinoïdes les plus utilisés
à travers un test de prolifération des cellules MCF-7 qui a
démontré qu’aucun d’entre eux n’activait le ERα (de même pour le
récepteur aux hormones thyroïdiennes sur des cellules GH3)
(Mesnage et coll., 2018 ).
). | Figure 13.3 Résumé des effets de néonicotinoïdes en lien avec un effet susceptible de favoriser la survenue du cancer du sein |
Glyphosate
 ). Ceci va
dans le sens d’une absence d’effet initiateur du glyphosate.
Toutefois, associé à un agent initiateur, il pourrait exercer un
effet promoteur à des doses plus faibles que celles
préalablement testées ; celui-ci reposerait sur divers
mécanismes d’action qui rentrent également dans le cadre de la
perturbation endocrinienne.
). Ceci va
dans le sens d’une absence d’effet initiateur du glyphosate.
Toutefois, associé à un agent initiateur, il pourrait exercer un
effet promoteur à des doses plus faibles que celles
préalablement testées ; celui-ci reposerait sur divers
mécanismes d’action qui rentrent également dans le cadre de la
perturbation endocrinienne. ; Hokanson et coll., 2007
; Hokanson et coll., 2007 ; Mesnage et coll.,
2017
; Mesnage et coll.,
2017 ), voire de l’ordre de 10-11 M, ce qui suggère que
l’effet est médié par le ERα (Thongprakaisang et coll.,
2013
), voire de l’ordre de 10-11 M, ce qui suggère que
l’effet est médié par le ERα (Thongprakaisang et coll.,
2013 ; Sritana et coll., 2018
; Sritana et coll., 2018 ). Cet effet « faible dose » est à
opposer à ceux observés par exemple par Li et coll. qui montrent
que des concentrations de glyphosate comprises entre 15 et 50 mM
bloquent la croissance de certaines lignées cancéreuses (Li et
coll., 2013
). Cet effet « faible dose » est à
opposer à ceux observés par exemple par Li et coll. qui montrent
que des concentrations de glyphosate comprises entre 15 et 50 mM
bloquent la croissance de certaines lignées cancéreuses (Li et
coll., 2013 ). Ceci est aussi observé avec l’AMPA,
son produit de dégradation (Parajuli et coll.,
2015
). Ceci est aussi observé avec l’AMPA,
son produit de dégradation (Parajuli et coll.,
2015 ; Parajuli et coll., 2016
; Parajuli et coll., 2016 ). Des processus apoptotiques sont
stimulés à ces fortes doses, par exemple par l’AMPA dès 50 mM
(Li et coll., 2013
). Des processus apoptotiques sont
stimulés à ces fortes doses, par exemple par l’AMPA dès 50 mM
(Li et coll., 2013 ). Dans le contexte d’une exposition
au glyphosate à des concentrations pertinentes sur le plan
environnemental (de l’ordre de 1 µM à 1 pM), une liaison du
glyphosate au ERα n’a pas été mise en évidence à ce jour (EPA,
2015
). Dans le contexte d’une exposition
au glyphosate à des concentrations pertinentes sur le plan
environnemental (de l’ordre de 1 µM à 1 pM), une liaison du
glyphosate au ERα n’a pas été mise en évidence à ce jour (EPA,
2015 ). En revanche, Mesnage et coll. suggèrent une activation de
ce récepteur par d’autres mécanismes (par exemple, activation de
kinases et phosphorylation du ERα) (Mesnage et coll.,
2017
). En revanche, Mesnage et coll. suggèrent une activation de
ce récepteur par d’autres mécanismes (par exemple, activation de
kinases et phosphorylation du ERα) (Mesnage et coll.,
2017 ). Dans cette étude utilisant de nombreuses techniques, les
auteurs montrent ainsi que le glyphosate active la protéine
kinase A qui phosphoryle et active le ERα en l’absence d’un de
ses ligands. Par ailleurs, une étude de transcriptomique menée
sur des lignées cancéreuses mammaires ER+ et ER montre que le
GBH Roundup (à faibles concentrations sur de courtes durées
d’exposition) et l’AMPA affectent des fonctions telles que la
régulation du cycle cellulaire, la réparation de l’ADN et
l’intégrité mitochondriale (Stur et coll.,
2019
). Dans cette étude utilisant de nombreuses techniques, les
auteurs montrent ainsi que le glyphosate active la protéine
kinase A qui phosphoryle et active le ERα en l’absence d’un de
ses ligands. Par ailleurs, une étude de transcriptomique menée
sur des lignées cancéreuses mammaires ER+ et ER montre que le
GBH Roundup (à faibles concentrations sur de courtes durées
d’exposition) et l’AMPA affectent des fonctions telles que la
régulation du cycle cellulaire, la réparation de l’ADN et
l’intégrité mitochondriale (Stur et coll.,
2019 ).
). ; Romano et coll.,
2012
; Romano et coll.,
2012 ; Owagboriaye et coll., 2017
; Owagboriaye et coll., 2017 ). Cet effet peut être constaté avec
du Roundup et pas du glyphosate, soulignant la plus forte
toxicité des formulations (Walsh et coll.,
2000
). Cet effet peut être constaté avec
du Roundup et pas du glyphosate, soulignant la plus forte
toxicité des formulations (Walsh et coll.,
2000 ; Romano et coll., 2012
; Romano et coll., 2012 ). Cet effet pourrait impacter
indirectement la glande mammaire qui est sensible aux stéroïdes.
Le cas de l’aromatase est intéressant car son inhibition par le
Roundup suggère une baisse de la concentration locale
d’œstrogènes (Defarge et coll.,
2016
). Cet effet pourrait impacter
indirectement la glande mammaire qui est sensible aux stéroïdes.
Le cas de l’aromatase est intéressant car son inhibition par le
Roundup suggère une baisse de la concentration locale
d’œstrogènes (Defarge et coll.,
2016 ) expliquant la perturbation du développement de la glande
mammaire constatée dans certaines études chez les rongeurs
(Gomez et coll., 2019
) expliquant la perturbation du développement de la glande
mammaire constatée dans certaines études chez les rongeurs
(Gomez et coll., 2019 ). Cet effet est toutefois sujet à
controverse (Altamirano et coll.,
2018
). Cet effet est toutefois sujet à
controverse (Altamirano et coll.,
2018 ). Ces effets sont transposables à d’autres organes comme
l’utérus au niveau duquel un effet prolifératif est constaté à
certains stades précoces (mais pas tardifs) ; les GBH pourraient
ainsi en fonction du stade de développement activer ou inhiber
les voies ER (Guerrero Schimpf et coll.,
2017
). Ces effets sont transposables à d’autres organes comme
l’utérus au niveau duquel un effet prolifératif est constaté à
certains stades précoces (mais pas tardifs) ; les GBH pourraient
ainsi en fonction du stade de développement activer ou inhiber
les voies ER (Guerrero Schimpf et coll.,
2017 ). Les mêmes auteurs suggèrent qu’une exposition précoce au
GBH augmente la sensibilité de l’utérus à l’œstradiol (Guerrero
Schimpf et coll., 2018
). Les mêmes auteurs suggèrent qu’une exposition précoce au
GBH augmente la sensibilité de l’utérus à l’œstradiol (Guerrero
Schimpf et coll., 2018 ). Ces résultats, pris dans leur
ensemble, vont dans le sens d’une activité de perturbation
endocrinienne du glyphosate, mais ces effets demeurent complexes
car il peut présenter des propriétés anti-œstrogénique de par
son action sur l’aromatase et pro-œstrogénique de par
l’hypersensibilisation à l’action de l’œstradiol.
). Ces résultats, pris dans leur
ensemble, vont dans le sens d’une activité de perturbation
endocrinienne du glyphosate, mais ces effets demeurent complexes
car il peut présenter des propriétés anti-œstrogénique de par
son action sur l’aromatase et pro-œstrogénique de par
l’hypersensibilisation à l’action de l’œstradiol. ). Ceci pourrait conduire à une
augmentation de la sensibilité de certains organes vis-à-vis des
œstrogènes, un phénomène déjà constaté dans d’autres contextes
et qu’il serait intéressant d’étudier dans la glande
mammaire.
). Ceci pourrait conduire à une
augmentation de la sensibilité de certains organes vis-à-vis des
œstrogènes, un phénomène déjà constaté dans d’autres contextes
et qu’il serait intéressant d’étudier dans la glande
mammaire. | Figure 13.4 Résumé des effets du glyphosate en lien avec un effet susceptible de favoriser la survenue du cancer du sein |
Conclusion
Références


















 •
•





























































































→ Aller vers SYNTHESE