Pesticides et effets sur la santé
III. Autres pathologies et évènements de santé
2021
| ANALYSE |
16-
Santé respiratoire
Introduction : la santé respiratoire
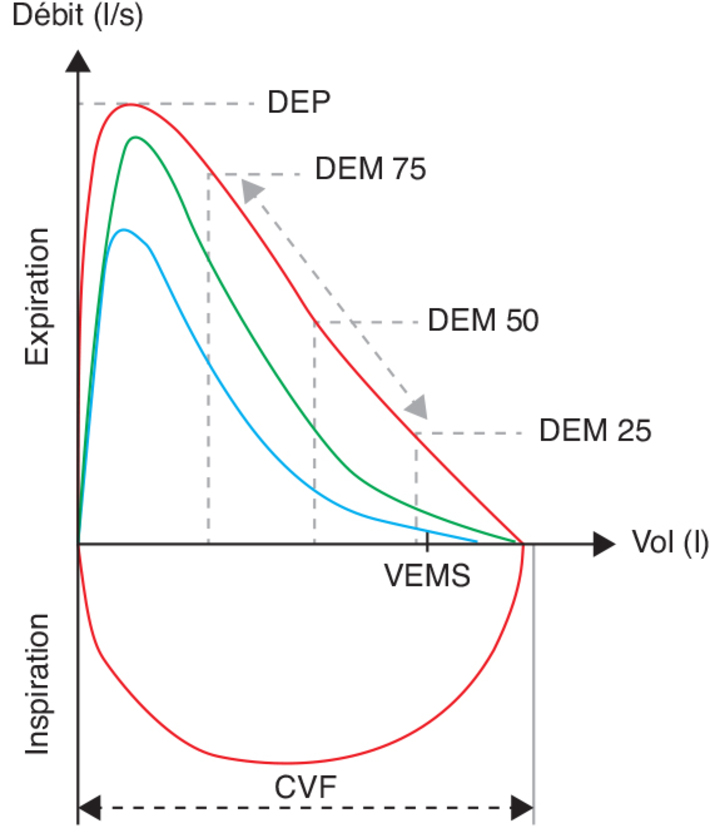
La fonction ventilatoire
 ) à partir
desquelles différents paramètres sont mesurés, et en
particulier :
) à partir
desquelles différents paramètres sont mesurés, et en
particulier : | Figure 16.1 Courbes débit-volume normales (rouges) et dans le cas d’un trouble ventilatoire obstructif léger (verte) ou sévère (bleue) |
L’asthme, les sifflements
 ) et ECRHS (European Community Respiratory Health
Survey) conduite chez les adultes (ECRHS,
1996
) et ECRHS (European Community Respiratory Health
Survey) conduite chez les adultes (ECRHS,
1996 ), ont mis en évidence des contrastes importants de la
prévalence de symptômes d’asthme ou de l’asthme entre zones
géographiques. La prévalence des sifflements dans les
12 derniers mois, variait selon les pays de 2,1 % à 32,2 % chez
les 13-14 ans et de 4,1 % à 32,1 % chez les 6-7 ans. Chez les
adultes âgés de 20-44 ans, la prévalence de l’asthme
diagnostiqué par un médecin variait de 2,0 % à Tartu en Estonie
à 11,9 % à Melbourne en Australie dans l’étude ECRHS. En France,
l’enquête nationale de santé en milieu scolaire effectuée en
2012-2013 auprès d’environ 20 000 élèves, montrait que 11,0 %
des enfants scolarisés en grande section de maternelle avaient
déjà eu de l’asthme et 11,8 % avaient eu des sifflements au
cours des 12 derniers mois (Delmas et coll.,
2017
), ont mis en évidence des contrastes importants de la
prévalence de symptômes d’asthme ou de l’asthme entre zones
géographiques. La prévalence des sifflements dans les
12 derniers mois, variait selon les pays de 2,1 % à 32,2 % chez
les 13-14 ans et de 4,1 % à 32,1 % chez les 6-7 ans. Chez les
adultes âgés de 20-44 ans, la prévalence de l’asthme
diagnostiqué par un médecin variait de 2,0 % à Tartu en Estonie
à 11,9 % à Melbourne en Australie dans l’étude ECRHS. En France,
l’enquête nationale de santé en milieu scolaire effectuée en
2012-2013 auprès d’environ 20 000 élèves, montrait que 11,0 %
des enfants scolarisés en grande section de maternelle avaient
déjà eu de l’asthme et 11,8 % avaient eu des sifflements au
cours des 12 derniers mois (Delmas et coll.,
2017 ). Au niveau mondial, l’asthme se positionne au
11e rang pour les années de vie avec de l’incapacité
(GBD, 2016
). Au niveau mondial, l’asthme se positionne au
11e rang pour les années de vie avec de l’incapacité
(GBD, 2016 ) et entraîne des coûts sociaux et économiques considérables
(Gibson et coll., 2013
) et entraîne des coûts sociaux et économiques considérables
(Gibson et coll., 2013 ). La prévalence de l’asthme a
augmenté de façon importante au cours de ces dernières
décennies, et en particulier entre le début des années 1970 et
1990, avec une prévalence qui a doublé dans certains pays (Upton
et coll., 2000
). La prévalence de l’asthme a
augmenté de façon importante au cours de ces dernières
décennies, et en particulier entre le début des années 1970 et
1990, avec une prévalence qui a doublé dans certains pays (Upton
et coll., 2000 ). Les données internationales du
Global Burden of Disease montrent une augmentation de
12,6 % (IC 95 % [9,0-16,4]) de la prévalence de l’asthme sur la
période la plus récente, entre 1990-2015, avec de fortes
variations géographiques selon un indice sociodémographique :
une augmentation de 95 % était estimée dans les pays avec le
plus faible indice et inversement une diminution de 13,8 % était
observée dans les pays avec le plus fort indice (Soriano et
coll., 2017
). Les données internationales du
Global Burden of Disease montrent une augmentation de
12,6 % (IC 95 % [9,0-16,4]) de la prévalence de l’asthme sur la
période la plus récente, entre 1990-2015, avec de fortes
variations géographiques selon un indice sociodémographique :
une augmentation de 95 % était estimée dans les pays avec le
plus faible indice et inversement une diminution de 13,8 % était
observée dans les pays avec le plus fort indice (Soriano et
coll., 2017 ). Cette augmentation résulte
principalement de la croissance démographique et du
vieillissement de la population mondiale puisque, sur la base
des prévalences standardisées sur l’âge, une diminution globale
de 17,7 % (IC 95 % [15,1-19,9]) de la prévalence de l’asthme
était estimée.
). Cette augmentation résulte
principalement de la croissance démographique et du
vieillissement de la population mondiale puisque, sur la base
des prévalences standardisées sur l’âge, une diminution globale
de 17,7 % (IC 95 % [15,1-19,9]) de la prévalence de l’asthme
était estimée. ). Les questions relatives à l’asthme
(« avez-vous déjà eu de l’asthme ? ») ou au diagnostic d’asthme
par un médecin (« un médecin vous a-t-il déjà dit que vous aviez
de l’asthme ? ») montrent une très bonne spécificité (≥ 94 %),
associée à une moindre sensibilité (36 %-68 % selon la
définition utilisée pour le gold standard) (Torén et
coll., 1993
). Les questions relatives à l’asthme
(« avez-vous déjà eu de l’asthme ? ») ou au diagnostic d’asthme
par un médecin (« un médecin vous a-t-il déjà dit que vous aviez
de l’asthme ? ») montrent une très bonne spécificité (≥ 94 %),
associée à une moindre sensibilité (36 %-68 % selon la
définition utilisée pour le gold standard) (Torén et
coll., 1993 ). En ce qui concerne les symptômes
respiratoires, la présence de sifflements dans la poitrine au
cours des 12 derniers mois est fortement prédictive de l’asthme
(diagnostic clinique ou déclaré), avec une sensibilité ≥ 63 % et
une spécificité ≥ 82 %.
). En ce qui concerne les symptômes
respiratoires, la présence de sifflements dans la poitrine au
cours des 12 derniers mois est fortement prédictive de l’asthme
(diagnostic clinique ou déclaré), avec une sensibilité ≥ 63 % et
une spécificité ≥ 82 %.La bronchite chronique et la BPCO
 ; GBD, 2017
; GBD, 2017 ). En France, on estime que la
prévalence de la BPCO atteint 5 à 10 % de la population des plus
de 45 ans (soit 2,5 à 3,5 millions de personnes) (Fuhrman et
Delmas, 2010
). En France, on estime que la
prévalence de la BPCO atteint 5 à 10 % de la population des plus
de 45 ans (soit 2,5 à 3,5 millions de personnes) (Fuhrman et
Delmas, 2010 ). Au niveau mondial, la prévalence de
la BPCO a augmenté de 44,2 % (IC 95 % [41,7-46,6]) entre 1990 et
2015, une augmentation particulièrement marquée dans les pays
avec un indice sociodémographique moyen, alors que la prévalence
standardisée selon l’âge a diminué de 14,7 % (IC 95 %
[13,5-15,9]) (Soriano et coll.,
2017
). Au niveau mondial, la prévalence de
la BPCO a augmenté de 44,2 % (IC 95 % [41,7-46,6]) entre 1990 et
2015, une augmentation particulièrement marquée dans les pays
avec un indice sociodémographique moyen, alors que la prévalence
standardisée selon l’âge a diminué de 14,7 % (IC 95 %
[13,5-15,9]) (Soriano et coll.,
2017 ).
). ). Le diagnostic de BPCO auto-déclaré
est donc peu approprié pour définir la prévalence de la maladie,
mais cette définition reste opérationnelle dans le contexte
d’études étiologiques dans lesquelles il est préférable de
disposer de définition de la maladie avec une grande
spécificité. Quand les données de spirométrie avec test de
réversibilité (post bronchodilatation) sont disponibles, la
définition de la BPCO repose sur un ratio fixe VEMS/CVF post-BD
< 0,7 ou, pour éviter un sur-diagnostic de la BPCO chez les
plus âgés, par un ratio < limite inférieure à la normale –
définie selon l’âge, la taille et le sexe du sujet.
). Le diagnostic de BPCO auto-déclaré
est donc peu approprié pour définir la prévalence de la maladie,
mais cette définition reste opérationnelle dans le contexte
d’études étiologiques dans lesquelles il est préférable de
disposer de définition de la maladie avec une grande
spécificité. Quand les données de spirométrie avec test de
réversibilité (post bronchodilatation) sont disponibles, la
définition de la BPCO repose sur un ratio fixe VEMS/CVF post-BD
< 0,7 ou, pour éviter un sur-diagnostic de la BPCO chez les
plus âgés, par un ratio < limite inférieure à la normale –
définie selon l’âge, la taille et le sexe du sujet. ).
).Données épidémiologiques
Exposition professionnelle
 ). D’autre part, des observations épidémiologiques montrent
que l’exposition précoce à un environnement fermier est un
facteur protecteur, et en particulier vis-à-vis du développement
de l’asthme allergique (Braun-Fahrländer et coll.,
1999
). D’autre part, des observations épidémiologiques montrent
que l’exposition précoce à un environnement fermier est un
facteur protecteur, et en particulier vis-à-vis du développement
de l’asthme allergique (Braun-Fahrländer et coll.,
1999 ; von Mutius, 2007
; von Mutius, 2007 ). Une méta-analyse suggère une forte
hétérogénéité de cet effet protecteur selon les études
(Genuneit, 2012
). Une méta-analyse suggère une forte
hétérogénéité de cet effet protecteur selon les études
(Genuneit, 2012 ). Cette hétérogénéité pourrait
résulter de différents types d’environnement fermier, comme le
suggèrent les résultats d’analyses dans la cohorte AGRICAN, avec
une tendance à un effet protecteur pour les fermes avec bétail,
mais au contraire une tendance délétère lors de la culture de la
vigne, de fruits et de légumes (Baldi et coll.,
2014
). Cette hétérogénéité pourrait
résulter de différents types d’environnement fermier, comme le
suggèrent les résultats d’analyses dans la cohorte AGRICAN, avec
une tendance à un effet protecteur pour les fermes avec bétail,
mais au contraire une tendance délétère lors de la culture de la
vigne, de fruits et de légumes (Baldi et coll.,
2014 ). Selon la théorie hygiéniste, cet effet protecteur
résulterait de l’exposition précoce aux infections et aux
composantes microbiennes qui permettrait une maturation du
système immunitaire et préviendrait ainsi le développement de
maladies allergiques. L’impact de l’exposition précoce de la vie
à la ferme est rarement pris en compte dans les études sur
l’exposition professionnelle aux pesticides en milieu agricole
sur la santé respiratoire.
). Selon la théorie hygiéniste, cet effet protecteur
résulterait de l’exposition précoce aux infections et aux
composantes microbiennes qui permettrait une maturation du
système immunitaire et préviendrait ainsi le développement de
maladies allergiques. L’impact de l’exposition précoce de la vie
à la ferme est rarement pris en compte dans les études sur
l’exposition professionnelle aux pesticides en milieu agricole
sur la santé respiratoire. ). Dans la majorité de ces études
épidémiologiques, on observe des associations statistiquement
significatives entre l’exposition professionnelle aux pesticides
et un risque augmenté de symptômes ou maladies respiratoires,
mais avec une forte hétérogénéité tant au niveau de l’évaluation
de l’exposition que de la définition de l’évènement de santé.
Cette revue conclut que l’exposition professionnelle aux
pesticides présente un risque pour la santé respiratoire mais
souligne la nécessité d’études supplémentaires, notamment des
études de cohortes avec une caractérisation approfondie des
expositions afin de documenter les relations dose-réponse et les
expositions spécifiques aux pesticides et avec des mesures
objectives de la santé respiratoire, en particulier des mesures
de spirométrie pour évaluer l’obstruction bronchique. Une autre
revue de la littérature publiée en 2014 ciblait l’impact de
l’exposition aux pesticides, professionnelle ou
environnementale, sur le développement des maladies obstructives
chroniques (asthme, BPCO) et des sifflements respiratoires
(Doust et coll., 2014
). Dans la majorité de ces études
épidémiologiques, on observe des associations statistiquement
significatives entre l’exposition professionnelle aux pesticides
et un risque augmenté de symptômes ou maladies respiratoires,
mais avec une forte hétérogénéité tant au niveau de l’évaluation
de l’exposition que de la définition de l’évènement de santé.
Cette revue conclut que l’exposition professionnelle aux
pesticides présente un risque pour la santé respiratoire mais
souligne la nécessité d’études supplémentaires, notamment des
études de cohortes avec une caractérisation approfondie des
expositions afin de documenter les relations dose-réponse et les
expositions spécifiques aux pesticides et avec des mesures
objectives de la santé respiratoire, en particulier des mesures
de spirométrie pour évaluer l’obstruction bronchique. Une autre
revue de la littérature publiée en 2014 ciblait l’impact de
l’exposition aux pesticides, professionnelle ou
environnementale, sur le développement des maladies obstructives
chroniques (asthme, BPCO) et des sifflements respiratoires
(Doust et coll., 2014 ). Parmi 42 études initialement
identifiées, 23 études qui concernaient principalement les
expositions professionnelles était retenues selon certains
critères de qualité (définis par The Scottish Intercollegiate
Guidelines Network, SIGN)2
. Les auteurs concluaient à un impact possible
de l’exposition aux pesticides sur l’asthme et les sifflements
et bien que quelques études aient indiqué des associations avec
la bronchite ou la BPCO, le niveau de preuve était considéré
plus faible pour la BPCO que pour l’asthme.
). Parmi 42 études initialement
identifiées, 23 études qui concernaient principalement les
expositions professionnelles était retenues selon certains
critères de qualité (définis par The Scottish Intercollegiate
Guidelines Network, SIGN)2
. Les auteurs concluaient à un impact possible
de l’exposition aux pesticides sur l’asthme et les sifflements
et bien que quelques études aient indiqué des associations avec
la bronchite ou la BPCO, le niveau de preuve était considéré
plus faible pour la BPCO que pour l’asthme. , voir en fin de ce chapitre) :
14 études basées sur des cohortes prospectives (principalement
d’Europe et d’Amérique du Nord), 7 études de type exposés-non
exposés (principalement d’Asie, d’Afrique ou du Moyen-Orient),
7 études transversales (principalement d’Afrique et d’Amérique
du Sud) et une méta-analyse. Les principaux résultats de ces
articles récents sont présentés ci-dessous (pour les articles
publiés avant 2013, se référer aux revues antérieures, Mamane et
coll., 2015a
, voir en fin de ce chapitre) :
14 études basées sur des cohortes prospectives (principalement
d’Europe et d’Amérique du Nord), 7 études de type exposés-non
exposés (principalement d’Asie, d’Afrique ou du Moyen-Orient),
7 études transversales (principalement d’Afrique et d’Amérique
du Sud) et une méta-analyse. Les principaux résultats de ces
articles récents sont présentés ci-dessous (pour les articles
publiés avant 2013, se référer aux revues antérieures, Mamane et
coll., 2015a ).
).Méta-analyse
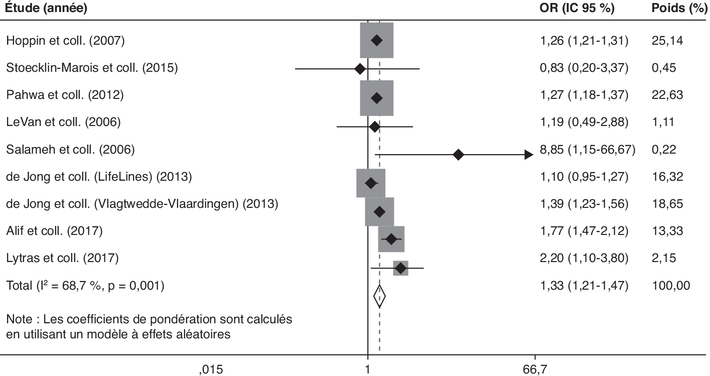
 ). La méta-analyse basée sur
9 cohortes, représentant plus de 100 000 participants (entre
300 et 50 000 participants par cohorte) conclut à un impact
significatif de l’exposition aux pesticides sur le risque de
BPCO ou de bronchite chronique (OR = 1,33 ; IC 95 %
[1,21-1,47]), les OR associés à la BPCO seule et la
bronchite chronique seule étaient 1,44 [1,14-1,81]) et 1,27
[1,23-1,31], respectivement (figure 16.2
). La méta-analyse basée sur
9 cohortes, représentant plus de 100 000 participants (entre
300 et 50 000 participants par cohorte) conclut à un impact
significatif de l’exposition aux pesticides sur le risque de
BPCO ou de bronchite chronique (OR = 1,33 ; IC 95 %
[1,21-1,47]), les OR associés à la BPCO seule et la
bronchite chronique seule étaient 1,44 [1,14-1,81]) et 1,27
[1,23-1,31], respectivement (figure 16.2 ). L’étude n’indiquait pas de biais
de publication (selon le graphique en entonnoir et la valeur
p du test de Egger = 0,16).
). L’étude n’indiquait pas de biais
de publication (selon le graphique en entonnoir et la valeur
p du test de Egger = 0,16). | Figure 16.2 Associations entre l’exposition
professionnelle aux pesticides et le risque de BPCO ou
bronchite chronique : résultat d’une méta-analyse
(d’après Pourhassan et coll.,
2019 ) ) |
Études de cohortes
 ). Les auteurs montraient que
cette association était particulièrement observée chez les
fumeurs. Dans une cohorte prospective hollandaise de presque
12 000 participants, l’exposition forte aux herbicides et
aux insecticides était associée à un niveau de VEMS abaissé
(- 204 ml [- 350 ; - 58] et - 109 ml [- 197 ; - 21],
respectivement) (De Jong et coll.,
2014c
). Les auteurs montraient que
cette association était particulièrement observée chez les
fumeurs. Dans une cohorte prospective hollandaise de presque
12 000 participants, l’exposition forte aux herbicides et
aux insecticides était associée à un niveau de VEMS abaissé
(- 204 ml [- 350 ; - 58] et - 109 ml [- 197 ; - 21],
respectivement) (De Jong et coll.,
2014c ). De plus, une exposition forte
aux herbicides était associée à un rapport VEMS/CVF diminué
et à l’obstruction bronchique définie par VEMS/CVF < 0,7,
et d’autant plus lorsque l’obstruction bronchique était
modérée à sévère (définie par VEMS < 80 % prédit,
OR = 3,6 [1,3 ; 9,9]). De façon intéressante, l’association
entre l’exposition aux herbicides et l’obstruction
bronchique modérée à sévère était retrouvée dans une seconde
cohorte, bien que de plus faible amplitude (OR = 1,7
[1,0-2,7]). Sur la base des données de 237 sujets recrutés
entre 10-15 ans en 1964 dans la cohorte WHEASE (Royaume-Uni)
et suivis pendant 50 ans, l’exposition aux biocides et
fongicides était associée à une fonction ventilatoire
altérée (niveau du VEMS diminué et déclin du VEMS accéléré)
et aux sifflements qui ont débuté à l’âge adulte (Tagiyeva
et coll., 2016
). De plus, une exposition forte
aux herbicides était associée à un rapport VEMS/CVF diminué
et à l’obstruction bronchique définie par VEMS/CVF < 0,7,
et d’autant plus lorsque l’obstruction bronchique était
modérée à sévère (définie par VEMS < 80 % prédit,
OR = 3,6 [1,3 ; 9,9]). De façon intéressante, l’association
entre l’exposition aux herbicides et l’obstruction
bronchique modérée à sévère était retrouvée dans une seconde
cohorte, bien que de plus faible amplitude (OR = 1,7
[1,0-2,7]). Sur la base des données de 237 sujets recrutés
entre 10-15 ans en 1964 dans la cohorte WHEASE (Royaume-Uni)
et suivis pendant 50 ans, l’exposition aux biocides et
fongicides était associée à une fonction ventilatoire
altérée (niveau du VEMS diminué et déclin du VEMS accéléré)
et aux sifflements qui ont débuté à l’âge adulte (Tagiyeva
et coll., 2016 ). L’étude mettait en évidence
des relations dose-réponse avec l’intensité de l’exposition
évaluée à partir du niveau et de la durée de l’exposition.
Le suivi sur près de 40 ans de 1 335 enfants recrutés en
1968 dans la cohorte australienne TAHS montre que
l’exposition aux pesticides était associée à un risque
augmenté d’obstruction chronique statistiquement
significatif (définie dans cette étude par le VEMS/CVF
post-BD < 0,7), à la bronchite chronique et à la dyspnée
avec des RR estimés entre 1,7 et 1,9 selon l’évènement de
santé. Des associations du même ordre de grandeur étaient
observées avec l’exposition aux herbicides et aux
insecticides séparément, et des associations significatives
étaient observées en considérant l’exposition cumulée sur
l’ensemble de l’histoire professionnelle (Alif et coll.,
2017
). L’étude mettait en évidence
des relations dose-réponse avec l’intensité de l’exposition
évaluée à partir du niveau et de la durée de l’exposition.
Le suivi sur près de 40 ans de 1 335 enfants recrutés en
1968 dans la cohorte australienne TAHS montre que
l’exposition aux pesticides était associée à un risque
augmenté d’obstruction chronique statistiquement
significatif (définie dans cette étude par le VEMS/CVF
post-BD < 0,7), à la bronchite chronique et à la dyspnée
avec des RR estimés entre 1,7 et 1,9 selon l’évènement de
santé. Des associations du même ordre de grandeur étaient
observées avec l’exposition aux herbicides et aux
insecticides séparément, et des associations significatives
étaient observées en considérant l’exposition cumulée sur
l’ensemble de l’histoire professionnelle (Alif et coll.,
2017 ). Plus récemment, deux analyses
longitudinales basées sur la cohorte européenne ECRHS, l’une
ciblant l’incidence de la BPCO (Lytras et coll.,
2018
). Plus récemment, deux analyses
longitudinales basées sur la cohorte européenne ECRHS, l’une
ciblant l’incidence de la BPCO (Lytras et coll.,
2018 ) et l’autre l’incidence de la
bronchite chronique (Lytras et coll.,
2019
) et l’autre l’incidence de la
bronchite chronique (Lytras et coll.,
2019 ) ont été publiées. L’incidence
de la BPCO (n = 96, définie par le rapport VEMS/CVF post-BD
< limite inférieure de la normale, parmi 3 343 adultes
suivis pendant 20 ans), était significativement augmentée
avec l’exposition aux pesticides (RR = 2,2 [1,1-3,8]) et aux
insecticides (RR = 2,3 [1,1-4,2]) ; des associations du même
ordre de grandeur mais non statistiquement significatives
était observées avec l’exposition aux herbicides et aux
fongicides. L’incidence de la bronchite chronique dans cette
cohorte n’était pas associée à l’exposition aux pesticides,
ni aux différentes sous-catégories herbicides, insecticides
et fongicides dans l’ensemble de la population, mais
l’analyse conduite séparément chez les hommes et les femmes
identifiait des associations positives et significatives
chez les femmes avec des RR de l’ordre de 2 pour
l’exposition aux insecticides et fongicides.
) ont été publiées. L’incidence
de la BPCO (n = 96, définie par le rapport VEMS/CVF post-BD
< limite inférieure de la normale, parmi 3 343 adultes
suivis pendant 20 ans), était significativement augmentée
avec l’exposition aux pesticides (RR = 2,2 [1,1-3,8]) et aux
insecticides (RR = 2,3 [1,1-4,2]) ; des associations du même
ordre de grandeur mais non statistiquement significatives
était observées avec l’exposition aux herbicides et aux
fongicides. L’incidence de la bronchite chronique dans cette
cohorte n’était pas associée à l’exposition aux pesticides,
ni aux différentes sous-catégories herbicides, insecticides
et fongicides dans l’ensemble de la population, mais
l’analyse conduite séparément chez les hommes et les femmes
identifiait des associations positives et significatives
chez les femmes avec des RR de l’ordre de 2 pour
l’exposition aux insecticides et fongicides. ). Dans cette étude, parmi les
producteurs de pommes de terre, l’utilisation de pesticides
était significativement associée à un risque augmenté de
bronchite chronique. Une étude récente dans la cohorte AHS a
mis en évidence un risque augmenté des symptômes de
bronchite chronique (avec ou sans diagnostic de BPCO
associé) avec l’utilisation d’insecticides sur la dernière
année et avec 9 des 18 insecticides étudiés (diazinon,
malathion, coumaphos, dichlorvos, carbaryl, pyréthrine,
perméthrine, lindane, parathion) (Rinsky et coll.,
2019
). Dans cette étude, parmi les
producteurs de pommes de terre, l’utilisation de pesticides
était significativement associée à un risque augmenté de
bronchite chronique. Une étude récente dans la cohorte AHS a
mis en évidence un risque augmenté des symptômes de
bronchite chronique (avec ou sans diagnostic de BPCO
associé) avec l’utilisation d’insecticides sur la dernière
année et avec 9 des 18 insecticides étudiés (diazinon,
malathion, coumaphos, dichlorvos, carbaryl, pyréthrine,
perméthrine, lindane, parathion) (Rinsky et coll.,
2019 ). En revanche, une autre étude
américaine portant sur 702 agriculteurs et agricultrices
n’observait pas d’association statistiquement significative
entre l’utilisation de pesticides au cours des 12 derniers
mois et la bronchite chronique, ni avec l’asthme et les
sifflements persistants, et les OR étaient < 1
(Stoecklin-Marois et coll.,
2015
). En revanche, une autre étude
américaine portant sur 702 agriculteurs et agricultrices
n’observait pas d’association statistiquement significative
entre l’utilisation de pesticides au cours des 12 derniers
mois et la bronchite chronique, ni avec l’asthme et les
sifflements persistants, et les OR étaient < 1
(Stoecklin-Marois et coll.,
2015 ).
). ). Ces observations sont en accord
avec les résultats plus anciens de la cohorte AHS, qui
indiquaient que l’utilisation de pesticides était plus
fortement associée avec l’asthme allergique comparativement
à l’asthme non allergique (Hoppin et coll.,
2008
). Ces observations sont en accord
avec les résultats plus anciens de la cohorte AHS, qui
indiquaient que l’utilisation de pesticides était plus
fortement associée avec l’asthme allergique comparativement
à l’asthme non allergique (Hoppin et coll.,
2008 ; Hoppin et coll.,
2009
; Hoppin et coll.,
2009 ). De plus, une analyse récente
sur la cohorte AHS a mis en évidence des associations
significatives entre 19 pesticides (parmi 78) et les
sifflements allergiques, et entre 21 pesticides et les
sifflements non allergiques, avec des risques souvent plus
forts pour les sifflements allergiques (Hoppin et coll.,
2017
). De plus, une analyse récente
sur la cohorte AHS a mis en évidence des associations
significatives entre 19 pesticides (parmi 78) et les
sifflements allergiques, et entre 21 pesticides et les
sifflements non allergiques, avec des risques souvent plus
forts pour les sifflements allergiques (Hoppin et coll.,
2017 ) (tableau 16.II
) (tableau 16.II , voir en fin de ce chapitre).
Dans une autre cohorte de 2 426 céréaliers de l’Alberta, le
diagnostic d’asthme rapporté par auto-questionnaire était
augmenté avec le nombre d’années d’utilisation de composés
phénoxy (OR = 1,3 [0,7-2,5], 2,5 [1,2-5,1], et 3,2 [1,5-6,6]
pour une exposition courte, moyenne et longue
respectivement), et l’étude ne mettait pas en évidence
d’association avec les autres familles de pesticides
étudiées (organochlorés, organophosphorés, pyréthrinoïdes,
carbamates, thiocarbamates et dithiocarbamates) (Cherry et
coll., 2018
, voir en fin de ce chapitre).
Dans une autre cohorte de 2 426 céréaliers de l’Alberta, le
diagnostic d’asthme rapporté par auto-questionnaire était
augmenté avec le nombre d’années d’utilisation de composés
phénoxy (OR = 1,3 [0,7-2,5], 2,5 [1,2-5,1], et 3,2 [1,5-6,6]
pour une exposition courte, moyenne et longue
respectivement), et l’étude ne mettait pas en évidence
d’association avec les autres familles de pesticides
étudiées (organochlorés, organophosphorés, pyréthrinoïdes,
carbamates, thiocarbamates et dithiocarbamates) (Cherry et
coll., 2018 ). Cette association était
retrouvée avec un autre phénotype d’asthme qui s’appuyait
sur les symptômes respiratoires et les données
médico-administratives, mais contrairement aux observations
des études précédentes, dans cette étude l’association était
plus forte avec l’asthme non allergique.
). Cette association était
retrouvée avec un autre phénotype d’asthme qui s’appuyait
sur les symptômes respiratoires et les données
médico-administratives, mais contrairement aux observations
des études précédentes, dans cette étude l’association était
plus forte avec l’asthme non allergique. ). Une étude thaïlandaise ayant
suivi ce type d’approche en comparant les données de
fonction respiratoire à 2 mois d’intervalle chez 58 hommes,
avant et après la saison de pulvérisation de pesticides, a
observé une diminution statistiquement significative du
VEMS, de la CVF et du débit de pointe sur la période de
suivi (Sapbamrer et coll.,
2019
). Une étude thaïlandaise ayant
suivi ce type d’approche en comparant les données de
fonction respiratoire à 2 mois d’intervalle chez 58 hommes,
avant et après la saison de pulvérisation de pesticides, a
observé une diminution statistiquement significative du
VEMS, de la CVF et du débit de pointe sur la période de
suivi (Sapbamrer et coll.,
2019 ).
).Études exposés-non exposés et études transversales
 ; Callahan et coll.,
2014
; Callahan et coll.,
2014 ; Ndlovu et coll.,
2014
; Ndlovu et coll.,
2014 ; Hanssen et coll.,
2015
; Hanssen et coll.,
2015 ; Negatu et coll.,
2017
; Negatu et coll.,
2017 ; Jalilian et coll.,
2018
; Jalilian et coll.,
2018 ) et une étude n’identifiait pas
de différences (Mwanga et coll.,
2016
) et une étude n’identifiait pas
de différences (Mwanga et coll.,
2016 ).
). ; Fiori et coll.,
2015
; Fiori et coll.,
2015 ; Negatu et coll.,
2017
; Negatu et coll.,
2017 ), la prévalence de l’asthme (Liu
et coll., 2019
), la prévalence de l’asthme (Liu
et coll., 2019 ), et une fonction ventilatoire
abaissée (Negatu et coll.,
2017
), et une fonction ventilatoire
abaissée (Negatu et coll.,
2017 ). L’étude de Patel et coll.
portant sur plus de 11 000 exploitants agricoles a montré un
risque d’asthme actif augmenté avec l’utilisation de
pesticides, d’herbicides et d’insecticides mais aucune
association n’était retrouvée avec des matières actives
spécifiques, à l’exception d’une association proche du seuil
de la signification pour le glyphosate (OR = 1,3 [0,97-1,8])
(Patel et coll., 2018
). L’étude de Patel et coll.
portant sur plus de 11 000 exploitants agricoles a montré un
risque d’asthme actif augmenté avec l’utilisation de
pesticides, d’herbicides et d’insecticides mais aucune
association n’était retrouvée avec des matières actives
spécifiques, à l’exception d’une association proche du seuil
de la signification pour le glyphosate (OR = 1,3 [0,97-1,8])
(Patel et coll., 2018 ). Dans une étude portant sur
300 maraîchers au Ghana, le risque de symptômes
respiratoires était augmenté avec le nombre d’heures par
jour d’utilisation de fumigants, d’insecticides et de
fongicides et avec les dosages urinaires de métabolites de
pesticides organochlorés (β-HCH, heptachlore et endosulfan
sulfate) et l’étude n’identifiait pas d’association avec les
dosages urinaires des métabolites des pyréthrinoïdes
(Quansah et coll., 2016
). Dans une étude portant sur
300 maraîchers au Ghana, le risque de symptômes
respiratoires était augmenté avec le nombre d’heures par
jour d’utilisation de fumigants, d’insecticides et de
fongicides et avec les dosages urinaires de métabolites de
pesticides organochlorés (β-HCH, heptachlore et endosulfan
sulfate) et l’étude n’identifiait pas d’association avec les
dosages urinaires des métabolites des pyréthrinoïdes
(Quansah et coll., 2016 ). Dans une étude récente sur
217 agriculteurs de Colombie qui ciblait principalement
l’exposition au paraquat, l’obstruction bronchique
(VEMS/CVF < 0,8) était associée à l’exposition combinée
paraquat-méthamidophos et la prévalence de l’asthme était
associée à l’exposition chronique au paraquat (évaluée par
les niveaux urinaires et le nombre de mois d’exposition)
( Díaz-Criollo et coll.,
2019
). Dans une étude récente sur
217 agriculteurs de Colombie qui ciblait principalement
l’exposition au paraquat, l’obstruction bronchique
(VEMS/CVF < 0,8) était associée à l’exposition combinée
paraquat-méthamidophos et la prévalence de l’asthme était
associée à l’exposition chronique au paraquat (évaluée par
les niveaux urinaires et le nombre de mois d’exposition)
( Díaz-Criollo et coll.,
2019 ). Dans cette étude, aucune
association n’était observée avec la dyspnée. Enfin, dans
une étude en Chine sur 1 366 individus qui travaillaient
dans des serres, les pathologies et symptômes respiratoires
n’étaient pas associés à l’utilisation de pesticides sauf
peut-être avec l’utilisation mixte de spray (manuelle et
machine) mais l’association rapportée reposait sur peu de
sujets exposés (n = 24) (Li et coll.,
2019
). Dans cette étude, aucune
association n’était observée avec la dyspnée. Enfin, dans
une étude en Chine sur 1 366 individus qui travaillaient
dans des serres, les pathologies et symptômes respiratoires
n’étaient pas associés à l’utilisation de pesticides sauf
peut-être avec l’utilisation mixte de spray (manuelle et
machine) mais l’association rapportée reposait sur peu de
sujets exposés (n = 24) (Li et coll.,
2019 ).
). ) et aucune étude chez des
patients avec une BPCO. L’étude transversale sur
926 agriculteurs avec un asthme actif dans la cohorte AHS
(Henneberger et coll., 2014
) et aucune étude chez des
patients avec une BPCO. L’étude transversale sur
926 agriculteurs avec un asthme actif dans la cohorte AHS
(Henneberger et coll., 2014 ) identifiait une association
inverse avec l’utilisation de 2 herbicides (glyphosate,
OR = 0,5 [0,3-0,8] et paraquat, OR = 0,3 [0,1-0,9])
suggérant un possible biais du travailleur en bonne santé
(les asthmatiques sujets à des exacerbations pourraient
éviter les expositions qui déclenchent les symptômes). Dans
cette étude, l’analyse stratifiée sur l’allergie,
identifiait une association positive cette fois avec un
herbicide (pendiméthaline, OR = 2,1 [1,1-4,1]) et un
insecticide (aldicarbe, OR = 10,2 [1,9-55]) parmi les
individus allergiques mais elle était menée sur un petit
échantillon. Les données de la littérature ne permettent
donc pas de conclure sur l’impact d’une exposition
professionnelle aux pesticides sur le risque d’exacerbation
ou d’aggravation de l’asthme ou de la BPCO.
) identifiait une association
inverse avec l’utilisation de 2 herbicides (glyphosate,
OR = 0,5 [0,3-0,8] et paraquat, OR = 0,3 [0,1-0,9])
suggérant un possible biais du travailleur en bonne santé
(les asthmatiques sujets à des exacerbations pourraient
éviter les expositions qui déclenchent les symptômes). Dans
cette étude, l’analyse stratifiée sur l’allergie,
identifiait une association positive cette fois avec un
herbicide (pendiméthaline, OR = 2,1 [1,1-4,1]) et un
insecticide (aldicarbe, OR = 10,2 [1,9-55]) parmi les
individus allergiques mais elle était menée sur un petit
échantillon. Les données de la littérature ne permettent
donc pas de conclure sur l’impact d’une exposition
professionnelle aux pesticides sur le risque d’exacerbation
ou d’aggravation de l’asthme ou de la BPCO.Exposition environnementale
 ). Parmi les 14 études chez les
enfants, qui reposent principalement sur des cohortes
mères-enfants ou des cohortes d’enfants, trois n’ont pas mis en
évidence d’association entre l’exposition pré- ou post-natale
aux pesticides et la santé respiratoire de l’enfant. Cinq des
huit études qui reposaient sur des dosages biologiques pour
évaluer l’exposition ont mis en évidence des associations entre
l’exposition au DDE, plus particulièrement l’exposition
prénatale au DDE, et la prévalence de l’asthme ou des
sifflements et une étude identifiait une association entre la
perméthrine (un pyréthrinoïde) dans l’air intérieur pendant la
grossesse et les sifflements de l’enfant. La plupart des études
(quatre sur six) qui n’ont pas mesuré les pesticides pour
évaluer l’exposition ont mis en évidence des associations
significatives avec la prévalence de l’asthme ou des sifflements
chez les enfants. Les six études chez les adultes reposaient sur
des schémas d’étude différents (étude rétrospective suite à un
programme d’éradication de moustiques, étude exposés/non
exposés, étude transversale, étude de cohorte) et la moitié des
études n’identifiaient pas d’association significative. Les
auteurs de cette revue concluaient à la nécessité d’études
supplémentaires pour évaluer le rôle de l’exposition
environnementale aux pesticides sur la santé respiratoire des
enfants et des adultes.
). Parmi les 14 études chez les
enfants, qui reposent principalement sur des cohortes
mères-enfants ou des cohortes d’enfants, trois n’ont pas mis en
évidence d’association entre l’exposition pré- ou post-natale
aux pesticides et la santé respiratoire de l’enfant. Cinq des
huit études qui reposaient sur des dosages biologiques pour
évaluer l’exposition ont mis en évidence des associations entre
l’exposition au DDE, plus particulièrement l’exposition
prénatale au DDE, et la prévalence de l’asthme ou des
sifflements et une étude identifiait une association entre la
perméthrine (un pyréthrinoïde) dans l’air intérieur pendant la
grossesse et les sifflements de l’enfant. La plupart des études
(quatre sur six) qui n’ont pas mesuré les pesticides pour
évaluer l’exposition ont mis en évidence des associations
significatives avec la prévalence de l’asthme ou des sifflements
chez les enfants. Les six études chez les adultes reposaient sur
des schémas d’étude différents (étude rétrospective suite à un
programme d’éradication de moustiques, étude exposés/non
exposés, étude transversale, étude de cohorte) et la moitié des
études n’identifiaient pas d’association significative. Les
auteurs de cette revue concluaient à la nécessité d’études
supplémentaires pour évaluer le rôle de l’exposition
environnementale aux pesticides sur la santé respiratoire des
enfants et des adultes. , voir en fin de ce chapitre) :
12 études basées sur des cohortes prospectives (principalement
en Europe ou aux États-Unis), une étude cas-témoins (Chine), et
une étude transversale (Canada). La plupart des études portaient
sur des populations d’enfants et l’exposition était évaluée par
des biomarqueurs dans 9 études : pesticides organochlorés (DDE,
DDT, DDD, 3 HCH, heptachlore) dans le sang du cordon (Gascon et
coll., 2014
, voir en fin de ce chapitre) :
12 études basées sur des cohortes prospectives (principalement
en Europe ou aux États-Unis), une étude cas-témoins (Chine), et
une étude transversale (Canada). La plupart des études portaient
sur des populations d’enfants et l’exposition était évaluée par
des biomarqueurs dans 9 études : pesticides organochlorés (DDE,
DDT, DDD, 3 HCH, heptachlore) dans le sang du cordon (Gascon et
coll., 2014 ) ou le sérum (Perla et coll.,
2015
) ou le sérum (Perla et coll.,
2015 ; Hansen et coll., 2016
; Hansen et coll., 2016 ; Meng et coll.,
2016
; Meng et coll.,
2016 ; Balte et coll., 2017
; Balte et coll., 2017 ; Abellan et coll.,
2019
; Abellan et coll.,
2019 ), métabolites urinaires des dialkylphosphates (DAP) (Perla et
coll., 2015
), métabolites urinaires des dialkylphosphates (DAP) (Perla et
coll., 2015 ; Raanan et coll.,
2015
; Raanan et coll.,
2015 ; Raanan et coll., 2016
; Raanan et coll., 2016 ), ou dosages urinaires reflétant
l’exposition aux fongicides dithiocarbamates (éthylène thiourée)
(Raherison et coll., 2019
), ou dosages urinaires reflétant
l’exposition aux fongicides dithiocarbamates (éthylène thiourée)
(Raherison et coll., 2019 ), par l’utilisation de système
d’information géographique dans deux études (Raanan et coll.,
2017
), par l’utilisation de système
d’information géographique dans deux études (Raanan et coll.,
2017 ; Gunier et coll., 2018
; Gunier et coll., 2018 ), et par la concentration de
56 pesticides dans l’air ambiant dans une étude (Raherison et
coll., 2019
), et par la concentration de
56 pesticides dans l’air ambiant dans une étude (Raherison et
coll., 2019 ). Les principaux résultats de ces
articles récents sont présentés ci-dessous (pour les articles
publiés avant 2013, se référer à la revue précédemment publiée
de Mamane et coll., 2015b
). Les principaux résultats de ces
articles récents sont présentés ci-dessous (pour les articles
publiés avant 2013, se référer à la revue précédemment publiée
de Mamane et coll., 2015b ).
). ). Mais l’étude ne mettait pas en évidence d’association avec
les sifflements, au cours de la vie, rapportés aux 4 ans de
l’enfant. Une étude récente sur 2 308 paires mères-enfants dans
la cohorte INMA suggère qu’une concentration augmentée de
p,p’-DDE chez la mère pendant la grossesse est associée à un
VEMS et une CVF abaissés à 4 et 7 ans, mais l’étude ne mettait
pas en évidence de relation dose-réponse et à 7 ans, les
associations étaient particulièrement observées pour les niveaux
d’exposition médians (Abellan et coll.,
2019
). Mais l’étude ne mettait pas en évidence d’association avec
les sifflements, au cours de la vie, rapportés aux 4 ans de
l’enfant. Une étude récente sur 2 308 paires mères-enfants dans
la cohorte INMA suggère qu’une concentration augmentée de
p,p’-DDE chez la mère pendant la grossesse est associée à un
VEMS et une CVF abaissés à 4 et 7 ans, mais l’étude ne mettait
pas en évidence de relation dose-réponse et à 7 ans, les
associations étaient particulièrement observées pour les niveaux
d’exposition médians (Abellan et coll.,
2019 ). Les résultats de 3 autres études récentes qui ont évalué
l’exposition post-natale au DDE sont soit négatifs soit positifs
mais nécessitent d’être interprétés avec prudence du fait de la
qualité des études. La cohorte NHANES sur 940 enfants âgés d’au
moins 12 ans ne mettait pas en évidence d’association
statistiquement significative avec l’asthme ou les sifflements,
bien qu’une tendance ait été observée avec les sifflements
(Perla et coll., 2015
). Les résultats de 3 autres études récentes qui ont évalué
l’exposition post-natale au DDE sont soit négatifs soit positifs
mais nécessitent d’être interprétés avec prudence du fait de la
qualité des études. La cohorte NHANES sur 940 enfants âgés d’au
moins 12 ans ne mettait pas en évidence d’association
statistiquement significative avec l’asthme ou les sifflements,
bien qu’une tendance ait été observée avec les sifflements
(Perla et coll., 2015 ). Une cohorte allemande sur
344 enfants vus entre 1 et 3 fois à 8 ans, 9 ans et 10 ans
(971 observations), n’observait pas d’association dans l’analyse
transversale, et les analyses prenant en compte le caractère
longitudinal de l’étude n’indiquaient pas d’effet direct de
l’exposition sur la fonction respiratoire (Balte et coll.,
2017
). Une cohorte allemande sur
344 enfants vus entre 1 et 3 fois à 8 ans, 9 ans et 10 ans
(971 observations), n’observait pas d’association dans l’analyse
transversale, et les analyses prenant en compte le caractère
longitudinal de l’étude n’indiquaient pas d’effet direct de
l’exposition sur la fonction respiratoire (Balte et coll.,
2017 ). Une étude sur 620 cas asthmatiques et 218 témoins, pour
lesquels les biomarqueurs ont été mesurés sur des pools de 5 cas
et de 2 témoins afin de minimiser les coûts de dosages,
indiquait une association positive avec le p,p’-DDE. Cette étude
montrait aussi une association positive avec
α-hexachlorocyclohexane, mais pas d’association avec
l’heptachlore (Meng et coll.,
2016
). Une étude sur 620 cas asthmatiques et 218 témoins, pour
lesquels les biomarqueurs ont été mesurés sur des pools de 5 cas
et de 2 témoins afin de minimiser les coûts de dosages,
indiquait une association positive avec le p,p’-DDE. Cette étude
montrait aussi une association positive avec
α-hexachlorocyclohexane, mais pas d’association avec
l’heptachlore (Meng et coll.,
2016 ). Chez l’adulte, une étude transversale canadienne sur
1 696 individus a observé une association statistiquement
significative entre p,p’-DDT et p,p’-DDE et un VEMS ou une CVF
diminué (Ye et coll., 2017
). Chez l’adulte, une étude transversale canadienne sur
1 696 individus a observé une association statistiquement
significative entre p,p’-DDT et p,p’-DDE et un VEMS ou une CVF
diminué (Ye et coll., 2017 ).
). ). L’absence d’association statistique peut résulter de
l’absence d’effet de ces expositions, mais possiblement aussi
d’une faible puissance statistique de l’étude compte tenu de
l’erreur de mesure sur l’exposition associée à la demi-vie
courte de ces métabolites. Dans ce contexte, un seul dosage
urinaire est insuffisant pour refléter précisément l’exposition
chronique. Dans la cohorte CHAMACOS, les six métabolites
urinaires des DAP ont été mesurés 2 fois pendant la grossesse (à
13 puis 26 semaines de gestation en moyenne) puis 5 fois chez
l’enfant entre 6 mois et 5 ans pour 359 couples mères-enfants.
La présence de symptômes respiratoires ou d’un traitement pour
l’asthme sur les 12 derniers mois, déclarée à 5 ou 7 ans, était
non significativement augmentée avec une concentration plus
élevée des DAP et plus spécifiquement des DE pendant la
grossesse, et l’association était significative en considérant
uniquement les dosages effectués pendant la seconde moitié de
grossesse (OR = 1,77 [1,06-2,95] pour une augmentation d’un
facteur 10 de la concentration des métabolites DAP) (Raanan et
coll., 2015
). L’absence d’association statistique peut résulter de
l’absence d’effet de ces expositions, mais possiblement aussi
d’une faible puissance statistique de l’étude compte tenu de
l’erreur de mesure sur l’exposition associée à la demi-vie
courte de ces métabolites. Dans ce contexte, un seul dosage
urinaire est insuffisant pour refléter précisément l’exposition
chronique. Dans la cohorte CHAMACOS, les six métabolites
urinaires des DAP ont été mesurés 2 fois pendant la grossesse (à
13 puis 26 semaines de gestation en moyenne) puis 5 fois chez
l’enfant entre 6 mois et 5 ans pour 359 couples mères-enfants.
La présence de symptômes respiratoires ou d’un traitement pour
l’asthme sur les 12 derniers mois, déclarée à 5 ou 7 ans, était
non significativement augmentée avec une concentration plus
élevée des DAP et plus spécifiquement des DE pendant la
grossesse, et l’association était significative en considérant
uniquement les dosages effectués pendant la seconde moitié de
grossesse (OR = 1,77 [1,06-2,95] pour une augmentation d’un
facteur 10 de la concentration des métabolites DAP) (Raanan et
coll., 2015 ). Pour ce même phénotype et pour la
toux induite par l’exercice, des associations de forte magnitude
étaient observées avec l’exposition post-natale (OR = 2,53
[1,32-4,86] et 5,40 [2,10-19,91] respectivement, pour une
augmentation d’un facteur 10 de la concentration des métabolites
DAP). Une autre étude qui portait sur les données spirométriques
disponibles pour 279 enfants à 7 ans n’identifiait pas
d’association avec les concentrations prénatales aux métabolites
de DAP, mais montrait qu’une concentration postnatale aux
métabolites des DAP était significativement associée à un VEMS
et une CVF significativement diminués (Raanan et coll.,
2016
). Pour ce même phénotype et pour la
toux induite par l’exercice, des associations de forte magnitude
étaient observées avec l’exposition post-natale (OR = 2,53
[1,32-4,86] et 5,40 [2,10-19,91] respectivement, pour une
augmentation d’un facteur 10 de la concentration des métabolites
DAP). Une autre étude qui portait sur les données spirométriques
disponibles pour 279 enfants à 7 ans n’identifiait pas
d’association avec les concentrations prénatales aux métabolites
de DAP, mais montrait qu’une concentration postnatale aux
métabolites des DAP était significativement associée à un VEMS
et une CVF significativement diminués (Raanan et coll.,
2016 ).
). ). Une seconde étude ciblait l’utilisation agricole de bromure
de méthyle, chloropicrine, métham sodium et 1,3-dichloro-propène
par fumigation autour du domicile des enfants et explorait
différentes fenêtres d’exposition (grossesse, 0-7 ans,
12 derniers mois). Dans cette étude, aucune association n’était
observée avec les symptômes respiratoires à 7 ans, et
inversement à l’hypothèse testée, l’exposition prénatale au
bromure de méthyle et à la chloropicrine était associée à un
VEMS et un DEM25-75 augmenté (Gunier et coll.,
2018
). Une seconde étude ciblait l’utilisation agricole de bromure
de méthyle, chloropicrine, métham sodium et 1,3-dichloro-propène
par fumigation autour du domicile des enfants et explorait
différentes fenêtres d’exposition (grossesse, 0-7 ans,
12 derniers mois). Dans cette étude, aucune association n’était
observée avec les symptômes respiratoires à 7 ans, et
inversement à l’hypothèse testée, l’exposition prénatale au
bromure de méthyle et à la chloropicrine était associée à un
VEMS et un DEM25-75 augmenté (Gunier et coll.,
2018 ).
). ). En revanche une concentration urinaire d’éthylène thiourée
(biomarqueur d’une exposition au fongicide dithiocarbamates)
augmentée était associée à un score de symptômes d’asthme et
rhinite plus élevé.
). En revanche une concentration urinaire d’éthylène thiourée
(biomarqueur d’une exposition au fongicide dithiocarbamates)
augmentée était associée à un score de symptômes d’asthme et
rhinite plus élevé. ). Après ajustement sur plusieurs facteurs de confusion
potentiels, des associations transversales significatives
étaient observées avec un niveau abaissé du VEMS, de la CVF et
du DEM25-75, mais l’analyse longitudinale ne mettait
pas en évidence d’association avec l’évolution de la fonction
respiratoire.
). Après ajustement sur plusieurs facteurs de confusion
potentiels, des associations transversales significatives
étaient observées avec un niveau abaissé du VEMS, de la CVF et
du DEM25-75, mais l’analyse longitudinale ne mettait
pas en évidence d’association avec l’évolution de la fonction
respiratoire. ). Une seconde étude sur 16 enfants asthmatiques suivis à
intervalle régulier de 6 jours pendant 4 mois identifiait une
association positive entre des métabolites urinaires des
dialkylphosphates et le dosage urinaire des leucotriènes E4, un
marqueur d’inflammation bronchique, mais l’étude n’incluait pas
d’information sur les symptômes respiratoires ou la fonction
ventilatoire (Benka-Coker et coll.,
2019
). Une seconde étude sur 16 enfants asthmatiques suivis à
intervalle régulier de 6 jours pendant 4 mois identifiait une
association positive entre des métabolites urinaires des
dialkylphosphates et le dosage urinaire des leucotriènes E4, un
marqueur d’inflammation bronchique, mais l’étude n’incluait pas
d’information sur les symptômes respiratoires ou la fonction
ventilatoire (Benka-Coker et coll.,
2019 ).
). (voir
en fin de ce chapitre) pour les expositions aux pesticides sans
distinction des substances actives. Il reste difficile
d’identifier précisément les substances associées à une
altération de la santé respiratoire. Cependant, principalement
sur la base de l’ensemble des résultats sur la santé
respiratoire de l’AHS, la plus large étude à avoir évalué les
expositions spécifiques sur différents paramètres de la santé
respiratoire (tableau 16.II
(voir
en fin de ce chapitre) pour les expositions aux pesticides sans
distinction des substances actives. Il reste difficile
d’identifier précisément les substances associées à une
altération de la santé respiratoire. Cependant, principalement
sur la base de l’ensemble des résultats sur la santé
respiratoire de l’AHS, la plus large étude à avoir évalué les
expositions spécifiques sur différents paramètres de la santé
respiratoire (tableau 16.II , voir en fin de ce chapitre), une
liste de 17 produits qui présentent un lien possible avec des
symptômes respiratoires, la fonction ventilatoire, l’asthme ou
la BPCO ont été retenus, dont 11 insecticides et 6 herbicides
(tableau 16.V
, voir en fin de ce chapitre), une
liste de 17 produits qui présentent un lien possible avec des
symptômes respiratoires, la fonction ventilatoire, l’asthme ou
la BPCO ont été retenus, dont 11 insecticides et 6 herbicides
(tableau 16.V , voir
en fin de ce chapitre).
, voir
en fin de ce chapitre).Données toxicologiques
 , voir en
fin de ce chapitre), une recherche a été conduite sur les mécanismes
pouvant contribuer au développement des pathologies respiratoires
induites par ces substances actives. La plupart sont aujourd’hui
interdites d’utilisation en France (14/17) mais une majorité d’entre
elles sont persistantes dans l’environnement ; 3 pesticides sont
actuellement autorisés pour un emploi en agriculture ou élevage
(tableau 16.VI
, voir en
fin de ce chapitre), une recherche a été conduite sur les mécanismes
pouvant contribuer au développement des pathologies respiratoires
induites par ces substances actives. La plupart sont aujourd’hui
interdites d’utilisation en France (14/17) mais une majorité d’entre
elles sont persistantes dans l’environnement ; 3 pesticides sont
actuellement autorisés pour un emploi en agriculture ou élevage
(tableau 16.VI , voir en
fin de ce chapitre). La liste des pesticides a été élargie à
7 autres substances sur une base moins restrictive à partir des
classifications, de données provenant de la médecine du travail et
d’indication faible dans les études épidémiologiques :
3 insecticides (carbofuran, cyfluthrine, cyperméthrine), 1 herbicide
(pendiméthaline) et 3 fongicides (captafol, chlorothalonil,
fluaziname). Des études de cas ont rapporté le développement d’un
asthme professionnel chez des travailleurs exposés à ces trois
fongicides (Royce et coll., 1993
, voir en
fin de ce chapitre). La liste des pesticides a été élargie à
7 autres substances sur une base moins restrictive à partir des
classifications, de données provenant de la médecine du travail et
d’indication faible dans les études épidémiologiques :
3 insecticides (carbofuran, cyfluthrine, cyperméthrine), 1 herbicide
(pendiméthaline) et 3 fongicides (captafol, chlorothalonil,
fluaziname). Des études de cas ont rapporté le développement d’un
asthme professionnel chez des travailleurs exposés à ces trois
fongicides (Royce et coll., 1993 ; Draper et coll.,
2003
; Draper et coll.,
2003 )
(tableau 16.VII
)
(tableau 16.VII , voir
en fin de ce chapitre).
, voir
en fin de ce chapitre). et
VII
et
VII , voir en fin de ce
chapitre).
, voir en fin de ce
chapitre).Mécanismes généraux de toxicité
Stress oxydatif
 , voir en fin de ce
chapitre).
, voir en fin de ce
chapitre). ,
voir en fin de ce chapitre). L’induction d’un stress
oxydatif caractérisé par la production d’espèces réactives
de l’oxygène (ROS) et/ou de l’oxydation de macromolécules
et/ou la régulation des systèmes de défense est retrouvée
pour les 30 pesticides plus le PBO. Bien que les modèles
in vivo ou in vitro ne ciblent pas
directement une toxicité pulmonaire, ces résultats indiquent
un potentiel effet pro-inflammatoire au niveau pulmonaire
qui dépend en outre de la voie d’exposition, des doses
utilisées et du temps d’exposition.
,
voir en fin de ce chapitre). L’induction d’un stress
oxydatif caractérisé par la production d’espèces réactives
de l’oxygène (ROS) et/ou de l’oxydation de macromolécules
et/ou la régulation des systèmes de défense est retrouvée
pour les 30 pesticides plus le PBO. Bien que les modèles
in vivo ou in vitro ne ciblent pas
directement une toxicité pulmonaire, ces résultats indiquent
un potentiel effet pro-inflammatoire au niveau pulmonaire
qui dépend en outre de la voie d’exposition, des doses
utilisées et du temps d’exposition.Mitotoxicité
 ,
voir en fin de ce chapitre). Les expérimentations chez les
rongeurs sont conduites sur la base d’une analyse de la
neurotoxicité et l’extrapolation au parenchyme pulmonaire
doit être vérifiée. Le modèle C. elegans dans une
expérimentation de neurotoxicité montre un effet sur le
fonctionnement mitochondrial avec production de ROS suite à
une exposition au glyphosate (Bailey et coll.,
2018
,
voir en fin de ce chapitre). Les expérimentations chez les
rongeurs sont conduites sur la base d’une analyse de la
neurotoxicité et l’extrapolation au parenchyme pulmonaire
doit être vérifiée. Le modèle C. elegans dans une
expérimentation de neurotoxicité montre un effet sur le
fonctionnement mitochondrial avec production de ROS suite à
une exposition au glyphosate (Bailey et coll.,
2018 ). De même, le fluaziname provoque
un effet de découplage de la chaîne respiratoire chez le
poisson zèbre (Wang et coll.,
2018
). De même, le fluaziname provoque
un effet de découplage de la chaîne respiratoire chez le
poisson zèbre (Wang et coll.,
2018 ). Cependant si ces modèles in
vivo sont informatifs sur les mécanismes de
toxicité, l’extrapolation au système pulmonaire mérite des
compléments expérimentaux en ciblant les mitochondries du
parenchyme pulmonaire.
). Cependant si ces modèles in
vivo sont informatifs sur les mécanismes de
toxicité, l’extrapolation au système pulmonaire mérite des
compléments expérimentaux en ciblant les mitochondries du
parenchyme pulmonaire.Immunomodulation
 ).
). , voir en fin de ce chapitre),
les organophosphorés sont décrits depuis une vingtaine
d’années comme des agents susceptibles d’interférence avec
le système immunitaire conduisant à un effet immunotoxique
reposant sur des réseaux de régulation à la fois
cholinergique et non cholinergique (Galloway et Handy,
2003
, voir en fin de ce chapitre),
les organophosphorés sont décrits depuis une vingtaine
d’années comme des agents susceptibles d’interférence avec
le système immunitaire conduisant à un effet immunotoxique
reposant sur des réseaux de régulation à la fois
cholinergique et non cholinergique (Galloway et Handy,
2003 ). L’immunotoxicité résultant de
l’action de carbamates et des organophosphorés reposerait
non exclusivement sur les mécanismes suivants :
). L’immunotoxicité résultant de
l’action de carbamates et des organophosphorés reposerait
non exclusivement sur les mécanismes suivants : ).
). ). Des agriculteurs exposés au DDT
ont été suivis et la concentration plasmatique de DDE est
corrélée à une diminution de concentration d’IgG (Cooper
Glinda et coll., 2004
). Des agriculteurs exposés au DDT
ont été suivis et la concentration plasmatique de DDE est
corrélée à une diminution de concentration d’IgG (Cooper
Glinda et coll., 2004 ). Les concentrations plasmatiques
de pentachlorophénol (PCP), hexachlorocyclohexane (HCH),
polychlorobiphényles (PCB) et hexachlorobenzène (HCB) ont
été déterminées chez des agriculteurs exposés ainsi que
celles de marqueurs immunitaires. Les résultats indiquent
que l’exposition aux PCP, HCB ou HCH est associée à des
anomalies du système immunitaire mais de faible intensité
(Daniel et coll., 2001
). Les concentrations plasmatiques
de pentachlorophénol (PCP), hexachlorocyclohexane (HCH),
polychlorobiphényles (PCB) et hexachlorobenzène (HCB) ont
été déterminées chez des agriculteurs exposés ainsi que
celles de marqueurs immunitaires. Les résultats indiquent
que l’exposition aux PCP, HCB ou HCH est associée à des
anomalies du système immunitaire mais de faible intensité
(Daniel et coll., 2001 ). Par exemple pour une exposition
d’agriculteurs au HCB, il est retrouvé à long terme une
suppression de la production d’IFN-γ (Daniel et coll.,
2001
). Par exemple pour une exposition
d’agriculteurs au HCB, il est retrouvé à long terme une
suppression de la production d’IFN-γ (Daniel et coll.,
2001 ). Une autre étude montre une
augmentation des concentrations d’IgG et IgM chez des
agriculteurs exposés au HCB (Queiroz et coll.,
1998
). Une autre étude montre une
augmentation des concentrations d’IgG et IgM chez des
agriculteurs exposés au HCB (Queiroz et coll.,
1998 ). Une analyse in vitro
d’un effet immunomodulateur sur des cellules NK humaines
induit par 11 organochlorés et dérivés a conclu à un effet
inhibiteur sur les fonctions des cellules NK, le PCP
correspondant à l’agent le plus efficace. En outre, ces
composés exercent un effet immunomodulateur sur d’autres
cellules mononucléées, cellules T et B ainsi que sur des
monocytes (Reed et coll.,
2004
). Une analyse in vitro
d’un effet immunomodulateur sur des cellules NK humaines
induit par 11 organochlorés et dérivés a conclu à un effet
inhibiteur sur les fonctions des cellules NK, le PCP
correspondant à l’agent le plus efficace. En outre, ces
composés exercent un effet immunomodulateur sur d’autres
cellules mononucléées, cellules T et B ainsi que sur des
monocytes (Reed et coll.,
2004 ).
). ).
).Mécanismes épigénétiques
 ). Une cohorte néerlandaise en
population générale a montré que l’exposition
professionnelle à des pesticides est associée à un profil de
méthylation différent en particulier pour le sous-groupe des
patients avec une obstruction bronchique (van der Plaat et
coll., 2018
). Une cohorte néerlandaise en
population générale a montré que l’exposition
professionnelle à des pesticides est associée à un profil de
méthylation différent en particulier pour le sous-groupe des
patients avec une obstruction bronchique (van der Plaat et
coll., 2018 ). L’analyse de la méthylation de
l’ADN a été réalisée sur des prélèvements sanguins de
patients et sur les 21 sites CpG différentiellement
méthylés, 20 d’entre eux étaient associés à une forte dose
d’exposition. Parmi les gènes identifiés sur la base de ces
20 CpG, certains sont connus comme associés à la
physiopathologie pulmonaire tels que : ALLC,
PTPRN2, LRRC3B et PAX2.
). L’analyse de la méthylation de
l’ADN a été réalisée sur des prélèvements sanguins de
patients et sur les 21 sites CpG différentiellement
méthylés, 20 d’entre eux étaient associés à une forte dose
d’exposition. Parmi les gènes identifiés sur la base de ces
20 CpG, certains sont connus comme associés à la
physiopathologie pulmonaire tels que : ALLC,
PTPRN2, LRRC3B et PAX2.Exemple de pesticides et mécanismes spécifiques
impliqués
dans la toxicité pulmonaire
Organophosphorés et carbamates
 ; Deschamps et coll.,
1994
; Deschamps et coll.,
1994 ). L’abondante littérature sur la
toxicité des organophosphorés rapporte les effets observés
en toxicité aiguë à forte dose à la fois lors d’une approche
médicale d’un traitement du toxidrome induit par ces
insecticides mais aussi par utilisation de ces molécules en
tant que gaz de combat. Une explication des effets toxiques
pulmonaires des organophosphorés repose sur l’inhibition de
l’acétylcholinestérase (AChE, EC 3.1.1.7), enzyme de
dégradation de l’acétylcholine (ACh) ciblée par des
organophosphorés et carbamates (Senthilselvan et coll.,
1992
). L’abondante littérature sur la
toxicité des organophosphorés rapporte les effets observés
en toxicité aiguë à forte dose à la fois lors d’une approche
médicale d’un traitement du toxidrome induit par ces
insecticides mais aussi par utilisation de ces molécules en
tant que gaz de combat. Une explication des effets toxiques
pulmonaires des organophosphorés repose sur l’inhibition de
l’acétylcholinestérase (AChE, EC 3.1.1.7), enzyme de
dégradation de l’acétylcholine (ACh) ciblée par des
organophosphorés et carbamates (Senthilselvan et coll.,
1992 ). L’inhibition de l’AChE
provoque une augmentation d’ACh responsable d’une
sur-stimulation cholinergique dans le système nerveux mais
aussi au niveau des tissus périphériques conduisant
potentiellement à une détresse respiratoire. Le système
cholinergique présente une variété importante d’acteurs,
qu’il convient de rappeler.
). L’inhibition de l’AChE
provoque une augmentation d’ACh responsable d’une
sur-stimulation cholinergique dans le système nerveux mais
aussi au niveau des tissus périphériques conduisant
potentiellement à une détresse respiratoire. Le système
cholinergique présente une variété importante d’acteurs,
qu’il convient de rappeler.Liaison de l’acétylcholine (ACh) à des
récepteurs muscariniques
et
nicotiniques
 ). Au niveau des voies
respiratoires humaines, seuls trois types sont détectés
(M1, M2 et M3) avec une expression élevée de M1 au
niveau du poumon et des voies alvéolaires alors que M2
et M3 sont majoritairement exprimés au niveau des voies
aériennes proximales (Gwilt et coll.,
2007
). Au niveau des voies
respiratoires humaines, seuls trois types sont détectés
(M1, M2 et M3) avec une expression élevée de M1 au
niveau du poumon et des voies alvéolaires alors que M2
et M3 sont majoritairement exprimés au niveau des voies
aériennes proximales (Gwilt et coll.,
2007 ). Ces récepteurs sont
exprimés dans presque chaque type cellulaire, incluant
le muscle lisse des voies respiratoires et vasculaires,
les différentes cellules épithéliales de surface et des
glandes sous-muqueuses, les cellules endothéliales ainsi
que la majorité des cellules immunitaires (Racké et
coll., 2006
). Ces récepteurs sont
exprimés dans presque chaque type cellulaire, incluant
le muscle lisse des voies respiratoires et vasculaires,
les différentes cellules épithéliales de surface et des
glandes sous-muqueuses, les cellules endothéliales ainsi
que la majorité des cellules immunitaires (Racké et
coll., 2006 ). L’activation des
récepteurs M3 provoque une broncho-constriction ainsi
que la sécrétion de mucus dans les voies aériennes. En
revanche, les récepteurs M2 des nerfs parasympathiques
exercent une activité autorégulatrice en diminuant le
relargage d’ACh par le nerf vague limitant ainsi l’effet
bronchoconstricteur induit via les récepteurs M3.
Outre un effet direct du neuromédiateur, le NO a été
impliqué dans le dysfonctionnement du récepteur M2
(Coulson et Fryer, 2003
). L’activation des
récepteurs M3 provoque une broncho-constriction ainsi
que la sécrétion de mucus dans les voies aériennes. En
revanche, les récepteurs M2 des nerfs parasympathiques
exercent une activité autorégulatrice en diminuant le
relargage d’ACh par le nerf vague limitant ainsi l’effet
bronchoconstricteur induit via les récepteurs M3.
Outre un effet direct du neuromédiateur, le NO a été
impliqué dans le dysfonctionnement du récepteur M2
(Coulson et Fryer, 2003 ).
). ). Il existe différents
isotypes des récepteurs nicotiniques avec un arrangement
des sous-unités différent selon leur localisation :
i) au niveau des jonctions neuromusculaires
des muscles somatiques, ii) au niveau
ganglionnaire, iii) mais aussi exprimé par
différentes cellules dont celles du poumon et des voies
aériennes (bronchiques, alvéolaires, glandulaires,
endothéliales, macrophages...) (Racké et coll.,
2006
). Il existe différents
isotypes des récepteurs nicotiniques avec un arrangement
des sous-unités différent selon leur localisation :
i) au niveau des jonctions neuromusculaires
des muscles somatiques, ii) au niveau
ganglionnaire, iii) mais aussi exprimé par
différentes cellules dont celles du poumon et des voies
aériennes (bronchiques, alvéolaires, glandulaires,
endothéliales, macrophages...) (Racké et coll.,
2006 ).
). ; Pfeil et coll.,
2003
; Pfeil et coll.,
2003 ). L’ACh relarguée par les
cellules non neuronales peut cibler les récepteurs
nicotiniques et muscariniques et est impliquée dans
l’adhésion et la prolifération des cellules épithéliales
ainsi que dans le contrôle de la production de
l’histamine par les mastocytes (Racké et coll.,
2006
). L’ACh relarguée par les
cellules non neuronales peut cibler les récepteurs
nicotiniques et muscariniques et est impliquée dans
l’adhésion et la prolifération des cellules épithéliales
ainsi que dans le contrôle de la production de
l’histamine par les mastocytes (Racké et coll.,
2006 ). En conséquence, ce système
cholinergique non neuronal exprimé par les cellules
inflammatoires joue un rôle potentiel dans le processus
d’initiation ou d’exacerbation de la BPCO et de l’asthme
(Gwilt et coll., 2007
). En conséquence, ce système
cholinergique non neuronal exprimé par les cellules
inflammatoires joue un rôle potentiel dans le processus
d’initiation ou d’exacerbation de la BPCO et de l’asthme
(Gwilt et coll., 2007 ).
).Mécanismes toxicologiques à des concentrations qui n’inhibent pas l’acétylcholinestérase (AChE)
 ). Le mécanisme repose sur une
inhibition des récepteurs muscariniques auto-inhibiteurs
M2 des nerfs parasympathiques alimentant les muscles
lisses des voies respiratoires (Coulson et Fryer,
2003
). Le mécanisme repose sur une
inhibition des récepteurs muscariniques auto-inhibiteurs
M2 des nerfs parasympathiques alimentant les muscles
lisses des voies respiratoires (Coulson et Fryer,
2003 ). La perte de fonction des
récepteurs M2 (inhibant le relargage d’ACh par le nerf
vague, voir plus haut) entraîne donc une augmentation de
la libération d’ACh par les nerfs parasympathiques, ce
qui potentialise la bronchoconstriction par voie vagale
contribuant à l’hyperréactivité des voies respiratoires.
Ce mécanisme est en accord avec des études antérieures
démontrant que les récepteurs M2 neuronaux étaient
dysfonctionnels pour des modèles animaux développant un
syndrome asthmatique (Fryer et Wills-Karp,
1991
). La perte de fonction des
récepteurs M2 (inhibant le relargage d’ACh par le nerf
vague, voir plus haut) entraîne donc une augmentation de
la libération d’ACh par les nerfs parasympathiques, ce
qui potentialise la bronchoconstriction par voie vagale
contribuant à l’hyperréactivité des voies respiratoires.
Ce mécanisme est en accord avec des études antérieures
démontrant que les récepteurs M2 neuronaux étaient
dysfonctionnels pour des modèles animaux développant un
syndrome asthmatique (Fryer et Wills-Karp,
1991 ). Le même résultat a été
observé chez des cochons d’Inde suite à une exposition
au parathion et diazinon par injection sous-cutanée
(Lein et Fryer, 2004
). Le même résultat a été
observé chez des cochons d’Inde suite à une exposition
au parathion et diazinon par injection sous-cutanée
(Lein et Fryer, 2004 ). De plus, la production de
mucus en partie contrôlée par l’activité des récepteurs
M2 est augmentée suite à l’exposition aux
organophosphorés (Rogers,
2001
). De plus, la production de
mucus en partie contrôlée par l’activité des récepteurs
M2 est augmentée suite à l’exposition aux
organophosphorés (Rogers,
2001 ).
). ; Zhang et coll.,
2007
; Zhang et coll.,
2007 ). En retour, un blocage de
TNF-α ou IL-1β avec des agonistes spécifiques protège
d’une hyperréactivité bronchique causée par des
allergènes. Ainsi, des liposomes-clodronate ont été
utilisés pour induire une apoptose de macrophages
alvéolaires (administration J1 et J3) chez des cochons
d’Inde traités à J4 avec 1 mg/kg en injection s.c avec
du parathion. L’effet protecteur du clodronate (qui
limite donc le nombre de macrophages par stimulation de
l’apoptose) confirme que le parathion active les
macrophages lesquels induisent une hyperréactivité des
bronches (Proskocil et coll.,
2013
). En retour, un blocage de
TNF-α ou IL-1β avec des agonistes spécifiques protège
d’une hyperréactivité bronchique causée par des
allergènes. Ainsi, des liposomes-clodronate ont été
utilisés pour induire une apoptose de macrophages
alvéolaires (administration J1 et J3) chez des cochons
d’Inde traités à J4 avec 1 mg/kg en injection s.c avec
du parathion. L’effet protecteur du clodronate (qui
limite donc le nombre de macrophages par stimulation de
l’apoptose) confirme que le parathion active les
macrophages lesquels induisent une hyperréactivité des
bronches (Proskocil et coll.,
2013 ).
). ). Le mécanisme est à nouveau
indépendant de l’inhibition de l’AChE avec une
concentration de l’ordre de celle retrouvée dans
l’environnement. L’exposition au chlorpyrifos contribue
à une exacerbation de l’asthme avec un effet plus marqué
chez les femelles (réponse à 24 h et 7 j) que chez les
mâles (réponse à 7 j). Cette sensibilité plus forte des
femelles n’implique pas que le mécanisme impliqué dans
l’hyperréactivité bronchique soit identique entre les
deux sexes (Shaffo et coll.,
2018b
). Le mécanisme est à nouveau
indépendant de l’inhibition de l’AChE avec une
concentration de l’ordre de celle retrouvée dans
l’environnement. L’exposition au chlorpyrifos contribue
à une exacerbation de l’asthme avec un effet plus marqué
chez les femelles (réponse à 24 h et 7 j) que chez les
mâles (réponse à 7 j). Cette sensibilité plus forte des
femelles n’implique pas que le mécanisme impliqué dans
l’hyperréactivité bronchique soit identique entre les
deux sexes (Shaffo et coll.,
2018b ).
). ).
). ). Le bénomyl induit un stress
oxydant en exposition aiguë mais aussi en exposition
chronique avec une augmentation de la peroxydation des
lipides (LPO) (Banks et Soliman,
1997
). Le bénomyl induit un stress
oxydant en exposition aiguë mais aussi en exposition
chronique avec une augmentation de la peroxydation des
lipides (LPO) (Banks et Soliman,
1997 ). Or un effet stress oxydant
outre son action directe, contribue à l’effet
immunotoxique rapporté pour les carbamates (Gao et
coll., 2015
). Or un effet stress oxydant
outre son action directe, contribue à l’effet
immunotoxique rapporté pour les carbamates (Gao et
coll., 2015 ).
).Organochlorés
 ). Le développement des poumons
résulte d’une interaction complexe entre facteurs de
croissance, hormones, facteurs génétiques et
environnementaux. Les récepteurs œstrogéniques et
androgéniques sont exprimés dans les poumons et leur
modulation joue un rôle important dans le développement des
poumons du fœtus (Carey et coll.,
2007
). Le développement des poumons
résulte d’une interaction complexe entre facteurs de
croissance, hormones, facteurs génétiques et
environnementaux. Les récepteurs œstrogéniques et
androgéniques sont exprimés dans les poumons et leur
modulation joue un rôle important dans le développement des
poumons du fœtus (Carey et coll.,
2007 ).
). ). L’activation de AhR a été
associée entre autres à un retard de développement du poumon
chez le rat et à une réponse pro-inflammatoire (Kransler et
coll., 2008
). L’activation de AhR a été
associée entre autres à un retard de développement du poumon
chez le rat et à une réponse pro-inflammatoire (Kransler et
coll., 2008 ). Ce récepteur détecte par
ailleurs de nombreux polluants environnementaux et
l’hypothèse d’une sensibilisation du système pulmonaire par
les organochlorés liée à une augmentation de AhR n’est donc
pas exclue.
). Ce récepteur détecte par
ailleurs de nombreux polluants environnementaux et
l’hypothèse d’une sensibilisation du système pulmonaire par
les organochlorés liée à une augmentation de AhR n’est donc
pas exclue.Un effet d’exacerbation du syndrome asthmatique ?
 ).
). ) induit une inflammation
pulmonaire. À dose plus faible il conduit à
l’exacerbation de l’inflammation induite par une
instillation nasale de LPS.
) induit une inflammation
pulmonaire. À dose plus faible il conduit à
l’exacerbation de l’inflammation induite par une
instillation nasale de LPS.Pyréthrinoïdes
 ; Koureas et coll.,
2012
; Koureas et coll.,
2012 ). Chez les mammifères exposés aux
pyréthrinoïdes, les comportements moteurs, sexuels,
d’apprentissage, d’anxiété et de peur peuvent être modifiés.
Chez l’être humain, les symptômes rapportés à la suite d’une
exposition domestique chronique comprennent des nausées,
vertiges et douleurs respiratoires mais ces symptômes sont
non spécifiques et difficiles à relier à une simple
exposition aux pyréthrinoïdes.
). Chez les mammifères exposés aux
pyréthrinoïdes, les comportements moteurs, sexuels,
d’apprentissage, d’anxiété et de peur peuvent être modifiés.
Chez l’être humain, les symptômes rapportés à la suite d’une
exposition domestique chronique comprennent des nausées,
vertiges et douleurs respiratoires mais ces symptômes sont
non spécifiques et difficiles à relier à une simple
exposition aux pyréthrinoïdes. ). Cet insecticide était considéré
comme peu toxique pour l’être humain mais montre cependant à
dose sub-létale en chronique de nombreux effets toxiques en
particulier neurotoxicité, génotoxicité, toxicité de la
reproduction, fœtotoxicité (Zhao et coll.,
2016
). Cet insecticide était considéré
comme peu toxique pour l’être humain mais montre cependant à
dose sub-létale en chronique de nombreux effets toxiques en
particulier neurotoxicité, génotoxicité, toxicité de la
reproduction, fœtotoxicité (Zhao et coll.,
2016 ). Des publications en nombre
croissant proposent que le stress oxydant puisse représenter
l’un des mécanismes de toxicité, effet observé chez diverses
espèces animales (rats, souris, poisson zèbre, palourdes).
Si la toxicité pulmonaire n’a pas été identifiée, voire
recherchée, sur les modèles expérimentaux, l’effet stress
oxydant peut être le support d’un mécanisme de toxicité en
rapport avec une association entre exposition et santé
pulmonaire trouvée d’après des résultats
d’épidémiologie.
). Des publications en nombre
croissant proposent que le stress oxydant puisse représenter
l’un des mécanismes de toxicité, effet observé chez diverses
espèces animales (rats, souris, poisson zèbre, palourdes).
Si la toxicité pulmonaire n’a pas été identifiée, voire
recherchée, sur les modèles expérimentaux, l’effet stress
oxydant peut être le support d’un mécanisme de toxicité en
rapport avec une association entre exposition et santé
pulmonaire trouvée d’après des résultats
d’épidémiologie.Paraquat
 ). Le paraquat est connu comme
toxique pulmonaire en exposition aiguë (accident ou suicide)
en raison de ses effets pro-oxydants conduisant à une
fibrose pulmonaire. Cet agent est un irritant (classement
CLP, H335) et s’il n’est pas responsable d’une intoxication
systémique notable lors d’un épandage, il peut induire une
irritation des voies aériennes supérieures avec épistaxis,
douleurs buccopharyngées et toux.
). Le paraquat est connu comme
toxique pulmonaire en exposition aiguë (accident ou suicide)
en raison de ses effets pro-oxydants conduisant à une
fibrose pulmonaire. Cet agent est un irritant (classement
CLP, H335) et s’il n’est pas responsable d’une intoxication
systémique notable lors d’un épandage, il peut induire une
irritation des voies aériennes supérieures avec épistaxis,
douleurs buccopharyngées et toux.Toxicité potentielle de pesticides non
identifiés actuellement
en
épidémiologie
 ). Sur la lignée macrophagique THP-1, le mancozèbe module la
réponse induite par les lipopolysaccharides bactériens (LPS) en
diminuant la production de TNF-α (Corsini et coll.,
2006
). Sur la lignée macrophagique THP-1, le mancozèbe module la
réponse induite par les lipopolysaccharides bactériens (LPS) en
diminuant la production de TNF-α (Corsini et coll.,
2006 ). De plus, le mancozèbe active le processus inflammatoire
caractérisé par une augmentation de la prolifération de cellules
RAW 264.7 et la production de cytokines pro-inflammatoires
IL-1β, IL-6, TNF-α, et IFN-γ (Weis et coll.,
2019
). De plus, le mancozèbe active le processus inflammatoire
caractérisé par une augmentation de la prolifération de cellules
RAW 264.7 et la production de cytokines pro-inflammatoires
IL-1β, IL-6, TNF-α, et IFN-γ (Weis et coll.,
2019 ).
). ). Le méthoxychlore agissant comme un
xénoestrogène environnemental amplifie le processus de
dégranulation des mastocytes in vitro testé sur la lignée
RBL-2H3 (issue d’une leucémie basophile du rat) et sur des
cellules de moelle osseuse de souris (BBMC, bone marrow
mononuclear cell) (Yasunaga et coll.,
2015
). Le méthoxychlore agissant comme un
xénoestrogène environnemental amplifie le processus de
dégranulation des mastocytes in vitro testé sur la lignée
RBL-2H3 (issue d’une leucémie basophile du rat) et sur des
cellules de moelle osseuse de souris (BBMC, bone marrow
mononuclear cell) (Yasunaga et coll.,
2015 ). Cette fonction peut être en rapport avec une exacerbation
de réactions inflammatoires potentiellement au niveau
pulmonaire.
). Cette fonction peut être en rapport avec une exacerbation
de réactions inflammatoires potentiellement au niveau
pulmonaire. ).
). ).
). ).
). ). Or l’augmentation d’expression de
Wnt-6 avec l’activation de la voie Wnt/PCP induit une
polarisation des macrophages en phénotype M2 (macrophage
alternativement activé impliquant l’expression entre autres de
c-myc) (Schaale et coll., 2013
). Or l’augmentation d’expression de
Wnt-6 avec l’activation de la voie Wnt/PCP induit une
polarisation des macrophages en phénotype M2 (macrophage
alternativement activé impliquant l’expression entre autres de
c-myc) (Schaale et coll., 2013 ).
). ). Cependant, le PBO conduit aussi à
une réaction d’exacerbation de la réaction asthmatique
allergique bien qu’avec un effet moins prononcé que celui trouvé
pour le parathion (Nishino et coll.,
2013
). Cependant, le PBO conduit aussi à
une réaction d’exacerbation de la réaction asthmatique
allergique bien qu’avec un effet moins prononcé que celui trouvé
pour le parathion (Nishino et coll.,
2013 ), résultat qui peut être rapproché des données
épidémiologiques.
), résultat qui peut être rapproché des données
épidémiologiques.Conclusion
 ;
Pourhassan et coll., 2019
;
Pourhassan et coll., 2019 ).
). , voir en
fin de ce chapitre). Les études exposés-non exposés ou les études
transversales conduites dans différentes régions du monde convergent
pour indiquer un effet délétère de l’exposition professionnelle aux
pesticides sur la santé respiratoire, et plus particulièrement les
symptômes respiratoires, l’asthme, la fonction respiratoire, bien
que la plupart de ces études aient été conduites sur des
échantillons de petite à moyenne taille (< 300). En milieu
professionnel, les études sur les cohortes d’agriculteurs, avec en
premier lieu la cohorte AHS qui a évalué l’utilisation de pesticides
spécifiques sur un large nombre d’agriculteurs (> 20 000), ont
permis d’identifier des substances candidates pour la santé
respiratoire (tableau 16.V
, voir en
fin de ce chapitre). Les études exposés-non exposés ou les études
transversales conduites dans différentes régions du monde convergent
pour indiquer un effet délétère de l’exposition professionnelle aux
pesticides sur la santé respiratoire, et plus particulièrement les
symptômes respiratoires, l’asthme, la fonction respiratoire, bien
que la plupart de ces études aient été conduites sur des
échantillons de petite à moyenne taille (< 300). En milieu
professionnel, les études sur les cohortes d’agriculteurs, avec en
premier lieu la cohorte AHS qui a évalué l’utilisation de pesticides
spécifiques sur un large nombre d’agriculteurs (> 20 000), ont
permis d’identifier des substances candidates pour la santé
respiratoire (tableau 16.V ,
voir en fin de ce chapitre).
,
voir en fin de ce chapitre). , voir en fin de ce chapitre). Les trois effets recherchés, stress
oxydant, mitotoxicité et immunomodulation de la réponse
inflammatoire sont retrouvés pour le chlorpyrifos et la perméthrine.
La participation de deux facteurs (stress oxydant et mitotoxicité)
est retrouvée pour le malathion, l’HCH, le DDT, l’atrazine, le
glyphosate et le paraquat ; pour la participation du stress oxydant
et de l’immunomodulation ces deux facteurs sont retrouvés pour le
diazinon, le parathion, et le 2,4-D. Ainsi, le lien entre une
exposition aux 17 pesticides et santé respiratoire est conforté par
des données mécanistiques en particulier pour 11 d’entre eux, y
compris le chlorpyrifos et la perméthrine qui sont associés aux
3 facteurs. Parmi les 7 pesticides issus d’un classement moins
restrictif (tableau 16.VII
, voir en fin de ce chapitre). Les trois effets recherchés, stress
oxydant, mitotoxicité et immunomodulation de la réponse
inflammatoire sont retrouvés pour le chlorpyrifos et la perméthrine.
La participation de deux facteurs (stress oxydant et mitotoxicité)
est retrouvée pour le malathion, l’HCH, le DDT, l’atrazine, le
glyphosate et le paraquat ; pour la participation du stress oxydant
et de l’immunomodulation ces deux facteurs sont retrouvés pour le
diazinon, le parathion, et le 2,4-D. Ainsi, le lien entre une
exposition aux 17 pesticides et santé respiratoire est conforté par
des données mécanistiques en particulier pour 11 d’entre eux, y
compris le chlorpyrifos et la perméthrine qui sont associés aux
3 facteurs. Parmi les 7 pesticides issus d’un classement moins
restrictif (tableau 16.VII , voir en fin de ce chapitre), 6 sont associés à l’induction d’un
stress oxydatif. Outre l’effet stress oxydatif, le carbofuran
présente une activité mitotoxique, et la cyfluthrine et le
chlorothalonil un effet immunomodulateur. Ces données mécanistiques
en particulier lorsqu’elles sont associées à un effet irritant
(H317, H335) pour le chlorothalonil devront être validées par des
résultats d’enquêtes épidémiologiques, mais illustrent l’intérêt
d’une réflexion partagée entre épidémiologie et toxicologie
moléculaire. Par ailleurs, sur la base d’un effet immunomodulateur
au niveau pulmonaire, 6 pesticides non retrouvés dans les données
épidémiologiques ont été considérés : mancozèbe, méthoxychlore,
deltaméthrine, indoxacarbe, imidaclopride et fipronil ainsi qu’un
agent synergisant, le PBO (tableau 16.VIII
, voir en fin de ce chapitre), 6 sont associés à l’induction d’un
stress oxydatif. Outre l’effet stress oxydatif, le carbofuran
présente une activité mitotoxique, et la cyfluthrine et le
chlorothalonil un effet immunomodulateur. Ces données mécanistiques
en particulier lorsqu’elles sont associées à un effet irritant
(H317, H335) pour le chlorothalonil devront être validées par des
résultats d’enquêtes épidémiologiques, mais illustrent l’intérêt
d’une réflexion partagée entre épidémiologie et toxicologie
moléculaire. Par ailleurs, sur la base d’un effet immunomodulateur
au niveau pulmonaire, 6 pesticides non retrouvés dans les données
épidémiologiques ont été considérés : mancozèbe, méthoxychlore,
deltaméthrine, indoxacarbe, imidaclopride et fipronil ainsi qu’un
agent synergisant, le PBO (tableau 16.VIII , voir en fin de ce chapitre). La
pertinence d’une démarche allant d’un impact sur une cible vers la
recherche d’un lien potentiel en pathologie chez l’être humain est à
tester, par exemple sur ces composés.
, voir en fin de ce chapitre). La
pertinence d’une démarche allant d’un impact sur une cible vers la
recherche d’un lien potentiel en pathologie chez l’être humain est à
tester, par exemple sur ces composés.Tableau 16.I Études épidémiologiques publiées depuis 2014 portant sur le lien entre expositions professionnelles aux pesticides et la santé respiratoire*
|
Référence
Pays |
Population étudiée
Design d’étude |
Définition
de l’évènement de santé |
Méthode et définition
de l’exposition aux pesticides |
Facteurs d’ajustement
|
Résultats
|
|---|---|---|---|---|---|
|
Études de cohortes prospectives en
population générale
|
|||||
|
2 527 adultes (12 772
observations)
Cohorte Vlagtwedde-Vlaardingen, suivi de 25 ans |
Déclin du VEMS et du
VEMS/CVF
|
Exposition aux pesticides (herbicides
et insecticides), évaluée par MEE (ALOHA+) pour le
dernier emploi et en considérant 3 emplois (les 2
derniers et le plus important)
|
Âge, sexe, niveau de fonction
respiratoire au début du suivi, paquets-années de
tabac au dernier suivi
+ exposition professionnelle à poussières/gaz/fumée |
Exposition forte aux pesticides lors du
dernier emploi (12 %) associée à un déclin
accéléré du VEMS (-5,1 ml/an [-8,0 ; -2,1]) et du
ratio VEMS/CVF (-0,09 %/an [-0,15 ; -0,03] par
rapport au groupe non exposé
Association significative avec l’exposition cumulée Interaction significative avec le tabac : l’association était observée uniquement chez les fumeurs. |
|
|
11 851 adultes (18-89 ans) de la
cohorte LifeLines 2 364 adultes de la
cohorte Vlagtwedde-Vlaardingen
Analyse transversale |
Niveau de la fonction respiratoire
(VEMS, VEMS/CVF)
Obstruction bronchique (VEMS/CVF pré-BD < 0,7) et obstruction bronchique modérée/sévère (VEMS/CVF pré-BD < 0,7 et VEMS < 80 % prédit) |
Exposition aux herbicides,
insecticides, et tous pesticides évaluée par MEE
(ALOHA+) pour le dernier emploi
|
Âge, sexe, taille, poids, statut
tabagique, paquets-années de tabac
|
Associations significatives avec VEMS
(ml) dans LifeLines avec les expositions
fortes, β [IC 95 %] :
Herbicides : -204 [-350 ; -58] Insecticides : -109 [-197 ; -21] Tous pesticides : -113 [-201 ; -25] VEMS/CVF ( %) et obstruction bronchique modérée/sévère associée seulement avec une exposition forte aux herbicides β = -2,8 ; IC 95 % [-4,8 ; -0,7] et OR = 3,6 ; IC 95 % [1,3 ; 9,9] |
|
|
237 adultes qui n’avaient pas de
sifflements dans l’enfance, cohorte WHEASE
(enfants de 10-15 ans recrutés en 1964, suivis
pendant 50 ans)
|
Niveau et évolution sur 25 ans de la
santé respiratoire (par Spirométries – VEMS, CVF,
DEM25-75)
VEMS abaissé (< LIN) Obstruction bronchique (VEMS/CVF post-BD < 0,7) Sifflements qui ont débuté à l’âge adulte (n = 95) |
Présence et intensité de l’exposition à
11 asthmogènes (dont biocides/fongicides) évaluées
par MEE
Exposition : aucune/faible/ modérée/forte selon l’intensité et la durée d’exposition (terciles) |
Sexe, tabac (avoir fumé > 100
cigarettes), niveau de diplôme
+ âge pour l’étude de l’évolution de la fonction respiratoire |
Exposition biocides/fongicides (48,5 %)
associée à :
Sifflements : OR = 1,8 ; IC 95 % [1,0-3,1] VEMS/OR = 3,4 ; IC 95 % [1,1-10,8] Obstruction bronchique : OR = 1,5 ; IC 95 % [0,8-2,6] VEMS, CVF, DEM25-75 abaissés, mais non significatif Déclin accéléré du VEMS : β = -6,3 ; IC 95 % [-11,6 ; -1,0] Relation dose-réponse observée avec tous les évènements de santé, sauf CVF |
|
|
1 335 participants aux suivis de 2002 à
2008 de la cohorte TAHS (recrutement des
enfants en 1968)
|
Obstruction bronchique : VEMS/CVF
post-BD < 0,7 (ou Prévalence de la toux
chronique, crachats chroniques et bronchite
chronique et dyspnée par questionnaire
|
Exposition aux herbicides, insecticides
et tous pesticides, évaluée par MEE
(ALOHA+)
Exposition cumulée sur l’ensemble de l’histoire professionnelle |
Sexe, statut tabagique, paquets-années
de tabac, asthme et niveau socio-économique,
exposition professionnelle à
poussière/gaz/fumée
|
Exposition à « tous pesticides »
associée à RR [IC 95 %] :
Obstruction bronchique : 1,7 [1,0 ; 3,1] Bronchite chronique : 1,8 [1,1 ; 2,9] Toux chronique : 1,8 [1,0 ; 3,0] Crachats chroniques : 2,1 [1,2 ; 3,5] Dyspnée : 1,9 [1,2 ; 3,1] Associations de même ordre de grandeur avec herbicides (significatives pour tous les évènements de santé sauf crachats et dyspnée) et insecticides (significatives pour bronchite chronique et toux chronique) Association significative avec l’exposition cumulée |
|
|
3 343 adultes (20-44 ans au
recrutement) sans asthme et sans BPCO au
recrutement
Cohorte ECRHS, suivi de 20 ans |
Incidence de la BPCO définie par
VEMS/CVF post-BD < LIN
|
Exposition à 10 catégories d’agents
(dont insecticides, herbicides, fongicides étudiés
séparément ou ensemble (tous pesticides)), évaluée
par MEE (ALOHA+)
|
VEMS/CVF au recrutement, âge, sexe,
paquets-années, niveau socio-économique, score de
« désavantage précoce » (tabac maternel, asthme
parental, asthme avant 10 ans, infection
respiratoire sévère avant 5 ans)
|
96 cas incidents
RR [IC 95 %] incidence BPCO associé à : Herbicides : 2,0 [0,7-4,1] Insecticides : 2,3 [1,1-4,2] Fongicides : 1,9 [0,9-3,6] Tous pesticides : 2,2 [1,1-3,8] Pas de relation dose-réponse |
|
|
8 794 adultes (20-44 ans au
recrutement) sans bronchite chronique au
recrutement, suivis à ECRHSII et/ou ECRHSIII
(13 285 observations)
Cohorte ECRHS, suivi de 20 ans |
Obstruction bronchique : VEMS/CVF
post-BD Sévérité de l’obstruction selon le niveau
de VEMS
Incidence de : toux chronique (toux habituelle en hiver ≥ 3 mois chaque année) ; crachats chroniques (crachats en hiver ≥ 3 mois chaque année) ; bronchite chronique (toux et crachats chroniques) |
Exposition à 10 catégories d’agents non
spécifiques (dont insecticides, herbicides,
fongicides étudiés séparément ou ensemble),
évaluée par MEE (ALOHA+)
|
Âge, paquets-années de tabac, tabac
actuel, niveau socio-économique, asthme actuel
sévérité de l’obstruction bronchique
|
116 cas incidents à ECRHSII
Absence d’association significative dans l’ensemble de la population Associations observées chez les femmes avec l’incidence de la bronchite chronique : Herbicides : 1,9 [0,8-4,6] Insecticides : 2,1 [1,1-4,0] Fongicides : 2,0 [1,03-4,0] Tous pesticides : 1,8 [0,9-3,5] |
|
|
Études de cohortes prospectives
d’agriculteurs et étude de suivi (avant/après
exposition)
|
|||||
|
14 441 agriculteurs/trices
Analyse transversale dans un échantillon aléatoire (10 %) de la cohorte AGRICAN |
Prévalence de bronchite chronique
diagnostiquée par un médecin, définie par
questionnaire auto-administré
|
Histoire professionnelle sur les
différents types d’élevage, cultures et
tâches
Utilisation des pesticides non spécifique (animaux, culture, cours de ferme) Empoisonnement par pesticides (vie, suivie d’une consultation/hospitalisation) |
Âge, sexe, niveau d’éducation,
diagnostic d’asthme, rhume des foins, eczéma,
maladie du poumon du fermier, maladie
cardiovasculaire, IMC, statut
tabagique
|
Risque de bronchite chronique
(prévalence = 8,4 %) augmenté avec l’élevage
(OR = 1,2 ; IC 95 % [1,0-1,5] et la culture de la
pomme de terre (OR = 1,3 ; IC 95 % [1,1-1,6], avec
un OR augmenté avec une accumulation de
l’exposition et la taille de l’exploitation), et
un empoisonnement par pesticides (suivi ou non par
une prise en charge médicale, OR = 1,7 ; IC 95 %
[1,1-2,4])
|
|
|
15 494 sujets
agriculteurs/agricultrices
Analyse transversale dans un échantillon aléatoire (10 %) de la cohorte AGRICAN |
Prévalence d’asthme diagnostiqué par un
médecin, défini par questionnaire
auto-administré
Allergie définie par rhume des foins ou eczéma |
Histoire professionnelle sur les
différents types d’élevage, de culture et
tâches
Utilisation des pesticides (animaux, culture, cours de ferme) Empoisonnement par pesticides (vie, suivie d’une consultation/hospitalisation) |
Âge, sexe, niveau d’éducation, + IMC
pour l’asthme non allergique
|
Risque augmenté de l’asthme allergique
avec l’utilisation de pesticide dans les vignes
(OR = 1,3 ; IC 95 % [1,0-1,8]), les prairies (1,3
[1,0-1,8]), les vergers (1,6 [1,0-2,4]) et un
empoisonnement par pesticides (2,0
[1,4-2,7])
Risque augmenté de l’asthme non allergique avec l’utilisation de pesticides dans la culture de betteraves (OR = 1,5 [1,0-2,1]) |
|
|
702 agriculteurs/trices
|
Prévalence de l’asthme, la toux
chronique, la bronchite chronique, les sifflements
persistants évalués par questionnaire
|
Utilisation de pesticides (non
spécifiques) sur les 12 derniers mois, par
questionnaire
|
Âge, sexe et tabac
|
Pas d’association
|
|
|
22 134 hommes agriculteurs qui ont
participé au suivi 2005-2010 de la cohorte
prospective AHS
Analyse transversale |
Sifflements allergiques et non
allergiques par questionnaire
Allergie définie par le rhume des foins diagnostiqué par un docteur |
78 pesticides spécifiques utilisés par
au moins 1 % des agriculteurs : 45 herbicides,
25 insecticides, 6 fongicides, 1 fumigant et
1 raticide
Exposition actuelle/passée/jamais |
Âge, IMC, tabac, État, asthme, nombre
de jours d’utilisation de pesticides, nombre de
jours d’utilisation d’un tracteur
|
19 pesticides (utilisation actuelle)
associés avec les sifflements allergiques
21 pesticides associés avec les sifflements non allergiques Effet dose-réponse avec plusieurs pesticides : 2,4-D, glyphosate, perméthrine, carbaryl, raticide warfarine |
|
|
82 familles d’agriculteurs (48
agriculteurs, 34 apparentés) vus à 2 reprises,
pendant la saison des récoltes et
hors-saison
|
Spirométrie
Symptômes respiratoires (questionnaire) |
Dosage dans le sang de l’activité des
cholinestérases (AChE et BChE)
|
Âge, tabac
|
Pas de différence des valeurs
spirométriques entre les 2 saisons
Réveil avec essoufflement ou toux plus souvent rapporté dans la saison des récoltes La fréquence de manipulation de pesticides associée à certains paramètres spirométriques lors des 2 saisons, et AChE et BChE abaissés lors de la saison des récoltes |
|
|
2 426 céréaliers dans l’Alberta
2 cohortes constituées en 2002. Liens avec les données médico-administratives en 2009 (n = 1 371) |
Diagnostic d’asthme
auto-déclaré
Vraisemblance d’un diagnostic d’asthme (estimée en liant les données du questionnaire ATS [American Thoracic Society respiratory questionnaire] avec les données des bases médico-administratives) |
Pesticides spécifiques par
questionnaire, liste de 26 insecticides et 48
herbicides et 25 traitements des
semences
Nombre d’années d’exposition à 7 groupes chimiques : phénoxys, organochlorés, organophosphorés, pyréthrinoïdes, carbamates, thiocarbamates, dithiocarbamates |
Âge, sexe, statut (agriculteur et/ou
céréalier), exposition aux pesticides au cours du
dernier mois, tabac, données
médico-administratives disponibles
(oui/non)
|
Association significative entre le
nombre d’années d’utilisation de composés phénoxy
et le diagnostic d’asthme (OR = 1,29 ; IC 95 %
[0,66-2,52], 2,52 ; IC 95 % [1,25-5,09], et 3,18 ;
IC 95 % [1,54-6,58] pour une exposition courte,
moyenne et longue respectivement), ou la
vraisemblance d’un diagnostic d’asthme
Pas d’association avec les autres groupes chimiques |
|
|
22 491 agriculteurs qui ont participé
au suivi 2005-2010 de la cohorte prospective
AHS
Analyse transversale |
Diagnostic BPCO : rapporter un
diagnostic de BPCO, de bronchite chronique ou
d’emphysème
Symptômes de bronchite chronique : toux ou crachats ≥ 3 mois pendant 2 années consécutives |
« Avez-vous appliqué des insecticides
sur des animaux de ferme au cours des 12 derniers
mois ? »
18 insecticides spécifiques : 9 organophosphorés, 1 carbamate, 1 organochloré, 7 pyréthrinoïdes |
Âge, État, sexe, éducation, tabac (par
la méthode IPEW « Inverse probability of
exposure weights »)
|
Utilisation d’insecticides associée à
un risque de symptôme avec (1,39 ; IC 95 %
[1,08-1,78] ou sans diagnostic de BPCO (1,21 ;
IC 95 % [1,05-1,38])
Diazinon associé avec les 3 évènements de santé 9 insecticides associés avec la présence de symptômes, avec ou sans diagnostic : diazinon, malathion, coumaphos, dichlorvos, carbaryl, perméthrine, pyréthrines, lindane, parathion |
|
|
58 hommes (25-55 ans) qui pulvérisent
des pesticides vus à 2 mois d’intervalle, avant
(fin avril) et après (fin juin) les saisons de
pulvérisation
Absence de symptômes et maladies respiratoires à l’entrée dans l’étude |
Spirométrie
Questionnaire sur les symptômes respiratoires pendant la saison de pulvérisation |
Pesticides non
spécifiques
Information sur le nombre de pesticides, les tâches professionnelles |
Données spirométriques étudiées en %
prédit (selon âge, sexe et taille)
|
Fréquence des symptômes respiratoires
non nulle au questionnaire de suivi (de 27 % pour
la toux à 7 % pour les essoufflements). Diminution
significative du VEMS, de la CVF et du débit de
pointe sur la période de suivi (pas de différence
pour VEMS/CVF et DEM25-75). La
diminution du VEMS était particulièrement observée
avec l’application de 2 polluants et la diminution
de la CVF avec l’application de 3 polluants (mais
études en sous-groupes de faibles effectifs). La
diminution des paramètres de fonction ventilatoire
au cours du suivi était plus élevée chez ceux qui
déclaraient une toux.
|
|
|
Études exposés – non
exposés
|
|||||
|
166 ouvriers qui pulvérisent des
pesticides sans équipements de protection
versus 77 témoins
|
Spirométrie
Symptômes respiratoires (questionnaire) : toux, crachats, dyspnée, sifflements, irritation de la gorge |
Utilisation de pesticides
organophosphorés, durée de l’exposition (nombre
d’années*nombre d’heures)
Biomarqueurs d’exposition : AChE et BChE dans le sang |
Tabac (dans certains
modèles)
|
Prévalence de symptômes respiratoires
(≥ 1) : 4 % (n = 3) chez les témoins, 37 % chez
les ouvriers (OR avec des IC 95 % très
larges)
Chez les ouvriers, effet dose-réponse entre la durée d’exposition et ≥ 1 symptôme respiratoire Débit de pointe, VEMS et VEMS/CVF significativement diminués chez les ouvriers et parmi les ouvriers effet dose-réponse avec la durée de l’exposition Activité de AChE et BChE diminuées chez les exposés et BChE diminuée avec un VEMS et CVF plus faibles |
|
|
38 adolescents qui appliquent de
pesticides versus 24 témoins suivis pendant
10 mois
|
Spirométrie jour 146 (après utilisation
de pesticides, mais niveau de TCPγ encore élevé)
et jour 269 (niveau TCPγ revenu à la
normale)
Restriction (CVF < 5epercentile et ratio VEMS/CVF normal) Sifflements (questionnaire) |
Dosage urinaire : TCPγ, un métabolite
spécifique du chlorpyrifos
|
Âge
|
Niveau de TCPγ augmenté chez les
exposés, et inversement associé aux mesures
spirométriques au jour 146 (mais pas au jour
269)
Risque de sifflements augmenté chez les exposés |
|
|
211 femmes incluant 121 femmes
agricultrices et 90 citadines (5-10 km des zones
agricoles)
|
Symptômes respiratoires (questionnaire
ECRHS) : score de symptômes d’asthme, asthme
diagnostiqué, asthme actif
Mesure du FeNO |
Exposition rapportée par
questionnaire
Dosage dans le sang de l’activité des cholinestérases (AChE) |
Tabac, atopie, né dans une ferme,
niveau d’éducation
|
Chez les agricultrices, le score de
symptômes d’asthme était positivement associé à
différentes variables d’exposition et négativement
à AChE.
|
|
|
213 ouvriers agricoles (fleurs)
versus 60 témoins (employés dans des
supermarchés)
|
Symptômes au cours des 30 derniers
jours (questionnaire BMRC) : toux, crachats,
essoufflement, sifflements
|
Comparaison des différents postes chez
les ouvriers agricoles
Comparaison avec les témoins |
Âge, niveau d’éducation
|
Symptômes respiratoires augmentés chez
les femmes qui coupent/désherbent versus
les autres (statistiquement significatif pour la
toux)
Pas de témoins avec symptômes respiratoires |
|
|
211 femmes incluant 121 femmes
agricultrices versus 90 citadines (5-10 km
des zones agricoles)
|
Symptômes respiratoires (questionnaire
ECRHS)
Mesure du FeNO Sensibilisation allergique (test phadiatop®) Dosage de cytokines « non-Th2 » (IL-8, IL-6, IL10, IL-17, INF-γ) et « Th2 » (IL-4, IL-5, IL-13) |
Métabolites urinaires des pesticides
ajustés sur la créatinine urinaire : 6 métabolites
des dialkylphosphates (DMP, DMTP, DMDTP, DEP,
DETP, DEDTP), TCPγ, métabolites des pyréthrinoïdes
(DCCA, DBCA, 4F3-PBA, 3-PBA)
|
Tabac, atopie, né dans une ferme,
niveau d’éducation
|
Pas de différence sur la prévalence de
l’asthme, FeNO > 50 ppb, détection de cytokines
non-Th2 et Th2 selon les 2 groupes
Pas d’association métabolites – asthme/FeNO chez les agricultrices Les métabolites des organophosphorés et pyréthrinoïdes étaient associés à un taux de cytokines plus élevé, et plus spécifiquement pour les cytokines non-th2. |
|
|
2 populations :
1 104 agriculteurs, dont 601 exposés et 503 non exposés 387 agriculteurs, dont 206 exposés et 180 non exposés |
Spirométrie (pour la seconde
étude)
Symptômes respiratoires (questionnaire BMRC) |
Estimation de l’exposition cumulée à
partir de i) intensité de l’exposition,
ii) utilisation de protection, iii)
durée d’exposition
|
Sexe, âge, IMC (2e étude),
statut tabagique, antécédent de pneumonie,
salaire, statut marital, mâcher du
khat
|
Prévalence de la toux chronique et de
l’essoufflement significativement plus élevée chez
les exposés que les non exposés, dans chacune des
2 études (OR estimés entre 3,1 et 6,7)
VEMS, DEM25-75 et VEMS/CVF significativement abaissés chez les exposés versus non exposés Associations dose-réponse observées |
|
|
70 détaillants de pesticides
versus 64 ouvriers du bâtiment
|
Symptômes respiratoires (questionnaire
ECRHS) : toux, crachats, essoufflement,
sifflements, oppression thoracique
Marqueurs de stress oxydants (glutathion, malondialdéhyde, catalase) |
Comparaison des groupes
|
Âge, taille, poids, niveau d’éducation,
expériences professionnelles, travail quotidien,
antécédents familiaux de maladies respiratoires,
statut marital, statut tabagique, nombre de
cigarettes/j
|
Les détaillants de pesticides
déclaraient significativement plus de sifflements,
oppression thoracique, toux et crachats et avaient
des niveaux de glutathion et malondialdéhyde
augmentés.
|
|
|
Études transversales
|
|||||
|
228 agriculteurs
|
Symptômes respiratoires
(questionnaire) : toux, crachats, essoufflement,
sifflements, oppression thoracique, allergies
nasales
Mesure du débit de pointe |
Utilisation de pesticides non
spécifique (questionnaire)
|
Âge, tabac, comorbidités, utilisation
de biomasse
|
L’utilisation de pesticides était
associée à un risque augmenté de toux chronique
(2,96 [1,21-7,23]), crachats chroniques (2,64
[1,12-6,24]) et essoufflement (4,28
[1,65-10,86]).
|
|
|
2 469 familles de cultivateurs de
tabac
|
Sifflements dans les 12 derniers mois
évalués par questionnaire
|
Utilisation de pesticides
(questionnaire) : nombre de jours/mois
d’utilisation, nombre d’années d’utilisation de
pesticides (vie)
|
Pas clairement précisé (âge, tabac,
antécédent d’asthme...)
|
L’utilisation de pesticides
(jours/mois) était associée à un risque de
sifflements augmenté chez les hommes, avec une
relation dose-réponse (RR = 2,71 ; IC 95 %
[1,56-4,71]).
Pas d’association chez les femmes |
|
|
300 maraîchers
|
Symptômes respiratoires
(questionnaire) : toux chronique, crachats
chroniques, sifflements, essoufflement
|
Questionnaire administré
Dosages urinaires de métabolites des pesticides organochlorés (γ-HCH, β-HCH, δ-HCH, heptachlore, aldrine, dieldrine, endosulfan sulfate) et des pyréthrinoïdes (λ-cyhalothrine, cyperméthrine) pour 100 participants |
Sexe, âge, statut marital, niveau
d’éducation, tabac
|
Risque augmenté des crachats chroniques
avec le nombre heures/jour d’utilisation de
fongicides et d’insecticides
Risque augmenté des sifflements avec le nombre d’heures/jour d’utilisation de fumigants, de fongicides et d’insecticides et le nombre d’années d’utilisation de fongicides (relation dose-réponse) Relation dose-réponse entre la combinaison d’activités qui exposent les maraîchers (0 à 3 ; transport, mélange et pulvérisation) et chacun des symptômes respiratoires Associations dose-réponse observées avec β-HCH, heptachlore et endosulfan sulfate Pas d’association avec les pyréthrinoïdes |
|
|
11 210 exploitants agricoles
The Farm and Ranch Safety Survey |
Asthme actif
(questionnaire)
|
Auto-questionnaire avec question sur
les pesticides spécifiques utilisés
|
Sexe, région
|
L’utilisation de pesticides (quels
qu’ils soient), d’herbicides et d’insecticides
était associée à un risque d’asthme actif
augmenté.
Pas d’association avec les produits spécifiques (tendance avec le glyphosate : OR = 1,3 [0,97-1,8]) |
|
|
217 agriculteurs
|
Spirométrie (VEMS, CVF,
VEMS/CVF)
Obstruction bronchique : VEMS/CVF < 80 % Symptômes/maladies respiratoires auto-déclarés : toux, dyspnée, sifflements, douleur thoracique, bronchite chronique, asthme |
Niveau de paraquat mesuré dans les
urines (SPE-HPLC)
Exposition évaluée par : niveau urinaire * nombre de mois d’utilisation de pesticides au travail (MEE) Exposition aux pesticides auto-déclarée |
62 pesticides déclarés : profénofos
(35 %), méthamidophos (25 %), chlorpyrifos (22 %),
méthomyl (14 %), chlorothalonil (13 %), mancozèbe
(12 %), esbiothrin (12 %) et glyphosate (12 %).
Exposition combinée à ces 8 pesticides :
46 %
Obstruction bronchique (prévalence : 5 %) associée à des expositions combinées, incluant paraquat et méthamidophos Asthme (prévalence : 1 %) associé à l’exposition au paraquat |
||
|
5 420 agriculteurs travaillant dans des
serres
|
Asthme : sifflements ou crise d’asthme
au cours de la dernière année et VEMS/CVF
< 75 % et test de réversibilité positif (VEMS
post-BD > 12 % et > 200 ml de la valeur de
base)
|
Application de pesticides non
spécifiques (questionnaire)
|
Sexe, IMC, type de culture, temps de
ventilation, odeurs, toux à l’entrée dans la
serre, toux avant 14 ans
|
L’utilisation de plusieurs pesticides
augmente significativement le risque d’asthme :
OR = 1,24 ; IC 95 % [1,03-1,49].
|
|
|
1 366 individus travaillant dans des
serres
|
Maladie respiratoire diagnostiquée
(bronchite chronique, emphysème, asthme, autres)
et symptômes respiratoires (toux ou crachats,
dyspnée ou tachypnée, essoufflement ou détresse
pulmonaire, hémoptysie) par questionnaires non
standardisés
|
Questionnaire posé par un enquêteur
incluant le nombre d’années d’utilisation de
pesticides (non spécifiques), méthode de spray
(manuelle, machine, mixte), durée moyenne
d’utilisation de spray
|
Modèle complet ajusté sur des facteurs
généraux et liés au style de vie, mais pas
clairement précisé sur lesquels parmi âge, sexe,
niveau d’éducation, statut marital, ethnicité,
revenu de la famille, année de l’étude, tabagisme
actif, tabagisme passif, consommation d’alcool,
activité physique, nombre de repas par jour, prise
du petit-déjeuner
|
Pas d’association statistiquement
significative avec les maladies respiratoires
(n = 49 cas)
Des associations significatives et positives étaient observées avec la méthode de spray mixte versus manuelle, mais peu de sujets dans le groupe « mixte ». Aucune association significative quand ajustement sur le modèle complet |
|
* : Les études épidémiologiques antérieures à 2014
sont présentées en détail dans la revue de la littérature
publiée en 2015 (Mamane et coll.,
2015a ) et ne sont pas reprises dans ce tableau.
) et ne sont pas reprises dans ce tableau.
3-PBA : acide
3-phénoxybenzoïque ; 4F3-PBA : acide
4-fluoro-3-phénoxybenzoiïque ; AChE : acétylcholinestérase ;
BChE : butyrylchlolinestérase ; BD : bronchodilatation ; BMRC :
British Medical Research Council ; CVF : capacité
vitale forcée ; DBCA : acide
3-(2,2-dibromovinyl)-2,2-diméthylcyclopropane-1-carboxylique ;
DCCA : acide
3-(2,2-dichlorovinyl)-2,2-diméthylcyclopropane-1-carboxylique ;
DMP : diméthylphosphate ; DEP : diéthylphosphate ; DMTP :
diméthylthiophosphate ; DETP : diéthylthiophosphate ; DMDTP :
diméthyldithiophosphate ; DEDTP : diéthyldithiophosphate ;
FeNO : fraction expirée du monoxyde d’azote ; IMC : indice de
masse corporelle ; LIN : limite inférieure de la normale ; MEE :
matrice emploi-exposition ; TCPγ : 3,5,6-trichloro-2-pyridinol ;
VEMS : volume expiratoire maximal seconde
Tableau 16.II Résultats de l’ensemble des études d’association substances spécifiques-santé respiratoire conduites dans la cohorte américaine AHS
|
Référence
|
Phénotype respiratoire
|
Pesticides pour lesquels une
association statistiquement significative a été
observée
|
|---|---|---|
|
Sifflements 12 derniers mois chez les
agriculteurs (n = 20 468)
|
Herbicides : alachlore,
atrazine**, chlorimuron-éthyle, EPTC**,
paraquat**, petroleum oil,
trifluraline
Insecticides : chlorpyrifos**, malathion, parathion**, perméthrine (élevage de poules) Fongicides : métalaxyl |
|
|
Sifflements 12 derniers mois chez des
applicateurs industriels (n = 2 255)
|
Atrazine, chlorimuron-éthyle,
glyphosate, imazéthapyr, métolachlore,
métribuzine, pendiméthaline, chlorpyrifos,
dichlorvos, fonofos, phorate, terbufos
|
|
|
Asthme allergique et non allergique
chez les femmes (n = 25 814)
|
Asthme allergique : 2,4-D,
glyphosate, carbamates (carbaryl), coumaphos,
malathion, parathion, phorate, DDT, perméthrine
(animaux) ; métalaxyl
Asthme non allergique : perméthrine (cultures) |
|
|
Asthme allergique et non allergique à
début dans la vie adulte chez les hommes
agriculteurs (n = 19 704)
|
Asthme allergique : 2,4,5-TP+,
EPTC, paraquat, chlordane, heptachlor, lindane,
coumaphos, diazinon, parathion, captane, 80/20
mix, dibromure d’éthylène
Asthme non allergique : DDT, malathion, phorate |
|
|
Exacerbation des symptômes chez les
applicateurs de pesticides asthmatiques
(n = 926)
|
Effet protecteur du paraquat,
glyphosate
|
|
|
Bronchite chronique chez les
agriculteurs (n = 20 908)
|
Carbaryl*, carbofuran*, chlordane,
DDT*, heptachlor*, lindane, toxaphène, coumaphos,
diazinon*, dichlorvos, malathion*, parathion,
perméthrine*, 2,4,5-T*, 2,4,5-TP*,
chlorimuron-éthyle*
|
|
|
Bronchite chronique chez les femmes non
fumeuses (n = 21 541)
|
Dichlorvos, DDT, cyanazine, paraquat,
bromure de méthyle
|
|
|
Sifflements allergiques et non
allergiques (n = 22 134)
|
Sifflements allergiques :
dicamba, piclorame, trifluraline, glyphosate**,
2,4-D**, triclopyr, atrazine, simazine, bentazone,
carbaryl**, chlorpyrifos, diméthoate, malathion,
perméthrine**, pyréthrines, zeta cyperméthrine,
warfarine**
Sifflements non allergiques : clopyralid/flumétsulame, dicamba, piclorame, mésotrione, acétochlore, métolachlore, trifluraline, imazaquine, glyphosate**, fluazifop-butyl/fénoxaprop-p-éthyle, triclopyr, atrazine, nicosulfuron, malathion, cyfluthrine, perméthrine**, pyréthrines |
|
|
BPCO, bronchite chronique,
BPCO+bronchite chronique (n = 22 491)
|
Diazinon associé avec les 3 phénotypes
et perméthrine, malathion, pyréthrines, lindane,
parathion, coumaphos, dichlorvos, carbaryl
associés avec 1 ou 2 phénotypes
|
* : Association toujours significative après ajustement sur les pesticides corrélés ; ** : Effet dose-réponse rapporté
Tableau 16.III Études épidémiologiques publiées depuis 2014 portant sur le lien entre expositions environnementales aux pesticides et la santé respiratoire*
|
Référence
Pays |
Population étudiée
Design d’étude |
Définition de l’évènement
de santé |
Méthode et définition
de l’exposition aux pesticides |
Facteurs d’ajustement
|
Résultats
|
|---|---|---|---|---|---|
|
Études de cohortes
prospectives
|
|||||
|
4 608 mères-enfants
Méta-analyse de 10 cohortes de naissances (ENRIECO) |
Bronchite et sifflements rapportés par
les parents 6-18 mois
Sifflements avant 4 ans |
DDE dans le sang du cordon
|
Sexe, âge de l’enfant, durée de
l’allaitement, âge gestationnel, nombre de
frères/sœurs à la naissance, âge maternel, IMC de
la mère, tabac mère pré et post-natal, niveau
d’études de la mère, asthme/allergie de la mère,
date de recueil de l’échantillon
|
Association significative avec les
symptômes à 18 mois, RR [IC 95 %] pour une
variation log2 DDE ng/ml :
Bronchite et/ou sifflements : 1,03 [1,00-1,07] Bronchite : 1,05 [1,00-1,11] Sifflements : 1,02 [0,96-1,07] Association dose-réponse (basée sur les terciles d’exposition) Association robuste à l’ajustement sur PCB-153, pas d’hétérogénéité selon les cohortes Pas d’association avec les sifflements vie évalués à 4 ans |
|
|
414 paires mères-enfants avec des
mesures prénatales d’exposition et une spirométrie
au suivi à 20 ans
|
Spirométrie à 20 ans : obstruction
bronchique (VEMS/CVF < 75 %), et fonction
ventilatoire diminuée (VEMS %
prédit < 90 %)
|
p-p’-DDE, HCB, 6 PCB (-118, -156, -138,
-153, -170, -180) mesurés dans le sérum maternel
pendant la grossesse
|
Âge maternel, parité, tabagisme pendant
la grossesse, IMC avant la grossesse, niveau
d’éducation, triglycérides, cholestérol, et sexe
de l’enfant
|
Comparativement aux individus avec les
plus faibles niveaux d’expositions pendant la
grossesse (1er tercile d’exposition),
ceux qui étaient les plus exposés (dernier tercile
d’exposition) aux PCB de type dioxine, aux PCB qui
ne sont pas de type dioxine, HCB et p,p’-DDE
avaient un risque d’obstruction bronchique
augmenté (OR = 2,96 [1,14-7,70], 2,68 [1,06-6,81],
2,63 [1,07-6,46], et 2,87 [1,09-7,57],
respectivement).
Pas d’association avec un niveau de VEMS diminué < 90 % |
|
|
2 777 enfants de 6 ans et plus pour
données DAP
940 enfants ≥ 12 ans pour les données DDT Cohorte NHANES (1999-2008) |
Asthme vie, asthme actif et sifflements
actifs par questionnaires
|
Taux des DAP urinaires (somme des
concentrations de 6 métabolites : DMP, DMTP,
DMDTP, DEP, DETP, DEDTP)
p,p’-DDE |
Modèle DAP : sexe, ethnicité, IMC,
index de pauvreté, tabac prénatal,
log(cotinine)
Modèle DDT : sexe, IMC, index de pauvreté |
Pas d’association significative
observée
Tendance non significative entre DDE et sifflements Associations plutôt négatives dans les analyses selon les groupes ethniques |
|
|
359 enfants vus à 5 et 7
ans
Cohorte de naissance CHAMACOS |
Symptômes respiratoires (sifflements,
essoufflement traitements pour asthme) et toux à
l’effort rapportés à 5 et 7 ans
|
6 métabolites urinaires des OP (3 DEP
et 3 DMP) mesurés 2 fois pendant la grossesse
(0-20 ; 21-40 semaines) et 5 fois chez l’enfant
(0,5-5 ans)
|
Sexe, tabac maternel grossesse, tabac
passif première année de vie, saison de naissance,
concentration moyenne de PM2,5 sur les
3 premiers mois de vie, moisissures dans
l’habitat, proximité d’une autoroute, présence de
blattes dans la maison
|
Association significative DAP total et
DEP mesurée lors de la seconde moitié de grossesse
et les symptômes respiratoires (log-10 DAP total,
OR = 1,77 ; IC 95 % [1,06-2,95])
Associations « fortes » observées avec l’exposition dans l’enfance et DAP total, DEP et DMP ; OR [IC 95 %] pour DAP total : Symptômes respiratoires : 2,53 [1,32-4,86] Toux à l’effort : 5,40 [2,10-13,91] |
|
|
279 enfants
Cohorte de naissance CHAMACOS |
Spirométrie à 7 ans
|
6 métabolites urinaires des OP (3 DEP
et 3 DMP) mesurés 2 fois pendant la grossesse
(0-20 ; 21-40 semaines) et 5 fois chez l’enfant
(0,5-5 ans)
|
Sexe, âge, taille, animaux domestiques,
score d’insécurité alimentaire, niveau d’éducation
mère, saison de la spirométrie, technicien, tabac
grossesse mère, saison de naissance, concentration
moyenne de PM2,5 sur les 3 premiers
mois de vie, durée allaitement, moisissures dans
l’habitat, distance à une autoroute
|
Pas d’association entre les expositions
maternelles pendant la grossesse et les paramètres
de fonction respiratoire
Association négative entre les expositions dans l’enfance et le VEMS (log-10 total DAP, OR = -0,16 ; IC 95 % [-0,30 ; -0,02]) et la CVF (log-10 total DAP, OR = -0,17 ; IC 95 % [-0,34 ; -0,01]). Pas d’associations avec DEM25-75 |
|
|
237 enfants
Cohorte de naissance CHAMACOS |
Spirométrie à 7 ans
Symptômes respiratoires (sifflements, essoufflement ou traitement pour asthme) à 7 ans Traitements pour asthme à 7 ans |
Modèles SIG- Quantité de soufre
élémentaire (kg) utilisé pour l’agriculture dans
un rayon de 0,5/1/3 km
Exposition pré- et post-natale |
Modèles symptômes/traitement : tabac de
la mère, saison de naissance, moisissures dans
l’habitat, mesures urinaires des métabolites des
pesticides organophosphorés (DAP)
Modèle paramètres de spirométrie : âge, taille, sexe de l’enfant, tabac mère grossesse, saison de naissance, concentration moyenne de PM2,5 sur les 3 premiers mois de vie, durée de l’allaitement, moisissures dans l’habitat, distance à une autoroute, animaux domestiques, mesures urinaires des métabolites des pesticides organophosphorés (DAP), insécurité alimentaire du foyer, nez qui coule sans rhume à 5 ans, nez qui coule sans rhume à 5 ans et soufre < 1 km, saison de la spirométrie, technicien |
Association significative de
l’exposition au soufre (augmentation par un
facteur 10) avec un risque augmenté de
symptômes/traitements, OR [IC 95 %] dans un rayon
de < 0,5 km/< 1 km :
Symptômes respiratoires, 1,71 [1,14 ; 2,57] / 2,09 [1,27 ; 2,36] Traitements pour asthme, 2,23 [1,19 ; 4,21] / 3,51 [1,50 ; 3,23] Association significative de l’exposition au soufre (augmentation par un facteur 10) avec une fonction respiratoire diminuée, β (IC 95 %) : VEMS : -0,14 [-0,25 ; -0,04] CVF : -0,13 [-0,3 ; -0,02] DEM25-75 : -0,16 [-0,34 ; -0,00] |
|
|
344 enfants vus à 8 et/ou 9 ans et à 10
ans (971 observations)
Cohorte d’enfants (8 ans au recrutement) |
1-3 spirométries par enfant
VEMS, CVF, VEMS/CVF |
Concentration DDE dans le sang à 8 ou
10 ans
|
Antécédent personnel d’asthme, asthme
mère, asthme père, durée de l’allaitement, tabac
grossesse
|
Pas d’association entre la
concentration de DDE et paramètres spirométriques
dans le modèle pour données répétées
Effet direct de la concentration de DDE sur taille et poids, mais pas sur la fonction respiratoire. Effet indirect de la concentration de DDE sur la fonction respiratoire, médiée par l’effet de DDE sur la taille et le poids |
|
|
294 enfants
Cohorte de naissance CHAMACOS |
Spirométrie à 7 ans
Symptômes respiratoires (sifflements, essoufflement) et traitements pour asthme |
Modèles SIG- Proximité résidence (8 km)
aux traitements agricoles par fumigation
(Pesticide Use Report data) bromure de
méthyle, chloropicrine, métham sodium et
1,3-dichloropropène
Exposition pré- et post-natale |
Modèles symptômes/traitement : tabac de
la mère, saison de naissance, moisissures dans
l’habitat, allergie (nez qui coule sans
rhume)
Modèle paramètres de spirométrie : ajustement supplémentaire sur âge, taille, sexe de l’enfant |
Pas d’association avec les symptômes
/traitements
Association positive entre l’exposition prénatale au bromure méthyle et le VEMS (0,06 [0,00-0,12]), DEM25-75 (0,15 [0,03-0,27]) |
|
|
282 enfants 3-10 ans en milieu viticole
(1/4 habitaient dans une ferme)
Cohorte, avec 2 périodes de suivi : l’hiver (peu de pesticides dans l’air) et l’été (période de traitement des vignes) |
Spirométrie : débit de pointe et
VEMS
Asthme (diagnostic par un médecin) Symptômes d’asthme Score de symptômes (asthme ; rhinite ; asthme + rhinite) |
56 pesticides mesurés dans l’air 1
semaine sur chaque période → Index d’exposition
cumulatif
Biomarqueur urinaire d’exposition au fongicide dithiocarbamates (éthylène thiourée, ETU (µg/g créatinine, n = 96) |
Sexe, âge, niveau d’éducation père et
mère, atopie, tabac passif, bronchiolite, animaux
domestiques, habiter dans une ferme, utilisation
domestique de pesticides, exposition
professionnelle aux pesticides, indice de la
qualité de l’air, température, score de symptômes
à la phase I (hiver)
|
Pas d’association entre les
concentrations de pesticides dans l’air et les
scores de symptômes (n = 177)
Association positive et significative entre ETU et le score total de symptômes (n = 66, OR = 3,56 ; IC 95 % [1,04-12,12]) Pas d’association avec les paramètres de fonction respiratoire |
|
|
559 adultes (âge moyen 75 ans ; 117
hommes) habitants de Séoul
Jusqu’à 3 visites à environ 1 an d’intervalle entre 2 visites (1 198 observations) Cohorte |
1-3 spirométries par sujet
VEMS, CVF, VEMS/CVF, DEM25-75 |
1-3 dosages urinaires d’un métabolite
des pyréthrinoïdes (3-PBA) par enfant
(ICCtotal = 0,76 mais variabilité
importante selon la concentration :
ICCélevé = 0,78
ICCfaible = 0)
|
Âge, sexe, IMC, tabac, niveau de
diplôme, numéro de visite, sommes des métabolites
des phtalates
|
Associations transversales négatives, β
[IC 95 %] pour une variation ln(3-BPA) : VEMS
(-1,48 [-2,19 ; -0,78], CVF (-1,14 [-1,82 ;
-0,46]), DEM25-75. (-1,11 [-2,14 ;
-0,09])
Pas d’association sur le déclin de la fonction |
|
|
16 enfants (6-16 ans)
asthmatiques
Données répétées à intervalle de 6 jours pendant 4 mois (139 observations) The Aggravating Factors of Asthma in a Rural Environment (AFARE) study |
Dosage urinaire des leucotriènes E4
(uLTE4), marqueur d’inflammation
|
Métabolites urinaires des OP (DAP
total, DMP total, DEP total) ajustés sur la
créatinine
|
Âge, atopie, utilisation de corticoïdes
inhalés, température maximale et vitesse du
vent
|
Association positive significative
entre la concentration uLTE4 et DAP total, DMP
total et DEP total
|
|
|
2 308 paires mères-enfants, cohorte
INMA
|
Spirométrie à 4 ans (n = 636) et 7 ans
(n = 1 192)
520 enfants avec spirométrie à 4 et 7 ans |
p,p’-DDE, HCB, PCB-138, PCN-153,
PCB-180 et somme des PCB mesurés dans le sang
maternel ou le sang du cordon
|
Âge maternel à la naissance, IMC de la
mère avant la grossesse, niveau d’éducation de la
mère, CSP de la mère, pays de naissance de la
mère, parité, consommation d’alcool et tabac
pendant la grossesse, nutrition de la mère, région
d’habitation, et âge, sexe et taille de l’enfant à
la visite
|
Une concentration augmentée à p,p’-DDE
était associée à un VEMS et une CVF diminués :
statistiquement significatif à 4 ans et 7 ans,
mais pas de relation dose-réponse et à 7 ans
seulement pour des niveaux d’exposition médians.
Même tendance pour HCB et VEMS et CVF à 7 ans. Pas
d’association observée avec les PCB
|
|
|
Études de
cas-témoins
|
|||||
|
620 cas asthmatiques
218 témoins Enfants recrutés en 2013/14 |
Asthme diagnostiqué par un
médecin
|
Pesticides organochlorés dosés dans des
pools de sérum (5 cas/2 témoins) (3 HCH ;
heptachlore ; DDT, DDE, DDD)
|
Sexe, PCB total, BDE total
|
Risque d’asthme augmenté avec
HCH (1 ng/g lipide, OR = 1,06 ; IC 95 %
[1,02-1,10]) et p,p’-DDE (1 ng/g lipide,
OR = 1,02 ; IC 95 % [1,01-1,03])
Pas d’association positive avec l’asthme sévère, mais 2 associations négatives (p,p’-DDD et o,p’-DDT) |
|
|
Études transversales
|
|||||
|
1 696 participants à l’étude
Canadian Health Measures Survey âgés de 20
à 79 ans
|
Spirométrie : VEMS, CVF, VEMS/CVF,
DEM25-75
|
p,p’-DDT (traitée en variable binaire :
> limite de détection oui/non) et p,p’-DDE
(traitée en variable continue) mesurés dans la
plasma
|
Âge, sexe, ethnicité, taille, tabac et
dépenses énergétiques quotidiennes (variables
sélectionnées parmi un plus large nombre de
facteurs étudiés)
|
p,p’-DDT et p,p’-DDE étaient
significativement associés à un VEMS et une CVF
diminués (β [IC 95 %] pour une augmentation de
10 ng/g lipide de p,p’-DDE = -11,8 [-20,6 ; -3,1]
et -18,8 [-28,7 ; -8,9] respectivement). Pas de
relation avec VEMS/CVF et
DEM25-75
|
|
* : Les études épidémiologiques antérieures à 2014
sont présentées en détail dans une revue de la littérature
(Mamane et coll., 2015a ) et ne sont pas reprises dans ce
tableau.
) et ne sont pas reprises dans ce
tableau.
3-PBA : l’acide 3-phénoxybenzoïque ; 4F3-PBA :
acide 4-fluoro-3-phénoxybenzoiïque ; AChE :
acétylcholinestérase ; BChE : butyrylchlolinestérase ; CVF :
capacité vitale forcée ; DAP : dialkyl phosphate ; DBCA : acide
3-(2,2-dibromovinyl)-2,2-diméthylcyclopropane-1-carboxylique ;
DCCA : acide
3-(2,2-dichlorovinyl)-2,2-diméthylcyclopropane-1-carboxylique ;
DDD : dichlorodiphényldichloroéthane ; DDE :
dichlorodiphényldichloroéthylène ; DDT :
dichlorodiphényltrichloroéthane ; DMP : diméthylphosphate ;
DEP : diéthylphosphate ; DMTP : diméthylthiophosphate ; DETP :
diéthylthiophosphate ; DMDTP : diméthyldithiophosphate ; DEDTP :
diéthyldithiophosphate ; FeNO : fraction expirée du monoxyde
d’azote ; HCB : hexachlorobenzène ; ICC : intraclass
correlation coefficient ; IMC : indice de masse
corporelle ; LIN : limite inférieure de la normale ; MEE :
matrice emploi-exposition ; TCPγ : 3,5,6-trichloro-2-pyridinol ;
VEMS : volume expiratoire maximal seconde.
Tableau 16.IV Présomption d’un lien entre exposition aux pesticides et pathologies respiratoires
|
Exposition/populations
|
Effets
|
Présomption d’un lien
|
|---|---|---|
|
Exposition professionnelle aux
pesticides (sans distinction)
|
Fonction respiratoire
|
+
|
|
Asthme, sifflements
|
+
|
|
|
BPCO, bronchite chronique
|
++
|
|
|
Exposition environnementale aux
pesticides au domicile (proximité, usages
domestiques)
|
Fonction respiratoire
|
±
|
|
Asthme, sifflements
|
+
|
|
|
BPCO, bronchite chronique
|
Absence d’études
rigoureuses
|
++ d’après les résultats d’une méta-analyse
+
d’après les résultats de plusieurs études dont au moins une
grande cohorte
± d’après les résultats de plusieurs études
mais pas d’étude de cohorte
Tableau 16.V Familles et substances actives impliquées dans les excès de risque d’altération de la santé respiratoire
|
Exposition
|
Populations
|
Présomption d’un lien
|
|||
|---|---|---|---|---|---|
|
Fonction respiratoire
|
Asthme, sifflements
|
Bronchite chronique, BPCO
|
|||
|
Insecticides
|
|||||
|
Carbamates/Dithiocarbamates
|
Milieu agricole
|
± 1,2
| |||
|
Carbaryl
|
Agriculteurs
|
± 3,4
|
± 5,6
|
||
|
Organophosphorés
|
Population générale
|
± 7-9
| |||
|
Chlorpyrifos
|
Agriculteurs
|
± 10
|
± 4,11,12
| ||
|
Coumaphos
|
Agriculteurs
|
± 3,13
|
± 5,6
|
||
|
Diazinon
|
Agriculteurs
|
± 12
|
± 5,6
|
||
|
Dichlorvos
|
Agriculteurs
|
± 12
|
± 5,6,14
|
||
|
Malathion
|
Agriculteurs
|
± 3,4,11,13
|
± 5,6
|
||
|
Parathion
|
Agriculteurs
|
± 3,11,13
|
± 5,6
|
||
|
Organochlorés
|
Population générale
|
± 15
| |||
|
DDT
|
Agriculteurs
|
± 3,13
|
± 5,14
|
||
|
Population générale
|
+ 16-18
|
+ 9,19-21
| |||
|
Heptachlor
|
Agriculteurs
|
± 13,20
|
± 5
|
||
|
Hexachlorocyclohexane (HCH)
|
Agriculteurs
|
± (lindane)
13,20
|
± (lindane) 5,6
|
||
|
Pyréthrinoïdes
|
± 22
| ||||
|
Perméthrine
|
Agriculteurs
|
± 3,4,11
|
± 5,6
|
||
|
Herbicides
|
|||||
|
Triazine
| |||||
|
Atrazine
|
Agriculteurs
|
± 4,11,12
| |||
|
Sulfonylurée
| |||||
|
Chlorimuron-éthyle
|
Agriculteurs
|
± 11,12
|
± 5
|
||
|
Bipyrymidine
| |||||
|
Paraquat
|
Agriculteurs
|
± 23
|
+ 11,13,24,25
|
± 5
|
|
|
Phénoxyherbicides
|
± 26,27
|
± 27
|
|||
|
2,4-D
|
Agriculteurs
|
± 3,4
| |||
|
2,4,5-T
|
Agriculteurs
|
± 13
|
± 5
|
||
|
Aminophosphonate glycine
| |||||
|
Glyphosate
|
Agriculteurs
|
± 3,4,12
| |||
1. Senthilselvan et coll.,
1992 ; 2. Raherison et coll.,
2019
; 2. Raherison et coll.,
2019 ; 3. Hoppin et coll., 2017
; 3. Hoppin et coll., 2017 ; 4. Hoppin et coll.,
2008
; 4. Hoppin et coll.,
2008 ; 5. Rinsky et coll., 2019
; 5. Rinsky et coll., 2019 ; 6. Hoppin et coll.,
2007
; 6. Hoppin et coll.,
2007 ; 7. Perla et coll., 2015
; 7. Perla et coll., 2015 ; 8. Raanan et coll.,
2016
; 8. Raanan et coll.,
2016 ; 9. Raanan et coll., 2015
; 9. Raanan et coll., 2015 ; 10. Callahan et coll.,
2014
; 10. Callahan et coll.,
2014 ; 11. Hoppin et coll., 2006
; 11. Hoppin et coll., 2006 ; 12. Hoppin et coll.,
2002
; 12. Hoppin et coll.,
2002 ; 13. Hoppin et coll., 2009
; 13. Hoppin et coll., 2009 ; 14. Valcin et coll.,
2007
; 14. Valcin et coll.,
2007 ; 15. Benka-Coker et coll.,
2019
; 15. Benka-Coker et coll.,
2019 ; 16. Ye et coll., 2015
; 16. Ye et coll., 2015 ; 17. Abellan et coll.,
2019
; 17. Abellan et coll.,
2019 ; 18. Hanssen et coll., 2015
; 18. Hanssen et coll., 2015 ; 19. Balte et coll.,
2017
; 19. Balte et coll.,
2017 ; 20. Meng et coll., 2016
; 20. Meng et coll., 2016 ; 21. Gascon et coll.,
2014
; 21. Gascon et coll.,
2014 ; 22. Kim et coll., 2019
; 22. Kim et coll., 2019 ; 23. Cha et coll.,
2012
; 23. Cha et coll.,
2012 ; 24. Schenker et coll.,
2004
; 24. Schenker et coll.,
2004 ; 25. Castro-Gutiérrez et coll.,
1997
; 25. Castro-Gutiérrez et coll.,
1997 ; 26. Kang et coll., 2006
; 26. Kang et coll., 2006 ; 27. Cherry et coll.,
2018
; 27. Cherry et coll.,
2018
++ d’après les résultats d’une méta-analyse de très bonne
qualité et convergence avec les résultats des études publiées
depuis la méta-analyse
+ d’après les résultats qui ont été
rapportés dans au moins 2 études indépendantes de bonne qualité
(2 études conduites sur la même cohorte, comme l’AHS, ne sont
pas considérées comme indépendantes)
± d’après les résultats
rapportés dans une seule étude (ou plusieurs études conduites
sur une même cohorte)
Les substances rapportées dans ce
tableau ont été définies à partir de l’ensemble des résultats de
la littérature épidémiologique des associations entre pesticides
et santé respiratoire (pas seulement dans la littérature
récente). En ce qui concerne les résultats de la cohorte AHS,
toutes les substances associées avec au moins un phénotype
respiratoire sont rapportées dans le tableau 16.II, et ne sont
reportées dans ce tableau que les substances identifiées dans au
moins 3 études AHS sur la santé respiratoire (ou associées avec
au moins 3 phénotypes respiratoires distincts), les substances
pour lesquelles il y a donc une cohérence interne pour les
associations observées.
Tableau 16.VI Caractéristiques des 17 pesticides potentiellement impliqués dans les pathologies pulmonaires obstructives sélectionnés à partir des résultats épidémiologiques
|
Composé
|
Famille chimique
|
Carcinogenèse
|
Usage agricole autorisé*
|
Irritant
|
Stress oxydant
|
Mitotoxicité
|
Immunomodulation
|
|---|---|---|---|---|---|---|---|
|
Insecticides
|
|||||||
|
Carbaryl
|
Carb
|
Circ 3
|
non
|
H315
|
x
| ||
|
Chlorpyrifos
|
OP
|
non
|
non**
|
x
|
x
|
x
|
|
|
Coumaphos
|
OP
|
non
|
x
| ||||
|
Diazinon
|
OP
|
Circ 2A
|
non
|
H315
|
x
|
x
|
|
|
Dichlorvos
|
OP
|
Circ 2B
|
non
|
H317
|
x
| ||
|
Malathion
|
OP
|
Circ 2A
|
oui
|
H317
|
x
|
x
| |
|
Parathion
|
OP
|
Circ 2B
|
non
|
x
|
x
|
||
|
DDT
|
OC
|
Circ 2A
|
non
|
x
|
x
| ||
|
Heptachlor
|
OC
|
Circ 2B
|
non
|
x
| |||
|
Hexachlorocyclohexane (HCH)
|
OC
|
Circ 1
|
non
|
x
|
x
| ||
|
Perméthrine
|
Pyr
|
Circ 3
|
non
|
H317
|
x
|
x
|
x
|
|
Herbicides
|
|||||||
|
Atrazine
|
Triazine
|
Circ 3
|
non
|
H317
|
x
|
x
| |
|
Chlorimuron-éthyle
|
Sulfonylurée
|
non
|
H315
|
x
| |||
|
Glyphosate
|
Circ 2A
|
oui
|
x
|
x
| |||
|
Paraquat
|
Bipyrymidine
|
non
|
H335 H315
|
x
|
x
| ||
|
2,4-D
|
Dérivé phénoxy
|
oui
|
H317 H335
|
x
|
x
|
||
|
2,4,5-T
|
Dérivé phénoxy
|
non
|
H315 H335
|
x
| |||
* : Autorisé pour une utilisation en agriculture en France en 2020 (https://ephy.anses.fr, consulté en mars 2020) ; ** chlorpyrifos méthyl est classé H317 ; Carb : carbamates ; Pyr : pyréthrinoïdes ; OC : organochlorés ; OP : organophosphorés
Tableau 16.VII Caractéristiques des 7 pesticides sélectionnés sur des critères moins restrictifs
|
Composé
|
Famille chimique
|
Carcinogenèse
|
Usage agricole autorisé*
|
Irritant
|
Stress oxydant
|
Mitotoxicité
|
Immuno-modulation
|
|---|---|---|---|---|---|---|---|
|
Insecticides
|
|||||||
|
Carbofuran
|
Carb
|
non
|
x
|
x
| |||
|
Cyfluthrine
|
Pyr
|
non**
|
x
|
x
|
|||
|
Cyperméthrine
|
Pyr
|
oui
|
H335 H315 H317
|
x
| |||
|
Herbicides
|
|||||||
|
Pendiméthaline
|
Dinitroaniline
|
oui
|
H317
|
x
| |||
|
Fongicides
|
|||||||
|
Captafol
|
Phtalimides
|
Circ 2A
|
non
|
H317
|
x
| ||
|
Chlorothalonil
|
OC
|
Circ 2B
|
non
|
H317 H335
|
x
|
x
|
|
|
Fluaziname
|
Pyridinamine
|
oui
|
H317 H315
|
x
| |||
* : Autorisé pour une utilisation en agriculture en France en 2020 (https://ephy.anses.fr, consulté en mars 2020) ; ** mais oui β-cyfluthrine ; Carb : carbamate ; Pyr : pyréthrinoïde ; OC : organochloré
Tableau 16.VIII Caractéristiques des 6 pesticides sélectionnés sur leur mécanisme d’action
|
Pesticide
|
Famille chimique
|
Carcinogenèse
|
Usage agricole autorisé*
|
Irritant
|
Stress oxydant
|
Mitotoxicité
|
Immunomodulation
|
|---|---|---|---|---|---|---|---|
|
Insecticides
|
|||||||
|
Deltaméthrine
|
Pyr
|
Circ 3
|
oui
|
x
|
|||
|
Méthoxychlore
|
OC
|
Circ 3
|
non
|
x
|
|||
|
Indoxacarbe
|
Oxadiazine
|
oui
|
H317
|
x
|
|||
|
Imidaclopride
|
Nitroguanidine
|
oui
|
x
|
||||
|
Fipronil
|
Phénypyrazole
|
non
|
x
|
||||
|
Fongicides
|
|||||||
|
Mancozèbe
|
Dithiocarbamate
|
oui
|
H317
|
x
|
|||
|
Coformulants
|
|||||||
|
PBO
|
Circ 3
|
-**
|
x
|
||||
* : Autorisé pour une utilisation en agriculture en France, https://ephy.anses.fr (consulté en mars 2020) ; ** : certaines formulations commerciales contiennent ce coformulant ; Pyr : pyréthrinoïde ; OC : organochloré
Tableau 16.IX Effets toxiques et pesticides : stress oxydatif, mitotoxicité et immunotoxicité
|
Composés
|
Effets
|
Modèles
|
Références
|
|---|---|---|---|
|
STRESS OXYDATIF – production
d’espèces réactives de l’oxygène
(ROS)
|
|||
|
DDT
|
↑ H2O2
|
Poisson (H.
malabaricus)-hépatocytes in
vitro
| |
|
Dieldrine
|
↑ ROS
|
PC12 (lignée
dopaminergique)
| |
|
THP1 (lignée monocyte
humain)
| |||
|
Heptachlore
|
↑ ROS
|
HaCaT (lignée kératinocytes
humains)
| |
|
Pendiméthaline
|
↑ ROS
|
V79 (lignée fibroblaste hamster), PBMC
humains
| |
|
STRESS OXYDATIF – systèmes de
défense
|
|||
|
Atrazine
|
↑ SOD, GPx, GR
↓ CAT |
Poisson (D. rerio)
| |
|
↑ Bax, Caspase 3, Nrf2
↓ Bcl2 (rein) |
Caille
| ||
|
↑ Nrf2, HO-1, NQO1, CAT, SOD, GPx
(rein)
|
Rat (28 jours)
| ||
|
Carbaryl
|
↓ GSH
↑ GST, CAT (foie, rein) |
Poisson (O. mykiss)
| |
|
Carbofuran
|
↓ CAT, SOD, GSH, GST, LPO (tous
tissus)
|
Poisson (C.
gariepinus)
| |
|
Chlorothalonil
|
↑ CAT, SOD, GPx, GR
(branchies)
|
Huitre et moule
| |
|
Chlorpyrifos
|
↓ CAT, SOD, GR (tissu
viscéral)
|
Poisson (G. affinis)
| |
|
Coumaphos
|
↑ CAT, SOD, GST, GSH, LPO
|
Algue (Ulva pertusa)
| |
|
Cyfluthrine
|
↑ BNIP3, AKT1, p53, APAF1, NF-κB1, TNFα
et Nrf2
|
SH-SY5Y (lignée
neuroblastome)
| |
|
β-Cyfluthrine
|
↑ LPO
↓ CAT, SOD, GPx (foie) |
Souris (per os)
| |
|
α-Cyperméthrine
|
↓ CAT, SOD, GSH,
HO-1, iNOS, NF-κB (poumon), NO, IL-1β, TNFα (sérum) |
Rat (per os)
| |
|
DDT
|
↑ CAT
↓ GST, SOD, GSH |
Poisson (H.
malabaricus)-hépatocytes in
vitro
| |
|
2,4,5-T
|
↓ GST, SOD, GSH
|
Erythrocytes
| |
|
HCH
|
↑ LPO
↓ CAT, SOD |
Cellules d’ascites
d’Ehrlich
| |
|
HCH
|
↑ GSH, GST, GPx, GR
|
CHO-K1
| |
|
Diazinon
|
↑ SOD, GPx (branchies)
|
Poisson (C. carpio)
| |
|
↓ GSH, CAT, GST (poumon)
|
Lapin (per os)
| ||
|
Glyphosate
|
↑ LPO
|
HepG2 (lignée
hépatocarcinome)
|
Kauba et coll., 2017
|
|
Malathion
|
↓ SOD, CAT, GSH
|
PC12 (phéochromocytome rat)
| |
|
↑ SOD, CAT (hippocampe)
|
Rat
| ||
|
Paraquat
|
↑ XO
↓ SOD (poumon) |
Rat
| |
|
STRESS OXYDATIF – oxydation des
macromolécules et dérivés
|
|||
|
Atrazine
|
↑ NO, MDA (rein)
|
Rat (28 jours)
| |
|
Captane
|
↑ Cassures ADN (comet assay,
γH2AX et 53BP1 foci)
|
HeLa (lignée humaine), AA8 (lignée
rongeur)
| |
|
Chlorimuron-éthyle
|
↑ MDA
↓ SOD (feuilles et racines) |
Blé
| |
|
Chlorothalonil
|
↑ MDA (branchies)
|
Huitre et moule
| |
|
↑ CA, MN, cassures ADN
|
PBMC humains
| ||
|
Chlorpyrifos
|
↑ MDA, LPO
|
Poisson (G. affinis)
| |
|
↑ Cassures ADN (comet assay)
(tissus : foie, cerveau, rein, rate)
|
Rat
| ||
|
↑ LPO (foie, cerveau), cassures ADN
(élution) (foie, cerveau et PC12)
|
Rat et lignée PC-12 lignée
phéochromocytome de la surrénale)
| ||
|
Cyfluthrine
|
↑ MDA, NO
↓ NQO-1 |
SH-SY5Y (lignée neuroblastome humain)
in vitro
| |
|
β-Cyfluthrine
|
↑ CA, cassures ADN (moelle
osseuse)
|
Souris
| |
|
α-Cyperméthrine
|
↑ MDA (poumon)
|
Rat (per os)
| |
|
2,4-D
|
↑ Cassures ADN (comet
assay)
|
Poisson (C.
decemmaculatus)
| |
|
Diazinon
|
↑ MDA (poumon)
|
Lapin (per os)
| |
|
Dichlorvos
|
↑ MDA (plasma)
↓ CAT (hématie) |
Rat
| |
|
Glyphosate
|
↑ Cassures ADN (comet
assay)
|
PBMC humains
| |
|
↑ Cassures ADN (comet
assay)
|
HepG2 (lignée
hépatocarcinome)
| ||
|
RoundUp 360+, glyphosate,
AMPA
|
↑ Cassures ADN (comet assay)
Roundup > glyphosate > AMPA
|
PBMC humains
| |
|
Malathion
|
↑ MDA
|
PC12 (phéochromocytome rat)
| |
|
↑ Cassures ADN (comet assay)
(tissus : foie, cerveau, rein, rate)
|
Rat
| ||
|
Parathion-méthyl
|
↑ Cassures ADN (comet assay)
(tissus : foie, cerveau, rein, rate)
|
Rat
| |
|
Paraquat
|
↑ MDA (poumon)
|
Rat
| |
|
Pendiméthaline
|
↑ Cassures ADN (comet assay),
MN
|
V79 (lignée fibroblaste hamster),
PBMC humains
| |
|
Perméthrine
|
↑ Cassure ADN (striatum)
|
Rat
| |
|
MITOTOXICITÉ – dysfonctionnement
mitochondrial
|
|||
|
Atrazine
|
Malformations et dégénérescence
mitochondriales
|
Caille
| |
|
Carbofuran
|
↓ Activité chaîne
respiratoire
↑ SDH, LPO (cerveau) |
Rat
| |
|
Chlorothalonil
|
↑ IL-1β, IL-6, TNFα, IFNγ, caspase 1, 3
et 8 et ↑ prolifération cellulaire
|
RAW 264.7 lignée macrophage
murin
| |
|
Chlorpyrifos
|
↓ Énergie
perturbation métabolisme des acides gras |
Rat
| |
|
Hyperréactivité bronchique
|
Rat
| ||
|
↓ IFN-γ, IL-4, IL-13
|
PBMC humains (traités PHA)
| ||
|
Cyfluthrine
|
↑ Bax, Bcl-2, Casp-3, BNIP3, AKT1, p53,
APAF1, NFκB1, TNFα et Nrf2
|
SH-SY5Y (lignée neuroblastome humain)
in vitro
| |
|
DDT
|
↑ Voie NF-κB/FasL et apoptose dépendant
de la production de ROS
|
HL-7702 (cellules foie
humain)
| |
|
β-HCH
|
↓ β-oxydation, perturbation TCA,
métabolisme acides gras
|
HepG2
| |
|
2,4-D
|
LLNA assay (positive) ↑ IGE,
IL-2, TNFα, INFγ, MCP-1, MIP-1b
|
Souris
| |
|
Diazinon
|
↑ TNF-α, IL6, CD40, CD86, MHC class II
mais
↓ phagocytose |
RAW 264.7 lignée macrophage
murin
| |
|
↑ TNFα, IL6 macrophages BAL
|
Souris
| ||
|
↓ IFNγ, IL-4, IL-13
|
PBMC humains (traités PHA)
| ||
|
Dieldrine
|
↑ NOX, p47phox, cPLA2, Ca2+
et stress kinases (JNK, ERK, p38MAPK)
|
THP1 (lignée monocyte
humain)
| |
|
Fluaziname
|
↓ Énergie, agent découplant
|
Poisson (D. rerio)
| |
|
IMMUNOTOXICITÉ – inflammation et
signalisation
|
|||
|
Glyphosate
|
Dysfonctionnement
↓ ROS |
C. elegans
| |
|
Imidaclopride
|
Modifications histopathologiques poumon
(inflammation)
↑ ARNm TNFα |
Souris
| |
|
Malathion
|
↑ Formation O2o- inhibition
complexe IV (hippocampe et striatum)
|
Rat
| |
|
Mancozèbe
|
↑ IL-1β, IL-6, TNF-α, IFN-γ, caspase 1,
3 et 8 ↑ prolifération cellulaire
|
RAW 264.7 lignée macrophage
murin
| |
|
Méthoxychlore
|
↑ IGE, INFγ, TNF, IL-4, IL-5, IL-6,
IL-10, IL-13, IL-17A
|
Souris
| |
|
Dégranulation des
mastocytes
↑ réaction allergique de type immédiat |
RBL-2H3 (lignée humaine de mastocytes),
mastocytes isolés de moelle osseuse de
souris
| ||
|
Paraquat
|
↑ MMP9, IL-8, VEGF, COX-2
(poumon)
|
Rat
| |
|
Parathion
|
↑ IGE, INFγ, TNF, IL-4, IL-5, IL-6,
IL-10, IL-13, IL-17A
|
Souris
| |
|
↑ TNF-α dans macrophages du
BAL
|
Cochon d’Inde
| ||
|
Perméthrine
|
Inhibition du complexe I
(striatum)
|
Rat
| |
|
↑ O2o-, MPO
|
Neutrophiles in vitro
(rat)
| ||
|
Butoxyde de pipéronyle
|
↑ IGE, INFγ, TNF, IL-6,
IL-13
|
Souris
| |
AKT1 : Ak strain transforming = RAC-alpha serine/threonine-protein kinase ; AMPA : aminomethylphosphonic acid ; APAF1 : apoptotic protease activating factor 1 ; BAL : bronchoalveolar lavage ; Bax : Bcl-2-associated protein X ; Bcl2 : B-cell lymphoma 2 ; BNIP3 : BCL2 Interacting Protein 3 ; CA : chromosome aberration ; CAT : catalase ; CD40 : Cluster of differentiation 40 ; COX-2 : cyclooxygenase-2 ; cPLA2 : cytosolic phospholipase A2 ; ERK : extracellular signal egulated kinases-r ; GPx : glutathione peroxidase ; GR : glutathione reductase ; GSH : glutathione ; GST : glutathione S-transferase ; γH2AX : phophorylated variant of H2A histone ; HO-1 : heme oxigenase-1 ; IL-1β : interleukin 1 beta ; IFNγ : interferon gamma ; JNK : c-Jun N-terminal kinase ; LLNA assay : local lymph node assay ; LPO : lipid peroxidase ; MCP-1 : monocyte chemoattractant protein 1 ; MDA : malondialdehyde ; MHC : major histocompatibility complex ; MIP-1b : macrophage inflammatory protein-1β ou CCL4 ; MN : micronucleus ; iNOS : nitric oxide synthases ; MMP9 : matrix metallopeptidase 9 ; MPO : myeloperoxidase ; NQO1 : NAD(P)H dehydrogenase [quinone] 1 ; NF-κB1 : nuclear factor NF-kappa-B p105 subunit ; Nrf2 : nuclear factor erythroid-2 elated factor 2-r ; p38MAPK : P38 mitogen-activated protein kinase ; p47phox : sub-unit of neutrophil NADPH oxidase = neutrophil cytosol factor 1 ; PC12 : pheochromocytoma cell line of the rat adrenal medulla ; ROS : reactive oxygen species ; SDH : succinate dehydrogenase ; SOD : superoxide dismutase ; TCA : tricarboxylic acid cycle = Krebs cycle ; TNFα : tumor necrosis factor ; VEGF : vascular endothelial growth factor ; XO : xanthine oxidase ; 53BP1 : p53-binding protein 1.
Références














































































































































































→ Aller vers SYNTHESE