Pesticides et effets sur la santé
III. Autres pathologies et évènements de santé
2021
| ANALYSE |
18-
Endométriose
 ). La
paroi interne de l’utérus est recouverte d’un tissu muqueux
(l’endomètre) composé d’un épithélium superficiel, reposant sur un
stroma composé de tissu conjonctif, contenant de nombreuses glandes.
Cette muqueuse dont les propriétés évoluent au cours du cycle menstruel
(épaississement et vascularisation dans la première phase, accueil
éventuel de l’embryon au cours de la deuxième phase), se desquame en
l’absence de fécondation, produisant les règles ou menstruations.
). La
paroi interne de l’utérus est recouverte d’un tissu muqueux
(l’endomètre) composé d’un épithélium superficiel, reposant sur un
stroma composé de tissu conjonctif, contenant de nombreuses glandes.
Cette muqueuse dont les propriétés évoluent au cours du cycle menstruel
(épaississement et vascularisation dans la première phase, accueil
éventuel de l’embryon au cours de la deuxième phase), se desquame en
l’absence de fécondation, produisant les règles ou menstruations. ). Les foyers d’endométriose peuvent être
présents dans divers organes et compartiments anatomiques. On distingue
ainsi principalement des localisations ovariennes (endométriome
ovarien), péritonéales superficielles et sous-péritonéales, ces
dernières pouvant être rétro-péritonéales ou profondes en infiltrant les
viscères abdominaux ou pelviens. Il existe également des localisations
exceptionnelles telles que les poumons, le cerveau ou les glandes
lacrymales.
). Les foyers d’endométriose peuvent être
présents dans divers organes et compartiments anatomiques. On distingue
ainsi principalement des localisations ovariennes (endométriome
ovarien), péritonéales superficielles et sous-péritonéales, ces
dernières pouvant être rétro-péritonéales ou profondes en infiltrant les
viscères abdominaux ou pelviens. Il existe également des localisations
exceptionnelles telles que les poumons, le cerveau ou les glandes
lacrymales. ).
). ). Les données du PMSI (programme de
médicalisation du système d’information), ont été utilisées en France
pour estimer la prévalence d’hospitalisation pour endométriose. Sur
environ 14 millions de femmes en âge de procréer entre 2008 et 2012,
environ 125 000 (0,9 %) ont été hospitalisées au moins une fois pour
cette pathologie (von Theobald et coll.,
2016
). Les données du PMSI (programme de
médicalisation du système d’information), ont été utilisées en France
pour estimer la prévalence d’hospitalisation pour endométriose. Sur
environ 14 millions de femmes en âge de procréer entre 2008 et 2012,
environ 125 000 (0,9 %) ont été hospitalisées au moins une fois pour
cette pathologie (von Theobald et coll.,
2016 ). Ce
pourcentage variait de 0,4 % à 1,6 % selon les régions et avait tendance
à augmenter dans le temps. La prévalence d’hospitalisation sous-estime
la prévalence de la maladie en population générale dans la mesure où de
nombreuses formes ne sont pas ou sont peu symptomatiques et n’entraînent
pas d’hospitalisation. Selon cette même étude, 10 à 50 % des formes
auraient une localisation ovarienne, péritonéale superficielle (20 à
30 %), digestive (10 à 20 %) et moins de 10 % urétrale et vésicale.
). Ce
pourcentage variait de 0,4 % à 1,6 % selon les régions et avait tendance
à augmenter dans le temps. La prévalence d’hospitalisation sous-estime
la prévalence de la maladie en population générale dans la mesure où de
nombreuses formes ne sont pas ou sont peu symptomatiques et n’entraînent
pas d’hospitalisation. Selon cette même étude, 10 à 50 % des formes
auraient une localisation ovarienne, péritonéale superficielle (20 à
30 %), digestive (10 à 20 %) et moins de 10 % urétrale et vésicale.Facteurs de risque
 ).
Des associations avec l’activité physique, l’alimentation et le fait
d’allaiter son enfant semblent exister mais auraient néanmoins
besoin d’être confirmées. L’exposition intra-utérine au
diéthylstilbestrol a également été associée avec une augmentation de
risque ultérieur, et le tabagisme plutôt à une diminution de risque,
qui pourrait s’expliquer par une diminution des niveaux d’œstrogènes
circulants chez les mères exposées.
).
Des associations avec l’activité physique, l’alimentation et le fait
d’allaiter son enfant semblent exister mais auraient néanmoins
besoin d’être confirmées. L’exposition intra-utérine au
diéthylstilbestrol a également été associée avec une augmentation de
risque ultérieur, et le tabagisme plutôt à une diminution de risque,
qui pourrait s’expliquer par une diminution des niveaux d’œstrogènes
circulants chez les mères exposées. ;
Vassilopoulou et coll., 2019
;
Vassilopoulou et coll., 2019 ), ce qui suggère une composante génétique
à la maladie. Les études de jumeaux estiment l’hérédité de
l’endométriose à 50 % (Zondervan et coll.,
2020
), ce qui suggère une composante génétique
à la maladie. Les études de jumeaux estiment l’hérédité de
l’endométriose à 50 % (Zondervan et coll.,
2020 ).
Plusieurs études d’association pangénomique ont été réalisées sur
des cohortes de femmes atteintes ou non d’endométriose. Parmi
celles-ci, une étude japonaise (Uno et coll.,
2010
).
Plusieurs études d’association pangénomique ont été réalisées sur
des cohortes de femmes atteintes ou non d’endométriose. Parmi
celles-ci, une étude japonaise (Uno et coll.,
2010 )
impliquant 1 907 patientes et 5 292 témoins et une étude
internationale (Painter et coll.,
2010
)
impliquant 1 907 patientes et 5 292 témoins et une étude
internationale (Painter et coll.,
2010 )
incluant 3 194 patientes et 7 060 témoins ont conduit à
l’identification de polymorphismes génétiques significativement
associés à la maladie. Les impacts fonctionnels de ces
polymorphismes, qui sont localisés dans des régions codantes et non
codantes du génome et qui touchent une vingtaine de gènes, restent à
déterminer. Cependant, ces variations n’augmentent que faiblement le
risque relatif de développer une endométriose : elles expliquent
ensemble à peine 5 % de l’héritabilité génétique de la maladie
(Sapkota et coll., 2017
)
incluant 3 194 patientes et 7 060 témoins ont conduit à
l’identification de polymorphismes génétiques significativement
associés à la maladie. Les impacts fonctionnels de ces
polymorphismes, qui sont localisés dans des régions codantes et non
codantes du génome et qui touchent une vingtaine de gènes, restent à
déterminer. Cependant, ces variations n’augmentent que faiblement le
risque relatif de développer une endométriose : elles expliquent
ensemble à peine 5 % de l’héritabilité génétique de la maladie
(Sapkota et coll., 2017 ). Des études ont mis en évidence des
associations entre des polymorphismes de gènes codant des enzymes
participant au métabolisme des xénobiotiques (cytochromes,
glutathion-S-transférases et N-acétyl-transférases) et le risque de
survenue de l’endométriose, ce qui évoque un effet
gène-environnement (Vassilopoulou et coll.,
2019
). Des études ont mis en évidence des
associations entre des polymorphismes de gènes codant des enzymes
participant au métabolisme des xénobiotiques (cytochromes,
glutathion-S-transférases et N-acétyl-transférases) et le risque de
survenue de l’endométriose, ce qui évoque un effet
gène-environnement (Vassilopoulou et coll.,
2019 ).
Cependant, à notre connaissance, il n’existe pas à ce jour des
données sur les interactions gènes-environnement dans le cadre de
l’endométriose et l’exposition aux pesticides.
).
Cependant, à notre connaissance, il n’existe pas à ce jour des
données sur les interactions gènes-environnement dans le cadre de
l’endométriose et l’exposition aux pesticides. ; Trabert et coll.,
2011
; Trabert et coll.,
2011 ).
). ;
Buck Louis et coll., 2005
;
Buck Louis et coll., 2005 ; Heilier et coll.,
2005
; Heilier et coll.,
2005 ;
Porpora et coll., 2006
;
Porpora et coll., 2006 ; Simsa et coll.,
2010
; Simsa et coll.,
2010 ;
Cai et coll., 2011
;
Cai et coll., 2011 ). Plus récemment, des associations ont
été mises en évidence pour des retardateurs de flamme (Hoffman et
coll., 2007
). Plus récemment, des associations ont
été mises en évidence pour des retardateurs de flamme (Hoffman et
coll., 2007 ; Buck Louis et coll., 2012
; Buck Louis et coll., 2012 ). Ces xénobiotiques ayant des propriétés
de perturbateurs endocriniens sont des ligands du récepteur
aryl-hydrocarbone (AhR), notion à rapprocher de l’implication
potentielle de ce récepteur dans le fonctionnement normal de
l’endomètre en modulant la prolifération cellulaire en réponse aux
hormones stéroïdiennes (Hernández-Ochoa et coll.,
2009
). Ces xénobiotiques ayant des propriétés
de perturbateurs endocriniens sont des ligands du récepteur
aryl-hydrocarbone (AhR), notion à rapprocher de l’implication
potentielle de ce récepteur dans le fonctionnement normal de
l’endomètre en modulant la prolifération cellulaire en réponse aux
hormones stéroïdiennes (Hernández-Ochoa et coll.,
2009 ).
Enfin, une dizaine d’études épidémiologiques, analysées ici, ont
exploré l’association entre l’exposition aux pesticides, notamment
ceux appartenant à la famille des organochlorés, et le risque de
l’endométriose.
).
Enfin, une dizaine d’études épidémiologiques, analysées ici, ont
exploré l’association entre l’exposition aux pesticides, notamment
ceux appartenant à la famille des organochlorés, et le risque de
l’endométriose.Mécanismes physiopathologiques
 ).
). ;
Dawson et coll., 2018
;
Dawson et coll., 2018 ). L’implantation qui survient est alors
suivie d’une prolifération à condition de recevoir des nutriments en
quantité suffisante. Une angiogenèse et une lymphangiogenèse sont
donc fréquemment observées suite à l’étape d’implantation (Nisolle
et coll., 2007
). L’implantation qui survient est alors
suivie d’une prolifération à condition de recevoir des nutriments en
quantité suffisante. Une angiogenèse et une lymphangiogenèse sont
donc fréquemment observées suite à l’étape d’implantation (Nisolle
et coll., 2007 ). Les endométrioses ovariennes semblent prendre leur origine
d’implants superficiels du péritoine qui adhèrent au cortex ovarien
entraînant un refoulement du parenchyme et la formation de
pseudo-kystes (endométriomes), avec en leur sein du tissu
endométrial qui saigne au moment des règles entretenant ainsi une
inflammation (Brosens et coll.,
2003
). Les endométrioses ovariennes semblent prendre leur origine
d’implants superficiels du péritoine qui adhèrent au cortex ovarien
entraînant un refoulement du parenchyme et la formation de
pseudo-kystes (endométriomes), avec en leur sein du tissu
endométrial qui saigne au moment des règles entretenant ainsi une
inflammation (Brosens et coll.,
2003 ).
Pour la formation des lésions profondes (endométriose profonde), les
mécanismes sont controversés avec deux propositions principales :
i) une infiltration d’une lésion superficielle (Koninckx
et Martin, 1992
).
Pour la formation des lésions profondes (endométriose profonde), les
mécanismes sont controversés avec deux propositions principales :
i) une infiltration d’une lésion superficielle (Koninckx
et Martin, 1992 ) ou ii) le développement
d’infiltrats endométriaux au cours du développement embryonnaire
(Donnez et coll., 2002
) ou ii) le développement
d’infiltrats endométriaux au cours du développement embryonnaire
(Donnez et coll., 2002 ).
). ;
Ballester et coll., 2012b
;
Ballester et coll., 2012b ) ou à une augmentation de la production
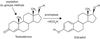
locale d’œstradiol par l’aromatase, enzyme clé de la biosynthèse des
œstrogènes (également associée ensuite à la prolifération, voir
ci-dessous) et de prostaglandines (PG). Ces cellules seront ensuite
désignées par l’adjectif « ectopique ».
) ou à une augmentation de la production
locale d’œstradiol par l’aromatase, enzyme clé de la biosynthèse des
œstrogènes (également associée ensuite à la prolifération, voir
ci-dessous) et de prostaglandines (PG). Ces cellules seront ensuite
désignées par l’adjectif « ectopique ». )
(voir ci-dessous). D’autres facteurs ont été impliqués, par exemple
des cytokines et des chimiokines inflammatoires comme les
interleukines-1β et 6, le TNF-α (Tumor Necrosis Factor, via
la prolifération et l’adhésion des cellules péritonéales) et le
TGF-β (Transforming Growth Factor β). La régulation des
métalloprotéinases de la matrice (MMP) et la stimulation de
l’angiogenèse sont aussi impliquées (Herington et coll.,
2011
)
(voir ci-dessous). D’autres facteurs ont été impliqués, par exemple
des cytokines et des chimiokines inflammatoires comme les
interleukines-1β et 6, le TNF-α (Tumor Necrosis Factor, via
la prolifération et l’adhésion des cellules péritonéales) et le
TGF-β (Transforming Growth Factor β). La régulation des
métalloprotéinases de la matrice (MMP) et la stimulation de
l’angiogenèse sont aussi impliquées (Herington et coll.,
2011 ).
Dans l’endométriose péritonéale, les cellules mésenchymateuses
stromales semblent jouer un rôle essentiel au cours de cette phase
d’adhésion.
).
Dans l’endométriose péritonéale, les cellules mésenchymateuses
stromales semblent jouer un rôle essentiel au cours de cette phase
d’adhésion. ).
). ).
De plus, les cellules endométriales expriment des
17β-hydroxystéroïde déshydrogénases qui convertissent l’œstradiol en
œstrone et donc entraîne la diminution des concentrations de
17β-œstradiol (E2), qui est l’œstrogène le plus puissant. La faible
concentration de l’E2 dans le tissu endométrial normal entraîne une
faible stimulation du récepteur nucléaire ERβ (Estrogen
Receptor-β), qui, à son tour, régule l’expression de la COX2
à l’origine de la production de la prostaglandine PGE2, et par
conséquent, la concentration de ce médiateur pro-inflammatoire est
faible. En cas d’endométriose, une augmentation de l’activité de
l’aromatase est observée et donc, par ricochet, l’activité de COX2
avec une production accrue de PGE2. Cette production serait de
nature à provoquer des douleurs chroniques et des dysménorrhées (Lai
et coll., 2019
).
De plus, les cellules endométriales expriment des
17β-hydroxystéroïde déshydrogénases qui convertissent l’œstradiol en
œstrone et donc entraîne la diminution des concentrations de
17β-œstradiol (E2), qui est l’œstrogène le plus puissant. La faible
concentration de l’E2 dans le tissu endométrial normal entraîne une
faible stimulation du récepteur nucléaire ERβ (Estrogen
Receptor-β), qui, à son tour, régule l’expression de la COX2
à l’origine de la production de la prostaglandine PGE2, et par
conséquent, la concentration de ce médiateur pro-inflammatoire est
faible. En cas d’endométriose, une augmentation de l’activité de
l’aromatase est observée et donc, par ricochet, l’activité de COX2
avec une production accrue de PGE2. Cette production serait de
nature à provoquer des douleurs chroniques et des dysménorrhées (Lai
et coll., 2019 ). Alors que la participation de la progestérone et de l’hormone
folliculo-stimulante dans la prolifération des cellules
endométriales reste discutée (Patel et coll.,
2017
). Alors que la participation de la progestérone et de l’hormone
folliculo-stimulante dans la prolifération des cellules
endométriales reste discutée (Patel et coll.,
2017 ;
Zondervan et coll., 2018
;
Zondervan et coll., 2018 ), les MMP semblent être impliquées dans
ce processus. L’expression ou l’activité de MMP2 et MMP9 est
associée à la sévérité de l’endométriose (Salata et coll.,
2008
), les MMP semblent être impliquées dans
ce processus. L’expression ou l’activité de MMP2 et MMP9 est
associée à la sévérité de l’endométriose (Salata et coll.,
2008 ),
MMP9 jouant un rôle à la fois dans l’initiation et le développement
de la pathologie ; l’inhibition de COX2 diminue la migration et
l’invasion des cellules épithéliales et stromales in vitro
par la suppression de l’activité de MMP2 et MMP9 en lien avec une
diminution de PGE2 (Banu et coll.,
2008
),
MMP9 jouant un rôle à la fois dans l’initiation et le développement
de la pathologie ; l’inhibition de COX2 diminue la migration et
l’invasion des cellules épithéliales et stromales in vitro
par la suppression de l’activité de MMP2 et MMP9 en lien avec une
diminution de PGE2 (Banu et coll.,
2008 ).
). ;
Attia et coll., 2000
;
Attia et coll., 2000 ; Xue et coll.,
2007a
; Xue et coll.,
2007a ).
Ainsi, la profondeur de l’implantation semble inversement corrélée à
l’expression des ER et PR (Donnez et coll.,
1997
).
Ainsi, la profondeur de l’implantation semble inversement corrélée à
l’expression des ER et PR (Donnez et coll.,
1997 ) et
le potentiel de croissance des lésions pourrait être lié au ratio
ERα/ERβ, diminué dans les endométriomes comparativement au tissu
normal (Brandenberger et coll.,
1999
) et
le potentiel de croissance des lésions pourrait être lié au ratio
ERα/ERβ, diminué dans les endométriomes comparativement au tissu
normal (Brandenberger et coll.,
1999 ).
Par ailleurs, ce maintien pourrait être associé à un déficit ou une
dysfonction immunitaire de plusieurs types cellulaires : les
« Natural Killer » (NK), certains lymphocytes T et les
macrophages infiltrants (Ploteau,
2016
).
Par ailleurs, ce maintien pourrait être associé à un déficit ou une
dysfonction immunitaire de plusieurs types cellulaires : les
« Natural Killer » (NK), certains lymphocytes T et les
macrophages infiltrants (Ploteau,
2016 ;
Riccio, Luiza da Gama Coelho et coll.,
2018
;
Riccio, Luiza da Gama Coelho et coll.,
2018 ;
Symons et coll., 2018
;
Symons et coll., 2018 ). Ce dysfonctionnement empêche la
reconnaissance des cellules endométriales ectopiques ; celles-ci ne
sont pas éliminées ce qui à terme favoriserait leur implantation et
les manifestations pathologiques. Au cours de ce processus, les
macrophages jouent un rôle particulier ; ainsi, en présence des
cellules endométriales ectopiques, ils produisent de grandes
quantités d’espèces réactives de l’oxygène (ERO) déclenchant un
stress oxydant non seulement au niveau des implants mais aussi du
tissu local. Cette activation locale des macrophages pourrait être
due à l’action initiale d’une chimiokine, MCP-1 (Monocyte
Chemotactic Protein-1), produite par le tissu endométrial
ectopique qui conduit à un recrutement de monocytes circulants au
sein de la lésion et à leur différenciation en macrophages (Ulukus
et coll., 2009
). Ce dysfonctionnement empêche la
reconnaissance des cellules endométriales ectopiques ; celles-ci ne
sont pas éliminées ce qui à terme favoriserait leur implantation et
les manifestations pathologiques. Au cours de ce processus, les
macrophages jouent un rôle particulier ; ainsi, en présence des
cellules endométriales ectopiques, ils produisent de grandes
quantités d’espèces réactives de l’oxygène (ERO) déclenchant un
stress oxydant non seulement au niveau des implants mais aussi du
tissu local. Cette activation locale des macrophages pourrait être
due à l’action initiale d’une chimiokine, MCP-1 (Monocyte
Chemotactic Protein-1), produite par le tissu endométrial
ectopique qui conduit à un recrutement de monocytes circulants au
sein de la lésion et à leur différenciation en macrophages (Ulukus
et coll., 2009 ). L’inflammation et le stress oxydant induits par les macrophages
peuvent, en plus des phénomènes décrits ci-dessus, contribuer par la
production de nombreuses cytokines et interleukines aux
dysfonctionnements des autres cellules mentionnées plus haut
(cellules NK) ou à la production de Vascular Endothelial Growth
Factor (VEGF) contribuant à l’angiogenèse participant à
l’homéostasie des lésions (Asghari et coll.,
2018
). L’inflammation et le stress oxydant induits par les macrophages
peuvent, en plus des phénomènes décrits ci-dessus, contribuer par la
production de nombreuses cytokines et interleukines aux
dysfonctionnements des autres cellules mentionnées plus haut
(cellules NK) ou à la production de Vascular Endothelial Growth
Factor (VEGF) contribuant à l’angiogenèse participant à
l’homéostasie des lésions (Asghari et coll.,
2018 ).
Ainsi, les niveaux de VEGF sont augmentés dans le fluide péritonéal
de patientes atteintes d’endométriose par rapport aux femmes non
atteintes (Pupo-Nogueira et coll.,
2007
).
Ainsi, les niveaux de VEGF sont augmentés dans le fluide péritonéal
de patientes atteintes d’endométriose par rapport aux femmes non
atteintes (Pupo-Nogueira et coll.,
2007 ).
Par ailleurs, une étude récente combinant intelligence artificielle
(traitement du langage naturel de la base PubMed) et analyse
bio-informatique a permis de proposer 6 gènes particuliers associés
du point de vue de leur variation d’expression et/ou d’activité avec
une endométriose (sous réserve de validation expérimentale
définitive) : CDKN2B (Cyclin-dependent kinase
inhibitor 2B), MAPK1 (Mitogen-activated protein
kinase 1), WNT4 (Wnt family member 4),
ILA (Interleukin 1 alpha), AKT1
(Serine/threonine kinase 1), et KRAS (V-Ki-ras2
Kirsten rat sarcoma viral oncogene homolog). L’ensemble de
ces gènes participe plus ou moins directement à des processus
cellulaires tels que la prolifération ou l’inflammation (Bouaziz et
coll., 2018
).
Par ailleurs, une étude récente combinant intelligence artificielle
(traitement du langage naturel de la base PubMed) et analyse
bio-informatique a permis de proposer 6 gènes particuliers associés
du point de vue de leur variation d’expression et/ou d’activité avec
une endométriose (sous réserve de validation expérimentale
définitive) : CDKN2B (Cyclin-dependent kinase
inhibitor 2B), MAPK1 (Mitogen-activated protein
kinase 1), WNT4 (Wnt family member 4),
ILA (Interleukin 1 alpha), AKT1
(Serine/threonine kinase 1), et KRAS (V-Ki-ras2
Kirsten rat sarcoma viral oncogene homolog). L’ensemble de
ces gènes participe plus ou moins directement à des processus
cellulaires tels que la prolifération ou l’inflammation (Bouaziz et
coll., 2018 ).
). )
ne sont pas indépendantes : ainsi au cours de l’endométriose les
cellules stromales participent à l’adhésion tandis que les cellules
épithéliales permettent la prolifération.
)
ne sont pas indépendantes : ainsi au cours de l’endométriose les
cellules stromales participent à l’adhésion tandis que les cellules
épithéliales permettent la prolifération.Données épidémiologiques
 )
(tableau 18.I
)
(tableau 18.I , voir en
fin de ce chapitre). L’association entre l’exposition aux pesticides
organochlorés et risque d’endométriose a été explorée dans deux
revues systématiques de la littérature avec méta-analyse
(Cano-Sancho et coll., 2019
, voir en
fin de ce chapitre). L’association entre l’exposition aux pesticides
organochlorés et risque d’endométriose a été explorée dans deux
revues systématiques de la littérature avec méta-analyse
(Cano-Sancho et coll., 2019 ; Wen et coll.,
2019
; Wen et coll.,
2019 ).
La méta-analyse de Cano-Sancho et coll. portait sur une sélection de
17 études sur les polluants organiques persistants (POP) dont 5 qui
incluaient des pesticides organochlorés, et celle de Wen et coll.
portait sur une sélection de 30 études sur les perturbateurs
endocriniens dont 8 qui incluaient des pesticides organochlorés.
S’agissant des pesticides organochlorés, l’analyse de Cano-Sancho et
coll. aboutissait à un Odds Ratio (OR) global de 1,23 ;
IC 95 % [1,13-1,36] tandis que celle de Wen et coll. aboutissait à
un OR de 1,40 ; IC 95 % [1,02-1,92]. Les deux méta-analyses sont
donc arrivées à des conclusions assez similaires et nous avons
choisi ici de ne détailler que l’étude la plus rigoureuse pour
résumer la littérature sur la question du lien entre pesticides
organochlorés et risque d’endométriose. Les études incluses dans les
deux méta-analyses ont ensuite été détaillées individuellement.
).
La méta-analyse de Cano-Sancho et coll. portait sur une sélection de
17 études sur les polluants organiques persistants (POP) dont 5 qui
incluaient des pesticides organochlorés, et celle de Wen et coll.
portait sur une sélection de 30 études sur les perturbateurs
endocriniens dont 8 qui incluaient des pesticides organochlorés.
S’agissant des pesticides organochlorés, l’analyse de Cano-Sancho et
coll. aboutissait à un Odds Ratio (OR) global de 1,23 ;
IC 95 % [1,13-1,36] tandis que celle de Wen et coll. aboutissait à
un OR de 1,40 ; IC 95 % [1,02-1,92]. Les deux méta-analyses sont
donc arrivées à des conclusions assez similaires et nous avons
choisi ici de ne détailler que l’étude la plus rigoureuse pour
résumer la littérature sur la question du lien entre pesticides
organochlorés et risque d’endométriose. Les études incluses dans les
deux méta-analyses ont ensuite été détaillées individuellement.Méta-analyse
 ). Ont été considérées les études
publiées en anglais jusqu’à août 2018 comprenant les mesures
d’exposition aux dibenzodioxines ou dibenzofuranes polychlorés,
des PCB, ou des pesticides organochlorés. Les actes de
conférences, les revues et les données redondantes n’étaient pas
inclus dans l’analyse. Le paramètre d’évaluation principal de la
revue était la présence d’endométriose (incluant l’ensemble des
sous-types), quel que soit l’âge ou l’IMC des participants.
). Ont été considérées les études
publiées en anglais jusqu’à août 2018 comprenant les mesures
d’exposition aux dibenzodioxines ou dibenzofuranes polychlorés,
des PCB, ou des pesticides organochlorés. Les actes de
conférences, les revues et les données redondantes n’étaient pas
inclus dans l’analyse. Le paramètre d’évaluation principal de la
revue était la présence d’endométriose (incluant l’ensemble des
sous-types), quel que soit l’âge ou l’IMC des participants.Études cas-témoins sur les pesticides organochlorés
 ) figuraient une étude dite de « cohorte » et quatre études
cas-témoins. Les principaux résultats sont présentés
ci-dessous.
) figuraient une étude dite de « cohorte » et quatre études
cas-témoins. Les principaux résultats sont présentés
ci-dessous. ). Ces deux cohortes étaient appariées
sur l’âge et le lieu de résidence. À l’inclusion, un
questionnaire et un examen anthropométrique étaient réalisés
deux mois avant chirurgie (dans la première cohorte) ou IRM
(dans la seconde). L’exposition étant évaluée de manière
concomitante avec la recherche d’une endométriose, l’étude n’est
pas une cohorte au sens où on l’entend habituellement en
épidémiologie, mais plutôt une enquête transversale excluant les
cas précédemment diagnostiqués. Un algorithme a été utilisé pour
classer l’endométriose selon le stade de sévérité. Dans la
cohorte « opérée », l’endométriose était définie par
visualisation puis qualifiée par examen histologique. Tandis que
dans la cohorte en population, l’endométriose diagnostiquée par
IRM était essentiellement une endométriose ovarienne. Les
échantillons de tissu adipeux viscéral (uniquement pour la
cohorte « opérée ») et de sérum (pour les deux cohortes) ont été
analysés pour les pesticides organochlorés suivants :
hexachlorobenzène (HCB), β- et γ-hexachlorocyclohexane (HCH),
oxychlordane, cis- et trans-nonachlore,
cis- et trans-chlordane,
p,p’-dichlorodiphényltrichloroéthane (p,p’-DDT) et ses
métabolites o,p’-DDT et p,p’-dichlorodiphényldichloroéthylène
(p,p’-DDE). Les isomères d’un même pesticide (HCH) étaient
retrouvés associés à une augmentation de risque d’endométriose
dans les deux cohortes : le γ-HCH était le seul pesticide
associé à une élévation du risque dans la cohorte de femmes
opérées (OR ajusté = 1,27 ; IC 95 % [1,01-1,59] pour chaque
augmentation d’un écart-type de γ-HCH log-transformé), tandis
que le β-HCH était le seul pesticide associé au risque dans la
cohorte en population (OR ajusté = 1,72 ; IC 95 % [1,09-2,72]).
Les associations étaient présentes avant et après ajustement sur
l’âge, une variable composite entre antécédent d’allaitement et
parité, l’IMC, et la cotinine comme mesure d’exposition au
tabagisme, ainsi que les lipides sériques totaux.
). Ces deux cohortes étaient appariées
sur l’âge et le lieu de résidence. À l’inclusion, un
questionnaire et un examen anthropométrique étaient réalisés
deux mois avant chirurgie (dans la première cohorte) ou IRM
(dans la seconde). L’exposition étant évaluée de manière
concomitante avec la recherche d’une endométriose, l’étude n’est
pas une cohorte au sens où on l’entend habituellement en
épidémiologie, mais plutôt une enquête transversale excluant les
cas précédemment diagnostiqués. Un algorithme a été utilisé pour
classer l’endométriose selon le stade de sévérité. Dans la
cohorte « opérée », l’endométriose était définie par
visualisation puis qualifiée par examen histologique. Tandis que
dans la cohorte en population, l’endométriose diagnostiquée par
IRM était essentiellement une endométriose ovarienne. Les
échantillons de tissu adipeux viscéral (uniquement pour la
cohorte « opérée ») et de sérum (pour les deux cohortes) ont été
analysés pour les pesticides organochlorés suivants :
hexachlorobenzène (HCB), β- et γ-hexachlorocyclohexane (HCH),
oxychlordane, cis- et trans-nonachlore,
cis- et trans-chlordane,
p,p’-dichlorodiphényltrichloroéthane (p,p’-DDT) et ses
métabolites o,p’-DDT et p,p’-dichlorodiphényldichloroéthylène
(p,p’-DDE). Les isomères d’un même pesticide (HCH) étaient
retrouvés associés à une augmentation de risque d’endométriose
dans les deux cohortes : le γ-HCH était le seul pesticide
associé à une élévation du risque dans la cohorte de femmes
opérées (OR ajusté = 1,27 ; IC 95 % [1,01-1,59] pour chaque
augmentation d’un écart-type de γ-HCH log-transformé), tandis
que le β-HCH était le seul pesticide associé au risque dans la
cohorte en population (OR ajusté = 1,72 ; IC 95 % [1,09-2,72]).
Les associations étaient présentes avant et après ajustement sur
l’âge, une variable composite entre antécédent d’allaitement et
parité, l’IMC, et la cotinine comme mesure d’exposition au
tabagisme, ainsi que les lipides sériques totaux. ). Pour 80 d’entre elles, les taux sériques de six pesticides
ont été mesurés : aldrine, β-HCH (ou β-benzene
hexachloride ; β-BHC), DDE, HCB, mirex, et
trans-nonachlore. Parmi les participantes, 32 avaient été
diagnostiquées avec endométriose par biopsie (dont 20 cas
classifiés comme minimes ou légers, et 12 cas classifiés comme
modérés ou sévères selon la classification de l’American
Fertility Society) et 52 n’avaient pas d’endométriose
identifiée (témoins). Par régression logistique, le tercile le
plus élevé du fongicide aromatique (HCB) était associé à une
augmentation de risque d’endométriose (OR ajusté = 5,3 ; IC 95 %
[1,2-23,6]) comparé au plus faible, après ajustement sur le
tabagisme et concentration de lipides sériques. Cette
association n’était pas statistiquement significative pour le
tercile intermédiaire (OR ajusté = 1,9 ; IC 95 % [0,5-7,3]).
L’ajustement sur les lipides avait plutôt tendance à augmenter
les associations. Des résultats similaires, mais non
significatifs, étaient retrouvés pour le
trans-nonachlore. Des tendances positives étaient
observées pour l’aldrine, le β-HCH et le mirex, mais
l’interprétation de ces résultats est limitée par le faible taux
de détection de ces molécules.
). Pour 80 d’entre elles, les taux sériques de six pesticides
ont été mesurés : aldrine, β-HCH (ou β-benzene
hexachloride ; β-BHC), DDE, HCB, mirex, et
trans-nonachlore. Parmi les participantes, 32 avaient été
diagnostiquées avec endométriose par biopsie (dont 20 cas
classifiés comme minimes ou légers, et 12 cas classifiés comme
modérés ou sévères selon la classification de l’American
Fertility Society) et 52 n’avaient pas d’endométriose
identifiée (témoins). Par régression logistique, le tercile le
plus élevé du fongicide aromatique (HCB) était associé à une
augmentation de risque d’endométriose (OR ajusté = 5,3 ; IC 95 %
[1,2-23,6]) comparé au plus faible, après ajustement sur le
tabagisme et concentration de lipides sériques. Cette
association n’était pas statistiquement significative pour le
tercile intermédiaire (OR ajusté = 1,9 ; IC 95 % [0,5-7,3]).
L’ajustement sur les lipides avait plutôt tendance à augmenter
les associations. Des résultats similaires, mais non
significatifs, étaient retrouvés pour le
trans-nonachlore. Des tendances positives étaient
observées pour l’aldrine, le β-HCH et le mirex, mais
l’interprétation de ces résultats est limitée par le faible taux
de détection de ces molécules. ). Les concentrations de pesticides organochlorés étaient
mesurées dans le sérum de cas confirmés par chirurgie (n = 248),
diagnostiqués en 1999-2001 et chez des témoins de la population
(n = 538) appariés sur l’âge (classes de 5 ans). Les OR et
IC 95 % ont été calculés par régression logistique non
conditionnelle, ajustés sur âge, année, lipides sériques,
éducation, ethnie, tabagisme, et consommation d’alcool. Les
résultats ont montré que le β-HCH et le mirex étaient
positivement associés à l’endométriose. Pour le β-HCH, le
3e quartile d’exposition comparé au plus faible :
OR = 1,7 ; IC 95 % [1,0-2,8] ; le 4e comparé au plus
faible quartile : OR = 1,3 ; IC 95 % [0,8-2,4] et pour le mirex,
la catégorie la plus élevée comparée à la plus faible :
OR = 1,5 ; IC 95 % [1,0-2,2]. L’association avec le β-HCH était
plus forte lorsque l’analyse était restreinte aux cas
d’endométriose ovarienne (3e comparé au dernier
quartile : OR = 2,5 ; IC 95 % [1,5-5,2] ; 4e comparé
au plus faible quartile : OR = 2,5 ; IC 95 % [1,1-5,3]).
). Les concentrations de pesticides organochlorés étaient
mesurées dans le sérum de cas confirmés par chirurgie (n = 248),
diagnostiqués en 1999-2001 et chez des témoins de la population
(n = 538) appariés sur l’âge (classes de 5 ans). Les OR et
IC 95 % ont été calculés par régression logistique non
conditionnelle, ajustés sur âge, année, lipides sériques,
éducation, ethnie, tabagisme, et consommation d’alcool. Les
résultats ont montré que le β-HCH et le mirex étaient
positivement associés à l’endométriose. Pour le β-HCH, le
3e quartile d’exposition comparé au plus faible :
OR = 1,7 ; IC 95 % [1,0-2,8] ; le 4e comparé au plus
faible quartile : OR = 1,3 ; IC 95 % [0,8-2,4] et pour le mirex,
la catégorie la plus élevée comparée à la plus faible :
OR = 1,5 ; IC 95 % [1,0-2,2]. L’association avec le β-HCH était
plus forte lorsque l’analyse était restreinte aux cas
d’endométriose ovarienne (3e comparé au dernier
quartile : OR = 2,5 ; IC 95 % [1,5-5,2] ; 4e comparé
au plus faible quartile : OR = 2,5 ; IC 95 % [1,1-5,3]). ). Les femmes incluses avaient entre
18 et 45 ans. Des échantillons de sérum et de tissu adipeux
(sous-cutané et viscéral) ont été prélevés à partir des cas
confirmés chirurgicalement (n = 55) et de témoins (n = 44)
inclus entre 2013 et 2015 (Pays de la Loire, France). Les
témoins avaient consulté pour des motifs gynécologiques bénins
(ligature des trompes, prolapsus génital, kystectomie ovarienne)
sans symptôme clinique évocateur d’un diagnostic d’endométriose
profonde en absence d’exploration invasive. L’âge, l’IMC,
l’origine ethnique et la région de résidence des cas et des
témoins étaient similaires. Les taux de 76 composés, dont des
dioxines, des PCB, des polybromodiphényléthers (PBDE), des
polybromobiphényles (PBB), des hexabromocyclododécanes (HBCD) et
des pesticides organochlorés ont été quantifiés par
chromatographie couplée à la spectrométrie de masse. Les taux
sériques de POP étaient ajustés sur les lipides totaux en
considérant la somme des phospholipides, triglycérides,
cholestérol total et cholestérol libre. Le modèle final incluait
l’âge et l’IMC comme covariables, car les autres variables
considérées ne modifiaient pas les estimations de façon
importante (variations des OR inférieures à 10 %). Les résultats
montraient des associations significatives entre le risque
d’endométriose et les niveaux de plusieurs pesticides
organochlorés dont le trans-nonachlore, le
cis-heptachlor époxyde, la dieldrine, le β-HCH et l’HCB
dans le tissu adipeux. L’association avec le
cis-heptachlor époxyde (OR = 5,36 ; IC 95 % [2,44-14,84])
était la deuxième la plus forte après un autre POP (non
pesticide) par augmentation d’un écart-type de concentration
log-transformée. Dans cette étude, les relations étaient
généralement plus marquées avec les concentrations mesurées dans
le tissu adipeux que dans le sérum, possiblement en raison d’un
meilleur taux de détection ; ils étaient également plus marqués
quand les cas avaient en plus une endométriose ovarienne.
). Les femmes incluses avaient entre
18 et 45 ans. Des échantillons de sérum et de tissu adipeux
(sous-cutané et viscéral) ont été prélevés à partir des cas
confirmés chirurgicalement (n = 55) et de témoins (n = 44)
inclus entre 2013 et 2015 (Pays de la Loire, France). Les
témoins avaient consulté pour des motifs gynécologiques bénins
(ligature des trompes, prolapsus génital, kystectomie ovarienne)
sans symptôme clinique évocateur d’un diagnostic d’endométriose
profonde en absence d’exploration invasive. L’âge, l’IMC,
l’origine ethnique et la région de résidence des cas et des
témoins étaient similaires. Les taux de 76 composés, dont des
dioxines, des PCB, des polybromodiphényléthers (PBDE), des
polybromobiphényles (PBB), des hexabromocyclododécanes (HBCD) et
des pesticides organochlorés ont été quantifiés par
chromatographie couplée à la spectrométrie de masse. Les taux
sériques de POP étaient ajustés sur les lipides totaux en
considérant la somme des phospholipides, triglycérides,
cholestérol total et cholestérol libre. Le modèle final incluait
l’âge et l’IMC comme covariables, car les autres variables
considérées ne modifiaient pas les estimations de façon
importante (variations des OR inférieures à 10 %). Les résultats
montraient des associations significatives entre le risque
d’endométriose et les niveaux de plusieurs pesticides
organochlorés dont le trans-nonachlore, le
cis-heptachlor époxyde, la dieldrine, le β-HCH et l’HCB
dans le tissu adipeux. L’association avec le
cis-heptachlor époxyde (OR = 5,36 ; IC 95 % [2,44-14,84])
était la deuxième la plus forte après un autre POP (non
pesticide) par augmentation d’un écart-type de concentration
log-transformée. Dans cette étude, les relations étaient
généralement plus marquées avec les concentrations mesurées dans
le tissu adipeux que dans le sérum, possiblement en raison d’un
meilleur taux de détection ; ils étaient également plus marqués
quand les cas avaient en plus une endométriose ovarienne. ). Par des analyses de « machine learning », les
auteurs ont montré que le cis-heptachlore époxyde
apparaissait (avec 2 autres POP) comme associé au risque
d’endométriose dans les 5 modèles utilisés. Le
trans-nonachlore était identifié par 4 modèles et
l’oxychlordane dans 3 des 5 modèles. Les modèles étaient les
suivants : régression logistique, réseaux de neurones, machines
à vecteurs de support, « adaptive boosting », et analyse
discriminante par moindres carrés partiels. Les résultats
obtenus sont cohérents avec l’analyse précédente. Dans les cas
d’expositions hautement corrélées, cet article montre comment
des techniques statistiques avancées pourraient être utiles pour
la modélisation des expositions aux polluants, et constituer une
approche complémentaire aux analyses statistiques
classiques.
). Par des analyses de « machine learning », les
auteurs ont montré que le cis-heptachlore époxyde
apparaissait (avec 2 autres POP) comme associé au risque
d’endométriose dans les 5 modèles utilisés. Le
trans-nonachlore était identifié par 4 modèles et
l’oxychlordane dans 3 des 5 modèles. Les modèles étaient les
suivants : régression logistique, réseaux de neurones, machines
à vecteurs de support, « adaptive boosting », et analyse
discriminante par moindres carrés partiels. Les résultats
obtenus sont cohérents avec l’analyse précédente. Dans les cas
d’expositions hautement corrélées, cet article montre comment
des techniques statistiques avancées pourraient être utiles pour
la modélisation des expositions aux polluants, et constituer une
approche complémentaire aux analyses statistiques
classiques. ). Dans cette population de 80 cas et 78 témoins de 18 à
45 ans, le p,p’-DDE et le HCB ont été dosés. Les patientes
étaient des femmes qui avaient eu une laparoscopie pour
endométriose ou autre motif gynécologique bénin, entre 2002 et
2005. Les pesticides étaient classés en terciles d’exposition.
La concentration de p,p’-DDE était supérieure chez les cas par
rapport aux témoins. Les résultats suggèrent une tendance à
l’augmentation de risque d’endométriose en fonction de
l’exposition au DDE après ajustement sur âge, tabagisme, IMC, et
changement de poids : OR = 1,54 ; IC 95 % [0,66-3,58] pour le
2e tercile et OR = 2,14 ; IC 95 % [0,93-4,93]
pour le 3e tercile de concentration par comparaison
au 1er tercile.
). Dans cette population de 80 cas et 78 témoins de 18 à
45 ans, le p,p’-DDE et le HCB ont été dosés. Les patientes
étaient des femmes qui avaient eu une laparoscopie pour
endométriose ou autre motif gynécologique bénin, entre 2002 et
2005. Les pesticides étaient classés en terciles d’exposition.
La concentration de p,p’-DDE était supérieure chez les cas par
rapport aux témoins. Les résultats suggèrent une tendance à
l’augmentation de risque d’endométriose en fonction de
l’exposition au DDE après ajustement sur âge, tabagisme, IMC, et
changement de poids : OR = 1,54 ; IC 95 % [0,66-3,58] pour le
2e tercile et OR = 2,14 ; IC 95 % [0,93-4,93]
pour le 3e tercile de concentration par comparaison
au 1er tercile. ) car elles ne présentaient pas de mesure d’association qui
permettait de calculer un méta-OR. Il était néanmoins important
d’évoquer ces études qui concluent toutes les trois à une
absence d’association.
) car elles ne présentaient pas de mesure d’association qui
permettait de calculer un méta-OR. Il était néanmoins important
d’évoquer ces études qui concluent toutes les trois à une
absence d’association. ). Dans cette étude cas-témoins
réalisée au Canada chez des femmes de 18 à 50 ans non
ménopausées se présentant dans des centres spécialisés en 1994,
les 86 cas et les 70 témoins avaient subi une laparoscopie pour
différentes indications (douleurs pelviennes, infertilité,
fulguration tubaire). Onze pesticides organo-chlorés avaient été
mesurés dans le sang. En raison des fortes corrélations entre
les pesticides, les analyses, considérant l’exposition de
différentes manières (en continu, quartiles ou terciles),
étaient réalisées en sommant les concentrations pour d’une part
α- et γ-chlordane, oxychlordane, cis- et
trans-nonachlore ; et d’autre part p,p’-DDT et
p,p’-dichlorodiphényldichloroéthane (p,p’-DDD). Les autres
pesticides étaient : l’aldrine, le β-HCH, l’HCB, et le mirex.
Les modèles ajustés sur l’âge, l’IMC, la parité, et l’indication
de la laparoscopie ne montraient pas d’association avec le
risque d’endométriose.
). Dans cette étude cas-témoins
réalisée au Canada chez des femmes de 18 à 50 ans non
ménopausées se présentant dans des centres spécialisés en 1994,
les 86 cas et les 70 témoins avaient subi une laparoscopie pour
différentes indications (douleurs pelviennes, infertilité,
fulguration tubaire). Onze pesticides organo-chlorés avaient été
mesurés dans le sang. En raison des fortes corrélations entre
les pesticides, les analyses, considérant l’exposition de
différentes manières (en continu, quartiles ou terciles),
étaient réalisées en sommant les concentrations pour d’une part
α- et γ-chlordane, oxychlordane, cis- et
trans-nonachlore ; et d’autre part p,p’-DDT et
p,p’-dichlorodiphényldichloroéthane (p,p’-DDD). Les autres
pesticides étaient : l’aldrine, le β-HCH, l’HCB, et le mirex.
Les modèles ajustés sur l’âge, l’IMC, la parité, et l’indication
de la laparoscopie ne montraient pas d’association avec le
risque d’endométriose. ). Les cas d’endométriose (n = 60) ont été confirmés par
visualisation et par biopsie au cours d’une laparoscopie de la
cavité péritonéale, des ovaires, de l’extérieur des trompes de
Fallope et de l’utérus. Les témoins étaient des femmes ayant
consulté la même clinique d’assistance à la procréation pour qui
l’absence d’endométriose était confirmée par laparoscopie
(n = 30), ou des femmes sans signe ou symptôme de la maladie
avec un partenaire stérile (n = 27) ou des problèmes d’ovulation
(n = 7). Le risque d’endométriose associé à l’exposition au DDE
a été analysé pour l’ensemble des participants et pour un
sous-échantillon de cas et de témoins avec confirmation
chirurgicale, en utilisant des modèles de régression logistique
avec des variables d’exposition continues ou dichotomisées à la
médiane. Dans cette population, l’exposition au DDE était un peu
plus élevée que chez les femmes du même âge en population
générale dans une cohorte historique
(NHANES)3
. Les variables de confusion considérées étaient
l’âge, le niveau d’éducation, le nombre de grossesses
précédentes, le revenu, le tabagisme, l’utilisation de tampons.
Les concentrations sériques (ajustées ou non sur les lipides
totaux) du DDE étaient comparables pour les cas et les témoins
et n’expliquaient donc pas le risque d’endométriose dans cette
étude.
). Les cas d’endométriose (n = 60) ont été confirmés par
visualisation et par biopsie au cours d’une laparoscopie de la
cavité péritonéale, des ovaires, de l’extérieur des trompes de
Fallope et de l’utérus. Les témoins étaient des femmes ayant
consulté la même clinique d’assistance à la procréation pour qui
l’absence d’endométriose était confirmée par laparoscopie
(n = 30), ou des femmes sans signe ou symptôme de la maladie
avec un partenaire stérile (n = 27) ou des problèmes d’ovulation
(n = 7). Le risque d’endométriose associé à l’exposition au DDE
a été analysé pour l’ensemble des participants et pour un
sous-échantillon de cas et de témoins avec confirmation
chirurgicale, en utilisant des modèles de régression logistique
avec des variables d’exposition continues ou dichotomisées à la
médiane. Dans cette population, l’exposition au DDE était un peu
plus élevée que chez les femmes du même âge en population
générale dans une cohorte historique
(NHANES)3
. Les variables de confusion considérées étaient
l’âge, le niveau d’éducation, le nombre de grossesses
précédentes, le revenu, le tabagisme, l’utilisation de tampons.
Les concentrations sériques (ajustées ou non sur les lipides
totaux) du DDE étaient comparables pour les cas et les témoins
et n’expliquaient donc pas le risque d’endométriose dans cette
étude. ). Les participantes de 20 à 45 ans
étaient 139 femmes japonaises consultant pour des problèmes
d’infertilité en 1999-2000 et examinées par laparoscopie et
diagnostiquées comme cas d’endométriose (stades II-IV selon la
classification de l’American Fertility Society, n = 58)
ou témoins (stades 0-I, n = 81). Les pesticides ou leurs
métabolites mesurés étaient les suivants : dieldrine, HCB, β- et
λ-HCH, heptachlor époxyde, oxychlordane,
trans-nonachlore, p,p’-DDE, o,p’-DDT, p,p’-DDT, et mirex.
Les pesticides organochlorés sont lipophiles et se concentrent
ou sont transportés par des lipides, dont ceux du sérum. Pour
prendre cela en compte, leurs concentrations ont été ajustées
sur les niveaux de lipides sériques totaux. Les OR étaient
ajustés sur la régularité du cycle (binaire) et la durée moyenne
des cycles (en jours). Les niveaux de concentrations ont été
normalisés par log transformation. Les concentrations sériques
de pesticides ne différaient pas significativement entre les cas
et les témoins. En l’absence de report des résultats chiffrés
pour les pesticides dans l’article, il n’a pas été possible
d’interpréter les résultats de cette étude. En outre, comme le
signalent Cooney et coll., l’interprétation est aussi rendue
difficile par l’absence de groupe indemne d’infertilité ou
d’endométriose et le possible sur-ajustement sur les
caractéristiques du cycle menstruel qui peuvent être la
manifestation de l’endométriose elle-même ou sur le chemin
causal (Cooney et coll., 2010
). Les participantes de 20 à 45 ans
étaient 139 femmes japonaises consultant pour des problèmes
d’infertilité en 1999-2000 et examinées par laparoscopie et
diagnostiquées comme cas d’endométriose (stades II-IV selon la
classification de l’American Fertility Society, n = 58)
ou témoins (stades 0-I, n = 81). Les pesticides ou leurs
métabolites mesurés étaient les suivants : dieldrine, HCB, β- et
λ-HCH, heptachlor époxyde, oxychlordane,
trans-nonachlore, p,p’-DDE, o,p’-DDT, p,p’-DDT, et mirex.
Les pesticides organochlorés sont lipophiles et se concentrent
ou sont transportés par des lipides, dont ceux du sérum. Pour
prendre cela en compte, leurs concentrations ont été ajustées
sur les niveaux de lipides sériques totaux. Les OR étaient
ajustés sur la régularité du cycle (binaire) et la durée moyenne
des cycles (en jours). Les niveaux de concentrations ont été
normalisés par log transformation. Les concentrations sériques
de pesticides ne différaient pas significativement entre les cas
et les témoins. En l’absence de report des résultats chiffrés
pour les pesticides dans l’article, il n’a pas été possible
d’interpréter les résultats de cette étude. En outre, comme le
signalent Cooney et coll., l’interprétation est aussi rendue
difficile par l’absence de groupe indemne d’infertilité ou
d’endométriose et le possible sur-ajustement sur les
caractéristiques du cycle menstruel qui peuvent être la
manifestation de l’endométriose elle-même ou sur le chemin
causal (Cooney et coll., 2010 ).
).Étude sur d’autres familles de pesticides
 ) a évalué dans les mêmes populations que l’article de Buck
Louis (Buck Louis et coll.,
2012
) a évalué dans les mêmes populations que l’article de Buck
Louis (Buck Louis et coll.,
2012 ), décrit ci-dessus, l’association entre risque d’endométriose
et les métabolites urinaires de pesticides organophosphorés,
d’insecticides pyréthrinoïdes, et d’herbicides phénoxys.
L’article concluait que des expositions élevées au diazinon
(composé parent du IMPy) ou au chlorpyrifos et
chlorpyrifos-méthyl (composés parents du
3,5,6-trichloro-2-pyridinol ; TCPγ) pourraient être associées au
risque d’endométriose. Onze substances actives ou leurs
métabolites appartenant à des familles autres que celle des
organochlorés, ont été dosées chez 619 femmes en âge de procréer
dans les États de l’Utah et de Californie. L’association a été
étudiée chez 594 femmes ayant eu une laparoscopie ou laparotomie
(cohorte « opérée », n = 471) ou une IRM pelvienne (cohorte en
population, n = 123), sur la période 2007-2009. Les deux
cohortes étaient appariées sur l’âge et le lieu de résidence.
Les critères d’inclusion étaient les suivants : pas d’antécédent
d’endométriose chirurgicalement visualisable, pas de traitement
hormonal par injection au cours des deux années précédentes, pas
d’allaitement au cours des 6 derniers mois, pas d’antécédent de
cancer. Chez les 471 femmes de la cohorte « opérée » ayant eu
une laparoscopie ou une laparotomie, 188 (40 %) ont eu un
diagnostic d’endométriose. Les cas étaient catégorisés en
4 groupes de gravité selon la classification de l’American
Society for Reproductive Medicine (ASRM,
1997
), décrit ci-dessus, l’association entre risque d’endométriose
et les métabolites urinaires de pesticides organophosphorés,
d’insecticides pyréthrinoïdes, et d’herbicides phénoxys.
L’article concluait que des expositions élevées au diazinon
(composé parent du IMPy) ou au chlorpyrifos et
chlorpyrifos-méthyl (composés parents du
3,5,6-trichloro-2-pyridinol ; TCPγ) pourraient être associées au
risque d’endométriose. Onze substances actives ou leurs
métabolites appartenant à des familles autres que celle des
organochlorés, ont été dosées chez 619 femmes en âge de procréer
dans les États de l’Utah et de Californie. L’association a été
étudiée chez 594 femmes ayant eu une laparoscopie ou laparotomie
(cohorte « opérée », n = 471) ou une IRM pelvienne (cohorte en
population, n = 123), sur la période 2007-2009. Les deux
cohortes étaient appariées sur l’âge et le lieu de résidence.
Les critères d’inclusion étaient les suivants : pas d’antécédent
d’endométriose chirurgicalement visualisable, pas de traitement
hormonal par injection au cours des deux années précédentes, pas
d’allaitement au cours des 6 derniers mois, pas d’antécédent de
cancer. Chez les 471 femmes de la cohorte « opérée » ayant eu
une laparoscopie ou une laparotomie, 188 (40 %) ont eu un
diagnostic d’endométriose. Les cas étaient catégorisés en
4 groupes de gravité selon la classification de l’American
Society for Reproductive Medicine (ASRM,
1997 ) : 106 en stade minimal et 27, 22 et 28 respectivement en
stades 2, 3 et 4. Les femmes de la cohorte en population avaient
une IRM pour l’évaluation de l’endométriose (meilleure
sensibilité pour les stades 3 et 4). Sur les 123 femmes de la
cohorte en population ayant eu une IRM pelvienne, 14 (11 %) ont
été diagnostiquées avec endométriose. Les composés dosés étaient
les suivants : 2-isopropyl-4-méthyl-6-hydroxypyrimidine (IMPy),
acide dicarboxylique de malathion (MDA), paranitrophénol (PNP),
TCPγ, acide 3-phénoxybenzoïque (3-PBA), acide
4-fluoro-3-phénoxybenzoïque (4F3-PBA), acide
2,4-dichlorophénoxyacétique (2,4-D), acide
2,4,5-trichlorophénoxyacétique (2,4,5-T), acide
trans/cis-3-(2,2-dichlorovinyl)-2,2-diméthylcyclopropane
carboxylique (trans/cis-DCCA) et acide
cis-3-(2,2-dibromovinyl)-2,2-diméthylcyclopropane
carboxylique (cis-DBCA). La substance détectée aux
concentrations les plus importantes était l’IMPy, suivi de PNP
et TCPγ. L’IMPy, MDA, PNP, TCPγ, 2,4-D et 3-PBA étaient les
principaux pesticides/métabolites retrouvés avec une fréquence
de détection de 95 à 100 %. Les métabolites d’insecticides
pyréthrinoïdes, dont le 4F3-PBA et le
trans/cis-DCCA (métabolites de cyfluthrine,
fluméthrine, cyperméthrine et perméthrine) et le cis-DBCA
(un métabolite spécifique de deltaméthrine) étaient détectés
dans 47 à 80 % des échantillons, alors que le niveau de
détection de 2,4,5-T était seulement de 0,8 %. Les analyses de
données étaient restreintes aux analytes avec une fréquence de
détection de > 80 % dans tous les échantillons. Il n’y avait pas
de différence significative dans la somme des concentrations de
ces six pesticides entre les femmes avec ou sans endométriose
dans les deux cohortes. Séparément, des concentrations plus
élevées de PNP et TCPγ étaient retrouvées chez les femmes avec
ou sans endométriose dans la cohorte « opérée » par rapport à
celle en population. De plus, les femmes témoins avaient des
concentrations plus élevées de 3-PBA mais plus faibles d’IMPy
(p < 0,05) dans la cohorte « opérée » que dans celle en
population.
) : 106 en stade minimal et 27, 22 et 28 respectivement en
stades 2, 3 et 4. Les femmes de la cohorte en population avaient
une IRM pour l’évaluation de l’endométriose (meilleure
sensibilité pour les stades 3 et 4). Sur les 123 femmes de la
cohorte en population ayant eu une IRM pelvienne, 14 (11 %) ont
été diagnostiquées avec endométriose. Les composés dosés étaient
les suivants : 2-isopropyl-4-méthyl-6-hydroxypyrimidine (IMPy),
acide dicarboxylique de malathion (MDA), paranitrophénol (PNP),
TCPγ, acide 3-phénoxybenzoïque (3-PBA), acide
4-fluoro-3-phénoxybenzoïque (4F3-PBA), acide
2,4-dichlorophénoxyacétique (2,4-D), acide
2,4,5-trichlorophénoxyacétique (2,4,5-T), acide
trans/cis-3-(2,2-dichlorovinyl)-2,2-diméthylcyclopropane
carboxylique (trans/cis-DCCA) et acide
cis-3-(2,2-dibromovinyl)-2,2-diméthylcyclopropane
carboxylique (cis-DBCA). La substance détectée aux
concentrations les plus importantes était l’IMPy, suivi de PNP
et TCPγ. L’IMPy, MDA, PNP, TCPγ, 2,4-D et 3-PBA étaient les
principaux pesticides/métabolites retrouvés avec une fréquence
de détection de 95 à 100 %. Les métabolites d’insecticides
pyréthrinoïdes, dont le 4F3-PBA et le
trans/cis-DCCA (métabolites de cyfluthrine,
fluméthrine, cyperméthrine et perméthrine) et le cis-DBCA
(un métabolite spécifique de deltaméthrine) étaient détectés
dans 47 à 80 % des échantillons, alors que le niveau de
détection de 2,4,5-T était seulement de 0,8 %. Les analyses de
données étaient restreintes aux analytes avec une fréquence de
détection de > 80 % dans tous les échantillons. Il n’y avait pas
de différence significative dans la somme des concentrations de
ces six pesticides entre les femmes avec ou sans endométriose
dans les deux cohortes. Séparément, des concentrations plus
élevées de PNP et TCPγ étaient retrouvées chez les femmes avec
ou sans endométriose dans la cohorte « opérée » par rapport à
celle en population. De plus, les femmes témoins avaient des
concentrations plus élevées de 3-PBA mais plus faibles d’IMPy
(p < 0,05) dans la cohorte « opérée » que dans celle en
population.Données mécanistiques
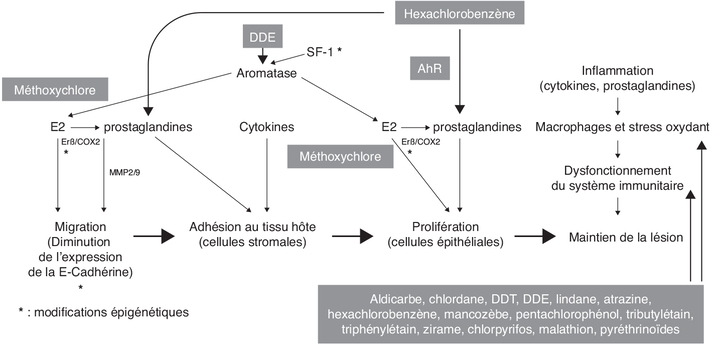
 ), et en particulier les organochlorés.
), et en particulier les organochlorés.Immunomodulation et inflammation
 ). Les principales cellules ciblées
seraient les cellules NK (atrazine, chlordane, organophosphorés,
PCP, tributylétain, zirame), certains lymphocytes T (aldicarbe,
organophosphorés, PCP) et les macrophages (voir ci-dessous).
). Les principales cellules ciblées
seraient les cellules NK (atrazine, chlordane, organophosphorés,
PCP, tributylétain, zirame), certains lymphocytes T (aldicarbe,
organophosphorés, PCP) et les macrophages (voir ci-dessous). ; Astiz et coll., 2009
; Astiz et coll., 2009 ; Lushchak et coll.,
2009
; Lushchak et coll.,
2009 ; Turkyilmaz et coll., 2016
; Turkyilmaz et coll., 2016 ) ; pour rappel, cette production
déséquilibrée d’ERO au niveau ovarien pourrait être responsable
de phénomènes d’infertilité observés fréquemment en cas
d’endométriose. Les espèces réactives de l’azote sont aussi
impliquées dans les mécanismes biologiques inhérents à
l’endométriose probablement via la stimulation de
l’angiogenèse (voie de signalisation du NO et stimulation du
VEGF) (Asghari et coll., 2018
) ; pour rappel, cette production
déséquilibrée d’ERO au niveau ovarien pourrait être responsable
de phénomènes d’infertilité observés fréquemment en cas
d’endométriose. Les espèces réactives de l’azote sont aussi
impliquées dans les mécanismes biologiques inhérents à
l’endométriose probablement via la stimulation de
l’angiogenèse (voie de signalisation du NO et stimulation du
VEGF) (Asghari et coll., 2018 ).
). ). Ce fait est illustré par une étude de Quaranta et coll. qui
ont montré qu’une exposition de cellules mononucléaires
périphériques sanguines normales au p,p’-DDE provoque une
diminution d’activité de cellules NK et de production d’IL-1β et
IL-12 (Quaranta et coll., 2006
). Ce fait est illustré par une étude de Quaranta et coll. qui
ont montré qu’une exposition de cellules mononucléaires
périphériques sanguines normales au p,p’-DDE provoque une
diminution d’activité de cellules NK et de production d’IL-1β et
IL-12 (Quaranta et coll., 2006 ). Dans cette étude utilisant une
double approche expérimentale et épidémiologique, les auteurs
ont aussi retrouvé une diminution de l’activité cytotoxique de
cellules NK du sang périphérique et une diminution de production
d’IL-1β et IL-12 en lien avec la concentration sérique de
p,p’-DDE chez des patientes atteintes d’endométriose par rapport
à un groupe contrôle. À noter que les faibles effectifs de cette
étude (10 cas confirmés par laparoscopie et biopsie
versus 8 témoins hospitalières ayant subi une
laparoscopie pour d’autres indications gynécologiques) rendent
les conclusions difficilement interprétables.
). Dans cette étude utilisant une
double approche expérimentale et épidémiologique, les auteurs
ont aussi retrouvé une diminution de l’activité cytotoxique de
cellules NK du sang périphérique et une diminution de production
d’IL-1β et IL-12 en lien avec la concentration sérique de
p,p’-DDE chez des patientes atteintes d’endométriose par rapport
à un groupe contrôle. À noter que les faibles effectifs de cette
étude (10 cas confirmés par laparoscopie et biopsie
versus 8 témoins hospitalières ayant subi une
laparoscopie pour d’autres indications gynécologiques) rendent
les conclusions difficilement interprétables. ; Chiappini et coll., 2019
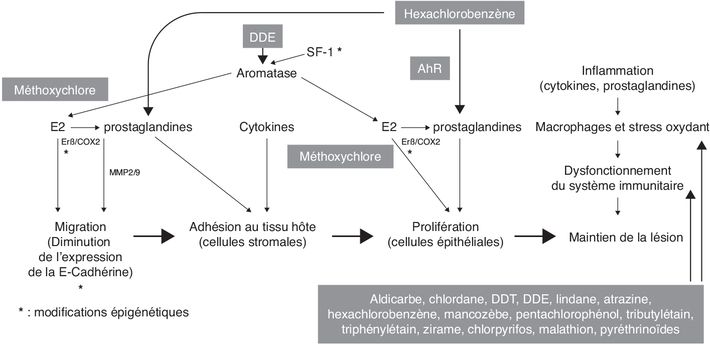
; Chiappini et coll., 2019 ). Ces auteurs montrent, à l’aide de
différents modèles cellulaires (lignée humaine stromale
endométriale, cultures primaires de fibroblastes humains
d’utérus ou de cellules stromales endométriales humaines) et
animal (endomètre de rat) que le HCB lie le récepteur AhR
(également le récepteur des dioxines suspectées d’exercer un
effet pro-invasif) dans le cytoplasme ce qui provoque la
libération et l’activation de la kinase c-Src normalement
associée au complexe cytoplasmique du AhR. Src active COX2 et la
production de PGE2 ce qui a pour conséquence une augmentation
d’activité des métallo-protéinases MMP2 et MMP9. Ces enzymes
dégradent la matrice extra-cellulaire et facilitent ainsi la
migration des cellules endométriales (Chiappini et coll.,
2016
). Ces auteurs montrent, à l’aide de
différents modèles cellulaires (lignée humaine stromale
endométriale, cultures primaires de fibroblastes humains
d’utérus ou de cellules stromales endométriales humaines) et
animal (endomètre de rat) que le HCB lie le récepteur AhR
(également le récepteur des dioxines suspectées d’exercer un
effet pro-invasif) dans le cytoplasme ce qui provoque la
libération et l’activation de la kinase c-Src normalement
associée au complexe cytoplasmique du AhR. Src active COX2 et la
production de PGE2 ce qui a pour conséquence une augmentation
d’activité des métallo-protéinases MMP2 et MMP9. Ces enzymes
dégradent la matrice extra-cellulaire et facilitent ainsi la
migration des cellules endométriales (Chiappini et coll.,
2016 ). Dans l’endomètre de rat, l’expression des MMP2 et 9 est
aussi augmentée (Chiappini et coll.,
2019
). Dans l’endomètre de rat, l’expression des MMP2 et 9 est
aussi augmentée (Chiappini et coll.,
2019 ) ; une exposition à l’HCB, à la dose de 10 mg/kg de poids
corporel par gavage (trois fois par semaine pendant 30 jours),
augmente l’expression de AhR, de COX2 (suggérant un renforcement
du mécanisme précité) et du VEGF, ce qui est cohérent avec les
lésions précitées comportant une plus forte densité de
vascularisation (stimulée par le VEGF).
) ; une exposition à l’HCB, à la dose de 10 mg/kg de poids
corporel par gavage (trois fois par semaine pendant 30 jours),
augmente l’expression de AhR, de COX2 (suggérant un renforcement
du mécanisme précité) et du VEGF, ce qui est cohérent avec les
lésions précitées comportant une plus forte densité de
vascularisation (stimulée par le VEGF).Perturbation endocrinienne
 ). L’implication du système œstrogénique est également
suggérée par une étude menée in vivo sur des rats (modèle
chirurgical d’endométriose par implantation d’une corne utérine
à proximité d’un vaisseau mésentéral) ; les rats après
ovariectomie au jour 21 sont exposés à du méthoxychlore, un
pesticide pro-œstrogénique. L’œstradiol (en tant que contrôle)
et le méthoxychlore favorisent tous deux le développement de
l’endométriose tandis que la progestérone provoque une
régression de celle-ci (Cummings et Metcalf,
1995
). L’implication du système œstrogénique est également
suggérée par une étude menée in vivo sur des rats (modèle
chirurgical d’endométriose par implantation d’une corne utérine
à proximité d’un vaisseau mésentéral) ; les rats après
ovariectomie au jour 21 sont exposés à du méthoxychlore, un
pesticide pro-œstrogénique. L’œstradiol (en tant que contrôle)
et le méthoxychlore favorisent tous deux le développement de
l’endométriose tandis que la progestérone provoque une
régression de celle-ci (Cummings et Metcalf,
1995 ). L’endométriose est par ailleurs associée à un état de
résistance à la progestérone qui, entre autres, diminue
l’expression de cytokines pro-inflammatoires (Patel et coll.,
2017
). L’endométriose est par ailleurs associée à un état de
résistance à la progestérone qui, entre autres, diminue
l’expression de cytokines pro-inflammatoires (Patel et coll.,
2017 ). Cette hypothèse est concordante avec la répression de
l’activité du récepteur de la progestérone par l’ERβ.
). Cette hypothèse est concordante avec la répression de
l’activité du récepteur de la progestérone par l’ERβ. ) ; ii) une autre étude suggère un blocage de
l’aromatase par le glyphosate (Richard et coll.,
2005
) ; ii) une autre étude suggère un blocage de
l’aromatase par le glyphosate (Richard et coll.,
2005 ).
). ). Or, cette enzyme est une cible des
organophosphorés (Medina-Díaz et coll.,
2017
). Or, cette enzyme est une cible des
organophosphorés (Medina-Díaz et coll.,
2017 ).
).Altérations épigénétiques potentielles
 ). En cas d’hypométhylation (Xue et coll.,
2007b
). En cas d’hypométhylation (Xue et coll.,
2007b ), SF1 activerait l’expression de l’aromatase, qui produirait
de l’œstradiol responsable de la stimulation du ERβ (lui-même
exprimé en plus grande quantité du fait de l’hypométhylation) ce
qui provoquerait une activation de la COX2 à l’origine d’une
production accrue de PG (par exemple PGE2) qui agiraient aussi
positivement sur l’activité de l’aromatase. Cette série
d’évènements (autoentretenus) aboutirait ainsi à une forte
production d’œstradiol à l’origine de la migration de cellules
endométriales (Bulun, 2009
), SF1 activerait l’expression de l’aromatase, qui produirait
de l’œstradiol responsable de la stimulation du ERβ (lui-même
exprimé en plus grande quantité du fait de l’hypométhylation) ce
qui provoquerait une activation de la COX2 à l’origine d’une
production accrue de PG (par exemple PGE2) qui agiraient aussi
positivement sur l’activité de l’aromatase. Cette série
d’évènements (autoentretenus) aboutirait ainsi à une forte
production d’œstradiol à l’origine de la migration de cellules
endométriales (Bulun, 2009 ). Une hypométhylation des promoteurs
de l’aromatase (Izawa et coll.,
2008
). Une hypométhylation des promoteurs
de l’aromatase (Izawa et coll.,
2008 ) et du ERβ (Xue et coll.,
2007a
) et du ERβ (Xue et coll.,
2007a ) peut être aussi observée dans les cellules stromales
endométriales.
) peut être aussi observée dans les cellules stromales
endométriales. ). De même, la diminution de
l’expression de l’E-cadhérine, protéine transmembranaire
contribuant à l’adhésion entre cellules épithéliales, a été
démontrée dans une étude au sein de cellules endométriales du
fait d’un traitement par la trichostatine A, un inhibiteur de
l’histone déacétylase (Wu et coll.,
2007
). De même, la diminution de
l’expression de l’E-cadhérine, protéine transmembranaire
contribuant à l’adhésion entre cellules épithéliales, a été
démontrée dans une étude au sein de cellules endométriales du
fait d’un traitement par la trichostatine A, un inhibiteur de
l’histone déacétylase (Wu et coll.,
2007 ; Ballester et coll., 2012a
; Ballester et coll., 2012a ). Ce phénomène semble également
associé à une hyperméthylation de son promoteur. Il fait écho
aux études montrant que les dioxines (qui peuvent aussi
favoriser un stress oxydant) via le AhR, diminuent
l’expression de l’E-cadhérine par augmentation de l’expression
de facteurs transcriptionnels répresseurs comme Snail et Slug
qui se lient dans le promoteur de ce gène (Bui et coll.,
2009
). Ce phénomène semble également
associé à une hyperméthylation de son promoteur. Il fait écho
aux études montrant que les dioxines (qui peuvent aussi
favoriser un stress oxydant) via le AhR, diminuent
l’expression de l’E-cadhérine par augmentation de l’expression
de facteurs transcriptionnels répresseurs comme Snail et Slug
qui se lient dans le promoteur de ce gène (Bui et coll.,
2009 ; Pierre et coll., 2014
; Pierre et coll., 2014 ; Duval et coll.,
2017
; Duval et coll.,
2017 ).
).Conclusion
 ). La technique repose sur le fait que,
pour les cas d’endométriose exprimant le récepteur aux œstrogènes,
l’administration d’un analogue d’œstrogène marqué (le
16α-[18F]fluoro-17β-œstradiol) permet l’imagerie des
lésions endométriales par la tomographie par émission de
positrons.
). La technique repose sur le fait que,
pour les cas d’endométriose exprimant le récepteur aux œstrogènes,
l’administration d’un analogue d’œstrogène marqué (le
16α-[18F]fluoro-17β-œstradiol) permet l’imagerie des
lésions endométriales par la tomographie par émission de
positrons.Tableau 18.I Études sur le lien entre exposition aux pesticides et l’endométriose
|
Référence
Pays |
Type d’étude
|
Population étudiée
|
Définition de la maladie
|
Mesure de l’exposition
|
Facteurs d’ajustement
|
Résultats
Commentaires |
|---|---|---|---|---|---|---|
|
Design complexe (cohortes
appariées)
Étude ENDO(Endometriosis : Natural History, Diagnosis and Outcomes) |
Patientes de 18 à 44 ans opérées pour
une laparoscopie ou une laparotomie (n = 473), et
femmes en population (n = 127)
Recrutement en 2007-2009 Appariées sur l’âge et le lieu de résidence |
Cohorte « opérée » : visualisation
chirurgicale (méthode de référence), typée par
examen histologique
Cohorte « population » : visualisation IRM (principalement endométriomes ovariens) Classification selon le stade de sévérité par un algorithme |
Dosage de 11 pesticides OC dans les
échantillons de tissu adipeux (cohorte « opérée »)
et de sérum (cohorte « population » et
« opérée »
|
Âge, antécédent d’allaitement et
parité, IMC, tabagisme (cotinine), lipides (dans
les modèles sur sérums)
|
γ-HCH (cohorte « opérée », tissu
adipeux) : OR = 1,27 [1,01-1,59]
β-HCH (cohorte « population », sérum) : OR = 1,72 [1,09-2,72] |
|
|
Idem
|
Patientes de 18 à 44 ans opérées pour
une laparoscopie ou une laparotomie (n = 471), et
femmes en population (n = 123), recrutement en
2007-2009
Appariées sur l’âge et le lieu de résidence |
Idem
|
Dosage de 11 pesticides et métabolites
OP, pyréthrinoïdes, herbicides phénoxys dans les
échantillons urinaires
|
Lieu d’inclusion, âge, ethnie, parité,
revenu du foyer, tabagisme et consommation
d’alcool, créatinine urinaire
|
IMPy (métabolite du diazinon) dans la
cohorte « opérée » : tendance linéaire
(p < 0,001) ; OR = 1,72 [0,98-3,00] dans le
4equartile
TCPY (métabolite du chlorpyrifos) : OR = 1,52 [0,92-2,51] dans le 2equartile (2 cohortes réunies) |
|
|
Cas-témoins hospitalières
(~transversale)
|
Patientes de 18 à 40 ans opérées pour
une laparoscopie (n = 84) en 1999-2000,
32 cas
|
Inspection de tout le bassin au moment
de l’acte chirurgical
Classification selon le stade de sévérité par un algorithme |
Dosage sérique de 6 pesticides
OC
|
Lipides totaux du sérum (mg/dl sérum)
et tabagisme actuel (oui/non)
|
Tercile d’exposition le plus élevé
versus le plus faible :
Fongicides aromatiques : OR ajusté = 5,3 [1,2-23,6] HCB : OR ajusté = 6,4 [1,0-42,8] |
|
|
Cas-témoins hospitalières
|
Femmes entre 18 et 45 ans, recrutées
entre 2013 et 2015
Exclusion : antécédents ou suspicion de cancer, maladies auto-immunes, conditions chroniques Témoins (n = 44) consultant pour d’autres motifs gynécologiques mineurs, appariées sur âge, IMC Cas : endométriose profonde de stades III ou IV (n = 55), dont 26 avec endométriose ovarienne |
Diagnostic chirurgical avec
confirmation anatomopathologique
|
Taux de 76 POP (dont dioxines, PCB,
PBDE, PBB, HBCD, et pesticides OC) dans le tissu
adipeux
|
Âge, IMC
|
Endométriose profonde versus
témoins (OR ajustés) :
HCB : OR = 2,06 [1,20-3,91]* β-HCH : OR = 1,58 [0,94-2,80] trans-nonachlore : OR = 2,21 [1,24-4,28]* Oxychlordane : OR = 3,22 [1,60-7,70]** Heptachlor : OR = 5,36 [2,44-14,84]*** Dieldrine : OR = 2,71 [1,57-5,11]*** |
|
|
Cas-témoins en population
générale
Étude WREN (Women’s Risk of Endometriosis) |
Femmes entre 18 et 49 ans, dont le
1erdiagnostic des cas était entre 1996
et 2001
Appariement des témoins sur l’âge (classes de 5 ans) Cas (n = 248) et témoins (n = 538) |
Cas confirmés chirurgicalement,
éventuellement par histologie
|
Collecte de sang au moment du
questionnaire, 11 pesticides OC ou
métabolites
|
Âge, année de la date de référence,
lipides sériques, éducation, ethnicité, tabagisme,
et consommation d’alcool
|
β-HCH : OR = 1,7 [1,0-2,8] et 1,3
[0,8-2,4] dans les 3e et 4e
quartiles, relation plus forte avec l’endométriose
ovarienne
Mirex : OR = 1,5 [1,0-2,2] chez les plus exposées |
|
|
Cas-témoins hospitalières
(~transversale)
|
Patientes de 18-45 ans opérées pour
laparoscopie entre 2002 et 2005
Cas (n = 80) et témoins (n = 78, avec conditions gynécologiques bénignes) |
Confirmation par histologie
Forme ovarienne (90 %), forme profonde (7,5 %), stades III ou IV (84 %), lésions péritonéales (56 %) |
Plusieurs POP dans le sérum, dont le
p,p’-DDE et le HCB
|
Âge, tabagisme, IMC, modification de
poids (> 10 kg dans les 5 années
précédentes)
|
Pas d’association avec
HCB
p,p’-DDE : concentration supérieure chez les cas, OR élevé mais non significatif après ajustement : OR ajusté = 1,54 [0,66-3,58] et 2,14 [0,93-4,93] pour les 2e et 3eterciles d’exposition |
|
|
Cas-témoins hospitalières
|
Femmes préménopausées de 18-50 ans
ayant eu une laparoscopie en 1994
Cas (n = 86) et témoins (n = 70) appariées sur l’indication de laparoscopie |
Laparoscopie,
Classification des cas≠ : minime (58 %), légère (31 %), modérée (8 %), ou sévère (2 %) |
11 pesticides OC à partir
d’échantillons de sang
|
Âge, IMC, nombre d’enfants, indication
de la laparoscopie
|
Pas d’association mise en
évidence
|
|
|
Cas-témoins hospitalières
(~transversale)
|
Patientes d’une clinique d’assistance à
la procréation en 1998-1999
Cas (n = 60) et témoins sans endométriose confirmée ou non par chirurgie (respectivement n = 30 et n = 34) |
Laparoscopie, dont biopsie et
visualisation
|
Plusieurs POP dont p,p’- DDE (seul
métabolite de pesticide)
|
Aucun pour le p,p’-DDE
|
p,p’-DDE (concentration médiane) :
189 000 pg/g de lipides pour les cas et 145 000
pg/g de lipides pour les témoins (différence non
significative, p = 0,15)
|
|
|
Cas-témoins hospitalières
(~ transversale)
|
Femmes infertiles de 20-45 ans ayant eu
une laparoscopie en 1999-2000
Cas (n = 58, stades II-IV) et témoins (n = 81, stades 0-I) |
Laparoscopie
Stade 0 (n = 59), stade I (n = 22), stade II (n = 10), stade III (n = 23) et stade IV (n = 25) |
71 composés OC incluant 13 pesticides
ou métabolites mesurés dans le sérum (11, car
aldrine et endrine non mesurables)
|
Lipides, régularité du cycle menstruel
(oui/non), durée moyenne des cycles
(jours)
|
Pas d’association mise en
évidence
|
DDE : dichlorodiphényldichloroéthylène ; HCB :
hexachlorobenzène ; HCH : hexachlorocyclohexane ; IMC : indice
de masse corporelle ; OC : organochloré ; OP : organophosphoré ;
PBB : polybromobiphényles ; PBDE : polybromodiphényléthers ;
PCB : polychlorobiphényles ; POP : polluants organiques
persistants ; Les intervalles de confiance donnés entre
parenthèses sont les intervalles de 95 % ; * p < 0,05 ;
** p < 0,01 ; *** p < 0,001
≠ Selon les
critères de l’American Fertility Society,
1985
Références















































































→ Aller vers SYNTHESE