Pesticides et effets sur la santé
IV. Focus sur des substances actives
2021
| ANALYSE |
20-
Fongicides inhibiteurs
de la succinate déshydrogénase
Préambule
 ).
).Introduction
 ).
). ). La
contamination par les moisissures des cultures, des fruits et des
légumes est un enjeu de santé publique (Lee et Ryu,
2017
). La
contamination par les moisissures des cultures, des fruits et des
légumes est un enjeu de santé publique (Lee et Ryu,
2017 ),
particulièrement dans un contexte de réchauffement climatique de
nature à favoriser leur développement (Battilani et coll.,
2016
),
particulièrement dans un contexte de réchauffement climatique de
nature à favoriser leur développement (Battilani et coll.,
2016 ).
L’usage des fongicides est croissant et tend à s’élargir, d’autant
que l’on découvre que certains possèdent, en plus de leurs
propriétés antifongiques, des propriétés insecticides et
antiparasitaires (Sakai et coll.,
2012
).
L’usage des fongicides est croissant et tend à s’élargir, d’autant
que l’on découvre que certains possèdent, en plus de leurs
propriétés antifongiques, des propriétés insecticides et
antiparasitaires (Sakai et coll.,
2012 ;
Inaoka et coll., 2015
;
Inaoka et coll., 2015 ; Ren et coll.,
2018
; Ren et coll.,
2018 ).
L’usage important des fongicides a conduit au développement de
champignons résistants, nécessitant une utilisation encore accrue,
la production de nouvelles molécules ou l’association de plusieurs
fongicides pour le traitement des cultures et produits de
l’agriculture (Lucas et coll., 2015
).
L’usage important des fongicides a conduit au développement de
champignons résistants, nécessitant une utilisation encore accrue,
la production de nouvelles molécules ou l’association de plusieurs
fongicides pour le traitement des cultures et produits de
l’agriculture (Lucas et coll., 2015 ).
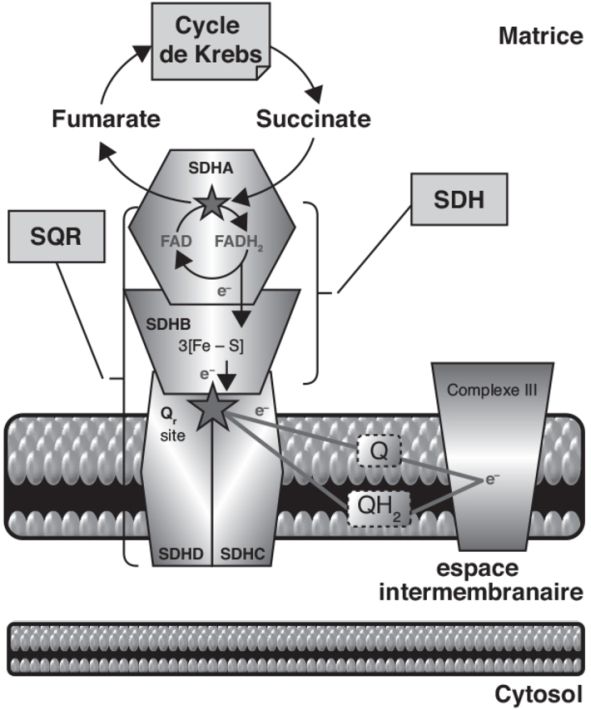
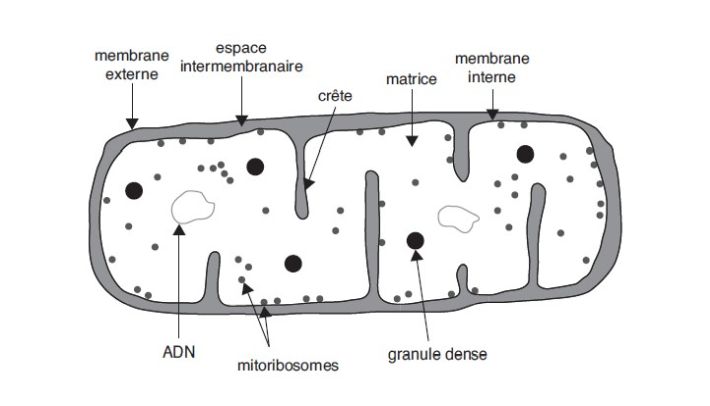
).La succinate déshydrogénase : enzyme clé de la chaîne respiratoire
Complexe II de la chaîne respiratoire
 ). La SQR mitochondriale (complexe II) appartient à la
classe C avec un groupe hème et deux sous-unités
transmembranaires. Le complexe II, localisé dans la membrane
interne de la mitochondrie, participe à deux processus
métaboliques interconnectés assurant la production d’énergie :
la respiration cellulaire où elle permet le transfert
d’électrons vers l’ubiquinone ou coenzyme Q, et le cycle de
Krebs où elle catalyse l’oxydation du succinate en fumarate. Le
complexe II est composé de quatre sous-unités protéiques SDHA,
B, C, D et de quatre cofacteurs d’assemblage SDHAF1, SDHAF2,
SDHAF3 et SDHAF4 tous exclusivement codés par le génome
nucléaire (Ackrell, 2000
). La SQR mitochondriale (complexe II) appartient à la
classe C avec un groupe hème et deux sous-unités
transmembranaires. Le complexe II, localisé dans la membrane
interne de la mitochondrie, participe à deux processus
métaboliques interconnectés assurant la production d’énergie :
la respiration cellulaire où elle permet le transfert
d’électrons vers l’ubiquinone ou coenzyme Q, et le cycle de
Krebs où elle catalyse l’oxydation du succinate en fumarate. Le
complexe II est composé de quatre sous-unités protéiques SDHA,
B, C, D et de quatre cofacteurs d’assemblage SDHAF1, SDHAF2,
SDHAF3 et SDHAF4 tous exclusivement codés par le génome
nucléaire (Ackrell, 2000 ; Moosavi et coll.,
2019
; Moosavi et coll.,
2019 ). Les facteurs d’assemblage SDHAF2 et SDHAF4 facilitent la
maturation de la sous-unité SDHA, alors que les facteurs SDHAF1
et SDHAF3 participent à la réaction d’insertion du centre
fer-soufre dans la sous-unité SDHB. Les sous-unités SDHA et B
sont localisées dans le compartiment matriciel de la
mitochondrie (figure 20.1
). Les facteurs d’assemblage SDHAF2 et SDHAF4 facilitent la
maturation de la sous-unité SDHA, alors que les facteurs SDHAF1
et SDHAF3 participent à la réaction d’insertion du centre
fer-soufre dans la sous-unité SDHB. Les sous-unités SDHA et B
sont localisées dans le compartiment matriciel de la
mitochondrie (figure 20.1 ).
La SDHA humaine est une flavoprotéine de 72 kDa (664 acides
aminés ; aa) comportant un groupe prosthétique flavine adénine
dinucléotide (FAD) fixé par liaison covalente. La SDHB est une
protéine fer-soufre de 32 kDa (280 aa) qui comporte trois
centres fer-soufre ([2Fe-2S]2+/1+,
[4Fe-4S]2+/1+ et [3Fe-4S]2+/0). Les
sous-unités SDHC et SDHD sont des protéines de respectivement
19 kDa (169 aa) et 17 kDa (159 aa), qui possèdent un groupement
hème enchâssé entre leurs hélices transmembranaires. Intégrées à
la membrane interne mitochondriale, elles ancrent les
sous-unités A et B dans la membrane, conférant à la SDH une
structure tétramérique. Concernant les aspects mécanistiques du
fonctionnement de la SQR mitochondriale (complexe II), le
succinate est oxydé en fumarate par la SDHA, ce qui s’accompagne
de la réduction du FAD en FADH2. Puis le
FADH2 transfère les électrons aux centres
fer-soufre de la SDHB et le coenzyme Q est à son tour réduit.
Les inhibiteurs spécifiques d’activité du complexe II se lient
au site de liaison soit du succinate (SDHA), soit de
l’ubiquinone (dénommé Q-site). Les composés agissant comme
inhibiteurs compétitifs en se liant au Q-site ont été utilisés
pour des études structurales du complexe II tels que le
thénoyltrifluoroacétone (TTFA), et l’atpenin (Miyadera et coll.,
2003
).
La SDHA humaine est une flavoprotéine de 72 kDa (664 acides
aminés ; aa) comportant un groupe prosthétique flavine adénine
dinucléotide (FAD) fixé par liaison covalente. La SDHB est une
protéine fer-soufre de 32 kDa (280 aa) qui comporte trois
centres fer-soufre ([2Fe-2S]2+/1+,
[4Fe-4S]2+/1+ et [3Fe-4S]2+/0). Les
sous-unités SDHC et SDHD sont des protéines de respectivement
19 kDa (169 aa) et 17 kDa (159 aa), qui possèdent un groupement
hème enchâssé entre leurs hélices transmembranaires. Intégrées à
la membrane interne mitochondriale, elles ancrent les
sous-unités A et B dans la membrane, conférant à la SDH une
structure tétramérique. Concernant les aspects mécanistiques du
fonctionnement de la SQR mitochondriale (complexe II), le
succinate est oxydé en fumarate par la SDHA, ce qui s’accompagne
de la réduction du FAD en FADH2. Puis le
FADH2 transfère les électrons aux centres
fer-soufre de la SDHB et le coenzyme Q est à son tour réduit.
Les inhibiteurs spécifiques d’activité du complexe II se lient
au site de liaison soit du succinate (SDHA), soit de
l’ubiquinone (dénommé Q-site). Les composés agissant comme
inhibiteurs compétitifs en se liant au Q-site ont été utilisés
pour des études structurales du complexe II tels que le
thénoyltrifluoroacétone (TTFA), et l’atpenin (Miyadera et coll.,
2003 ; Sun et coll., 2005
; Sun et coll., 2005 ), groupe dans lequel se trouvent les
fongicides inhibiteurs de la succinate déshydrogénase.
), groupe dans lequel se trouvent les
fongicides inhibiteurs de la succinate déshydrogénase. ).
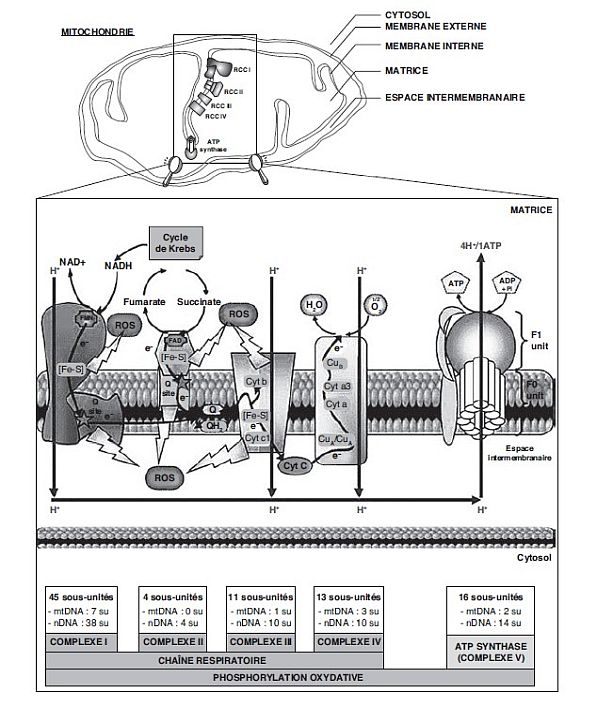
).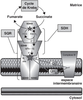 | Figure 20.1 Schéma récapitulant la structure et le
fonctionnement de la succinate-ubiquinone oxydoréductase
(SQR) mitochondriale (complexe II) (d’après Lemarie et
Grimm, 2011 ) ) |
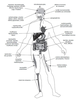
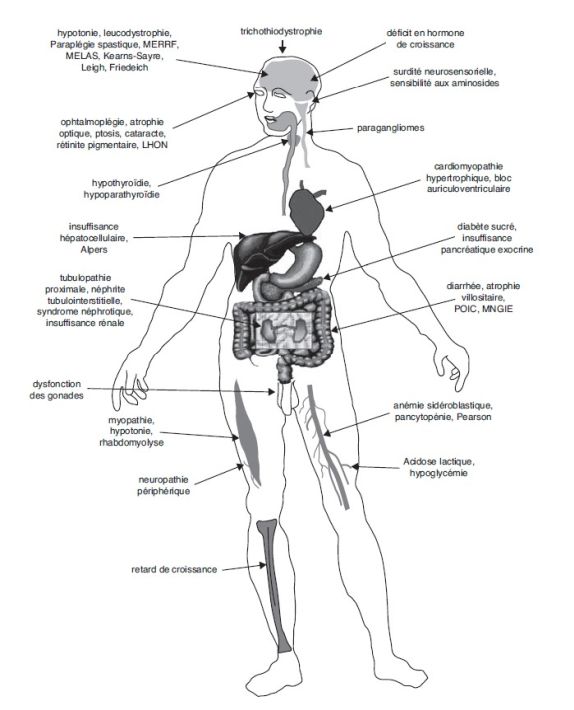
Pathologies liées à des mutations dans des gènes codant pour la succinate déshydrogénase
 ), de leucodystrophies (Alston et
coll., 2012
), de leucodystrophies (Alston et
coll., 2012 ), d’encéphalopathies (Ma et coll.,
2014
), d’encéphalopathies (Ma et coll.,
2014 ), ainsi que des cancers (Baysal et coll.,
2000
), ainsi que des cancers (Baysal et coll.,
2000 ; Habano et coll., 2003
; Habano et coll., 2003 ; Neumann et coll.,
2004
; Neumann et coll.,
2004 ; Malinoc et coll., 2012
; Malinoc et coll., 2012 ; Dwight et coll.,
2013b
; Dwight et coll.,
2013b ; Dwight et coll., 2013a
; Dwight et coll., 2013a ; Killian et coll.,
2013
; Killian et coll.,
2013 ; Letouzé et coll., 2013
; Letouzé et coll., 2013 ; Ni et coll.,
2015
; Ni et coll.,
2015 ; Bausch et coll., 2017
; Bausch et coll., 2017 ; Calió et coll.,
2017
; Calió et coll.,
2017 ; Lussey-Lepoutre et coll.,
2017
; Lussey-Lepoutre et coll.,
2017 ) (tableau 20.I
) (tableau 20.I ).
).
Tableau 20.I Maladies associées aux mutations dans les gènes
codant les sous-unités de la SDH (d’après Bénit et coll.,
2018 )
)
|
Gène
|
Phénotype tumoral
|
Maladies non cancéreuses
|
|---|---|---|
|
SDHA
|
Adénome hypophysaire,
Paragangliome/Phéochromocytome,
Carcinome rénal |
Syndrome de Leigh,
Atrophie optique, Ataxie, Cardiomyopathie, Encéphalopathie |
|
SDHB
|
Paragangliome/Phéochromocytome,
Carcinome rénal, Tumeur gastro-intestinale, Syndrome de Carney-Stratakis, Syndrome de Cowden |
Leucodystrophie
|
|
SDHC
|
Cancer du rein à cellules
claires,
Paragangliome/Phéochromocytome, Syndrome de Carney-Stratakis | |
|
SDHD
|
Paragangliome/Phéochromocytome,
Syndrome de Carney-Stratakis, Cancer du rein, Syndrome de Cowden |
Encéphalomyopathie
|
 ; Burnichon et coll., 2010
; Burnichon et coll., 2010 ). Ces deux évènements génétiques sont
responsables d’une perte de l’activité SDH, conduisant à une
accumulation massive de succinate (Pollard et coll.,
2005
). Ces deux évènements génétiques sont
responsables d’une perte de l’activité SDH, conduisant à une
accumulation massive de succinate (Pollard et coll.,
2005 ).
). ; Alston et coll., 2012
; Alston et coll., 2012 ; Ohlenbusch et coll.,
2012
; Ohlenbusch et coll.,
2012 ) et des cardiomyopathies (Levitas et coll.,
2010
) et des cardiomyopathies (Levitas et coll.,
2010 ), les mutations des gènes SDHx (SDHA,
SDHB, SDHC, ou SDHD) ont été
identifiées dans des formes familiales de phéochromocytomes
(PCC) et paragangliomes (PGL) au début des années 2000 (Baysal
et coll., 2000
), les mutations des gènes SDHx (SDHA,
SDHB, SDHC, ou SDHD) ont été
identifiées dans des formes familiales de phéochromocytomes
(PCC) et paragangliomes (PGL) au début des années 2000 (Baysal
et coll., 2000 ; Neumann et coll.,
2004
; Neumann et coll.,
2004 ). Les PCC et PGL sont des tumeurs rares, dérivées des
cellules chromaffines, qui se développent dans les glandes
médullo-surrénales et dans les ganglions des systèmes nerveux
parasympathique et sympathique au niveau de la tête, du cou et
du pelvis (Gimenez-Roqueplo,
2006
). Les PCC et PGL sont des tumeurs rares, dérivées des
cellules chromaffines, qui se développent dans les glandes
médullo-surrénales et dans les ganglions des systèmes nerveux
parasympathique et sympathique au niveau de la tête, du cou et
du pelvis (Gimenez-Roqueplo,
2006 ). Comparés aux autres cancers, les PCC et les PGL sont
caractérisés par un déterminisme génétique très particulier. À
ce jour, plus de 15 gènes de susceptibilité ont été identifiés
incluant 2 oncogènes (RET et HIF2A) et des gènes
suppresseurs de tumeur (NF1, VHL, SDHA,
SDHB, SDHC, SDHD, SDHAF2,
FH, TMEM127, MAX, MDH2,
SLC25A11, GOT2, DNMT3A). Plus de 40 %
des patients porteurs d’un PGL ou un PCC possèdent une mutation
germinale sur l’un de ces gènes (Dahia,
2014
). Comparés aux autres cancers, les PCC et les PGL sont
caractérisés par un déterminisme génétique très particulier. À
ce jour, plus de 15 gènes de susceptibilité ont été identifiés
incluant 2 oncogènes (RET et HIF2A) et des gènes
suppresseurs de tumeur (NF1, VHL, SDHA,
SDHB, SDHC, SDHD, SDHAF2,
FH, TMEM127, MAX, MDH2,
SLC25A11, GOT2, DNMT3A). Plus de 40 %
des patients porteurs d’un PGL ou un PCC possèdent une mutation
germinale sur l’un de ces gènes (Dahia,
2014 ). De plus, les mutations constitutionnelles affectant les
gènes codant la SDHB ou la fumarate hydratase sont associées à
un risque augmenté de métastases (Gimenez-Roqueplo et coll.,
2003
). De plus, les mutations constitutionnelles affectant les
gènes codant la SDHB ou la fumarate hydratase sont associées à
un risque augmenté de métastases (Gimenez-Roqueplo et coll.,
2003 ; Amar et coll., 2007
; Amar et coll., 2007 ; Castro-Vega et coll.,
2014
; Castro-Vega et coll.,
2014 ). Les gènes codant les sous-unités SDHB, SDHC et SDHD sont
les gènes majeurs de susceptibilité des PGL et PCC. Sur une
cohorte de 1 832 patients référencés avec un dépistage génétique
en raison d’une histoire familiale de PGL ou PCC, 876 d’entre
eux présentaient une mutation dans les gènes SDHB,
SDHC et SDHD pour 673, 43 et 160 cas,
respectivement (Andrews et coll.,
2018
). Les gènes codant les sous-unités SDHB, SDHC et SDHD sont
les gènes majeurs de susceptibilité des PGL et PCC. Sur une
cohorte de 1 832 patients référencés avec un dépistage génétique
en raison d’une histoire familiale de PGL ou PCC, 876 d’entre
eux présentaient une mutation dans les gènes SDHB,
SDHC et SDHD pour 673, 43 et 160 cas,
respectivement (Andrews et coll.,
2018 ). Parmi les 876 mutations, il est observé une minorité de
délétions ou de duplications et une majorité de mutations
ponctuelles intragéniques dont 44 % de faux-sens. Il est à noter
que la pénétrance des mutations dans le gène SDHB est
incomplète. Par ailleurs, des mutations « perte de fonction »
dans les gènes codant NF1 ou VHL, ainsi que des mutations
activant les oncogènes RET, HIF2A ou HRAS ont été décrites au
niveau somatique dans environ 30 % de ces tumeurs (Burnichon et
coll., 2012
). Parmi les 876 mutations, il est observé une minorité de
délétions ou de duplications et une majorité de mutations
ponctuelles intragéniques dont 44 % de faux-sens. Il est à noter
que la pénétrance des mutations dans le gène SDHB est
incomplète. Par ailleurs, des mutations « perte de fonction »
dans les gènes codant NF1 ou VHL, ainsi que des mutations
activant les oncogènes RET, HIF2A ou HRAS ont été décrites au
niveau somatique dans environ 30 % de ces tumeurs (Burnichon et
coll., 2012 ; Favier et coll.,
2012
; Favier et coll.,
2012 ; Crona et coll., 2013
; Crona et coll., 2013 ; Oudijk et coll.,
2014
; Oudijk et coll.,
2014 ).
). ), des tumeurs rénales, des tumeurs thyroïdiennes, des
mélanomes, des sarcomes, des tumeurs coliques, des
neuroblastomes (Dubard Gault et coll.,
2018
), des tumeurs rénales, des tumeurs thyroïdiennes, des
mélanomes, des sarcomes, des tumeurs coliques, des
neuroblastomes (Dubard Gault et coll.,
2018 ; Gill, 2018
; Gill, 2018 ), des tumeurs neuroendocrines
pancréatiques, des ganglioneuromes et des triades de Carney
(Bezawork-Geleta et coll., 2017
), des tumeurs neuroendocrines
pancréatiques, des ganglioneuromes et des triades de Carney
(Bezawork-Geleta et coll., 2017 ).
). ; Casey et coll.,
2019
; Casey et coll.,
2019 ). La diminution du niveau d’ARNm peut également être liée à
l’augmentation d’expression de microARN (miARN) ciblant les ARNm
codant les différentes sous-unités de la SDH, notamment miR-210
(SDHD), miR-31 (SDHA) et miR-378 (SDHB) (Eichner et coll.,
2010
). La diminution du niveau d’ARNm peut également être liée à
l’augmentation d’expression de microARN (miARN) ciblant les ARNm
codant les différentes sous-unités de la SDH, notamment miR-210
(SDHD), miR-31 (SDHA) et miR-378 (SDHB) (Eichner et coll.,
2010 ; Puisségur et coll., 2011
; Puisségur et coll., 2011 ; Kelly et coll.,
2013
; Kelly et coll.,
2013 ; Tsang et coll., 2014
; Tsang et coll., 2014 ; Lee et coll.,
2016
; Lee et coll.,
2016 ; Merlo et coll., 2017
; Merlo et coll., 2017 ).
). ; Lepoutre-Lussey et coll.,
2016
; Lepoutre-Lussey et coll.,
2016 ) ou les rats (Siebers et coll.,
2018
) ou les rats (Siebers et coll.,
2018 ; Powers et coll., 2020
; Powers et coll., 2020 ). À ce jour, les résultats de ces
études montrent que les animaux porteurs d’une mutation
hétérozygote ne présentent aucune prédisposition au cancer
comparable à celle décrite chez l’être humain.
). À ce jour, les résultats de ces
études montrent que les animaux porteurs d’une mutation
hétérozygote ne présentent aucune prédisposition au cancer
comparable à celle décrite chez l’être humain.Les fongicides inhibiteurs de la succinate déshydrogénase (SDHi)
 .
.Utilisation des SDHi en France
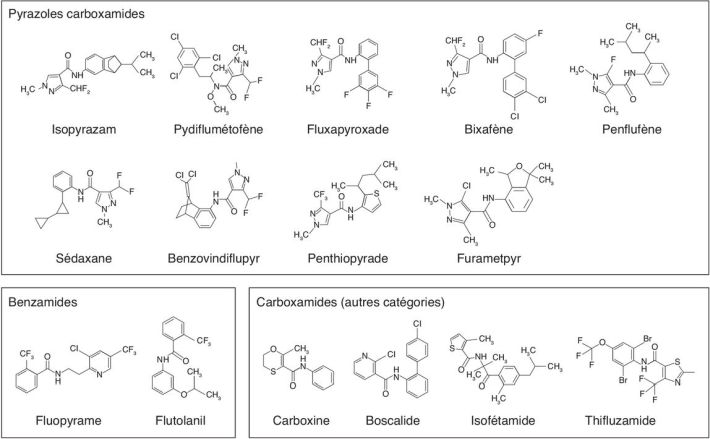
 ). Parmi elles, 12 sont autorisées en France en octobre 2020
avec des utilisations en traitement des parties aériennes, des
semences, des sols ou des plants/tubercules
(tableau 20.II
). Parmi elles, 12 sont autorisées en France en octobre 2020
avec des utilisations en traitement des parties aériennes, des
semences, des sols ou des plants/tubercules
(tableau 20.II ). À
noter que deux substances actives, la carboxine et le
penflufène, sont autorisées sans que des spécialités
commerciales les contenant ne soient autorisés en France ; au
total, 42 formulations commerciales contenant de la carboxine et
précédemment autorisées en France (premiers usages à la fin des
années 1960) ont été retirées en 20184
. Les produits correspondants ne sont plus
distribués depuis mi-2019 et ne doivent plus être utilisés
depuis fin janvier 2020. L’autorisation de quatre substances
actives SDHi, le bénodanil, le fenfurame, le mépronil et
l’oxycarboxine, a été retirée par le règlement (CE)
no 2076/2002 de la Commission du 20 novembre
20025
(tableau 20.III
). À
noter que deux substances actives, la carboxine et le
penflufène, sont autorisées sans que des spécialités
commerciales les contenant ne soient autorisés en France ; au
total, 42 formulations commerciales contenant de la carboxine et
précédemment autorisées en France (premiers usages à la fin des
années 1960) ont été retirées en 20184
. Les produits correspondants ne sont plus
distribués depuis mi-2019 et ne doivent plus être utilisés
depuis fin janvier 2020. L’autorisation de quatre substances
actives SDHi, le bénodanil, le fenfurame, le mépronil et
l’oxycarboxine, a été retirée par le règlement (CE)
no 2076/2002 de la Commission du 20 novembre
20025
(tableau 20.III ). Le bénodanil a été autorisé sur
les cultures ornementales entre 1983 et 1987. Le fenfurame a été
autorisé pour la protection des plaies de taille et le
traitement des semences entre 1983 et 1997. Le mépronil a été
autorisé pour le traitement des sols, le traitement des semences
et les cultures légumières entre 1986 et 2003 et l’oxycarboxine
a été autorisée sur les cultures ornementales entre 1973 et
20026
. Il existe neuf substances actives appartenant
à la famille des SDHi non autorisées au niveau européen mais
autorisées dans d’autres pays (voir addenda en fin de chapitre :
tableau A20.I
). Le bénodanil a été autorisé sur
les cultures ornementales entre 1983 et 1987. Le fenfurame a été
autorisé pour la protection des plaies de taille et le
traitement des semences entre 1983 et 1997. Le mépronil a été
autorisé pour le traitement des sols, le traitement des semences
et les cultures légumières entre 1986 et 2003 et l’oxycarboxine
a été autorisée sur les cultures ornementales entre 1973 et
20026
. Il existe neuf substances actives appartenant
à la famille des SDHi non autorisées au niveau européen mais
autorisées dans d’autres pays (voir addenda en fin de chapitre :
tableau A20.I ).
Parmi ces substances actives, quatre sont en cours d’examen dans
le processus d’autorisation de mise sur le marché au niveau
européen : le pydiflumétofène, l’isoflucyprame, l’inpyrfluxame
et le fluindapyr7
. Deux substances actives SDHi, le furametpyr et
le thifluzamide, ont fait l’objet d’une demande d’enregistrement
préalable auprès de l’Agence européenne des produits chimiques
(European Chemicals Agency ; Echa) au titre de la
directive REACH8
. Elles ne sont pas autorisées pour une
utilisation en tant que produit phytopharmaceutique. Enfin,
aucun renseignement n’est disponible au niveau européen sur le
pyraziflumid, qui a été homologué en mars 2018 par le Japon et
dont l’examen par la réunion conjointe FAO/OMS sur les résidus
de pesticides était prévu en 20209
.
).
Parmi ces substances actives, quatre sont en cours d’examen dans
le processus d’autorisation de mise sur le marché au niveau
européen : le pydiflumétofène, l’isoflucyprame, l’inpyrfluxame
et le fluindapyr7
. Deux substances actives SDHi, le furametpyr et
le thifluzamide, ont fait l’objet d’une demande d’enregistrement
préalable auprès de l’Agence européenne des produits chimiques
(European Chemicals Agency ; Echa) au titre de la
directive REACH8
. Elles ne sont pas autorisées pour une
utilisation en tant que produit phytopharmaceutique. Enfin,
aucun renseignement n’est disponible au niveau européen sur le
pyraziflumid, qui a été homologué en mars 2018 par le Japon et
dont l’examen par la réunion conjointe FAO/OMS sur les résidus
de pesticides était prévu en 20209
. ), reste le plus vendu en 2018 avec
230 tonnes, sa part ayant progressivement diminué au profit
d’autres SDHi, notamment le fluopyram, le fluxapyroxade, et le
bixafène, avec respectivement 185, 161 et 97 tonnes de substance
active vendues en 2018.
), reste le plus vendu en 2018 avec
230 tonnes, sa part ayant progressivement diminué au profit
d’autres SDHi, notamment le fluopyram, le fluxapyroxade, et le
bixafène, avec respectivement 185, 161 et 97 tonnes de substance
active vendues en 2018. ).
). ), et nématicides utilisés en médecine vétérinaire (Sakai et
coll., 2012
), et nématicides utilisés en médecine vétérinaire (Sakai et
coll., 2012 ; Inaoka et coll.,
2015
; Inaoka et coll.,
2015 ). En effet, la résistance aux nématicides a abouti à des
résistances, voire des multi-résistances, chez les animaux et
donc la recherche de nouveaux principes actifs ciblant le
complexe SDH a été entreprise (Inaoka et coll.,
2015
). En effet, la résistance aux nématicides a abouti à des
résistances, voire des multi-résistances, chez les animaux et
donc la recherche de nouveaux principes actifs ciblant le
complexe SDH a été entreprise (Inaoka et coll.,
2015 ; Myung et Klittich, 2015
; Myung et Klittich, 2015 ; Mathew et coll.,
2016
; Mathew et coll.,
2016 ). En médecine humaine, un fongicide SDHi (ME1111) pour le
traitement de la mycose des ongles a été proposé (Takahata et
coll., 2016
). En médecine humaine, un fongicide SDHi (ME1111) pour le
traitement de la mycose des ongles a été proposé (Takahata et
coll., 2016 ), ainsi qu’un médicament à activité
anti-tumorale (lonidamine) (Nath et coll.,
2016
), ainsi qu’un médicament à activité
anti-tumorale (lonidamine) (Nath et coll.,
2016 ) mais sans autorisation de mise sur le marché à ce jour en
France.
) mais sans autorisation de mise sur le marché à ce jour en
France.Tableau 20.II Principaux types d’usages des fongicides SDHi autorisés en France
|
Substances actives (SA)
|
Principaux types de
traitement
|
Cultures
|
Spécialité contenant la SA autorisée en
France
|
Date de la 1re autorisation
en France d’une spécialité contenant la
SA
|
|---|---|---|---|---|
|
Benzovindiflupyr
|
Parties aériennes
|
Céréales, terrains de golf
|
Oui
|
22/07/2016
|
|
Bixafène
|
Parties aériennes
|
Céréales
|
Oui
|
15/08/2011
|
|
Boscalide
|
Parties aériennes
|
Céréales, vigne, arboriculture,
crucifères oléagineuses, tournesol,
légumes
|
Oui
|
14/06/2005
|
|
Carboxine
|
Semences
|
Céréales
|
Non
|
01/12/1968
|
|
Fluopyram
|
Parties aériennes
|
Céréales, vigne, arboriculture,
cultures légumières, oléagineux, banane, terrains
de golf
|
Oui
|
15/10/2013
|
|
Flutolanil
|
Semences
|
Pomme de terre
|
Oui
|
01/06/1992
|
|
Fluxapyroxade
|
Semences et parties
aériennes
|
Céréales, arboriculture,
légumes
|
Oui
|
04/10/2011
|
|
Isofétamide
|
Semences et parties
aériennes
|
Vigne, arboriculture, crucifères
oléagineuses, pêches, prunes, abricots, cerises,
laitues
|
Oui
|
10/08/2018
|
|
Isopyrazam
|
Parties aériennes
|
Plantes ornementales
|
Oui
|
18/12/2017
|
|
Penflufène
|
Parties aériennes
|
Céréales (blé, orge), légumes,
riz
|
Non
|
–
|
|
Penthiopyrade
|
Parties aériennes
|
Céréales, tomates, fruits à pépins,
concombres, courgettes, aubergines,
cucurbitacées
|
Oui
|
27/11/2014
|
|
Sédaxane
|
Semences
|
Céréales et maïs
|
Oui
|
01/07/2011
|
Sources : Anses,
2019 ; Pesticide Properties
DataBase (https://sitem.herts.ac.uk/aeru/ppdb/
[consulté le 14 mai 2020]) ; rapports Efsa et Echa (EU
Pesticide Database : https://ec.europa.eu/food/plant/pesticides/eu-pesticides-database
[consulté le 14 mai 2020]). Les données correspondent aux
règlements en vigueur à la date de consultation des bases de
données.
; Pesticide Properties
DataBase (https://sitem.herts.ac.uk/aeru/ppdb/
[consulté le 14 mai 2020]) ; rapports Efsa et Echa (EU
Pesticide Database : https://ec.europa.eu/food/plant/pesticides/eu-pesticides-database
[consulté le 14 mai 2020]). Les données correspondent aux
règlements en vigueur à la date de consultation des bases de
données.
Tableau 20.III Principaux types d’usages des fongicides SDHi anciennement autorisés en France
|
Substances actives
|
Cultures
|
Dates d’autorisation
d’utilisation
|
Durée d’utilisation
|
|---|---|---|---|
|
Bénodanil
|
Cultures ornementales
|
1983 à 1987
|
4 ans
|
|
Fenfurame
|
Plaies de taille (cultures fruitières,
viticulture), traitement de semences
|
1983 à 1997
|
14 ans
|
|
Mépronil
|
Cultures légumières, traitement de
sols, traitement de semences
|
1986 à 2003
|
17 ans
|
|
Oxycarboxine
|
Cultures ornementales
|
1973 à 2002
|
29 ans
|
Source : Base CIPA (Compilation des Index phytosanitaires ACTA), un outil du programme Matphyto disponible à l’adresse http://matphyto.acta-informatique.fr/ [consulté le 14 mai 2020].
Contamination des milieux et des denrées alimentaires
Surveillance dans les différents milieux
 ). Une autre étude plus
restreinte menée en Allemagne sur des sols sableux a détecté
le boscalide, 3 ans après son application, à une
concentration moyenne de 0,2 µg/kg (Karlsson et coll.,
2016
). Une autre étude plus
restreinte menée en Allemagne sur des sols sableux a détecté
le boscalide, 3 ans après son application, à une
concentration moyenne de 0,2 µg/kg (Karlsson et coll.,
2016 ). La demi-vie (DT50)
des fongicides SDHi dans les sols varie selon les substances
actives, les types d’études (études de laboratoire ou de
terrain), les conditions environnementales (température,
humidité) et les types de sol. Dans le rapport Anses de
2019, le groupe d’experts a compilé les données sur les
DT50 des fongicides SDHi dans les sols à
partir des évaluations de risques publiées par l’Autorité
européenne de sécurité des aliments (European Food Safety
Authority ; Efsa). Ont été rapportées les données
obtenues sur l’ensemble des substances actives autorisées au
niveau européen en janvier 2019 (à l’exception du
penflufène). Les valeurs les plus faibles sont retrouvées
pour la carboxine avec une DT50 moyenne de
0,28 jours (DT50 maximum 11 jours), l’isofétamide
avec 37 jours et le sédaxane avec 100 jours. La persistance
des autres substances SDHi est plus élevée comme par exemple
le benzovindiflupyr, le flutolanil et le bixafène avec des
DT50 respectivement de 184, 190 et 203 jours.
Dans le dernier rapport d’évaluation européenne du
boscalide, les DT50 rapportées sont de 108 à
384 jours à partir des études de laboratoire (moyenne
232 jours), et de 27 à 208 jours dans les études de terrain
(C.E., 2008
). La demi-vie (DT50)
des fongicides SDHi dans les sols varie selon les substances
actives, les types d’études (études de laboratoire ou de
terrain), les conditions environnementales (température,
humidité) et les types de sol. Dans le rapport Anses de
2019, le groupe d’experts a compilé les données sur les
DT50 des fongicides SDHi dans les sols à
partir des évaluations de risques publiées par l’Autorité
européenne de sécurité des aliments (European Food Safety
Authority ; Efsa). Ont été rapportées les données
obtenues sur l’ensemble des substances actives autorisées au
niveau européen en janvier 2019 (à l’exception du
penflufène). Les valeurs les plus faibles sont retrouvées
pour la carboxine avec une DT50 moyenne de
0,28 jours (DT50 maximum 11 jours), l’isofétamide
avec 37 jours et le sédaxane avec 100 jours. La persistance
des autres substances SDHi est plus élevée comme par exemple
le benzovindiflupyr, le flutolanil et le bixafène avec des
DT50 respectivement de 184, 190 et 203 jours.
Dans le dernier rapport d’évaluation européenne du
boscalide, les DT50 rapportées sont de 108 à
384 jours à partir des études de laboratoire (moyenne
232 jours), et de 27 à 208 jours dans les études de terrain
(C.E., 2008 ). Des valeurs du même ordre
(entre 182 et 572 jours) ont été rapportées dans des
dossiers de l’agence américaine de la protection de
l’environnement (EPA, 2010
). Des valeurs du même ordre
(entre 182 et 572 jours) ont été rapportées dans des
dossiers de l’agence américaine de la protection de
l’environnement (EPA, 2010 ). Enfin, des données sont
disponibles pour quelques fongicides SDHi qui font l’objet
d’une demande d’autorisation au niveau européen, dont
l’inpyrfluxame avec une demi-vie dans les sols de 121 à
1 720 jours (EPA, 2020
). Enfin, des données sont
disponibles pour quelques fongicides SDHi qui font l’objet
d’une demande d’autorisation au niveau européen, dont
l’inpyrfluxame avec une demi-vie dans les sols de 121 à
1 720 jours (EPA, 2020 ), l’isoflucyprame avec une
demi-vie de 224 à 630 jours dans les études de laboratoire
et de 16,5 à 177 jours dans les études de terrain (Echa,
2018
), l’isoflucyprame avec une
demi-vie de 224 à 630 jours dans les études de laboratoire
et de 16,5 à 177 jours dans les études de terrain (Echa,
2018 ), et le pydiflumétofène avec une
demi-vie moyenne de 1 334 jours (maximum de 8 540 jours)
(Anses, 2019
), et le pydiflumétofène avec une
demi-vie moyenne de 1 334 jours (maximum de 8 540 jours)
(Anses, 2019 ). La quasi-totalité des fongicides
SDHi répondent donc aux critères d’une substance dite
« persistante » dans les sols selon la réglementation
européenne16
et leur utilisation à long terme peut ainsi
conduire à leur accumulation, un phénomène qui a été montré
par modélisation pour le boscalide (JMPR,
2009
). La quasi-totalité des fongicides
SDHi répondent donc aux critères d’une substance dite
« persistante » dans les sols selon la réglementation
européenne16
et leur utilisation à long terme peut ainsi
conduire à leur accumulation, un phénomène qui a été montré
par modélisation pour le boscalide (JMPR,
2009 ).
). ). Les molécules les plus
fréquemment détectées dans les cours d’eau (eau de surface)
sont des herbicides. Parmi les 15 molécules les plus
fréquemment détectées en 2013, le boscalide est en
8e position. Il est le seul fongicide de ce
top 15. Le taux de détection est inférieur à 20 % en 2012 et
2013. Parmi les 1 580 points de surveillance le concernant,
aucun n’a dépassé le seuil d’écotoxicité
(11,6 µg/l)17
. La plupart des autres SDHi n’étant pas
recherchés, la présence de ces molécules dans les
hydrosystèmes n’est pas connue (Commissariat général au
développement durable, 2015
). Les molécules les plus
fréquemment détectées dans les cours d’eau (eau de surface)
sont des herbicides. Parmi les 15 molécules les plus
fréquemment détectées en 2013, le boscalide est en
8e position. Il est le seul fongicide de ce
top 15. Le taux de détection est inférieur à 20 % en 2012 et
2013. Parmi les 1 580 points de surveillance le concernant,
aucun n’a dépassé le seuil d’écotoxicité
(11,6 µg/l)17
. La plupart des autres SDHi n’étant pas
recherchés, la présence de ces molécules dans les
hydrosystèmes n’est pas connue (Commissariat général au
développement durable, 2015 ).
).Surveillance dans les denrées alimentaires (végétales ou animales)
 ), les substances SDHi faisant
l’objet d’une surveillance dans les denrées alimentaires
destinées à la consommation humaine en France sont : le
boscalide, le flutolanil, la carboxine, le bixafène, le
fluopyram, le fluxapyroxade, le penthiopyrade et le
benzovindiflupyr. Les résultats des programmes de
surveillance et de contrôles mis en œuvre par les ministères
de l’Agriculture et de la Consommation entre 2013 et 2016
montrent que le boscalide est quantifié18
dans 4,4 % à 8,7 % des échantillons de
denrées prélevées à la distribution et dans 9,2 % à 12,7 %
de denrées directement à la production. Concernant le
flutolanil, le taux de quantification est de 0,02 % pour les
denrées distribuées, et de 0,7 % pour les denrées à la
production. Un seul dépassement de la limite maximale de
résidus (LMR) est constaté sur un échantillon de carotte
issu des denrées prélevées à la distribution. La carboxine
n’a pas été quantifiée dans les denrées prélevées à la
distribution et l’a été une seule fois sur les denrées à la
production (sur 800 à 1 400 analyses annuelles) sans
dépasser la LMR. Concernant les autres substances, le
bixafène et le fluopyram sont quantifiés dans moins de 2,5 %
des échantillons (sans dépassement de la LMR sauf pour un
cas pour des kiwis et le fluopyram), le fluxapyroxade, le
penthiopyrade et le benzovindiflupyr ne sont pas
quantifiés.
), les substances SDHi faisant
l’objet d’une surveillance dans les denrées alimentaires
destinées à la consommation humaine en France sont : le
boscalide, le flutolanil, la carboxine, le bixafène, le
fluopyram, le fluxapyroxade, le penthiopyrade et le
benzovindiflupyr. Les résultats des programmes de
surveillance et de contrôles mis en œuvre par les ministères
de l’Agriculture et de la Consommation entre 2013 et 2016
montrent que le boscalide est quantifié18
dans 4,4 % à 8,7 % des échantillons de
denrées prélevées à la distribution et dans 9,2 % à 12,7 %
de denrées directement à la production. Concernant le
flutolanil, le taux de quantification est de 0,02 % pour les
denrées distribuées, et de 0,7 % pour les denrées à la
production. Un seul dépassement de la limite maximale de
résidus (LMR) est constaté sur un échantillon de carotte
issu des denrées prélevées à la distribution. La carboxine
n’a pas été quantifiée dans les denrées prélevées à la
distribution et l’a été une seule fois sur les denrées à la
production (sur 800 à 1 400 analyses annuelles) sans
dépasser la LMR. Concernant les autres substances, le
bixafène et le fluopyram sont quantifiés dans moins de 2,5 %
des échantillons (sans dépassement de la LMR sauf pour un
cas pour des kiwis et le fluopyram), le fluxapyroxade, le
penthiopyrade et le benzovindiflupyr ne sont pas
quantifiés. ). Dans l’EATi, le boscalide a
été quantifié dans 5 sur 305 des produits analysés (1,6 %) à
des taux faibles, de l’ordre de 0,001 mg/kg, alors que la
carboxine, le flutolanil et le mépronil n’ont pas été
quantifiés (Nougadère et coll.,
2020
). Dans l’EATi, le boscalide a
été quantifié dans 5 sur 305 des produits analysés (1,6 %) à
des taux faibles, de l’ordre de 0,001 mg/kg, alors que la
carboxine, le flutolanil et le mépronil n’ont pas été
quantifiés (Nougadère et coll.,
2020 ).
). ), 16 substances actives SDHi ont
été étudiées (tableau 20.IV
), 16 substances actives SDHi ont
été étudiées (tableau 20.IV ) : le boscalide et le
fluopyram sont quantifiés dans respectivement 8,96 % et
6,75 % des échantillons analysés, un groupe de 7 substances
sont quantifiées dans moins de 0,5 % des échantillons (le
benzovindiflupyr, le bixafène, la carboxine, le flutolanil,
le fluxapyroxade, l’isopyrazam et le penthiopyrade) et
7 substances ne sont quantifiées dans aucun des échantillons
(le bénodanil, le fenfurame, l’isofétamide, le mépronil,
l’oxycarboxine, le penflufène et le sédaxane). Seul le
boscalide dépasse sur certains échantillons la LMR : sur
75 008 échantillons analysés pour cette substance, 61
(0,08 %) dépassent la LMR (8 sont des produits d’origine
européenne, 53 d’origine extra-européenne).
) : le boscalide et le
fluopyram sont quantifiés dans respectivement 8,96 % et
6,75 % des échantillons analysés, un groupe de 7 substances
sont quantifiées dans moins de 0,5 % des échantillons (le
benzovindiflupyr, le bixafène, la carboxine, le flutolanil,
le fluxapyroxade, l’isopyrazam et le penthiopyrade) et
7 substances ne sont quantifiées dans aucun des échantillons
(le bénodanil, le fenfurame, l’isofétamide, le mépronil,
l’oxycarboxine, le penflufène et le sédaxane). Seul le
boscalide dépasse sur certains échantillons la LMR : sur
75 008 échantillons analysés pour cette substance, 61
(0,08 %) dépassent la LMR (8 sont des produits d’origine
européenne, 53 d’origine extra-européenne).Tableau 20.IV Analyse des niveaux de résidus de pesticides SDHi dans les aliments sur le marché européen : nombre d’échantillons analysés et nombre de quantifications
|
Substance active
|
Nombre d’échantillons
analysés
|
Nombre
de quantifications (> LQ) |
% de quantification
|
Nombre de pays concernés
|
|---|---|---|---|---|
|
Bénodanil
|
9 689
|
0
|
0
|
7
|
|
Benzovindiflupyr
|
11 841
|
1
|
0,01
|
10
|
|
Bixafène
|
40 458
|
11
|
0,03
|
26
|
|
Boscalide
|
75 008
|
6 720
|
8,96
|
30
|
|
Carboxine
|
52 926
|
1
|
0
|
27
|
|
Fenfurame
|
6 713
|
0
|
0
|
4
|
|
Fluopyram
|
61 161
|
4 131
|
6,75
|
30
|
|
Flutolanil
|
61 478
|
18
|
0,03
|
28
|
|
Fluxapyroxade
|
45 507
|
208
|
0,46
|
26
|
|
Isofétamide
|
1 409
|
0
|
0
|
1
|
|
Isopyrazam
|
32 079
|
3
|
0,01
|
17
|
|
Mépronil
|
37 440
|
0
|
0
|
21
|
|
Oxycarboxine
|
14 049
|
0
|
0
|
14
|
|
Penflufène
|
21 455
|
0
|
0
|
19
|
|
Penthiopyrade
|
33 021
|
23
|
0,07
|
20
|
|
Sédaxane
|
5 035
|
0
|
0
|
6
|
LQ : Limite de quantification. Source :
Efsa, 2020
 ).
).Biosurveillance humaine et sources d’exposition
 ).
). ; Béranger et coll., 2020
; Béranger et coll., 2020 ). Parmi un échantillon de
16 individus participant à une étude interventionnelle portant
sur l’impact de l’alimentation d’origine biologique sur
l’imprégnation urinaire aux États-Unis, aucune mesure réalisée
avant et après l’intervention ne rapportait la présence du
boscalide dans les urines (Hyland et coll.,
2019
). Parmi un échantillon de
16 individus participant à une étude interventionnelle portant
sur l’impact de l’alimentation d’origine biologique sur
l’imprégnation urinaire aux États-Unis, aucune mesure réalisée
avant et après l’intervention ne rapportait la présence du
boscalide dans les urines (Hyland et coll.,
2019 ).
). ). D’autres auteurs ont évalué, par modélisation, l’exposition
à la carboxine par voie cutanée et par inhalation chez les
personnes travaillant en floriculture sous serres en Colombie
(Lesmes-Fabian et Binder, 2013
). D’autres auteurs ont évalué, par modélisation, l’exposition
à la carboxine par voie cutanée et par inhalation chez les
personnes travaillant en floriculture sous serres en Colombie
(Lesmes-Fabian et Binder, 2013 ) ou, dans une étude menée aux
États-Unis, chez des personnes traitant les semences (Grey et
coll., 1983
) ou, dans une étude menée aux
États-Unis, chez des personnes traitant les semences (Grey et
coll., 1983 ).
).Toxicocinétique
Conséquences biologiques d’une altération de la
fonction
de la succinate déshydrogénase
Succinate et production d’espèces réactives de l’oxygène
 ). La production de ROS par ciblage du complexe II par des
agents chimio-thérapeutiques serait dépendante des modifications
du pH intracellulaire et mitochondrial matriciel, et
entraînerait la mort cellulaire par apoptose (Lemarie et coll.,
2011
). La production de ROS par ciblage du complexe II par des
agents chimio-thérapeutiques serait dépendante des modifications
du pH intracellulaire et mitochondrial matriciel, et
entraînerait la mort cellulaire par apoptose (Lemarie et coll.,
2011 ). Le stress oxydant peut être associé à des syndromes
neurodégénératifs, comme la maladie de Parkinson, d’Alzheimer ou
de Huntington (Ebadi et coll.,
2001
). Le stress oxydant peut être associé à des syndromes
neurodégénératifs, comme la maladie de Parkinson, d’Alzheimer ou
de Huntington (Ebadi et coll.,
2001 ; Lin et Beal, 2006
; Lin et Beal, 2006 ; Niedzielska et coll.,
2016
; Niedzielska et coll.,
2016 ; Trist et coll., 2019
; Trist et coll., 2019 ). Il peut aussi faciliter la
promotion et la progression tumorale (Liou et Storz,
2010
). Il peut aussi faciliter la
promotion et la progression tumorale (Liou et Storz,
2010 ) en altérant la signalisation cellulaire et en causant des
dommages oxydatifs à l’ADN (Tamura et coll.,
2014
) en altérant la signalisation cellulaire et en causant des
dommages oxydatifs à l’ADN (Tamura et coll.,
2014 ; Galadari et coll., 2017
; Galadari et coll., 2017 ; Prasad et coll.,
2017
; Prasad et coll.,
2017 ).
). ; Szeto et coll., 2007
; Szeto et coll., 2007 ; Goffrini et coll.,
2009
; Goffrini et coll.,
2009 ). D’autres études suggèrent que des mutations dans les
sous-unités B, C et D pourraient également influencer la
production d’anion superoxyde au niveau du site de liaison de
l’ubiquinone sur la SDHD (Guo et Lemire,
2003
). D’autres études suggèrent que des mutations dans les
sous-unités B, C et D pourraient également influencer la
production d’anion superoxyde au niveau du site de liaison de
l’ubiquinone sur la SDHD (Guo et Lemire,
2003 ; Szeto et coll., 2007
; Szeto et coll., 2007 ). Plus récemment, il a été montré
que l’inactivation de la SDHC dans des cellules humaines
d’hépatocarcinome conduit à une augmentation de la production de
ROS (Li et coll., 2019
). Plus récemment, il a été montré
que l’inactivation de la SDHC dans des cellules humaines
d’hépatocarcinome conduit à une augmentation de la production de
ROS (Li et coll., 2019 ). De manière similaire, dans des
lignées cellulaires humaines d’hépatome Hep3B, de carcinome
pulmonaire A549 et d’ostéosarcome dans lesquelles la SDHB a été
inactivée par ARN interférence ou « pharmacologiquement » (par
traitement avec le TTFA), on observe un stress oxydant associé à
la stabilisation nucléaire du facteur de transcription HIF-α
(Hypoxia Inducible Factor alpha) en conditions
normoxiques (Guzy et coll.,
2008
). De manière similaire, dans des
lignées cellulaires humaines d’hépatome Hep3B, de carcinome
pulmonaire A549 et d’ostéosarcome dans lesquelles la SDHB a été
inactivée par ARN interférence ou « pharmacologiquement » (par
traitement avec le TTFA), on observe un stress oxydant associé à
la stabilisation nucléaire du facteur de transcription HIF-α
(Hypoxia Inducible Factor alpha) en conditions
normoxiques (Guzy et coll.,
2008 ). Dans des cellules de hamster exprimant une version normale
ou une version mutée du gène SDHC humain, il se produit
une augmentation des niveaux d’anion superoxyde et de peroxyde
d’hydrogène qui s’accompagne d’une activation de la superoxyde
dismutase et du métabolisme du glutathion, cohérente avec la
mise en place des mécanismes de défense contre le stress
oxydant. Ce phénomène est associé à un stress métabolique
caractérisé par une augmentation de la consommation de glucose.
L’ensemble de ces désordres sont prévenus par une réexpression
du gène SDHC (Slane et coll.,
2006
). Dans des cellules de hamster exprimant une version normale
ou une version mutée du gène SDHC humain, il se produit
une augmentation des niveaux d’anion superoxyde et de peroxyde
d’hydrogène qui s’accompagne d’une activation de la superoxyde
dismutase et du métabolisme du glutathion, cohérente avec la
mise en place des mécanismes de défense contre le stress
oxydant. Ce phénomène est associé à un stress métabolique
caractérisé par une augmentation de la consommation de glucose.
L’ensemble de ces désordres sont prévenus par une réexpression
du gène SDHC (Slane et coll.,
2006 ). Enfin, l’inhibition de la SDH par l’atpenin A5, un
inhibiteur pharmacologique du complexe II de la chaîne
respiratoire, doté de propriétés antifongiques et nématicides
(Selby et coll., 2010
). Enfin, l’inhibition de la SDH par l’atpenin A5, un
inhibiteur pharmacologique du complexe II de la chaîne
respiratoire, doté de propriétés antifongiques et nématicides
(Selby et coll., 2010 ; Lee et coll.,
2019
; Lee et coll.,
2019 ), induit également un stress oxydant dans les cellules
tumorales coliques humaines HT29 et DLD-1 mais pas dans des
fibroblastes normaux (Paranagama et Kita,
2017
), induit également un stress oxydant dans les cellules
tumorales coliques humaines HT29 et DLD-1 mais pas dans des
fibroblastes normaux (Paranagama et Kita,
2017 ). La production de ROS résultant d’un déficit en SDH peut
également favoriser la transduction d’un signal de stabilisation
du facteur de transcription d’HIF-1α en oxydant le
Fe2+ en Fe3+, car le Fe2+
est un cofacteur critique des prolyl-hydroxylases responsables
de l’hydroxylation d’HIF1 (Zhao et coll.,
2017
). La production de ROS résultant d’un déficit en SDH peut
également favoriser la transduction d’un signal de stabilisation
du facteur de transcription d’HIF-1α en oxydant le
Fe2+ en Fe3+, car le Fe2+
est un cofacteur critique des prolyl-hydroxylases responsables
de l’hydroxylation d’HIF1 (Zhao et coll.,
2017 ).
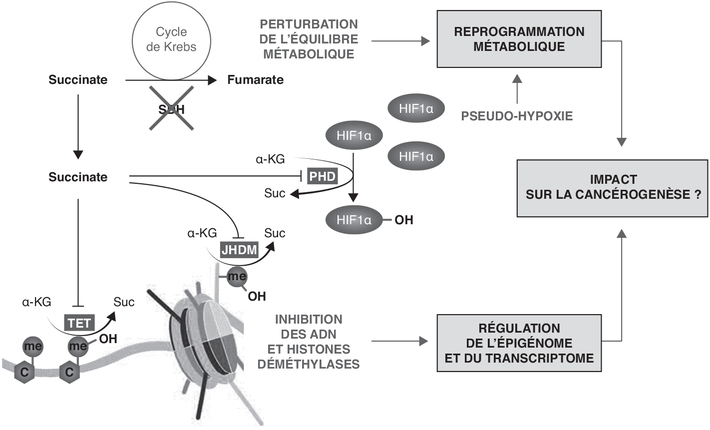
).Succinate, HIF1 et pseudo-hypoxie
 ). La fonction physiologique d’HIF1 est de favoriser
l’adaptation des cellules à la fluctuation du niveau de
dioxygène (O2). En situation de normoxie, le complexe
HIF1 est maintenu à un faible niveau grâce à sa dégradation
régulière par le protéasome, après son hydroxylation par les PHD
dont l’activité est dépendante du dioxygène.
). La fonction physiologique d’HIF1 est de favoriser
l’adaptation des cellules à la fluctuation du niveau de
dioxygène (O2). En situation de normoxie, le complexe
HIF1 est maintenu à un faible niveau grâce à sa dégradation
régulière par le protéasome, après son hydroxylation par les PHD
dont l’activité est dépendante du dioxygène. ) ou dans le transport du glucose et la glycolyse (Vander
Heiden et coll., 2009
) ou dans le transport du glucose et la glycolyse (Vander
Heiden et coll., 2009 ) et favoriser une reprogrammation
métabolique propice à la promotion et à la progression tumorale.
Ce remodelage métabolique, connu sous le nom d’effet Warburg,
constitue un marqueur du phénotype tumoral commun à la plupart
des cellules cancéreuses. Il favorise la glycolyse aux dépens de
l’activité du cycle de Krebs couplé à la chaîne respiratoire des
mitochondries, pour fournir les métabolites nécessaires à une
prolifération rapide des cellules cancéreuses, ainsi que les
cofacteurs nécessaires à leur lutte contre le stress oxydant
(Vander Heiden et coll., 2009
) et favoriser une reprogrammation
métabolique propice à la promotion et à la progression tumorale.
Ce remodelage métabolique, connu sous le nom d’effet Warburg,
constitue un marqueur du phénotype tumoral commun à la plupart
des cellules cancéreuses. Il favorise la glycolyse aux dépens de
l’activité du cycle de Krebs couplé à la chaîne respiratoire des
mitochondries, pour fournir les métabolites nécessaires à une
prolifération rapide des cellules cancéreuses, ainsi que les
cofacteurs nécessaires à leur lutte contre le stress oxydant
(Vander Heiden et coll., 2009 ). Le succinate est un inhibiteur
compétitif des PHD (Xiao et coll.,
2012
). Le succinate est un inhibiteur
compétitif des PHD (Xiao et coll.,
2012 ; Her et coll., 2015
; Her et coll., 2015 ; Peters et coll.,
2015
; Peters et coll.,
2015 ). En bloquant l’hydroxylation d’HIF1 par les PHD, une
élévation du succinate pourrait induire la stabilisation de ce
facteur de transcription même dans des conditions de normoxie,
avec des conséquences sur le développement du phénotype
tumoral.
). En bloquant l’hydroxylation d’HIF1 par les PHD, une
élévation du succinate pourrait induire la stabilisation de ce
facteur de transcription même dans des conditions de normoxie,
avec des conséquences sur le développement du phénotype
tumoral. ; Gimenez-Roqueplo,
2006
; Gimenez-Roqueplo,
2006 ), liée à une inhibition de l’activité des PHD par le
succinate. C’est également le cas dans des cellules transfectées
avec un siARN dirigé contre SDHB (cellules hépatiques
Hep3b et cellules d’adénocarcinome gastrique AGS) (Cervera et
coll., 2009
), liée à une inhibition de l’activité des PHD par le
succinate. C’est également le cas dans des cellules transfectées
avec un siARN dirigé contre SDHB (cellules hépatiques
Hep3b et cellules d’adénocarcinome gastrique AGS) (Cervera et
coll., 2009 ) et dans des fibroblastes de patients
présentant une inactivation complète du gène SDHA (Brière
et coll., 2005
) et dans des fibroblastes de patients
présentant une inactivation complète du gène SDHA (Brière
et coll., 2005 ). HIF1 concourt à l’activation de
processus favorables à la cancérogenèse, notamment par la
promotion d’une reprogrammation métabolique propice à la
prolifération cellulaire. Ces caractéristiques ont conduit à
considérer que l’inactivation des gènes SDHx entraîne la
mise en place d’un phénotype de pseudo-hypoxie et à qualifier
ces gènes de suppresseurs de tumeur. On peut également noter que
l’accumulation de succinate observée dans des macrophages
humains THP1 en réponse à une exposition à l’inhibiteur
pharmacologique du complexe II atpenin A5 est également associée
à une augmentation du niveau d’HIF-1α (Fuhrmann et coll.,
2019
). HIF1 concourt à l’activation de
processus favorables à la cancérogenèse, notamment par la
promotion d’une reprogrammation métabolique propice à la
prolifération cellulaire. Ces caractéristiques ont conduit à
considérer que l’inactivation des gènes SDHx entraîne la
mise en place d’un phénotype de pseudo-hypoxie et à qualifier
ces gènes de suppresseurs de tumeur. On peut également noter que
l’accumulation de succinate observée dans des macrophages
humains THP1 en réponse à une exposition à l’inhibiteur
pharmacologique du complexe II atpenin A5 est également associée
à une augmentation du niveau d’HIF-1α (Fuhrmann et coll.,
2019 ).
).Succinate et régulation épigénétique
 ).
). ). La méthylation de l’ADN est une
modification chimique qui affecte les bases C au sein de
dinucléotides CpG. Cette modification épigénétique, lorsqu’elle
affecte les régions promotrices des gènes, permet de contrôler
l’activité des gènes dans différents tissus et en réponse à
différents stimuli nutritionnels, hormonaux ou environnementaux,
sans modifier la séquence primaire d’ADN. La méthylation de
l’ADN affecte la structure de la chromatine et est fréquemment
associée à une répression des gènes. Elle peut être réversée par
des enzymes possédant une activité déméthylase de la famille TET
(ten-eleven-translocation) qui catalysent l’oxydation
des 5-méthyl-cytosines en 5-hydroxy-méthyl-cytosine. Ce signal
moléculaire de déméthylation est alors associé à une activation
de la transcription des gènes (Vasanthakumar et Godley,
2015
). La méthylation de l’ADN est une
modification chimique qui affecte les bases C au sein de
dinucléotides CpG. Cette modification épigénétique, lorsqu’elle
affecte les régions promotrices des gènes, permet de contrôler
l’activité des gènes dans différents tissus et en réponse à
différents stimuli nutritionnels, hormonaux ou environnementaux,
sans modifier la séquence primaire d’ADN. La méthylation de
l’ADN affecte la structure de la chromatine et est fréquemment
associée à une répression des gènes. Elle peut être réversée par
des enzymes possédant une activité déméthylase de la famille TET
(ten-eleven-translocation) qui catalysent l’oxydation
des 5-méthyl-cytosines en 5-hydroxy-méthyl-cytosine. Ce signal
moléculaire de déméthylation est alors associé à une activation
de la transcription des gènes (Vasanthakumar et Godley,
2015 ). Le succinate est un inhibiteur des déméthylases de la
famille TET, avec une concentration inhibitrice médiane
(IC50) de l’ordre de 550 µM (Laukka et coll.,
2016
). Le succinate est un inhibiteur des déméthylases de la
famille TET, avec une concentration inhibitrice médiane
(IC50) de l’ordre de 550 µM (Laukka et coll.,
2016 ), une valeur compatible avec le niveau de succinate dans les
tumeurs SDHx qui peut atteindre plusieurs millimolaires (Pollard
et coll., 2005
), une valeur compatible avec le niveau de succinate dans les
tumeurs SDHx qui peut atteindre plusieurs millimolaires (Pollard
et coll., 2005 ; Xiao et coll.,
2012
; Xiao et coll.,
2012 ). Son accumulation est donc susceptible de modifier la
méthylation de l’ADN et il est connu que les altérations du
profil de méthylation des gènes sont souvent impliquées dans le
processus de cancérogenèse.
). Son accumulation est donc susceptible de modifier la
méthylation de l’ADN et il est connu que les altérations du
profil de méthylation des gènes sont souvent impliquées dans le
processus de cancérogenèse.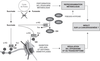 | Figure 20.3 Conséquences potentielles d’une accumulation de succinate sur la reprogrammation métabolique et la régulation de l’épigénome |
 ). En accord avec cette hypothèse, l’inactivation génétique de
SDHB dans des cellules chromaffines de souris
entraîne une accumulation de succinate qui agit comme un
inhibiteur compétitif des déméthylases de la famille TET,
conduisant à une accumulation progressive de cytosines
méthylées. Le phénotype hyperméthylé qui en résulte reproduit
celui observé dans les tumeurs humaines portant une mutation
SDHB à l’état homozygote et est associé à des
capacités migratoires augmentées des cellules chromaffines ainsi
modifiées (Letouzé et coll.,
2013
). En accord avec cette hypothèse, l’inactivation génétique de
SDHB dans des cellules chromaffines de souris
entraîne une accumulation de succinate qui agit comme un
inhibiteur compétitif des déméthylases de la famille TET,
conduisant à une accumulation progressive de cytosines
méthylées. Le phénotype hyperméthylé qui en résulte reproduit
celui observé dans les tumeurs humaines portant une mutation
SDHB à l’état homozygote et est associé à des
capacités migratoires augmentées des cellules chromaffines ainsi
modifiées (Letouzé et coll.,
2013 ).
). ). L’accumulation de succinate est donc également associée à
une augmentation de la méthylation des histones
(figure 20.3
). L’accumulation de succinate est donc également associée à
une augmentation de la méthylation des histones
(figure 20.3 ). Les
histones sont les protéines formant les nucléosomes de la
chromatine. Elles subissent des modifications
post-traductionnelles qui modulent l’accessibilité de l’ADN,
donc des gènes, à la machinerie transcriptionnelle. C’est
principalement l’extrémité N-terminale de la chaîne
polypeptidique des histones qui émerge des nucléosomes, qui
subit ces nombreuses modifications post-traductionnelles. La
nature de ces modifications est diverse incluant notamment la
phosphorylation, l’acétylation, l’ubiquitinylation et la
méthylation. Concernant ce dernier type de modulation, les
histones peuvent être mono-, di-, ou triméthylés. La méthylation
des lysines 9 et 27 de l’histone H3 (H3K9 et H3K27,
respectivement) est associée à une répression de la
transcription.
). Les
histones sont les protéines formant les nucléosomes de la
chromatine. Elles subissent des modifications
post-traductionnelles qui modulent l’accessibilité de l’ADN,
donc des gènes, à la machinerie transcriptionnelle. C’est
principalement l’extrémité N-terminale de la chaîne
polypeptidique des histones qui émerge des nucléosomes, qui
subit ces nombreuses modifications post-traductionnelles. La
nature de ces modifications est diverse incluant notamment la
phosphorylation, l’acétylation, l’ubiquitinylation et la
méthylation. Concernant ce dernier type de modulation, les
histones peuvent être mono-, di-, ou triméthylés. La méthylation
des lysines 9 et 27 de l’histone H3 (H3K9 et H3K27,
respectivement) est associée à une répression de la
transcription. ; Aspuria et coll., 2014
; Aspuria et coll., 2014 ). Dans les cellules embryonnaires
rénales humaines HEK293T, l’inactivation de SDHA ou
SDHB par ARN interférence (utilisation de siARN)
entraîne une augmentation du niveau des histones H3K4 mono-, di-
et triméthylés, et H3K79 diméthylés. Cette hyperméthylation des
histones est retrouvée dans les cellules humaines
d’hépatocarcinome Hep3B, de fibrosarcome HT1080 et de
phéochromo-cytome de rat PC12 suite à une inhibition de la SDH
par un traitement avec 0,5 mM de TTFA pendant 24 h (Cervera et
coll., 2009
). Dans les cellules embryonnaires
rénales humaines HEK293T, l’inactivation de SDHA ou
SDHB par ARN interférence (utilisation de siARN)
entraîne une augmentation du niveau des histones H3K4 mono-, di-
et triméthylés, et H3K79 diméthylés. Cette hyperméthylation des
histones est retrouvée dans les cellules humaines
d’hépatocarcinome Hep3B, de fibrosarcome HT1080 et de
phéochromo-cytome de rat PC12 suite à une inhibition de la SDH
par un traitement avec 0,5 mM de TTFA pendant 24 h (Cervera et
coll., 2009 ), avec des profils d’hyperméthylation
de l’histone H3 différents selon les lignées cellulaires
utilisées.
), avec des profils d’hyperméthylation
de l’histone H3 différents selon les lignées cellulaires
utilisées. ; Cervera et coll., 2009
; Cervera et coll., 2009 ; Lemarie et coll.,
2011
; Lemarie et coll.,
2011 ; Wentzel et coll., 2017
; Wentzel et coll., 2017 ).
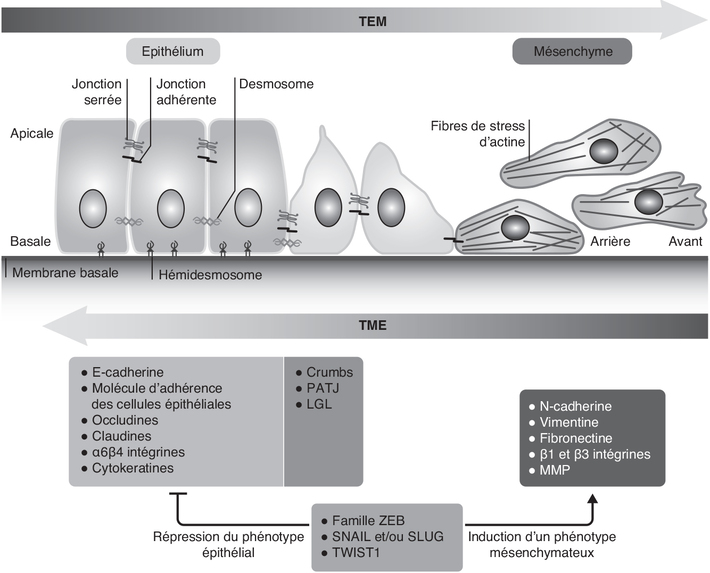
).Succinate, SDH et transition épithélio-mésenchymateuse
 ). L’EMT
se caractérise par la perte des propriétés de polarité et
d’adhérence caractéristiques des cellules épithéliales, et
l’acquisition de propriétés de mobilité et d’invasion propres
aux cellules mésenchymateuses (Thiery et coll.,
2009
). L’EMT
se caractérise par la perte des propriétés de polarité et
d’adhérence caractéristiques des cellules épithéliales, et
l’acquisition de propriétés de mobilité et d’invasion propres
aux cellules mésenchymateuses (Thiery et coll.,
2009 ).
). ) et épigénétiques (McDonald et coll.,
2011
) et épigénétiques (McDonald et coll.,
2011 ; Tam et Weinberg, 2013
; Tam et Weinberg, 2013 ), liés à un remodelage métabolique
affectant le métabolisme du glucose, des lipides, de la
glutamine et des nucléotides (Sciacovelli et Frezza,
2017
), liés à un remodelage métabolique
affectant le métabolisme du glucose, des lipides, de la
glutamine et des nucléotides (Sciacovelli et Frezza,
2017 ). La connexion étroite entre l’EMT et le métabolisme
mitochondrial a notamment été établie par la démonstration d’une
signature moléculaire caractéristique de l’EMT dans des tumeurs
porteuses de mutations dans des gènes codant des enzymes du
cycle de Krebs, dont la SDH (Loriot et coll.,
2012
). La connexion étroite entre l’EMT et le métabolisme
mitochondrial a notamment été établie par la démonstration d’une
signature moléculaire caractéristique de l’EMT dans des tumeurs
porteuses de mutations dans des gènes codant des enzymes du
cycle de Krebs, dont la SDH (Loriot et coll.,
2012 ). Certains travaux mettent également en évidence que l’EMT
peut être impliquée dans l’émergence de propriétés
caractéristiques des cellules souches cancéreuses (Puisieux et
coll., 2014
). Certains travaux mettent également en évidence que l’EMT
peut être impliquée dans l’émergence de propriétés
caractéristiques des cellules souches cancéreuses (Puisieux et
coll., 2014 ; Ye et Weinberg,
2015
; Ye et Weinberg,
2015 ), incluant la chimiorésistance avec une surexpression de
gènes codant des pompes d’efflux de médicaments (Du et Shim,
2016
), incluant la chimiorésistance avec une surexpression de
gènes codant des pompes d’efflux de médicaments (Du et Shim,
2016 ), et la dormance tumorale (Giancotti,
2013
), et la dormance tumorale (Giancotti,
2013 ).
).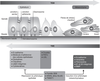 | Figure 20.4 Représentation schématique des modifications
cellulaires intervenant lors de la mise en place de la
transition épithélio-mésenchymateuse (EMT) (d’après Dongre
et Weinberg, 2019 ) ) |
 ). Confirmant cette hypothèse,
l’inactivation du gène SDHB dans les cellules
chromaffines de souris induit l’expression de ces facteurs de
transcription et conduit à une augmentation des capacités
migratoires, partiellement bloquée par la décitabine, un
inhibiteur de la méthylation de l’ADN (Letouzé et coll.,
2013
). Confirmant cette hypothèse,
l’inactivation du gène SDHB dans les cellules
chromaffines de souris induit l’expression de ces facteurs de
transcription et conduit à une augmentation des capacités
migratoires, partiellement bloquée par la décitabine, un
inhibiteur de la méthylation de l’ADN (Letouzé et coll.,
2013 ; Loriot et coll., 2015
; Loriot et coll., 2015 ). Le lien entre le déficit en SDHB
et l’EMT a également été démontré dans le cancer colorectal, où
l’inactivation du gène SDHB favorise la migration et
l’invasion cellulaires via un mécanisme impliquant le
TGF-β et le facteur de transcription Snail1 (Wang et coll.,
2016
). Le lien entre le déficit en SDHB
et l’EMT a également été démontré dans le cancer colorectal, où
l’inactivation du gène SDHB favorise la migration et
l’invasion cellulaires via un mécanisme impliquant le
TGF-β et le facteur de transcription Snail1 (Wang et coll.,
2016 ), ainsi que dans le cancer ovarien (Aspuria et coll.,
2014
), ainsi que dans le cancer ovarien (Aspuria et coll.,
2014 ).
). ). Chez les patients présentant des tumeurs hépatocellulaires,
cette atténuation de l’expression de la SDH est associée à la
progression tumorale et à une diminution de la survie des
patients (Li et coll., 2019
). Chez les patients présentant des tumeurs hépatocellulaires,
cette atténuation de l’expression de la SDH est associée à la
progression tumorale et à une diminution de la survie des
patients (Li et coll., 2019 ). Dans des cellules
d’hépatocarcinome, l’inactivation du gène SDHC induit une
augmentation du niveau de succinate et favorise la prolifération
cellulaire et la mise en place d’une EMT, avec la diminution des
marqueurs épithéliaux (E-cadhérine et zonula occludens-1) et une
augmentation des marqueurs mésenchymateux (vimentine et
N-cadhérine). Ces observations s’accompagnent d’une augmentation
des capacités de migration et d’invasion des cellules tumorales
(Li et coll., 2019
). Dans des cellules
d’hépatocarcinome, l’inactivation du gène SDHC induit une
augmentation du niveau de succinate et favorise la prolifération
cellulaire et la mise en place d’une EMT, avec la diminution des
marqueurs épithéliaux (E-cadhérine et zonula occludens-1) et une
augmentation des marqueurs mésenchymateux (vimentine et
N-cadhérine). Ces observations s’accompagnent d’une augmentation
des capacités de migration et d’invasion des cellules tumorales
(Li et coll., 2019 ). De manière similaire,
l’inactivation du gène SDHB dans les cellules
d’hépatocarcinome Hep3B induit une EMT caractérisée par une
diminution du marqueur épithélial E-cadhérine et une
augmentation des marqueurs mésenchymateux N-cadhérine, vimentine
et des facteurs de transcription contrôlant l’EMT (Twist, Slug
et Snail). La mise en place de cette EMT s’accompagne d’une
augmentation des capacités de prolifération et de migration des
cellules tumorales (Tseng et coll.,
2018
). De manière similaire,
l’inactivation du gène SDHB dans les cellules
d’hépatocarcinome Hep3B induit une EMT caractérisée par une
diminution du marqueur épithélial E-cadhérine et une
augmentation des marqueurs mésenchymateux N-cadhérine, vimentine
et des facteurs de transcription contrôlant l’EMT (Twist, Slug
et Snail). La mise en place de cette EMT s’accompagne d’une
augmentation des capacités de prolifération et de migration des
cellules tumorales (Tseng et coll.,
2018 ).
). ).
).Données toxicologiques concernant les fongicides SDHi
 ; Cochemé et Murphy,
2008
; Cochemé et Murphy,
2008 ),
le manèbe (Zhang et coll., 2003
),
le manèbe (Zhang et coll., 2003 ; Domico et coll.,
2006
; Domico et coll.,
2006 ),
et la roténone (Betarbet et coll.,
2000
),
et la roténone (Betarbet et coll.,
2000 ;
Navarro et coll., 2010
;
Navarro et coll., 2010 ) qui perturbent la respiration
cellulaire en bloquant l’activité des complexes I et/ou III de la
chaîne respiratoire des mitochondries et sont suspectés de jouer un
rôle dans le développement de la maladie de Parkinson (Costello et
coll., 2009
) qui perturbent la respiration
cellulaire en bloquant l’activité des complexes I et/ou III de la
chaîne respiratoire des mitochondries et sont suspectés de jouer un
rôle dans le développement de la maladie de Parkinson (Costello et
coll., 2009 ; Tanner et coll., 2011
; Tanner et coll., 2011 ; Wang et coll.,
2011
; Wang et coll.,
2011 ).
).Inhibition de la succinate déshydrogénase :
analyses structurales
(in silico) et fonctionnelles
(in vitro)
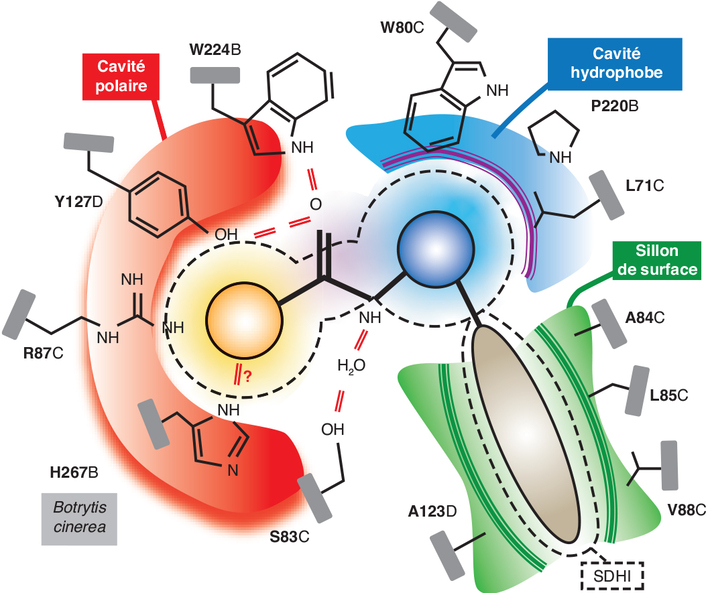
Structure protéique de la SDH et site de fixation des SDHi
 ). Non seulement les séquences
mais aussi les structures déterminées par cristallographie
aux rayons X sont semblables et, en premier lieu, le site de
liaison de l’ubiquinone et des fongicides SDHi (Q-site).
L’étude de mutations spontanées ou induites (ciblées ou non)
apporte des informations sur l’activité du complexe II
mitochondrial. Le site de liaison du succinate est localisé
dans la sous-unité SDHA et le Q-site implique des acides
aminés des sous-unités SDHB, SDHC et SDHD (Cecchini,
2003
). Non seulement les séquences
mais aussi les structures déterminées par cristallographie
aux rayons X sont semblables et, en premier lieu, le site de
liaison de l’ubiquinone et des fongicides SDHi (Q-site).
L’étude de mutations spontanées ou induites (ciblées ou non)
apporte des informations sur l’activité du complexe II
mitochondrial. Le site de liaison du succinate est localisé
dans la sous-unité SDHA et le Q-site implique des acides
aminés des sous-unités SDHB, SDHC et SDHD (Cecchini,
2003 ; Lalève et coll.,
2014
; Lalève et coll.,
2014 ).
). ),
5 d’entre eux sont identiques entre les espèces comparées
alors que les autres sont différents mais les changements
sont conservatifs (Bénit et coll.,
2019
),
5 d’entre eux sont identiques entre les espèces comparées
alors que les autres sont différents mais les changements
sont conservatifs (Bénit et coll.,
2019 ).
). ) (dénommées ci-après SdhB-Pro225
et SdhB-His272 ; locus et acides aminés correspondant chez
l’être humain ou le porc à respectivement SDHB-Pro197 et
SDHB-His249). Une trentaine de mutations ont été identifiées
comme responsables de la résistance aux fongicides et les
plus fréquentes chez B. cinerea sont, comme
précédemment, SdhB-Pro225 et SdhB-His272 avec de plus
SdhB-Asn230 (Sierotzki et Scalliet,
2013
) (dénommées ci-après SdhB-Pro225
et SdhB-His272 ; locus et acides aminés correspondant chez
l’être humain ou le porc à respectivement SDHB-Pro197 et
SDHB-His249). Une trentaine de mutations ont été identifiées
comme responsables de la résistance aux fongicides et les
plus fréquentes chez B. cinerea sont, comme
précédemment, SdhB-Pro225 et SdhB-His272 avec de plus
SdhB-Asn230 (Sierotzki et Scalliet,
2013 ), locus et acide aminé de ce
dernier correspondant chez l’être humain (ou le porc) à
SDHB-Asn202. Ces mutations sont pour partie dans la région
du Q-site identifié en radiocristallographie (Yankovskaya et
coll., 2003
), locus et acide aminé de ce
dernier correspondant chez l’être humain (ou le porc) à
SDHB-Asn202. Ces mutations sont pour partie dans la région
du Q-site identifié en radiocristallographie (Yankovskaya et
coll., 2003 ; Sun et coll.,
2005
; Sun et coll.,
2005 ). Il est intéressant de noter
que des mutations de l’acide aminé SdhB-Pro225 chez B.
cinerea (correspondant à SDHB-Pro197 chez l’être
humain), conduisant à une résistance aux SDHi ont été
retrouvées chez des patientes atteintes de PCC/PGL (Andrews
et coll., 2018
). Il est intéressant de noter
que des mutations de l’acide aminé SdhB-Pro225 chez B.
cinerea (correspondant à SDHB-Pro197 chez l’être
humain), conduisant à une résistance aux SDHi ont été
retrouvées chez des patientes atteintes de PCC/PGL (Andrews
et coll., 2018 ).
). ). Le Q-site est formé par
l’hélice 2L (SDHC ; aa 38-52), l’hélice 2S (SDHD ; aa 77-91)
et les sites de liaison des complexes Fe-S (SDHB ;
aa 166-175 et 214-219). Une similarité structurale entre le
Q-site du complexe SQR d’E. coli et de mitochondries
de porc renforce la notion de permanence structurale du
complexe entre les organismes (Yankovskaya et coll.,
2003
). Le Q-site est formé par
l’hélice 2L (SDHC ; aa 38-52), l’hélice 2S (SDHD ; aa 77-91)
et les sites de liaison des complexes Fe-S (SDHB ;
aa 166-175 et 214-219). Une similarité structurale entre le
Q-site du complexe SQR d’E. coli et de mitochondries
de porc renforce la notion de permanence structurale du
complexe entre les organismes (Yankovskaya et coll.,
2003 ; Sun et coll.,
2005
; Sun et coll.,
2005 ; Horsefield et coll.,
2006
; Horsefield et coll.,
2006 ; Ruprecht et coll.,
2009
; Ruprecht et coll.,
2009 ). Cependant, peu de structures
cristallographiques du complexe mitochondrial SQR ont été
publiées et de nombreux articles portent sur des
comparaisons de séquences non validées au plan d’une
structure à résolution atomique. Ainsi si les structures
sont semblables, elles peuvent différer légèrement entre
espèces avec des affinités différentes pour les inhibiteurs
au site de liaison de l’ubiquinone.
). Cependant, peu de structures
cristallographiques du complexe mitochondrial SQR ont été
publiées et de nombreux articles portent sur des
comparaisons de séquences non validées au plan d’une
structure à résolution atomique. Ainsi si les structures
sont semblables, elles peuvent différer légèrement entre
espèces avec des affinités différentes pour les inhibiteurs
au site de liaison de l’ubiquinone. | Figure 20.5 Représentation schématique de l’interaction
des SDHi avec le site de liaison de l’ubiquinone du
complexe II mitochondrial (d’après Bénit et coll.,
2019 ) ) |
Inhibition in vitro de l’activité de la succinate déshydrogénase de différentes espèces par les SDHi
 ) (Bénit et coll.,
2019
) (Bénit et coll.,
2019 ). Cependant, il faut noter que la
préparation des extraits varie en fonction de l’espèce,
allant d’une purification de mitochondries (B.
cinerea, Apis mellifera), sans indication de
critères de qualité des préparations mitochondriales, à un
lysat (Lumbricus terrestris, Homo sapiens) et
réalisée à partir d’une seule préparation par organisme.
). Cependant, il faut noter que la
préparation des extraits varie en fonction de l’espèce,
allant d’une purification de mitochondries (B.
cinerea, Apis mellifera), sans indication de
critères de qualité des préparations mitochondriales, à un
lysat (Lumbricus terrestris, Homo sapiens) et
réalisée à partir d’une seule préparation par organisme. ). Cette différence (facteur
d’environ 800 fois) est expliquée par la liaison plus forte
du flutolanil dans la structure de la SDH d’ascaris évaluée
d’après des données cristallographiques (Inaoka et coll.,
2015
). Cette différence (facteur
d’environ 800 fois) est expliquée par la liaison plus forte
du flutolanil dans la structure de la SDH d’ascaris évaluée
d’après des données cristallographiques (Inaoka et coll.,
2015 ). D’autres études, publiées par
des industriels des phytosanitaires, ont comparé les
IC50 des SDHi entre espèces. Nakano et coll.
ont montré que les IC50 du pyflubumide pour la
SDH d’un acarien (Tetranychus urticae), du rat et de
la truite présentent une variabilité importante, de l’ordre
de 400 fois (Nakano et coll.,
2015
). D’autres études, publiées par
des industriels des phytosanitaires, ont comparé les
IC50 des SDHi entre espèces. Nakano et coll.
ont montré que les IC50 du pyflubumide pour la
SDH d’un acarien (Tetranychus urticae), du rat et de
la truite présentent une variabilité importante, de l’ordre
de 400 fois (Nakano et coll.,
2015 ). Une deuxième étude a montré
des différences d’IC50 entre 7 800 et 17 700 fois
entre la souris et deux champignons (B. cinerea et
Sclerotinia sclerotiorum) respectivement pour le
pyraziflumid, mais cet article ne précise pas la nature des
échantillons biologiques sur lesquels les mesures ont été
réalisées (Kikutake et coll.,
2020
). Une deuxième étude a montré
des différences d’IC50 entre 7 800 et 17 700 fois
entre la souris et deux champignons (B. cinerea et
Sclerotinia sclerotiorum) respectivement pour le
pyraziflumid, mais cet article ne précise pas la nature des
échantillons biologiques sur lesquels les mesures ont été
réalisées (Kikutake et coll.,
2020 ). Les études disponibles
suggèrent donc que les valeurs d’IC50 pourraient
être très différentes d’une espèce à l’autre mais ne
permettent pas d’évaluer objectivement la spécificité des
SDHi vis-à-vis des champignons au regard d’espèces
non-cibles. Cette caractérisation requiert des études
supplémentaires rigoureuses, en particulier quant à la
nature, l’homogénéité et la préparation des échantillons
biologiques sur lesquels sont mesurées les
IC50.
). Les études disponibles
suggèrent donc que les valeurs d’IC50 pourraient
être très différentes d’une espèce à l’autre mais ne
permettent pas d’évaluer objectivement la spécificité des
SDHi vis-à-vis des champignons au regard d’espèces
non-cibles. Cette caractérisation requiert des études
supplémentaires rigoureuses, en particulier quant à la
nature, l’homogénéité et la préparation des échantillons
biologiques sur lesquels sont mesurées les
IC50. | Figure 20.6 Potentiel inhibiteur des SDHi sur la SDH
mesurée sur des préparations de mitochondries de
différents organismes (d’après Bénit et coll.,
2019 ) ) |
Sensibilité aux SDHi de cellules de patients présentant un dysfonctionnement de la chaîne respiratoire
 ). Les auteurs de cette étude, à
partir de ces données limitées soulèvent l’hypothèse que les
personnes atteintes d’un dysfonctionnement mitochondrial, en
particulier touchant la chaîne respiratoire, pourraient
présenter une susceptibilité accrue aux éventuels effets
toxiques des SDHi.
). Les auteurs de cette étude, à
partir de ces données limitées soulèvent l’hypothèse que les
personnes atteintes d’un dysfonctionnement mitochondrial, en
particulier touchant la chaîne respiratoire, pourraient
présenter une susceptibilité accrue aux éventuels effets
toxiques des SDHi.Génotoxicité et cancérogénicité
 ). Une étude provenant d’une équipe de recherche académique
s’intéressant à l’effet du bénodanil sur des lymphocytes humains
rapporte un résultat négatif pour l’essai du micronoyau qui
évalue un effet de cassure ou d’anomalie de répartition des
chromosomes entre les cellules filles (effet clastogène ou
aneugène, respectivement) (Akyil et coll.,
2016
). Une étude provenant d’une équipe de recherche académique
s’intéressant à l’effet du bénodanil sur des lymphocytes humains
rapporte un résultat négatif pour l’essai du micronoyau qui
évalue un effet de cassure ou d’anomalie de répartition des
chromosomes entre les cellules filles (effet clastogène ou
aneugène, respectivement) (Akyil et coll.,
2016 ).
). ), avec
pour certains un dimorphisme sexuel puisque les atteintes ne
sont pas les mêmes chez les animaux mâles et les femelles
(tumeurs hépatiques et thyroïdiennes, astrocytomes).
), avec
pour certains un dimorphisme sexuel puisque les atteintes ne
sont pas les mêmes chez les animaux mâles et les femelles
(tumeurs hépatiques et thyroïdiennes, astrocytomes).
Tableau 20.V Génotoxicité, cancérogénicité et classification
cancérogène des fongicides SDHi autorisés au niveau européen
(d’après Anses, 2019 ; rapports Efsa, site de
l’Echa1)
; rapports Efsa, site de
l’Echa1)
|
Substance active
|
Génotoxicité
|
Cancérogénicité
|
Proposition de classification
Efsa
|
Classification Echa
|
|---|---|---|---|---|
|
Benzovindiflupyr
|
Non
|
Tumeurs thyroïdiennes (rat)
|
Non classé
|
Non classé
|
|
Bixafène
|
Non
|
Non
|
Non classé
|
Non classé
|
|
Boscalide
|
Non
|
Non
|
Non classé
|
Non classé
|
|
Carboxine
|
Oui in vitro
Non in vivo |
Hépatocarcinomes (rat) ; adénomes
pulmonaires (souris)
|
Carc 32
|
Non classé
|
|
Fluopyram
|
Non
|
Adénomes et carcinomes hépatiques (rats
femelles) ; adénomes folliculaires de la thyroïde
(souris mâles)
|
Carc 33
|
Non classé
|
|
Flutolanil
|
Non
|
Non
|
Non classé
|
Non classé
En cours |
|
Fluxapyroxad
|
Non
|
Tumeurs hépatiques (rat) ; adénomes
folliculaires de la thyroïde (rats
mâles)
|
Carc 2
|
Non classé
|
|
Isofétamide
|
Non
|
Non
|
Non classé
|
Non classé
|
|
Isopyrazam
|
Non
|
Adénomes hépatocellulaires (rat) et
adénocarcinomes utérins (rat)
|
Carc 2
|
En cours
|
|
Penflufène
|
Non
|
Adénome hépatique (rats mâles) ;
carcinome hépatique (rat) ; adénomes ovariens
(rat) ; astrocytomes (rats mâles) ; sarcomes
histiocytaires (rats mâles)
|
Carc 2
|
Carc 2
|
|
Penthiopyrade
|
Non
|
Adénomes folliculaires de la thyroïde
(rats mâles) ; adénomes hépatiques et
hépatocarcinomes (souris mâles)
|
Carc 2
|
Non classé
|
|
Sédaxane
|
Non
|
Adénomes hépatiques et thyroïdiens
(rats mâles), adénocarcinomes utérins (rat) ;
adénomes hépatiques (souris mâles)
|
Carc 2
|
Carc 2
|
Classification harmonisée (Règlement CE
no 1272/2008) Carc 2 : « susceptible de
provoquer le cancer » ; Carc 3 : « effet cancérogène
suspecté, preuves insuffisantes ». Le cyflumétofène, un
insecticide SDHi autorisé au niveau européen, est classé par
Echa comme non génotoxique et fait l’objet d’une
classification Carc 2.
1 https://www.echa.europa.eu/fr/information-on-chemicals
[consulté le 1er avril
2020].
2 Source : https://efsa.onlinelibrary.wiley.com/doi/epdf/10.2903/j.efsa.2010.1857
[consulté le 27 août 2020]. À noter que la classification
Efsa indiquée dans l’avis de l’Anses est « Carc 2 » (Anses,
2019 ).
).
3 Source :
https://efsa.onlinelibrary.wiley.com/doi/epdf/10.2903/j.efsa.2013.3052
[consulté le 27 août 2020]. À noter que la classification
Efsa indiquée dans l’avis de l’Anses est « Carc 2 » (Anses,
2019 ).
).
 ; Tinwell et coll.,
2014
; Tinwell et coll.,
2014 ; Peffer et coll., 2018
; Peffer et coll., 2018 ; Plummer et coll.,
2018
; Plummer et coll.,
2018 ) ou d’études non publiées mais référencées en interne lors de
l’évaluation réglementaire, le mécanisme d’action rapporté pour
rendre compte des effets cancérigènes des SDHi évoque
l’activation du récepteur nucléaire CAR (constitutive
androstane receptor). Principalement considéré comme un
récepteur de xénobiotiques (par exemple des pesticides et des
médicaments) très exprimé dans le foie et l’intestin, mais se
liant également à des molécules endogènes, l’activation de CAR
déclenche la régulation transcriptionnelle d’enzymes (de la
famille des cytochromes, des uridine diphospho
glucuronyltransférases...) et de transporteurs intervenant dans
la métabolisation et l’élimination de substances exogènes et
endogènes. Son activation dans les hépatocytes de souris ou de
rats stimule la synthèse de l’ADN et la prolifération
cellulaire, favorisant ainsi le développement de lésions
prénéoplasiques focales (nodules hyperplasiques) qui peuvent
conduire à des tumeurs du foie bénignes (adénomes) ou malignes
(carcinomes). Toutefois, ce mécanisme est considéré comme
spécifique aux rongeurs car de nombreuses études in vitro
et in vivo montrent que l’activation de CAR dans les
cellules humaines n’induit pas la synthèse de l’ADN, comme il a
été largement documenté pour l’hépato-cancérogenèse
différentielle du phénobarbital entre le rat et l’être humain
(Elcombe et coll., 2014
) ou d’études non publiées mais référencées en interne lors de
l’évaluation réglementaire, le mécanisme d’action rapporté pour
rendre compte des effets cancérigènes des SDHi évoque
l’activation du récepteur nucléaire CAR (constitutive
androstane receptor). Principalement considéré comme un
récepteur de xénobiotiques (par exemple des pesticides et des
médicaments) très exprimé dans le foie et l’intestin, mais se
liant également à des molécules endogènes, l’activation de CAR
déclenche la régulation transcriptionnelle d’enzymes (de la
famille des cytochromes, des uridine diphospho
glucuronyltransférases...) et de transporteurs intervenant dans
la métabolisation et l’élimination de substances exogènes et
endogènes. Son activation dans les hépatocytes de souris ou de
rats stimule la synthèse de l’ADN et la prolifération
cellulaire, favorisant ainsi le développement de lésions
prénéoplasiques focales (nodules hyperplasiques) qui peuvent
conduire à des tumeurs du foie bénignes (adénomes) ou malignes
(carcinomes). Toutefois, ce mécanisme est considéré comme
spécifique aux rongeurs car de nombreuses études in vitro
et in vivo montrent que l’activation de CAR dans les
cellules humaines n’induit pas la synthèse de l’ADN, comme il a
été largement documenté pour l’hépato-cancérogenèse
différentielle du phénobarbital entre le rat et l’être humain
(Elcombe et coll., 2014 ). La problématique de la pertinence
de ce mécanisme d’action pour l’être humain, et donc plus
généralement du recours à des modèles de rongeurs dans le cadre
de l’évaluation du potentiel cancérogène des substances
chimiques fait encore l’objet de débat (Felter et coll.,
2018
). La problématique de la pertinence
de ce mécanisme d’action pour l’être humain, et donc plus
généralement du recours à des modèles de rongeurs dans le cadre
de l’évaluation du potentiel cancérogène des substances
chimiques fait encore l’objet de débat (Felter et coll.,
2018 ). Par ailleurs, les études de cancérogénicité réalisées
révèlent aussi l’apparition de tumeurs dans des tissus exprimant
peu ce récepteur (thyroïde, utérus, ovaire...).
). Par ailleurs, les études de cancérogénicité réalisées
révèlent aussi l’apparition de tumeurs dans des tissus exprimant
peu ce récepteur (thyroïde, utérus, ovaire...). ), le fluopyram, le fluxapyroxade et le penthiopyrade sur la
base d’un mécanisme reliant le métabolisme hépatique et la
fonction thyroïdienne19
. L’activation de CAR induit en effet
l’expression hépatique de l’enzyme UGT1A1
(UDP-glucurunosyltransférase 1 polypeptide A1) qui
intervient dans la clairance des hormones thyroïdiennes (HT) en
stimulant la conjugaison et l’élimination biliaire de la
thyroxine. Ce mécanisme de clairance exerce un rétrocontrôle sur
l’axe hypothalamo-hypophysaire thyroïdien lequel conduit à une
production compensatrice de TSH (thyroxin stimulating
hormone). La TSH, en stimulant la thyroïde, participe à
un processus d’hyperplasie qui, dans le cas d’une activation
chronique, peut conduire à une tumeur. Ce mécanisme n’est pas
transposable à la régulation du taux d’HT chez l’être humain qui
exprime la thyroxine binding globulin (TBG) sérique,
absente chez le rat, avec pour conséquence une demi-vie des HT
plus courte chez le rat. De plus, la glande thyroïde stocke une
quantité de thyroglobuline bien plus élevée chez l’être humain
ce qui limite le recours à un état d’hyperplasie compensatrice
(Hurley, 1998
), le fluopyram, le fluxapyroxade et le penthiopyrade sur la
base d’un mécanisme reliant le métabolisme hépatique et la
fonction thyroïdienne19
. L’activation de CAR induit en effet
l’expression hépatique de l’enzyme UGT1A1
(UDP-glucurunosyltransférase 1 polypeptide A1) qui
intervient dans la clairance des hormones thyroïdiennes (HT) en
stimulant la conjugaison et l’élimination biliaire de la
thyroxine. Ce mécanisme de clairance exerce un rétrocontrôle sur
l’axe hypothalamo-hypophysaire thyroïdien lequel conduit à une
production compensatrice de TSH (thyroxin stimulating
hormone). La TSH, en stimulant la thyroïde, participe à
un processus d’hyperplasie qui, dans le cas d’une activation
chronique, peut conduire à une tumeur. Ce mécanisme n’est pas
transposable à la régulation du taux d’HT chez l’être humain qui
exprime la thyroxine binding globulin (TBG) sérique,
absente chez le rat, avec pour conséquence une demi-vie des HT
plus courte chez le rat. De plus, la glande thyroïde stocke une
quantité de thyroglobuline bien plus élevée chez l’être humain
ce qui limite le recours à un état d’hyperplasie compensatrice
(Hurley, 1998 ). Le cas particulier de l’association
entre l’exposition à ces SDHi et la survenue de cancer de la
thyroïde chez les rongeurs n’a pas été jugé pertinent pour
l’être humain par les agences réglementaires, selon la mise en
application du principe de déclassification « mode of
action » en se référant aux critères établis par le
WHO/IPCS (World Health Organization/International Programme
on Chemical Safety) (Boobis et coll.,
2006
). Le cas particulier de l’association
entre l’exposition à ces SDHi et la survenue de cancer de la
thyroïde chez les rongeurs n’a pas été jugé pertinent pour
l’être humain par les agences réglementaires, selon la mise en
application du principe de déclassification « mode of
action » en se référant aux critères établis par le
WHO/IPCS (World Health Organization/International Programme
on Chemical Safety) (Boobis et coll.,
2006 ; Meek et coll., 2014
; Meek et coll., 2014 ).
).Effets sur le développement et le système endocrinien
 ; Yang et coll., 2016a
; Yang et coll., 2016a ; Qian et coll.,
2018a
; Qian et coll.,
2018a ; Teng et coll., 2018
; Teng et coll., 2018 ; Yao et coll.,
2018b
; Yao et coll.,
2018b ; Yao et coll., 2018a
; Yao et coll., 2018a ; Qian et coll.,
2019a
; Qian et coll.,
2019a ; Yang et coll., 2019c
; Yang et coll., 2019c ; Yang et coll.,
2019b
; Yang et coll.,
2019b ; Li et coll., 2020a
; Li et coll., 2020a ; Li et coll.,
2020b
; Li et coll.,
2020b ; Wang et coll., 2020
; Wang et coll., 2020 ). À ces études s’ajoute une étude
française récente qui montre que l’exposition des embryons au
bixafène à des concentrations ≥ 0,2 µM (≥ 0,083 mg/l) provoque
des anomalies du développement cérébral et une inhibition de la
croissance des motoneurones spinaux (Brenet et coll.,
2020
). À ces études s’ajoute une étude
française récente qui montre que l’exposition des embryons au
bixafène à des concentrations ≥ 0,2 µM (≥ 0,083 mg/l) provoque
des anomalies du développement cérébral et une inhibition de la
croissance des motoneurones spinaux (Brenet et coll.,
2020 ).
). ), et le flutolanil qui augmente la
production des hormones thyroïdiennes tri-iodothyronine et
thyroxine, et perturbe l’expression de plusieurs gènes
intervenant dans la fonction thyroïdienne (TRH,
TSHR, TPO, Dio1, TRα, et
UGT1ab) à des concentrations ≥ 0,5 mg/l (Teng et
coll., 2018
), et le flutolanil qui augmente la
production des hormones thyroïdiennes tri-iodothyronine et
thyroxine, et perturbe l’expression de plusieurs gènes
intervenant dans la fonction thyroïdienne (TRH,
TSHR, TPO, Dio1, TRα, et
UGT1ab) à des concentrations ≥ 0,5 mg/l (Teng et
coll., 2018 ). Ces deux SDHi augmentent également
l’expression de la mélatonine et perturbent le cycle circadien
(Yang et coll., 2019c
). Ces deux SDHi augmentent également
l’expression de la mélatonine et perturbent le cycle circadien
(Yang et coll., 2019c ; Yang et coll.,
2019b
; Yang et coll.,
2019b ).
). ; Yang et coll., 2017
; Yang et coll., 2017 ; Yang et coll.,
2018a
; Yang et coll.,
2018a ; Yang et coll., 2018b
; Yang et coll., 2018b ), après 28 jours d’exposition à
0,1 mg/l de boscalide (Qian et coll.,
2019b
), après 28 jours d’exposition à
0,1 mg/l de boscalide (Qian et coll.,
2019b ) et après 60 jours d’exposition à 0,05 mg/l de flutolanil
(Teng et coll., 2019
) et après 60 jours d’exposition à 0,05 mg/l de flutolanil
(Teng et coll., 2019 ). Une induction d’un stress oxydant
et de l’apoptose et une altération du métabolisme des glucides
et des lipides ont également été mises en évidence dans ces
conditions expérimentales. Plus récemment, Qian et coll. ont
montré que les poissons zèbres adultes exposés à 1 mg/l de
boscalide pendant 21 jours présentent des anomalies
histopathologiques de la rétine et du cerveau, ainsi qu’une
diminution de la locomotion et de la capacité de prédation (Qian
et coll., 2021
). Une induction d’un stress oxydant
et de l’apoptose et une altération du métabolisme des glucides
et des lipides ont également été mises en évidence dans ces
conditions expérimentales. Plus récemment, Qian et coll. ont
montré que les poissons zèbres adultes exposés à 1 mg/l de
boscalide pendant 21 jours présentent des anomalies
histopathologiques de la rétine et du cerveau, ainsi qu’une
diminution de la locomotion et de la capacité de prédation (Qian
et coll., 2021 ). En outre, cette étude a mis en
évidence des effets neurotoxiques chez les larves à partir de
4 jours d’exposition à 1,2 mg/l de boscalide.
). En outre, cette étude a mis en
évidence des effets neurotoxiques chez les larves à partir de
4 jours d’exposition à 1,2 mg/l de boscalide. ). Le flutolanil, quant à lui, a un
effet œstrogénique. Les poissons mâles exposés au flutolanil à
des concentrations faibles (≥ 0,25 µg/l) pendant 60 jours
montrent une augmentation de la concentration plasmatique de
17β-estradiol et une diminution de celle de testostérone (Teng
et coll., 2020
). Le flutolanil, quant à lui, a un
effet œstrogénique. Les poissons mâles exposés au flutolanil à
des concentrations faibles (≥ 0,25 µg/l) pendant 60 jours
montrent une augmentation de la concentration plasmatique de
17β-estradiol et une diminution de celle de testostérone (Teng
et coll., 2020 ). L’exposition des poissons femelles
au flutolanil conduit à une augmentation de la concentration
plasmatique de 17β-estradiol et une perturbation du profil de
méthylation génomique dans l’ovaire. Ces modifications ont pour
conséquence des effets néfastes sur la reproduction. Les
embryons issus des croisements des animaux exposés sont plus
petits et ont un taux de mortalité plus élevé. Plus récemment,
ce même groupe a montré que l’exposition pendant 21 jours à
1 mg/l de boscalide est associée à un effet oestrogénique chez
les poissons mâles et que, contrairement au flutolanil, il
possède une activité anti-oestrogénique chez les femelles
(diminution du taux plasmatique de 17β-estradiol et peturbation
de la fertilité) à des concentrations ≥ 0,01 mg/l (Qian et
coll., 2020).
). L’exposition des poissons femelles
au flutolanil conduit à une augmentation de la concentration
plasmatique de 17β-estradiol et une perturbation du profil de
méthylation génomique dans l’ovaire. Ces modifications ont pour
conséquence des effets néfastes sur la reproduction. Les
embryons issus des croisements des animaux exposés sont plus
petits et ont un taux de mortalité plus élevé. Plus récemment,
ce même groupe a montré que l’exposition pendant 21 jours à
1 mg/l de boscalide est associée à un effet oestrogénique chez
les poissons mâles et que, contrairement au flutolanil, il
possède une activité anti-oestrogénique chez les femelles
(diminution du taux plasmatique de 17β-estradiol et peturbation
de la fertilité) à des concentrations ≥ 0,01 mg/l (Qian et
coll., 2020). ). Il est à noter que les rapports d’évaluation des risques de
l’Efsa rapportent des effets perturbateurs endocriniens
potentiels chez les rats pour le benzovindiflupyr (effets sur la
reproduction), et pour le fluopyram et le penflufène, des
lacunes dans les données n’ont pas permis à l’agence de conclure
définitivement à l’absence d’effets perturbateurs endocriniens
(Efsa, 2013
). Il est à noter que les rapports d’évaluation des risques de
l’Efsa rapportent des effets perturbateurs endocriniens
potentiels chez les rats pour le benzovindiflupyr (effets sur la
reproduction), et pour le fluopyram et le penflufène, des
lacunes dans les données n’ont pas permis à l’agence de conclure
définitivement à l’absence d’effets perturbateurs endocriniens
(Efsa, 2013 ; Efsa,
2015
; Efsa,
2015 ; Efsa, 2016
; Efsa, 2016 ).
).Données d’écotoxicologie
SDHi et abeilles
 ). Dans une étude conduite dans
la région Rhône-Alpes, le boscalide est l’un des pesticides
les plus détectés chez les abeilles, à des fréquences au
moins aussi élevées que les néonicotinoïdes (14 %), et à des
concentrations de 1 à 47,6 ng de boscalide/g de poids
corporel (Daniele et coll.,
2018
). Dans une étude conduite dans
la région Rhône-Alpes, le boscalide est l’un des pesticides
les plus détectés chez les abeilles, à des fréquences au
moins aussi élevées que les néonicotinoïdes (14 %), et à des
concentrations de 1 à 47,6 ng de boscalide/g de poids
corporel (Daniele et coll.,
2018 ). La cire ainsi que le pain
d’abeille (nourriture des larves) sont également fréquemment
contaminés par le boscalide par rapport à d’autres
pesticides, avec des niveaux dans le pain d’abeille pouvant
atteindre plus de 700 ng/g de pain (Daniele et coll.,
2018
). La cire ainsi que le pain
d’abeille (nourriture des larves) sont également fréquemment
contaminés par le boscalide par rapport à d’autres
pesticides, avec des niveaux dans le pain d’abeille pouvant
atteindre plus de 700 ng/g de pain (Daniele et coll.,
2018 ). Dans la cire, le boscalide est
détecté dans 39 % des échantillons avec des concentrations
supérieures à 300 ng de boscalide/g de cire (Daniele et
coll., 2018
). Dans la cire, le boscalide est
détecté dans 39 % des échantillons avec des concentrations
supérieures à 300 ng de boscalide/g de cire (Daniele et
coll., 2018 ).
). ). Ces travaux mettent également
en évidence que les abeilles qui collectent ce pollen
rapportent les résidus à la ruche (jusqu’à 21 ng/g), bien
que les quantités de boscalide détectées dans les abeilles
soient moindres, de 0,24 à 9,8 ng/g de poids corporel (David
et coll., 2016
). Ces travaux mettent également
en évidence que les abeilles qui collectent ce pollen
rapportent les résidus à la ruche (jusqu’à 21 ng/g), bien
que les quantités de boscalide détectées dans les abeilles
soient moindres, de 0,24 à 9,8 ng/g de poids corporel (David
et coll., 2016 ). Ces variations soulignent les
différences de contamination des abeilles en fonction des
régions et donc des cultures et traitements des parcelles.
Dans une étude subséquente menée dans la même région, ces
auteurs ont montré également une haute fréquence de
détection du boscalide dans 35 % des bourdons sauvages, à
des concentrations allant jusqu’à 54,5 ng/g et une
variabilité de la contamination en fonction des espèces de
bourdons et en fonction de la saison (Botias et coll.,
2017
). Ces variations soulignent les
différences de contamination des abeilles en fonction des
régions et donc des cultures et traitements des parcelles.
Dans une étude subséquente menée dans la même région, ces
auteurs ont montré également une haute fréquence de
détection du boscalide dans 35 % des bourdons sauvages, à
des concentrations allant jusqu’à 54,5 ng/g et une
variabilité de la contamination en fonction des espèces de
bourdons et en fonction de la saison (Botias et coll.,
2017 ). Il est à noter que bien que le
niveau de contamination soit globalement plus élevé dans les
zones arables (jusqu’à 31,7 ng/g de poids corporel), le
boscalide est aussi détecté dans des bourdons collectés en
zone urbaine (jusqu’à 54 ng/g de poids corporel). Enfin, une
exposition de larves à la Pristine (une formulation
contenant du boscalide) affecte leur survie à l’âge adulte,
avec un effet significativement potentialisé en mélange avec
d’autres résidus d’insecticides à faible dose (Wade et
coll., 2019
). Il est à noter que bien que le
niveau de contamination soit globalement plus élevé dans les
zones arables (jusqu’à 31,7 ng/g de poids corporel), le
boscalide est aussi détecté dans des bourdons collectés en
zone urbaine (jusqu’à 54 ng/g de poids corporel). Enfin, une
exposition de larves à la Pristine (une formulation
contenant du boscalide) affecte leur survie à l’âge adulte,
avec un effet significativement potentialisé en mélange avec
d’autres résidus d’insecticides à faible dose (Wade et
coll., 2019 ).
). ). Le temps létal 50 %
(TL50 ; temps d’exposition pour lequel la
mortalité de la population d’abeilles est de 50 % à une
concentration de substance active donnée) est de 25 jours
pour la concentration de boscalide la plus faible testée
(1,125 mg/l). De plus, la concentration létale 50 %
(CL50 ; concentration de substance active
pour laquelle 50 % de la population d’abeilles est morte
après une période d’exposition donnée) est dix fois plus
élevée à 8 jours qu’à 25 jours (respectivement 14,7 et
1,17 mg/l). Ces observations, qui méritent d’être
reproduites, soulignent le fait que les approches
« exposition jusqu’à la mort » sont plus pertinentes que les
approches « exposition à durée fixe », en particulier pour
les doses d’exposition faibles (Simon-Delso et coll.,
2018
). Le temps létal 50 %
(TL50 ; temps d’exposition pour lequel la
mortalité de la population d’abeilles est de 50 % à une
concentration de substance active donnée) est de 25 jours
pour la concentration de boscalide la plus faible testée
(1,125 mg/l). De plus, la concentration létale 50 %
(CL50 ; concentration de substance active
pour laquelle 50 % de la population d’abeilles est morte
après une période d’exposition donnée) est dix fois plus
élevée à 8 jours qu’à 25 jours (respectivement 14,7 et
1,17 mg/l). Ces observations, qui méritent d’être
reproduites, soulignent le fait que les approches
« exposition jusqu’à la mort » sont plus pertinentes que les
approches « exposition à durée fixe », en particulier pour
les doses d’exposition faibles (Simon-Delso et coll.,
2018 ).
). ; Campbell et coll.,
2016
; Campbell et coll.,
2016 ). Il est important de noter que
de tels symptômes rendent les abeilles vulnérables à
d’autres stresseurs environnementaux, comme les parasites
(Nosema ceranae) et les pathogènes. Ainsi,
associé à N. ceranae, le boscalide impacte la
composition du microbiote intestinal des abeilles
(alpha-protéobactéries et gamma-protéobactéries) dont
l’importance dans la régulation de la fonction du système
nerveux est de plus en plus soulignée (Paris et coll.,
2020
). Il est important de noter que
de tels symptômes rendent les abeilles vulnérables à
d’autres stresseurs environnementaux, comme les parasites
(Nosema ceranae) et les pathogènes. Ainsi,
associé à N. ceranae, le boscalide impacte la
composition du microbiote intestinal des abeilles
(alpha-protéobactéries et gamma-protéobactéries) dont
l’importance dans la régulation de la fonction du système
nerveux est de plus en plus soulignée (Paris et coll.,
2020 ). À titre d’exemple, une étude
récente démontre que le boscalide réduit la fréquence de
battement d’ailes des butineuses pendant le vol, sans
modifier toutefois la durée du vol, ainsi que l’efficacité
des butineuses au niveau de la colonie (Liao et coll.,
2019
). À titre d’exemple, une étude
récente démontre que le boscalide réduit la fréquence de
battement d’ailes des butineuses pendant le vol, sans
modifier toutefois la durée du vol, ainsi que l’efficacité
des butineuses au niveau de la colonie (Liao et coll.,
2019 ). De plus, la Pristine modifie
le comportement relatif à la reconnaissance du nid chez les
abeilles solitaires (Artz et Pitts-Singer,
2015
). De plus, la Pristine modifie
le comportement relatif à la reconnaissance du nid chez les
abeilles solitaires (Artz et Pitts-Singer,
2015 ).
).SDHi et écosystèmes aquatiques
 ; Gandar et coll.,
2017
; Gandar et coll.,
2017 ). En plus de constituer un modèle
de choix pour les études de toxicologie (voir ci-dessus),
les poissons sont des indicateurs sensibles de la qualité
des écosystèmes aquatiques.
). En plus de constituer un modèle
de choix pour les études de toxicologie (voir ci-dessus),
les poissons sont des indicateurs sensibles de la qualité
des écosystèmes aquatiques. ). De nombreux fongicides SDHi
sont commercialisés sous forme de formulations contenant,
outre la ou les substances actives, d’autres composés
(tensioactifs, solvants, stabilisants, antimoussants,
conservateurs...) qui peuvent posséder leur propre toxicité
et/ou interférer avec les substances actives. Ces
formulations peuvent contenir plus d’une substance active
SDHi, ou un SDHi avec un fongicide de la famille des
triazoles qui inhibe la synthèse des stérols. D’autres
contiennent des fongicides de la famille des strobilurines
(pyraclostrobine, dimoxystrobine, fluoxastrobine,
krésoxime-méthyle) qui inhibent la respiration cellulaire en
agissant sur le complexe III de la chaîne respiratoire et
qui pourraient donc potentialiser les effets des SDHi sur la
fonction mitochondriale. En effet, l’exposition des embryons
de xénope à un mélange de deux SDHi (bixafène et
l’isopyrazam) ou d’un SDHi et une strobilurine entraîne des
effets toxiques synergiques (Wu et coll.,
2018
). De nombreux fongicides SDHi
sont commercialisés sous forme de formulations contenant,
outre la ou les substances actives, d’autres composés
(tensioactifs, solvants, stabilisants, antimoussants,
conservateurs...) qui peuvent posséder leur propre toxicité
et/ou interférer avec les substances actives. Ces
formulations peuvent contenir plus d’une substance active
SDHi, ou un SDHi avec un fongicide de la famille des
triazoles qui inhibe la synthèse des stérols. D’autres
contiennent des fongicides de la famille des strobilurines
(pyraclostrobine, dimoxystrobine, fluoxastrobine,
krésoxime-méthyle) qui inhibent la respiration cellulaire en
agissant sur le complexe III de la chaîne respiratoire et
qui pourraient donc potentialiser les effets des SDHi sur la
fonction mitochondriale. En effet, l’exposition des embryons
de xénope à un mélange de deux SDHi (bixafène et
l’isopyrazam) ou d’un SDHi et une strobilurine entraîne des
effets toxiques synergiques (Wu et coll.,
2018 ). Cela souligne l’importance de
tester non seulement les substances actives mais aussi les
formulations dans des études de toxicologie.
). Cela souligne l’importance de
tester non seulement les substances actives mais aussi les
formulations dans des études de toxicologie. ).
). ).
).SDHi et écosystèmes du sol
 ). Mais, ils présentent aussi
l’inconvénient de détruire de nombreux organismes vivants
utiles. En effet, les travaux récemment publiés par Bénit et
coll. montrent que les principaux SDHi bloquent la SDH du
ver de terre (Bénit et coll.,
2019
). Mais, ils présentent aussi
l’inconvénient de détruire de nombreux organismes vivants
utiles. En effet, les travaux récemment publiés par Bénit et
coll. montrent que les principaux SDHi bloquent la SDH du
ver de terre (Bénit et coll.,
2019 ). Le fluopyram et la carboxine
sont fortement toxiques pour le ver de terre Eisenia
andrei, avec un blocage des mécanismes de
détoxication qui concourt à la rétention de ces pesticides
dans les organismes (Velki et coll.,
2019
). Le fluopyram et la carboxine
sont fortement toxiques pour le ver de terre Eisenia
andrei, avec un blocage des mécanismes de
détoxication qui concourt à la rétention de ces pesticides
dans les organismes (Velki et coll.,
2019 ). Le thifluzamide inhibe la
croissance et la reproduction des vers à des doses de
10 mg/kg de sol après 28 jours. Cela est associé à un
blocage de la SDH dès 1 mg/kg de sol (Yao et coll.,
2020
). Le thifluzamide inhibe la
croissance et la reproduction des vers à des doses de
10 mg/kg de sol après 28 jours. Cela est associé à un
blocage de la SDH dès 1 mg/kg de sol (Yao et coll.,
2020 ). Des études sur le polychète
estuarien Simplisetia aequisetis en Australie
montrent que des doses sub-létales de boscalide modifient
précocement (48 h) le métabolome du ver, avec une forte
altération du cycle de Krebs, et des voies de détoxication
impliquées dans la synthèse de glutathion, probablement
mobilisées pour éliminer le boscalide. Cela se traduit
ensuite au niveau physiologique par une baisse de réserves
énergétiques lipidiques et une augmentation de la mortalité
après 336 h d’exposition (Sinclair et coll.,
2019
). Des études sur le polychète
estuarien Simplisetia aequisetis en Australie
montrent que des doses sub-létales de boscalide modifient
précocement (48 h) le métabolome du ver, avec une forte
altération du cycle de Krebs, et des voies de détoxication
impliquées dans la synthèse de glutathion, probablement
mobilisées pour éliminer le boscalide. Cela se traduit
ensuite au niveau physiologique par une baisse de réserves
énergétiques lipidiques et une augmentation de la mortalité
après 336 h d’exposition (Sinclair et coll.,
2019 ). Par ailleurs, la carboxine
associée au thirame, un fongicide non-SDHi, à des doses
supérieures à 50 mg/kg de sol inhibe la reproduction et
modifie le comportement d’évitement du ver E. andrei
(Alves et coll., 2013
). Par ailleurs, la carboxine
associée au thirame, un fongicide non-SDHi, à des doses
supérieures à 50 mg/kg de sol inhibe la reproduction et
modifie le comportement d’évitement du ver E. andrei
(Alves et coll., 2013 ).
).Données épidémiologiques : exposition aux SDHi
et survenue de pathologies
 ).
Cette étude réalisée au sein de la cohorte ELFE en France a révélé
la présence de boscalide dans les cheveux des mères
(195 échantillons positifs pour la présence de boscalide sur
311 échantillons de cheveux de mères testés) mais n’a pas montré
d’association entre l’exposition maternelle au boscalide (estimée
par la mesure de sa concentration dans les cheveux, médiane des
concentrations mesurées de 0,55 pg/mg de cheveu) et les paramètres
anthropométriques des enfants à la naissance (poids, taille et
périmètre crânien), suggérant l’absence d’association de
l’exposition au boscalide pendant la grossesse sur la croissance
intra-utérine.
).
Cette étude réalisée au sein de la cohorte ELFE en France a révélé
la présence de boscalide dans les cheveux des mères
(195 échantillons positifs pour la présence de boscalide sur
311 échantillons de cheveux de mères testés) mais n’a pas montré
d’association entre l’exposition maternelle au boscalide (estimée
par la mesure de sa concentration dans les cheveux, médiane des
concentrations mesurées de 0,55 pg/mg de cheveu) et les paramètres
anthropométriques des enfants à la naissance (poids, taille et
périmètre crânien), suggérant l’absence d’association de
l’exposition au boscalide pendant la grossesse sur la croissance
intra-utérine.Exposition potentielle au flutolanil lors de la culture de pommes de terre
 ). De même, pour les tumeurs cérébrales, les cultivateurs de
pommes de terre présentaient une élévation de risque, plus
marquée chez ceux qui utilisaient des pesticides (HR = 2,11 ;
IC 95 % [1,19-3,75]) et ceux qui traitaient les semences/plants
(HR = 2,84 ; IC 95 % [1,34-6,03]) (Piel et coll.,
2017
). De même, pour les tumeurs cérébrales, les cultivateurs de
pommes de terre présentaient une élévation de risque, plus
marquée chez ceux qui utilisaient des pesticides (HR = 2,11 ;
IC 95 % [1,19-3,75]) et ceux qui traitaient les semences/plants
(HR = 2,84 ; IC 95 % [1,34-6,03]) (Piel et coll.,
2017 ). Cependant, il n’a pas été mené d’analyse spécifiquement sur
le flutolanil, et diverses autres molécules ont été utilisées
pour ces traitements.
). Cependant, il n’a pas été mené d’analyse spécifiquement sur
le flutolanil, et diverses autres molécules ont été utilisées
pour ces traitements.Exposition potentielle au boscalide
Exposition potentielle à la carboxine par le traitement de semences
 ). Une augmentation de risque, non statistiquement
significative, a également été retrouvée pour le traitement des
semences et le cancer de la vessie (HR = 1,24 ; IC 95 %
[0,77-1,99]) (Boulanger et coll.,
2017
). Une augmentation de risque, non statistiquement
significative, a également été retrouvée pour le traitement des
semences et le cancer de la vessie (HR = 1,24 ; IC 95 %
[0,77-1,99]) (Boulanger et coll.,
2017 ). Il n’est pas possible de déterminer le rôle spécifique de
la carboxine dans ces élévations de risque.
). Il n’est pas possible de déterminer le rôle spécifique de
la carboxine dans ces élévations de risque.Conclusion
 )
telles que les SDHi. Le groupe d’experts international de l’OCDE a
reconnu dans cette déclaration de consensus le besoin d’élargir
l’évaluation avec des essais in vitro/ex vivo, selon
une approche intégrative basée sur le concept des voies d’effets
indésirables (adverse outcome pathway), qui consiste à
décrire une séquence logique d’évènements liés de façon causale à
différents niveaux d’organisation biologique. Certains mécanismes
identifiés par l’OCDE sont pertinents pour les SDHi, dont le stress
oxydant et l’épigénotoxicité, alors que d’autres mécanismes
d’intérêt qui n’ont pas été retenus, pourraient inclure notamment la
mitotoxicité et la transition épithélio-mésenchymateuse. Les tests
visant à établir le caractère cancérogène ou non d’une substance
pourraient également intégrer la notion d’impact sur la progression
tumorale (promotion/métastase), le processus d’initiation criblé
notamment par les tests de génotoxicité et de mutagénicité n’étant
pas le seul impliqué dans la cancérogenèse. Cependant, faire des
recommandations précises sur l’amélioration des essais et des
modèles en toxicologie réglementaire nécessiterait d’analyser
l’ensemble des processus et des essais utilisés, ce qui dépasse
largement le cadre de cette expertise.
)
telles que les SDHi. Le groupe d’experts international de l’OCDE a
reconnu dans cette déclaration de consensus le besoin d’élargir
l’évaluation avec des essais in vitro/ex vivo, selon
une approche intégrative basée sur le concept des voies d’effets
indésirables (adverse outcome pathway), qui consiste à
décrire une séquence logique d’évènements liés de façon causale à
différents niveaux d’organisation biologique. Certains mécanismes
identifiés par l’OCDE sont pertinents pour les SDHi, dont le stress
oxydant et l’épigénotoxicité, alors que d’autres mécanismes
d’intérêt qui n’ont pas été retenus, pourraient inclure notamment la
mitotoxicité et la transition épithélio-mésenchymateuse. Les tests
visant à établir le caractère cancérogène ou non d’une substance
pourraient également intégrer la notion d’impact sur la progression
tumorale (promotion/métastase), le processus d’initiation criblé
notamment par les tests de génotoxicité et de mutagénicité n’étant
pas le seul impliqué dans la cancérogenèse. Cependant, faire des
recommandations précises sur l’amélioration des essais et des
modèles en toxicologie réglementaire nécessiterait d’analyser
l’ensemble des processus et des essais utilisés, ce qui dépasse
largement le cadre de cette expertise.Addenda
Mitochondrie et chaîne respiratoire
 . Elle
comporte deux compartiments séparés par une membrane externe et
une membrane interne : la matrice et l’espace intermembranaire.
La membrane interne forme des invaginations qui apparaissent
sous forme de crêtes ou replis qui augmentent la surface de la
membrane et dont le nombre varie selon l’activité mitochondriale
(respiration cellulaire, oxydation des acides gras...). Les
complexes de la chaîne respiratoire sont situés au niveau de ces
crêtes.
. Elle
comporte deux compartiments séparés par une membrane externe et
une membrane interne : la matrice et l’espace intermembranaire.
La membrane interne forme des invaginations qui apparaissent
sous forme de crêtes ou replis qui augmentent la surface de la
membrane et dont le nombre varie selon l’activité mitochondriale
(respiration cellulaire, oxydation des acides gras...). Les
complexes de la chaîne respiratoire sont situés au niveau de ces
crêtes. ). Elle
est couplée avec l’ATP synthase (parfois appelée complexe V),
également localisée dans la membrane interne, qui accomplit la
phosphorylation oxydative de l’ADP en ATP. La chaîne
respiratoire est reliée au cycle de Krebs, qui lui fournit une
partie des équivalents réduits (NADH, FADH2)
nécessaire à la synthèse d’ATP. Les électrons provenant du NADH
et FADH2 sont respectivement transmis aux complexes I
et II, puis transitent par les complexes III et IV pour être
enfin transmis au dioxygène, accepteur final. L’énergie ainsi
libérée par le passage des électrons d’un complexe au suivant
est utilisée pour pomper des protons (H+) par
l’intermédiaire des complexes I, III et V, depuis la matrice
mitochondriale vers l’espace intermembranaire. Ce mouvement de
protons crée un gradient de pH de part et d’autre de la membrane
interne mitochondriale (le pH devient plus acide dans l’espace
intermembranaire que dans la matrice) et engendre un potentiel
de membrane (Δψm) à travers la membrane interne de la
mitochondrie dû au déséquilibre de charges positives. La
résultante de ces deux forces constitue un gradient
électrochimique qui est employé par l’ATP synthase qui catalyse
la conversion d’ADP + Pi en ATP.
). Elle
est couplée avec l’ATP synthase (parfois appelée complexe V),
également localisée dans la membrane interne, qui accomplit la
phosphorylation oxydative de l’ADP en ATP. La chaîne
respiratoire est reliée au cycle de Krebs, qui lui fournit une
partie des équivalents réduits (NADH, FADH2)
nécessaire à la synthèse d’ATP. Les électrons provenant du NADH
et FADH2 sont respectivement transmis aux complexes I
et II, puis transitent par les complexes III et IV pour être
enfin transmis au dioxygène, accepteur final. L’énergie ainsi
libérée par le passage des électrons d’un complexe au suivant
est utilisée pour pomper des protons (H+) par
l’intermédiaire des complexes I, III et V, depuis la matrice
mitochondriale vers l’espace intermembranaire. Ce mouvement de
protons crée un gradient de pH de part et d’autre de la membrane
interne mitochondriale (le pH devient plus acide dans l’espace
intermembranaire que dans la matrice) et engendre un potentiel
de membrane (Δψm) à travers la membrane interne de la
mitochondrie dû au déséquilibre de charges positives. La
résultante de ces deux forces constitue un gradient
électrochimique qui est employé par l’ATP synthase qui catalyse
la conversion d’ADP + Pi en ATP. | Figure A20.2 Représentation schématique des complexes de la
chaîne respiratoire mitochondriale et du système de
phosphorylation oxydative (d’après Lemarie et Grimm,
2011 ) ) |
Pathologies liées à un déficit de la chaîne respiratoire
 ).
).Pesticides SDHi non autorisés au niveau européen
Tableau A20.I Les pesticides SDHi non autorisés au niveau européen
|
Substances actives
|
Type
de pesticide |
Principaux types de traitement,
cultures
|
Régions/pays où la SA est utilisée,
date d’autorisation
|
Statut réglementaire
européen
|
|---|---|---|---|---|
|
Cyenopyrafène
|
Insecticide
|
Arboriculture, vigne
|
Japon (2009)
|
–
|
|
Inpyrfluxame
|
Fongicide
|
Parties aériennes ; arboriculture,
légumes
|
Japon (2020)
|
Demande d’autorisation en cours
d’examen
|
|
Isoflucyprame
|
Fongicide
|
Céréales
|
Nouvelle Zélande (2019)
|
Demande d’autorisation en cours
d’examen
|
|
Fluindapyr
|
Fongicide
|
–
|
–
|
Demande d’autorisation en cours
d’examen
|
|
Furametpyr
|
Fongicide
|
Riz
|
Japon (1996)
|
Objet d’une demande d’enregistrement
préalable auprès de l’Echa
|
|
Pydiflumétofène
|
Fongicide
|
Parties aériennes ; céréales, maïs,
cacahuètes, pommes de terre, vigne, melon, plantes
ornementales
|
Argentine (2016), Uruguay,
Australie
|
Demande d’autorisation en cours
d’examen
|
|
Pyflubumide
|
Insecticide
|
–
|
Japon (2015), Corée
|
–
|
|
Pyraziflumid
|
Fongicide
|
Fruits, légumes
|
Japon (2018), Corée
|
–
|
|
Thifluzamide
|
Fongicide
|
Parties aériennes ; riz, pommes de
terre, maïs, cacahuètes, coton, café
|
1997, Amérique du Sud, Asie
|
L’objet d’une demande d’enregistrement
préalable auprès de l’Echa
|
Sources : Anses,
2019 ; Pesticide Properties
DataBase (https://sitem.herts.ac.uk/aeru/ppdb/
[consulté le 14 mai 2020]), rapports Efsa et Echa (EU
Pesticide Database : https://ec.europa.eu/food/plant/pesticides/eu-pesticides-database
[consulté le 14 mai 2020]) et les sites des entreprises
agrochimiques.
; Pesticide Properties
DataBase (https://sitem.herts.ac.uk/aeru/ppdb/
[consulté le 14 mai 2020]), rapports Efsa et Echa (EU
Pesticide Database : https://ec.europa.eu/food/plant/pesticides/eu-pesticides-database
[consulté le 14 mai 2020]) et les sites des entreprises
agrochimiques.
Algorithmes de recherche bibliographique pour identifier des études portant sur les effets sanitaires des fongicides SDHi
SDHi et pesticides (PubMed/Scopus/WoS)
Nom des familles SDHi et pesticides (PubMed/Scopus/WoS)
SDHi et épidémiologie (PubMed)
Nom des familles SDHi et épidémiologie (PubMed)
Nom des substances actives SDHi116 et épidémiologie (PubMed)
SDHi et exposition des agriculteurs (PubMed/Scopus/WoS)
Traitement des semences et épidémiologie (PubMed)
Traitement des semences et exposition des agriculteurs (PubMed)
Exposition des agriculteurs lors du traitement des pommes de terre (PubMed/Scopus/WoS)
Références






















 •
•

































 •
•




 •
•












 •
•



 •
•


 •
•

 •
•

































 •
•












 •
•


 •
•










 •
•








 •
•















 •
•






























→ Aller vers SYNTHESE