| |
| Med Sci (Paris). 36(1): 9–11. doi: 10.1051/medsci/2019252.Un engramme ocytocinergique pour apprendre et contrôler
sa peur Angel Baudon1 and Alexandre Charlet1* 1CNRS et université de Strasbourg, institut des neurosciences
cellulaires et intégratives (INCI, UPR3212), 8 allée du Général Rouvillois,
67000Strasbourg,
France MeSH keywords: Conditionnement (psychologie), Peur, Humains, Imprégnation (psychologie), Apprentissage, Consolidation de la mémoire, Ocytocine, Sang-froid, physiologie, psychologie, métabolisme |
La mémoire est un processus permettant aux êtres vivants de stocker des informations
afin de mieux s’adapter à leur environnement. L’idée d’une représentation physique
de la mémoire remonte à plus de 2 000 ans. En 350 avant J.-C., Aristote théorisait
que « le processus de stimulation sensorielle marque une sorte d’impression
du percept, juste comme un sceau laisse son empreinte dans une cire
chaude » [1].
Cette idée a progressivement conduit à l’hypothèse selon laquelle des ensembles de
cellules, organisés et sélectivement activés, forment les blocs de base de la trace
mnésique, l’engramme. Cette hypothèse constitue aujourd’hui un champ majeur
d’investigations, guidant l’étude des mécanismes cellulaires et moléculaires
sous-jacents à l’encodage et la préservation de la mémoire, qui restent pourtant
encore mal connus. Ainsi, les informations seraient encodées par l’activité de
micro-circuits précis au sein d’un réseau de neurones, de la même manière qu’une
constellation peut se dessiner dans la voûte céleste. Une équipe internationale
animée et coordonnée par Alexandre Charlet (France) et Valery Grinevich (Allemagne)
a récemment montré que des engrammes sont susceptibles de se former dans certaines
régions du cerveau comme l’hypothalamus. |
Ocytocine et amygdale cérébrale Afin de mettre en évidence un tel engramme, Hasan et al. [2] se sont intéressés à la
création d’un souvenir de peur associée au contexte chez le rat. Chez cette espèce,
la peur peut se manifester par une réaction comportementale d’immobilité appelée
pétrification. Cette prétrification est sous le contrôle de nombreuses structures,
ou régions, du cerveau, dont l’amygdale, une structure sous-corticale au cœur de la
modulation des émotions, et l’hypothalamus, une région apparue très tôt au cours de
l’évolution, impliquée dans l’homéostasie et la modulation de l’équilibre
émotionnel. L’activité électrique des neurones de l’amygdale est modulée par
l’activité de nombreux neurotransmetteurs ou neuromodulateurs, dont le glutamate,
l’acide g-amino-butyrique (GABA), la vasopressine, et l’ocytocine [3]. L’ocytocine, découverte en 1906 par Sir Henry Dales [4], est un petit peptide de neuf acides aminés
synthétisé presque exclusivement dans l’hypothalamus, plus particulièrement dans le
noyau paraventriculaire. Ce neuropeptide est produit par de grands neurones dits
magnocellulaires, capables de sécréter l’ocytocine dans le sang, et par de petits
neurones dits parvocellulaires, ne libérant l’ocytocine que dans le système nerveux
central [5]. L’ocytocine joue
un rôle majeur dans le comportement prosocial en favorisant les interactions
sociales, la confiance, l’empathie, le comportement parental ou, plus généralement,
les interactions sociales [5]. Outre ces
effets désormais bien décrits et très médiatisés, on lui reconnaît aujourd’hui
d’importantes fonctions comme molécule analgésique [6], anti-stress et anxiolytique, impliquant
notamment sa libération axonale dans l’amygdale [2,7]. Ainsi, la
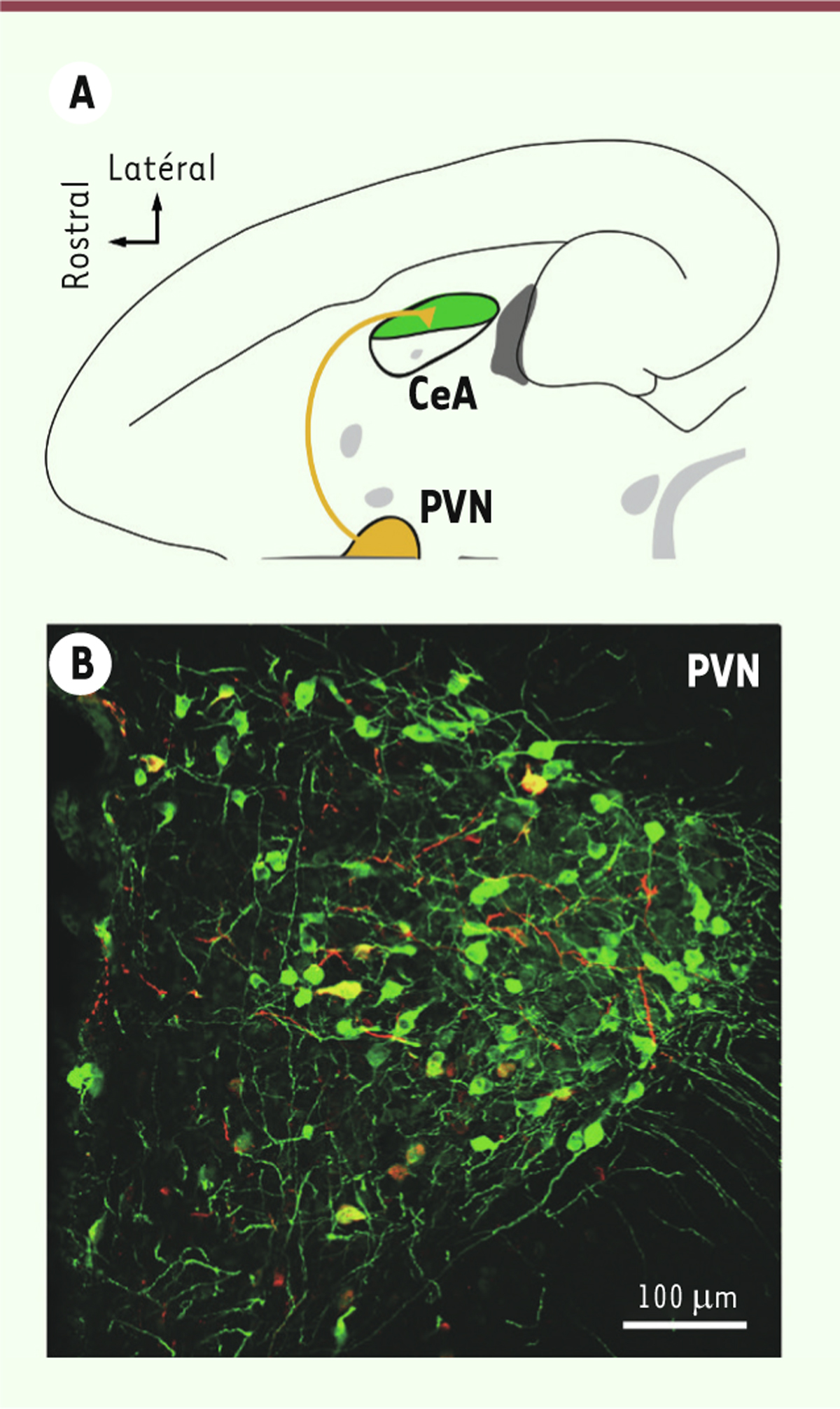
libération d’ocytocine endogène dans l’amygdale (Figure 1A) induit une forte diminution de la
réaction de peur conditionnée (pétrification) chez le rat, suggérant que le dialogue
entre l’hypothalamus et l’amygdale pourrait être fortement impliqué dans le contrôle
des comportements de peur.
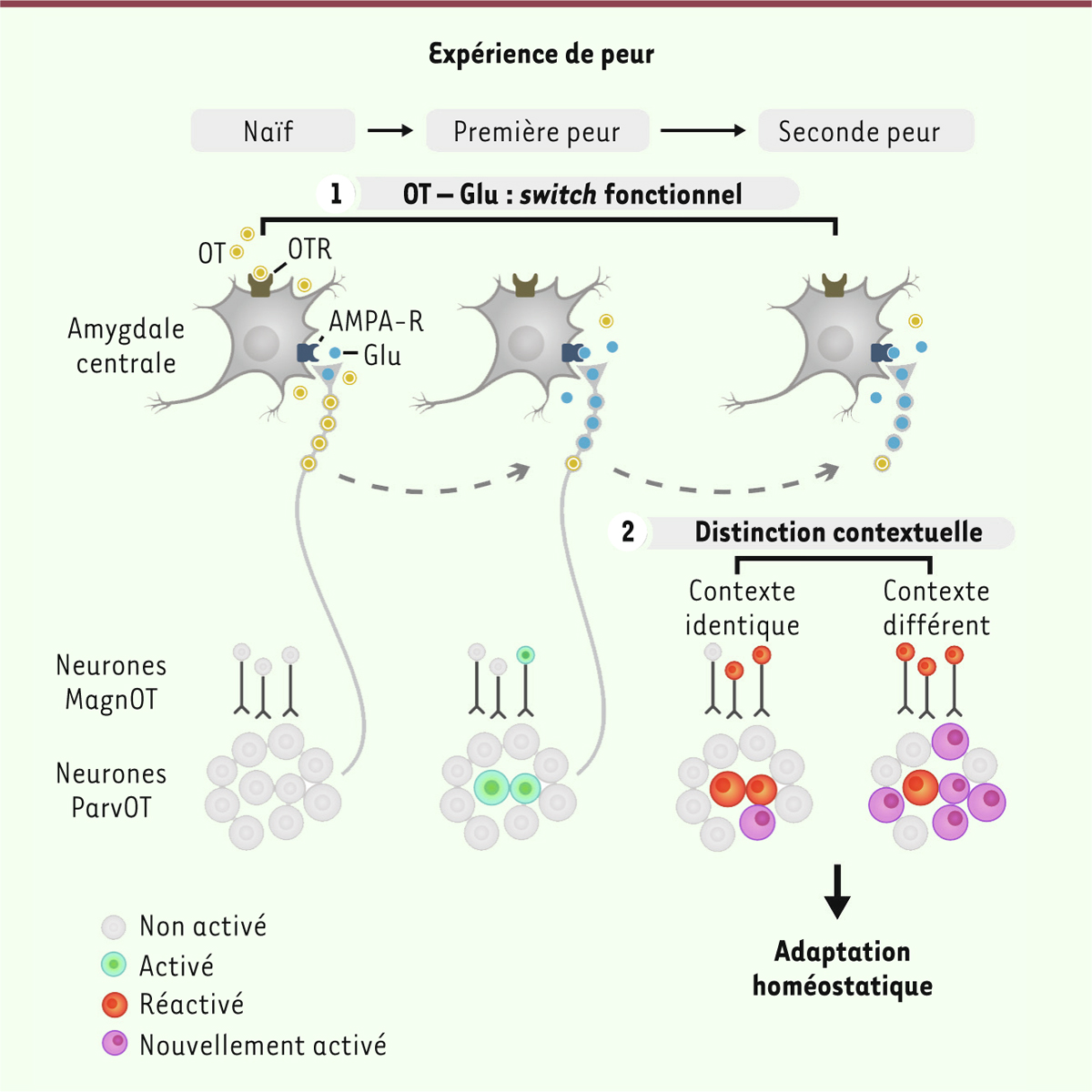
 | Figure 1. Identification des neurones activés lors d’une peur chez le rat.
A. Les neurones ocytocinergiques
du noyau paraventriculaire de l’hypothalamus (PVN ; en orange)
projettent leurs axones vers l’amygdale centrale (CeA ; en vert).
B. Seuls ~ 13 % des neurones
ocytocinergiques sont activés par une expérience de peur. En vert :
immunomarquage de l’ocytocine révélant tous les neurones produisant ce
neuropeptide. En rouge : expression de la molécule fluorescente mCherry
par les seuls neurones activés. |
Pourtant, comment expliquer qu’un neuropeptide synthétisé dans un seul noyau cérébral
puisse posséder autant de fonctions complémentaires ? Est-il possible d’isoler et de
définir des sous-populations fonctionnelles de neurones ocytocinergiques ? C’est ce
questionnement qui a poussé les chercheurs à s’intéresser à ces ensembles de
cellules hypothalamiques potentiellement impliqués. |
Un engramme ocytocinergique contrôlant la peur En utilisant une combinaison de vecteurs viraux permettant l’identification des
neurones activés durant une courte fenêtre temporelle, les chercheurs ont montré que
seule une sous-population de neurones ocytocinergiques hypothalamiques (~ 13 %) est
active durant l’exposition à un stimulus induisant une réaction de peur chez le rat
(Figure 1B). Grâce au
système viral utilisé, ils ont pu faire exprimer des récepteurs exogènes uniquement
par ces neurones activés lors d’une peur, ce qui leur a permis de manipuler leur
activité. L’utilisation d’outils optogénétiques et chimiogénétiques leur a ainsi
permis de montrer que l’excitation spécifique de ce groupe de neurones écourte la
durée de la pétrification, et qu’à l’inverse, leur inhibition augmente cette durée.
Ainsi, ces quelques neurones ocytocinergiques sont à la fois nécessaires et
suffisants pour contrôler la réaction de peur chez le rat (Figure 2) [2].
 | Figure 2. Schéma récapitulatif des expériences présentées.
1. Une expérience de peur chez le
rat induit une plasticité neuronale qui se traduit notamment par un
switch fonctionnel de neurotransmetteur entre
ocytocine (OT) et glutamate (Glu). 2. La
propriété de dépendance du contexte de la population des neurones
activés atteste de l’existence d’un engramme ocytocinergique. parvOT :
neurones parvocellulaires produisant l’ocytocine ; magnOT, neurones
magnocellulaires produisant l’ocytocine ; AMPA-R : récepteur AMPA du
glutamate. |
Cependant, les critères de nécessité et de suffisance dans la modulation d’une
émotion par un groupe de neurones ne permettent pas d’établir l’existence d’un
engramme. Il est également important de montrer que ce groupe de neurones est
recruté spécifiquement lors d’une émotion donnée. Aussi, les chercheurs ont comparé
les populations neuronales activées lors de réactions de peur obtenues par
l’exposition des rats à différents contextes. Par cette approche, ils ont montré que
les assemblées de neurones activés sont spécifiquement associées à un contexte
donné. Ainsi, il existe dans l’hypothalamus un engramme constitué de neurones
ocytocinergiques permettant d’associer un contexte précis à une émotion de peur
(Figure 2). |
Un engramme pourvu de plasticité On sait que les souvenirs se modifient au fil des expériences vécues. Les chercheurs
ont donc voulu savoir si l’engramme ocytocinergique découvert est, à l’image de la
mémoire, capable de plasticité. à cette fin, ils ont enregistré l’activité
électrophysiologique de neurones de l’amygdale. Les données électrophysiologiques et
transcriptomiques obtenues ont permis de montrer que les neurones hypothalamiques
libèrent majoritairement de l’ocytocine dans l’amygdale chez les rats « naïfs »,
c’est-à-dire non exposés au conditionnement de peur (Figure 1–2).
Étonnamment, après que l’animal a vécu une première expérience de peur les neurones
hypothalamiques libèrent préférentiellement du glutamate (Figure 2). Une telle variation du
type de neurotransmetteur libéré permet d’expliquer que la maîtrise de la peur
via l’hypothalamus est plus rapide et plus importante face à un
stimulus déjà rencontré. Cet important changement de neurotransmetteur libéré, ce «
switch fonctionnel » de l’ocytocine vers le glutamate, démontre
ainsi l’existence d’une véritable plasticité fonctionnelle de cet engramme [2]. Finalement, une peur donnée induit le recrutement d’un groupe de neurones
ocytocinergiques de l’hypothalamus permettant le contrôle de cette peur. Par
ailleurs, une expérience de peur modifie le fonctionnement de cet engramme en
provoquant un changement du neurotransmetteur libéré, de l’ocytocine vers le
glutamate. Une telle conversion de la molécule sécrétée est en accord avec la vision
selon laquelle les processus cognitifs et émotionnels seraient modulés par un
équilibre entre les neuropeptides, dont l’activité neuromodulatrice est lente, et
les neurotransmetteurs « classiques » (e.g. glutamate, GABA,
acétylcholine), qui ont une activité bien plus brève [8]. Dans ce contexte, l’ocytocine laisse place
au glutamate après le conditionnement de peur associée au contexte chez le rat,
modifiant ainsi la rapidité de réaction face à un stimulus effrayant et donc
potentiellement dangereux, afin de permettre une meilleure adaptation homéostatique
(fréquence cardiaque, activité métabolique, etc.) [2]. |
Cibler cet engramme pour agir sur la peur pathologique Hasan et collaborateurs ont donc découvert que des engrammes répondant à tous les
critères de la théorie synaptique de la mémoire [9] peuvent se former dans l’hypothalamus. Ils
ont ainsi montré pour la première fois que les souvenirs ne sont pas uniquement
stockés dans les structures cérébrales dites supérieures (cortex, hippocampe) [10], mais aussi dans des
régions apparues beaucoup plus tôt au cours de l’évolution, telles que
l’hypothalamus. Cette découverte majeure incite à rechercher l’existence des
engrammes dans les différentes régions cérébrales et à en explorer l’intégration.
Comprendre les circuits anatomiques et fonctionnels impliqués dans une mémoire
émotionnelle telle que celle de la peur pourrait permettre l’émergence de nouvelles
stratégies thérapeutiques, notamment quand la peur devient pathologique, comme dans
le cas de l’anxiété chronique ou du stress post-traumatique. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
2.
Hasan
M
Althammer
F
Silva da Gouveia
M
et al.
A fear memory engram and its plasticity in the hypothalamic
oxytocin system . Neuron.
2019; ; 103 :
:133.–146. 3.
Viviani
D
Charlet
A
van den Burg
E
et al.
Oxytocin selectively gates fear responses through distinct
outputs from the central amygdala . Science.
2011; ; 333 :
:104.–107. 4.
Dale
H.
On some physiological actions of ergot . J
Physiol.
1906; ; 34 :
:163.–206. 5.
Lee
H
Macbeth
A
Pagani
J
Young
W
Oxytocin: the great facilitator of life .
Prog Neurobiol.
2009; ; 88 :
:127.–151. 6.
Eliava
M
Melchior
M
Knobloch-Bollmann
H
et al.
A new population of parvocellular oxytocin neurons controlling
magnocellular neuron activity and inflammatory pain
processing . Neuron.
2016; ; 89 :
:1291.–1304. 7.
Knobloch
H
Charlet
A
Hoffmann
L
et al.
Evoked axonal oxytocin release in the central amygdala attenuates
fear response . Neuron.
2012; ; 73 :
:553.–566. 8.
Merighi
A
Salio
C
Ferrini
F
Lossi
L
Neuromodulatory function of neuropeptides in the normal
CNS . J Chem Neuroanat.
2011; ; 42 :
:276.–287. 9.
Martin
S
Grimwood
P
Morris
R
Synaptic plasticity and memory: an evaluation of the
hypothesis . Annu Rev Neurosci.
2000; ; 23 :
:649.–711. 10.
Kitamura
T
Ogawa
S
Roy
D
et al.
Engrams and circuits crucial for systems consolidation of a
memory . Science.
2017; ; 356 :
:73.–78. |